Raquitismo Hipofosfatémico Ligado a X
Palabras clave
Hipofosforemia, Raquitismo, Osteomalacia, Hormona del crecimiento, Burosumab
INTRODUCCIÓN
El raquitismo hipofosfatémico ligado a X (RHLX) (OMIM: 307800) o hipofosfatemia ligada al cromosoma X (XLH) es una enfermedad de la homeostasis mineral caracterizada por la pérdida renal de fosfato. Es la forma más frecuente de los raquitismos hipofosfatémicos hereditarios [1].
Se trata de una enfermedad rara, con afectación multisistémica, causada por una mutación con pérdida de función en el gen PHEX (en inglés: phosphate regulating endopeptidase homolog X-linked) localizado en Xp22.1 [2]. Se han encontrado más de 300 mutaciones diferentes. En la mayoría de los casos se hereda con un patrón dominante ligado a X, aunque en muchas ocasiones se trata de mutaciones “de novo” [3] [4].
Tiene una incidencia de 3,9 por 100.000 nacidos vivos con una prevalencia que varía de 1,7 por 100.000 niños a 4,8 por 100.0000 individuos (niños y adultos), con mayor afectación de mujeres con ratio hombre:mujer de 1:2 [5] [6]. Aunque las manifestaciones clínicas de la XLH suelen iniciarse en la infancia temprana, con la deambulación, el desarrollo de posteriores comorbilidades multisistémicas se incrementa progresivamente durante la vida adulta [7].
PATOGENIA
El defecto fisiológico básico de la XLH es un defecto tubular aislado en la reabsorción de fosfato y una absorción intestinal disminuida del mismo.
El gen PHEX forma parte de la familia de genes que controlan la síntesis de endopeptidasas, enzimas que intervienen en la degradación de las hormonas peptídicas. Codifica una proteína de membrana expresada predominantemente en osteoblastos, osteocitos y dientes [5] [8], y en menor medida en pulmón, ovario y testículo, pero no en riñón.
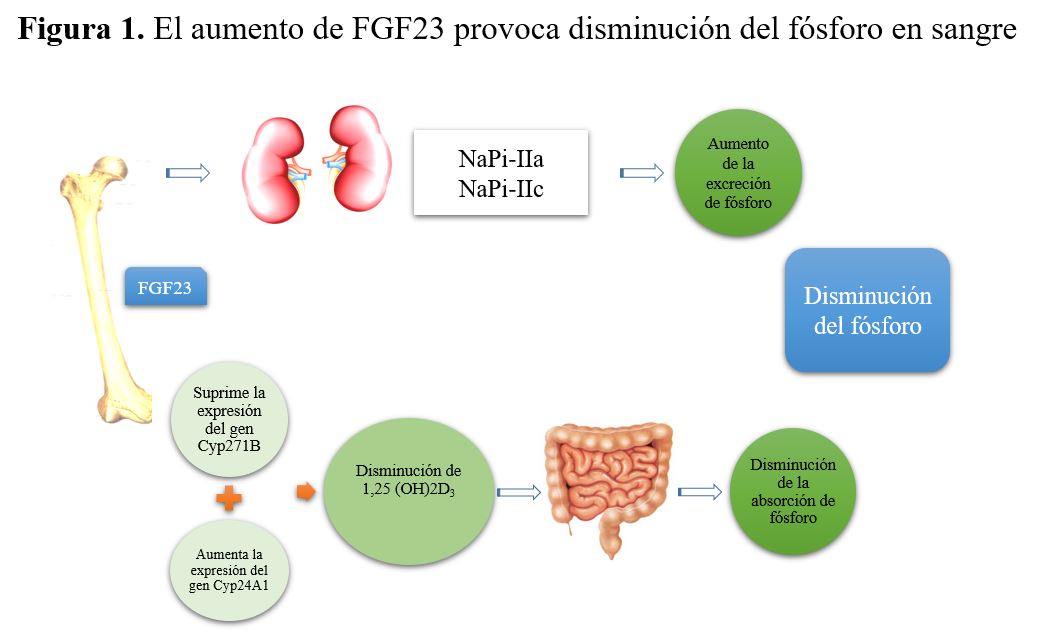
Aunque la patogénesis de la XLH no es del todo conocida, la pérdida de función de PHEX da lugar a una mayor secreción de la hormona fosfatúrica “factor de crecimiento de fibroblastos 23” (FGF-23) [9]. La acción del FGF-23 es mediada a través de los receptores del FGF-23 y el co-receptor transmembrana Klotho [10].
En el túbulo proximal, el transporte de fósforo se realiza mediante los cotransportadores sodio-fosfato (NaPi) tipo I, II y III. De ellos el más importante es el IIa ya que realiza aproximadamente el 70% de la reabsorción del túbulo proximal [11]. El aumento de FGF23, en el riñón reduce la expresión de los NaPi tipo II (NaPi-IIa y NaPi-IIc), que se encuentran en la superficie apical del epitelio del túbulo renal [12] lo que conduce a hiperfosfaturia, al disminuir su reabsorción (Figura 1).
Además FGF23 suprime la transcripción del CYP27B1 (que codifica la enzima 1-hidroxilasa de la vitamina D) y aumenta la transcripción de CYP24A1 (que codifica la enzima 24-hidroxilasa) [13]. Esta combinación de alteraciones en la expresión de las enzimas da lugar a la disminución del metabolito activo de la vitamina D, 1,25- dihidroxivitamina D circulante, lo que a su vez disminuye la absorción de fosfato en intestino y hueso [11].
Estos efectos explican la mayoría de los rasgos característicos de la enfermedad, como la pérdida renal de fosfato con la consiguiente hipofosfatemia, la disminución de la síntesis de vitamina D activa (1,25(OH)2 vitamina D), el raquitismo, la osteomalacia, la odontomalacia y la baja estatura [5].
Sin embargo, sigue siendo desconocido cómo la pérdida de función de PHEX resulta en la alteración de la secreción normal de FGF-23 por el osteocito. A pesar de que PHEX codifica una peptidasa se cree que no interviene en la degradación de FGF23 sino que afecta a su transcripción y expresión [14]. Se ha sugerido que la acción de PHEX se lleva a cabo a través de un metabolito intermediario, la proteína de matriz extracelular (MEPE).
Además, es probable que la vía del FGF23 no sea el único mecanismo molecular alterado. Se ha encontrado poca correlación entre las características fenotípicas y el tipo o la ubicación de la mutación genética entre individuos e incluso dentro de la misma familia [15]. Estos hallazgos sugieren una posible implicación de otros factores genéticos y ambientales en la determinación del fenotipo clínico de los individuos con XLH.
DIAGNÓSTICO
El diagnóstico de la XLH se realiza por la combinación de manifestaciones clínicas, hallazgos de laboratorio y radiológicos junto a los datos de la historia familiar y estudio genético. En la actualidad también es posible determinar los valores de FGF23 en suero lo que agiliza el diagnóstico en espera de los test genéticos.
En los pacientes con historia familiar negativa (aproximadamente un tercio de los pacientes) el estudio de la mutación del gen PHEX puede dar el diagnóstico de certeza en el 70-90% de los casos, sin embargo hasta en un 30% de los pacientes el diagnóstico se hará en función de los hallazgos clínicos y de laboratorio [5].
MANIFESTACIONES CLÍNICAS
Las manifestaciones clínicas más destacadas se deben a una mineralización inadecuada de los huesos y de los dientes. El raquitismo es la manifestación cardinal de la XLH, con una amplia variabilidad fenotípica.
A) En la infancia
Al nacimiento, los recién nacidos afectos tienen una longitud normal y las piernas no suelen mostrar deformidades, de forma que los principales síntomas clínicos aparecen con el gateo o la marcha, siendo esta anormal, a la vez que aparecen deformidades de las extremidades inferiores y disminuye la velocidad de crecimiento lo que se hace más evidente entre el primer y segundo año de vida.
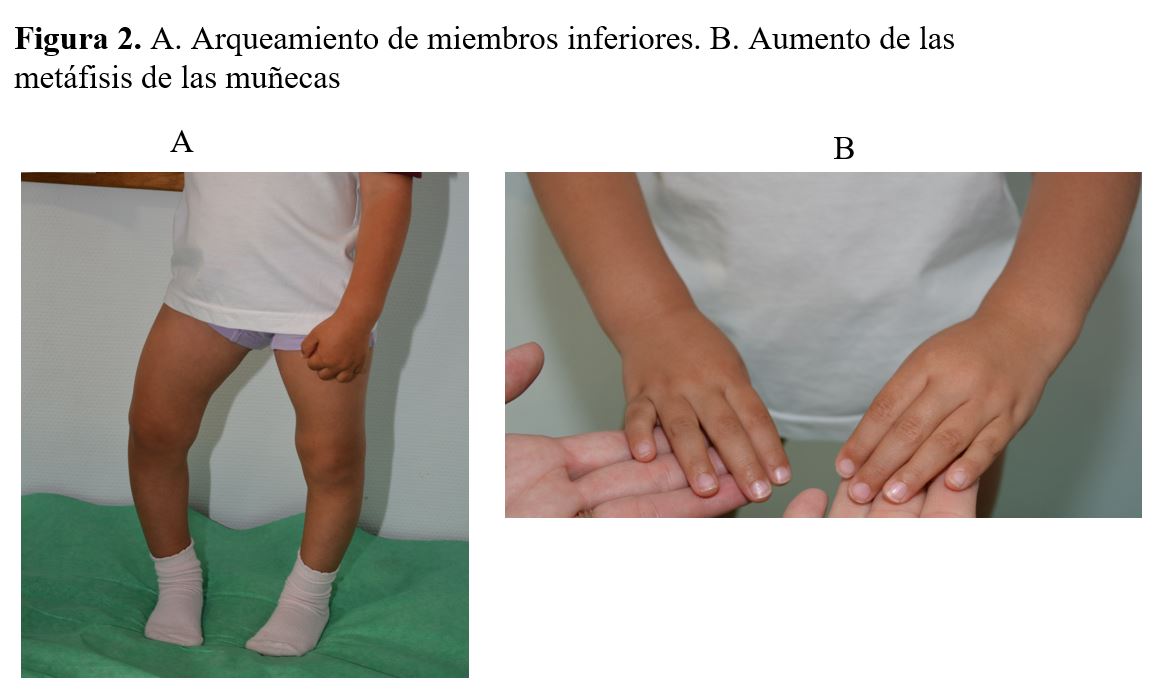
Los hallazgos clínicos más característicos son el arqueamiento del fémur y de la tibia que se traduce en genu varum o menos frecuente en genu valgum, estas deformidades suelen asociar cierto componente de rotación, con ensanchamiento de los cartílagos de crecimiento de los huesos largos que condiciona ensanchamiento de las metáfisis de las muñecas y tobillos (Figura 2). En los casos graves pueden presentarse deformidades óseas, como coxa vara o tibias en forma de sable. Todo ello se traduce en un talla baja desproporcionada con acortamiento del segmento inferior corporal [16]. En ocasiones el diagnóstico se retrasa debido a que un cierto grado de varo es normal en los niños, y esta deformidad a menudo pasa desapercibida al no considerarse patológica en pacientes menores de 2 años [17].
La afectación más frecuente en el macizo facial es la existencia de prominencia frontal y de dolicocefalia secundaria a craneosinostosis de una o más suturas que puede requerir craneotomía; el aplanamiento de la base craneal ocasiona una disminución de la profundidad de la fosa posterior que predispone a malformaciones tipo Chiari I en cerca de un 44% de los pacientes. También pueden presentar siringomielia. Estas malformaciones pueden originar dolor de cabeza, vértigo e hipertensión intracraneal [17] [18] [19]. Algunos niños pueden presentar alteración o retraso del desarrollo motor por afectación muscular tipo miopatía [20].
Pueden presentar sordera neurosensorial o de conducción secundaria a osteoesclerosis y deformación o engrosamiento del hueso petroso, con una prevalencia de la hipoacusia que varía de un 16% a un 76%, siendo más frecuente en adultos, pero que puede aparecer incluso en la adolescencia [21] [22] [23].
Las alteraciones dentales son características, frecuentes en mayores de 3 años, producidas por una alteración de la mineralización de la dentina y del cemento dental, dando lugar a la aparición de abscesos dentales y periodontitis que puede llegar a afectar al 61-78% de los pacientes [24] [25]. Con el tratamiento correcto y precoz estas alteraciones son prácticamente inexistentes [26].
Las complicaciones cardiológicas de la XLH no son comunes, lo que sorprende ya que el FGF-23 se asocia a riesgo cardiovascular e hipertrofia miocárdica que puede evolucionar a fallo cardiaco congestivo. Recientemente se ha descrito hipertrofia ventricular izquierda e hipertensión arterial en un estudio prospectivo de pacientes afectos de la XLH, por ello algunos autores recomiendan controles regulares cardiológicos cada 5 años [27] [28].
B) En la edad adulta
El diagnóstico puede establecerse durante las investigaciones en los familiares de un paciente índice. La anomalía que con más frecuencia desencadena el diagnóstico es el dolor crónico de huesos o articulaciones o la hipofosfatemia con hiperfosfaturia (en los adultos hay más causas de hipofosfatemia que en el niño y se precisa una reabsorción tubular de fosfatos disminuida)[17]. El raquitismo tiene lugar cuando las metáfisis aún están abiertas, por tanto sólo en la infancia, mientras que la osteomalacia persiste a lo largo de la vida y se asocia a dolor óseo, que es frecuente y debilitante, y a un incremento en el riesgo de pseudofracturas [21].
Los hallazgos típicos y más debilitantes en la etapa adulta incluyen osteomalacia, dolores óseos, artrosis, pseudofracturas, rigidez, entesopatías, talla baja y problemas dentales [5].
La entesopatía incluye la calcificación de tendones y ligamentos. Su fisiopatología es incierta aunque parece que es efecto directo del aumento de FGF-23. Produce rigidez articular y limitación importante de la movilidad, y cuando afecta a los ligamentos anterior y posterior espinal se pierden los movimientos de flexión y extensión del tronco, así como de rotación del cuello y en ocasiones se produce compresión de la médula espinal. Las entesopatías pueden desarrollarse a partir de la segunda y tercera década de la vida [17] y son más frecuentes en varones [29] [30].
La artropatía degenerativa u osteoartritis es consecuencia de la curvatura de los huesos y de la alteración en la alineación de las articulaciones, lo que contribuye al dolor.
Las fracturas óseas son más frecuentes en los adultos afectos que en los niños [11].
En general hay una afectación de la calidad de vida de estos pacientes, tanto en niños como adultos [31], aunque pueden observarse amplias variaciones en el compromiso óseo y en la talla baja en los miembros de una familia, aún del mismo sexo, a pesar de la presencia de grados similares de hipofosfatemia.
HALLAZGOS BIOQUÍMICOS
Los pacientes con XLH muestran de forma característica hipofosfatemia secundaria a hiperfosfaturia, con disminución de TmP/GFR y del porcentaje de reabsorción tubular de fósforo (RTP). En un paciente con hipofosfatemia, incluso los valores de RTP y/o TmP/GFR en el rango inferior de la normalidad deben considerarse anormales.
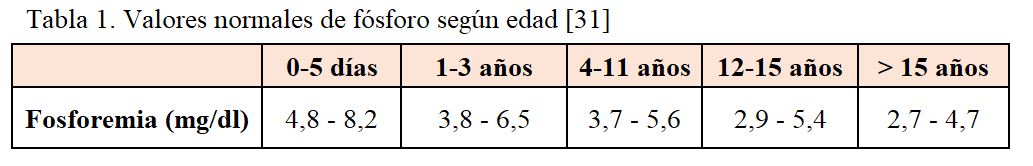
Es importante incidir en la variabilidad de las concentraciones plasmáticas de fósforo en función de la edad (Tabla 1), lo que puede llevar a un diagnóstico tardío de la enfermedad, más aún si se realiza la determinación inmediatamente tras la administración de alimentos, ya que se pueden obtener valores de fosforemia postprandiales normales [21] [32].
La hipofosfatemia puede estar presente desde el nacimiento o desarrollarse a partir de los 6-12 meses [11].
Otros hallazgos bioquímicos característicos son la elevación de la fosfatasa alcalina (FA) y las concentraciones bajas o inapropiadamente normales de 1,25(OH)2 vitamina D. El calcio sérico es normal, o está en el límite inferior del rango normal, y la excreción de calcio en la orina es baja.
La concentración de hormona paratiroidea (PTH) está habitualmente dentro de la normalidad, aunque un porcentaje de pacientes (<10%) pueden presentar hiperparatiroidismo grave [33].
No hay evidencia de tubulopatía proximal o distal y las concentraciones de FGF23 plasmático están elevadas.
HALLAZGOS RADIOLÓGICOS
Las lesiones radiológicas características son las propias del raquitismo óseo, caracterizadas por deshilachamiento de las epífisis conformando una imagen en “copa”, con la concavidad hacia las epífisis, engrosamiento del platillo epifisario de crecimiento y defecto de calcificación epifisaria que disminuye la densidad y nitidez de los márgenes corticales.
Estas anormalidades ocurren sobre todo en los sitios de crecimiento rápido (particularmente en la zona distal de los fémures, las tibias y los radios) [5]. La radiografía limitada a las rodillas, muñecas y/o los tobillos suele ser suficiente para diagnosticar el raquitismo. Las deformidades óseas afectan principalmente a las extremidades inferiores [34].
Los adultos pueden presentar características radiográficas diferentes de los niños, incluyendo pseudofracturas, osteoartritis temprana de la columna vertebral, la cadera y las rodillas (osteofitos en los márgenes de las articulaciones o estrechamiento del cartílago articular) y / u osteopatías (como proliferación ósea o calcificación de los ligamentos). Las fracturas relacionadas con la osteomalacia, aunque más frecuentes en adultos que en niños, se observan raramente, mientras que son frecuentes las pseudofracturas [5] [29].
DIAGNÓSTICO DIFERENCIAL
Se debe realizar con otros tipos de raquitismo como el raquitismo carencial o por malabsorción que genera carencia de vitamina D, los raquitismos vitamina D dependientes o con otras enfermedades que causan pérdida renal de fosfato y con las enfermedades renales tubulares primarias (Tabla 2, Fig.3). Los algoritmos ayudan al diagnóstico diferencial aunque existen variaciones en la práctica clínica diaria.
TRATAMIENTO
A) Tratamiento convencional
El tratamiento clásico se introdujo por primera vez en 1975 y fue el único tratamiento disponible hasta 2018.
Se basa en la administración crónica de sales de fósforo y suplementos de vitamina D activa. El objetivo del tratamiento no es conseguir corregir la fosforemia, ya que esto implicaría la necesidad de administrar grandes dosis de fosfato que podría provocar efectos adversos, sino curar las lesiones activas de raquitismo existentes al diagnóstico, evitar nuevas lesiones y deformidades óseas, mantener concentraciones de PTH normales y optimizar el crecimiento, evitando las complicaciones derivadas del tratamiento como la nefrocalcinosis o el hiperparatiroidismo. Para ello se recomienda mantener el fósforo sérico en el límite bajo de la normalidad para la edad y sexo del paciente o incluso menor. En cuanto a las dosis recomendadas de sales de fósforo y análogos activos de Vitamina D existe una gran variabilidad tanto en las guías de consenso como en publicaciones de expertos [5] [34] [36] [37].
1. Sales de fosfato
El fósforo debe administrarse en cantidades progresivamente crecientes y repartidas en 5 o 6 tomas, ya que tras su ingesta la concentración sérica aumenta rápidamente pero vuelve a su basal en 1,5 horas. Las dosis recomendadas de sales de fósforo varían según la edad y la gravedad del fenotipo, y no existe consenso sobre la dosis óptima [36].
En general, se inicia el tratamiento con dosis de fósforo elemento entre 20-40 mg/kg/día en función de la gravedad del fenotipo, con incrementos cada 4 semanas, siendo aconsejable no superar los 60-70 mg/kg/día con un máximo en niños mayores de 2-3 gr al día. Dosis superiores a 70 mg/kg/día o 3 gr/1,73m2/día tienen mayor riesgo de producir nefrocalcinosis [5].
Las dosis deben basarse en el fósforo elemental dado que el contenido de fósforo difiere en gran medida entre las sales de fosfato disponibles [5]. Los principales problemas que se presentan son la frecuencia de las dosis y el desarrollo de diarrea en las primeras semanas [11]. El fosfato no debe administrarse junto con suplementos de calcio o alimentos con alto contenido de calcio, como la leche, ya que la precipitación en el tracto intestinal reduce la absorción.
2. Vitamina D activa
Se debe añadir al tratamiento suplementos de vitamina D activa en forma de calcitriol o alfacalcidiol. El objetivo es tratar la deficiencia de calcitriol y prevenir el hiperparatiroidismo secundario, además de aumentar la absorción de fósforo desde el intestino.
Se puede administrar calcitriol (cápsulas oleosas de 250 o 500 ng) con dosis iniciales de 20-30 ng/kg/día, repartidas en 1 o 2 dosis, hasta alcanzar un máximo de 50-70 ng/kg/día. Una vez resueltas las lesiones óseas iniciales la dosis de calcitriol podría disminuirse.
El tratamiento debe ajustarse en función de los niveles séricos de FA y PTH y de la excreción urinaria de calcio. Los periodos de mayor crecimiento (primera infancia y pubertad) precisan mayores dosis. Dosis elevadas de calcitriol favorecen el crecimiento y mineralización ósea pero asocia mayor riesgo de hipercalciuria y nefrocalcinosis; por el contrario dosis bajas o insuficientes se asocian a disminución en la absorción de calcio intestinal, baja excreción de calcio urinario, raquitismo persistente y elevación de fosfatasa alcalina y PTH.
También se puede administrar en forma de alfacalcidiol (Etalpha gotas 1 gota = 0,1 µg), en este caso la dosis oscila de 30-50 ng/kg/día y se administra una sola vez al día dada su mayor vida media, siendo la dosis equivalente de alfacalcidiol 1,5-2 veces mayor que la de calcitriol [5] [34] [38]. Una sola dosis nocturna podría ayudar a prevenir la absorción excesiva de calcio después de la ingesta de alimentos [5].
Los pacientes afectos de XLH pueden tener déficit de 25(OH) vitamina D al igual que los niños sanos en cuyo caso deben ser suplementados con vitamina D nativa [20].
3. Suplementos de calcio
La ingesta de calcio debe ajustarse a las necesidades basales normales según la edad, no se recomienda administrar suplementos de calcio ya que la masa ósea y el contenido mineral generalmente no están disminuidos, y puede provocar hipercalciuria como efecto adverso [5]. En caso de hipercalciuria puede valorarse la administración de hidroclorotiazida y/o citrato potásico para prevenir la precipitación del calcio especialmente en pacientes con hipocitraturia [5], teniendo en cuenta que la alcalinización de la orina puede provocar precipitación del fósforo y empeorar la nefrocalcinosis, el citrato potásico debe emplearse con precaución.
4. Seguimiento
Durante el seguimiento se debe monitorizar el fósforo, calcio, FA y PTH en plasma, así como el calcio en orina. La hipercalcemia o hipercalciuria y niveles subóptimos de PTH obligan a reducir la dosis de calcitriol. La administración de hidroclorotiazida con amiloride se ha visto eficaz a corto plazo para disminuir la calciuria e incrementar la fosforemia por la contracción del volumen vascular inducida por los diuréticos [39]. Por el contrario, niveles plasmáticos elevados de PTH nos orientan a un déficit en la dosis de calcitriol administrada o bien un exceso de suplemento con sales de fósforo. Si aparece hipercalciuria se debe disminuir la dosis de calcitriol o alfacalcidiol [20].
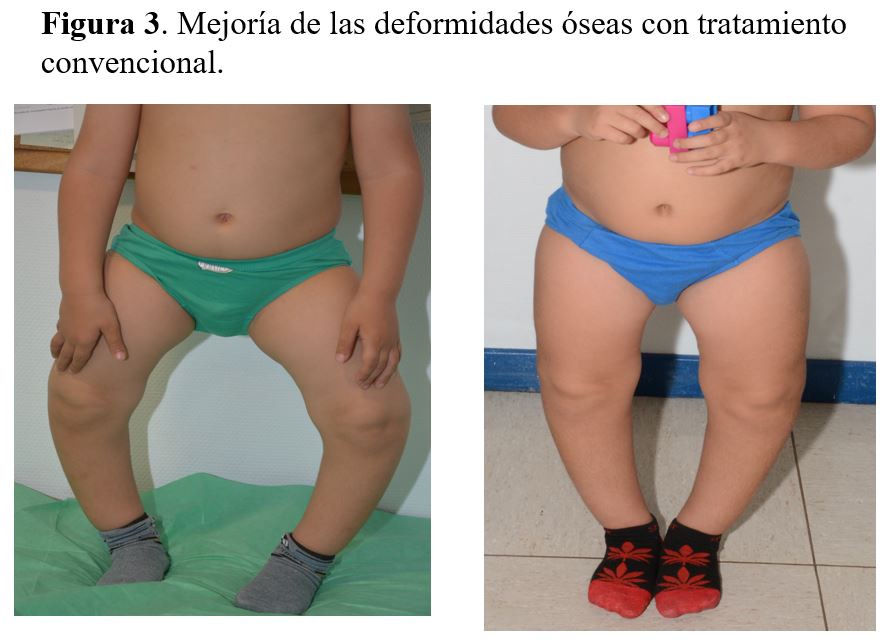
El tratamiento convencional reduce la FA hasta el límite superior de la normalidad en aproximadamente un año, aumenta la velocidad de crecimiento, mejora la talla en aproximadamente una desviación estándar [40], corrige parcial o totalmente las deformidades óseas (Figura 4) y, por último, mejora la mineralización dental, con lo que disminuye significativamente el número de abscesos dentales [17]. La respuesta clínica al tratamiento debe monitorizarse con gráficas de crecimiento (con medidas de talla de pie, sentado y braza), midiendo circunferencia craneal, sobre todo en menores de cinco años, y valorando la mejoría de deformidades óseas (medición de distancia intermaleolar e intercondilar) [20].
A diferencia del raquitismo carencial que se cura tras adecuada repleción de vitamina D, en la XLH el defecto en la homeostasis del fósforo se mantiene toda la vida. Sin embargo, debido a los riesgos de la terapia convencional, como norma general el tratamiento se suspende cuando finaliza el crecimiento y se reinicia cuando aparecen signos clínicos de osteomalacia en el adulto [18] [36].
El tratamiento convencional se recomienda en adultos sintomáticos con XLH, considerando como tales, aquellos con dolor musculoesquelético, pseudofracturas, afectación dental, cuando se va a realizar cirugía ortopédica o dental o cuando hay evidencia bioquímica de osteomalacia con aumento de fosfatasa alcalina ósea. El tratamiento convencional no previene la hipoacusia, ni la entesopatía.
En adultos asintomáticos con tratamiento conservador, salvo la mejoría en salud bucal, no hay evidencia de mejoría en otros parámetros, por el contrario, la toma continuada del tratamiento puede tener efectos adversos y empeorar la calidad de vida de los pacientes.
Las dosis en adultos oscilan en torno a 0,5-0,75 µg/día de calcitriol. Los suplementos de sales de fósforo oscilan entre 750-1600 mg al día repartido en dos a cuatro dosis [5] [41].
Un momento crítico es el embarazo, en este periodo los niveles de vitamina D deben ser ajustados y se pueden requerir dosis más elevadas de fósforo oral hasta 2 gr al día. Las mujeres que recibían tratamiento convencional previo al embarazo deben mantenerlo y si no lo recibían se debe recomendar su inicio. La lactancia materna no está contraindicada y se sugiere tratamiento convencional en esta etapa para prevenir pérdida ósea [5] [41].
5. Complicaciones
Las limitaciones del tratamiento convencional vienen determinadas por la persistencia de la pérdida renal de fosfato y la hipofosfatemia mantenida.
-Hiperparatiroidismo: El hiperparatiroidismo secundario ha sido descrito en niños y adultos con este tratamiento y puede inducir complicaciones reumáticas en la edad adulta [17].
Las causas de este hiperparatiroidismo no son bien conocidas. Cerca de un 50% de niños presentan al diagnóstico elevación de PTH que disminuye tras iniciar tratamiento con vitamina D activa [42]. Por otra parte, el tratamiento con suplementos orales de fosfato induce un descenso transitorio de la calcemia que estimula la secreción de PTH añadido al déficit de 1,25(OH)2D3. Se recomienda que ante un aumento de las cifras de PTH se disminuya la dosis de los suplementos de fosfato, manteniendo o aumentando la de calcitriol [43]. Algunos pacientes con hiperparatiroidismo secundario pueden progresar a hiperparatiroidismo terciario por hiperplasia glandular secundaria al estímulo prolongado y repetido de altas dosis de fosfato, y puede requerir intervención quirúrgica para controlar la hipercalcemia. La administración de dosis adecuadas de vitamina D activa y la disminución de la dosis de fósforo pueden ser suficientes para controlar el hiperparatirodismo [18] [44] [45]. Sin embargo también hay casos descritos de hiperparatiroidismo secundario y terciario que no han recibido nunca sales de fósforo [41] [46].
-Nefrocalcinosis: No suele existir al diagnóstico de la enfermedad y puede desarrollarse hasta en un 30-70% de los pacientes con XLH que siguen tratamiento convencional [5]. No se ha podido relacionar con la duración o la dosis de calcitriol ni con el grado o frecuencia de hipercalciuria, sin embargo, algunos estudios lo relacionan con la dosis de fosfato [47] [48] [49] [50].
-Otros: No se dispone de datos a largo plazo del impacto del tratamiento clásico en la incidencia de complicaciones como el síndrome de Chiari, la craneoestenosis, las entesopatías, las deficiencias auditivas y/o la fatiga [17].
B) Tratamiento quirúrgico
A pesar del tratamiento médico, en ocasiones se siguen desarrollando deformidades óseas progresivas, especialmente si el diagnóstico fue tardío, y puede ser necesario el tratamiento quirúrgico (generalmente osteotomías). Si se hace en niños se debe respetar la placa de crecimiento [51]. La cirugía correctiva al final del crecimiento sigue siendo la opción más segura y se asocia con menor riesgo de recurrencia [52].
C) Tratamiento con hormona de crecimiento
El tratamiento con hormona del crecimiento (rhGH) se puede planear en niños con talla baja a pesar de un tratamiento óptimo mantenido durante al menos 1 año y niveles de FA casi normales que indican el control del raquitismo [16].
Algunos autores preconizan el uso de rhGH a dosis altas (0,20-0,33 mg/kg/semana), lo que acelera la velocidad de crecimiento, la densidad mineral ósea y la talla final, si bien algunos autores advierten que puede mejorar proporcionalmente más el crecimiento del tronco que de las extremidades inferiores y acentuar la desproporción entre el segmento inferior y superior del cuerpo [53] [54] [55]. Un ensayo controlado aleatorio durante tres años en niños con talla baja con RHLX mostró una mejora de crecimiento sustancial, en comparación con los individuos control, sin agravar la desproporción corporal [56]. Sin embargo, la GH no ha demostrado aumentar significativamente la talla final adulta. Por tanto, no se recomienda su administración rutinaria en niños con XLH [5].
D) Tratamiento con burosumab
Burosumab es un anticuerpo monoclonal totalmente humano contra el FGF-23. En 2018 fue autorizado por FDA para su uso en niños y adultos. En 2020 tuvo la aprobación de la EMA para niños y adultos. En 2021 en España se obtuvo financiación con reembolso en niños y en adolescentes de 1 a 17 años con signos radiográficos de enfermedad ósea, y en 2023 se amplía el reembolso a adultos con XLH y osteomalacia inducida por tumor.
Burosumab contrarresta los efectos del FGF-23, restaurando así la expresión del transportador de fosfato, la reabsorción de fosfato por el túbulo proximal renal y la 1,25(OH)2 vitamina D [5].
La dosis de inicio en niños y adolescentes de 1 a 17 años es de 0,8 mg/kg de peso redondeando a la decena más cercana, administrado por vía subcutánea cada dos semanas, con dosis máxima de 2 mg/kg/dosis (máximo 90 mg). La dosis inicial en adultos es de 1 mg/kg, en inyección subcutanea, cada 4 semanas, hasta una dosis máxima de 90 mg.
La dosis debe ajustarse en función del fósforo plasmático tratando de mantener éste en el límite inferior de la normalidad para la edad del paciente, con incrementos de dosis que no deben realizarse en intervalos inferiores a 4 semanas [27] y se sugiere intervalos de 2 meses [5] [17]. La dosis se aumentará cuando se objetiven niveles subóptimos de fosforemia y elevación de FA, aumentando la dosis en 0,4 mg/kg de peso redondeando a la decena más cercana del aumento.
No debe administrarse junto con fosfato oral ni metabolitos activos de la vitamina D, por lo que el tratamiento convencional debe suspenderse al menos una semana antes de iniciar tratamiento con burosumab. Si existiera déficit de vitamina D, se podrá administrar vitamina D nativa.
En niños de 5 a 12 años tratados con burosumab, se ha observado un incremento en las concentraciones plasmáticas de fósforo y de calcitriol, una mejoría radiológica del raquitismo tras 40-64 semanas de tratamiento y una mejoría de la función física valorada como un incremento en la distancia caminada durante el test 6MWT [20] [27] [57].
Por otro lado, en adultos con XLH tratados con burosumab hasta 48 semanas, se ha observado una normalización de la homeostasis del fosfato, asociada a una mejoría significativa de la osteomalacia, con mejora de la curación de fracturas y pseudofracturas, así como beneficios clínicamente significativos en términos de dolor, rigidez, función física y capacidad de ejercicio funcional [58] [59] [60].
Los efectos secundarios observados con mayor frecuencia son las reacciones locales en el lugar de la inyección, dolor de cabeza y dolor de extremidades.
Su uso está contraindicado en enfermedad renal crónica grado IV. Durante el embarazo no está bien establecida la pauta a seguir, teniendo en cuenta que burosumab atraviesa la barrera placentaria. La decisión del tratamiento debe basarse en los síntomas óseos de la madre, más que en los posibles beneficios del feto. En caso de optar por tratar se recomienda control analítico mensual [63] [64].