Tubulopatías
Palabras clave
Glucosuria, Cistinuria, hipouricemia, raquitismo hipofosfatémico, acidosis tubular, Síndrome de Fanconi, Enfermedad de Dent, Síndrome de Bartter, Síndrome de Gitelman, Síndrome de East, Enfermedad de Liddle, Enfermedad de Gordon, Diabetes insípida nefrogénica, raquitismo hipofosfatémico
INTRODUCCIÓN
Las tubulopatías son un grupo heterogéneo de entidades definidas por anomalías de la función tubular renal. Se distinguen las tubulopatías hereditarias o primarias, de las secundarias a tóxicos, fármacos u otras enfermedades. Pueden ser simples o complejas según se afecte el transporte tubular de una o varias sustancias [1] [2] [3].
Dependiendo de la función tubular que se encuentre afectada, cada entidad tiene una edad de aparición, manifestaciones clínicas y analíticas, gravedad y pronóstico. Las vamos a clasificar según la zona del túbulo afectada (Tabla 1) (Tabla 2) y (Tabla 3).
El diagnóstico de sospecha de las distintas tubulopatías se basa en:
1. Anamnesis: historia familiar (consanguinidad), antecedentes obstétricos y neonatales, síntomas sugestivos, historia dietética, avidez por la sal, ingesta de agua y diuresis.
2. Exploración: crecimiento y desarrollo (talla, peso, perímetro cefálico), presión arterial, exploración general, estado de hidratación, raquitismo, anomalías en órganos de los sentidos.
3. Evaluación de la función renal:
• Orina: Inspección, tiras reactivas y sedimento.
• Volumen urinario (orina de 24 horas o corregido por 100 ml. de filtrado glomerular renal (FGR))
• Cálculo del filtrado glomerular renal
• Función tubular:
– Excreciones fraccionales (EF) de bicarbonato, Na, K, Cl y ácido úrico. Tasa de reabsorción de fosfato (TRP)
– Excreción de Ca, Mg, glucosa, y proteínas de bajo peso molecular (calculada en orina de 24 horas o expresada en forma de cocientes urinarios)
Código OMIM: El proyecto OMIM (Mendelian Inheritance in Man) es una base de datos que incluye todas enfermedades de base genética, y que ofrece cuando existe evidencia científica información sobre su manifestación fenotípica
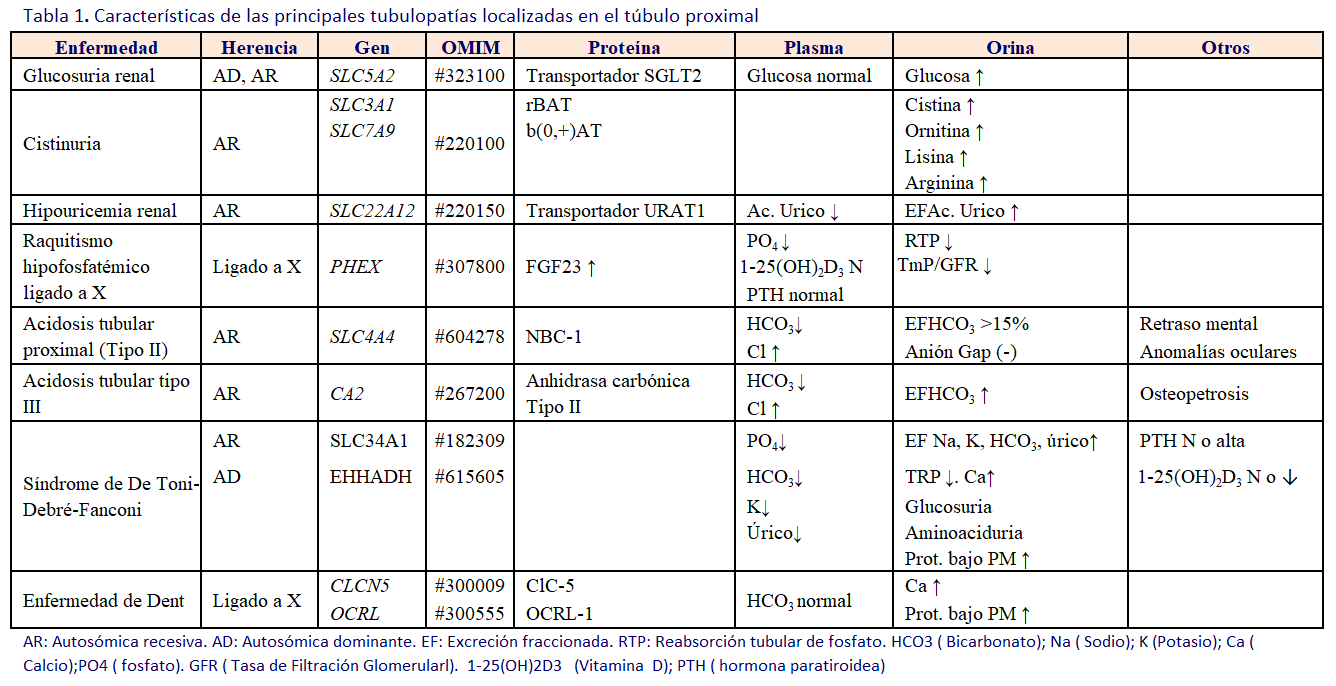
CARACTERISTICAS DE LAS PRINCIPALES TUBULOPATÍAS LOCALIZADAS EN EL TÚBULO PROXIMAL
Se describen en la (Tabla 1)
Glucosuria Renal hereditaria
La glucosuria renal hereditaria (OMIM#233100) es una enfermedad benigna causada por mutaciones en el gen SLC5A2, que codifica el transportador SGLT2, y da lugar a un trastorno en el transporte tubular activo de la glucosa. Se excretan en la orina cantidades variables de glucosa (150 gr/1,73m2SC/día), siendo la concentración plasmática de glucosa normal. En el diagnóstico se deben excluir glucosurias asociadas a otros defectos tubulares. Aunque algunos pacientes presentan poliuria importante, habitualmente no tiene síntomas, excepto durante el embarazo o inanición prolongada, cuando puede aparecer deshidratación y cetosis. La alteración existe desde la infancia hasta la edad adulta y el diagnóstico se hace habitualmente de forma casual. No requiere tratamiento [4] [5] [6]. Existen estudios que intentan valorar el impacto de la inhibición a largo plazo de SGLT2 en el transporte del túbulo renal proximal y la secreción de glucagón en estos pacientes [7].
Cistinuria
La cistinuria (OMIM#220100) es la aminoaciduria hereditaria más frecuente. Se caracteriza por un defecto tubular proximal e intestinal en la absorción de cistina (dímero de L-cisteína) y de los aminoácidos dibásicos ornitina, lisina y arginina. La etiología son las mutaciones de los genes SLC3A1 y SLC7A9 que codifican, respectivamente, el transportador rBAT o la subunidad b (0, +)AT del transportador específico. Se transmite de forma AD o AR. Cursa con nefrolitiasis repetida de cistina, cólico renal, obstrucción urinaria, infecciones e incluso ERC, sobre todo en varones. Para el diagnóstico se considera patognomónico la presencia de cristales de cistina. La determinación normal de cistina en orina es menos de 30 mg/día, en heterocigotos puede ser < 250 mg/día y en homocigotos > 400 mg/día. Los cálculos observados son radiopacos y pueden ser de aspecto coraliforme. El tratamiento consiste en una ingestión elevada de agua (1,5-2 L/m2/día), restricción de sodio, alcalinización urinaria y fármacos que solubilizan la cistina, como la D-penicilamina o la tiopronina, siendo ésta última de elección por tener menos efectos adversos [8]. Recientemente se ha establecido un consenso internacional de práctica clínica para esta entidad [9].
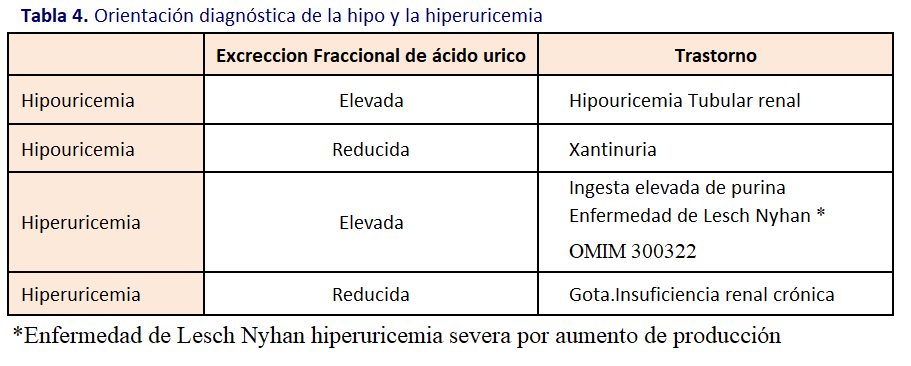
Hipouricemia renal
La hipouricemia aislada de origen renal (Tabla 4) es un defecto tubular aislado con aumento de la excreción urinaria de ácido úrico.
Hipouricemia renal tipo 1 es consecuencia de una mutación en el gen SLC22A12 (OMIM#220150), que codifica un intercambiador renal de urato-anión URAT1. Es responsable de más del 90% de los casos. Los pacientes homocigotos tienen concentraciones de urato en suero por debajo de 1,0 mg/dl y un defecto
descrita en pacientes con mutaciones en el gen SLC2A9 (OMIM#612076), que codifica un transportador de urato de alta capacidad llamada GLUT9. Presenta herencia autosómica recesiva, y en algún caso dominante. La pérdida de la función de las mutaciones en GLUT9 causan hipouricemia más grave (cerca de cero) en los individuos homocigotos, con una excreción fraccional de urato 100 a 150 % (valores por encima del 100 % reflejan la secreción de ácido úrico) [10]. Recientemente se han identificado nuevas mutaciones con significado clínico [11].
Las anormalidades clínicas son inusuales, aunque se ha descrito nefrolitiasis (8,5 a 12,5% en hipouricemia renal tipo 1 y 7 a 42% en tipo 2) y lesión renal aguda inducida por el ejercicio y estrés oxidativo (10% con hipouricemia renal tipo 1 y 10-42% en tipo 2) El tratamiento consiste en ingesta abundante de líquidos (1,5-2 l/día/m2 SC), dieta rica en cítricos y evitar la práctica de ejercicio anaeróbico, realizando ejercicio con abundante hidratación. Se debe mantener el pH urinario entre 6-7, administrando citrato potásico. Se han publicado casos aislados de utilización con éxito de alopurinol previo a realización de ejercicio intenso para evitar el Daño renal agudo. La aparente benignidad de esta entidad no puede hacernos olvidar la existencia de posibles complicaciones [12].
Raquitismo hipofosfatemico ligado a X
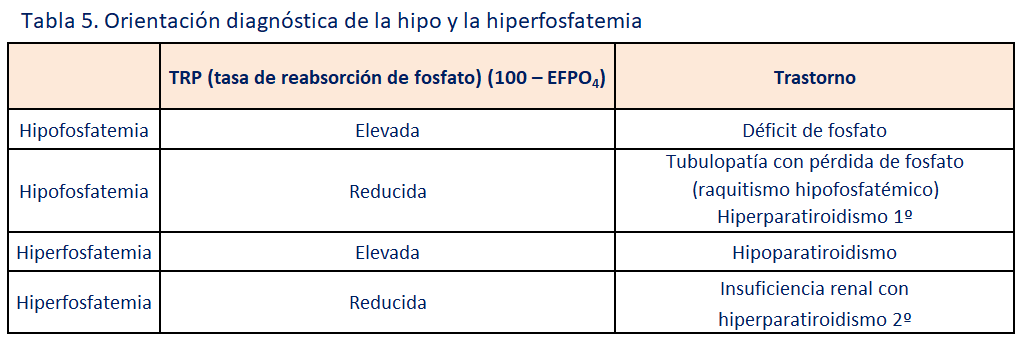
El raquitismo hipofosfatémico ligado al cromosoma X (Tabla 5) es la forma de raquitismo hereditario más frecuente. Mutaciones en el gen PHEX ocasionan una proteólisis defectuosa del factor de crecimiento fibroblástico (FGF23), cuyo aumento induce la endocitosis de los cotrasportadores específico de fósforo NaPT2a y NaPT2c, lo que conlleva una fuga renal de fosfato. Se trasmite de modo dominante ligado al cromosoma X. Es un raquitismo resistente a la vitamina D, talla baja, deformidades de las extremidades inferiores (genu varo), cráneo y cara, hiperlordosis lumbar y leves trastornos de la dentición. Existe hipofosfatemia con hiperfosfaturia, disminución del TmP/GFR y del TRP. Suele evidenciarse normo o hipocalciuria, e insuficiente producción reactiva de 1,25(OH)2D3 (valores inadecuadamente normales), con fosfatasa alcalina aumentada y PTH normal (90%). Además, se evidenciarán niveles elevados de FGF23. El tratamiento se realiza con aporte de suplementos de fosfato (20-40 mg/kg/día oral en varias dosis) y calcitriol (20-30 ng/kg/día según respuesta). Desde el 2021, está aprobado el Burosumab en niños y desde el diciembre del 2023, existe indicación en adultos (Anticuerpo anti-FGF23) [13].
Acidosis tubular renal proximal tipo II
La ATR proximal (ATR tipo II) se caracteriza por un defecto en la reabsorción de CO3H-. Se observa con más frecuencia en asociación con una disfunción tubular proximal múltiple en el contexto un síndrome de Fanconi. Existe una forma de origen genético de herencia AR causada por mutaciones homocigotas en el gen SLC4A4 (OMIM#604278), que codifica el transportador basolateral Na+-HCO3-, asociada a anomalías oculares y retraso mental y una forma transitoria. La ATR tipo II puede ser también secundaria al uso de drogas y tóxicos (acetazolamida, tetraciclinas, ifosfamida, valproato, etc) o acontecer en el curso de otras enfermedades (hiperparatiroidismo, síndrome de Leigh, etc). El diagnóstico se realiza al comprobarse la existencia de acidosis metabólica hiperclorémica con anión gap normal, con excreción fraccionada de bicarbonato >15%, anión Gap urinario negativo y mecanismos de acidificación distal indemnes.
La ATR renal combinada proximal y distal (tipo III) se observa en la osteopetrosis AR como consecuencia de mutaciones en el gen CA2 (OMIM#267200), codificante de la anhidrasa carbónica tipo II. En la ATR proximal se necesitan dosis altas de álcalis.
Síndrome de De Toni-Debré-Fanconi (OMIM #134600)
Con este término se designa a cualquier disfunción tubular proximal compleja, sea completa o parcial, e independientemente de la etiología responsable. Es un proceso multifactorial, probablemente causado por un daño enzimático no específico de la célula tubular proximal, que afectaría la función de los trasportadores sodio dependientes o por alteración de algún proceso metabólico esencial que afecta a múltiples transportadores simultáneamente. Se caracteriza por pérdida renal, en grado variable, de fosfato, bicarbonato, sodio, potasio, cloro, ácido úrico, aminoácidos, glucosa, proteínas de bajo peso molecular, carnitina y otros solutos manejados en este segmento [14].
Puede ser primario (autosómico dominante (AD), autosómico recesivo (AR) o recesivo ligado al cromosoma X) con mutaciones genéticas desconocidas (sólo se han descrito una de herencia AD por mutaciones en el gen EHHADH y otra de herencia AR por mutaciones en el gen SLC34A1) o secundario a otras enfermedades genéticas (cistinosis, tirosinemia, galactosemia, fructosemia, síndrome de Lowe, glucogenosis, citopatías mitocondriales, enfermedad de Wilson entre otros). Puede asociarse a enfermedades adquiridas (mieloma múltiple, enfermedad neoplásica, síndrome nefrótico idiopático, nefritis intersticial aguda con anticuerpos antimembrana basal glomerular, cirrosis biliar primaria, trasplante renal). También en relación con fármacos (antibióticos, citostáticos, ácido valpróico, ranitidina, hierbas medicinales chinas) y tóxicos (metales pesados) [10].
Los síntomas principales son poliuria (por defecto en la capacidad de concentración), polidipsia, episodios de deshidratación y fiebre, retraso de crecimiento, raquitismo y osteomalacia, debilidad muscular y manifestaciones extrarrenales que dependen de la enfermedad a la que se asocie. En sangre, existe acidosis metabólica hiperclorémica, hipofosfatemia, normo o hiponatremia, hipopotasemia, hipouricemia, elevación de fosfatasa alcalina. La PTH puede estar normal o alta y 1-25(OH)2vitD3 normal o disminuida. En orina se comprueba defecto de concentración urinaria, hiperfosfaturia, aumento de la eliminación de sodio y potasio, hiperaminoaciduria, glucosuria, proteinuria de bajo peso molecular, hiperuricosuria, y de forma no constante hipercalciuria. En ecografía, puede haber nefrocalcinosis.
La evolución es variable, dependiendo del agente etiológico., algunos cuadros desaparecen al suprimir el agente causal o tratar la enfermedad subyacente, en las formas primarias el curso clínico suele ser crónico y la evolución es progresiva hacia la enfermedad renal crónica (ERC).
Enfermedad de Dent
Es una tubulopatía proximal compleja incompleta causada por mutaciones en dos genes. La enfermedad de Dent tipo I es causada por mutaciones en el gen CLCN5 que codifica el canal de Cloro 5 (OMIM#300009), responsable del 60% de los casos y la tipo II presenta mutaciones en el gen OCRL-1 que codifica la fosfatidil-inositol 4,5 bifosfato 5 fosfatasa (OMIM#300555), causa el 15% de casos y también el síndrome de Lowe. Ambos trasmitidos por el cromosoma X, por lo que el fenotipo es más severo en los varones afectos. En el 25% de paciente no se detecta ninguna de estas mutaciones. Existe gran variabilidad fenotípica, se caracteriza por proteinuria de bajo peso molecular muy incrementada (β2 microglobulina, proteína trasportadora de retinol), hipercalciuria notable, nefrolitiasis/nefrocalcinosis medular, raquitismo/osteomalacia. En algunos pacientes puede existir hiperuricosuria, hematuria, glucosuria, hiperaminoaciduria, hiperfosfaturia, pérdida renal de potasio y defecto en la capacidad de concentración. El diagnóstico se suele realizar tras el hallazgo de proteinuria persistente en un varón, en el estudio de un paciente con nefrocalcinosis, litiasis y/o insuficiencia renal. Algunos pacientes presentan proteinuria glomerular aislada por glomeruloesclerosis. El diagnóstico se apoya en la historia familiar de litiasis y la detección de hipercalciuria y/o proteinuria de bajo peso molecular en las portadoras. La evolución es a enfermedad renal crónica en el 30-80% de los afectos en la edad adulta. No se ha objetivado recidiva en el trasplante renal [15] [16]. Se están estudiando nuevas terapias para frenar la progresión de la enfermedad [17].
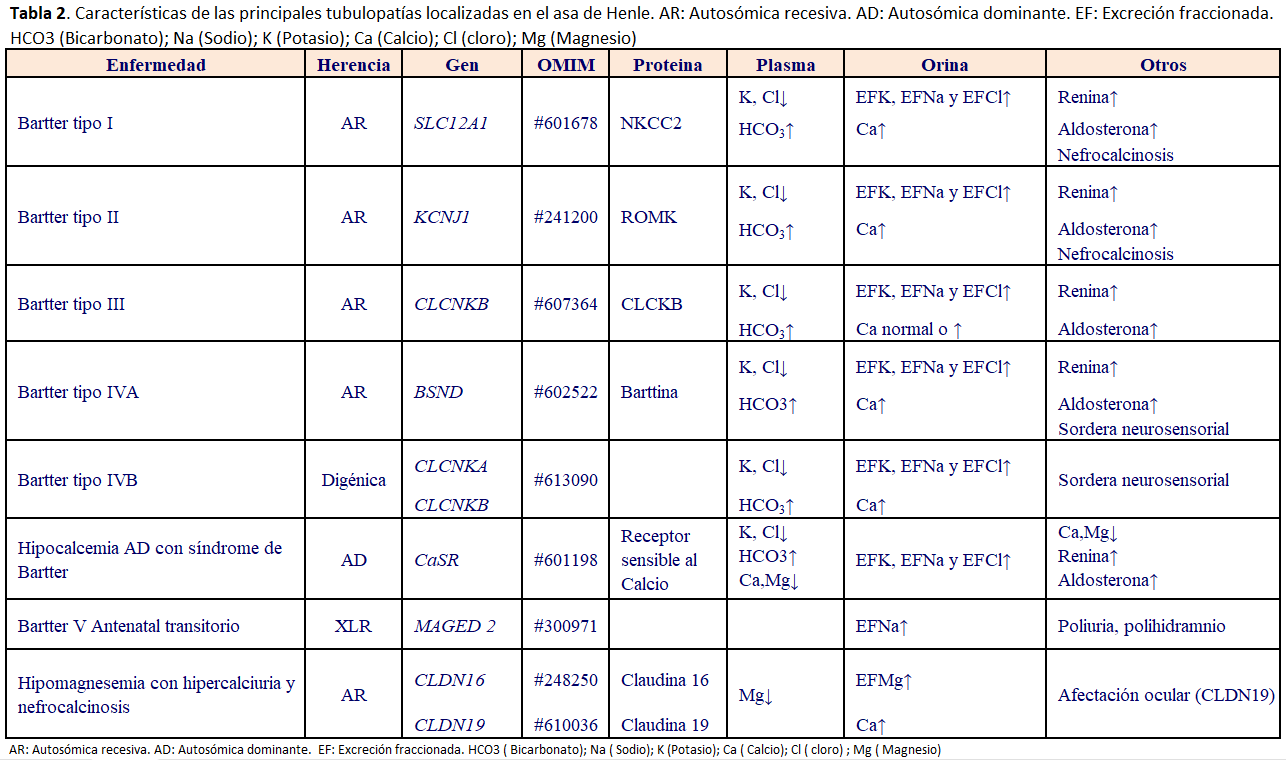
CARACTERÍSTICAS DE LAS PRINCIPALES TUBULOPATÍAS LOCALIZADAS EN EL ASA DE HENLE
Las principales características se describen en la (Tabla 2)
Síndrome de Bartter
El síndrome de Bartter está constituido por un conjunto de trastornos hereditarios con herencia autosómica recesiva, caracterizados por una tubulopatía pierde sal confinada a nivel del segmento grueso del asa ascendente de Henle con diversas causas subyacentes, pero con un mecanismo patogénico final común, caracterizada por una pérdida de función del cotransportador NKCC2. Tiene una prevalencia de 1 en 1.000.000. Se distinguen dos formas clínicas principales, el síndrome de Bartter neonatal y el síndrome de Bartter clásico.
Las mutaciones de los genes que codifican el transporte de Na+, K+ y Cl- producen pérdida salina urinaria, con la consiguiente depleción de volumen e hipercalciuria, que secundariamente estimulan el sistema renina-angiotensina-aldosterona, cuya hiperactividad es responsable del resto de las características del síndrome. [18] [19]
El Bartter neonatal o tipo I depende de mutaciones en el gen SLC12A1 (OMIM#601678), que codifica el cotransportador NKCC2 del asa ascendente de Henle. Presenta la variedad más grave. Se caracteriza por presentar polihidramnios, prematuridad, poliuria severa, episodios de deshidratación, hipercalciuria, nefrocalcinosis difusa. Se ha descrito un fenotipo peculiar caracterizado por facies triangular con frente prominente, ojos grandes, orejas que protruyen, boca con las comisuras hacia abajo, tejido graso escaso y pobre masa muscular.
El Bartter tipo II depende de mutaciones en el gen KCNJ1 (OMIM#241200), que codifica el canal de potasio ROMK.
El Bartter clásico o tipo III está causado por mutaciones en el gen CLCNKB (OMIM#607364), que codifica el canal de cloro ClC-Kb . Debuta por lo general en los dos primeros años de vida con poliuria, polidipsia, vómitos, estreñimiento, avidez por la sal, tendencia a la deshidratación y falta de medro. Puede haber síntomas musculares en forma de debilidad muscular y fatiga. La presión arterial es normal o baja. A veces se diagnostica por el hallazgo de nefrocalcinosis o en el estudio de una infección urinaria [20][21].
El Bartter tipo IVA está producido por mutaciones en el gen BSND (OMIM#602522), que codifica una subunidad de los canales de cloro ClC-Ka y ClC-Kb denominada barttina. Esta variante cursa con sordera y según la mutación subyacente puede tener una presentación neonatal o clásica.
El Bartter tipo IVB (OMIM#613090) se caracteriza por la presencia simultánea de una delección en el gen CLCNKB y de una mutación “missense” en el gen CLCNKA, sin existir mutaciones en el gen BSND.
El síndrome de Bartter con hipocalcemia AD es producido por mutaciones “de ganancia de función” en el gen CASR (OMIM#601198), que codifica el receptor sensible a calcio. La herencia de este tipo del síndrome es autosómica dominante. La activación del receptor sensible a calcio inhibe la actividad del canal ROMK y, secundariamente, reduce la reabsorción de ClNa en la rama ascendente del asa de Henle.
El Bartter V Antenatal transitorio, recientemente se ha identificado mutaciones en MAGED2 como causa de una forma ligada a X caracterizada por un inicio muy temprano de polihidramnios severo y extrema prematuridad que conduce a una alta mortalidad. Aproximadamente el 20% de los pacientes con diagnóstico clínico de Bartter antenatal no mostraban mutaciones conocidas Sorprendentemente, todos los síntomas en los pacientes supervivientes con mutaciones MAGE-D2 se resuelven espontáneamente, en el tercer trimestre de embarazo o unas semanas después del parto prematuro. MAGE-D2 afecta la expresión (con disminución de la expresión) de los cotransportadores de cloruro de sodio NKCC2 y NCC, explicando de ese modo la gravedad de la enfermedad. Está por determinar si la severidad de la enfermedad puede explicarse totalmente por el compromiso simultáneo de NKCC2 y NCC o porque hay otros transportadores que también están afectados [22].
Diagnóstico del síndrome de Bartter
La característica diagnóstica fundamental es la hipopotasemia si bien la hipocloremia y la alcalosis metabólica suelen ser universales. En orina se objetiva defecto de concentración urinaria con pérdida salina con excreciones fraccionales de Na+, K+ y Cl- elevadas. El filtrado glomerular inicialmente está conservado, excepto en algunos casos del tipo 4. El tipo 3 puede presentar hipomagnesemia. El gradiente transtubular de potasio está elevado (GTTK >12). Habitualmente existe hipercalciuria, excepto en el tipo 3, en el que es inconstante, e incluso puede observarse hipocalciuria. Además, existe hiperreninemia con aldosterona y prostaglandina E elevadas.
El síndrome de Bartter con hipocalcemia AD puede asociar hipocalcemia y déficit de paratohormona.
Se debe realizar ecografía renal (nefrocalcinosis-litiasis), audiometría, potenciales evocados auditivos y estudiar la agudeza visual. El diagnóstico prenatal se sospecha por polihidramnios, y aumento de la concentración de Cl- del líquido amniótico.
Tratamiento del Síndrome de Bartter
Si se diagnostica Bartter prenatal y el polihidramnios es grave se puede tratar con AINE hasta la semana 31 y posteriormente drenaje intermitente de líquido amniótico si es preciso. En estas formas el esfuerzo terapeútico inicial se orienta a prevenir o corregir la deshidratación y el desequilibrio hidroelectrolítico. Los inhibidores de la síntesis de prostaglandinas son los fármacos de elección, fundamentalmente la indometacina (1-5 mg/kg/día dependiendo del tipo), que debe evitarse hasta las 4-6 semanas de vida en el Bartter neonatal por riesgo de enterocolitis necrosante). Se requieren suplementos de cloruro potásico (1-3 mEq/kg/día). Otros tratamientos adyuvantes son el amiloride, la espironolactona y el triamtereno e incluso las tiazidas en un intento de evitar la hipercalciuria y la nefrocalcinosis. Se debe suministrar suplementos de magnesio y calcio en los casos en que es necesario. No se ha descrito recurrencia de la enfermedad en el trasplante renal.
Hipomagnesemia con hipercalciuria y nefrocalcinosis
Es una tubulopatía causada por las mutaciones de los genes CLDN16 (OMIM#248250), y CLDN19 (OMIM#610036), que codifican unas proteínas denominadas claudinas 16 y 19 que regulan el trasporte paracelular de Ca2+ y Mg2+ en la rama ascendente del asa ascendente de Henle. Tiene herencia autosómica recesiva. La mayoría de los pacientes españoles son portadores de la misma mutación en el gen CLDN19 (p.G20D). La edad de diagnóstico es muy variable (media 3,5 a 15 años de edad). Se manifiesta en forma de poliuria y polidipsia, infección urinaria, nefrolitiasis y nefrocalcinosis, menos frecuentemente se presenta tetania, convulsiones, hematuria, debilidad muscular, calambres musculares, dolor articular, letargia, vómitos, retraso de crecimiento o dolor abdominal.
Evolución hacia enfermedad renal crónica. Es frecuente, además, en pacientes con mutaciones en el gen CLDN19 la afectación ocular principalmente con miopía maligna, nistagmus o coloboma macular. En los exámenes de laboratorio se detecta, hipomagnesemia con hipermagnesiuria (la ausencia de hipomagnesemia no descarta el diagnóstico si existe ERC), pérdida de capacidad de concentración urinaria, En orina existe una excreción muy aumentada de calcio y magnesio. Se puede evidenciar además PTH elevada previo al desarrollo de ERC, hipocitraturia, acidosis tubular distal incompleta e hiperuricemia.
Un tercio de los pacientes presenta ERC al momento del diagnóstico con elevación de urea y creatinina plasmáticas (más frecuente en mutaciones del gen CLDN19).
En la ecografía es constante la nefrocalcinosis y puede asociar litiasis.
El tratamiento consiste en mantener un estado de hidratación adecuado, suplementos de magnesio, citrato potásico y sintomático. El tratamiento no suele prevenir el fallo renal progresivo. No hay recaída en el trasplante renal [23].
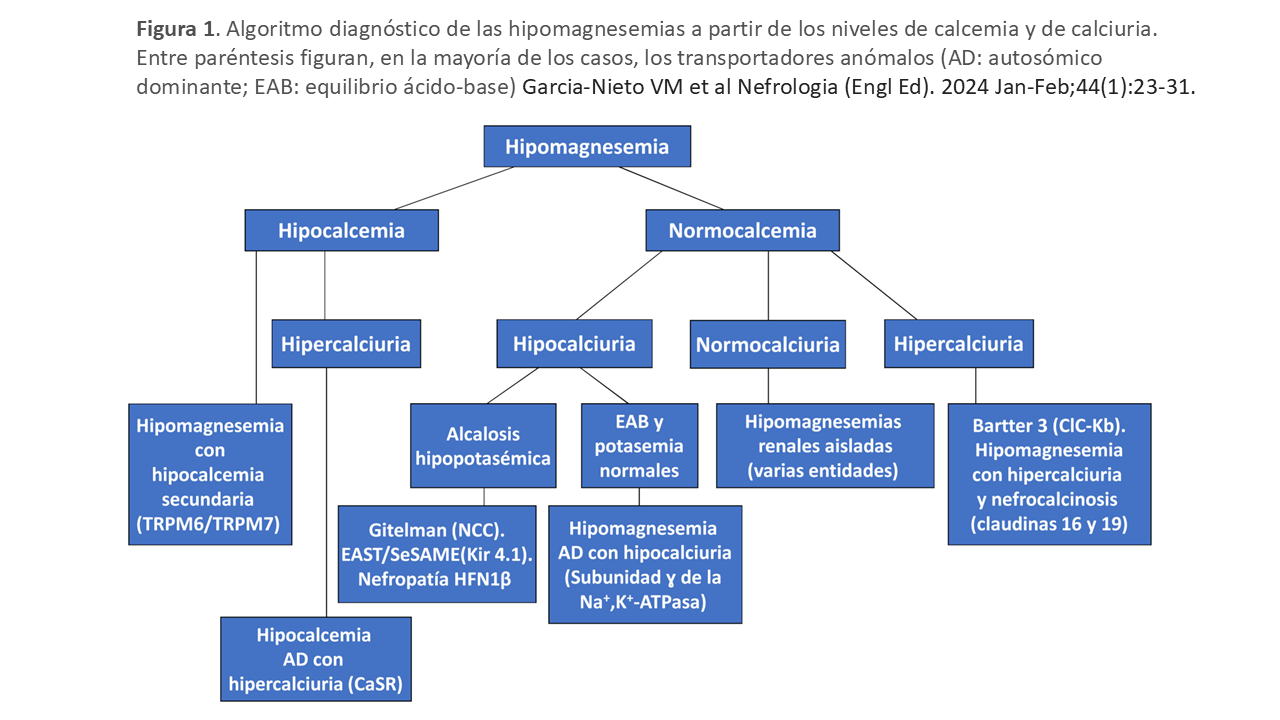
Las entidades que cursan con hipomagnesemia han sido ampliamente estudiadas, existiendo nuevas tubulopatías, recomendamos la lectura de esta actualización y adjuntamos la figura para el diagnóstico diferencial [24]. (Figura 1)
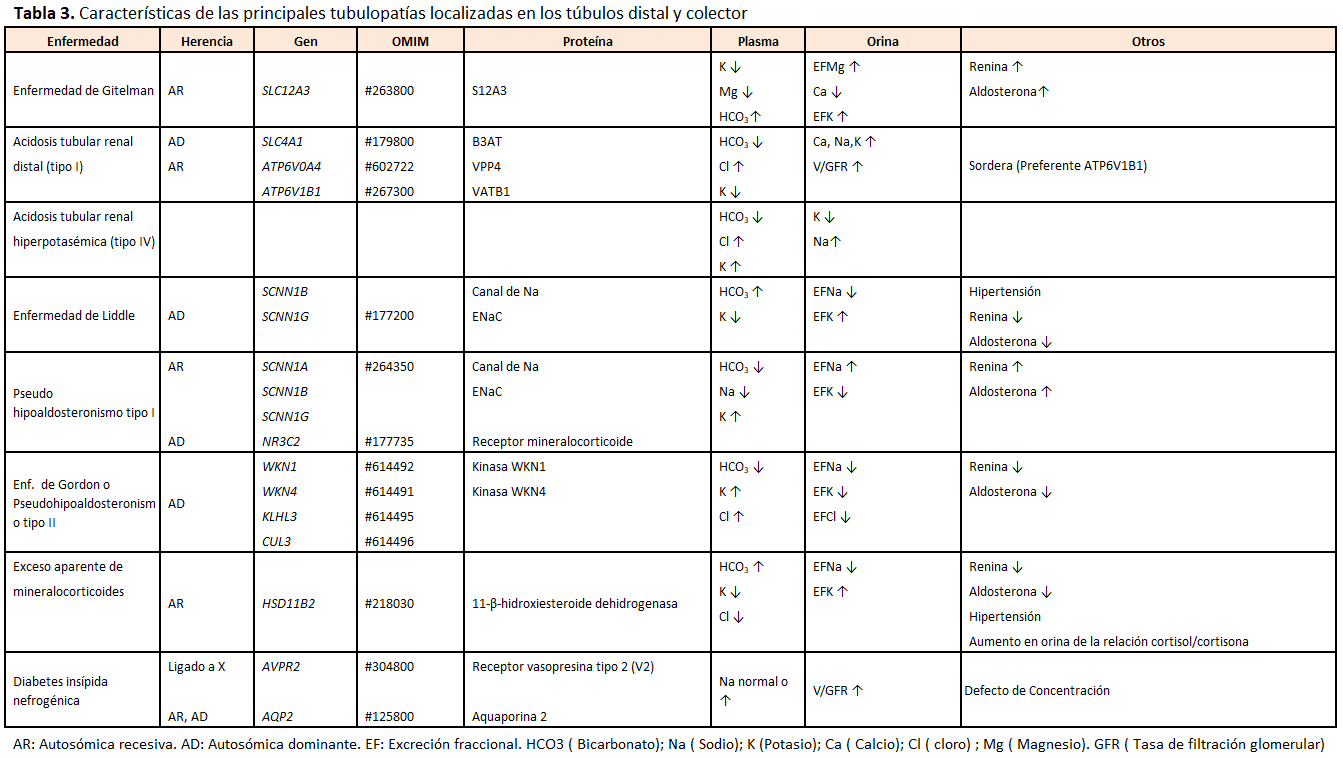
CARACTERÍSTICAS DE LAS PRINCIPALES TUBULOPATÍAS LOCALIZADAS EN LOS TÚBULOS DISTAL Y COLECTOR
Las principales características se describen en la (Tabla 3).
Enfermedad de Gitelman
Está causada por mutaciones inactivantes del gen SLC12A3 (OMIM#263800), que codifica el cotransportador NaCl sensible a tiazidas del túbulo contorneado distal. Existe una pérdida urinaria de ClNa con la subsiguiente depleción moderada de volumen y estimulación del sistema renina-angiotensina-aldosterona, con hipopotasemia y alcalosis metabólica secundaria. Se evidencia una reducción en la expresión del canal de Mg2+ TRPM6 en la membrana apical de las células del TCD que es responsable de la hipomagnesemia y un aumento en la reabsorción de Ca2+ que causa la hipocalciuria. La prevalencia es de 1/50.000 [25].
Muchos pacientes se encuentran asintomáticos o con síntomas leves neuromusculares de inicio en la infancia tardía o en la juventud, no obstante, existen formas más severas en la primera infancia difíciles de distinguir clínicamente de un síndrome de Bartter tipo III. No existe correlación fenotipo-genotipo y los síntomas principales son avidez por alimentos salados, tendencia a presión arterial normal o normal-baja, intolerancia al ejercicio físico, poliuria, debilidad muscular, calambres, parestesias. En una minoría de casos puede haber retraso del crecimiento y talla baja. Los síntomas neuromusculares son habitualmente leves, secundarios a hipopotasemia y a hipomagnesemia, pero puede haber tetania o convulsiones. La condrocalcinosis es poco habitual en niños. Puede existir prolongación del intervalo QT y arritmias.
En la analítica se evidencia hipomagnesemia con EFMg inapropiadamente elevada, hipopotasemia con EFK elevada, alcalosis metabólica, hipocalciuria (Cociente Ca/Cr < 0,10 mmol/mmol o calciuria < 1 mg/kg/día), renina y aldosterona elevadas.
El tratamiento se basa en la administración de cloruro potásico y sales de magnesio (en forma de cloruro, lactato o aspartato). En situaciones graves se administran potasio y/o magnesio endovenoso. Se puede añadir diuréticos ahorradores de potasio o antagonistas de la aldosterona (amilorida, triamtereno, espironolactona). Se emplean inhibidores de las prostaglandinas en pacientes con respuesta inadecuada al tratamiento. Se deben evitar los ejercicios físicos intensos para minimizar las arritmias junto a una dieta rica en potasio, magnesio y sodio. No se deben tomar fármacos arritmogénicos [26].
Síndrome EAST o SeSAME)(OMIM#612780)
Mutaciones en el gen KCNJ10 que codifica el canal de potasio Kir4.1, de herencia autosómica recesiva, producen un cuadro similar al Gitelman asociado a epilepsia, ataxia y sordera neurosensorial.
Acidosis tubular renal (ATR) distal tipo I
En el niño, la ATR distal se manifiesta casi siempre de manera primaria con carácter hereditario permanente y algunas ocasiones de forma transitoria (síndrome de Lightwood). Se define por la incapacidad de disminuir el pH urinario
Se debe a mutaciones en varios genes; en el gen ATP6V1B1 (OMIM#267300) que codifica la subunidad B1 de la H+-ATPasa (localizadas en las células alfa-intercaladas y células cocleares) originan la forma AR asociada con sordera neurosensorial. La forma AR de ATRd sin sordera o con sordera neurosensorial de aparición tardía está causada por mutaciones en el gen ATP6V0A4 (OMIM#602722), que codifica la subunidad a4 de la H+-ATPasa. Las mutaciones en el gen SLC4A1 (OMIM#179800), que codifica en intercambiador AE1 (Cl-/HCO3-) de la cara basolateral de la célula alfa-intercalada pueden heredarse de forma AD o AR. Se han descrito también mutaciones en el gen ATP6N1B que codifica la unidad accesoria no catalítica de la bomba de protones.
Los pacientes presentan síntomas desde las primeras semanas de vida como vómitos, poliuria, deshidratación y falta de ganancia ponderal. Posteriormente, se hace evidente el retraso de crecimiento, la poliuria y el estreñimiento. Pueden aparecer debilidad muscular e incluso episodios de parálisis flácida como consecuencia de la hipopotasemia. En la exploración, pueden observarse signos de deshidratación, desnutrición y raquitismo. Debe investigarse siempre la posible asociación con sordera nerviosa, aunque puede ser progresiva y muchos pacientes superan el screening de sordera neonatal y desarrollan hipoacusia tardíamente. En casos más leves puede manifestarse durante la adolescencia o edad adulta en forma de litiasis, nefrocalcinosis y dolores óseos o articulares que son consecuencia de la osteomalacia.
El diagnóstico se realiza al confirmar la presencia de acidosis metabólica hiperclorémica con hiato aniónico (anión gap) normal, normopotasémica o hipopotasémica con pH urinario superior a 5,5, a pesar de la acidosis sistémica. Puede observarse una hipercalcemia transitoria en recién nacidos y lactantes, que es secundaria a la acidosis y desaparece tras normalizarla. Se evidencia además hipercalciuria, hipocitraturia, aumento de la secreción de prostaglandina E2 y aldosterona. Existe nefrocalcinosis precoz, siendo poco frecuente la litiasis renal en la infancia. La filtración glomerular es normal al inicio [27] [28].
PRUEBAS DE ESTIMULO: Estudio de la capacidad de acidificación renal
Prueba con estímulo combinado de bicarbonato sódico y acetazolamida
En este prueba se administran dos sustancias por vía oral a la mitad de las dosis, es decir, 2 mEq/kg de bicarbonato y 0,5 g/1,73 m2 de acetazolamida. La respuesta bicarbonatúrica es adecuada y sin ningún efecto secundario.
Los pacientes vacían la vejiga al inicio de la prueba y una hora después. Media hora mas tarde, se recoge una muestra de orina en la que se determina la pCO2 de forma inmediata; en caso contrario, deberá conservarse la orina bajo aceite mineral. Para que la prueba sea válida, la concentración urinaria de bicarbonato debe ser superior a 80 mEq/l, la cual se suele alcanzar cuando el pH urinario es >7,4. En caso de no alcanzarse, se repetirá la determinación en la siguiente orina. La pCO2 urinaria máxima, en situación de normalidad, debe ser superior a 70 mmHg. En nuestros controles pediátricos, el valor mínimo de la normalidad con estímulo con bicarbonato oral fue de 70.6 mmHg (80.6±8.7) y con acetazolamida de 76.2 mmHg (82.0±14.4)
Es la prueba más sencilla y la que mejor estudia la capacidad de acidificación distal
Acidosis tubular renal hiperpotasemica (tipo IV)
Es la más frecuente, se asocia a diversas patologías que se caracterizan por presentar acidosis metabólica e hiperpotasemia generalmente secundaria a un déficit de aldosterona por disminución en su producción o resistencia periférica a su acción. No se ha referido una forma primaria. Se ha descrito en casos de hipoaldosteronismo y pseudohipoaldosteronismo, en ciertas situaciones patológicas (pseudohipoaldosteronismos, lupus eritematoso sistémico, hipoaldosteronismo hiporreninémico, uropatía obstructiva, drepanocitosis, nefropatía diabética, hiperplasia suprarrenal congénita con pérdida salina, etc) y tras el uso de algunos fármacos (trimetoprim, anticalcineurínicos, IECA, ARA II entre otros). En esta variante de ATR, los pacientes acidifican adecuadamente por debajo de 5,5 tras una sobrecarga ácida, si bien son incapaces de aumentar la excreción urinaria de pCO2 en situaciones de acidosis [29].
Tratamiento
El tratamiento consiste en la administración de bicarbonato y/o citrato potásico en cantidad suficiente para compensar la producción endógena de H+ (1,5-2 mEq/kg/día en niños), corregir la hipercloremia, la hipercalciuria y la hipocitraturia y normalizar completamente el crecimiento.. En el tipo IV, es necesario suprimir los fármacos que retienen potasio y administrar resinas de intercambio iónico o diuréticos del tipo de la furosemida para controlar la hiperpotasemia. Desde el año 2021 se ha aprobado el uso de ADV7103 (Sibnayal), una combinación de sales de liberación
n prolongada (citrato de potasio y carbonato ácido de potasio) [30] Si cursa con hipoaldosteronismo, se debe administrar fludrocortisona.
Enfermedad de Liddle
Es una tubulopatía AD causada por mutaciones de ganancia de función en los genes SCNN1B y SCNN1G (OMIM#177200), que codifican las subunidades β y γ del canal epitelial de sodio ENaC con lo que se evita su unión a Nedd4-2 y aumenta la densidad apical de ENaC. En situación normal, la unión de Nedd4-2 a ENaC favorece la endocitosis y su degradación.
Se manifiesta con signos clínicos y bioquímicos que son consecuencia de una reabsorción tubular renal excesiva de ClNa. El resultado es una expansión del espacio extracelular con hipertensión arterial severa, alcalosis metabólica, hipopotasemia. Los niveles de renina y aldosterona se encuentran muy reducidos. El tratamiento se basa en diuréticos como triamtereno o amiloride.
Enfermedad de Gordon (Pseudohipoaldosteronismo tipo II)
Es debido a mutaciones de ganancia de función de los genes WKN1 (OMIM#614492)y WKN4 (OMIM#614491), que codifican las kinasas WKN1 y WKN4 respectivamente, que regulan el cotrasportador NCC en el túbulo distal. Puede haber mutaciones también en el gen KLHL3 (OMIM#614495) y CUL3 (OMIM#614496). Se trasmite de forma AD con alguna variante AR (KLHL3).
Las mutaciones en CUL3 causan el fenotipo más severo y las mutaciones en WNK1 el más leve. Los individuos afectos presentan hipertensión, talla baja, hiperpotasemia, acidosis metabólica (acidosis tubular distal tipo IV) y un descenso de los niveles plasmáticos de renina y aldosterona. Algunos pacientes presentan hipercalciuria. El tratamiento se basa en una dieta baja en sodio y diuréticos tipo tiazidas.
Diabetes insípida nefrogénica (DIN)
Es un trastorno de la reabsorción de agua en el túbulo colector. Se manifiesta por la excreción de grandes cantidades de orina muy diluida dada la incapacidad de concentrar la orina debido al fallo de respuesta tubular a la hormona antidiurética (ADH) o vasopresina. Puede ser de origen genético o secundario. Las mutaciones en el gen AVPR2 (OMIM#304800) son la causa más frecuente de DIN primaria (90% de los casos) y tienen forma de herencia recesiva ligada al cromosoma X, por lo que la enfermedad severa se presenta en varones homocigotos. Mutaciones del gen que codifica la aquaporina 2 (AQP2) (OMIM#125800) son responsables del 10% de los casos y tiene herencia AR o AD, por lo que afecta a niños de ambos sexos. La DIN adquirida se debe a la pérdida del gradiente osmótico y a la lesión tubular que cursa con una reducción en la expresión de AQP2 en la médula renal. Se observa en nefropatías túbulo-intersticiales crónicas (poliquistosis, uropatía obstructiva, displasia renal, nefronoptisis, insuficiencia renal, depleción de potasio o hipercalcemia crónicas) o puede ser secundaria a fármacos (litio, colchicina, anfotericina B, vincristina).
La DIN de origen genético se caracteriza por poliuria importante (puede exceder 5 ml/kg/hora), hipostenuria y polidipsia secundaria. Los síntomas aparecen en las primeras semanas de vida. Las manifestaciones iniciales en los niños pequeños son irritabilidad, rechazo de las tomas, avidez por el agua, anorexia, vómitos, fallo de medro, fiebre y estreñimiento. En niños mayores, es frecuente la nicturia y la enuresis. La poliuria puede derivar en alteraciones urológicas como megavejiga, megauréter e hidronefrosis no obstructiva. El retraso psicomotor podría estar relacionada con los desequilibrios hidroelectrolíticos, ya que es poca su incidencia en niños adecuadamente tratados.
Cuando los niños son pequeños y no tienen acceso directo a la ingesta de agua, la osmolalidad plasmática y los iones, sodio y cloro, están elevados, con valores de osmolalidad urinaria es inferior a la plasmática (< 200 mOsm/kg). Se observa falta de respuesta en la prueba de concentración con desmopresina.
El pilar fundamental del tratamiento consiste en la reposición de las pérdidas urinarias mediante el adecuado aporte de fluidos. Puede ser necesario el uso de sonda nasogástrica o gastrostomía en niños pequeños. Las pérdidas urinarias pueden reducirse con una dieta baja en solutos que disminuya la carga osmolar renal y, por tanto, la excreción de agua. La lactancia materna resulta ideal debido a su escasa carga osmolar y a su bajo contenido en sodio. En los niños mayores se recomienda una dieta con limitación moderada de proteínas y de sodio. La hidroclorotiazida, favorece la reabsorción tubular proximal de agua y sodio renales. La indometacina, reduce el volumen urinario. La amilorida con la hidroclorotiazida, también, puede ser eficaz [31].
Pseudohipoaldosteronismo tipo I
Se ilustra en la (Tabla 3)
Se trata de una enfermedad hereditaria caracterizada por una resistencia a la acción de la aldosterona en el túbulo colector con la subsiguiente pérdida salina con hipovolemia, hiponatremia, hiperpotasemia y acidosis metabólica (acidosis tubular renal tipo IV) con niveles elevados de renina y aldosterona.
La variante renal es la más frecuente, se hereda con carácter AD y está causada por mutaciones en el gen NR3C2 (OMIM#177735), que codifica la síntesis del receptor mineralocorticoide humano. Incidencia de 1/80.000. Se manifiesta en la primera infancia por polihidramnios, fallo de crecimiento, pérdida de peso, vómitos, deshidratación, pérdida salina renal, hiperpotasemia, hiponatremia y acidosis metabólica con gran aumento de renina y aldosterona en plasma. En las familias afectas pueden existir individuos aparentemente asintomáticos. El tratamiento se basa en suplementos de cloruro sódico son evolución clínica favorable y mejoría espontanea a partir de 1 a 3 años de vida.
La variante sistémica se hereda con carácter AR y está causada por mutaciones con pérdida de función de uno de los genes codificadores SCNN1A, SCNN1B y SCNN1G (OMIM#264350), de las subunidades α, β y γ del canal epitelial de sodio ENaC que se expresa en las células principales del túbulo colector. Existe una resistencia periférica a la acción de los mineralocorticoides con afectación tubular, digestiva, respiratoria y de glándulas sudoríparas y salivares. Es más grave, la sintomatología aparece al nacimiento con pérdida salina masiva, poliuria, deshidratación y posible muerte.
Si se supera el periodo neonatal se pueden presentar posteriormente episodios de descompensación progresivamente menos frecuentes, y habitualmente retraso ponderoestatural. También presentan infecciones respiratorias de repetición y síntomas respiratorios sin infección. Se comprueba un aumento de la concentración de electrolitos en sudor y saliva. El tratamiento consiste en la administración de suplementos de cloruro sódico y si es necesario resinas de intercambio para controlar la hiperpotasemia [32].