Poliquistosis Renal Autosómica Dominante
Palabras clave
Quistogénesis, cistogénesis, PQRAD, PQR, Tolvaptan, hígado, aneurismas, hipertensión
INDICE
Introducción
Quistogénesis en la PQRAD
Manifestaciones clínicas de la PQRAD
Diagnóstico diferencial de la PQRAD
Diagnóstico por imagen
Diagnóstico genético
Criterios de Rápida Progresión
Tratamiento
Nota: este capítulo es redactado por el Coordinador del documento de consenso de PQRAD 2020, por lo que, en general, las recomendaciones de varios apartados son transcripciones de las propias Guías. Asimismo, el manuscrito se irá actualizando en función de las novedades temáticas.
INTRODUCCIÓN
La Poliquistosis Renal Autosómica Dominante (PQRAD) es la enfermedad renal hereditaria más frecuente con una incidencia de 1 cada 400-1000 nacimientos vivos y donde la presentación típica consiste en el desarrollo y crecimiento progresivo de quistes en todo el parénquima renal y que resultarán en el crecimiento bilateral de los riñones con aparición de Enfermedad Renal Crónica (ERC) en el 45 al 70% de individuos con edad de 65 años [1]. Fue Pierre Rayer en 1841 quien escribió, que cuando se sospecha la degeneración quística de los riñones durante la vida, se trata de una enfermedad sin cura. Este concepto se ha mantenido durante el siglo XX. Los conocimientos de esta enfermedad se han incrementado tras la identificación en la década de los 90 de los genes PKD1 y PKD2.
El gen PKD1 se localiza en el cromosoma 16 (16p13.3), contiene 46 exones y se localiza en una región del genoma rica en citosina y guanina. Este gen es responsable de aproximadamente el 78% de los casos de PQRAD, su transcripción permite la síntesis de la poliquistina 1 (PC1), glicoproteína de membrana relacionada con la interacción intercelular y con la matriz intercelular [2].
El segundo gen implicado es PKD2 (gen responsable del 15% de los casos), se halla en el brazo largo del cromosoma 4 (4q22.1), [3]. La proteína sintetizada por el gen PKD2; la poliquistina 2 (PC2), es un canal de calcio. Ambas proteínas se localizan en los cilios primarios, presentes en casi todas las células del organismo, por lo que estas enfermedades se llaman actualmente ciliopatías [4].
La pérdida de PC1 o PC2 se asocia con niveles bajos de las concentraciones de calcio intracelular provocando un incremento de la actividad de la adenilciclasa, reducción de la actividad de la fosfodiesterasa-1 e incremento de la concentración de AMPc y con ello aumento de la quistogénesis a través de vías de proliferación y secreción [5] [6] [7]. Se han identificado más de 1500 mutaciones diferentes de PKD1 y PKD2 l [7]. Recientemente se han identificado mutaciones en otros genes que causan una enfermedad poliquística que se asemeja a la PQRAD: GANAB, DNAJB11, ALG9, ALG5 y IFT140 [8] [9] [10] [11]. Las mutaciones espontáneas (casos esporádicos) pueden aparecer hasta en un 10% de los casos [12].
QUISTOGÉNESIS EN LA PQRAD
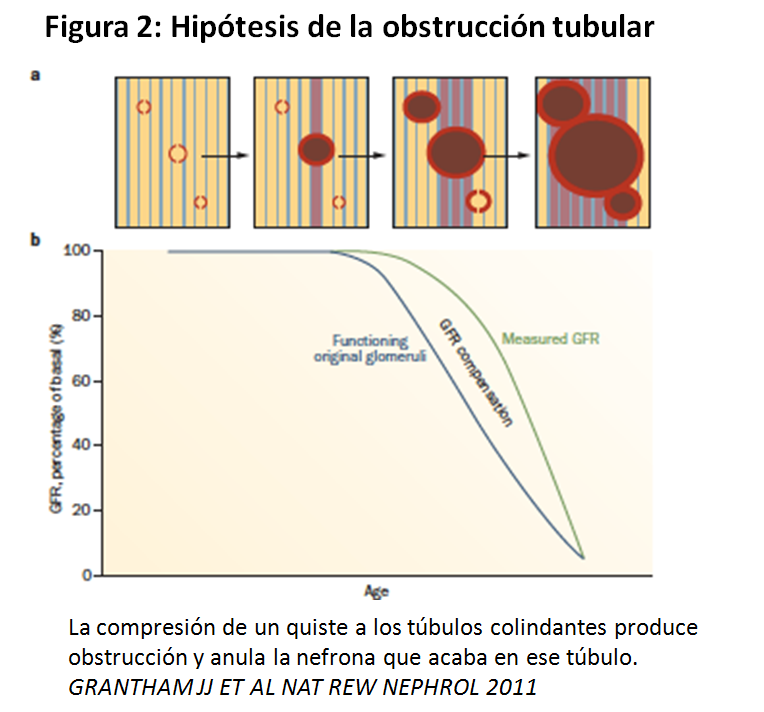
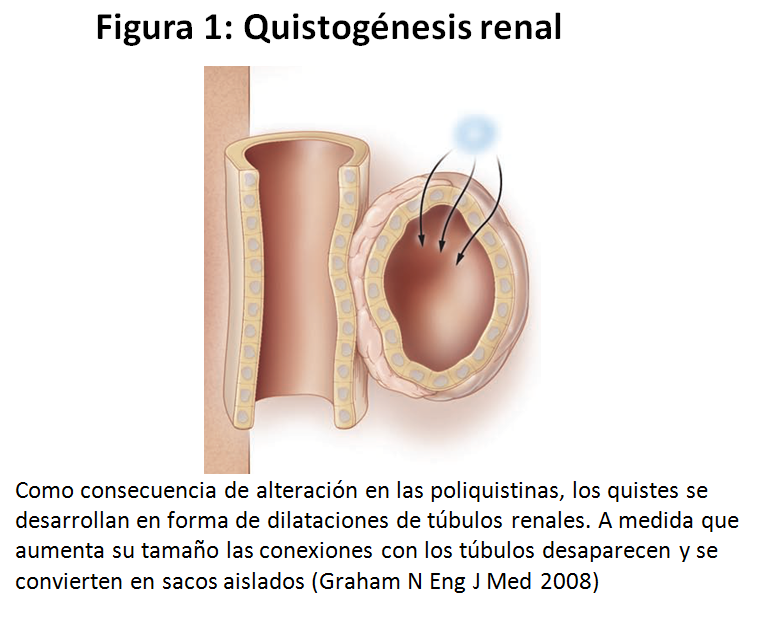
La gran pregunta que permanece hasta hoy, es ¿como de un epitelio tubular renal normal se originan los quistes renales? El desarrollo de los quistes renales involucra la dilatación de los túbulos renales con formación de sacos rellenos de líquido derivado del filtrado glomerular. La expansión de los mismos eventualmente logra la separación de los quistes del túbulo origen (Figura 1). El crecimiento de los nuevos quistes, ya independientes, se debe a la secreción líquida transepitelial y a la proliferación de las células epiteliales quísticas. Esta expansión quística causa cambios parenquimatosos, tales como infiltración de macrófagos, fibrosis y una neovascularización que resultará en fallo renal (Figura 2). Estudios de microdisección precoces en riñones extraidos de pacientes con PQRAD han revelado que los quistes son lesiones focales capaces de afectar cualquier segmento de un túbulo renal normal pero predominan a nivel del túbulo colector. No más del 1-5% de las nefronas desarrollan quistes a pesar de que cada célula de cada túbulo renal porta una mutación germinal PKD1 o PKD2 [11].
MANIFESTACIONES CLÍNICAS DE LA PQRAD
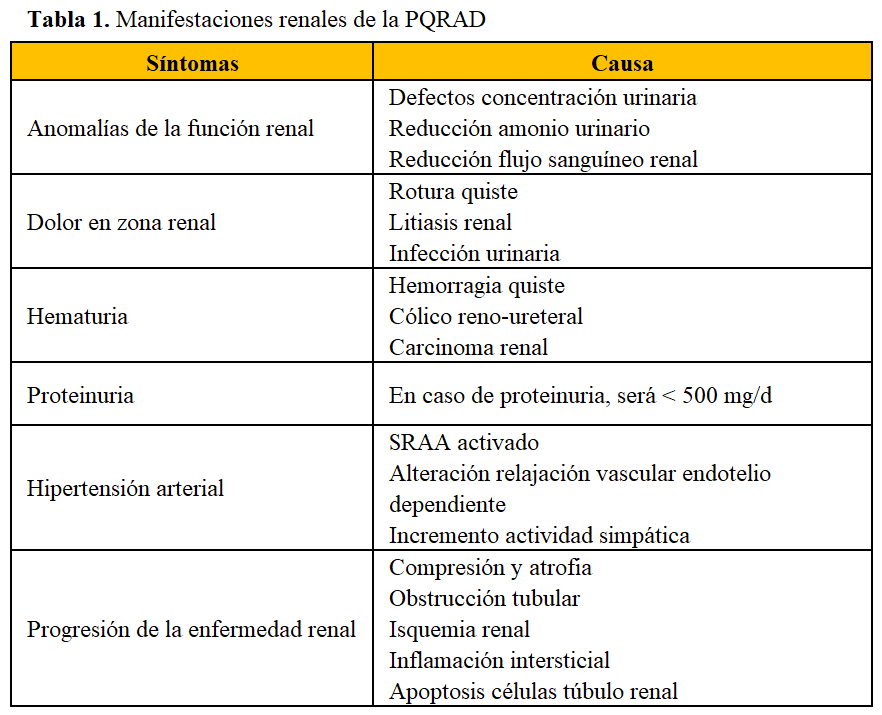
La PQRAD se caracteriza por la formación y crecimiento progresivo de quistes bilaterales y múltiples que llegan a provocar la necesidad de TRS entre los 50-75 años. Los típicos síntomas incluyen malestar o dolor abdominal, molestias lumbares, hematuria macroscópica e infecciones de orina. Las manifestaciones renales se ilustran en la (Tabla 1).
Como se trata de un proceso sistémico se pueden encontrar quistes en el hígado (70%), páncreas (hasta el 10%), bazo, aracnoides, y vesículas seminales. La poliquistosis hepática (PQH) es muy frecuente y aumenta con la edad pero es insólito que se asocie con insuficiencia hepática. Es más frecuente y grave en mujeres demostrándose la dependencia hormonal. Debe diferenciarse de la poliquistosis hepática autosómica dominante que suele cursar sin o con escasos quistes renales y cuya causa es por mutación en diferentes genes [14]. En algunas mujeres la PQH se presenta en forma de hepatomegalia quística dando lugar a problemas derivados de la ocupación de espacio, tales como disconfort, dolor, problemas digestivos y malnutrición. Se ha visto un efecto moderado de los análogos de la somatostatina sobre el volumen hepático [15]. En casos de gran hepatomegalia se hace necesario el trasplante hepático aun funcionando el hígado perfectamente. Se recomienda precaución en la administración de estrógenos exógenos en mujeres debido al riego de empeorar la PQH.
Entre las manifestaciones extrarrenales, las cardiovasculares son las más comunes y a menudo las más peligrosas. La hipertensión arterial ocurre en el 70% de los pacientes, generalmente antes de que ocurra el deterioro de la función renal. Se correlaciona con el aumento del volumen renal, de manera que es poco frecuente en ausencia de nefromegalia. La prevalencia de HTA aumenta con la edad, de manera que a partir de la cuarta o quinta década de la vida es excepcional que los pacientes con PQRAD no presenten HTA. El tratamiento de elección son los inhibidores del sistema renina angiotensina. El objetivo de presión arterial en individuos entre 18 y 50 años con FGe>60, según el estudio HALT es de 110/75 [16] [17]. La enfermedad valvular cardíaca también es frecuente, con descripciones de prolapso mitral en hasta el 25% de los pacientes [18].
La prevalencia de los aneurismas intracraneales se ha cifrado entre el 9-12%, frente a una prevalencia en la población general del 2-3%. La rotura de los mismos es la complicación más seria de la PQRAD, con una mortalidad del 10-20% y una morbilidad del 50%. En aquellos pacientes con antecedentes familiares de aneurismas intracraneales la prevalencia sube al 21-22% [19] [20]. Recientemente, se ha detectado una mayor prevalencia de aneurismas en mujeres post menopaúsicas atribuyendo un papel a los estrógenos en la protección de cara a esta manifestación extrarrenal [21]. La indicación principal de cribaje de presencia de aneurismas cerebrales es la presencia de antecedentes familiares de los mismos. También en caso de cirugía mayor o síntomas relacionados se recomienda descartarlos. El método de elección es la angioresonancia craneal sin contraste.
Estas manifestaciones renales y extrarrenales de la PQRAD también han sido reportadas en niños e incluso intraútero [18]. Pero en general son muy infrecuentes en edad pediátrica y no se recomienda el estudio de estas.
DIAGNÓSTICO DIFERENCIAL DE LA PQRAD
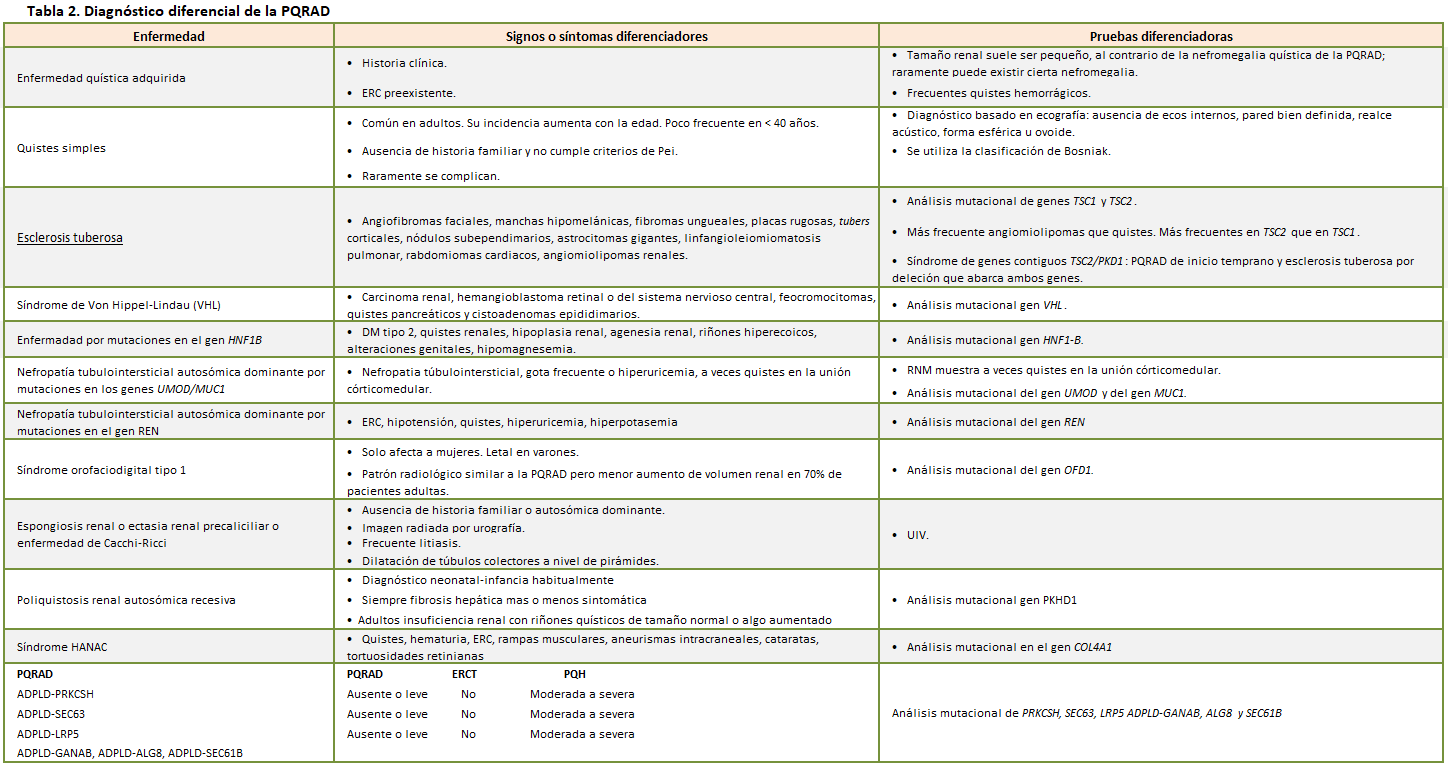
El diagnóstico diferencial con otras patologías quísticas hereditarias o adquiridas se ilustra en la (Tabla 2).
DIAGNÓSTICO POR IMAGEN
Las pruebas de imagen son generalmente las utilizadas para el diagnóstico clínico de la PQRAD.
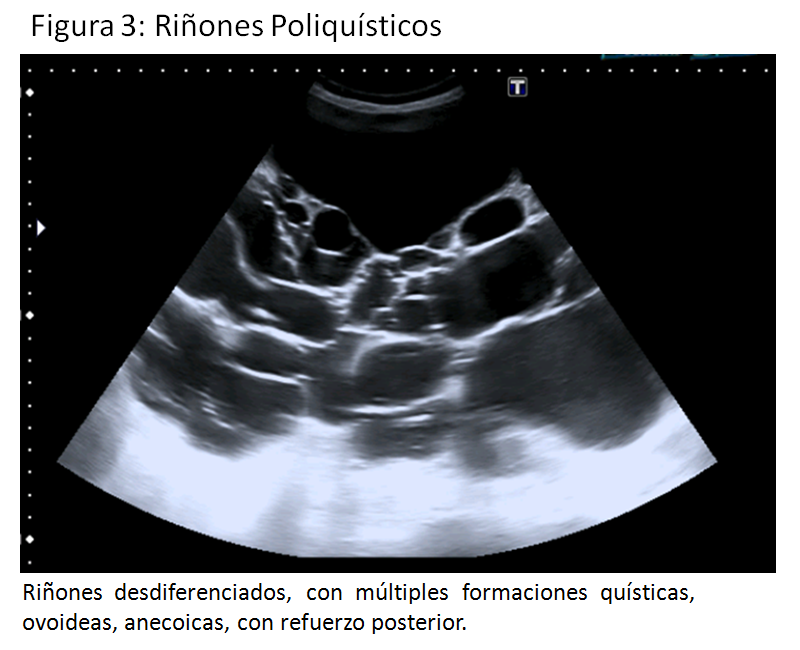
La ecografía es la primera herramienta diagnóstica por su carácter no invasivo. Los criterios diagnósticos universalmente aceptados son los elaborados por Pei Y y cols [22] (Tabla 3) (Figura 3).
La ecografía no es un buen método de medida del volumen renal total (VRT), especialmente si el diámetro renal es mayor de 17 cm.
La Tomografía Axial Computarizada (TC) es más sensible que la ecografía, puede detectar quistes de tan sólo 1-2 mm, así como litiasis pequeñas. Sin embargo, la TC expone a los pacientes a radiación y es más cara, por lo que, aunque permite determinar el VRT, no se usa rutinariamente para el seguimiento de pacientes con PQRAD.
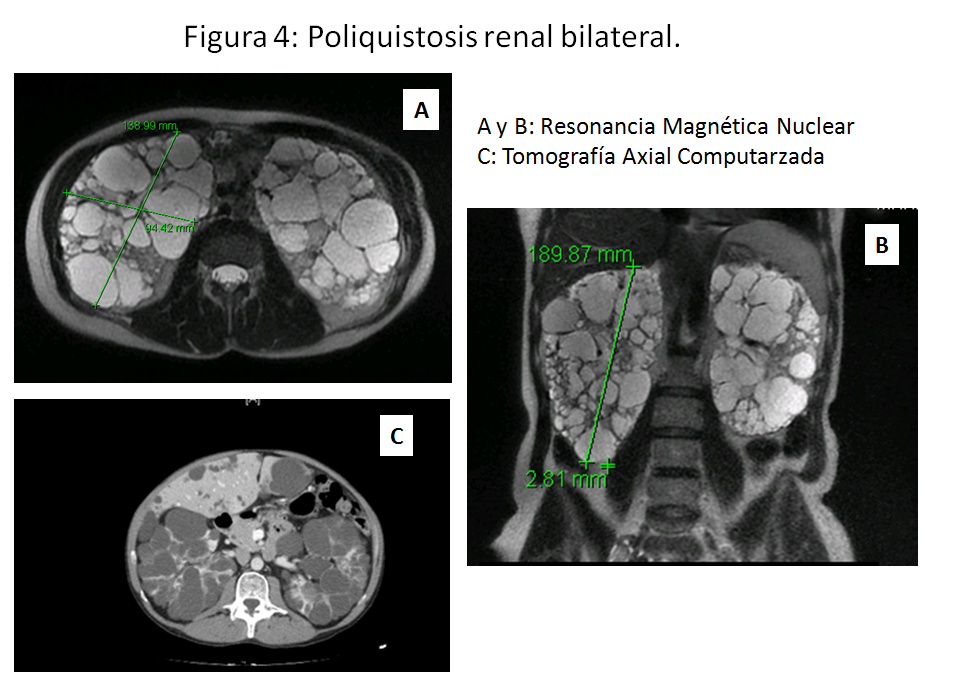
La Resonancia Magnética Nuclear (RMN) La RM es capaz de detectar quistes de menor tamaño que la ecografía por lo que se han elaborado unos criterios diagnósticos basados en RM (Tabla 4). La RM se ha establecido como la técnica de elección para establecer volumen renal total [23] [24] [25] aunque también se puede determinar por TC (Figura 4). Actualmente, se utilizar el VRT como herramienta predictiva mediante la clasificación de la clínica Mayo. Esta herramienta permite estimar el riesgo de rápida progresión, tras introducción de los datos de medición por la fórmula de la elipsoide o por estereología. https://www.mayo.edu/research/documents/pkd-center-adpkd-classification/doc-20094754 [23].
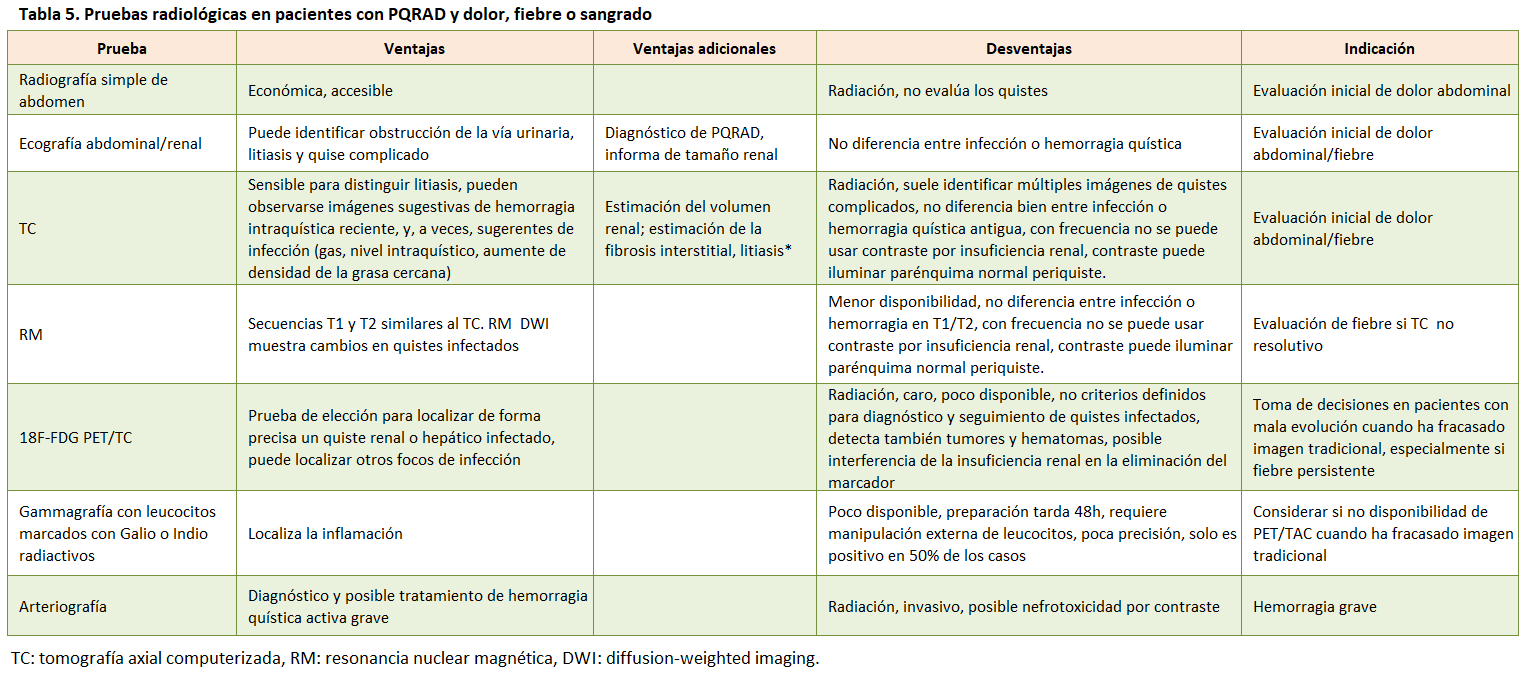
En la (Tabla 5) se sugieren las pruebas de imagen a realizar en pacientes con dolor, fiebre o sangrado.
DIAGNÓSTICO GENÉTICO
Idealmente se debería realizar siempre pero debido al coste y volumen de pacientes se aconseja restringirlo a las indicaciones abajo mencionadas. El diagnóstico que se realiza actualmente es la identificación de la mutación por técnicas de secuenciación masiva (panel de genes preferentemente o exoma con una peor cobertura de ciertas regiones de PKD1).
Brevemente, las indicaciones básicas del diagnóstico genético son las siguientes (GUIAS PQRAD 2020):
1. El diagnóstico genético de rutina de la PQRAD no está recomendado, si el diagnóstico clínico y por imagen es claro (sin grado de recomendación).
2. Las situaciones específicas en las que el diagnóstico genético de PQRAD está indicado son:
Donante vivo potencial de una familia con PQRAD
Pacientes sin antecedentes familiares de PQRAD, con diagnóstico clínico incierto, debut muy temprano de la enfermedad, diagnóstico genético preimplantacional y síntomas urológicos o HTA antes de los 35 años para definición del riesgo de rápida progresión e indicación de tratamiento específico.
3. El análisis mutacional de PKD1, PKD2, GANAB y DNAJB es actualmente el método de diagnóstico genético de elección en la PQRAD.
4. Es muy recomendable la secuenciación masiva de PKD1, PKD2, GANAB y DNAJB junto con un amplio panel de otros genes también asociados a enfermedades renales quísticas en los pacientes que presentan fenotipos atípicos.
ASESORAMIENTO GENÉTICO
Todo paciente con PQRAD tiene derecho a recibir asesoramiento genético. Debe recibir información sobre las opciones reproductivas que tiene: aceptar el 50% de riesgo de tener un hijo con la enfermedad, inseminación de donante u ovodonación, diagnóstico prenatal o diagnóstico genético preimplantacional.
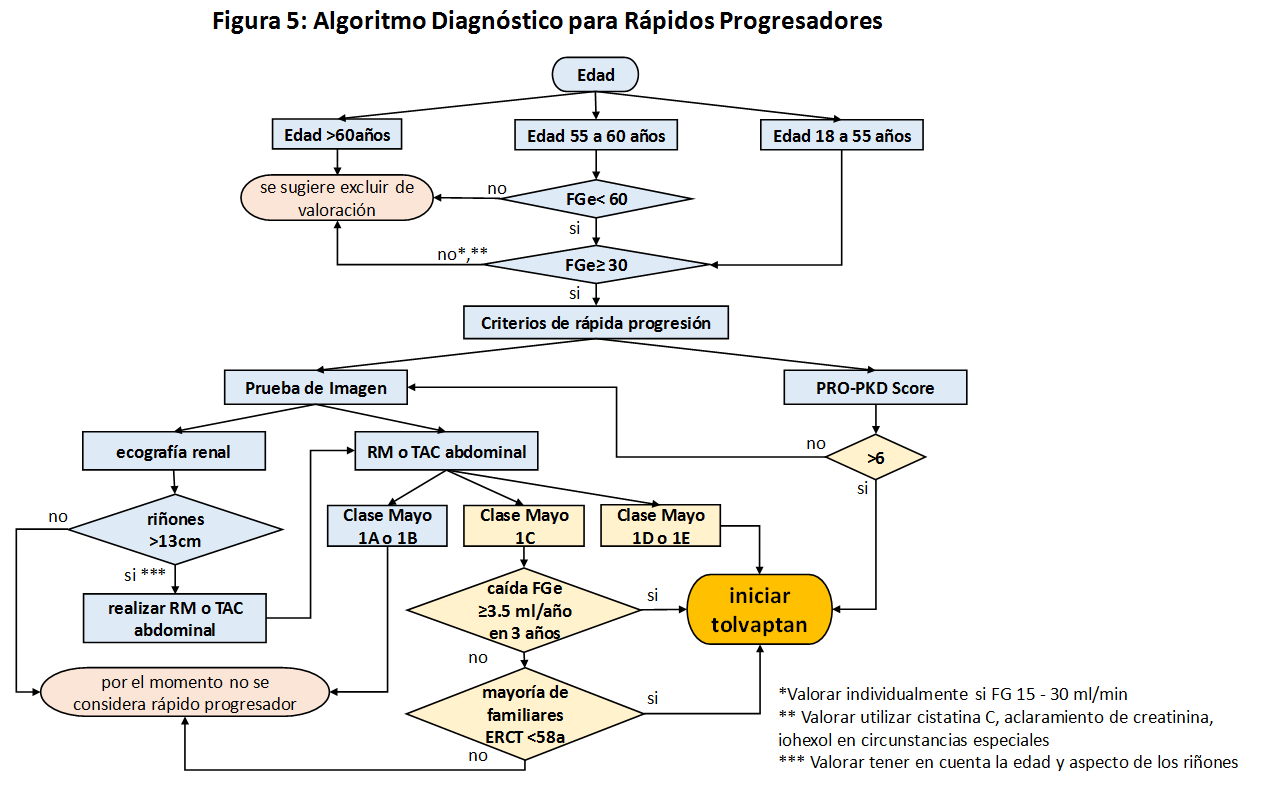
CRITERIOS DE RÁPIDA PROGRESIÓN
Los criterios directos de rápida progresión se basan fundamentalmente en las modificaciones del filtrado glomerular estimado y en las tasas de crecimiento renal [26] [27] [28] [29] [30]. Pero este concepto está en constante modificación por lo que se recomienda seguir las guías clínicas españolas de PQRAD (GUIAS PQRAD 2020).imagen del algoritmo
EMBARAZO Y PQRAD
El embarazo no se recomienda en mujeres con PQRAD y ERC estadios 3-5, excluyendo las pacientes trasplantadas. Las gestantes hipertensas con PQRAD deberían ser controladas como embarazo de alto riesgo pues tiene un mayor riesgo de preeclamsia. Las mujeres con PQRAD embarazadas, normotensas y con función renal normal no precisan un seguimiento especial, aunque debe prestarse especial atención al control de la tensión arterial. Se recomienda suspender IECA/ARAII preconcepcional debido a los riesgos de teratogenicidad. Así mismo se recomienda suspender Tolvaptan durante el embarazo y usar contracepción durante su uso.
Se desaconseja el proceso de fecundación in vitro, debido al tratamiento hormonal inherente al mismo, en mujeres con poliquistosis hepática importante.
CARCINOMA RENAL
La prevalecía de carcinoma renal no está aumentado en la PQRAD. Pero ante una hematuria macroscópica que dure más de una semana o si el episodio inicial se produce después de los 50 años, se debe realizar una prueba de imagen para descartarlo.
TRATAMIENTO
Tratamiento renal sustitutivo
Los pacientes con mutación en PKD1 suelen requerir TRS en la sexta década de la vida mientras que los que tienen la mutación en PKD2 lo hacen en la octava década de promedio. La diálisis peritoneal y la hemodiálisis son modalidades de TRS válidas para pacientes con PQRAD. El trasplante renal es la forma recomendada de TRS. El trasplante de donante vivo es una opción válida a considerar por su mejor supervivencia renal. Siempre debe descartarse la enfermedad en un donante emparentado.
La nefrectomía nativa electiva debe considerarse antes del trasplante renal cuando el tamaño del riñón impide la colocación adecuada del injerto y en casos con hemorragia o infección persistente.
Tratamiento Medidas Generales
Se deben implementar cambios en el estilo de vida: mantener un peso adecuado, realizar ejercicio aeróbico de forma regular y limitar el consumo de sal a un máximo de 5-6 g/d.
Se recomienda realizar automedida de la presión arterial o monitorización ambulatoria de la presión arterial para conseguir un diagnóstico precoz de HTA.
El tratamiento farmacológico antihipertensivo debería incluir un inhibidor del SRAA como primera opción, en base a sus teóricas ventajas [31].
Ingesta líquida: aunque persiste como objeto de debate, la ingesta libre de agua debe ser recomendada (siempre que no tenga otras contraindicaciones), no solo por los beneficios en la supresión de vasopresina, sino por la profilaxis de la nefrolitiasis [32] [33].
Tolvaptán
El tolvaptán es el único fármaco aprobado para el tratamiento de la PQRAD. Los ensayos clínicos Tempo 3:4 y REPRISE permitieron la aprobación del fármaco [34] [35]. El tolvaptán debe tomarse dos veces al día. La dosis matutina debe ser al menos 30 minutos antes del desayuno y la segunda dosis 8 horas después. El tolvaptán reduce la caída del filtrado glomerular y reduce la tasa de crecimiento renal, retrasando varios años la necesidad de TRS.
En la (Figura 5) se muestra el algoritmo de definición de rápida progresión según el documento de consenso de PQRAD de la S.E.N.
Se debe realizar una cuidadosa selección de aquellos pacientes candidatos a iniciar el tratamiento con tolvaptán, valorando contraindicaciones, efectos adversos y estilo de vida del paciente, por lo que la decisión se debe tomar conjuntamente.
Entre sus efectos adversos, el más frecuente es la acuaresis que presentan los pacientes (65-95%), por lo que se debe mantener una ingesta líquida en consonancia [36]. Existe una especial llamada de control a la hepatotoxicidad idiosincrática, poco frecuente, pero con posibilidad de daño hepático grave. Con el fin de controlar este efecto, se deben monitorizar las transaminasas mensualmente durante los primeros 18 meses de tratamiento y cada 3 meses a partir de los 18 meses. Algunos estudios han comunicado un efecto sostenido y acumulativo del tolvaptán hasta once años después [37]. El impacto del tolvaptán sobre la pérdida del filtrado glomerular es, en términos porcentuales, similar al del bloqueo de SRA en otras nefropatías.
En la actualidad hay varios ensayos clínicos en marcha con nuevas moléculas para la PQRAD. Los ensayos de venglustat y lixivaptan se ha detenido por ineficacia y toxicidad hepática respectivamente.