Poliquistosis Renal Autosómico Recesiva
INTRODUCCIÓN
La poliquistosis renal autosómica recesiva (PQRAR) es una enfermedad hereditaria que forma parte del grupo de las ciliopatías o alteraciones del cilio primario. Se produce fundamentalmente por alteraciones del gen PKHD1, que codifica la proteína fibroquistina o poliductina, y en algunos casos por alteraciones en el gen DZIP1L. Ambos genes codifican proteínas implicadas en el funcionamiento del cilio primario. La PQRAR es una enfermedad con un espectro fenotípico amplio, que afecta fundamentalmente al riñón y al hígado, y que puede tener manifestaciones severas desde el periodo neonatal y una morbimortalidad elevada. Su incidencia aproximada a nivel poblacional es de 1/20.000 recién nacidos vivos. Se hereda de forma autosómica recesiva, siendo ambos padres generalmente portadores sanos de una mutación en este gen.
MANIFESTACIONES CLÍNICAS Y COMPLICACIONES ASOCIADAS A LA PQRAR
Periodo perinatal
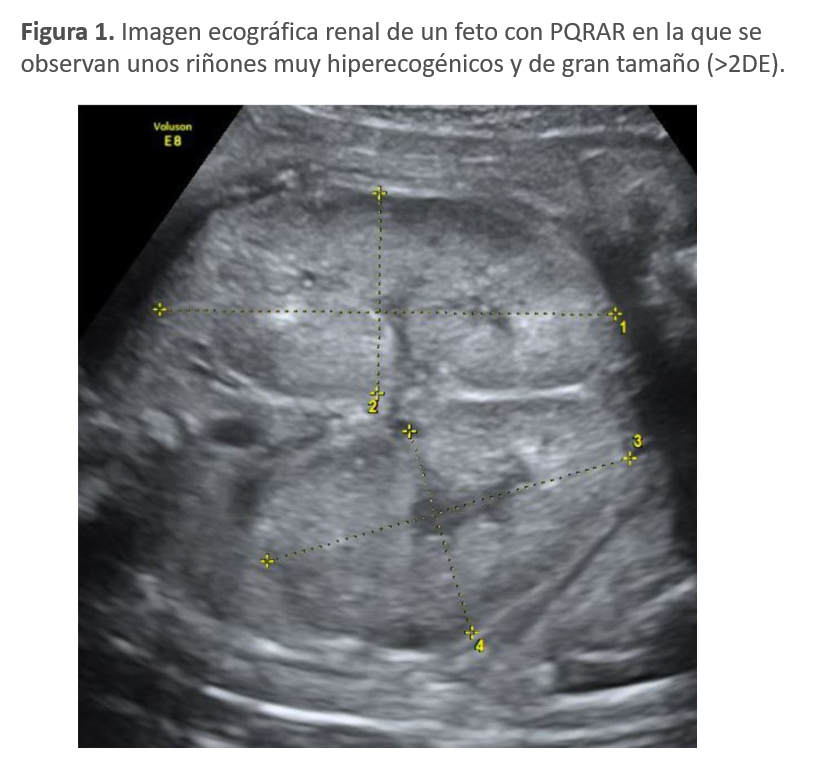
En los países en los que se realiza de forma reglada un control ecográfico de la gestación, la PQRAR puede sospecharse desde la ecografía del segundo trimestre de gestación, cuando el desarrollo renal es más evidente y el líquido amniótico refleja en gran medida la producción de orina fetal. Habitualmente se observa la presencia de riñones de gran tamaño (> +2DE para la edad del feto), con marcada hiperecogenicidad como reflejo de la displasia renal severa con microquistes (Figura 1) (Figura 2) (Figura 3). Es frecuente el desarrollo de oligoamnios o anamnios como reflejo de la escasa producción urinaria fetal, que puede a su vez complicar el embarazo. De hecho, la mayoría de las muertes fetales en este periodo o en el periodo postnatal inmediato se deben al desarrollo de una hipoplasia pulmonar severa debido a la ausencia del líquido amniótico necesario para el desarrollo embriológico normal de los pulmones [1].
Afectación renal
Aunque en los estudios clínicos observacionales en pacientes con PQRAR existe una variabilidad fenotípica grande, la presencia de enfermedad renal crónica (ERC) es frecuente ya desde primeros años de la vida. El desarrollo de ERC terminal ocurre en las primeras dos décadas de la vida en torno a un 50% de los pacientes [1][2][3].
Otras manifestaciones clínicas relevantes relacionadas con la afectación renal son la hiponatremia y la hipertensión arterial. La hiponatremia sucede en alrededor del 25% de los pacientes [1], y puede deberse a una pérdida tubular aumentada de sodio o a una sobrecarga hídrica. La hipertensión arterial (HTA) es otra de las manifestaciones que acompañan o preceden a la ERC en más de la mitad de los pacientes [1][2]. El riesgo de desarrollo de infecciones urinarias está también muy aumentado (alrededor del 20%) [1].
Con la generalización del diagnóstico genético, se han descrito cuadros de PQRAR más leves en adultos que presentan riñones de tamaño normal o levemente aumentado, hiperecogenicos o con pequeños quistes, y un grado variable de afectación hepática. A nivel renal, puede diagnosticarse como un síndrome de Cacchi-Ricci, o simplemente presentar litiasis por la ectasia de los túbulos colectores En algunos de estos casos la afectación es principalmente hepática, secundaria a una fibrosis congénita, con una afectación renal mínima [4].
Afectación hepática
A nivel hepático los pacientes con PQRAR generalmente desarrollan de forma variable una fibrosis hepática congénita, que puede resultar en la aparición de hipertensión portal y riesgo aumentado de colangitis. La hipertensión portal da lugar a esplenomegalia con hiperesplenismo y al desarrollo de varices esofágicas. Las citopenias (anemia, leucopenia y trombopenia) son frecuentes en estos pacientes debido al secuestro esplénico, aunque esto no les confiere mayor susceptibilidad a infecciones (no son pacientes inmunodeprimidos). Además, en el contexto de cuadros infecciosos, estas citopenias tienden a empeorar de forma transitoria. Existe un riesgo teórico de rotura esplénica en los pacientes con esplenomegalia masiva por lo que algunos expertos abogan por limitar los deportes de contacto en estos casos. A pesar de todo, la esplenectomía no es un tratamiento en principio indicado en la PQRAR [5].
El desarrollo de varices esofágicas en los pacientes con hipertensión portal puede dar lugar a hemorragias intestinales graves. Se debe evaluar mediante endoscopia de forma periódica [6].
Los episodios de colangitis aguda son frecuentes en los pacientes con afectación biliar y a menudo difícil de diagnosticar. Deben sospecharse ante todo cuadro de fiebre sin foco, descartados otros procesos infecciosos. La tríada clínica de fiebre, ictericia y dolor en hipocondrio derecho, propio de colangitis aguda, es infrecuente en niños. Aunque no está indicado el uso de antibióticos profilácticos para estas infecciones, se recomienda mantener una profilaxis durante 6-12 meses tras un episodio de colangitis [5]. Por otro lado, la presencia de episodios de colangitis de repetición es una de las indicaciones de trasplante hepático.
Otras complicaciones asociadas
A nivel neurológico, es posible que los niños con PQRAR tengan un mayor riesgo de anomalías del desarrollo psicomotor y del comportamiento, en relación a la presencia de HTA severa y ERC de forma precoz en momentos críticos para el desarrollo neurológico [7]. Sin embargo, en los pacientes con afectación más moderada probablemente el riesgo de anomalías neurológicas sea similar al de aquellos con HTA y/o ERC por otras causas [8].
Por otro lado, se han descrito secuelas neurológicas graves asociadas a la hipotensión refractaria que se puede desarrollar en los casos con fenotipos muy severos en los que se realiza una nefrectomía bilateral precoz (primeros 3 meses de vida) con objeto de mejorar la función respiratoria, optimizar la nutrición o permitir una depuración extrarrenal mediante diálisis peritoneal [9].
DIAGNÓSTICO
Diagnóstico clínico
La presencia de riñones aumentados de tamaño con pobre diferenciación corticomedular y aspecto hiperecogénico de forma bilateral, junto con la presencia de enfermedad hepática constituye el principal pilar para el diagnóstico. El diagnóstico de sospecha se realiza, en la mayoría de los casos, en la ecografía prenatal a partir del segundo trimestre con el hallazgo clásico de riñones grandes (>+2DE) e hiperecogénicos (Figura 1) con o sin disminución del líquido amniótico en función de la gravedad de la afectación renal. La ausencia de patología quística en la ecografía renal de los progenitores apoya el diagnóstico de PQRAR frente a formas graves de inicio precoz de poliquistosis renal autosómica dominante, a veces indistinguibles ecográficamente de la PQRAR.
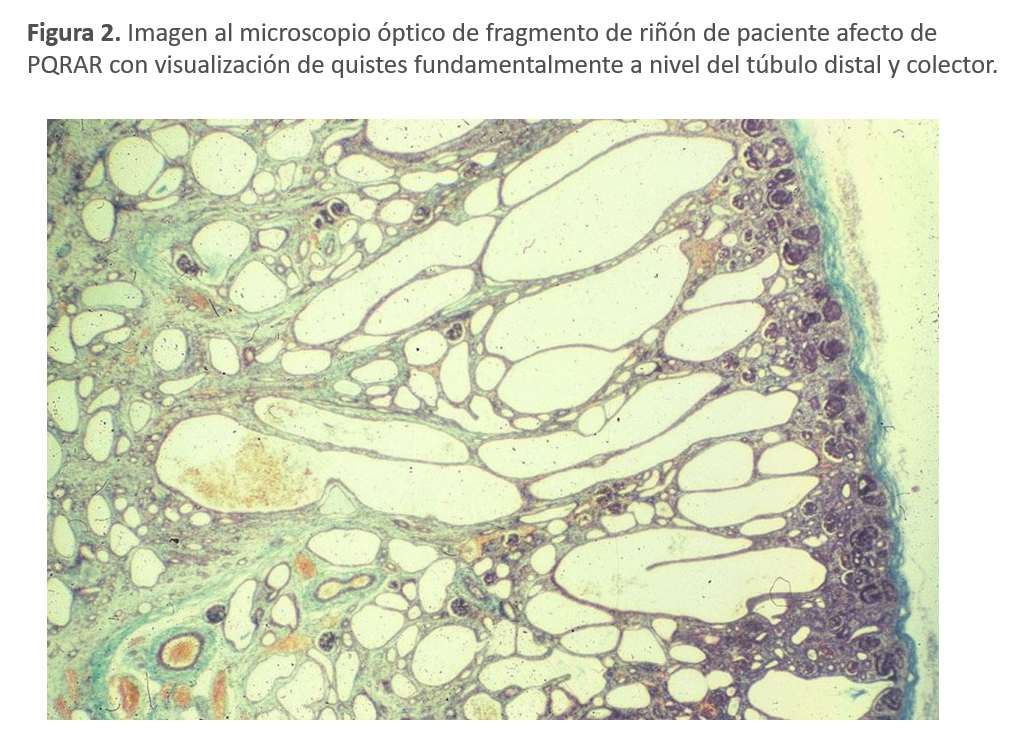
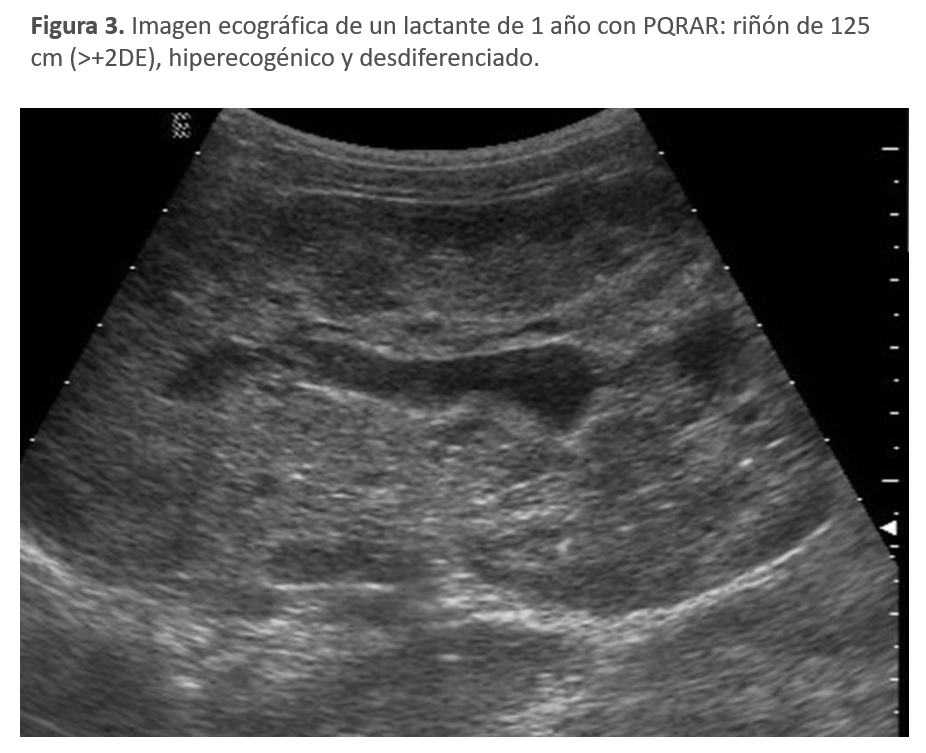
Los hallazgos clásicos en las necropsias de los fetos fallecidos y en las biopsias renales (Figura 2) son el desarrollo precoz de múltiples quistes microscópicos a nivel del túbulo distal y colector y una displasia renal progresiva. A nivel ecográfico, el aspecto hiperecogénico y desdiferenciado refleja la displasia mencionada junto a la presencia de microquistes tubulares (Figura 3). En los pacientes que sobreviven a la etapa perinatal, con el paso de los años la relación del tamaño renal respecto al corporal disminuye, no siendo tan llamativa como en los primeros años y a menudo se desarrollan quistes visibles [3].
La afectación hepática secundaria a la fibrosis hepática congénita en la PQRAR a menudo es sutil, con mínima alteración en las pruebas de función hepática (transaminasas y coagulación) y de imagen. La presencia de esplenomegalia a la exploración física y trombocitopenia (<150.000/mcl) junto a la presencia de varices esofago-gástricas o ascitis debe levantar la sospecha de hipertensión portal. La colangioresonancia puede ser útil para la valoración de la vía biliar en los casos en los que no se aprecian alteraciones a nivel ecográfico. Asimismo, debe mantenerse en estos pacientes un elevado índice de sospecha de colangitis aguda ante episodios de fiebre sin foco, a pesar de la normalidad de las pruebas de función hepática.
Diagnóstico genético
El análisis molecular del gen PKHD1 confirma en la mayoría de los casos el diagnóstico clínico de PQRAR con el hallazgo de dos variantes patogénicas, y es el patrón oro en el diagnóstico de esta entidad. Por ello, siempre que sea posible se debe realizar la confirmación molecular en los pacientes con sospecha clínica de PQRAR. El gen PKHD1 es un gen grande y difícil de estudiar, con multitud de mutaciones descritas a lo largo de todo el gen. El rendimiento diagnóstico ante cuadros clínicamente compatibles con PQRAR es del 80-85% [10]. Además, recientemente se han descrito en un grupo pequeño de pacientes variantes patogénicas en el gen DZIP1L como causantes de PQRAR. Este gen codifica una proteína implicada también en el funcionamiento del cilio primario y se han descrito variantes en homocigosis en varias familias consanguíneas que no presentaban alteraciones en el gen PKHD1 [11].
Actualmente el estudio molecular mediante secuenciación masiva ha facilitado el estudio de PKHD1 y el diagnóstico diferencial con otras entidades similares que se mencionan en el próximo apartado [12]. La confirmación molecular de esta patología permite ofrecer un asesoramiento genético adecuado a la familia y la posibilidad de seleccionar donantes adecuados en la familia en el caso de realizar un trasplante renal de donante vivo.
Diagnóstico diferencial
Existen fenocopias de la PQRAR, es decir, entidades que pueden presentarse de forma muy similar a la PQRAR (grandes riñones hiperecogénicos, oligoamnios, afectación renal precoz o afectación hepática) pero que se deben a mutaciones en otros genes. Así, la poliquistosis renal autosómica dominante (PQRAD) se presenta en un 2% de los casos con un fenotipo precoz y grave, muy similar a la PQRAR [13]. Muchos de estos casos se deben a la herencia combinada de una variante patogénica en los genes PKD1 o PKD2 y otra variante hipomorfa en estos o en otros genes relacionados (PKHD1, HNF1B) [14].
Por otro lado, las mutaciones en el gen HNF1B, implicado en el desarrollo embrionario de riñón y páncreas, puede dar lugar a displasias renales quísticas muy severas en la etapa prenatal, indistinguibles de la afectación renal en la PQRAR [15].
Otras ciliopatías como la nefronoptisis, el síndrome de Bardet-Biedl y el síndrome de Joubert pueden dar lugar a cuadros clínicos similares a nivel renal, aunque generalmente con afectación de otros órganos [16].
Por último, algunas anomalías cromosómicas, así como la infección congénita por CMV puede presentarse como riñones hiperecogénicos con o sin oligohidramnios en el periodo prenatal.
TRATAMIENTO
No existe un tratamiento específico para los pacientes con PQRAR. Sin embargo, actualmente se está llevando a cabo un ensayo clínico en fase 3 para evaluar la eficacia y seguridad del tolvaptán en el tratamiento de pacientes pediátricos con PQRAR [17]. El tolvaptán es un antagonista de la vasopresina y actúa inhibiendo el efecto de esta hormona en el crecimiento de los quistes renales. Este tratamiento ha mostrado eficacia en la disminución del crecimiento de los quistes renales y la progresión de la enfermedad renal en pacientes con PQRAD [18].
A nivel respiratorio, al nacimiento un porcentaje importante de estos niños requerirá soporte ventilatorio inmediato por la hipoplasia pulmonar secundaria a la disminución del líquido amniótico. Posteriormente, sobre todo durante los primeros años de vida, algunos de estos pacientes pueden beneficiarse de un soporte respiratorio domiciliario con BIPAP o CPAP nocturno para mejorar los parámetros respiratorios, especialmente durante los episodios de sobreinfección respiratoria.
A nivel renal, en los lactantes con PQRAR que desarrollan un fallo renal y que requieren iniciar tratamiento renal sustitutivo se recomienda el uso de la diálisis peritoneal [5]. La realización del trasplante renal está indicada cuando se alcanza un peso mínimo y unas condiciones clínicas estables. La supervivencia a medio y largo plazo del injerto y las complicaciones asociadas al trasplante renal son similares a otras causas de enfermedad renal terminal en la infancia. Algunos estudios han evaluado el beneficio de la nefrectomía uni o bilateral en estos pacientes para el control de la HTA o la patología respiratoria, aunque no parece que el limitado beneficio supere a los riesgos de eliminar la diuresis residual y del procedimiento quirúrgico en pacientes con patología grave y afectación multiorgánica [5] [9].
La nutrición en los niños con PQRAR es uno de los puntos más conflictivos del tratamiento, no sólo por la anorexia inherente a la ERC, sino por la ocupación importante de espacio abdominal que suponen los grandes riñones poliquísticos. Para asegurar una nutrición adecuada se precisa frecuentemente la colocación de un tubo de gastrostomía, sobre todo en los casos con afectación renal precoz y grave. A pesar de que la PQRAR con fibrosis hepática congénita ha sido considerada clásicamente una contraindicación relativa para la realización de una gastrostomía, un estudio europeo reciente ha demostrado una tasa baja de complicaciones respecto al beneficio de una nutrición óptima en los pacientes pediátricos con PQRAR [19].
Para el abordaje de la HTA se recomienda el uso de inhibidores de la enzima convertidora de angiotensiona (IECA) o antagonistas del receptor de la angiotensina (ARA). Como extrapolación a otras patologías con evolución a ERC en la infancia, parece que mantener la TA por debajo de un percentil 50 podría enlentecer la progresión a ERC terminal [20].
La hiponatremia que frecuentemente asocian estos pacientes únicamente debe tratarse con suplementos de sodio en los casos con poliuria secundaria a un déficit de concentración urinaria y tendencia a la hipovolemia. Si hay oliguria o tendencia a la hipervolemia, el abordaje de la hiponatremia debe hacerse con restricción de líquido. Se puede tolerar una hiponatremia relativa en favor de no empeorar la HTA si se aumenta el aporte de sodio.
Como método de prevención de la trasmisión de la enfermedad en las parejas con un hijo previo afecto se puede realizar una terapia de reproducción asistida con un diagnóstico preimplantacional y selección embrionaria. El estudio genético y el conocimiento previo de la mutación y su causalidad en la enfermedad del primer hijo son imprescindibles.
PRONÓSTICO
Mortalidad perinatal
Es difícil estimar la supervivencia global real de los fetos afectos de PQRAR porque muchos de los embarazos en los que se sospecha una PQRAR con oligoamnios precoz y progresivo, y grandes riñones hiperecogénicos, son interrumpidos. La tasa de mortalidad perinatal en estudios previos se estima en torno a un 30-50% [2][21][22] y está fundamentalmente relacionada con la insuficiencia respiratoria secundaria a la hipoplasia pulmonar severa.
Riesgo de enfermedad renal crónica terminal y de tratamiento sustitutivo
Generalmente, los pacientes que sobreviven al periodo neonatal tienen tasas de supervivencia aceptables, aunque la mayoría presentan sintomatología de forma precoz y muchos precisarán métodos de depuración extrarrenal en los primeros años de la vida. En un estudio de 2018 con cerca de 400 pacientes con PQRAR se reporta la necesidad de diálisis durante el primer año de vida en alrededor del 10% de los pacientes, siendo los factores de riesgo asociados los siguientes: oligoamnios o anamnios, el tamaño renal aumentado prenatal, la baja puntuación Apgar al nacer y la necesidad de soporte ventilatorio al nacer [23].
A medio y largo plazo, la necesidad de tratamiento renal sustitutivo y diálisis es variable. En los estudios con un número elevado de pacientes se ha reportado ERC terminal en las primeras dos décadas de la vida en aproximadamente la mitad de los pacientes [1][2][3]. En el 2025, se ha reportado en un estudio con 658 pacientes con diagnóstico de PQRAR procedentes del registro internacional ARegPKD, una probabilidad de fallo renal a la edad de 20 años de 50.1%, con una pérdida de función renal media anual de 1.3 ml/min/1.73m2 durante la infancia y la adolescencia [24]. En este mismo trabajo se describen 5 variables clínicas de fácil acceso que predicen a los 2 meses de vida aquellos pacientes que con un riesgo relativo mayor de fallo renal precoz: edad gestacional al diagnóstico de oligo-anamnios, edad gestacional al nacimiento, genotipo, creatinina sérica y presencia de hipertensión arterial [24].
En estos estudios se debe tener en cuenta que no se incluyen los pacientes que fallecen prenatalmente o cuyo embarazo se interrumpe, así como aquellos pacientes que no sobreviven al periodo perinatal.
Correlación genotipo-fenotipo
Los casos más graves de PQRAR generalmente se relacionan con la presencia de dos mutaciones truncantes en el gen PKHD1 [10][22]. La mayoría de los pacientes que sobreviven al periodo neonatal generalmente son portadores de al menos una mutación tipo missense, aunque esto no se cumple en todos los casos [25].
Asesoramiento genético
Los padres con un hijo afecto de PQRAR son habitualmente portadores cada uno de una mutación en el gen PKHD1. Estas parejas tienen un riesgo de un 25% de tener un hijo afecto por cada embarazo. Sin embargo, a pesar de la gravedad habitual de esta patología, existe una variabilidad significativa en la presentación clínica en un 15-20% de los hermanos estudiados portadores de la misma mutación [2] [26].