Síndrome de Alport y Hematurias Familiares
Palabras clave
Nefropatía por MYH9, Síndrome HANAC
Introducción
El síndrome de Alport (SA) es la segunda enfermedad renal hereditaria más frecuente después de la poliquistosis renal autosómica dominante. En los últimos años se han publicado diferentes opiniones sobre la nomenclatura de las hematurias familiares, quedando obsoleto el término de “hematuria familiar benigna”, ya que se ha visto que algunos casos evolucionan a terapia renal sustitutiva (TRS) eliminando así el carácter de "benigno". Durante mucho tiempo también se ha utilizado el término “Enfermedad de la membrana basal delgada”, siendo un concepto histológico que no contempla la genética ni la clínica y además existen otras entidades que pueden presentarlo. El Síndrome de Alport se produce por variantes patogénicas en los genes del colágeno tipo IV (COL4A3, COL4A4 y COL4A5) mediante los 3 patrones de herencia mendelianos. La presentación clínica es muy variable: desde pacientes asintomáticos o con microhematuria, a hipoacusia neurosensorial bilateral, afectación ocular, proteinuria y evolución a TRS [1][2][3].
Síndrome de Alport con herencia ligada al cromosoma X (SALX)
Hace años era considerada la forma más frecuente por ser la de presentación clásica con afectación renal a edades tempranas, hipoacusia neurosensorial y alteraciones oculares. Se produce por variantes patogénicas en el gen COL4A5. Los pacientes varones con SALX, suelen presentar hipoacusia y evolucionar a TRS en la segunda o tercera década de la vida. Mientras que alrededor del 12 % de las mujeres con SALX pueden evolucionar a TRS antes de los 40 años, aumentando al 30 y 40 % a los 60 y 80 años respectivamente [4][5][6]. Los varones afectos no transmiten la enfermedad a sus hijos varones, en cambio tienen una probabilidad del 100% de transmitirlo a sus hijas. Las mujeres con SALX tienen un 50% de tener descendencia afectada.
Síndrome de Alport con herencia autosómica recesiva (SAAR)
Los pacientes con SAAR, tienen 2 variantes patogénicas heredadas de ambos progenitores en los genes COL4A3 o COL4A4. Los pacientes con SAAR, tanto hombres como mujeres, suelen desarrollar hipoacusia y evolucionar a TRS antes de los 30 años. Los progenitores tienen un patrón de herencia autosómico dominante y clínicamente pueden estar asintomáticos, presentar microhematuria o llegar a presentar TRS en edades habitualmente avanzadas [7]. Actualmente, para los expertos no está claro si estos pacientes con una variante de COL4A3 o COL4A4 estando asintomáticos, se podría considerar como Alport Autosómico dominante o solamente sería un factor de riesgo para enfermedad renal crónica, dado la alta frecuencia en estas variantes en la población general. [8]
Síndrome de Alport con herencia autosómica dominante (SAAD)
Los pacientes con SAAD tienen una variante patogénica en el gen COL4A3 o COL4A4 y la presentación clínica es tan variada como microhematuria solamente o evolucionar a TRS en edades avanzadas, generalmente después de los 40 años. La afectación ocular y auditiva es mucho menos frecuente que en el SALX y SAAR [9][10][11][12].
En 2021, se ha publicado una cohorte de 252 pacientes con diagnóstico de SAAD, en donde se ha observado que la edad de supervivencia renal era de 67 años, las afectaciones extrarrenales eran muy raras y destacando que los pacientes que no tenían proteinuria, ninguno evolucionaba a enfermedad renal crónica [13].
Recientemente, se ha publicado un estudio sobre la prevalencia de las variantes en COL4A3 y COL4A4 en la población general sin enfermedad renal conocida, destacando que 1/106 individuos puede tener una de estas variantes. Cabe destacar que la patogenicidad de estas variantes genéticas debe ajustarse a la penetrancia de la enfermedad y a las variantes individuales. La penetrancia de la enfermedad además puede depender de otros factores genéticos y ambientales [8]. Por lo que denominar Síndrome de Alport autosómico dominante a todos los individuos que tengan una de estas variantes en COL4A3 o COL4A4, no está muy claro, ya que podría tratarse solamente de un factor de riesgo sin poder explicar aún porqué un porcentaje tan bajo de esos individuos evolucionan a TRS.
Alport con herencia digénica
En los últimos años se han descritos casos de SA con herencia digénica, es decir, con variantes patogénicas en 2 genes del colágeno tipo IV al mismo tiempo, que podría justificar una presentación clínica más grave, pero esta premisa no se cumple en todas las series publicadas [13][14][15][16][17][18].
El síndrome de Alport con herencia digénica se debe a una variante patogénica en COL4A5 más uno en COL4A3 o COL4A4 o por una variante patogénica en COL4A3 más una en COL4A4. Estas se considerarán por separado debido a sus frecuencias de población, a los modos de herencia y porque sus consecuencias clínicas y moleculares son diferentes. Para variantes digénica que afectan COL4A5 más COL4A3 o COL4A4, muchas de las características dependen de si la variante COL4A5 afecta a un varón o mujer, y en todos los pacientes, la variante de gravedad también contribuye al fenotipo [7] [18].
Síndrome de genes contiguos asociado a Síndrome de Alport ligado a X.
El síndrome de “genes contiguos” es causado por una deleción del extremo 5’ del gen COL4A5 que incluye al gen COL4A6. Se caracteriza por presentar leiomiomatosis genital, uterina y esofágica asociada a SALX [19][20][21].
Diagnóstico
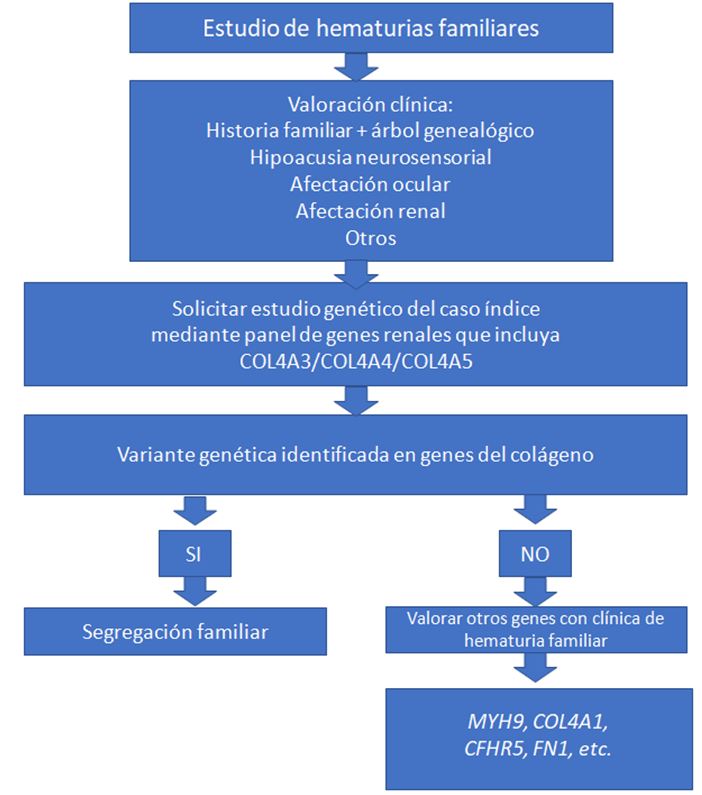
El algoritmo diagnóstico se ilustra en la (Figura 1)
Estudio genético
El diagnóstico de certeza es el estudio genético, disminuyendo el riesgo de complicaciones del diagnóstico por biopsia renal. El caso índice se suele estudiar mediante panel de genes o exoma y después se realiza segregación familiar, es decir, se comprueba la variante patogénica encontrada en el resto de los familiares disponibles [3] [22] [23] [24].
Una vez identificada la variante patogénica, se debe realizar consejo genético. Aquellos pacientes con deseo gestacional se les debe ofrecer la posibilidad de diagnóstico prenatal y preimplantacional. Está indicado el estudio genético en todos los casos de sospecha de SA.
Biopsia renal y de piel
Actualmente no se realiza de rutina la biopsia renal ni de piel para el diagnóstico. Histológicamente, la biopsia renal se caracteriza por presentar al microscopio electrónico adelgazamiento de la membrana basal delgada. Al microscopio óptico los hallazgos pueden ser normales, presentarse como proliferación mesangial con depósitos inespecíficos de IgM y C3 o en estadios más avanzados como glomeruloesclerosis focal y segmentaria [25]. Para aquellos casos, en que la evolución clínica no sea típica del SA, con deterioro inesperado de la función renal, se justificaría realizar una biopsia renal. La biopsia cutánea no se considera de utilidad actualmente.
Manifestaciones clínicas
Afectación renal
La hematuria es el signo más importante, ya sea microhematuria persistente o intermitente; o bien episodios de hematuria macroscópica asociada a cuadros de infecciones respiratorias. Además, pueden presentar proteinuria que aumenta con la edad y puede evolucionar a síndrome nefrótico y TRS. El grado de afectación renal presenta gran variabilidad intrafamiliar. El tratamiento renal sustitutivo de elección es el trasplante renal. Se han descrito algunos casos de pacientes trasplantados con SA que desarrollaban Ac antiMBG con pérdida del injerto renal, pero con el avance de los tratamientos inmunosupresores, este porcentaje ha disminuido del 1-5% al 0,4% en los últimos registros [26].
Afectación ocular
Aparece afectación ocular en el 15-40% de los casos. El lenticono anterior bilateral es la lesión prácticamente patognomónica. Aparece durante la segunda década de la vida, no produce pérdida de la visión y no requiere seguimiento. Además, pueden presentar lesiones en córnea, cristalino y retina (cataratas, erosiones corneales, desflecamientos retinianos). Generalmente se realiza un control anual dependiendo del tipo de patología [5] [27].
Afectación auditiva
La hipoacusia neurosensorial no es congénita, suele aparecer al final de la infancia o principio de la adolescencia. El diagnóstico se realiza con audiometría y la afectación es bilateral para sonidos agudos (frecuencia 4000-8000 Hz). Suele ser más frecuente en la adolescencia en los pacientes con SALX y SAAR [27][28][29].
Tratamiento y seguimiento
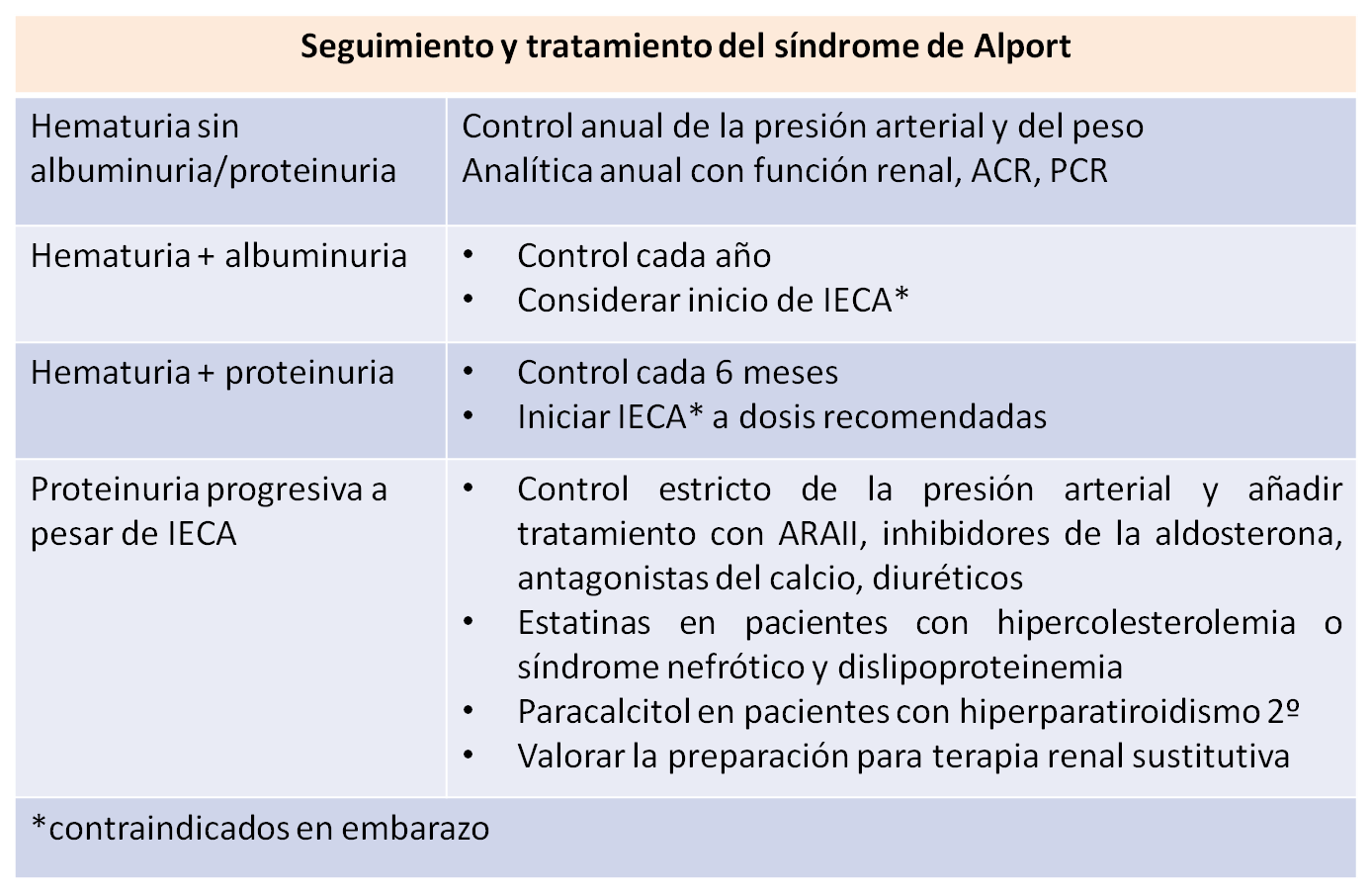
Se ilustra en la (Figura 2)
La hematuria no requiere tratamiento. Pero cuando aparece la albuminuria/proteinuria es necesario iniciar tratamiento con inhibidores o antagonistas del sistema renina angiotensina aldosterona para retrasar su evolución a TRS [30] [31].
Actualmente no hay un tratamiento específico para el SA, pero se encuentran en marcha varios estudios con diferentes fármacos como, anti-miRNA21, los inhibidores de STAT3, los inhibidores de EGFR, paricalcitol que actuarían disminuyendo el grado de fibrosis renal y su evolución a TRS. De momento, la FDA no aprobó bardoxolona para pacientes con Síndrome de Alport por no haber mostrado beneficio suficiente para enlentecer el deterioro de la función renal.
El ensayo clínico DAPA-CKD sugiere un efecto beneficioso de los inhibidores de SGLT2 en la ERC de origen no metabólico, en donde el número de pacientes incluidos con Síndrome de Alport fue bajo y, por lo tanto, las conclusiones no pueden extrapolarse para esta población en este momento y debe ampliarse su estudio [32]. Recientemente se publicado el estudio EMPA-KIDNEY en donde se ha observado que la empaglifozina enlentece el declive del filtrado glomerular en todos los subgrupos con albuminuria, por lo que los inhibidores de SGLT2 podrían ser beneficiosos para el Síndrome de Alport [33]. Se llevará a cabo el estudio observacional “Guard Alport” a cargo del Prof. Oliver Gross, en donde se estudiará el efecto de los inhibidores de SGLT en pacientes con diagnóstico de Sindrome de Alport (NCT02378805). Se encuentra en etapa de investigación las terapias con células madre que actuarían a nivel de la membrana basal glomerular y las chaperonas que podrían actuar directamente sobre la triple hélice de la cadena del colágeno IV [34].
Otras hematurias familiares.
Nefropatía por MYH9
Las variantes patogénicas en el gen MYH9 producen un cuadro clínico que se caracteriza por la presencia de macrotrombocitopenia, inclusiones leucocitarias y un riesgo variable de desarrollar microhematuria, insuficiencia renal, hipoacusia y cataratas en edad juvenil o adulta. Se transmite con un patrón de herencia autosómico dominante. El grupo de enfermedades causadas por variantes patogénicas en el gen MYH9 se agrupaban en cuatro síndromes caracterizados por presentar macrotrombocitopenia asociada a otras enfermedades. Históricamente dos de estos síndromes, el Síndrome de Fechtner y el Síndrome de Epstein, presentaban afectación renal y eran considerados como variantes del Síndrome de Alport [35].
Síndrome HANAC
Se produce por variantes patogénicas en el gen COL4A1 con un patrón de herencia autosómico dominante. Clínicamente se caracteriza por la asociación de hematuria, con o sin proteinuria, hemorragias retinianas debido a tortuosidades en las arterias de la retina, arritmia cardiaca, fenómeno de Raynaud y contracturas musculares. A diferencia de otras formas de hematuria familiar, los casos publicados presentaban anomalías no glomerulares y a nivel histológico el grosor de la membrana basal suele ser normal, así como la expresión de las cadenas de colágeno tipo IV [36][37][38].
Conceptos clave:
1) El Síndrome de Alport se produce por variantes patogénicas en los genes COL4A3, COL4A4 y COL4A5.
2) El diagnóstico de certeza se realiza por estudio genético.
3) No se realiza de rutina biopsia renal ni de piel.
4) Clínicamente se presenta con microhematuria, proteinuria y evolución a enfermedad renal crónica, presentando gran variabilidad entre los 3 patrones de herencia y dentro de una misma familia.
5) Pueden presentar hipoacusia neurosensorial bilateral y afectación ocular en grado variable.
6) Se recomienda tratar la proteinuria con fármacos antiproteinúricos.
7) No existe un tratamiento específico aprobado en la actualidad para SA.