Síndromes Hereditarios con Afectación Renal
ÍNDICE
I. Introducción.
II. Malformaciones congénitas renales y de vías urinarias: CAKUT.
III. Desarrollo embriológico del sistema urinario.
IV. Síndromes hereditarios con afectación renal.
A. Síndromes hereditarios asociados a CAKUT.
Síndrome de quistes renales y diabetes.
Síndrome coloboma-renal.
Síndrome branquio-oto-renal.
Síndrome de Townes-Brocks.
Síndrome de Kallman.
Síndrome de Fraser.
Síndrome BNAR.
Síndrome de Barakat.
Síndrome de Alagille.
Síndrome de CHARGE.
B. Síndromes de microdeleción.
Síndrome de microdeleción 22q11.2
Síndrome de Williams Beuren.
C. Síndromes hereditarios con predisposición a tumores renales.
Síndrome de Von Hippel Lindau.
Síndrome de WAGR (microdeleción).
Síndrome de Simpson Golabi Behmel.
D. Asociaciones con afectación renal de probable causa genética.
Asociación VACTERL.
Asociación MURCS.
E. Otros síndromes hereditarios con posible afectación renal.
F. CAKUT en anomalías cromosómicas numéricas.
V. Conclusiones.
I. INTRODUCCIÓN
Los síndromes hereditarios con afectación renal son un conjunto heterogéneo de enfermedades con afectación del sistema urinario que asocian alteraciones en otros órganos y aparatos, con un origen genético o cromosómico, y por tanto con posibilidad de transmisión a la descendencia.
Como primer concepto es necesario diferenciar los síndromes hereditarios con afectación renal del resto de enfermedades renales de base genética no sindrómicas, que no analizaremos en este capítulo.
Definimos “Síndrome” como la ocurrencia, no debida al azar, en un mismo individuo de dos o más anomalías relacionadas etiológicamente [1]. Asimismo definimos “Asociación” cuando existe un patrón no aleatorio de anomalías congénitas que ocurren conjuntamente con mayor frecuencia a la esperable pero no se ha identificado la causa. Por tanto, en el momento en que se identifica el defecto genético las asociaciones pasan a considerarse síndromes.
El término “Síndrome” no indica por sí sólo una etiología genética o cromosómica. En el diagnóstico diferencial de pacientes con anomalías congénitas múltiples debemos considerar la posibilidad de una herencia multifactorial o bien una embriofetopatía, como por ejemplo las anomalías renales asociadas al síndrome alcohólico-fetal. Se define fenocopia como a aquellos individuos que expresan un fenotipo similar a los afectados por una enfermedad genética, pero que carecen del defecto molecular, siendo el causante un factor ambiental.
Los pilares básicos para el diagnóstico de estas enfermedades son la anamnesis y la exploración física. La anamnesis debe incluir datos raciales y geográficos dado que la incidencia de síndromes puede estar incrementada en ciertas poblaciones. Es importante investigar exhaustivamente los antecedentes familiares, así como la realización de un árbol genealógico con el fin de establecer el patrón de herencia. En algunos casos la penetrancia incompleta y la expresividad variable intrafamiliar dificulta la categorización de familiares sanos o afectados. Se define penetrancia como la proporción de individuos con un defecto molecular que muestran signos clínicos de esa enfermedad. No debemos olvidar que en muchas ocasiones no existen antecedentes familiares, siendo el defecto genético “de novo”, al producirse una mutación nueva en las células germinales de los padres o en el cigoto.
Debemos ser exhaustivos y ordenados en la exploración física. La detección de rasgos dismórficos (características físicas que no están dentro del rango normal de los individuos sanos) pueden ser fundamentales en el proceso diagnóstico. Se recomienda que estas apreciaciones clínicas sean comprobadas con medidas antropométricas que permitan comparar con percentiles por edad y sexo. Unos ejemplos son la medida de la distancia interpupilar o la medición de segmentos corporales. Tras la exploración determinaremos qué hallazgos son más relevantes, y pueden servirnos como “signos guía” en el diagnóstico. La presencia de rasgos dismórficos múltiples nos debe llevar siempre a considerar la posibilidad de un síndrome. Es de interés que algunos rasgos pueden ser evolutivos por lo que se aconseja la reevaluación a lo largo de la vida.
Al ser enfermedades poco frecuentes y con afectación multisistémica el enfoque diagnóstico debe ser multidisciplinar y en la mayoría de ocasiones precisa de variadas exploraciones complementarias como estudios bioquímicos, pruebas de imagen y estudios genéticos.
El diagnóstico genético específico viene determinado por la sospecha diagnóstica. Es importante recordar que un mismo síndrome puede estar causado por distintos genes lo que se define como heterogeneidad genética. Si la sospecha clínica es de una entidad de etiología cromosómica, optaremos por técnicas citogenéticas de alta resolución como los microarrays cromosómicos. Estas técnicas nos van a permitir detectar variaciones del número de copias (CNVs), definidas como la ganancia o pérdida de DNA en la línea germinal. Frecuentemente son la primera elección en cuadros de anomalías congénitas múltiples o en pacientes con afectación cognitiva.
Si la sospecha es de etiología monogénica optaremos por técnicas de secuenciación exómica (NGS, Next Generation Sequencing). Estas técnicas han desplazado el uso de la secuenciación clásica (Sanger) de un gen específico.
Dada la alta heterogeneidad genética de muchos de los síndromes, así como la alta frecuencia de fenotipos no específicos se opta por el exoma dirigido o NGS basada en panel de genes. Estos estudios nos permiten estudiar de forma simultánea un amplio número de enfermedades monogénicas, con un buen perfil de costo-efectividad. Progresivamente se han incorporado nuevas técnicas moleculares que permiten ampliar la profundidad del estudio en casos no filiados; como son el análisis del exoma completo (WES, Whole Exome Sequencing), el Trio-WES (WES enfermo y de sus progenitores sanos), y la secuenciación genómica completa (WGS Whole Genome Sequencing). El actual y futuro desarrollo de estas técnicas va a permitir la capacidad adicional de detectar CNVs.
Esta tecnología está permitiendo la detección de nuevos genes y fenotipos, así como la posibilidad de estudiar a genes candidatos. Sin embargo, también existen limitaciones, como las propias de la técnica, la complejidad en la interpretación de los resultados, la detección de variantes de significado incierto y la presencia de hallazgos incidentales no buscados.
Es necesario considerar la complejidad del diagnóstico genético ante la posibilidad de otros tipos de herencia (trialélica, mitocondrial, mosaicismos somáticos/germinales, alteraciones en el imprinting, disomía uniparental), expresividad variable por genes reguladores y aspectos epigenéticos que modifican la expresión de genes.
Llegar a un diagnóstico genético etiológico nos va a permitir implantar un programa de seguimiento específico, establecer las opciones terapéuticas, prever posibles complicaciones y el asesoramiento genético familiar, planteando las opciones reproductivas y el riesgo de recurrencia de la enfermedad.
Ante el amplio número de síndromes hereditarios con afectación renal, incluimos en la presente revisión el grupo de enfermedades que consideramos más significativas por su frecuencia y/o características clínicas. En el presente capítulo nos centraremos en los principales síndromes asociados a malformaciones del sistema urinario y los síndromes con predisposición a tumores renales. Los síndromes hereditarios asociados a glomerulopatías, ciliopatías y tubulopatías serán tratados en capítulos específicos. Cada síndrome viene acompañado de su número OMIM de fenotipo (OMIM Online Mendelian Inheritance in Man). OMIM es una base de datos online de enfermedades humanas con base genética, en la que el lector puede ampliar la información de cada enfermedad: http://www.omim.org/
II. MALFORMACIONES CONGÉNITAS RENALES Y DE VÍAS URINARIAS: CAKUT.
Las malformaciones congénitas del riñón y las vías urinarias, también conocidas con el acrónimo inglés CAKUT (Congenital Anomalies of the Kidney and Urinary Tract) son el resultado de una alteración en el desarrollo embriológico del aparato urinario.
Las CAKUT son las anomalías congénitas más frecuentes, afectando a 3-6 casos por cada 1.000 recién nacidos vivos [2] y son la principal causa de enfermedad renal crónica en las primeras tres décadas de la vida [3].
Un 40-50% de los pacientes pediátricos que llegan a enfermedad renal terminal (ERT) es debido a una CAKUT. En adultos esta cifra baja en la bibliografía clásica al 5% pero probablemente esté infraestimado dada la mejoría en la supervivencia actual de estos pacientes [4].
La mayoría son esporádicas aunque en un 10-20% muestran una agregación familiar. Esta agregación traduce en la mayoría de ocasiones una herencia multifactorial (genética y ambiental) o poligénica. En ocasiones forman parte de una entidad sindrómica específica. La detección de una causa genética en las CAKUT se sitúa en torno al 20% de los casos, siendo la rentabilidad diagnóstica más alta en la hipodisplasia renal, en casos bilaterales, si existen antecedente familiares positivos y/o cuando se asocian anomalías extrarrenales.
Las CAKUT se clasifican en varios grupos: anomalías del parénquima renal, anomalías del tracto urinario superior e inferior y anomalías en la posición renal.
Las anomalías del parénquima renal incluyen la agenesia renal, la hipoplasia renal y la displasia renal. La agenesia renal se define como la ausencia de riñón y uréter. La hipoplasia y la displasia renal son términos histopatológicos. La hipoplasia se define como la disminución en el número de nefronas, a menudo sólo un 20-30% del número normal, asociada a hipertrofia glomerular y tubular, y alteraciones en la membrana basal y la cápsula de Bowman. Se habla de displasia renal ante la presencia en el parénquima renal de elementos displásicos tales como la fibrosis intersticial, la presencia de túbulos primitivos (en ocasiones con dilataciones quísticas) o la presencia de tejido no renal. Habitualmente la hipoplasia y la displasia renal van asociadas. En la práctica clínica hablamos de hipodisplasia renal ante un paciente con unos riñones pequeños, mal diferenciados o hiperecogénicos, de origen congénito. La hipodisplasia renal puede estar asociada a otras CAKUT. La forma más grave de displasia renal es la displasia renal multiquística que consiste en la sustitución del parénquima renal funcionante por quistes no comunicantes de distinto tamaño.
Las anomalías del tracto urinario superior e inferior incluyen el doble sistema excretor, la estenosis de la unión pieloureteral, el megauréter estenótico por estenosis de la unión ureterovesical, el reflujo vesicoureteral, el uréter ectópico, el ureterocele, la extrofia vesical y las válvulas de uretra posterior.
Las principales anomalías en la posición renal incluyen el riñón ectópico, el malrotado y el riñón en herradura.
III. DESARROLLO EMBRIOLÓGICO DEL SISTEMA URINARIO
Con el fin de comprender mejor la formación de CAKUT y el papel de los distintos genes en la embriogénesis del sistema urinario, describiremos brevemente el desarrollo del mismo.
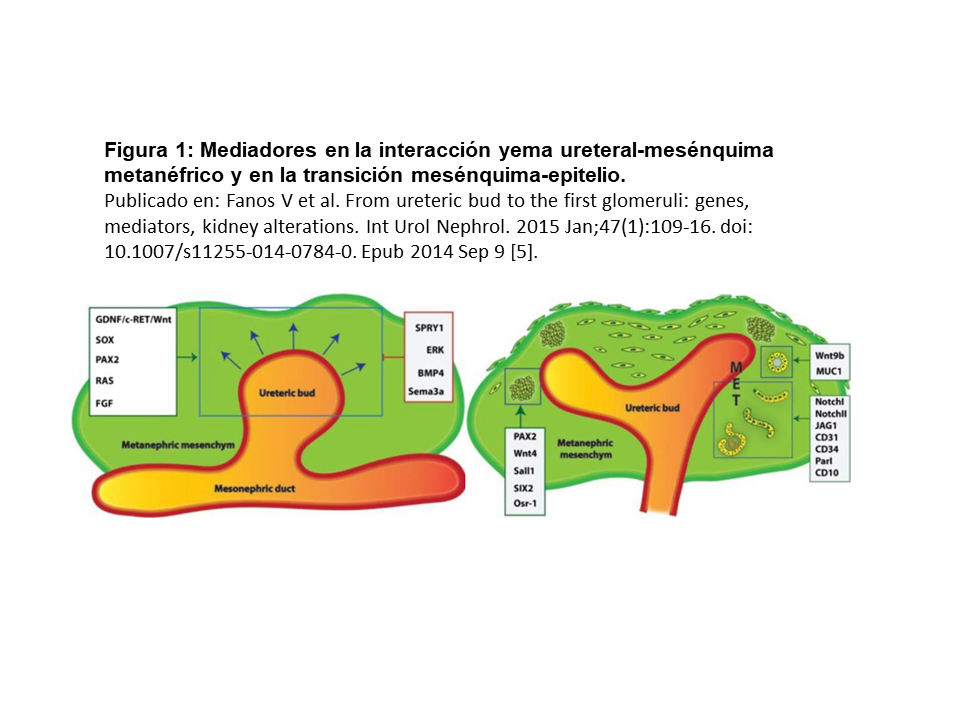
El riñón procede embriológicamente del mesodermo intermedio (cordón nefrógeno). A partir de la 4ª semana de gestación surgen en el cordón nefrógeno, secuencialmente, tres zonas denominadas pronefros, mesonefros y metanefros. Del metanefros embrionario se originará el riñón. La primera estructura importante derivada del metanefros es un tejido epitelial que asciende desde el conducto primitivo mesonéfrico de Wolff y que formará los túbulos colectores, cálices, pelvis, uréteres y trígono vesical. La segunda estructura fundamental es el mesénquima metanéfrico, que se transforma en parénquima renal formando los glomérulos y el resto de túbulos renales. La interacción entre el mesénquima metanéfrico y el conducto mesonéfrico es uno de los pasos más importantes en la embriogénesis renal. Una interacción adecuada induce la aparición de la yema ureteral a partir del conducto mesonéfrico. Esta yema ureteral va ramificándose formando el sistema colector renal. Simultáneamente el tejido mesenquimal metanéfrico sufre una transición de mesénquima a epitelio para formar las vesículas renales, que finalmente formarán las nefronas.
Como ejemplos la ausencia de formación de la yema ureteral condiciona una agenesia renal, una yema ureteral demasiado baja desencadena un reflujo vesicoureteral, y un defecto en la interacción entre la yema ureteral y el mesénquima metanéfrico es el origen de la hipodisplasia renal.
El uréter primitivo, formado a partir de la yema ureteral, sufre una obliteración casi completa de su luz en el periodo de alargamiento. Posteriormente sufre una recanalización desde la región media ureteral hacia los extremos. La recanalización completa ocurre en la semana 9ª de gestación. Un fallo en la recanalización del uréter explica la estenosis de la unión pieloureteral y la estenosis ureterovesical.
Además el riñón se forma en zona pélvica y progresivamente, entre la semana 5ª-8ª de gestación, se desplaza en sentido craneal. Un fallo en su migración explica el riñón ectópico. Los defectos en la cápsula renal provocan la fusión de los polos inferiores con formación de riñones en herradura (Figura 1) [5].
4. SÍNDROMES HEREDITARIOS CON AFECTACIÓN RENAL
A. SÍNDROMES HEREDITARIOS ASOCIADOS A CAKUT
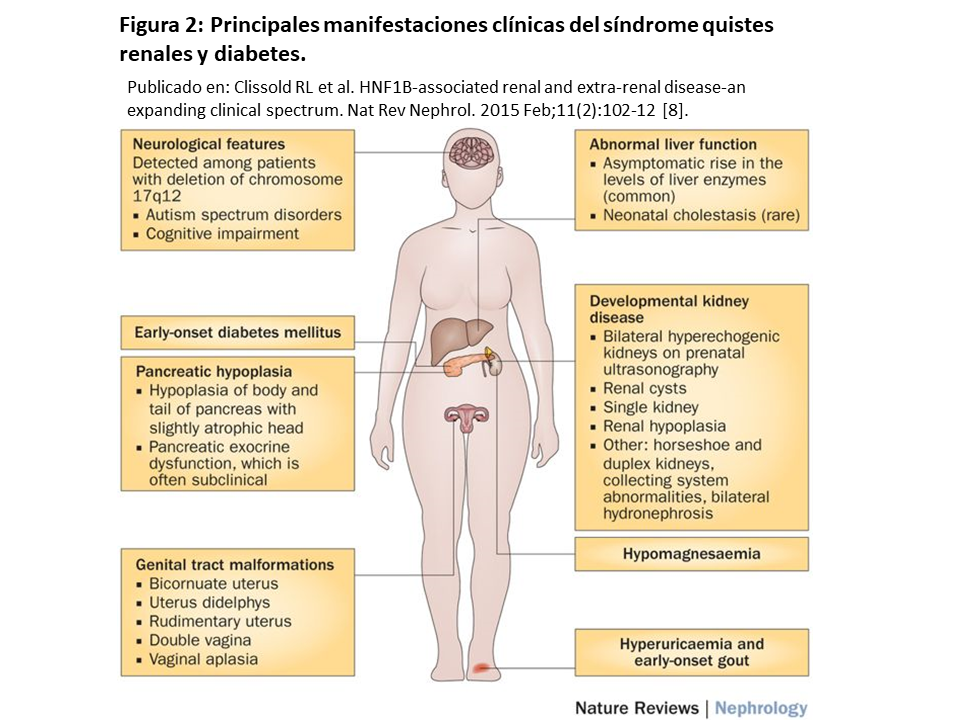
SÍNDROME QUISTES RENALES Y DIABETES (OMIM #137920).
También denominado síndrome RCAD (Renal Cysts and Diabetes Syndrome) (Figura 2). Es una enfermedad genética de transmisión autosómica dominante por mutaciones en el gen HNF1β, situado en la banda cromosómica 17q12.
Las manifestaciones clínicas principales de esta enfermedad son la nefropatía, la diabetes mellitus tipo MODY, las anomalías genitales, pancreáticas, hepáticas, neurocognitivas y metabólicas.
Respecto al diagnóstico genético, las variantes patogénicas identificadas con mayor frecuencia se agrupan en los primeros 4 exones del gen. En la mitad de los casos la alteración genética es una deleción heterocigota completa del gen. Más de la mitad de los casos la enfermedad es de novo y no existen antecedentes familiares. Respecto a los casos heredados la penetrancia es incompleta y no existe relación genotipo-fenotipo, por lo que la variabilidad fenotípica intrafamiliar es frecuente.
HNF1β (hepatocyte nuclear factor-1-beta) es un factor de transcripción también conocido como Transcription Factor 2 (TCF2). Participa en el desarrollo de epitelios especializados de varios órganos durante las fases temprana y tardía de la embriogénesis, realizando su funcionan principalmente regulando el ciclo celular y las vías de apoptosis [6]. Controla la expresión de otros genes, implicados principalmente en la formación del hígado, los riñones, el intestino, los genitales, el páncreas, las glándulas paratiroides y el sistema nervioso. A nivel renal participa en la interacción entre la yema ureteral y el mesénquima metanéfrico, y posteriormente en mantener la polaridad de plano del epitelio tubular. Las mutaciones en HNF1β modifican también la expresión de otros genes implicados en enfermedades quísticas renales como PKHD1, PKD2 y UMOD provocando la aparición de una displasia renal quística [7] [8].
La clínica renal es la predominante, afectando al 80-85% de los casos. Puede presentarse como una CAKUT (agenesia renal, ectopia renal, riñón displásico multiquístico, riñones en herradura o anomalías de vías urinarias). Sin embargo lo más frecuente es la displasia renal quística bilateral, con quistes de predominio cortical aunque con posibilidad de aparición en cualquier parte de la nefrona. Los riñones suelen tener un tamaño normal o pequeño. Otra forma de presentación posible es en forma de enfermedad túbulo-intersticial. En este caso se puede detectar hiperuricemia, hipomagnesemia, hipopotasemia y defectos en la concentración urinaria, sin proteinuria significativa inicial.
La hipomagnesemia y la hipopotasemia son frecuentes (62% y 46% respectivamente), y persisten incluso en estadios avanzados de ERC [9]. La hipomagnesemia está causada por una disminución en la reabsorción de magnesio en el túbulo distal, debido al fallo en la interacción de HNF1β con el gen FXYD2. Las pérdidas de potasio podrían ser secundarias al déficit de magnesio. En conclusión, la hipomagnesemia puede ser un signo guía de sospecha de este síndrome. En la forma túbulo-intersticial aislada debe hacerse el diagnóstico diferencial con la nefronoptisis y con el resto de enfermedades renales túbulo-intersticiales autosómicas dominantes como son las causadas por mutaciones en los genes MUC1 (mucina 1), UMOD (uromodulina) y REN (renina).
Se describe una baja prevalencia de hipertensión arterial en este síndrome.
Respecto al pronóstico renal el 30-50% de los casos evolucionará a enfermedad renal crónica y un 5-15% acabará en enfermedad renal terminal.
Las manifestaciones genitales son muy variables. En el varón las malformaciones afectan a estructuras derivadas del conducto de Wolf, como por ejemplo quistes del epidídimo o atresia de deferentes. En la mujer se pueden detectar alteraciones Müllerianas, desde malformaciones leves como un útero bicorne hasta un síndrome de Mayer-Rokitansky-Küster-Hauser (aplasia congénita del útero y de los 2/3 superiores de la vagina).
El páncreas es el segundo órgano más afectado. El 50% de estos pacientes desarrollarán diabetes mellitus tipo MODY5 (Maturity Onset Diabetes of the Youth), normalmente antes de los 25 años. Suele aparecer más tarde que la clínica renal. Es menos frecuente la aparición de anomalías morfológicas como la atrofia pancreática, que en algún caso puede desencadenar insuficiencia pancreática exocrina. De cara al trasplante renal requieren terapia inmunosupresora adaptada al riesgo de desarrollo de una diabetes mellitus post trasplante.
La afectación hepática ha sido habitualmente poco considerada, pero es frecuente (40%). Las formas más habituales son la hipertransaminasemia asintomática, y los cuadros colestásicos con elevación de GGT debidos a la alteración en la ciliogénesis y polarización de células epiteliales biliares, junto con la escasez de conductos biliares interlobulares y la fibrosis periportal [6].
En los pacientes con deleción del locus 17q12 existe un riesgo incrementado de alteraciones neurológicas y psiquiátricas tales como dificultades en el aprendizaje, discapacidad intelectual, trastornos del espectro autista, esquizofrenia, ansiedad y trastorno bipolar. Estas manifestaciones no están presentes en pacientes con mutaciones por lo que se postula que podrían no estar relacionadas directamente con HNF1B, sino con alguno de los 14 genes habitualmente afectados en la deleción de este locus.
Alteraciones en la expresión del HNF1β se han relacionado con un riesgo incrementado de tumores renales, sin ningún subtipo específico, sugiriéndose su papel como proto-oncogen pero aún son insuficientes los estudios en este campo.
SÍNDROME COLOBOMA-RENAL (OMIM #120330).
También denominado síndrome papilo-renal. Es una enfermedad de herencia autosómica dominante, de prevalencia desconocida, causada por mutaciones en el gen PAX2 (paired-box gene), localizado en la banda cromosómica 10q24. Este gen codifica un factor de transcripción implicado en el desarrollo del aparato urinario, ojo, oído y sistema nervioso [10]. PAX2 en uno de los genes más críticos implicados en el desarrollo del aparato urinario. La mayoría de casos ocurren por mutación (95%), con pocos casos descritos por deleción.
La principal manifestación es la hipodisplasia renal bilateral, presente en el 92% de los casos. A nivel histológico la lesión típica es la oligomeganefronia, consistente en una reducción del número de glomérulos pero de tamaño aumentado. Menos frecuentemente se asocia a otras CAKUT, como el reflujo vesicoureteral (14%) o la displasia renal multiquística (6-10%). La presentación clínica es muy variable, desde la muerte fetal por una secuencia Potter hasta formas leves asintomáticas en la edad adulta (raras). La mayoría de casos la afectación renal es significativa. La enfermedad debuta en el 41% de los casos entre los 1-10 años de vida, con una edad media de 8.2 años [11]. Se ha descrito una edad media de enfermedad renal terminal de 19.5 años [12]. Actualmente se describen pacientes con mutaciones en PAX2 con fenotipo no sindrómico, bien como una hipodisplasia renal aislada o bien como una glomeruloesclerosis segmentaria y focal del adulto [13].
La prevalencia del síndrome coloboma renal está probablemente infraestimada. En una serie amplia de pacientes con CAKUT se detectó mutación en PAX2 en el 6.5% de los casos [14]; en otra serie de pacientes con CAKUT que precisan trasplante renal se detectó en el 10% [15].
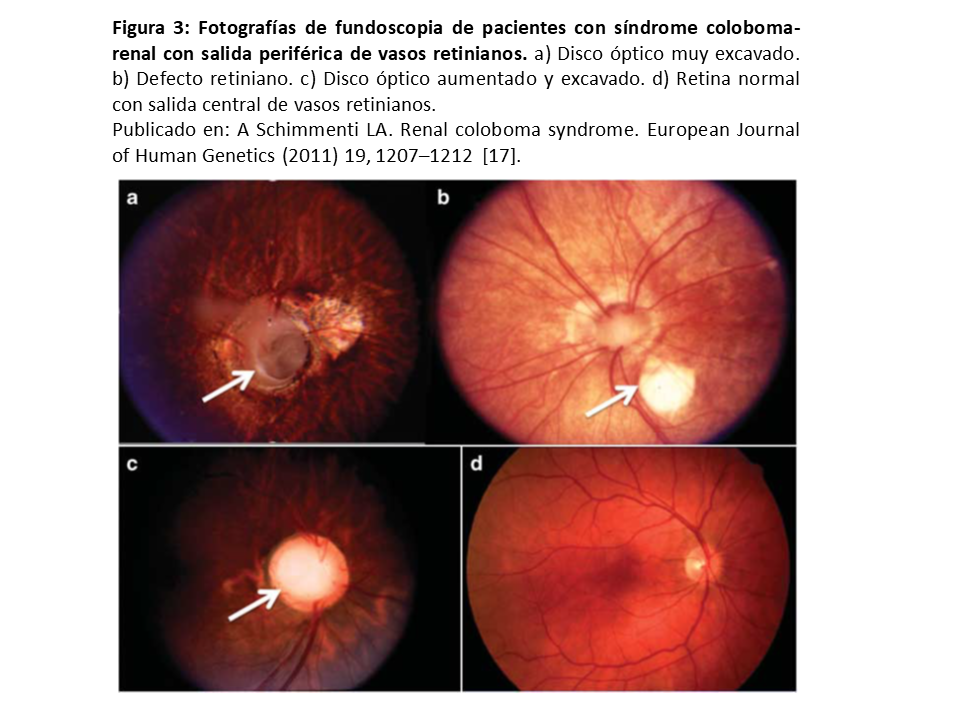
Las anomalías en el segmento ocular posterior están presentes en el 77% de los pacientes [12]. La principal manifestación ocular es la displasia del nervio óptico. Su forma grave se caracteriza por el paso anormal de vasos retinianos, que en vez de surgir de la parte central, surgen de la periferia; además existe una excavación profunda del nervio óptico y la presencia de tejido fibroglial. Este hallazgo es denominado por muchos oftalmólogos como “coloboma de nervio óptico”. Sin embargo algunos autores encuentran el término confuso porque se asocia erróneamente con un defecto de cierre de la fisura óptica y la formación de un coloboma uveal. De hecho no se han descrito pacientes con mutación en PAX2 con coloboma de iris. Algunos pacientes sí pueden asociar coloboma de retina.
En general las alteraciones oculares son altamente variables [16] desde pacientes con una leve displasia del nervio óptico sin consecuencias funcionales hasta gran afectación del nervio óptico con riesgo de ceguera. Otros hallazgos menos frecuentes son la microftalmia, el estafiloma escleral, el quiste del nervio óptico y la displasia pigmentaria de la mácula. En conclusión recomendamos la evaluación de fondo de ojo a todos los pacientes con hipodisplasia renal no filiada.
Otras manifestaciones clínicas menos frecuentes son la pérdida de audición de alta frecuencia (7%), presencia de piel suave, hiperlaxitud articular...
Es recomendable la evaluación de otros familiares de riesgo dada la gran expresividad variable intrafamiliar y la penetrancia casi completa (mayor del 99%).
Las imágenes del síndrome coloboma-renal se ilustran en la (Figura 3) [17].
SÍNDROME BRANQUIO-OTO-RENAL (OMIM #113650, #608389).
El Síndrome BOR, también conocido como síndrome de Melnick–Fraser, es una enfermedad de herencia autosómica dominante secundaria a mutaciones en los genes EYA1 (8q13.3; 40%), y SIX1 (14q23.1; 3-4.5%). En un porcentaje significativo de pacientes, más del 50%, el defecto molecular es desconocido. El principal gen relacionado con el síndrome es EYA1 que codifica un factor de transcripción implicado en el desarrollo del mesénquima metanéfrico, y que junto a los genes SIX controlan la expresión de otros genes implicados en el desarrollo renal como PAX2. El papel de SIX5 en esta enfermedad es controvertido, aunque ha sido descrito en unos pocos pacientes.
La prevalencia del síndrome es de 1/40.000 niños. Cursa con defectos branquiales, renales y del sistema auditivo. La penetrancia es completa pero la expresividad es muy variable por lo que no todos los pacientes van a tener todas las anomalías. Cuando no existe afectación renal hablamos de síndrome branquio-ótico. Por todo ello actualmente se prefiere hablar de enfermedades del espectro branquio-oto-renal.
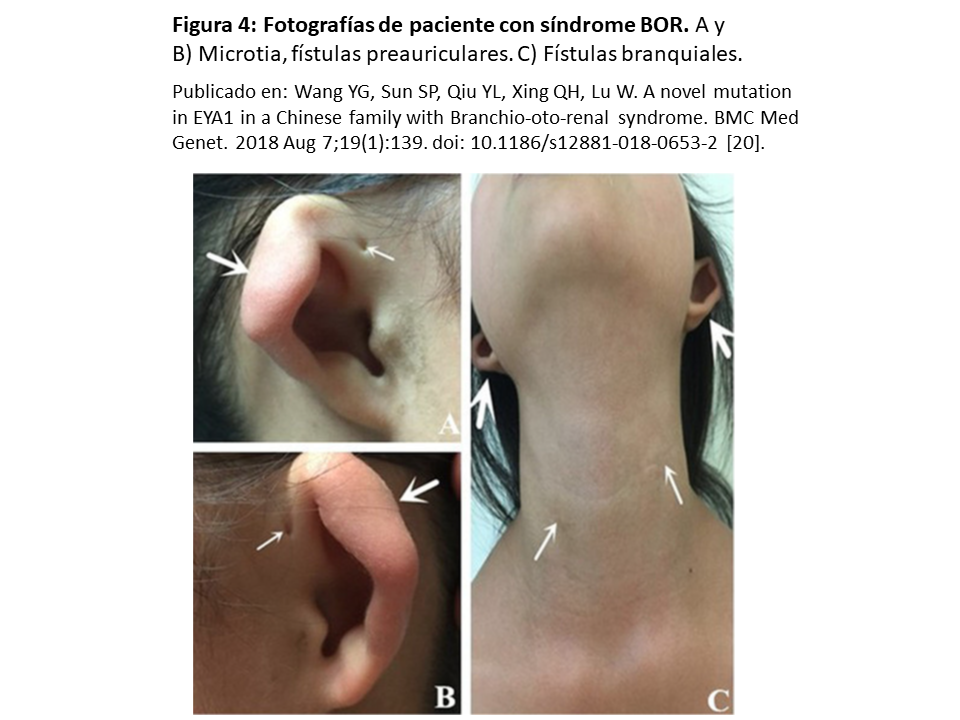
Las alteraciones del desarrollo del segundo arco branquial embrionario, presentes en el 50% de los casos, consisten en la presencia de quistes o fístulas laterocervicales. La afectación del oído es la más frecuente (>90%), pudiendo encontrar fositas o apéndices preauriculares, malformaciones de oído externo, medio y/o interno. Por lo tanto, la pérdida auditiva puede ser de transmisión, neurosensorial o mixta.
La afectación renal está presente en el 67% de los pacientes [18]. Cursa como una hipodisplasia renal unilateral o bilateral, pudiendo asociarse a otras CAKUT como agenesia renal o malformaciones de vías urinarias. El 6% de los pacientes con nefropatía acaban en enfermedad renal terminal habitualmente en la edad adulta [19].
Dado que el defecto molecular es desconocido en más de la mitad de los pacientes se han propuesto unos criterios para el diagnóstico clínico de la enfermedad. En ausencia de antecedentes familiares se puede realizar un diagnóstico clínico de síndrome de BOR con 3 criterios mayores o bien dos criterios mayores más dos menores. Si existe un familiar afectado sólo precisa de un criterio mayor. Se incluyen como criterios mayores las anomalías del segundo arco branquial, la sordera, las fositas preauriculares, las malformaciones del pabellón auricular y la nefropatía. Como criterios menores se engloban las anomalías del oído medio, interno, y conducto auditivo externo, los apéndices preauriculares, y otros hallazgos menos frecuentes como las alteraciones del paladar o la asimetría facial.
Las imágenes del síndrome BOR se ilustran en la (Figura 4) [20].
SÍNDROME DE TOWNES-BROCKS (OMIM #107480).
Enfermedad autosómica dominante secundaria a mutaciones en el gen SALL1 localizado en el locus 16q12.1. Se estima una prevalencia de 1-9/1.000.000 habitantes. En la actualidad en un 25% de los casos no hay identificación molecular. La alteración es heredada de un progenitor en la mitad de los casos siendo en el otro 50% una mutación de novo. La deleción del gen es poco frecuente (5%). El gen SALL1 codifica un factor de transcripción en “dedo de zinc” esencial en el crecimiento de la yema ureteral y el desarrollo del tejido metanéfrico [21].
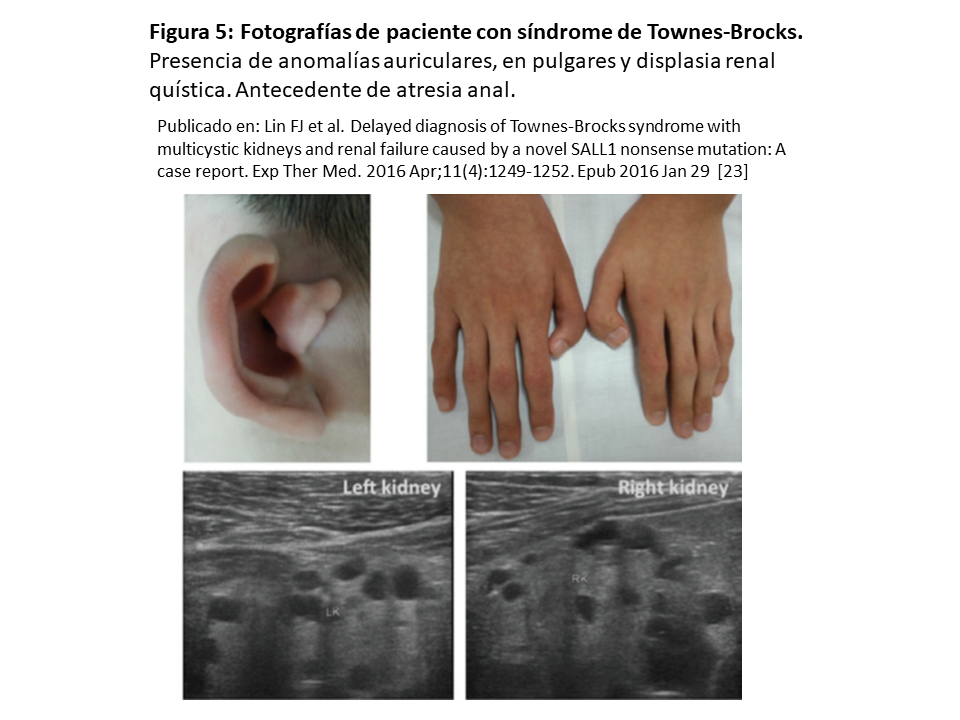
Fenotípicamente cursa con la triada de ano imperforado (84%), anomalías auriculares (87%) y alteraciones en los pulgares (89%) como polidactilia pre-axial, pulgares trifalángicos o hipoplásicos. Puede asociar hipoacusia de conducción y/o sensorial, alteraciones del pie, problemas renales, genitales y cardiacos. La discapacidad intelectual es rara (10%).
La afectación renal ocurre en el 42% de los pacientes y puede llevar a enfermedad renal terminal. Se manifiesta como una hipodisplasia renal y/u otras CAKUT como agenesia renal, riñones en herradura, displasia renal quística… Para la mayoría de las variantes no existe correlación genotipo-fenotipo, siendo la penetrancia completa y la expresividad variable. En algunas familias se describe anticipación genética (mayor gravedad clínica en las siguientes generaciones).
Se considera que mutaciones en el gen DACT1 (14q23) podrían causar el síndrome de Townes-Brocks tipo 2, aunque es necesaria más información dado que sólo existe una familia descrita con esta alteración [22].
Las imágenes del síndrome de Townes-Brocks se ilustran en la (Figura 5) [23].
SÍNDROME DE KALLMAN (OMIM #308700 KAL1).
Enfermedad con gran heterogeneidad genética. Entre los genes causantes más destacados se encuentran: KAL1 (Xp22.32), FGFR1 (8p12), FGF8 (10q25-q26), CHD7 (8q12.2), SOX10 (22q13.1), PROK2 (3p21.1) y PROKR2 (20p12.3). Sin embargo en la mayoría de casos no se ha identificado un gen responsable. La transmisión es variable según el gen implicado. La forma clásica es ligada al cromosoma X por mutaciones en el gen KAL1. Los genes FGFR1, FGF8, CHD7 y SOX10 se transmiten de forma dominante, mientras que PROK2 y PROKR2 de forma recesiva.
Los síntomas clásicos son el hipogonadismo hipogonadotrópico y alteraciones en el olfato (anosmia o hiposmia) secundarios a una alteración en la migración común de las células neuroendocrinas productoras de GnRH y las neuronas sensoriales olfativas.
La principal manifestación renal es la agenesia renal unilateral aunque pueden manifestarse como otras CAKUT. El 40% de los pacientes con mutación en KAL1 tienen afectación renal [24]. El gen KAL1 codifica la glicoproteína extracelular llamada anosmina 1, que está implicada en la organogénesis renal (presente en la yema ureteral y membranas basales de los túbulos mesonéfricos).
SÍNDROME DE FRASER (OMIM #219000, #617666, #617667).
También llamado síndrome de criptoftalmia-sindactilia. Es una enfermedad genética de transmisión recesiva, con una incidencia de 1/200.000 recién nacidos vivos, causada principalmente por mutaciones en homocigosis en el gen FRAS1 (4q21), y menos frecuentemente en los genes FREM2 (13q13) y GRIP1 (12q14).
La manifestación más frecuente es el criptoftalmos u “ojo oculto”, detectado en el 93% de los pacientes. Consiste en la ausencia de fisura palbebral con aspecto de párpado cerrado. Suele asociarse a microftalmia o anoftalmia.
La sindactilia (dedos fusionados) está presente en el 54% de los casos, y puede afectar a manos y/o pies. Otras comorbilidades posibles son las anomalías laríngeas, genitales, auditivas, nasales, discapacidad intelectual…
Las anomalías renales suelen ser graves, de hecho el 25% de los afectados fallece prenatalmente por agenesia renal bilateral. El resto suele cursar con agenesia renal unilateral y/o displasia renal quística. Hasta un 20% de los nacidos vivos fallecen en el primer año de vida por los defectos laríngeos o renales.
El Complejo de Fraser es un complejo proteico ternario, conformado por las proteínas FRAS1, FREM1 y FREM2, que recubre la interfaz extracelular epitelial-mesenquimal, implicado en la adherencia de la membrana basal a epitelios durante la organogénesis. A nivel renal participa en la interacción de la yema ureteral con el mesénquima metanéfrico. Se ha descrito que las mutaciones missense en homocigosis en los genes del complejo de Fraser conducen a un fenotipo de CAKUT aislada [25] frente a las mutaciones truncantes que ocasionarían el fenotipo Fraser completo. La proteína GRIP1 interacciona con el Complejo de Fraser causando el muy infrecuente Fraser tipo 3. Otras mutaciones bialélicas de genes codificadores de proteínas relacionadas con el Complejo de Fraser han sido descritas como causantes de CAKUT aisladas, como en los genes Npnt (nefronectina), ITGA8 (integrina alfa 8), o la VWA2 (Von Willebrand factor A domain containing 2).
Las imágenes del Síndrome de Fraser se ilustran en la (Figura 6).
SÍNDROME BNAR (OMIM #608980).
Acrónimo inglés (Bifid Nose, Anal and Renal anomalies) de una enfermedad recesiva poco frecuente causada por mutaciones en el gen FREM1 (9p22.3). Como se describe previamente FREM1 participa en el Complejo de Fraser implicado en la organogénesis renal.
Las manifestaciones nasales típicas son nariz ancha y/o bífida con hendidura o muesca central. Presencia de anomalías anales como estenosis o ano anterior. A nivel renal encontramos agenesia renal, displasia renal y malformaciones de vías como reflujo vesicoureteral.
SÍNDROME DE BARAKAT (OMIM #146255).
También conocido por el acrónimo inglés HDR (Hypoparathyroidism, nerve Deafness and Renal disease). Enfermedad rara, de prevalencia desconocida, de transmisión autosómica dominante causada por mutaciones o deleciones en heterocigosis en el gen GATA3 localizado en el locus 10p14. GATA3 es el único gen descrito hasta la fecha, aunque existen pacientes con diagnóstico clínico sin identificación molecular.
La triada característica se objetiva en el 64% de los casos [26]. El síntoma más común es la sordera “D” (96%) que suele ser bilateral, de debut precoz y con afectación moderada/grave. La segunda manifestación más frecuente es el hipoparatiroidismo “H” (93%).
La afectación renal “R” es común, hasta en el 72% de los pacientes, y es el principal factor pronóstico. En el 40% de los casos con manifestación renal se presenta como una hipodisplasia renal, una displasia quística o bien otra CAKUT, especialmente agenesia renal y reflujo vesicoureteral. También se describe síndrome nefrótico, hematuria, nefrocalcinosis, acidosis tubular renal y enfermedad renal crónica. La mayor parte de los pacientes desarrollan ERC y a menudo requieren terapia de reemplazo renal.
En ocasiones la presencia de proteinuria, hematuria y sordera lleva a establecer el diagnóstico diferencial con el síndrome de Alport; siendo la hipocalcemia por el hipoparatiroidismo el factor diferenciador. Otro de los principales diagnósticos diferenciales es la microdeleción 22q11.2, donde la triada clásica puede estar presente.
Otras manifestaciones posibles son las cardiacas, oculares o la discapacidad intelectual. Recordar que la expresividad clínica de esta enfermedad es variable y la penetrancia reducida.
GATA3 codifica un factor de transcripción (Glutamil AmidoTransferasa A) con dos dedos de zinc que interviene en el desarrollo embrionario de las glándulas paratiroideas, el oído, el riñón, el timo y el sistema nervioso. GATA3 es indispensable en la formación de la yema ureteral.
SÍNDROME DE ALAGILLE (OMIM #118450, #610205).
Enfermedad multisistémica de transmisión autosómica dominante con una prevalencia de 1/70.000 habitantes. En más del 89% de los casos está causada por mutaciones en el gen JAG1, localizado en el locus 20p12.2. La deleción del gen JAG1 es poco frecuente (7%). Ocasionalmente es consecuencia de mutaciones en el gen NOTCH2 (1-2%) localizado en la banda 1p12. En el 50-70% de los casos la mutación es de novo. En los casos familiares la expresividad es altamente variable.
Los órganos principalmente afectados son el hígado, el corazón, los ojos y el esqueleto. La afectación renal ocurre en el 39% de los casos [27], principalmente como displasia renal. La afectación hepática es la más común (90%) y se manifiesta como una escasez de conductos biliares intrahepáticos, que provocan colestasis crónica. El 15-20% de los pacientes evolutivamente desarrollarán cirrosis y fallo hepático, precisando trasplante. La estenosis periférica de las arterias pulmonares es la cardiopatía más relevante (67%). La afectación hepática y cardiaca son los principales determinantes de morbi-mortalidad. A nivel esquelético pueden existir anomalías en la segmentación vertebral, siendo características las vértebras en mariposa. La principal manifestación ocular del síndrome es un defecto en la cámara anterior del ojo denominado embriotoxon posterior (75%). Consiste en una línea de Schwalbe prominente en el ángulo de la cámara anterior del ojo, sin repercusión visual.
Además estos pacientes presentan unos rasgos faciales típicos con cara en “triángulo invertido”, consistente en una frente prominente, ojos hundidos con hipertelorismo, barbilla puntiaguda y nariz recta con punta bulbosa (Figura 7).
Short stature and/or failure to thrive are common in Alagille syndrome. Developmental delay is seen in approximately 10 percent of patients and may be due in part to malnutrition
Otras alteraciones que pueden asociarse son la talla baja, la artritis crónica, el aumento de los pliegues de flexión digitales, las anomalías vasculares sistémicas y/o cerebrales y el retraso psicomotor (10%).
Las anomalías renales incluyen CAKUT como anomalías de vías, hipoplasia renal o displasia quística. También son posibles las anomalías funcionales principalmente la acidosis renal tubular. Se han descrito casos de estenosis de la arteria renal por lo que es importante el control evolutivo de la presión arterial en estos pacientes. En una serie de casos [27] se objetivó que la mitad de los pacientes mayores de 2 años con nefropatía por Alagille ya tenían aclaramiento de creatinina menor de 90 ml/min/1.73.
El gen JAG1 codifica una proteína de superficie celular que actúa como ligando en la vía de señalización intercelular Notch, mientras el gen NOTCH2 codifica un receptor de la misma. Esta vía de señalización está implicada en la morfogénesis renal, jugando un papel destacado en la segmentación de la nefrona y la diferenciación de las estructuras proximales de la misma. También juega un papel destacado en la regeneración renal tras un episodio de fallo renal agudo.
Respecto al gen NOTCH2 encontramos heterogeneidad genética, dado que mutaciones en el último exón del gen (exón 34) causan una entidad diferente llamada Síndrome de Hajdu-Cheney (OMIM #102500). Es una enfermedad dominante rara caracterizada por osteólisis focal distal (falanges), osteoporosis, caída precoz de dientes y dismorfia craneofacial. A nivel renal puede asociar una displasia quística.
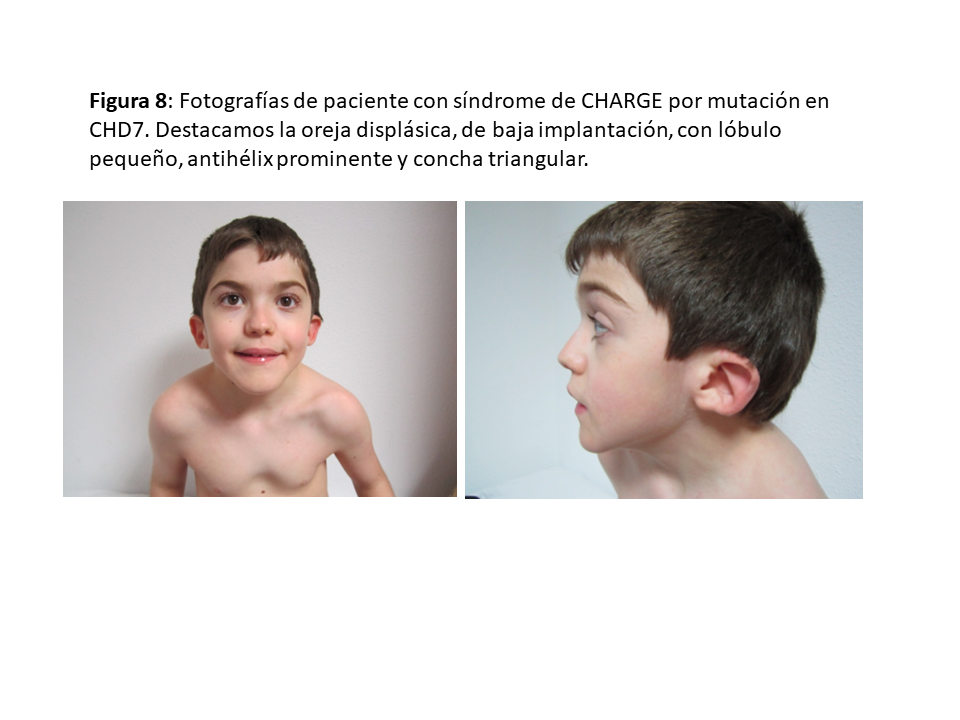
SÍNDROME DE CHARGE (OMIM #214800).
Síndrome con anomalías congénitas múltiples previamente denominado “Asociación CHARGE”. Pasó a denominarse síndrome con la identificación del defecto molecular. En el 65-70% de los casos se produce por mutaciones en el gen CHD7 (chromodomain helicase DNA-binding protein-7) localizado en la banda cromosómica 8q12.1. Es una enfermedad de transmisión autosómica dominante aunque la mayoría de casos son de novo (97%), y la penetrancia es completa. Su incidencia es de 1/12.000-15.000 nacidos vivos.
CHARGE es un acrónimo inglés que describe las principales características clínicas del síndrome (Coloboma of the retina or the iris, Heart anomalies, choanal Atresia, mental Retarded growth and development, Genital and Ear anomalies) (Figura 8). El hallazgo auditivo más predictivo de encontrar mutación en CHD7 es la ausencia o hipoplasia de los canales semicirculares en la resonancia magnética cerebral.
Tras la identificación del defecto molecular el fenotipo se ha expandido encontrando alteraciones renales, patología de nervios craneales, defectos vestibulares, fisura labial y/o palatina, hipotiroidismo, anomalías traqueo-esofágicas y anomalías SNC – epilepsia.
Las anomalías renales aparecen en el 25-40% de los casos, siendo las principales CAKUT descritas la hipoplasia renal, la agenesia renal unilateral, la ectopia renal, los riñones en herradura, la duplicidad ureteral, el reflujo vesicoureteral y la estenosis de la unión pieloureteral.
B. SÍNDROMES DE MICRODELECIÓN CON AFECTACIÓN RENAL
SÍNDROME DE MICRODELECIÓN 22q11.2 (OMIM #188400).
Este síndrome de deleción de genes contiguos es la consecuencia de una pérdida de material genético en el brazo largo del cromosoma 22. Por tanto su herencia es autosómica dominante aunque la mayoría de ocasiones la alteración es de novo (93% de los progenitores no están afectados). Este síndrome incluye a un conjunto de entidades sindrómicas con denominación previa propia pero que refleja distintos fenotipos con una misma causa genética (síndrome de DiGeorge, de Shprintzen..).
Es el síndrome de microdeleción más frecuente en humanos con una incidencia de aproximadamente 1 caso por cada 2.000-4.000 recién nacidos vivos, aunque probablemente sea mayor por el infra diagnóstico de las formas leves.
Las alteraciones renales sólo ocurren en el 30-40% de los casos sin embargo dada su frecuencia es importante el conocimiento de esta entidad en el campo de la Nefrología.
El fenotipo clásico incluye cardiopatía congénita (74%, especialmente anomalías conotruncales), anomalías del paladar (69%), discapacidad intelectual o dificultades en el aprendizaje (70-90%), alteraciones inmunológicas (77%) e hipocalcemia (50%). Los rasgos faciales son muy sugestivos e incluyen hendiduras palpebrales estrechas, raíz nasal prominente con punta bulbosa, narinas pequeñas y antevertidas, retromicrognatia y pabellones auriculares prominentes (Figura 9) [28].
Las manifestaciones renales más frecuentes son la hipodisplasia y la agenesia renal, siendo posibles otras malformaciones urogenitales como los riñones en herradura, displasia multiquística, hidronefrosis, hipospadias, criptorquidia... Su importancia radica en su frecuencia relativa ya que en series de pacientes con CAKUT se detecta esta entidad en un 1.1% de los casos [29], en segundo lugar tras el síndrome de quistes renales y diabetes (HNF1β, 2.2%).
Respecto a las técnicas de laboratorio disponemos del método clásico de FISH (Fluorescent In Situ Hybridization), con poca sensibilidad para deleciones de pequeño tamaño e imposibilidad de medir el tamaño del fragmento delecionado. Las técnicas más habituales en la actualidad son el MLPA o la hibridación genómica comparada (CGH).
Se postula una región crítica dentro del locus 22q11.2 (locus LCR22C-LCR22D), que es una deleción recurrente de 370 kb con genes implicados en el desarrollo renal [29]. Estudios moleculares y funcionales orientan a que la haploinsuficiencia del gen CRKL, es el principal actor genético en los defectos renales detectados en este síndrome [29].
SÍNDROME DE WILLIAMS-BEUREN (OMIM #194050).
El síndrome de Williams es otro síndrome de deleción de genes contiguos secundario a una deleción en heterocigosis en el locus 7q11.23. Tiene una incidencia de 1 caso por cada 7.500 recién nacidos vivos [30].
Esta deleción es habitualmente de 1.5-1.8 Mb y suele afectar a 28 genes. Aunque su herencia teórica es autosómica dominante, los afectados no suelen reproducirse por lo que la inmensa mayoría de los casos son de novo.
La deleción del gen de la elastina (ELN) explica la afectación cardiovascular. Se define como una arteriopatía por elastina con posibles estenosis en cualquier arteria del organismo. Las manifestaciones más frecuentes son la estenosis aórtica supravalvular (75% casos), la estenosis pulmonar periférica, la estenosis de la aorta abdominal y la afectación renovascular con hipertensión arterial secundaria. La hipertensión arterial está presente en un 50% de los casos [31]. Además, existe afectación del tejido conectivo con posibilidad de hernias, divertículos, hiperlaxitud articular, piel suave y laxa.
La mayoría de pacientes tienen discapacidad intelectual variable, desde formas leves a graves. Se describen como personas con personalidad muy sociable, siendo extraordinariamente amigables, cariñosos, empáticos, pero con problemas de ansiedad, fobias y atención.
Los rasgos faciales son característicos, con “cara de duende” consistentes en frente amplia, estrechamiento bitemporal, plenitud periorbitaria, nariz corta, filtrum largo, labios gruesos, boca ancha, mandíbula pequeña y pabellones auriculares grandes. El patrón de iris estrellado es característico.
Hay retraso en el crecimiento con talla baja y existe la posibilidad de anomalías endocrinológicas como pubertad precoz, hipotiroidismo, diabetes, hipercalcemia e hipercalciuria. La hipercalcemia es idiopática y se presenta en el 10-50% de los pacientes, siendo más frecuente en los primeros dos años de vida. En consecuencia se recomienda despistaje de hipercalcemia cada 4-6 meses en los primeros dos años de vida y posteriormente de forma anual. Asimismo se recomienda despistaje de hipercalciuria anual a todas las edades, sin embargo la nefrocalcinosis es rara (5-10%). Se deben evitar los suplementos con vitamina D en estos pacientes.
La presencia de CAKUT se describe en el 18-29% de los síndromes de Williams con posibilidad de anomalías en la posición, agenesia renal, hipoplasia renal, displasia renal, anomalías de vías y divertículos vesicales con posible disfunción vesical. El diagnóstico genético es similar a otros síndromes de microdeleción, basándose en técnicas de FISH, MLPA o CGH.
C. SÍNDROMES HEREDITARIOS CON PREDISPOSICIÓN A TUMORES RENALES
Los síndromes hereditarios con predisposición a tumores renales más característicos son la esclerosis tuberosa, el síndrome de Von Hippel-Lindau, el síndrome de WAGR, el síndrome de Simpson-Golabi-Behmel y el síndrome de Denys-Drash. Dada la incidencia significativa de la esclerosis tuberosa (1 caso cada 5800 recién nacidos) será tratada en un capítulo específico. El síndrome de Denys-Drash se tratará en el capítulo de los síndromes nefróticos congénitos. Este síndrome está causado por mutaciones en heterocigosis en los exones 8 y 9 del gen WT1, y cursa con fallo renal precoz por esclerosis mesangial difusa, anomalías genitales y riesgo de tumor de Wilms.
SÍNDROME DE VON HIPPEL-LINDAU (OMIM #193300).
Enfermedad genética con predisposición a tumores benignos y malignos, secundaria a una mutación en heterocigosis en línea germinal del gen supresor de tumores VHL, localizado en el locus 3p25.3. La transmisión es autosómica dominante con una alta penetrancia y una expresividad variable. El 80% de los casos la mutación es heredada de un progenitor. La mutación puntual es más frecuente que la deleción del gen (89% frente al 11%). La patogénesis molecular de esta enfermedad requiere la inactivación de la expresión del segundo alelo del gen VHL (modelo del segundo hit); bien mediante variantes patogénicas o deleciones somáticas del citado alelo, o bien por medio de una hipermetilación de su promotor que provoque una pérdida de expresión del mismo.
La incidencia es de 1 caso por cada 36.000 recién nacidos y la edad media de presentación son los 26 años.
La lesión típica del síndrome es el hemangioblastoma en sistema nervioso central, presente hasta en un 60-80% de los pacientes. El 80% de estos tumores benignos se sitúan en cerebro, con predominio infratentorial (hemisferios cerebelosos), y un 20% se sitúan en la médula espinal. Pueden ser asintomáticos o bien causar síntomas compresivos, variables según la localización. Otra localización típica es la retina, hasta en un 70% de los casos, con posibilidad de pérdida de visión por desprendimiento de retina, edema macular o glaucoma.
A nivel renal los quistes renales múltiples son frecuentes (70%), y habitualmente aparecen en la edad adulta. Existe un riesgo alto de carcinoma renal (70% a los 60 años de vida), especialmente el subtipo de células claras, siendo el tamaño del carcinoma renal mayor de 3 cm un factor pronóstico desfavorable.
A nivel tumoral también existe riesgo de feocromocitoma, paraganglioma, tumores neuroendocrinos pancreáticos y tumores del saco endolinfático. Otras lesiones posibles son los quistes de páncreas y epididimarios.
Las guías de vigilancia de 2020 de la Alianza del Von Hippel-Lindau (VHL Alliance), establecidas por consenso de expertos, proponen un cribado precoz, iniciado en la edad pediátrica. https://www.vhl.org/clinicians/surveillance/
SÍNDROME DE WAGR (OMIM #194072).
Síndrome de deleción de genes contiguos consistente en una pérdida de material en el locus 11p13, que provoca la deleción en heterocigosis de los genes WT1 y PAX6, entre otros. La enfermedad es rara afectando a 1 caso por cada medio millón de habitantes. La transmisión teórica es autosómica dominante pero la mayoría de casos son de novo, ya que habitualmente estos pacientes no suelen reproducirse.
Las características clínicas están representadas en el acrónimo WAGR: Wilms tumor, Aniridia, Genital anomalies, mental Retardation. El gen WT1 codifica un factor de transcripción implicado en el desarrollo renal y gonadal. La pérdida de WT1 conduce a un riesgo elevado de tumor de Wilms, entre un 42.5%-77% de los pacientes, y suele debutar en los primeros años de la vida, el 98% antes de los 7 años [32]. El 47% de los pacientes con tumor de Wilms acaban en enfermedad renal crónica en los 20 años siguientes al diagnóstico [32]. El riesgo de enfermedad renal terminal es mayor en los pacientes con Wilms bilateral (90%) frente al unilateral (36%).
La pérdida del gen PAX6 explica la aniridia, que está presente en prácticamente todos los casos. La aniridia es una enfermedad panocular con posible afectación de córnea, iris, cristalino, retina y nervio óptico. Se describe la aparición de glaucoma y cataratas. Las malformaciones genitales posibles son variadas, como la criptorquidia, el hipospadias, las anomalías de vías urinarias (uretra, uréter), la hipoplasia ovárica y las malformaciones uterinas. Existe riesgo de gonadoblastoma. Un 70% de los casos tienen discapacidad intelectual, de intensidad variable, y es frecuente la asociación de sintomatología psiquiátrica. El diagnóstico genético es similar al resto de síndromes de microdeleción ya descritos. En ocasiones asocia obesidad grave de inicio en la infancia constituyendo el Síndrome WAGRO (OMIM #612469). La deleción del gen BDNF (brain-derived neurotrophic factor) se ha relacionado con la discapacidad intellectual, el autismo [33] y la obesidad en pacientes con WAGR [34].
SÍNDROME DE SIMPSON-GOLABI-BEHMEL (OMIM #312870).
Síndrome de hipercrecimiento de herencia ligada al cromosoma X. El fenotipo no grave (tipo 1), es el más frecuente, y está originado por mutaciones/deleciones en el gen GPC3 (Xq26.2), y en casos raros por duplicaciones amplias del gen GPC4 (Xq26.2). El tipo 2 (OFD1) es una forma grave habitualmente con muerte prenatal. Las mujeres portadoras pueden estar asintomáticas o bien presentar síntomas variables según la inactivación preferencial del cromosoma X.
El síndrome está caracterizado por un crecimiento acelerado pre y postnatal, organomegalia, anomalías craneofaciales (macrocefalia, facies tosca), discapacidad intelectual leve-moderada, susceptibilidad a tumores embrionarios (5-10%) y anomalías congénitas.
Los defectos renales ocurren en la mitad de los pacientes. Se describen anomalías de vías urinarias, displasia renal, displasia renal quística y nefromegalia. Estos pacientes tienen incrementado el riesgo de tumor de Wilms, por lo que en los primeros años de vida deben realizarse ecografías seriadas. GPC3 codifica una glicoproteína heparan sulfato de la superficie celular extracelular (glipican 3) que controla el crecimiento celular. Su inactivación explica el sobrecrecimiento somático y la displasia renal quística [35].
D. ASOCIACIONES CON AFECTACIÓN RENAL DE PROBABLE CAUSA GENÉTICA.
ASOCIACIÓN VACTERL (OMIM #192350).
Asociación de anomalías congénitas múltiples con una incidencia de 1/10.000-40.000 nacidos vivos [36]. El diagnóstico es de exclusión y la sospecha clínica se establece ante la presencia de al menos tres de las malformaciones congénitas típicas definidas en el acrónimo VACTERL (Vertebral defects, Anal atresia, Cardiac defects, Tracheo-Esophageal fistula, Renal anomalies, and Limb abnormalities).
Existe una amplia variabilidad clínica respecto a las anomalías renales, que por otra parte son frecuentes, (50-80%). Varían desde agenesia renal, ectopia renal, riñones en herradura, hipodisplasia renal, displasia quística y anomalías de vías urinarias y/o genitales.
En la actualidad su presentación habitual es esporádica y su etiología es desconocida, aunque se han planteados múltiples causas ambientales y/o genéticas. La presencia de casos familiares sugiere la posibilidad de factores hereditarios.
ASOCIACIÓN MURCS (OMIM #601076).
También denominada síndrome de Mayer-Rokitansky-Küster-Hauser tipo 2. Es una asociación de anomalías congénitas múltiples de prevalencia desconocida, definida por el acrónimo MURCS (MÜllerian duct aplasia, Renal agenesis, Cervicothoracic Somite dysplasia).
Las pacientes tienen amenorrea primaria por una alteración en el desarrollo de las estructuras derivadas del conducto de Müller que provoca una aplasia o hipoplasia de útero y de los 2/3 superiores de la vagina. Los genitales externos son normales y el desarrollo de caracteres sexuales secundarios es normal lo que nos ayuda a diferenciar del Síndrome de Turner (monosomía X) donde no están presentes por el fallo ovárico.
Asocian malformaciones renales en el 40% de los casos [37], especialmente agenesia renal unilateral. También se describen anomalías de la posición renal, hipoplasia renal y dilatación de vías excretoras.
Las anomalías esqueléticas principales afectan a vértebras cervicales con presencia de fusión (posible síndrome de Klippel-Feil), hemivértebras, costilla cervical, escoliosis… Además pueden presentar talla baja y asimetría facial.
Inicialmente se planteó la hipótesis de una enfermedad esporádica con posible origen ambiental, consistente en un fallo en el desarrollo del mesodermo intermedio con defectos en el desarrollo los somitas cérvico-torácicos y del pronefros. Actualmente se postula que el origen es genético, siendo una enfermedad dominante de penetrancia incompleta y expresividad variable.
E. OTROS SÍNDROMES HEREDITARIOS CON POSIBLE AFECTACIÓN RENAL
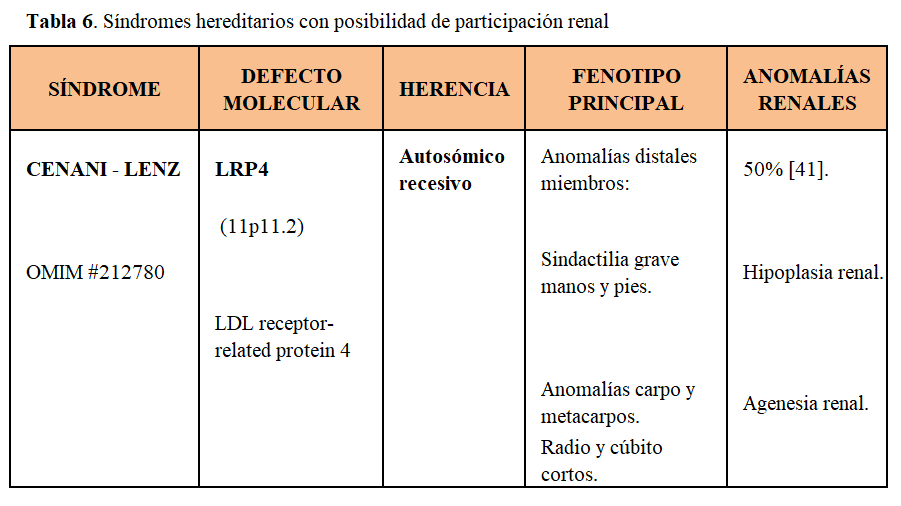
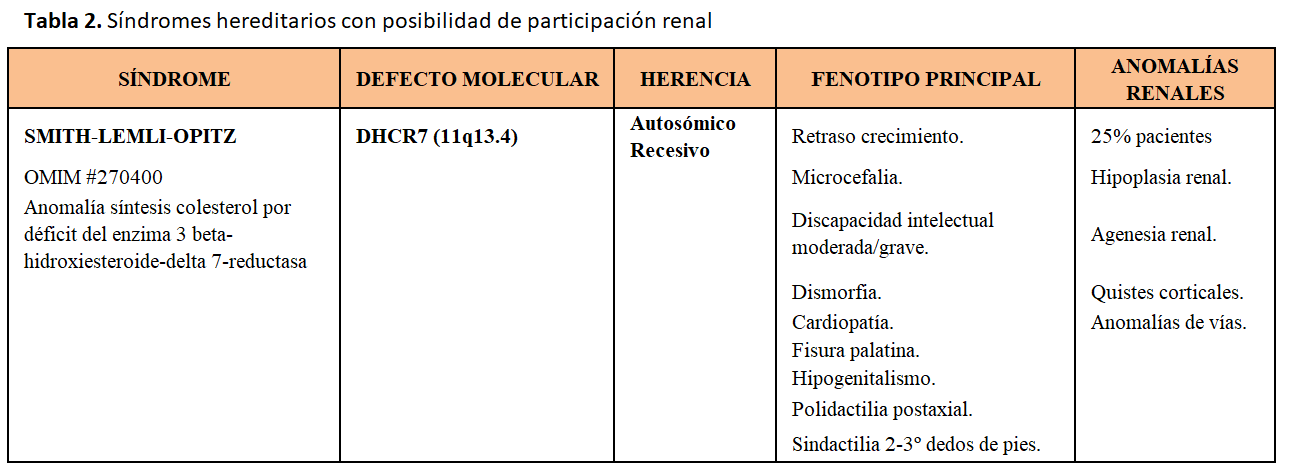
Dado que el número de síndromes hereditarios con posibilidad de afectación renal es extremadamente amplio, en los apartados anteriores hemos querido destacar las enfermedades más significativas en el campo de la Nefrología. En las siguientes tablas: (Tabla 1) (Tabla 2) (Tabla 3) (Tabla 4) (Tabla 5) (Tabla 6) (Tabla 7) (Tabla 8) (Tabla 9) resumimos las principales características de algunos otros síndromes hereditarios con posibilidad de participación renal.
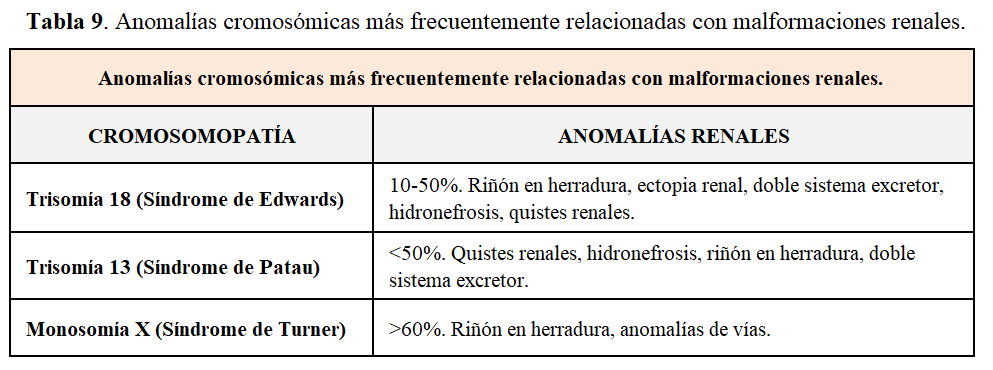
F. CAKUT EN ANOMALÍAS CROMOSÓMICAS NUMÉRICAS.
Las anomalías cromosómicas numéricas están asociadas frecuentemente a CAKUT. Los síndromes de Edwards, de Patau y de Turner son los más significativos (Tabla 9). No los incluimos dentro de los síndromes hereditarios al ser casos de novo. En los dos primeros síndromes la supervivencia es muy escasa, de hecho la mayoría mueren prenatalmente. En el Síndrome de Turner la disgenesia ovárica con ausencia de células germinales es la norma. Respecto a las anomalías renales del síndrome de Down se dispone de un capítulo específico en este tratado electrónico.
V. CONCLUSIONES.
Los síndromes hereditarios con afectación renal constituyen un grupo heterogéneo de enfermedades raras con morbilidad significativa y de diagnóstico complejo. Las anomalías estructurales y funcionales del sistema urinario condicionan en muchos casos la presencia de una enfermedad renal crónica. El manejo clínico de estos pacientes requiere un abordaje multidisciplinar. El conocimiento de estas enfermedades por parte del Nefrólogo va a permitir mejorar la detección clínica, diseñar programas de seguimiento específico, prever complicaciones y realizar un asesoramiento genético planteando las opciones reproductivas familiares.