Cistinuria
Palabras clave
Cistina, Cistinuria, SLC3A1, SlC7A9, modelos animales en ratón, litiasis, tratamiento
Introducción
La cistinuria es una enfermedad hereditaria de carácter autosómico recesivo (OMIM 220100) y parcialmente dominante (OMIM 600918). Se caracteriza por un defecto en la reabsorción de cistina y aminoácidos dibásicos (lisina, arginina y ornitina) a nivel del borde en cepillo de la porción proximal del túbulo renal y en las células epiteliales del tracto gastrointestinal. El exceso de cistina urinaria y debido a su gran insolubilidad a pH ácido genera la formación de litiasis urinaria de cistina [1].
Epidemiología
La cistinuria tiene una prevalencia promedio en neonatos de 1/7.000 nacidos vivos, pero con una gran variabilidad geográfica, así los valores oscilan de 1/2.500 en neonatos judíos-libios a 1/100.000 en Suecia. La litiasis urinaria de cistina es uno de los tipos de enfermedad litiásica renal más infrecuentes, con una prevalencia entre el 1 y 3% del total de las litiasis urinarias [2] [3].
Base genética de la cistinuria.
Estado actual
El defecto molecular radica en el fallo en un transportador de los aminoácidos mencionados, tanto en las células del borde en cepillo del epitelio del túbulo contorneado proximal renal como en las células epiteliales del intestino delgado. El transportador, formado por dos subunidades proteicas denominadas rBAT y b0,+AT, es el responsable del sistema de transporte denominado b0,+. Ambas subunidades forman un heterodímero en el cual rBAT (clonado en 1992 mediante ensayos de expresión funcional en oocitos de Xenopus laevis [4]) es la cadena pesada y b0,+AT (identificado en 1999 [5]) es la cadena ligera. Ambas están unidas por un puente disulfuro. Este transportador forma parte de la familia de transportadores conocidos como HATs (Heteromeric Amino acid Transporters) y todos sus miembros son intercambiadores obligatorios de aminoácidos [6]. La subunidad ligera es la responsable de la actividad de transporte específica de aminoácido, mientras que la cadena pesada es necesaria para el tráfico del heterodímero a la membrana plasmática.
Nuestro grupo contribuyó al descubrimiento y caracterización de los genes responsables de la síntesis de ambas cadenas. Inicialmente, identificamos (mediante clonaje posicional), el gen que codifica para rBAT, denominado SLC3A1 [7]. Posteriormente, una vez comprobado que no todas las familias ligaban con el primer gen y mediante una búsqueda por todo el genoma con las familias recombinantes, caracterizamos el gen responsable de la síntesis de b0,+AT, denominado SLC7A9 [8]. SLC3A1 se localiza en el brazo corto del cromosoma 2, banda 21 (2p21), mientras que SLC7A9 se localiza en el brazo largo del cromosoma 19, banda 13.1 (19q13.1) [9].
Estructuralmente, SLC3A1 ocupa 45 kb de DNA genómico y tiene 10 exones. Todos los lugares de splicing cumplen la regla GT/AG. El gen SLC7A9 abarca unos 32,33 kb de DNA genómico y presenta 13 exones [10].
Hasta la fecha, en la Human Gene Mutation Data Base (HGMD) se han descrito unas 247 mutaciones en SLC3A1 y unas 160 en SLC7A9 [11], si bien existe aproximadamente, un 5% de los pacientes en los que falta uno o dos alelos por caracterizar [12].
Clasificación
En 1966 Rosemberg y cols [13], clasifican la cistinuria en tres tipos (tipo I, II y III) en relación con la excreción de cistina en heterocigotos, en la respuesta plasmática a la sobrecarga oral de cistina y en la actividad de transporte intestinal de cistina, lisina y arginina. Así, los heterocigotos de tipo I presentan un patrón de excreción de aminoácidos normal, los de tipo II presentan cistin-lisinuria (en muchos casos están elevados los cuatro aminoácidos) y en el tipo III la elevación de aminoácidos está presente, pero es cuantitativamente menor que los de tipo II.
En 2002 propusimos una nueva clasificación basada en datos genéticos, así definimos cistinuria de tipo A, aquella debida a mutaciones en el gen SLC3A1 (genotipo AA) y de tipo B en el caso de cistinuria debida a mutaciones en el gen SLC7A9 (genotipo BB) [14]. Algo menos de un 2% de los pacientes presentan una mutación en cada uno de los genes de cistinuria, pero únicamente se dan cálculos si dos copias de uno de los genes están mutadas (AAB o BBA) [15], lo que nos hizo afirmar que no existía digenia en la cistinuria humana, al contrario de lo que ocurre en la cistinuria murina [16].
La correlación genotipo/fenotipo, es decir, las alteraciones clínicas asociadas a una mutación en concreto, no está claramente establecida. No se han estudiado funcionalmente todas las mutaciones descritas, por lo tanto, es imposible predecir el curso clínico de la enfermedad en la mayoría de los casos. Si parece bastante claro que la presencia de al menos una mutación de tipo cambio de sentido en SLC3A1 se asocia a niveles bajos de lisina, arginina y ornitina, pero no para cistina, ni implican una peor evolución de la enfermedad, al compararlas con valores resultantes de otro tipo de combinación de mutaciones [17]. Se han aplicado métodos computacionales para estudiar el efecto de las mutaciones a partir de la integración de información de estructuras modeladas y datos clínicos, pero los resultados requieren ser validados en una cohorte más grande [18]. Recientemente, se ha podido obtener la estructura del transportador b0,+AT-rBAT con alta resolución mediante criomicroscopía electrónica [19] [20], la cual incrementa los conocimientos estructurales que tenemos del transportador y permitirá estudiar el efecto de las mutaciones en los genes que lo codifican.
En 2016, conjuntamente con los grupos del Dr Palacín y el Dr Yakamori, describimos un nuevo transportador de cistina localizado en el segmento S3 del túbulo proximal renal AGT1 (SLC7A13), que se une a rBAT como subunidad ligera. Este compuesto rBAT/AGT1 es el responsable de la reabsorción del 10% de cistina que queda después de la actuación de b0,+AT/rBAT [21], abriendo la puerta a que pudiese ser un nuevo gen de cistinuria. El análisis de dicho gen (SLC7A13) en 17 pacientes cistinúricos con alelos por caracterizar, parece descartar que así sea, de acuerdo con los datos publicados recientemente [22]. De todos modos, nuestro grupo ha analizado 8 familias con individuos que tenían dos o un alelo por caracterizar y hemos encontrado en 5 de ellas una misma mutación en heterocigosis en AGT1 (SLC7A13) que según los programas de predicción sería maligna [23]. Por lo tanto, se necesitan investigaciones funcionales de dicho cambio, para acabar de confirmar si se trata de un nuevo gen responsable de cistinuria o será, uno de tantos genes, moduladores del fenotipo litiásico.
Modelos animales
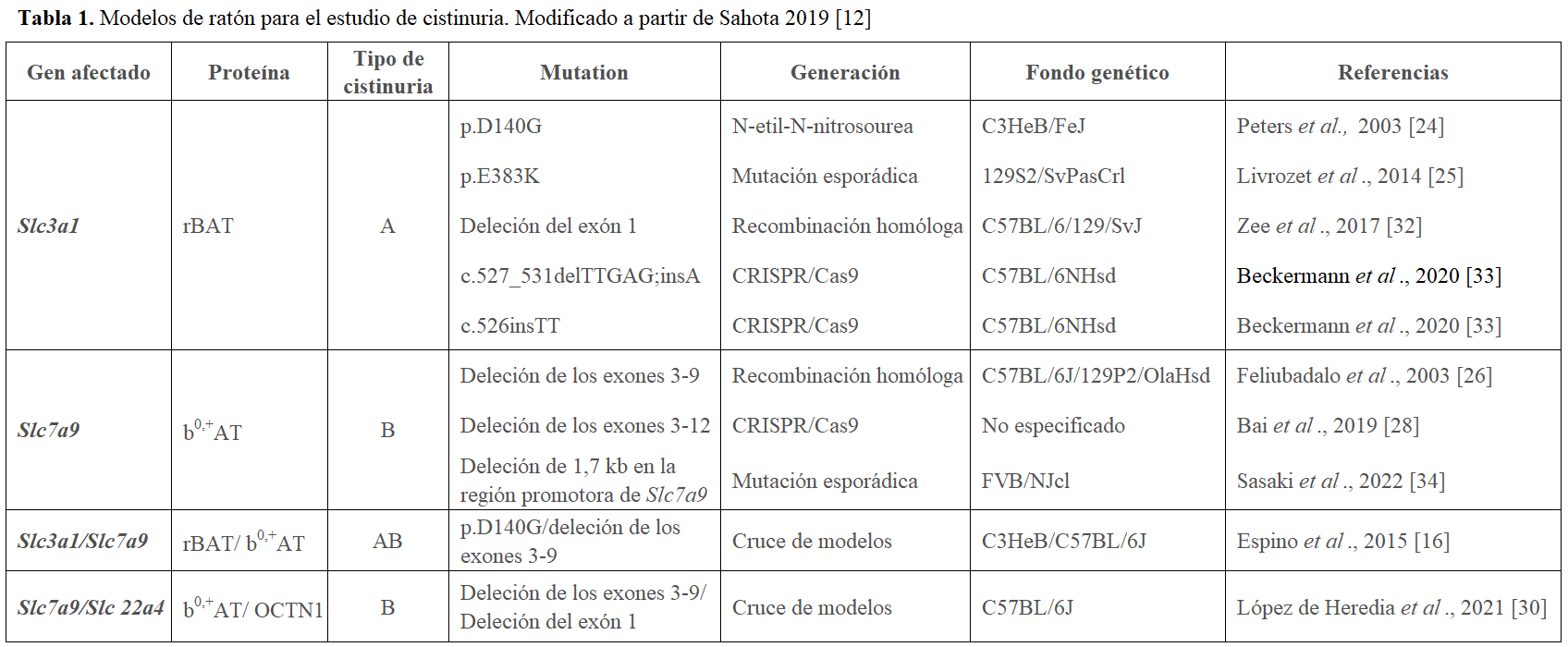
Hasta la fecha se han descrito 8 modelos de ratón que mimetizan los fenotipos en los pacientes cistinúricos, cinco para la cistinuria de tipo A y tres para la de tipo B (Tabla 1). Así, los modelos de ratón con dos alelos mutantes para Slc3a1 hiperexcretan significativamente cantidades elevadas cistina, ornitina, lisina y arginina [24] [25] siendo la excreción de estos aminoácidos en los ratones heterocigotos indistinguible de los wild type [24]. En los modelos Slc7a9 tambien se observa una hiperexcreción significativamente muy elevada de los aminoácidos cistina, ornitina, lisina y arginina en aquellos animales con ambas copias mutadas [26] [27]. De manera similar a los humanos, los heterocigotos para SLC7A9 muestran una moderada, pero significativa hiperexcreción de estos aminoácidos [26] [27].
Con respecto al fenotipo litiásico, animales de todos los modelos descritos hasta la fecha producen cálculos de cistina en el sistema urinario, mayoritariamente en la vejiga, aunque también se dan casos de cálculos localizados en la uretra y en los riñones [28], con diferentes porcentajes de animales litiásicos dependiendo del gen afectado, el fondo genético y el sexo (se detalla en el próximo apartado).
También, en nuestro grupo generamos el modelo de ratón para el tipo de cistinuria AB cruzando ratones de ambos tipos, observándose la formación de piedras de cistina en un 4% de los animales doble heterocigotos [16]. Esto sugiere la existencia de una leve digenia en los ratones, aunque los casos de pacientes publicados hasta la fecha con cistinuria de tipo AB han resultado tener dos copias mutadas para uno de los genes y una copia mutada para el otro (genotipos ABB o AAB) [14] [16] [17] [29].
Recientemente, hemos publicado la generación de un nuevo modelo de cistinuria tipo B cruzando nuestro modelo Slc7a9-/- con el modelo knock-out para el transportador de L-Ergotioneína, OCTN1 (Slc22a4) [30]. Este modelo doble mutante Slc7a9-/- Slc22a4-/- presenta, tanto en machos como en hembras, una tasa de formación de piedra un 10% superior al mutante simple Slc7a9-/- a los 3 meses de edad, revelando el papel modulador de OCNT1 en la cistinuria.
Finalmente, destacar la reciente generación del primer modelo de cistinuria de tipo B en ratas Sprague Dawley, delecionando 7 pb en el exón 3 mediante CRISPR-Cas9 [31]. Este modelo presenta hiperexcreción de cistina y cristaluria a los 6 meses de edad, pero no se observa formación de litiasis de cistina.
Diferencias asociadas al sexo, fondo genético y dieta
Los hombres suelen tener el primer episodio litiásico a menor edad y un mayor número de episodios litiásicos que las mujeres [35]. En este sentido, los modelos animales presentan algunas diferencias con respecto a lo observado en los pacientes. Así en los modelos de cistinuria de tipo A se ha descrito un retraso en la formación de los cálculos en las hembras con respecto a los machos en el modelo Slc3a1D140G [24], en el modelo Slc3a1E383K se observan cálculos sobre todo en los machos [25], en las hembras del modelo Slc3a1-/- solo se observan litiasis de cistina a partir de los 18 meses de edad [12] y, en los modelos originados mediante CRISPR/Cas9, las hembras no forman cálculos o en un porcentaje muy inferior a los machos (20% vs 90%) [33], aunque en todos los modelos descritos las hembras presentan hiperexcreción de cistina. Curiosamente, el modelo Slc3a1D140G en un fondo genético distinto (C57BL/6J) no muestra diferencias en la proporción de machos y hembras con litiasis (López de Heredia y Nunes, observación no publicada).
En relación a los modelos de cistinuria de tipo B, en el modelo Slc7a9-/- generado por recombinación homóloga no se describieron diferencias entre sexos [26], pero en el originado esporádicamente, se observa en las hembras un 50% menos de formación de cálculos que los machos, aunque ambos presentan un 100% de cristaluria [34]. Sin embargo, el primer modelo en un fondo genético distinto (C57BL/6J) muestra una mayor proporción de hembras que de machos con litiasis (López de Heredia y Nunes, observación no publicada). Además, al estudiar la tasa de formación de piedra del modelo Slc7a9-/- en fondo genético puro C57BL/6J o mixto C57BL/6J/129 y C57BL/6J/C3H, se observó una tasa del 37%, 82% y 92%, respectivamente, evidenciando la importancia del fondo genético [36]. Algo similar se ha detectado en un modelo de hiperoxaluria primaria de tipo I, ya que se observó una tasa de formación de cálculos del 53% en machos en fondo genético mixto 129/SvxC57BL/6, mientras que en fondo genético puro C57BL/6, la tasa disminuyó al 0%, confirmando el efecto antiagregante de este fondo genético [37]. Estos resultados indican la existencia de factores moduladores de la litiasis relacionados con el sexo y con el fondo genético, afectando la agregación de los cristales de cistina.
La variabilidad descrita entre los distintos modelos también podría estar influida por la dieta o por la interacción dieta-fondo genético, aunque es difícil evaluar el posible efecto al no haberse descrito en muchos casos la dieta suministrada. Tan solo se han publicado resultados con el modelo Slc3a1-/- en el que se observan que, en una dieta con mayor proporción de cistina, sodio y materia grasa con menor proporción de proteínas, el 100% de los machos presentan un fenotipo litiásico a las 28 semanas frente al 42% en la dieta estándar [38]. Tampoco hay estudios clínicos que evalúen sistemáticamente el efecto de la dieta en la presentación fenotípica de la cistinuria. Estudios limitados a un número reducido de pacientes cistinúricos han mostrado que se reduce la excreción de cistina con una dieta en la que se sustituya la mayor parte de la proteína animal por la vegetal [39], en una dieta ovolactovegetariana [40], reduciendo la ingesta de sodio [41] [42] o suministrando glutamina en una dieta rica en sodio [41].
En los modelos, Slc7a9-/- y Slc3a1D140G, se desarrollan ambos tipos de litiasis cistina Va y Vb, apreciándose diferencias en la proporción de cada tipo de cálculo según el sexo, siendo mayoritaria la de tipo Va en hembras y la Vb (cistinuria asociada a alcalinización urinaria excesiva) en machos. Así mismo, encontramos en aproximadamente un 3% de los ratones un tipo mixto en la que se desarrolla una piedra de cistina de tipo Va de tamaño considerable y unas de tipo Vb mucho más pequeñas (López de Heredia y cols., observaciones no publicadas). Daudon y colaboradores sugieren que el tipo morfológico de piedra de cistina desarrollado por los pacientes depende de factores ambientales como la dieta o un deficiente manejo de la enfermedad [43], aunque los datos anteriores sugieren que el tipo de piedra podría estar afectado por factores genéticos o fisiológicos relacionados con el sexo.
En conjunto, todos estos datos sugieren la existencia de genes y/o compuestos moduladores del fenotipo litiásico, aunque todavía no se ha descrito ninguno. Además, se da una alta variabilidad en la presentación de la cistinuria entre pacientes, incluso en hermanos con la misma mutación [14]. Resultados preliminares del grupo en ratones sugieren que AGT1 y OCTN1 podrían estar modulando la litiasis de cistina. AGT1, el segundo transportador de cistina en el túbulo proximal, debido a que los ratones cistinuricos que lo expresan presentan una mayor reabsorción de cistina y una menor tasa de formación de piedra [23]. OCTN1, el transportador de L-Ergotioneína, debido a que los ratones cistinúricos que no lo expresan presentan una mayor tasa de formación de piedra [30].
Nuevas terapias
Los modelos animales anteriormente descritos son muy útiles para evaluar posibles tratamientos, lo que se ha demostrado para el modelo Slc7a9-/- [44]. Actualmente, se están probando dos líneas de actuación para nuevos tratamientos en cistinuria. Por un lado, se están utilizando nuevos compuestos para inhibir el crecimiento de los cristales de cistina cómo ésteres [45] o diamidas de la L-cistina [46] en el modelo Slc3a1-/- . Por otro, se están investigando compuestos antioxidantes como el ácido α-lipoico del que se ha descrito que es capaz de inhibir el crecimiento del cálculo de cistina en el modelo Slc3a1-/- [32] y el ácido salvianólico que reduce el riesgo de la formación de cristales de cistina en el modelo Slc7a9-/- [47]. Nuestro grupo ha encontrado otro antioxidante, la L-Ergotioneína, capaz de retrasar la aparición y disminuir la proporción de ratones litiásicos en el modelo Slc7a9-/-, designada recientemente medicamento huérfano para la cistinuria por la Agencia Europea del Medicamento (EU/3/21/2445). También hay trabajos encaminados a corregir el gen Slc7a9 en ratones KO, aunque las dificultades para sortear el tamaño del vector y la inmunidad innata frente a los vectores están dificultando su avance [28]. De todos modos, las características de la cistinuria hacen de ella una enfermedad que puede ser abordada con terapia génica debido a que se puede considerar monogénica (solo un gen afecto por paciente), el defecto se sitúa en el túbulo proximal en el cual es relativamente fácil la llegada de los vectores con el cDNA corregido y no es necesario corregir totalmente la expresión del transportador, ya que con una mejora de la reabsorción de cistina que mantenga los niveles por debajo del umbral de precipitación sería suficiente [48].
En cuanto a la clínica, en los últimos años se ha completado un ensayo clínico para optimizar la administración de D-penicilamina y tiopronina que concluye que a dosis bajas (1 g/día) podrían reducir los efectos adversos sin reducir el efecto esperado [NTC03663855] [49]. También, ha finalizado un ensayo clínico ideado para comprobar el efecto diurético del Tolvaptán (un antagonista de la vasopresina) en 4 pacientes con cistinuria, en el cual observaron una menor concentración y un incremento de la capacidad de cistina en las orinas [NCT02538016] [50]. En fase 2, hay un ensayo clínico para validar el tratamiento con α-lipoico [NCT02910531], evaluar el efecto del compuesto di-tiol bucilamina [NCT02942420] y de la administración de alcalinizantes de la orina en gránulos diseñados para propiciar una absorción lenta y continua [NCT04147871]. Por último, recientemente se ha iniciado el reclutamiento de pacientes para un estudio preliminar para estudiar el efecto en la formación de cálculos de cistina al inhibir el cotransportador de sodio-glucosa tipo 2 [NCT04818034].
Direcciones futuras
El desarrollo de cálculos renales es el fenotipo clínico que más problemas causa a los pacientes cistinúricos. Esta presentación fenotípica de la cistinuria puede llegar a ser muy variable, sobre todo en lo referente a la edad de aparición del primer cálculo, así como en la recurrencia de la litiasis. De hecho, se ha observado que, a pesar de excretar más cistina que los varones, las mujeres presentan una menor recurrencia en la formación de piedras, probablemente debido a la mayor solubilidad de la misma [51].
Dado que la severidad del fenotipo clínico no puede ser explicado solo por la cantidad de cistina excretada, se hace necesaria la búsqueda de esos factores implicados en la modulación de este fenotipo, tanto genéticos como ambientales. Además, la formación de cálculos de cistina se puede separar en dos procesos, la nucleación y el crecimiento de los cristales y su agregación para formar el cálculo. Es por tanto necesario delimitar y caracterizar los factores específicos involucrados en cada una de las etapas de la formación de las piedras de cistina. Sin duda alguna, la utilización de abordajes ómicos a partir de muestras obtenidas tanto de los modelos animales anteriormente citados como de pacientes y la integración de estos resultados con una clasificación fenotípica detallada de los pacientes cistinúricos puede permitir la identificación de estos factores. Las tres aproximaciones proteómicas en orinas de pacientes cistinúricos realizadas hasta la fecha evidencian defectos en el transporte de membrana renal y procesos inflamatorios, fibrosis y estrés oxidativo en el sistema urinario [52] [53] [54]. En el modelo de rata, han realizado un análisis transcriptómico y lipidómico del córtex renal, y los resultados confirman lo observado en pacientes: alteraciones en la membrana plasmática, en el metabolismo del glutatión (GSH) y en la composición lipídica del córtex renal, las cuales sugieren que son consecuencia de la inflamación y el estrés oxidativo [31] [55]. En ratón, se ha llevado a cabo un estudio proteómico de la composición de los cálculos de cistina a lo largo de su crecimiento en el modelo Slc3a1-/- en el cual demuestran la presencia de componentes orgánicos en la matriz de los cálculos, la cual varía según aumenta el tamaño del cálculo y en las primeras etapas de formación de este, está compuesta por proteínas ribosomales y factores metabólicos de origen mitocondrial (cadena de transporte de electrones y Ciclo de Krebs) [56].
El resultado de estos primeros estudios ómicos junto con los efectos beneficiosos observados con los tratamientos antioxidantes sugieren una alteración del estado oxidativo en la cistinuria. La cisteína es el precursor limitante en la síntesis del GSH, el principal antioxidante en las células, y en leucocitos de pacientes cistinuricos se han observado niveles inferiores que en controles sanos [57]. Además, tanto en muestras de sangre de pacientes como en riñones de modelos de ratón de cistinuria se han observado otras alteraciones relacionadas con el estado oxidativo, como una baja actividad de las enzimas antioxidantes superóxido dismutasa (SOD) y glutatión peroxidasa (GPx), y un aumento de peroxidación lipídica [47] [58].
Incrementar el conocimiento sobre el defecto oxidativo y el efecto de los antioxidantes, así como del resto de vías alteradas descritas, permitirá comprender mejor las bases de la enfermedad, optimizar el tratamiento de los pacientes y proponer nuevas aproximaciones terapéuticas y/o biomarcadores que mejoren el pronóstico y la calidad de vida de estos pacientes. En este sentido, nuestro grupo ha identificado que la ratio entre la L-Ergotioneína y su metabolito S-Metil-L-Ergotioneína es un marcador que permite discernir entre aquellos ratones que tienen cálculos de los que no [30], el cual queremos validar en pacientes cistinúricos.
Clínica
La manifestación clínica más conocida de la cistinuria es el desarrollo de litiasis urinaria de cistina. Litiasis urinaria de cistina puede ser causa de dolor lumbar y/o cólico nefrítico, infección urinaria, hematuria, obstrucción de la vía urinaria, pielonefritis aguda o insuficiencia renal [1] [2].
Se ha descrito otra manifestación clínica infrecuente que es el síndrome de hipotonía-cistinuria. Es un síndrome de deleción génica contigua homocigótica que elimina parte o la totalidad de los genes SLC3A1 y PREPL, asociado con cistinuria de tipo A. Se caracteriza por hipotonía, dismorfia facial menor y déficit de la hormona del crecimiento [59] [60] [61].
Por otra parte, la detección de un colon hiperecoico en el examen rutinario ecográfico antes de las 36 semanas de gestación es sugestivo de cistinuria con un elevado valor predictivo [62] [63] [64].
Diagnóstico
Muchos pacientes son diagnosticados de cistinuria a partir de la presencia de cistina en el estudio cristalográfico del cálculo urinario expulsado espontáneamente o extraído mediante cirugía. El diagnóstico cristalográfico se realiza mediante la observación microscópica del cálculo (tipo Va: color amarillo-marrón, superficie granular y estructura radial). Esta morfología puede variar si el paciente está sometido a tratamiento alcalinizante, en este caso la superficie del cálculo es lisa o finamente rugosa debido a la incorporación en su periferia de cierta cantidad de fosfato cálcico y puede observarse una reducción del tamaño de los cristales de cistina (tipo Vb). Para un correcto análisis o determinación de la composición del cálculo se utiliza la espectrofotometría infrarroja [65] [66] [67].
La presencia de cristaluria cistínica (cristal de forma hexagonal) en el examen microscópico de la primera orina de la mañana, se considera patognomónica de la enfermedad [68].
El diagnóstico de cistinuria puede ser confirmado con la detección de niveles elevados de cistina y aminoácidos básicos en orina de 24 horas mediante cromatografía de intercambio iónico y/o espectrometría de masas [69] [70].
El test de cianida nitroprusiato ampliamente utilizado años atrás para el diagnóstico de cistinuria se considera actualmente obsoleto debido a su baja reproducibilidad y sensibilidad y por precisar el uso de reactivos peligrosos e inestables [71].
Diagnóstico por la imagen
Las litiasis de cistina suelen ser muy radiotransparentes por lo que la radiología simple de abdomen es de escasa utilidad. El UroTAC sin contraste ofrece alta sensibilidad y especificidad [72]. Actualmente la dosis de radiación suele ser baja, aunque depende del índice de masa corporal del paciente [73]. El uso de las unidades Hounsfield referido al cálculo de cistina es de escaso beneficio, muestran un rango aproximado a las 800 unidades Hounsfield a pesar de que se consideran cálculos de gran dureza [74]. La ecografía también es útil y no irradia [75]. La urografía endovenosa (UIV) se puede utilizar para valorar la funcionalidad renal, grado de obstrucción y como mapeo radiológico de cara a una intervención, aunque su uso está restringido en pacientes con insuficiencia renal [76].
El estudio genético no es necesario para el diagnóstico de la enfermedad, pero se utiliza como consejo genético en los pacientes que lo solicitan (cuando un paciente cistinúrico quiere tener descendencia) y en situaciones de incerteza clínica. También es útil para casos con el diagnóstico prenatal de colon hiperecogénico ya que en estos casos la excreción urinaria de aminoácidos es bastante difícil de interpretar en los primeros meses de vida debido a la inmadurez tubular.
Tratamiento
Tratamiento intervencionista
De modo similar a cualquier tipo de litiasis urinaria, las opciones intervencionistas son la litotricia extracorpórea por ondas de choque (LEOC), la ureteroscopia con lasertripsia (URS) y la nefrolitotomía percutánea (NLP). Estas medidas se aplicarán a los pacientes cistinúricos con recidiva litiásica frecuente, aquellos en los que se observa un rápido crecimiento de los cálculos o en casos de litiasis ureteral obstructiva [77] [78].
Debido a la elevada tasa de recidiva litiásica que presentan los pacientes cistinúricos es importante que, ante cualquier tratamiento intervencionista, no queden restos litiásicos para evitar el rápido crecimiento de los mismos [79]. Por este motivo es preferible la URS con ureteroscopio flexible versus la nefrolitotomía percutánea por ser la primera técnica menos agresiva y evitar en lo posible la lesión urotelial.
A tener en cuenta que la LEOC suele ser poco efectiva debido a la gran dureza de los cálculos de cistina, a pesar de ello puede utilizarse en cálculos de reciente aparición o en aquellos pacientes que no deseen tratamientos invasivos [80] [81] [82].
La URS es el tratamiento de elección en los cálculos calicilares y ureterales menores a 20 mm tanto en pacientes pediátricos como en adultos [83] [84]. La NLP está indicada para los cálculos calicilares mayores de 20 mm [85] [86] [87]. En casos de obstrucción de la vía urinaria por cálculo se derivará la misma mediante la colocación de catéter doble J o sonda de nefrostomía. El tiempo de permanencia de este tipo de catéteres ha de ser corto por el riesgo de calcificación de los mismos (no más de dos semanas) [83].
Tratamiento médico
Hidratación oral.
La ingesta de líquido ha de ser la suficiente como para mantener la concentración de cistina por debajo de 250 mg/L durante 24 horas y con un pH urinario entre 7–7.5. En adultos la cantidad de agua a ingerir suele ser de unos 3 litros para conseguir una excreción de cistina de 1-1.5 gramos/día [88] [89] [90] [91]. En pacientes pediátricos el objetivo es conseguir un volumen urinario de algo más de 2 litros/1.73 m2. Se aconseja a beber agua durante la noche para minimizar el pico de concentración urinaria nocturna de cistina.
Dieta
El paciente cistinúrico debe reducir el consumo de sal. Una dieta baja en sodio disminuye la excreción urinaria de cistina. Es recomendable reducir la ingesta sódica a 1-1,5 mEq/kg (en adultos corresponde a 100 mEq/día ó 6 gr/día de NaCl) [42] [92] [93].
La cistina proviene del aminoácido esencial metionina. La disminución de la ingesta de metionina disminuye la producción de cistina, esta reducción no puede sobrepasar los requerimientos fisiológicos diarios de metionina (1200-1400 mg/día en adultos). Restricción ingesta proteica por debajo 1 g/kg/día (no aconsejable en niños por afectar al crecimiento) [39].
Alcalinización urinaria
Es fundamental mantener el pH urinario entre 7.0-7.5. La solubilidad de la cistina en orina aumenta conforme lo hace el pH. El agente alcalinizante de elección es el citrato potásico a dosis de 60-80mEq/día (60-80 mEq/1.73 m2 en niños). Se debe evitar el uso de bicarbonato sódico por el efecto negativo de la ingesta de sodio [94] [95].
Se ha de monitorizar de manera individual la dosis de alcalinizante para no sobrepasar el pH límite de 7.5 y evitar así la aparición de cristaluria fosfocálcica [96] [97].
También se ha ensayado el uso de acetazolamida como terapia alcalinizante adicional, aunque no suele ser bien tolerada y no se ha demostrado que sea mejor alcalinizante que el citrato potásico [98].
Dada la importancia del control de pH en estos pacientes el uso de un medidor de pH (Lit-ControlRpH Meter) ha demostrado un efecto beneficioso en cuanto a mantener la adherencia del tratamiento alcalinizante crónico en estos pacientes [99].
Agentes quelantes de la cistina
Cuando la hidratación oral, las medidas dietéticas y la alcalinización urinaria no son suficientes para disminuir la concentración urinaria de cistina o aumentar su solubilidad se pueden emplear agentes quelantes de la cistina como la D-Penicilamina o la tiopronina. Estos compuestos escinden la cistina en dos fragmentos de cisteína para formar un compuesto disulfuro mixto. Los complejos cisteína-D-penicilamina o cisteína-tiopronina son hasta 50 veces más solubles que la cistina en orina [3] [14] [100] [101] [102].
El inconveniente del uso de estos fármacos es la elevada tasa de efectos secundarios como disgeusia, lesiones cutáneas, proteinuria por glomerulonefritis membranosa y/o síndrome nefrótico, reacciones hematológicas (neutropenia y trombocitopenia) e insuficiencia renal [103] [104] [105] [106] [107]. Las dosis recomendadas para la tiopronina son de 15-40 mg/kg/día en niños, 800-1500 mg/día adultos y de penicilamina 20-30 mg/kg/día en niños y 1,2 g/día en adultos [89] [96] [101].
Debido a que el tratamiento con D-penicilamina disminuye la actividad de la vitamina B6, se recomienda prescribir suplementos de la misma [108].
Si el paciente cistinúrico es además hipertenso puede tratarse con captopril, conocido inhibidor de la enzima de conversión de la angiotensina. El captopril se une a la cistina formando un complejo que es más soluble que la propia cistina, aunque su efectividad como anticistinúrico disminuye con el tiempo [109] [110].
Actualmente se están ensayando nuevas vías terapéuticas con selenio y las diamidas de L-cistina se han propuesto como inhibidores de la cristalización de L-cistina; en ambos casos no se ha demostrado efectividad en la práctica clínica [111] [112] [113] [114].
Debido al carácter crónico de la enfermedad y a que muchos de los pacientes sufren recidivas litiásicas frecuentes se requiere un seguimiento clínico con una frecuencia variable, que va de los 3 meses al año. Para un correcto control se precisa realizar ecografía renovesical y/o UroTAC sin contraste [84] [91]. La determinación de cristaluria en orina fresca matutina es una buena herramienta para calibrar la actividad litiásica del paciente [68] [115] [116]. El control (auto control) del pH urinario sirve para monitorizar el grado de alcalinización urinaria y por ende reforzar la adherencia al tratamiento alcalinizante [99]. Actualmente la determinación de cistina urinaria no se utiliza como seguimiento clínico de estos pacientes. En el estudio metabólico en orina de 24 horas el nivel de sodio urinario será reflejo del consumo de sal en la dieta, el nivel de urea refleja la ingesta proteica, la presencia de cilindruria y/o proteinuria el grado de afectación parenquimatosa y el nivel de potasio y citrato en orina como ayuda para calibrar la adherencia al tratamiento con citrato potásico. Así una densidad urinaria menor a 1010 nos indica una orina óptimamente diluida.
Complicaciones
El paciente litiásico en general tiene un mayor riesgo de desarrollar insuficiencia renal e hipertensión arterial que la población no litiásica, este riesgo es aún mayor en los pacientes cistinúricos [117] [118].
El paciente cistinúrico suele tener menor calidad de vida que la población general. Al tratarse de una enfermedad crónica muchos pacientes abandonan el tratamiento por considerarlo poco efectivo o mal tolerado [119] [120].
Agradecimientos
Parte de este trabajo ha sido financiado por los proyectos PI16/00267-R-FEDER y PI20/00200-R_FEDER del programa FIS del Instituto de Salud Carlos III a VN, 202025-30 de la Fundació la Marató a VN y SGR2017-191 de la Generalitat de Cataluña a VN. VN agradece el apoyo del programa CERCA de la Generalitat de Cataluña.