Síndrome Nefrótico Corticorresistente, Genético y Familiar
Palabras clave
Glomerulosclerosis segmentaria y focal familiar, síndrome nefrótico congénito
INTRODUCCIÓN
El Síndrome Nefrótico Corticorresistente (SNCR) es una entidad clínica y patológica heterogénea causada por un defecto de la barrera de filtración glomerular (BFG), el endotelio glomerular fenestrado, la membrana basal glomerular y los podocitos, principal componente de la BFG [1][2][3][4][5]. Representa la categoría del síndrome nefrótico idiopático históricamente definida por la falta de respuesta al tratamiento con prednisona. La heterogeneidad de esta entidad, basada en la respuesta terapéutica pero no en su etiología, se explica porque subyacen dos mecanismos distintos en su patogenia: el SNCR inmuno-mediado y el SNCR monogénico. En el SNCR inmuno-mediado existe una alteración del sistema inmunológico con o sin presencia de un factor de permeabilidad circulante, mientras que el SNCR monogénico es consecuencia de mutaciones en los genes estructurales de la barrera de filtración glomerular [6].
La etiología no es completamente conocida, aunque en los últimos 20 años, en los estudios de secuenciación genética de última generación han identificado mutaciones patogénicas en 60 genes críticos para la integridad estructural y funcional del podocito, mutaciones en el gen del colágeno 4, otros genes asociados con formas familiares y sindrómicas de la enfermedad y variantes de riesgo asociadas con glomeruloesclerosis segmentaria y focal como las variantes G1 y G2 de la apolipoproteína L1(APOL1). Estas mutaciones genéticas explican el 30-40 % de SNCR en niños y un porcentaje creciente del SNCR en adultos [7]. Varios autores proponen una reclasificación del SNCR basada en el mecanismo patogénico [8].
En la mayoría de los pacientes, la enfermedad está mediada por una disfunción del sistema inmune de causa desconocida, pero la identificación de una causa monogénica del SNCR permite proporcionar consejo genético, estudio familiar, evitar la inmunosupresión y predecir bajo riesgo de recurrencia de la enfermedad en el trasplante.
El SN es la glomerulopatía más frecuente en pediatría, con una incidencia de 2-7 casos/100.000 niños/año. El 85 % de niños con SN remite con corticoides, pero hasta el 15 % no responde y mantiene proteinuria nefrótica (> 40 mg/m2/hora ó > 3.5gr/día/1,73m2), hipoalbuminemia (< 2.5-3 gr/dl) y edemas [9]. La resistencia a corticoides se asocia con pronóstico desfavorable ya que el 35-50% de pacientes con SNCR progresan a enfermedad renal terminal a los 10 años [10].
La definición de corticorresistencia de mayor consenso en el SN pediátrico es la ausencia de remisión a las 4-6 semanas de corticoterapia diaria e implica mayor probabilidad de glomeruoesclerosis segmentaria y focal subyacente, complicaciones infecciosas, tromboembólicas, hipertensión arterial, hiperlipidemia, desnutrición, hipocrecimiento y progresión a enfermedad renal crónica a los 5-10 años del diagnóstico [11]. En adultos, la duración del tratamiento con corticoides para definir la corticorresistencia es de 16 semanas.
La histología principal en el SNCR en niños y adultos es la glomeruloesclerosis segmentaria y focal (GESF) (con distintos tipos morfológicos y grados de esclerosis, hialinosis segmentaria y fusión de pedicelos podocitarios en diferentes momentos de evolución de la enfermedad), seguida de la enfermedad de cambios mínimos (ECM) y la esclerosis mesangial difusa. La cuestión de si GESF y ECM representan dos fases del síndrome nefrótico idiopático o son entidades distintas no está completamente aclarada. La indicación de biopsia renal en niños con SNCR es unánime, a diferencia del SN corticosensible, cuya lesión subyacente en más del 80 % de los casos es enfermedad de cambios mínimos (ECM) y el diagnóstico es clínico. Los pacientes con ECM tienen en general mejor pronóstico comparados con GESF. En el registro internacional PodoNet, el 79 % de los niños con ECM tienen buen pronóstico frente al 52 % de los niños con GESF [7].
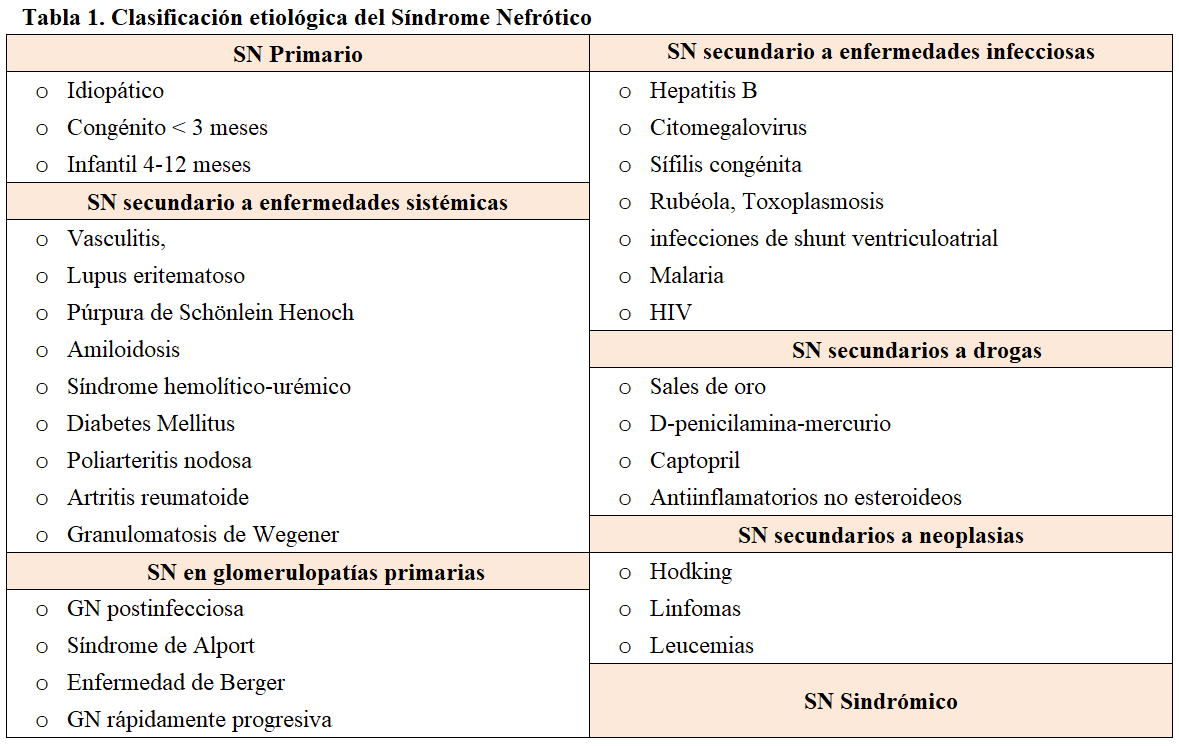
El SN Primario se clasifica en idiopático, congénito e infantil (Tabla 1). La probabilidad de una causa monogénica es mayor en el SNCR que se presenta a edades tempranas. Las alteraciones genéticas explican el 90 % del SN congénito, el 50% del SN infantil y el 10- 30 % de los SNCR idiopáticos no familiares. El SN monogénico se presenta de forma esporádica o familiar y se han identificado formas hereditarias autosómicas recesivas (AR), dominantes (AD), ligadas a X y de herencia mitocondrial.
El mecanismo patogénico del SNCR permite estratificar dos categorías:
1- SNCR monogénico: causado por mutaciones en un solo gen que afecta la estructura de la barrera de filtración glomerular. Se presenta de forma esporádica o familiar y se han identificado formas hereditarias autosómicas recesivas (AR), dominantes (AD), ligadas a X y de herencia mitocondrial. La resistencia a corticoides y otros imunosupresores es significativamente mayor en pacientes con SNCR genético comparado con SNCR no genético. Por el contrario, el riesgo de recidiva postrasplante es menor en el SNCR genético
2- SNCR inmuno-mediado determinado por disfunción inmunológica, activación de linfocitos T y B con o sin factores circulantes liberados por las células inmunes u otros factores de permeabilidad que dañan la BFG. Los mecanismos inmunológicos predominan en el SN idiopático corticosensible con histología de enfermedad de cambios mínimos y explicarían la recurrencia postrasplante en el SNCR.
Actualmente no existen biomarcadores específicos del factor o factores circulantes. Se han propuesto distintas moléculas asociadas a la patogenia del SNCR, al patrón de respuesta a tratamiento y con el riesgo de recurrencia, como el receptor soluble del plasminógeno tipo uroquinasa (suPAR), proteína coestimuladora CD80, hemopexina, factor de necrosis tisular alfa (TNF-α), galactosa, factor vascular de crecimiento endotelial (VEGF) y otras moléculas tipo citoquinas [12] [13].
El tratamiento del SNCR no está estandarizado, especialmente en niños. El balance entre la morbilidad y riesgo de ERT del SNCR en su evolución espontánea, los efectos secundarios de la inmunosupresión y el mal pronóstico del trasplante renal, dibuja un escenario de difícil equilibrio. El reconocimiento del origen genético del SN está mejorando nuestro conocimiento de la enfermedad, pero su baja incidencia y heterogeneidad limita la investigación clínica. En 2009 se estableció el registro internacional del SNCR pediátrico (Registro PodoNet, www.podonet.org), con más de 2000 pacientes incluidos procedentes de 72 centros de Nefrología Pediátrica, con el objetivo de evaluar la correlación fenotipo-genotipo, las características de la enfermedad, la genética, histología, supervivencia a largo plazo y recurrencia postrasplante. La información que genera este estudio, permite establecer recomendaciones basadas en la evidencia clínica de sus resultados. En base a las diferencias principales entre el SN genético y el SN mediado por disfunción inmune respecto al pronóstico y la respuesta a tratamiento inmunosupresor, los autores han propuesto una nueva sub-clasificación de los pacientes con SNCR: esporádico sensible a inmunosupresión, esporádico multirresistente, genético y familiar [7].
DETERMINANTES GENÉTICOS DEL SÍNDROME NEFRÓTICO CORTICORRESISTENTE
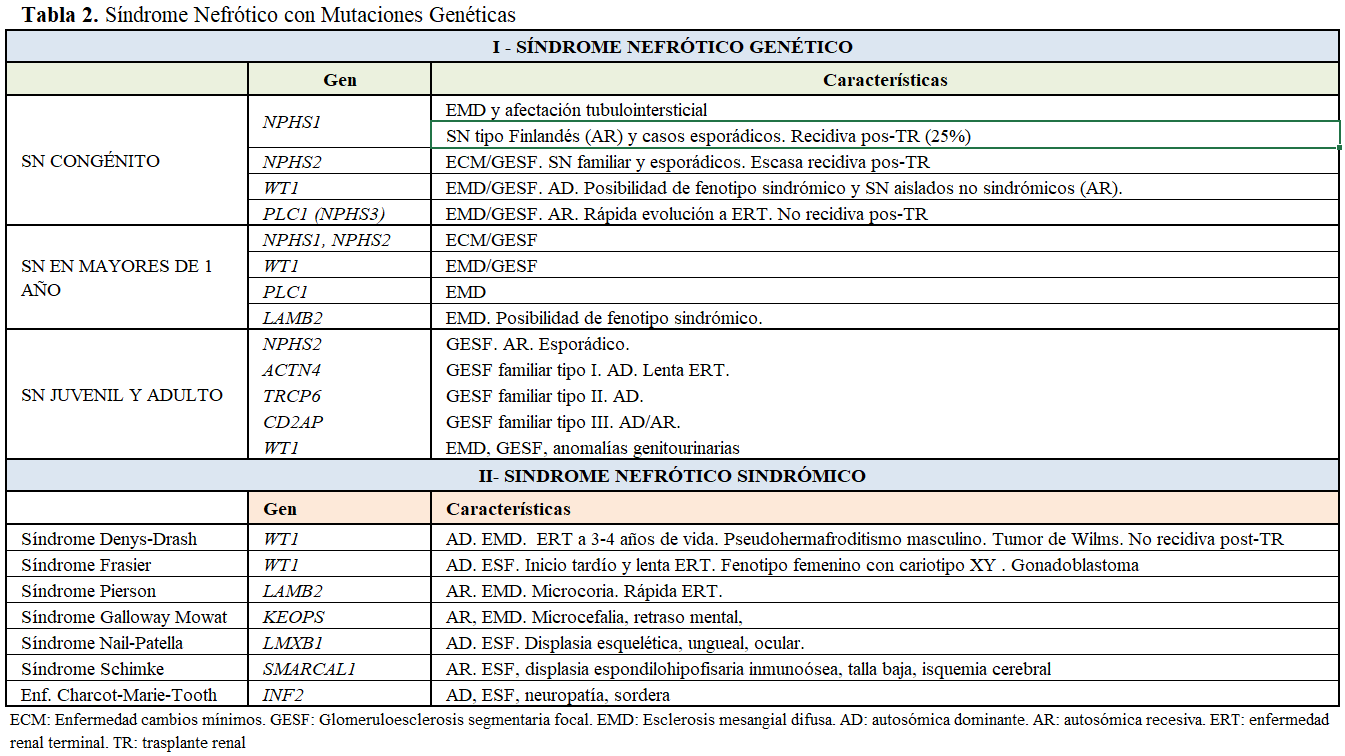
Se han identificado 60 genes relacionados con el SNCR que codifican las proteínas del diafragma de filtración, el citoesqueleto podocitario, la membrana basal glomerular, factores de transcripción, genes nucleares, mitocondriales y reguladores endosomiales (Tabla 2). La síntesis defectuosa de las proteínas da lugar a la alteración en la estructura molecular de la barrera de filtración, la estabilidad y dinámica del citoesqueleto, la supervivencia y diferenciación de los podocitos y las propiedades de la membrana basal glomerular. Los principales genes identificados, las proteínas que codifican y la forma de herencia son:
Diafragma de Filtración. NPHS1: nefrina (AR), NPHS2: podocina (AR), PLCE1: fosfolipasa C épsilon 1 (AR), CD2AP: proteína asociada con el dominio citoplasmático CD2 (AD/AR), TRCP6: receptor transitorio de potencial de canal C6 (AD).
Factores de transcripción. WT1: proteína 1 de tumor de Wilms (AD), LMX1B: factor de transcripción 1B (AD). SMARCL1: proteína SMARCA-like (AR), PAX2: proteína Box2 (AD), LMNA: laminina A y C (AD).
Citoesqueleto y membrana. ACTN4: α-actinina-4 (AD), INF2: proteína formina 2 (AD).
Citopatías mitocondriales. COQ2: coenzima Q2 4-hidroxibenzoato poliprentransferasa (AR), COQ6: coenzima monooxigenasa Q6 (AR). DGKE: diacilglicerol kinasa épsilon (AR). COQ8B: ADCK4 , dominio aarF que contiene kinasa 4.
Membrana basal glomerular. LAMB2: laminina subunidad β2 (AR). ITGB 4: integrina β4 (AR). ITGA3: integrina α3 (AR). COL4A 3/4/5: Colágeno tipo 4 α3, α4, α5 (AR/AD/ligado X)
Reguladores endosómicos. GAPVD (AR) y ANFKY1 (AR)
El estudio genómico del SNCR aporta información en el diagnóstico, la estrategia terapéutica, el pronóstico, la recurrencia postrasplante y el consejo genético. Los test genéticos más utilizados en el estudio del SNCR son la secuenciación directa de genes candidatos (Método Sanger) y la secuenciación de genes candidatos utilizando plataforma de secuenciación de última generación (TSC). Este último método tiene mayor relación coste-eficacia especialmente en poblaciones con genes conocidos de alta prevalencia, pero no puede identificar nuevos genes causales, por lo que un test negativo por este método, no descarta que el SNCR de un paciente individual pueda ser causado por una mutación aún no identificada.
La indicación del estudio genético del SNCR es distinta en niños y adultos. Sobre la base de la prevalencia del SNCR genético, en poblaciones con alta prevalencia de una mutación se recomienda realizar de rutina en todos los niños con SNCR [14].
En poblaciones con baja prevalencia de SNCR genético, se recomienda en pacientes con inicio de la enfermedad en el primer año de vida, historia familiar, SN Sindrómico y enfermedad renal crónica. En niños, las mutaciones en NPHS1, NPHS2 y PLC1 son las más comunes en formas de herencia AR, con mayor frecuencia de inicio precoz y de alta penetrancia. Las alteraciones de INF2, COL4A3, COL4A4, WT1, TRPC6, ACTN4 y LAMX1B son responsables de la mayoría de formas de herencia dominante, de inicio tardío y penetrancia incompleta [13]. Las mutaciones más frecuentes en el SN congénito en Europa afectan al gen de la podocina, mientras que en Finlandia afectan a la nefrina. En la práctica clínica se recomienda realizar análisis NPHS1 y NPHS2 en los niños con SNCR no sindrómico y en caso negativo ampliar estudio para WT1 o LAMB2.
En adultos, las Guias KDIGO recomiendan el estudio genético en formas familiares o sindrómicas, resistencia a inmunosupresión, estudio de riesgo de recurrencia postrasplante, estudio de candidatos a donación de vivo, alta sospecha de variantes de riesgo APOL1 y diagnóstico prenatal [14]. En adultos con formas familiares, son más frecuentes las mutaciones de herencia autosómica dominante (TRCP6, ACT4). Las mutaciones en los genes del colágeno se identifican hasta la 5ª década de la vida mientras que las variantes en genes distintos del colágeno 4 son más frecuentes en pacientes con SNCR menores de 25 años. En adultos con SNCR no familiar, en dos cohortes en Francia y Canadá, se identificó causa monogénica en un 11 % de pacientes, además de mutación en un gen de colágeno 4 en un 40-50 % de casos estudiados, sugiriendo solapamiento entre SNCR y el síndrome de Alport. El alelo de riesgo APOL1 se identificó en el 10 % de pacientes de etnia afroamericana.
Las alteraciones genéticas pueden expresar un fenotipo característico que oriente el estudio o heterogeneidad clínica e histológica. La misma mutación se puede asociar con diferentes formas histopatológicas: esclerosis mesangial difusa, GESF o enfermedad de cambios mínimos. Las mutaciones genéticas se han identificado tanto en SN hereditario como esporádico y algunos genes, como WTI y LAMB2, causan SNCR esporádico o SN sindrómico (Tabla 2). Las mutaciones del gen NPHS1 son responsables de la mayoría de los casos de SN congénito (niños menores de 3 meses), menos frecuentemente SN infantil (niños de 4 a 12 meses) y SNCR en mayores de 1 año. Las mutaciones del gen NPHS2, constituyen la causa más frecuente de SNCR precoz autosómico recesivo y son responsables de más del 45 % de SNCR familiar, donde también se han descrito mutaciones en el gen del tumor de Wilms (WT1) y de la laminina β2 (LAMB2). En conjunto, estas mutaciones explican el 90% del SN congénito y más del 50 % del SN infantil [15]. La mutación en el gen de la fosfolipasa PLCeC (PLCE1) es responsable de más del 25% de SN con esclerosis mesangial difusa aislada (EMD) y algunos casos de GESF. Las mutaciones en ACTN4, TRPC6, CD2AP, se describen como causa de GESF familiar autosómica dominante.
1 – Mutación en el gen NPHS1 (AR) (cromosoma 19q13.1), responsable del SN congénito tipo Finlandés y un 22,5 % de los SN esporádicos en el primer año de vida. Se han descrito más de 100 mutaciones en distintas poblaciones. En Finlandia, las mutaciones Fin-major y Fin-minor explican el 90% de los casos.
El SN se caracteriza por proteinuria masiva prenatal y al nacimiento, edema grave y oliguria. La histología renal muestra un patrón mixto glomerular (hipercelularidad y esclerosis mesangial) y túbulointersticial. Los pacientes progresan a fallo renal en la primera década de la vida. La recurrencia en el trasplante alcanza un 25% y se ha relacionado con la presencia de anticuerpos circulantes anti-nefrina de novo post-trasplante o factores de permeabilidad circulantes [16]. Muestra menos variación fenotípica que otros genes aunque se describen fenotipos más leves y coexistencia de mutaciones NPHS1 y NPHS2 [17].
2 – Mutación del gen NPHS2 (AR) (cromosoma 1q25-q31) [18][19], codifica la podocina y se expresa únicamente en el glomérulo. Las mutaciones NPHS2 causan la mitad de los SN congénitos en Europa y constituyen una causa común de SNCR esporádico. Se identifican en un 45-55 % de SN familiar y 8-20 % de casos esporádicos. Existe correlación genotipo-fenotipo: la mutación NPHS2 en homocigosis se expresa como SN congénito, NPHS1 asociada a NPHS2 se describe en SN infantil, la variante p.R138Q se asocia con SNCR de comienzo precoz, evolución a insuficiencia renal y base histológica de GESF y la variante pR.229Q en heterocigosis asociada a variante patogénica en el segundo alelo, se asocia con SN de inicio tardío [7][20][21]. La histología es variable: GESF, proliferación mesangial con depósito IgM, ECM y EMD. La mayoría de los pacientes son corticorresistentes desde la primera manifestación, no se han identificado mutaciones en pacientes con corticorresistencia tardía y se han comunicado algunos casos con respuesta parcial a tratamiento inmunosupresor [22].
3 – Mutaciones en el gen WT1 (AD) (cromosoma 11p13), codifica WT1, factor crítico en el desarrollo renal y gonadal. Se expresa en el podocito y controla las funciones celulares y la expresión de la nefrina. El gen WT1 fue identificado en niños con el síndrome de WARG no asociado a SN (tumor de Wilms, aniridia, malformación genitourinaria y retraso mental) que mostraban riesgo de fallo renal superior a pacientes con tumor de Wilms aislado [23]. Las alteraciones del gen WT1 se asocian a un amplio espectro clínico con dos fenotipos clásicos: Síndrome de Denis-Drash y Síndrome de Frasier, caracterizados por SN asociado a anomalías genitales, pseudohermafroditismo y tumores:
- Síndrome de Denys-Drash (SDD), AD con diferentes mutaciones en exón 8 y 9. SNCR con histología de EMD, manifestado en los primeros meses de vida y progresión a fallo renal a los 3-4 años. Asocia pseudohermafroditismo masculino y tumor de Wilms en la primera manifestación o en su evolución. No se ha descrito recidiva del SN postrasplante.
- Síndrome de Frasier, AD con mutación en el exón 9. SNCR con histología de GESF, manifestado a partir de la 1ª década de la vida y progresión lenta a fallo renal. Asocia pseudohermafroditismo masculino con genitales externos femeninos y cariotipo XY, disgenesia gonadal, predisposición a gonadoblastoma y menos frecuentemente tumor de Wilms. Sin embargo, se han descrito mutaciones WT1 en heterocigosis en mujeres con EMD aislada, mujeres con SNCR y GESF que tuvieron hijos con síndrome de Denys-Drash, niñas con SN aislado, GESF, malformaciones genitourinarias y evolución a insuficiencia renal y en familias con GESF y disgenesia gonadal 46 XY. Por ello, se recomienda estudio del gen WT1, cariotipo y despistaje de tumor de Wilms en niñas con EMD aislada y GESF con alteraciones genitourinarias.
4 – Mutaciones del gen LAMB2 (cromosoma 3p21), codifica laminina β2, y se expresa en glomérulo, retina, cristalino y sinapsis neuromusculares. El espectro clínico asociado a LAMB2 incluye el Síndrome de Pierson (AR), con SN y EMD, proteinuria masiva desde el nacimiento, rápida evolución a la insuficiencia renal, alteraciones oculares con microcoria y anomalía corneal, pero también se ha descrito en SN congénito sin anomalías oculares [24].
5 - Mutaciones en el gen PLCE1 (NPHS3) (cromosoma 10q23), codifica la fosfolipasa C epsilon (PLCε1). SNCR con EMD, manifestado en el primer año de vida, rápida evolución a la insuficiencia renal y herencia autosómica recesiva [25]. No recidiva postrasplante. La PLCε1 es un enzima precursor de segundo mensajero, que regula los procesos de maduración del podocito, expresión genética y función de conexión entre la PLCε1 y proteínas del diafragma como la podocina y nefrina. La histología depende del grado de afectación de actividad PLCε1: EMD se asocia con proteína truncada mientras que GESF se asocia con proteína disfuncional. Se ha publicado un caso que respondió a tratamiento con ciclosporina [26].
6 - Glomeruloesclerosis segmentaria y focal familiar. Es un grupo heterogéneo de enfermedades hereditarias caracterizadas por el inicio de proteinuria en la adolescencia o adulto joven, histología de GESF y evolución a insuficiencia renal [27]. Las alteraciones genéticas se heredan de forma recesiva (NPHS2), dominante (INF2, ACTN4 y TRPC6) o ambas (CD2AP), dando lugar a la GESF Familiar tipo 1 (ACTN4), tipo 2 (TRPC6) y tipo 3 (CD2AP).
• Mutaciones del gen INF2 es la primera causa de GESF/SNCR autosómica dominante, penetrancia incompleta y expresividad variable. Causa de GESF asociada a enfermedad de Charcot-Marie-Tooth con proteinuria a partir de los 7 años y neuropatía y sordera en la segunda década de la vida.
• Mutaciones de gen ACTN4 (cromosoma19q13), codifica la ∝-actinina-4, proteína altamente expresada en los podocitos que une los filamentos de actina del podocito. Da lugar a formas familiares de GESF y SNCR juveniles o del adulto y casos esporádicos [28]. Clínicamente se manifiestan a partir de la adolescencia o en el adulto joven y progresan lentamente a fallo renal.
• Mutaciones del TRPC6 (cromosoma11q21-22), codifica las proteínas TRPC6 que facilitan la entrada de calcio a la célula en la fase de proliferación celular. Se identifican en un 8 % de GESF familiar pero también en un 2 % de casos esporádicos. Penetrancia incompleta y expresividad variable. Se ha publicado un caso con SNCR y GESF que respondió a tratamiento con CSA y MMF. Estudios funcionales realizados en 3 familias muestran que las mutaciones de TRPC6 aumentan la entrada de calcio a las células y se postula que el incremento del calcio intracelular podría modificar la estructura contráctil de los podocitos o bien aumentar la apoptosis, el defecto de proliferación de los podocitos y podocitopenia [29].
• Mutaciones del CD2AP, codifica la proteína CD2AP (proteína asociada CD2) que actúa fijando la nefrina al citoesqueleto de actina. Las mutaciones modifican la interacción con CD2 y alteran la modulación CD2AP-podocina-nefrina [30]. Las mutaciones de asocian con SNCR e histología GESF.
7 - Sindromes nefróticos sindrómicos (Tabla 2)
- Síndrome de Nail-Patella: mutación del gen LMXB1, herencia autosómica dominante, histología de GESF, displasia esquelética, ungueal y ocular. Se han identificado variantes en adultos con SNCR sin manifestaciones extrarrenales.
- Síndrome de Schimke: mutación del gen SMARCAL1, herencia autosómica recesiva, GESF, displasia espondilo hipofisaria, talla baja , leucopenia, neutropenia, trombopenia y fenómenos de isquemia cerebral.
- Síndrome de Galloway Mowat: mutaciones del complejo KEOPS (OSGEP, WDR73, TP53RK, LAGE3, TPRKB), herencia autosómica recesiva, esclerosis mesangial difusa, microcefalia y retraso mental [31].
8- Nefropatía mitocondrial COQ8B.
COQ8B codifica el coenzima Q8B (ADCK4 , dominio aarF que contiene kinasa 4) que se localiza en el complejo CoQ10 en el interior de la membrana mitocondrial. Actualmente, las mutaciones COQ8B como causa de GESF/SNCR son raras, pero el diagnóstico es crucial ya que la suplementación con COQ10 reduce la proteinuria y mejora la sintomatología [32]. El SNCR por mutaciones COQ10 se ha escrito en más de 40 familias, aislado o asociado con manifestaciones extrarrenales (retraso del desarrollo, cardiomiopatía dilatada, retinitis pigmentaria). La edad de inicio de la proteinuria es variable aunque en la mayoría de los pacientes se manifiesta en la adolescencia. La histología incluye GESF, GESF colapsante, glomeruloesclerosis global y glomerulonefritis proliferativa mesangial. Se ha observado una reducción de la proteinuria del 50-80 % a las 6 semanas de tratamiento con suplementación con COQ10 y remisión parcial mantenida durante meses [33].
9- Mutaciones de los genes del colágeno IV (COL4A3, COL4A4 y COL4A5)
Se han identificado variantes del gen del colágeno en un 40-50 % de pacientes adultos con GESF/SNCR esporádico, microhematuria y pérdida de audición subclínica, algunas de significado incierto [34] [35].
SÍNDROME NEFRÓTICO CORTICORRESISTENTE INMUNO-MEDIADO
La hipótesis de la implicación de las células T y B en el SN primario se ha fundamentado en observaciones clínicas y en la respuesta al tratamiento inmunosupresor. La evidencia más importante de la presencia de un factor circulante en la patogenia del SNCR es la recidiva de la enfermedad en el trasplante renal.
CÉLULAS T
Existe evidencia de la participación de TNFα segregado por linfocitos T en la patogenia del SNCR. La β 3 integrina de los podocitos puede ser activada por plasma de pacientes con recurrencia de GESF postrasplante, activación reversible mediante el bloqueo de la vía TNFα. Además, la respuesta al tratamiento con anticuerpos anti- TNFα en pacientes con SNCR tanto en riñón nativo como en la recurrencia postrasplante sugiere el papel patogénico de TNFα en algunos casos de SNCR [36].
CELULAS B
El papel de las células B en el SNCR se manifiesta en la respuesta al tratamiento con anticuerpo monoclonal anti CD20 en la recurrencia de GESF postrasplante. Por otra parte, en SN Idiopático se han identificado anticuerpos frente a la proteína actina del citoesqueleto de los podocitos [36].
FACTORES DE PERMEABILIDAD
- Circulating cardiotrophin-like cytokine factor 1 (CLC-1)
CLC-1 es un miembro de la familia de la interleukina 6 que fisiológicamente estimula la expresión de inmunoglobulinas en las células B. Se ha caracterizado en el plasma de pacientes con recaída de SN postrasplante como factor de permeabilidad que se une a galactosa [37]. Se postula que la galactosa administrada via oral o intravenosa es estadios precoces de la enfermedad, podría ser una opción terapéutica en pacientes con SNCR y prevenir el desarrollo de enfermedad renal crónica al impedir la unión de este factor circulante a la superficie de los podocitos [38]. En un estudio sobre 7 pacientes pediátricos con SNCR y factor de permeabilidad positivo tratados con galactosa oral ( 0.2 g/kg/dosis dos veces al día), se observó una reducción de la actividad de factor de permeabilidad pero no de la proteinuria [39].
- Receptor activador de plasminógeno tipo urokinasa soluble (su-PAR)
Reiser J y su grupo publicaron en 2011 un estudio que mostraba niveles elevados de suPAR en pacientes con GESF recurrente postrasplante. Además, niveles elevados de suPAR provocaban la activación de αvβ3 integrina en los podocitos causando síndrome nefrótico. Sin embargo, otros estudios han mostrado resultados contradictorios en cuanto al valor de suPAR para distinguir GESF de otras glomerulopatías o predecir la recurrencia postrasplante, sugiriendo que podría ser un marcador inespecífico de estrés glomerular [40].
- Apolipoproteína A-I
La incidencia de GESF en pacientes afroamericanos es 5 veces superior a la de los europeos americanos. Friedman y colaboradores observaron una fuerte correlación de las variantes G1 y G2 del gen que codifica apolipoproteína A-I (APOLI), con el riesgo de desarrollar enfermedad renal en personas de etnia africana. Otro estudio posterior mostró que el descenso de función renal asociado a las variantes APOL1 es dependiente de niveles de suPAR, sugiriendo un efecto patogénico sinérgico [41].
- Autoanticuerpos , Anti-CD-40
El efecto del anticuerpo monoclonal antiCD20 Rituximab en el tratamiento de la GESF apoya el papel de los autoanticuerpos en la fisiopatología del SN primario. Delville y colaboradores demostraron la presencia de autoanticuerpos en el suero de pacientes con GESF recurrente y seleccionaron 10 anticuerpos en un panel biomarcador de recurrencia de GESF postrasplante que incluye anti-CD40, PTPRO, CGB5, FAS, P2RY11, SNRPB2 y APOL2 [42]. Este panel mostró alto valor predictivo de recurrencia, en particular anti-CD40. CD40 es un miembro de la superfamilia de receptores TNF que juega un papel importante como coestimulador en la inmunidad y la inflamación.
- CASK (calcium/calmodulin-serina protein kinasa)
CASK es una guanilato-kinasa asociada a la membrana esencial para el mantenimiento de la polarización de las células epiteliales. In vitro, es capaz de inducir alteraciones estructurales en los podocitos (deslocalización de ZO-1 en las uniones celulares y de sinaptopodina o reorganización de las fibras de actina) [40]. En pacientes con GESF recurrente postrasplante tratados con inmunoadsorción, CASK se identificó en el eluido de las columnas pero no en sujetos sanos, pacientes con ECM, pacientes trasplantados con GESF no recurrente ni trasplantados por patología no glomerular [43].
TRATAMIENTO DEL SÍNDROME NEFRÓTICO CORTICORRESISTENTE
El tratamiento del SNCR es un reto debido a la naturaleza heterogénea de esta entidad. El número de pacientes de los estudios publicados es pequeño, especialmente en casos pediátricos y pueden incluir casos con SNCR genético y no genético, lo que contribuye a resultados contradictorios o no concluyentes. El manejo clínico es complicado ante la falta de alternativas terapéuticas frente a la fármacorresistencia y los efectos secundarios de los inmunosupresores, las complicaciones infecciosas, trombóticas, la evolución a enfermedad renal terminal y la recidiva postrasplante.
En las guías de práctica clínica para el tratamiento del SNCR más recientes [44], los anticalcineurínicos constituyen la terapia inicial recomendada en niños y adultos con SNCR. La falta de respuesta a los 6 meses de tratamiento define el SNCR resistente a anticalcineurínicos. Si estos pacientes no pueden ser incluidos en ensayos clínicos se puede considerar el tratamiento con Micofenolato y/o Rituximab. El SNCR persistente tras RTX constituye el SNCR multi-resistente a fármacos [14] [45].
El predictor de respuesta a fármacos inmunosupresores es la respuesta inicial a los corticoides y la presencia de mutación genética patogénica se asocia con resistencia [7][46], pero no existen marcadores clínicos o de laboratorio específicos asociados a respuesta o resistencia al tratamiento con corticoides e inmunosupresores de segunda línea, que eviten sus efectos secundarios en pacientes potencialmente resistentes. Frente a las complicaciones asociadas al tratamiento, el impacto de la remisión parcial o completa inducida por inmunosupresores es muy significativa, ya que consigue preservar la función renal o retrasar la evolución a ERT. Los pacientes que alcanzan remisión completa, experimentan una reducción del 90% de riesgo de enfermedad renal crónica. La remisión parcial también mejora la supervivencia renal respecto a la ausencia de respuesta [47].
El manejo terapéutico del SNCR se apoya en la histología, la genética y el impacto del tratamiento sobre el pronóstico:
- El riesgo de ERT es 20 veces mayor en pacientes con EMD y 4 veces en GESF respecto a ECM [7]. La GESF subyace en el 75 % de los SNCR, frente al 7-10 % de todos los pacientes con SN. Evoluciona a fallo renal en un 30-40 % (causa más común de fallo renal en enfermedades glomerulares) con un riesgo del 8% a los 5 años, 17% a los 10 años y 43% a los 20 años de evolución. Se han identificado como factores negativos en la evolución la presencia de hipertensión arterial e insuficiencia renal, el debut precoz de la enfermedad, la ausencia de respuesta a los corticoides y la existencia de mutaciones genéticas [48].
- El registro de SNCR PodoNet, muestra respuesta completa o parcial al tratamiento inmunosupresor en el 45 % de pacientes con SNCR esporádico, 47% de SNCR familiar sin mutación identificada y 13 % en SNCR hereditario. Los pacientes con SN genético alcanzan remisión completa en un 3 % y remisión parcial transitoria en un 11 % frente a un 27 y 17 % respectivamente en pacientes con SNCR no genético. En estos pacientes, la ciclosporina fue el inmunosupresor alternativo a corticoides más eficaz [7].
- El 50 % de los pacientes con SNCR evolucionan a fallo renal, pero la supervivencia libre ERT es del 43 % en pacientes que no responden a inmunosupresión, 72 % en los que alcanzan remisión parcial y 94 % si la remisión es completa, la mayoría con tratamiento con ciclosporina [49].
En el SN congénito (con o sin mutación identificada) el tratamiento sintomático y de soporte es la mejor opción terapéutica ya que no existen evidencias del beneficio de un tratamiento inmunosupresor intensivo o prolongado en estos casos.
En el SNCR monogénico, se han publicado casos con respuesta parcial a la inmunosupresión. Las hipótesis que se proponen para explicar esta eficacia terapéutica son: los genes afectados pueden estar implicados en la respuesta inmune, las mutaciones podocitarias pueden asociar un mecanismo inmune, corticoides y ciclosporina pueden tener efecto directo no inmunomodulador sobre los podocitos, ciclosporina tiene efecto protector sobre la fosforilacion de sinaptopodina y existen casos familiares mixtos resistentes y sensibles a corticoides [8].
En una revisión sistemática de 22 publicaciones, 63 de 178 niños con SNCR genético mostraron respuesta parcial o completa a inhibidores de calcineurina, lo que supuso una reducción del riesgo de fallo renal del 40 % respecto a los pacientes que no respondieron. Los niños portadores de mutación WT1 mostraron una probabilidad de remisión 5 veces superior respecto a otras variantes genéticas [50]. Buscher y col. analizaron la respuesta a CSA en 231 pacientes (131 SNCR monogénicos, 60 de ellos SN congénito) documentando respuesta en 19 % de niños con SNCR monogénico ( 3% remisión completa, 16 % remisión parcial) [51]. En el registro PonoNet, respondió a inmunosupresión el 19 % (14 de 74 pacientes) de niños con SNCR genético documentado [7].
En la práctica clínica, los niños y adultos con SNCR están en tratamiento con anticalcineurínicos cuando se reciben los resultados del estudio genético a los 2 o 3 meses. Las guías de KDIGO 21 e IPNA 2020 recomiendan confirmar si la variante identificada es patogénica o probablemente patogénica para el diagnóstico de SNCR genético, y valorar la continuidad o suspensión de la inmunosupresión considerando la respuesta inicial, los beneficios de la remisión en cuanto a la progresión de la enfermedad frente al riesgo de la toxicidad del tratamiento y las complicaciones infecciosas [14] [44].
En pacientes con SNCR por mutaciones en los genes de la biosíntesis de CoQ10 relacionados con su deficiencia, debe ser considerada la suplementación con CoQ10 ya que se ha asociado con la reducción de la proteinuria y retraso del fallo renal [52] [53].
TRATAMIENTO SINTOMÁTICO Y PREVENCIÓN DE LAS COMPLICACIONES DEL SNCR
Las medidas generales dirigidas a evitar las complicaciones incluyen evitar el reposo en cama y movilizar a los pacientes encamados para disminuir el riesgo de trombosis, actividad física, una dieta normoproteica e hiposódica evitando la restricción de sodio si la natremia es menor de 125 mEq/L y un cuidadoso balance hídrico para evitar tanto la restricción inadecuada como la sobrecarga. El control del edema precisa ajustar la ingesta de líquidos para conseguir un balance negativo siempre que el paciente no presente signos de hipovolemia (relleno capilar prolongado, taquicardia, hipotensión). La administración de fluidos intravenosos se recomienda solo en pacientes con hipovolemia e hiponatremia sintomática o peritonitis. El tratamiento diurético (furosemida, tiazidas, ahorradores de potasio) está indicado en caso de edema grave e incapacitante y previa corrección de la depleción de volumen, ya que favorece la hipovolemia, insuficiencia renal aguda y las complicaciones tromboembólicas. La albúmina intravenosa se limita al tratamiento del SN congénito, hipovolemia intravascular sintomática con taquicardia, hipotensión arterial u oliguria, edemas incapacitantes, derrame pleural o pericárdico o infecciones graves, FE Na < 2% (seroalbúmina 20-25% pobre en sal, 0,5-1 g/kg i.v. en 4-8 horas, 2 veces al día con furosemida 0,5-2 mg/kg/i.v. a mitad y/o después de la perfusión) [45] [54].
Tratamiento no inmunosupresor
El tratamiento de soporte primera línea al diagnóstico de SNCR se basa en inhibidores del enzima convertidor de la angiotensina (IECA) y ó bloqueadores del receptor de la angiotensina tipo 2 (ARA2). Estrategias útiles tanto en el SNCR genético como SNCR idiopático para disminuir la presión intraglomerular, reducir la proteinuria y enlentecer la progresión a la ERT [55][56]. Algunos autores sugieren utilizar IECA de metabolismo no renal como Ramipril. Deben ser suspendidos en caso de deplección de volumen, vómitos, diarrea o hiperkalemia. En mujeres adolescentes en edad fértil se debe asegurar un método contraceptivo para evitar los efectos teratógenos de los IECA [45].
Prevención y tratamiento de las complicaciones [54]
• Profilaxis de la osteopenia inducida por la pérdida urinaria de vitamina D y el tratamiento con corticoides. Se recomienda aporte de calcio de 500 a 1200 mg/d y suplementos vitamina D suficiente para niveles de 25OH-Vitamina D superiores a 30 ng/ml.
• Tratamiento de la hipertensión arterial con IECA o ARA2. Los niños con SNCR deben recibir tratamiento con presión arterial (PA) superior al percentil 95 para edad, sexo y talla para alcanzar PA objetivo inferior al percentil 75 (sin proteinuria) o inferior a P50 en niños con proteinuria [57].
• Prevención de complicaciones tromboembólicas con medidas generales, corrección de la hipovolemia, evitar punciones arteriales o venosas profundas y catéteres centrales o periféricos que no sean imprescindibles. Tratamiento antiagregante (AAS 50-100 mg/día) y/o anticoagulación con heparina de bajo peso molecular (0,5-1 mg/kg/12h) en pacientes de alto riesgo trombótico clínico o de laboratorio: anasarca, tromboembolismo previo, catéter central, hipovolemia, infección, corticoterapia prolongada y glomerulonefritis membranosa, especialmente si coexiste hipovolemia o inmovilización prolongada, y predisposición por trombofilia hereditaria.
La presencia de alguna de las siguientes alteraciones de laboratorio se asocian con alto riesgo trombótico y apoyan el tratamiento anticoagulante: hipoalbuminemia < 2 g/dl, fibrinógeno > 6 g/L, antitrombina III < 70 %, D-dímeros > 1000 ng/ml. Objetivo: antiXa 0,4-0,8 UI/ml en anticoagulación profiláctica y 0,8-1,2 UI/ml en anticoagulación terapéutica. Se recomienda estudio de trombofilia en pacientes con SNCR con catéter central, proteinuria nefrótica persistente o historia familiar de predisposición trombofílica [45].
• Tratamiento de las infecciones bacterianas. Las más frecuentes son celulitis (staphylococcus aureus), peritonitis espontánea (streptococcus pneumoniae) y sepsis (s. pneumoniae, E. Coli, H Influenzae). En pacientes con hipogammaglobulinemia, o infecciones recurrentes o graves, se puede considerar el tratamiento sustitutivo con gammaglobulina iv. No recomendada profilaxis antibiótica sistemática excepto en pacientes tratados con rituximab (cotrimoxazol 5–10 mg TMP/kg/dia o 150 mg TMP/m2/dia en niños mayores de un mes, cada 12 o 24 horas 3 veces por semana en días consecutivos o alternos; dosis mñaxima de TMP 320 mg/day . En adolescentes 80 a160 mg TMP al día o 160 mg TMP 3 veces por semana. Reducir dosis al 50 % si FG < 30 ml/m2/min, no recomendado en FG < 15 ml/m2/min).
• Profilaxis de infecciones víricas. En pacientes no inmunes a varicela profilaxis post-exposición a varicela o herpes zoster con gammaglobulina varicela-zoster hiperinmune en las primeras 72 - 96 h (125 unidades/10 kg de peso, mínimo 125 U máximo 625 U). Tratamiento de la enfermedad con Aciclovir si se presenta durante el tratamiento con corticoides o inmunosupresores o si éste ha sido suspendido 1-2 meses antes.: aciclovir 10 mg/kg dos veces al día durante 7 días (en profilaxis postexposición dentro de 7–10 días de la exposición).
• Cumplimiento del calendario vacunal general y especialmente en pacientes pediátricos, inmunización frente a neumococo, meningococo, haemophylus influenzae, gripe y varicela-zoster. Vacunación antineumocócica conjugada hasta los 5 años más antineumocócica polisacárida p23 a partir de los 3 años. Los niveles de anticuerpos antineumococo descienden más rápidamente en niños con SN. Vacuna antigripal anual al paciente y contactos familiares. Los pacientes pueden ser vacunados en fase de remisión o con dosis de corticoides inferiores a 1 mg/k/día. Las vacunas de virus vivos triple vírica y varicela, están contraindicadas en las recaídas, en tratamiento con inmunosupresores (hasta tres meses después de la suspensión de ciclofosfamida y un mes después de anticalcineurinicos y MMF) y si han sido tratados con prednisona a dosis de 2 mg/kg/d durante 14 días hasta 4 semanas después de la suspensión. Pueden ser administradas en pacientes en remisión o bajo prednisona a dosis inferiores a 1 mg/kg/cada dos días. Si la tasa de anticuerpos antivaricela no es protectora, se recomienda administrar una dosis de recuerdo. Especialmente si está contraindicado vacunar al paciente, la vacunación de los contactos familiares disminuye el riesgo de transmisión.
• Tratamiento de la dislipemia: control de peso, dieta baja en grasas saturadas y estatinas en SNCR con dislipemia mantenida: LDL-C>130 mg/dl [45] . Algunos autores recomiendan estatinas si LDL-C>160 mg/dl ó >130 mg/dl si ERC, HTA, obesidad o tratamiento con anticalcineurínico. Aprobadas para su uso en pediatría por la FDA: simvastatina, lovastatina, atorvastatina y pravastatina [58].
• Hipotiroidismo secundario a proteinuria de alto grado o mantenida. Se recomienda monitorización periódica de la función tiroidea en niños asintomáticos con TSH entre 4.5 y 10 mU/L y T4 libre normal y tratamiento con levotiroxina si TSH > 10 mU/L y T4 libre baja.
• Tratamiento del Síndrome Nefrótico Congénito. En niños menores de 3 meses con o sin mutaciones identificadas, no se recomienda tratamiento inmunosupresor. La mayoría de los niños con SN congénito desarrollan una enfermedad grave, resistente a tratamiento farmacológico, dependiente de infusiones de albúmina, complicaciones tromboembólicas en 25 % de los casos y respuesta variable a tratamiento antiproteinúrico asociado a indometacina. Algunos pacientes precisan nefrectomía o binefrectomía para el control de la enfermedad y terapia renal sustitutiva. La recidiva postrasplante es poco frecuente. Por tanto, el valor del tratamiento antiproteinúrico y sintomático y la prevención de complicaciones es crucial para minimizar la morbilidad hasta el momento del trasplante.
TRATAMIENTO FARMACOLÓGICO DEL SN CORTICORRESISTENTE
El tratamiento inicial del SN primario se basa en los corticoides: 4-6 semanas de terapia diaria (60 mg/m2/día) y 4-6 de terapia alterna (40 mg/m2/cada 2 días) y dosis descendente durante un total de 3 meses de tratamiento en pediatría. En adultos se sugiere una terapia inicial con corticoides a dosis altas (1 mg/k/d o 2 mg/k días alternos) al menos durante 4 semanas hasta la remisión completa, durante un máximo de 16 semanas [14]. La mayoría de los niños con SN corticosensible remite a las 4 semanas de tratamiento pero 10-20 % no responde a corticoides. El SNCR se define como persistencia de proteinuria en rango nefrótico (40 mg/m2/h en niños, 3,5 g/día/1,73 m2 en mayores de 16 años) tras la administración de prednisona diaria durante 4-8 semanas. Algunos autores confirman la corticorresistencia tras 6 semanas de terapia diaria con hasta 3 bolos iv de metilprednisolona en días alternos [54].
El mecanismo de acción de los corticoides no está completamente aclarado. Su uso se basa en la evidencia del origen inmunológico del SN y su efecto modulador sobre la respuesta mediada por linfocitos T. Sin embargo, estudios preclínicos sugieren que los corticoides pueden actuar por mecanismos no inmunológicos sobre el esqueleto de actina-F del podocito y el diafragma de filtración, la regulación de la expresión de nefrina y tubulina ¿ y mostrar un efecto protector de la apoptosis podocitaria. Aunque estas propiedades podrían jugar un papel en el tratamiento del SNCR genético, no existen evidencias que justifiquen prolongar o intensificar el tratamiento en estos pacientes [13]. Los fármacos inmunomoduladores utilizados en segunda línea después de los corticoides son los inhibidores de la calcineurina, micofenolato mofetil y rituximab.
En pediatría, la ciclofosfamida (CFM) se ha utilizado como segunda opción terapéutica después de los corticoides hasta recientemente. Administrada a dosis de 2-3 mg/kg/día durante 12 semanas, un único ciclo de tratamiento supone una dosis total inferior a la asociada con toxicidad gonadal en niños prepuberales. Sin embargo, en la actualidad no hay datos que demuestren su eficacia frente a corticoides y ha sido desplazada por ciclosporina, más eficaz que CFM para inducir remisión en niños con SNCR, especialmente a largo plazo [14] [59] [60] [61].
El registro PodoNet del SNCR mostró una amplia variedad de protocolos de tratamiento inmunosupresor en el SNCR que incluyen desde uno a más de 3 fármacos combinados, incluidos metilprednisolona i.v., anticalcineurínicos, micofenolato mofetil, rituximab y ciclofosfamina i.v. La tasa de remisión global fue del 41%. La mayoría de los niños con SNCR fueron tratados con anticalcineurínicos como alternativa a los corticoides y los protocolos que incluyen ciclosporina, alcanzaron la tasa más alta de remisión completa (30%) y parcial (19%) [7]. En una publicacion reciente del registro Podonet, se analizó la evolución de 94 de 1864 pacientes con SNCR tratados con prednisona oral y/o IECA/ARA2 sin inmunosupresión intensiva. 18 de 31 pacientes con SNCR no genético (58,1 %) alcanzó remisión completa a los 2 años. Solo 2 pacientes progresaron a fallo renal. Por el contrario, ningún paciente de los 27 con SNCR genético alcanzó remisión completa y sostenida de la proteinuria y el 27 % (6 pacientes), progresaron a fallo renal a los 3 años [62].
El ensayo clínico publicado en 2011 por Gipson DS y colaboradores que analiza 192 niños y adultos jóvenes con GESF corticorresistente, muestra que Ciclosporina y Micofenolato más dexametasona son útiles en el tratamiento del SNCR, con una tasa de remisión del 65 y 42% respectivamente (sin diferencias significativas entre ambos protocolos) [63].
En un estudio sobre 91 niños con SNCR tratados con ciclosporina se observó: en pacientes con SNCR no genético, remisión completa 55% y parcial 13 % frente a 0 % y 17 % respectivamente en SNCR genético [64]. En el SNCR genético no se han identificado factores clínicos o moleculares de respuesta a anticalcineurínicos y no hay acuerdo sobre la duración del tratamiento. La mayoría de las series de pacientes con SN genético, sindrómico y familiar no responden a inmunosupresión, por lo que la terapia de soporte se convierte en la estrategia para enlentecer la progresión a ERT. No obstante, el tratamiento inmunosupresor se ha de considerar individualmente en pacientes con SNCR de presentación tardía, variantes de significado patogénico incierto o mutaciones en heterocigosis de NPHS2, TRCP6, CD2AP, con función renal normal y lenta evolución, ya que se han publicado casos de remisión completa o parcial en respuesta a tratamiento inmunosupresor, como se ha comentado [29] [51] [65] .
Anticalcineurínicos
Ciclosporina.
Los efectos antiproteinúricos de los anticalcineurínicos (CSA y Tacrolimus) se atribuyen a tres mecanismos: 1) Inmunológico a través de la inhibición de calcineurina que conduce a la supresión de la transcripción de interleukina 2 y a la activación de linfocitos T. 2) Hemodinámico al disminuir el flujo plasmático renal por vasoconstricción de la arteriola glomerular aferente y 3) Estructural a través de la inhibición de la degradación mediada por calcineurina de sinaptopodina, proteína implicada en la estabilidad del citoesqueleto de actina del podocito [66].
La vía de degradación más importante es el citocromo P450 del sistema microsomial hepático, lo que explica las importantes interacciones farmacológicas que presenta. Los efectos secundarios más importantes de la ciclosporina (CSA) son la nefrotoxicidad y la hipertensión arterial. Otros menos frecuentes son síndrome hemolítico-urémico, hiperuricemia, hipomagnesemia y acidosis metabólica. Entre los efectos extrarrenales destacan hirsutismo, hiperplasia gingival, síndrome linfoproliferativo y riesgo de desarrollo de procesos oncológicos. Una revisión sistemática mostró que Ciclosporina comparada con placebo y CFM i.v. fué eficaz en niños con SNCR con independencia de la histología subyacente [67].
La dosis inicial es 100-150 mg/m2/día (4-7 mg/k/d) en dos dosis, ajustada para niveles valle de CsA (C0) entre 100-200 ng/ml, asociada a prednisona alterna en los primeros 6 meses y reducción gradual hasta los 12 meses. Se recomienda un mínimo de 6 meses para valorar respuesta y suspender si no se alcanza remisión parcial o completa. Si se alcanza remisión parcial, se recomienda mantener 12 meses de tratamiento [14] [61]. En pacientes que responden, se observa alta tasa de recaídas tras la suspensión. La necesidad de tratamiento prolongado más de 2 a 5 años, conlleva riesgo de nefrotoxicidad, por lo que se debería reconsiderar el beneficio de la continuidad del tratamiento a los 12-24 meses [45]. Los signos histológicos de toxicidad por ciclosporina se pueden observar sin evidencia clínica sobre la función renal y no relacionados con la dosis. Por ello se recomienda realizar biopsia renal después de 18-24 meses de tratamiento o si se plantea iniciar un segundo curso de tratamiento [45] [68] [69].Los factores relacionados con toxicidad renal son exposición a ciclosporina superior a 36 meses, edad menor de 5 años, lesión histológica distinta de cambios mínimos y el mantenimiento de la proteinuria durante el tratamiento con CSA [70][71].
Tacrólimus
Un estudio sobre 45 niños con SNCR resistente a CFM tratados con Tac o CSA, mostró que ambos fueron eficaces con porcentajes comparables de remisión (70 y 82% respectivamente) [72].
Actualmente no existen evidencias suficientes sobre la superioridad de Tacrólimus o CSA en el tratamiento del SN, aunque algunos estudios, muestran resultados superiores de tacrólimus versus CSA respecto al porcentaje de remisión, sobre todo parcial, aunque con un 50% de recaídas en los pacientes que responden [73][74][75].
Su efecto inmunosupresor es similar a la ciclosporina. Induce más efectos secundarios neurotóxicos y sobre el metabolismo de la glucosa pero menos hirsutismo, hiperplasia gingival, hiperlipidemia y dependencia de la función hepática que CSA. La dosis es de 0.05-0.15 mg/Kg/día repartida en dos dosis para mantener niveles de 5-8 ng/ml.
Tacrólimus parece mostrar menor riesgo de nefrotoxicidad. En un estudio multicéntrico de pacientes con SNCR y en el estudio de Prasad y colaboradores [72] se sugiere una función renal a largo plazo mejor preservada en pacientes tratados con Tac respecto a CSA [76]. La dosis es de 0.05-0.15 mg/Kg/día repartida en dos dosis para mantener niveles de 5-10 ng/ml [14].
Micofenolato Mofetilo
Es un profármaco, el ester 2-morfolino-etil-micofenolato, derivado semisintético del principio activo ácido micofenólico (MPA), potente inhibidor selectivo de la síntesis de purinas, no competitivo y reversible del enzima inosin monofosfato deshidrogenasa (IMPDH), fundamental en la síntesis de novo de los guanosin nucleótidos, necesarios en la proliferación de los linfocitos T y B. Su mecanismo de acción en el SN no es completamente conocido. La experiencia en pacientes con SNCR es menor que en SN corticodependiente y en algunas series de analizan junto con SN dependiente y recaídas frecuentes, lo que dificulta establecer su eficacia [77][78]. En general, la respuesta a Micofenolato en el SNCR es inferior respecto al SN corticosensible. En un estudio que comparó MMF más dexametasona frente a CSA sola, se observó remisión sostenida en el 33,3% de pacientes con MMF comparable con el 45.9 % de los tratados con CSA [39] 63. Sin embargo, Sinha y colaboradores demostraron que MMF fue inferior a Tacrólimus en el mantenimiento de remisión en un grupo de 60 niños con SNCR. Los pacientes que habían alcanzado remisión completa o parcial con TAC y tras 6 meses fueron convertidos a MMF, mostraron doble riesgo de recaídas y por tanto mayor exposición a prednisolona [79]. Sin embargo, existe evidencia de que Micofenolato puede inducir remisión completa o parcial en SN resistente a corticoides y ciclosporina por lo que se sugiere su uso en estos pacientes, en monoterapia o asociado a corticoides. La importante ventaja sobre anticalcineurínicos es su ausencia de nefrotoxicidad [13][61] por lo que puede ser considerado en SNCR con FG < 30 ml/min/1.73 m2, para mantener remisión en niños con SNCR que han recibido anticalcineurínicos y presentan una recaída corticosensible o conversión a MMF como alternativa después de tratamiento con anticalcineurínicos a partir de los 12 meses [45].
La dosis de 600 mg/m2/12 horas asociado a prednisona se ajusta para niveles terapéuticos (C0) entre 2.5-5 ng/ml. La concentración es variable y dependiente de la dosis del fármaco, de las proteínas plasmáticas, de la función renal, de la variabilidad individual en su farmacocinética y de las interacciones medicamentosas, especialmente anticalcineurínicos. Los efectos secundarios más importantes son las infecciones y los síntomas gastrointestinales. La sustitución de Micofenolato Mofetilo por Micofenolato sódico a dosis 432 mg/m2/12 horas puede mejorar la tolerancia digestiva.
Corticoides a dosis altas
Los efectos secundarios y su importante repercusión sobre el metabolismo óseo y el crecimiento en el niño limitan su uso en el SNCR no genético y no existen evidencias científicas de su utilidad en el SN genético [13]. Se podría considerar su uso en combinación con ciclosporina o micofenolato en SNCR refractario a ciclosporina [61]. En un estudio sobre 78 niños con SNCR tratados con metilprednisolona a dosis 30 mg/kg o dexametasona i.v. asociada a prednisona oral 2 mg/kg/días alternos, se observó una tasa de remisión completa del 34 % y parcial del 13 % [80][81]. La remisión sostenida fue mayor en pacientes tratados con ciclosporina y metilprepnisolona i.v. comparados con ciclosporina más prednisona oral en un estudio retrospectivo de 52 pacientes [82]. Las Guías IPNA, recomiendan un curso inicial de prednisona oral (60 mg/m2/día máximo 60 mg) entre 4 y 6 semanas y/o pulsos de metilprednisolona i.v. solo en los pacientes que alcanzan remisión parcial a las 4 semanas de tratamiento con prednisona oral. El paciente que no alcanza remisión completa a las 6 semanas se define como SNCR aunque alcance remisión parcial a las 4 semanas.
No existe evidencia del beneficio del tratamiento prolongado con prednisona oral en el SNCR comparado con el riesgo de toxicidad, por lo que no se recomienda asociar de rutina prednisona con anticalcineurinicos más de 6 meses y se sugiere reducción progresiva tras el inicio del anticalcineurínico (40 mg/m2 días alternos 4 semanas, 30 mg/m2 días alternos 4 semanas, 20 mg/m2 días alternos 4 semanas, 10 mg/m2 días alternos 8 semanas y suspender) [45].
Rituximab
Es un anticuerpo monoclonal con especificidad contra el antígeno CD20 de la superficie celular de los linfocitos B, aunque algunas células T también expresan CD20. El mecanismo de acción en el SN es desconocido, aunque recientemente se ha observado que rituximab puede modular la función podocitaria independientemente de sus efectos inmunomoduladores, preservando la expresión de esfingomielina fosfodiesterasa (SMPDL-3b) [83].
En pacientes con SNCR multiresistente se considera un fármaco de rescate. Se ha utilizado a dosis de 375 mg/m2 /semana con amplia variabilidad entre 1 y 4 dosis [84]. En la literatura se han publicado estudios observacionales que muestran que rituximab puede inducir remisión parcial o completa en un 30% de pacientes con SNCR resistente a múltiples fármacos [85][86] [87] [88] [89] [90].
Sin embargo, RTX no fue superior comparado con protocolos de tratamiento que incluían recambio plasmático e inmunoadsorción [91]. La guía IPNA recomienda 1-2 infusiones de rituximab a dosis 375 mg/m2 en dos semanas, generalmente suficientes para reducir las células CD19 a menos de 5/microL o < 1% del recuento de linfocitos. En pacientes que alcanzan remisión parcial o completa se debe monitorizar la proteinuria y el recuento de células CD19 y considerar un segundo curso de tratamiento si se incrementa significativamente la proteinuria coincidiendo con el aumento de CD19 > 5 celulas/microL o > 1% de recuento de linfocitos [45]. Hasta un 30 % de pacientes presentan hipogammaglobulinemia después del tratamiento por lo que se recomienda monitorizar los niveles de inmunoglobulina G en suero [92]. Se recomienda profilaxis de neumonía por Pneumocystis jirovecii con cotrimoxazol . Las contraindicaciones del tratamiento con rituximab son: tuberculosis, hepatitis B o infección por virus JC [45].
Los efectos secundarios son graves y pueden persistir tras suspender el fármaco: infecciones por gérmenes oportunistas, fibrosis pulmonar [93] y leucoencefalopatía multifocal progresiva [94].
Ofatumumab
El ofatumumab, es un anticuerpo monoclonal dirigido al antígeno CD20 expresado en las células B, excluyendo las células plasmáticas. Se une a CD20 a través de un epítopo diferente de rituximab con mayor avidez, promoviendo citotoxicidad dependiente del complemento en mayor grado.
Se han publicado series de 2-5 casos pediátricos con SNCR resistente, intolerantes a RTX o sin tratamiento previo con rituximab que alcanzan remisión completa con Ofatumumab [95] [96] [97]. Se administró en dos estudios a dosis inicial de 300 mg/1,73 m2 ( máximo 300 mg) y 5 dosis semanales de 2000 mg/1,73 m2 (máximo 2000 mg) ( 60, 61) y en un solo caso 750 mg/1,73 m2 .
Aféresis Terapéutica
El recambio de plasma (RP), la inmunoadsorción no selectiva (IA) y la IA selectiva (LDL-aféresis) se han utilizado en pacientes con SN nativo resistente a inmunosupresores y en la recurrencia en el injerto después del trasplante renal. La IA, respecto al RP, permite procesar mayor cantidad de plasma por sesión y presenta menor incidencia de efectos secundarios, lo que supone una ventaja especialmente en pediatría [98]. Todas las técnicas de aféresis son coadyuvantes al tratamiento inmunosupresor y no permiten su retirada [99]. En la actualidad, el RP sigue siendo la principal modalidad de tratamiento en la recidiva de la enfermedad postrasplante renal.
En el SNCR nativo, se ha utilizado la IA en sus dos modalidades: no selectiva (columnas Immunoadsorba®, Immuno-sorba® o Ig-Therasorb®) y selectiva (LDL-aféresis). El uso de IA no selectiva se fundamenta en la eliminación de la circulación de factores circulantes responsables de la enfermedad, mientras que el objetivo de la LDL-aféresis, es reducir la hipercolesterolemia y secundariamente la proteinuria. Existe mayor experiencia con LDL-aféresis que con IA selectiva [98].
La LDL-aféresis se ha utilizado con mayor frecuencia en población japonesa. En una revisión de 15 pacientes con ECM resistente a corticoides tratados con LDL-aféresis se mostró reducción de la proteinuria en once casos. La mayoría de los pacientes recibieron sesiones con volumen de intercambio de 3-4 L por sesión, en los primeros 6 meses desde el diagnóstico, con frecuencia de 2 sesiones por semana y un promedio de 910 sesiones [100]. Muso y col. mostraron remisión en 4 de 7 pacientes con GESF tratados [101]. El mismo autor publicó el estudio observacional (POLARIS) sobre 28 pacientes con GESF resistente, seguidos de forma prospectiva durante 2 años. El 42,9% de los pacientes obtuvo un resultado favorable, definido como proteinuria menor de 1 gr / día [102].
La IA no selectiva se ha utilizado con menos frecuencia en SNCR nativo. Se han publicado series de casos y casos aislados refractarios con resultados variables sobre la reducción de la proteinuria. En pacientes que respondieron se observa recaída de la proteinuria al suspender el tratamiento. En 9 niños con GESF y 2 con recaída postrasplante tratados previamente con recambios plasmáticos, la IA con Immuno-sorbe TR-350 consiguió reducir la proteinuria en respuesta completa o incompleta en 6 casos [103].
En la GESF recurrente postrasplante, un metanálisis con 423 pacientes, analiza los resultados del tratamiento con recambios plasmáticos y rituximab. Se observó remisión en un 71 % de pacientes tratados y se identificaron factores relacionados con falta de respuesta: proteinuria superior a 7 g, sexo femenino, retraso de tratamiento de 2 semanas desde la aparición de la proteinuria [104].
El papel de la inmunoadsorción en el manejo de la recurrencia postrasplante y su mecanismo de acción no está aclarado. La mayoría de los pacientes tratados son refractarios a recambios plasmáticos utilizados previamente, lo que dificulta la comparación de la eficacia entre ambas técnicas. En un estudio sobre 20 pacientes tratados con IA, se midieron los niveles de suPAR en el eluido de las columnas. En todos los casos se observó reducción de la proteinuria, pero la concentración de suPAR en el eluido fue muy baja, se desconoce si por insuficiente adsorción a las columnas o por destrucción de suPAR durante el proceso de elución [105].
TRASPLANTE RENAL
El trasplante renal debe ser contemplado en pacientes con SNCR en situación de fallo renal independientemente de la causa genética o no genética de la enfermedad y discutido en el equipo de trasplante y la familia. La planificación del trasplante renal requiere el estudio genético para evaluar el riesgo de recurrencia, la consideración de recidiva en trasplante previo y la elección del donante. La situación ideal es la resolución del síndrome nefrótico pre-trasplante para minimizar el riesgo de tromboembolismo venoso y facilitar la monitorización de la recidiva postrasplante. Si la proteinuria es persistente pre-diálisis, se puede considerar la nefrectomía médica o quirúrgica pretrasplante.
La supervivencia renal del injerto en pacientes con SNCR está condicionada por la recurrencia postrasplante. Los factores más importantes asociados con el riesgo de recurrencia son: la rápida progresión a fallo renal, el inicio precoz de la enfermedad, alto grado de proteinuria e hipoalbuminemia y origen no genético del SN. Otros factores asociados son la gravedad histológica y la proliferación mesangial, el trasplante de donante vivo y la nefrectomía pretrasplante. Se ha observado un 40 % de recurrencia en pacientes nefrectomizados frente al 16 % en pacientes que conservan riñones nativos. Este hecho podría reflejar una mayor gravedad de la enfermedad en los pacientes que requieren nefrectomía, o bien la capacidad del riñón nativo para adsorber factores de permeabilidad liberados postrasplante [106].
El riesgo de recidiva en el primer injerto del 50 %, se multiplica en segundos y siguientes trasplantes, con tasas del 80 y más del 90 % en segundos y terceros trasplantes [107]. La recurrencia de GESF postrasplante supone un riesgo relativo de pérdida del injerto de 2,25. Este riesgo puede ser aún mayor en pacientes con recurrencia precoz [108].
Los pacientes con SN genético requieren diálisis y trasplante renal a los 10 años del diagnóstico en un 50 % de casos. Sin embargo, el riesgo de recurrencia es muy bajo comparado con los pacientes con SNCR primario no genético y corticorresistencia tardía, que muestran un riesgo del 47 % y 80% respectivamente [109]. No obstante, se ha descrito recurrencia precoz y tardía postrasplante en pacientes con SN por mutaciones de la podocina tanto en homocigosis como en heterocigosis (sin anticuerpos anti-podocina detectados) y en dos casos con síndrome de Frasier y mutación ACTN4 [110][111].
Después de la recurrencia del SN postrasplante se ha observado remisión completa en un 63% y parcial en un 8 % de pacientes y una supervivencia del injerto del 50 % a los 10 años [112] [113].
Los datos de registros como NAPRTCS, USRDS y RADR sugieren que no existen diferencias entre la tasa de recurrencia en el injerto procedente de donante vivo o donante fallecido. Por el contrario, en el registro australiano, el trasplante de donante vivo es un factor de riesgo independiente para la recidiva [114][115][116][117]. Actualmente, la elección del donante en el SNCR cuenta con el estudio genético como herramienta de decisión y plantea dos escenarios: SNCR no genético y SNCR monogénico y hereditario.
En el primer trasplante del SNCR no genético se recomienda considerar tanto el donante vivo como donante fallecido en virtud del porcentaje similar de recurrencia (10-50% versus 3-45% respectivamente) pero con una supervivencia del injerto superior tras la recurrencia en trasplante de donante vivo comparado con donante fallecido [118] [119].
En SNCR con recurrencia de la enfermedad en el primer trasplante se desaconseja la donación de vivo [45].
El trasplante de donante vivo en pacientes con SN genético y hereditario requiere una cuidadosa planificación según el defecto genético y el modo de herencia y la consideración del riesgo esperado de recurrencia y pérdida del injerto. Si la mutación genética es conocida en el receptor, la donación de vivo solo puede ser considerada si se descarta la mutación en el donante potencial en un estudio genético.
En mutaciones autosómico recesivas, un candidato portador heterocigoto de una variante de SNCR recesiva puede ser considerado potencial donante excepto para variantes en COL4A5, COL4A3, and COL4A4. Se debe excluir como potencial donante al candidato portador de una variante patogénica o probablemente patogénica en un gen dominante, con o sin sintomatología dado que la penetrancia es incompleta, por el riesgo de desarrollo de la enfermedad en el donante tras la reducción de masa renal y por la posibilidad de la implantación de un riñón no óptimo en el receptor [45].
No se recomienda la donación de vivo en familias con historia sugestiva de enfermedad hereditaria sin defecto genético identificado [13].
Prevención y tratamiento de la recurrencia postrasplante
La recurrencia postrasplante del SN es la manifestación prototipo de síndrome nefrótico determinado por un factor de permeabilidad circulante.
No hay suficiente evidencia para sugerir estrategias de prevención de recurrencia del SN en el primer trasplante en niños pero en SNCR con historia de pérdida del injerto previo por recidiva se recomienda aféresis terapéutica y rituximab. En caso de recidiva, se debe iniciar tratamiento lo antes posible. El diagnóstico precoz incluye monitorización diaria de la proteinuria postrasplante, semanalmente el primer mes y mensualmente el primer año. Puede ser indicativo de recidiva precoz un índice urinario Pr/Cr > 1 mg/mg en un paciente anúrico o un incremento > 1 mg/mg en un paciente con proteinuria previa, la disfunción primaria del injerto y la necrosis tubular aguda precoz. La biopsia renal no es necesaria para el diagnóstico de recidiva pero sí recomendada para en caso de proteinuria en rango no nefrótico o proteinuria tardía > 48 h postrasplante [45]..
El protocolo de tratamiento no está uniformemente establecido, pero los mejores resultados se obtienen combinando aféresis precoz, intensiva y mantenida para conseguir remisión sostenida (recambio plasmático o inmunoadsorción con proteína A), inmunoglobulinas IV, ciclosporina a altas dosis y rituximab [108].
CONCLUSIONES
El SNCR es una entidad heterogénea que engloba un conjunto de enfermedades determinadas por mecanismos inmunológicos y genéticos que afectan al podocito y la barrera de filtración glomerular. En conjunto se caracterizan por la falta de respuesta al tratamiento inmunomodulador, la evolución a fallo renal y la morbilidad secundaria a las complicaciones del estado nefrótico.
El avance en el conocimiento de la base genética y molecular de las alteraciones estructurales e inmunológicas de la barrera de filtración glomerular, ha mejorado la elección de la mejor estrategia terapéutica y amplía la posibilidad de la investigación de nuevas terapias basadas en la patogenia.
La heterogeneidad, variabilidad y baja prevalencia del SNCR, suscita la necesidad del tratamiento multirresistente en ensayos clínicos de registros multicéntricos que generen evidencias científicas sólidas para el manejo de los pacientes.
El estudio genético de los candidatos a trasplante renal permite individualizar la elección del donante y minimizar el riesgo de enfermedad para el donante y receptor.