Enfoque Clínico de las Enfermedades Renales Hereditarias
Palabras clave
Consulta nefropatías hereditarias
IMPORTANCIA DE LAS ENFERMEDADES RENALES HEREDITARIAS
El aumento de interés por las enfermedades renales hereditarias (ERH) viene ligado a la revolución de la investigación en Genética a partir de los años 80. En 1985 se localiza el primer gen causante de la Poliquistosis Renal Autosómica Dominante (PQRAD) en el cromosoma 16 y en 2003 se completa el Proyecto Genoma Humano. Los avances en nuevas técnicas de diagnóstico genético están permitiendo mejorar el diagnóstico y, con ello, el desarrollo de nuevos tratamientos.
Prevalencia de las enfermedades renales hereditarias
PQRAD es la enfermedad renal hereditaria más frecuente. Su prevalencia es de 1/1.000-1/2.000 y es la nefropatía subyacente en el 6-10% de paciente en terapia renal sustitutiva (TRS) [1].
El síndrome de Alport está tomando relevancia en los últimos años porque su prevalencia podría llegar a ser similar o incluso superior a la PQRAD [2].
El resto de ERH son enfermedades raras o minoritarias, es decir, tienen una prevalencia menor a 5 casos / 10.000 habitantes. Aunque si consideramos las ERH en su conjunto, constituyen del 10% al 15% (según las series) de la etiología de los pacientes que inician TRS. En los pacientes pediátricos esta prevalencia puede aumentar hasta casi el 20% [3].
Características generales de las ERH
Las nefropatías hereditarias están más presentes en nuestra práctica clínica diaria debido a los avances en el diagnóstico de las técnicas genéticas y los nuevos tratamientos disponibles. Aunque la base del diagnóstico se realiza a partir de un adecuado enfoque clínico que nos permita sospecharlas [4].
Debido a su baja prevalencia y poco conocimiento sobre las mismas por parte del especialista, son patologías infradiagnosticadas. Por eso, debe haber una conexión interhospitalaria de estas enfermedades y un equipo multidisciplinar formado por Nefrología, Pediatría, Radiología, Genética y otras especialidades [5] [6] [7].
El desarrollo de la genética molecular ha identificado nuevas dianas terapéuticas para conseguir un tratamiento de muchas de ellas, que antes no existía [8] [9].
Aunque es un grupo muy heterogéneo de enfermedades, tienen una serie de características comunes (Tabla 1).
ESTABLECIMIENTO DE UN PATRÓN CLÍNICO
Ante la sospecha de una nefropatía familiar se debe recoger los datos que identifiquen el tipo de lesión renal. En la mayoría de los casos una analítica de sangre completa y un análisis de orina, junto con una ecografía renal será suficiente para clasificar las ERH en los siguientes patrones: glomerular, tubular, intersticial, quístico o sindrómico.
Patrón glomerular: puede ser debido a la mutación de proteínas implicadas en estructura de la membrana basal glomerular, se altera inicialmente el glomérulo. Clínicamente se caracteriza por proteinuria y/o microhematuria. La proteinuria es, principalmente, albuminuria y puede llegar a rango nefrótico. En la citología de orina encontraremos hematíes dismórficos. Ejemplo: síndrome de Alport [10]. También puede ser debido a proteínas localizadas en la barrera de filtración dando lugar a síndrome nefrótico. Ejemplo: síndrome nefrótico finlandés.
Patrón quístico: la mutación afecta a las proteínas estructurales de la célula tubular, sobre todo, las localizadas en los cilios (ciliopatías). Se caracteriza por un deterioro progresivo de la función renal junto al hallazgo ecográfico de quistes renales bilaterales y múltiples. El análisis urinario es normal, no suele existir microhematuria ni proteinuria, excepto en fases avanzadas de la enfermedad. Ejemplo: Poliquistosis Renal Autosómica Dominante [11].
Tubulopatías: se afectan las proteínas transportadoras de la célula tubular, encargadas de la reabsorción tubular. Se caracterizan por la alteración de la reabsorción tubular de sustancias de bajo peso molecular (iones, glucosa o aminoácidos), que suelen disminuir en sangre y aumentar en orina. Aunque puede haber otros hallazgos propios de cada enfermedad. Ejemplo: Cistinuria [12].
Intersticiales: se produce una fibrosis tubulointersticial progresiva con glomérulos indemnes. Cursa con insuficiencia renal de lenta progresión sin hematuria ni proteinuria. Ejemplo: Nefropatía intersticial autosómica dominante [13]
Síndromes: La proteína mutada está relacionada con una función sistémica, por lo que la patogenia se produce en diferentes tejidos. Son síndromes hereditarios, donde la nefropatía se engloba en una importante afectación multiorgánica. A nivel renal puede haber quistes, malformaciones renales y/o alteración de la función renal. Es preciso realizar una exploración física muy detallada para detectar dismorfias y manifestaciones extrarrenales. Algunos de estos síndromes se diagnostican por una serie de criterios clínicos definidos que lo identifican, sin ser necesario el estudio genético. Ejemplo: Esclerosis Tuberosa [14].
ÁRBOL FAMILIAR
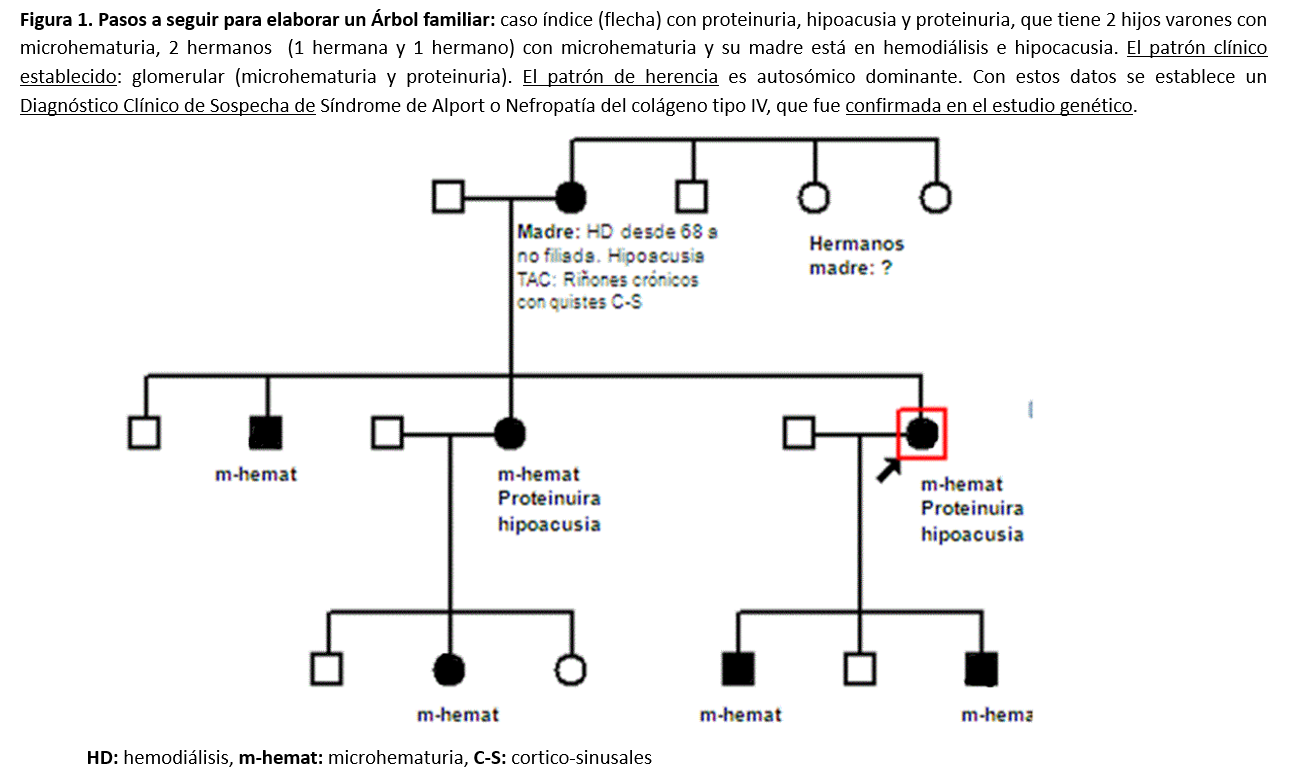
El árbol familiar nos permite una visión esquemática y rápida de los individuos que conforman la familia. Se realiza mediante un buen interrogatorio sobre los antecedentes familiares [15]. Esto nos va a permitir dirigir el estudio genético, que nos confirmará la enfermedad que previamente se había sospechado en el probando y familiares con riego, así como determinar el patrón de herencia [4]. Si el gen mutado se encuentra en los 22 pares de cromosomas autosómicos, puede ser Autosómica Dominante (la enfermedad se expresa en individuos heterocigóticos, se puede ser sano o enfermo) o Autosómica Recesiva (la enfermedad sólo se expresa en homocigóticos, se puede ser sano, enfermo o portador) [16] [17]. En el caso de que la mutación se localice en el cromosoma X, en la mayoría de los casos, los varones estarán mucho más afectados que las mujeres [18].
El ADN mitocondrial sólo se hereda por vía materna, por lo tanto mutaciones en estos genes sólo se puede trasmitir por la madre al 50% de la descendencia, independientemente del sexo [19].
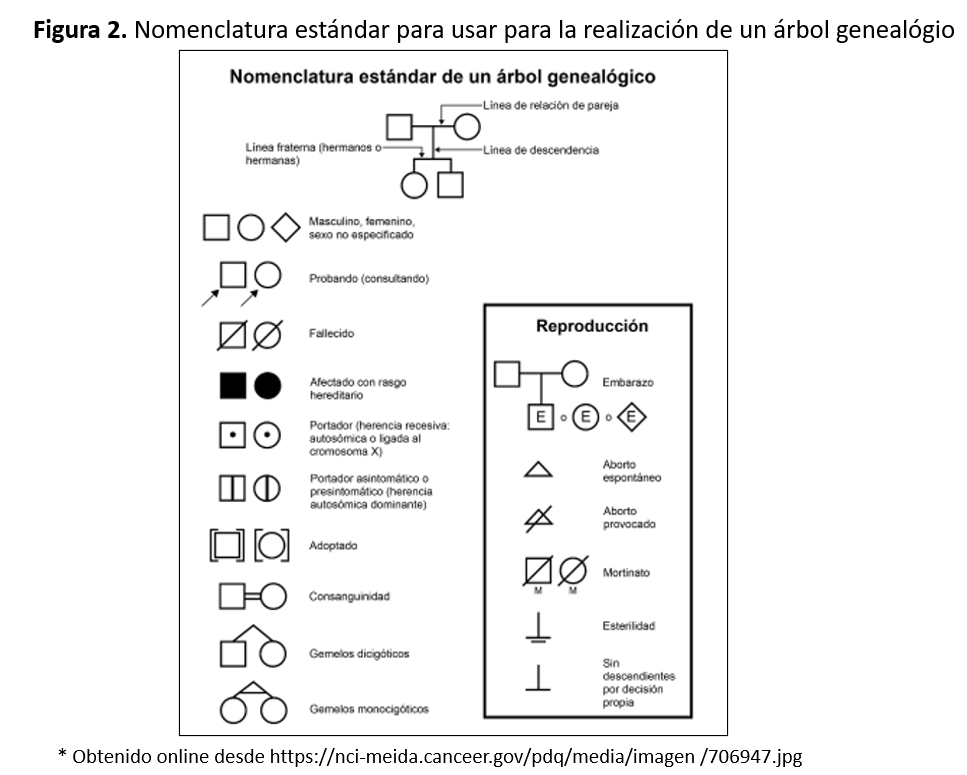
Se deben recoger los antecedentes familiares mediante una completa anamnesis, exploración física y exploraciones complementarias, basadas inicialmente en: analítica sangre, orina y ecografía renal. No sólo al caso índice, sino a todos los miembros familiares. Este proceso nos permitirá establecer si, clínicamente, cada individuo es sano o enfermo [20]. Se recoge un ejemplo en la (Figura 1). El árbol genealógico se representa con una nomenclatura estándar que podemos observar en la (Figura 2).
- El caso índice: paciente inicial a estudio
- Relación de parentesco en relación al caso índice. Los hombres representados como cuadrados y las mujeres, como círculos. Se indica cada generación en la misma línea y los hijos de cada matrimonio unidos por una línea vertical en la siguiente generación.
- Indicar los individuos sanos y enfermos: definidos por el color. Si está en blanco es sano y si se colorea es enfermo. La representación gráfica depende del patrón de herencia:
Autosómica Dominante: sanos (en blanco) o enfermos (coloreado total) [21].
Autosómica Recesiva: sano, portador (coloreado parcial) o enfermo (coloreado total)
Ligada a X: sano, portadora (un punto central) o enfermo (coloreado total) [22].
Es recomendable que estos pacientes se sigan en consultas especializadas de ERH [4]. Así mismo para muchas de las ERH es necesario un manejo multidisciplinar que debe llevarse a cabo mediante la participación en el equipo de todos los especialistas implicados en la enfermedad. Es deseable la existencia de un gestor de casos para una mejor organización del seguimiento del paciente [23].
ASESORAMIENTO GENÉTICO
Todo paciente con una ERH debe recibir consejo genético. Las decisiones reproductivas del paciente y su pareja deben ser tomadas con información fidedigna, bajo el principio de confidencialidad y evitando la coerción.
Se debe ofrecer además la posibilidad de llevar a cabo el estudio genético a los familiares directos del caso índice.
Es recomendable que estos pacientes se sigan en consultas especializadas de ERH [4]. Así mismo para muchas de las ERH es necesario un manejo multidisciplinar que debe llevarse a cabo mediante la participación en el equipo de todos los especialistas implicados en la enfermedad. Es deseable la existencia de un gestor de casos para una mejor organización del seguimiento del paciente [23].
El estudio genético en menores, debe ser una decisión consensuada e informada con los padres [24].
DISEÑO DE LA CONSULTA DE NEFROPATÍAS HEREDITARIAS
Ver esquema en la (Figura 2)