Complejo Esclerosis Tuberosa (CET)
Palabras clave
Angiomiolipomas
INTRODUCCIÓN
El complejo esclerosis tuberosa (CET) es una enfermedad rara (1/6.000-10.000), hereditaria, multisistémica y con un amplio espectro fenotípico [1].
CET es un síndrome caracterizado por el desarrollo de tumores benignos en múltiples órganos, causado por mutaciones en TSC1 o TSC2, que codifica hamartina y tuberina respectivamente. Proteínas que actúan como complejo que inhibe MTOR (mamalian target of rapamycin) que media el crecimiento y proliferación celular. La pérdida de esas proteínas lleva a crecimiento y proliferación celular en diferentes órganos. Los órganos más frecuentemente afectados son sistema nervioso central, retina, piel, pulmón, riñón y corazón. Las manifestaciones clínicas son progresivas y se van modificando con la edad. Algunas de las complicaciones son potencialmente mortales, lo que hace imprescindible las revisiones clínicas protocolizadas.
El CET es una enfermedad muy variable en su expresión respecto a edad de inicio, severidad de la enfermedad y diferentes signos y síntomas que resultan de un genotipo. Incluso, puede variar substancialmente entre individuos afectos dentro de una misma familia.
CRITERIOS DIAGNÓSTICOS
Es una enfermedad hereditaria autosómica dominante con una penetrancia muy alta, próxima al 100% y una expresividad muy variable. El CET está causado por una mutación que inactiva a uno de los alelos de TSC1 en 9q34 [2] o TSC2 en 16p13. Las mutaciones ocurren con mucha mayor frecuencia en TSC2.
Pueden aparecer mutaciones de novo, hasta 4 veces más frecuentes en mutaciones TSC2.
En 2012 se realizó una actualización internacional de los criterios diagnósticos, donde el cambio más destacable fue la inclusión de los estudios moleculares como suficientes para el diagnóstico [3]. En la conferencia mundial del 2018 (World TSC Conference organized by the TSC Alliance) en colaboración con TSC International (TSCi) se revisaron las recomendaciones del 2012. En los criterios diagnósticos hubo mínimas diferencias. Sin embargo, hubo mayores modificaciones en el entendimiento de los trastornos neuropsquiátricos (TSC-associated neuropsychiatric disorders, TAND) y las nuevas medicaciones (Tabla 1) [4].
El manejo diagnóstico-terapéutico adecuado del CET precisa de coordinación entre múltiples especialidades pediátricas y del adulto.
MANIFESTACIONES RENALES: CLÍNICA Y DIAGNÓSTICO
La afectación clínica más común del CET es el sistema nervioso central. La segunda manifestación es la renal y potencialmente la de peor pronóstico [5].
Las patologías renales más comunes son los angiomiolipomas (AML), los quistes renales y de manera infrecuente tumores renales, la mayoría de células claras. Los tumores renales malignos suelen aparecer en pacientes más jóvenes que en la población general (< 50 años).
Hay una mayor prevalencia de clínica renal en pacientes con mutación en gen TSC2, especialmente en síndrome de genes contiguos TSC2/PKD1.
El genotipo es predictor de la progresión de la función renal. Así, pacientes con mutación en TSC2 tienen mayor incidencia y severidad de AML y quistes, en comparación con TSC1 [6].
Angiomiolipomas
Los angiomiolipomas (AML) son tumores benignos derivados de células del endotelio (PEComas), relacionados con alteraciones genéticas de TSC con destacado papel en la regulación de la vía Rheb/mTOR/p70S6K [7]. Están compuestos por tejido adiposo, músculo liso y vasos sanguíneos [2]. Estos tumores surgen de una proliferación clonal de células epitelioides distribuidas alrededor de vasos sanguíneos. Los AML asociados a CET varían en tamaño y típicamente son múltiples y bilaterales [8]. Es la lesión renal más frecuente en pacientes con CET (prevalencia 55-80%) [6]. El 80% de los AML que presenta la población son esporádicos (frecuentes en mujeres, unilaterales, de menor tamaño y aparición en la cuarta a sexta década de la vida) y tienen características diferenciales con los AML asociados a CET [6]. AML normalmente causan más complicaciones en pacientes con CET que en aquellos que no tienen CET. La presencia de AMLs renales bilaterales en pacientes en edad 18-40 años, debería hacernos sospechar TSC como causa subyacente [9].
El crecimiento es más rápido en mujeres en tratamiento con estrógenos y niñas prepúberes, lo cual sugiere cierto efecto hormonal en su desarrollo [10].
Los AML constituyen la mayor causa de morbimortalidad en adultos con CET [5]. Su principal complicación es la hemorragia espontánea. El riesgo de hemorragia significativa está relacionado con el grado de vascularización, el tamaño de AML y de los aneurismas de su interior. Hay mayor riesgo de hemorragia, por aumento del riesgo de ruptura de AML, al presentan: lesiones > 4 cm o microaneurismas > 5 mm. Es de difícil diagnóstico en pruebas básicas rutinarias [11] [12] y puede aumentar el riesgo durante el embarazo. Los AML asociados a CET presentan una tasa de rotura y hemorragia de entre un 21 y un 100%, según las series publicadas.
Existen 2 tipos histológicos de AML: clásicos (contenido graso) y atípicos (pobres en grasa), hasta en 1/3 de los casos. Los AML clásicos suelen tener buen pronóstico. La variante epitelioide es un AML atípico con más del 10% de células epiteloides (células con abundante citoplasma eosinófilo y granular), que puede sufrir transformación maligna [13]. En pacientes con CET la coexistencia de ambos tipos de AML es común [8].
El diagnóstico y seguimiento se realiza por pruebas de imagen. La ecografía es útil como primera prueba en CET. Es poco precisa en AML pequeños y exofíticos, que pueden confundirse con grasa perirrenal. Ante una lesión hiperecogénica con sospecha de AML en un paciente con CET hay que confirmar con TC o RM [8] [14].
El estudio angiográfico TC o RMN con reconstrucción vascular es de elección para realizar un mapeo vascular de la lesión de forma preventiva en AML > 3 cm o tras un sangrado activo para localizar punto sangrante. La RMN es la técnica de elección para el diagnóstico inicial y el seguimiento.
El diagnóstico diferencial de los AML se realiza con tumores retroperitoneales y tumores renales malignos [8] [15] [16]. En casos dudosos se realizará biopsia de la lesión [8] [17], con análisis del tejido usando técnicas específicas de inmunohistoquímica. Se recomienda seguimiento radiológico por el riesgo de hemorragia retroperitoneal y malignización (aunque es rara). El sangrado espontáneo puede ser una complicación mortal. El riesgo del sangrado aumenta dependiendo del tamaño del AML [18]. En AML < 3 cm y asintomáticos se recomiendan controles preferiblemente con RMN anual. Si la lesión permanece estable, espaciar a cada 1-3 años. Puede alternarse ecografía con RMN para seguimiento [3] [19]. En AML con lesiones atípicas, de crecimiento rápido o en mujeres que inicien terapia con estrógenos, se deben realizar controles cada 6 meses.
Quistes Renales
Los quistes renales en el CET son la segunda manifestación renal después de los AML [20] [21]. Su incidencia aproximada es de 45%. Son más frecuentes en pacientes con mutación en el gen TSC2, especialmente si la mutación de TSC2 es truncante [6] [22]. Se pueden presentar como quistes simples corticales únicos, múltiples o con nefromegalia quística asociada a poliquistosis renal autosómica dominante.
Quistes simples o múltiples renales: suelen ser asintomáticos, aunque excepcionalmente, cuando son de gran tamaño pueden complicarse. La prevalencia aumenta con la edad y es más frecuente en varones. Su diagnóstico se realiza mediante ecografía. Las lesiones quísticas aisladas no requieren seguimiento específico. Sin embargo, pacientes con CET y quistes aislados requieren vigilancia, ya que la mayoría desarrollarán AML con la edad. No requieren tratamiento específico, tienen escasa repercusión clínica y no suelen requerir un manejo complejo [3][5].
Síndrome de genes contiguos: una minoría (2-3%) de pacientes con CET padece el Síndrome de genes contiguos TSC2/PKD1 (Poliquistosis renal autosómica dominante (PQRAD) tipo 1 con esclerosis tuberosa). El gen TSC2, responsable de la esclerosis tuberosa, se encuentra en el cromosoma 16p13.3, adyacente al gen de la poliquistosis renal autosómica dominante PKD1. Una deleción de gran tamaño puede afectar a ambos genes produciendo el llamado «síndrome de deleción de genes contiguos TSC2/PKD1» (MIM#600273) [23].
Se expresa con un fenotipo característico de poliquistosis renal autosómica dominante (PQRAD) grave y de aparición muy precoz, asociado con manifestaciones clínicas sugestivas del CET [23] e implica un peor pronóstico de la enfermedad renal.
La prevalencia estimada de esta entidad es < 1 / 1.000.000. Se hereda con un patrón de transmisión autosómico dominante teórico, aunque es infrecuente que los individuos afectados se reproduzcan.
El diagnóstico de sospecha se basa en la detección prenatal, al nacimiento o durante los primeros meses de vida, de riñones agrandados de tamaño, con múltiples quistes corticales de tamaño variable, que sugieren un cuadro de poliquistosis renal autosómica dominante (PQRAD) muy precoz y grave [23] sin historia familiar previa. Habitualmente los pacientes presentan hipertensión arterial de difícil control y/o disminución del filtrado glomerular y asocian síntomas o signos sugestivos del CET, generalmente neurológicos dada su temprana edad [2].
El fenotipo renal es más grave de lo habitual en pacientes con CET, con presencia de múltiples quistes en la ecografía, nefromegalia en aumento y progresión a enfermedad renal crónica (ERC) avanzada en el adulto joven [24].
El diagnóstico definitivo se establece mediante el estudio genético con el hallazgo de una deleción que afecta a los dos genes descritos [2].
Se debe realizar diagnóstico diferencial con la poliquistosis renal autosómica recesiva y la displasia quística por mutaciones del gen HNF1b entre otras [25].
Pacientes con TSC2/PKD1 tienen mayor riesgo de desarrollo de AML y cáncer de células renales, por lo que requieren seguimiento cada 1-3 años.
El manejo del paciente con CET es el propio de la enfermedad junto con el tratamiento sintomático que precise según la gravedad y progresión de la PQRAD asociada.
Litiasis renal
La incidencia de urolitiasis en pacientes con CET es desconocida. Se suele desarrollar en pacientes con CET tratados con antiepilépticos de manera prolongada, los cuales inhiben la anhidrasa carbónica en los túbulos renales. Ésto dará lugar a desarrollar una acidosis tubular renal, una acidosis metabólica sistémica y el pH urinario alcalino, junto a una baja concentración de citrato urinario, que promoverá la formación de piedras de fosfato cálcico más frecuentemente. Además, son pacientes con ciertos déficits cognitivos, más susceptibles de una ingesta hídrica inadecuada (< 2 l/día). Respecto al tratamiento, los alfabloqueantes favorecen la expulsión de litiasis < 10 mm. Las opciones quirúrgicas son limitadas en estos pacientes con AML y CET por el riesgo de sangrado [26].
Enfermedad Renal Crónica e Hipertensión Arterial
Existe mayor prevalencia de clínica renal, tanto de HTA como disminución del FG, en pacientes con mutación en gen TSC2, especialmente en síndrome de genes contiguos TSC2/PKD1.
La prevalencia de HTA en pacientes con CET es de hasta el 25% en menores de 25 años.
Las guías clínicas recomiendan valoración inicial de PA de un paciente diagnosticado de CET y posteriormente hacerlo anualmente [23]. El objetivo de control de presión arterial debe ser el mismo que en población hipertensa con enfermedad renal (< 140/90 mmHg en la consulta y < 135/85 mmHg mediante automedida de PA en domicilio o PA inferior al percentil 90 ajustado para talla y género si es un paciente pediátrico) [24] [25]. El control de la PA es fundamental para prevenir la progresión de la enfermedad renal crónica.
Algunos pacientes de CET desarrollan enfermedad renal crónica (ERC) con proteinuria que puede llevar a enfermedad renal crónica terminal (ERCT) en ausencia de AML gigantes o enfermedad renal macroquística extendida. Los riñones son típicamente pequeños y ecogénicos en la ecografía. La biopsia renal de los mismos, con frecuencia revela glomeruloesclerosis focal y segmentaria (GEFS) con enfermedad intersticial crónica, probablemente secundario a la pérdida nefronal. La evolución del desarrollo de la proteinuria y de la ERCT se caracteriza por ser lenta en comparación con GEFS primaria.
Algunos pacientes presentan enfermedad intersticial crónica. La patogénesis no está bien definida. Podría estar en relación con la deficiencia de tuberina.
EVOLUCIÓN Y SEGUIMIENTO
Los angiomiolipomas causan enfermedad renal crónica (ERC) debido a la destrucción del parénquima renal, junto con los tratamientos invasivos de los angiomiolipomas (embolización y nefrectomías parciales y totales). Pacientes con ERC secundaria a GEFS también puede progresar a ERCT.
El 40% de los pacientes con CET presentan ERC estadio 3 (o más avanzada) alrededor de los 45-54 años [5] [23]. La enfermedad renal es más prevalente en pacientes con mutaciones en TSC2 y, sobre todo, en pacientes con síndrome de genes contiguos TSC2-PKD1, los cuales suelen progresar hacia la insuficiencia renal avanzada alrededor de la 2ª década de la vida [27].
La función renal debe ser evaluada al diagnóstico y posteriormente anualmente en pacientes adultos.
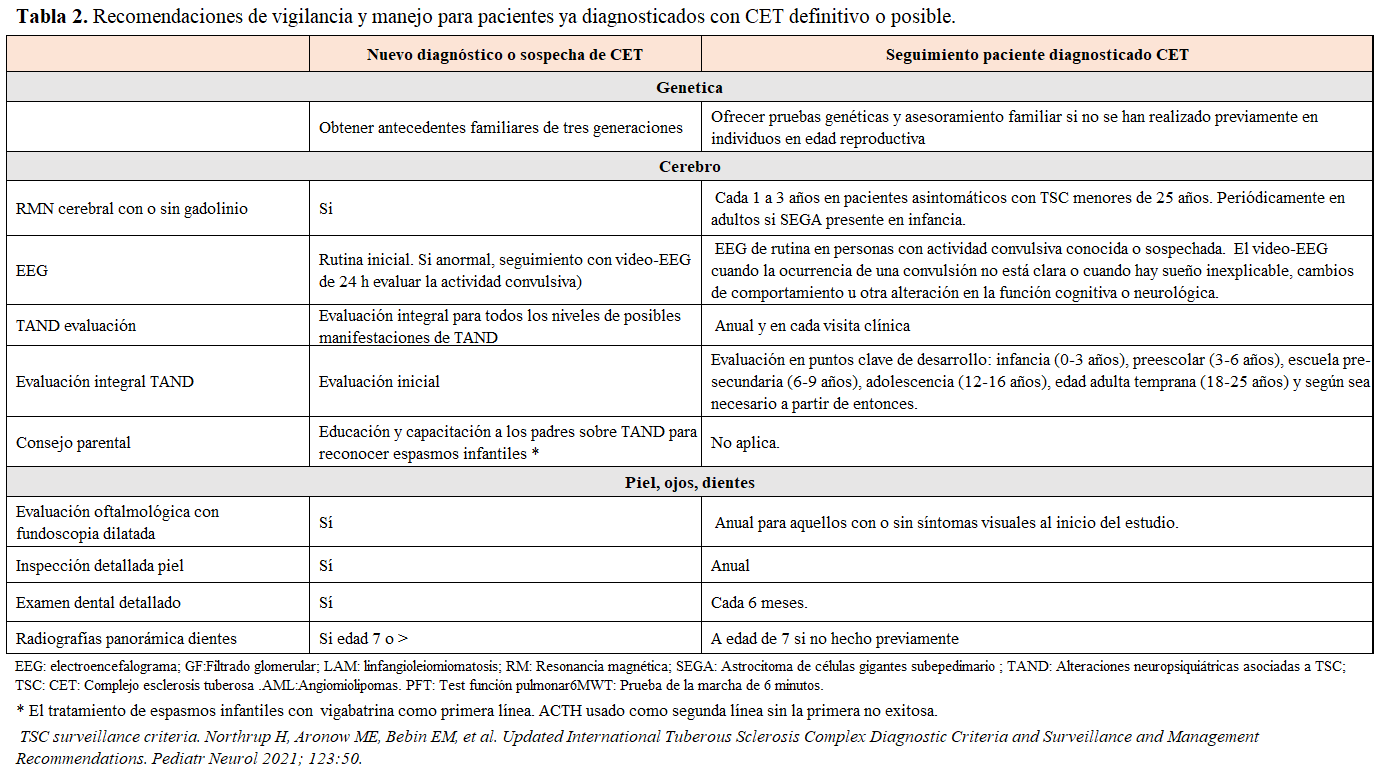
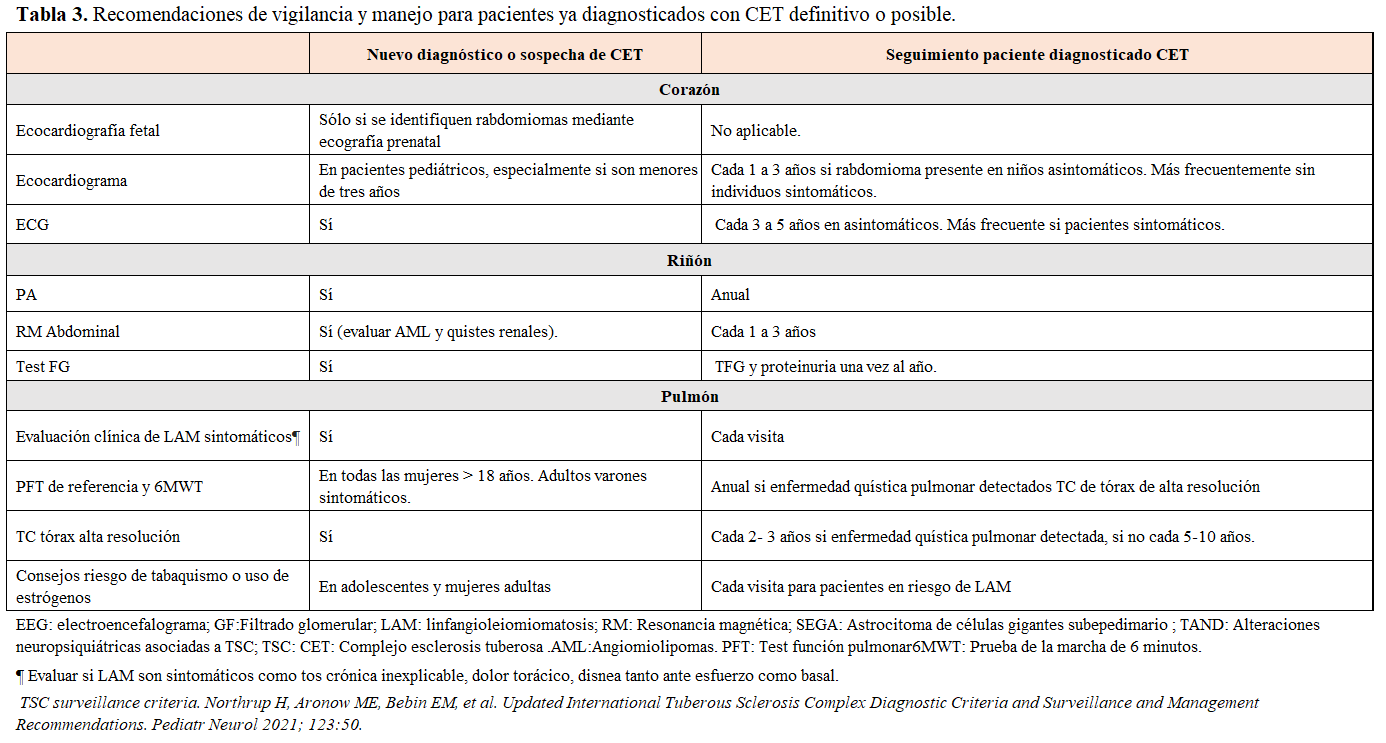
La CET debe llevar una revisión protocolizada de los órganos más frecuentemente afectos para limitar la aparición de complicaciones En las últimas recomendaciones actualizadas se detallan las revisiones que se requieren en el diagnóstico inicial de CET y en su seguimiento crónico [4] [28] [29] (Tabla 2) y (Tabla 3)
La enfermedad renal es la segunda causa de muerte en pacientes con CET (después de la neurológica) y la causa más común de muerte en adultos afectados.
TRATAMIENTO
Tratamiento antihipertensivo
Los inhibidores del sistema renina angiotensina son los fármacos antihipertensivos de primera elección [23]. Además, se ha demostrado la presencia de receptores tipo 1 de la angiotensina II en los angiomiolipomas y experimentalmente el bloqueo de angiotensina II parece tener un potencial efecto terapéutico a este nivel [30]. En pacientes tratados con everólimus, existe una mayor incidencia de angioedema en asociación con IECA, se aconseja el tratamiento con ARA II [31] [32]. En niños con espasmos infantiles, el tratamiento con corticotropina puede inducir HTA; en este contexto, el tratamiento inicial con diuréticos puede ser adecuado.
Tratamiento Renal Sustitutivo
No existe contraindicación en relación a la elección de la técnica sustitutiva renal (TRS). La actitud ante la TRS dependerá de la capacidad neurocognitiva del paciente, por lo que se realizará de forma individualizada. En los pacientes trasplantados, sería razonable incluir inhibidores de mTOR en su terapia inmunosupresora dados sus beneficios en relación a las manifestaciones de la enfermedad.
TRATAMIENTO DE LOS ANGIOMIOLIPOMAS
El objetivo del tratamiento de AML es prevenir los eventos agudos, preservar el parénquima renal y la función renal [20].
Los AML asociados a CET presentan una tasa de rotura y hemorragia elevada y se asocian a altas tasas de morbilidad en estos pacientes [18] [20]. El mayor riesgo de sangrado se establece si el tamaño es superior a 4 cm o en la aparición de microaneurismas > 5 mm.
En todas las series publicadas, el riesgo de sangrado es mínimo cuando el tamaño del AML está por debajo de 3 cm, por lo que la vigilancia es la norma en estos casos, con ecografía o resonancia bianual [8].
Tratamiento urgente
En el caso de hemorragia aguda, el tratamiento de elección es la embolización transarterial [23], que consigue una eficacia del 93% [33]. El síndrome post-embolización aparece en un 35% de los pacientes. Aunque la nefrectomía y la embolización consiguen solucionar el cuadro, el riesgo de insuficiencia renal es siete veces superior si se realiza nefrectomía [34], por ello, debe evitarse siempre y cuando la urgencia lo permita y estén disponibles técnicas de radiología vascular [19] [23].
En el caso de rotura aguda asociada a embarazo, el tratamiento de elección sigue siendo la embolización. En algunos casos, una opción es la realización de cesárea urgente y embolización posterior [35] [36].
Tratamiento no urgente
Debe evitarse en la medida de lo posible cualquier técnica que elimine parénquima renal funcionante, dada la condición de crónico, bilateral y múltiple [19].
La embolización programada de los AML ha sido durante años el tratamiento de elección, sustituidos actualmente por los inhibidores mTOR [19] [23]. La presencia de hipertrofia de uno o más grandes vasos que vascularicen facilita el procedimiento. La tasa de éxito de la embolización es muy elevada [33] [37], consiguiendo tanto la disminución del tamaño, el dolor o la sintomatología asociada (aproximadamente un 50% [35]). La función renal se suele mantener y sólo se asocia a un descenso en un 3,3% de los pacientes [34]. Los AML suelen recurrir tras embolización [23], por lo que está descrita una segunda reembolización del aneurisma entre el 20 y el 80% de los casos [33].
Cuantas más embolizaciones, mayor es el riesgo de insuficiencia renal [38].
Respecto al material utilizado, se prefiere el uso de partículas mayores de 150 micras por su eficacia y menor riesgo de émbolos a distancia [39].
El uso de la crioablación por congelación está derivado de su utilización en los tumores renales menores de 4 cm [40]. Para el tratamiento del angiomiolipoma está reportada una eficacia de hasta un 100% con menor estancia hospitalaria, pero no hay información suficiente acerca de las complicaciones [35] [41]. Es una alternativa atractiva pero aún faltan datos para establecerse por encima de la embolización.
El uso de radiofrecuencia o microondas también ha sido estudiado y publicado en series limitadas, con tasas de eficacia por encima del 78% [42] [43], pero asociado a efectos secundarios importantes como sangrados, lesiones nerviosas o fístulas de víscera hueca. Por ello, este tratamiento se mantiene también como alternativa a la embolización [23].
La cirugía es la alternativa cuando las opciones mínimamente invasivas fallan, por su agresividad y pérdida de parénquima renal. El 13% de los pacientes con CET y angiomiolipomas son intervenidos por nefrectomía radical (5%) o parcial (8%) [42]. La nefrectomía ha sido sustituida por la embolización selectiva, dado el alto índice de insuficiencia renal que asociaba [34].
El uso de la nefrectomía parcial en estos pacientes es mayor que el de la nefrectomía, siguiendo el objetivo de preservar función renal, pero casi un 45 % de ellos necesitará una segunda nefrectomía parcial [44] o incluso una nefrectomía radical posterior, en caso de riesgo de hemorragia significante posterior o fístula urinaria.
Tratamiento crónico
Las Guías recomiendan como primera línea de tratamiento iniciar inhibidores de mTOR en adultos con AML asociado con el CET que presentan riesgo de complicaciones:
o Tamaño mayor de 3cm, el 50% pueden volverse sintomáticos,
o Presencia de microanurismas > 5mm
o Crecimiento rápido (>0,25 cm/año)
o Presencia de tumores múltiples o bilaterales [8] [12] [23].
La evidencia se basa en el análisis del cambio en la suma del volumen del angiomiolipomas donde se ha demostrado una reducción permanente del tamaño de las lesiones [45] [46].
El tratamiento con inhibidores de mTOR ha resultado exitoso. Los resultados del estudio EXIST-1, evalúan la eficacia y tolerabilidad del everólimus, confirmándolos. Previene o disminuye el crecimiento de tumores, preserva la función renal, reduce la necesidad de futuras embolizaciones y reduce la frecuencia de hemorragias (se teoriza que podría prevenir el remodelamiento vascular y formación de aneurismas) [46]. Posteriormente se realiza el estudio Exist-2, un ensayo controlado doble ciego fase 3( everolimus vs placebo), que investiga la eficacia y seguridad de everolimus en adultos con AML > 3 cm. El 80% de pacientes tratados con everolimus tuvieron una reducción de > 30% del volumen de AML respecto al 3% de los pacientes tratados con placebo. Esta reducción se mantuvo durante 46,9 meses [47].
La dosis recomendada es de 10 mg de everólimus una vez al día según ficha técnica aunque se podría ajustar la dosis según niveles plasmáticos iniciales de 3-6 ng/ml y aumentar en 2 meses a 6-10 ng/ml. El tratamiento debe continuar mientras haya beneficio clínico o hasta que aparezca una toxicidad inaceptable. Para las reacciones adversas leves normalmente no se requiere ajuste de la dosis. Si se requiere una reducción de la dosis, la dosis recomendada es aproximadamente un 50% más baja que la dosis diaria administrada previamente. Para reducciones de dosis por debajo de la dosis más baja disponible. Se debe considerar la administración de la dosis a días alternos. Se debe monitorizar dosis al inicio del tratamiento, si modificación de tratamiento, por concomitancia de inductores o inhibidores de CYP3A4 y tras cambio en el estado hepático (Child-Pugh).
Los inhibidores de mTOR se metabolizan principalmente por CYP3A, por tanto, los inductores o inhibidores de CYP3A4 o de PgP pueden variar las concentraciones del fármaco en sangre. No se recomienda el tratamiento concomitante con inhibidores potentes del CYP3A4 como: ketoconazol y otros azoles, claritromicina, telitromicina, nefazodona o inhibidores de la proteasa del VIH [48], ni con inductores del CYP3A4: carbamazepina, oxcarbazepina, que reducen los niveles de imTOR [49].
Seguimiento de imagen: Lo más habitual es valorar el tratamiento mediante volumetrías pautadas de las lesiones renales más grandes y el tamaño total del riñón usando RM o TC según la disponibilidad [8]. Se recomienda control anual por RM pudiéndose espaciar más una vez se alcanza una estabilidad.
Efectos adversos (EA): La mayoría de los EA cesan tras reducción de dosis y/o suspensión. Los EA más frecuentes son estomatitis, úlceras orales, supresión de médula ósea, infecciones, dislipemia y otras alteraciones metabólicas.
o La estomatitis es la complicación más frecuente, pero no grave, con comportamiento recurrente y disminución progresiva de la intensidad. Suele ser dosis dependiente. Se recomienda mantener frecuente higiene bucal usando agentes no alcohólicos como el SSalino 0,9%. Para aliviar la mucositis, se podría usar tratamiento tópico con sucralfato o enjuagues bucales con dexametasona [50].
o Infecciones: Previo al inicio de tratamiento, se deben pedir marcadores virales. Los pacientes con hepatitis B activa deben iniciar profilaxis al menos una semana antes del comienzo del tratamiento y ésta se mantendrá al menos 6 meses tras su suspensión. En todos los casos de infección sintomática se debe suspender everólimus y reiniciar tratamiento con la mitad de la dosis [44]. Si existe invasión fúngica sistémica el tratamiento debe suspenderse inmediatamente.
o Alteraciones metabólicas: Diabetes y Dislipemia: Tratamiento según las guías de consenso. No hay contraindicación para uso de estatinas, fibratos u omega 3.
o Hipofosfatemia: Suspensión del fármaco si hipofosfatemia < 1 mg/dl [51].
o Proteinuria e insuficiencia renal: Es necesario monitorizar albuminuria y función renal. Si aparece albuminuria se puede realizar tratamiento con antagonistas de los receptores de la angiotensina. Si proteinuria grave se aconseja suspender el tratamiento para disminuir el riesgo de insuficiencia renal. El efecto sobre función renal no ha sido completamente evaluado a largo plazo [51].
o La neumonitis no infecciosa: Se debe confirmar el diagnóstico de neumonitis no infecciosa con cultivos de esputo y sangre en los casos sintomáticos, siendo un diagnóstico de exclusión. Los casos asintomáticos no requieren interrupción del tratamiento. Ajustar dosis de everólimus en casos levemente sintomáticos. En los casos más graves estará indicado la suspensión del tratamiento y el uso de corticosteroides. Típicamente suele aparecer a 2-6 meses de iniciar el tratamiento, por lo que se recomienda realizar un control radiológico cada 6 semanas en los primeros 6 meses de tratamiento [52].
o Anemia microcítica, trombocitopenia y linfopenia progresiva que raramente obligan a la suspensión de la medicación [53]. La toxicidad hematológica es concentración-dependiente; su aparición puede señalar una interacción o un fallo en la toma de medicación. Es recomendable conocer la concentración a la que ha aparecido la toxicidad, para reiniciar un nuevo esquema en rango terapéutico. El manejo es similar a cualquier otra citopenia [54].
o Amenorrea: Hay que vigilar la aparición de deficiencias o disfunciones en el crecimiento, el desarrollo o la maduración sexual. La mayor parte de los casos son transitorios, manejables y sin provocar la interrupción del tratamiento. Se recomienda remitir a Ginecología para descartar otras causas.
o Alteración de la cicatrización. Se debe suspender el fármaco en el periodo peri-quirúrgico, sobre todo en pacientes de riesgo: edad avanzada, afectos de diabetes, malnutrición, con elevado índice de masa corporal (IMC), así como pacientes que reciban tratamiento concomitante con corticosteroides y/o con anticoagulantes.
Antes de iniciar el tratamiento con everólimus se debe: informar al paciente de beneficios y riesgos; realizar analítica completa incluyendo perfil lipídico y control glucémico; información al paciente de cuidados higiénicos bucales; inventario de medicaciones e información de las interacciones con los fármacos descritos anteriormente; las vacunas vivas se deben evitar o completar antes del inicio del mismo. El tratamiento con everólimus se debe suspender temporalmente antes de una intervención, para evitar retrasar la cicatrización. Finalmente, advertir a las mujeres la necesidad de evitar embarazos.
En la práctica habitual se recomienda: Cesar el tratamiento temporalmente 1-2 semanas previas a la intervención programada o para inmunización de vacunas vivas o durante una infección nueva o prolongada u otros efectos adversos (EAMS) y recuperar el tratamiento tras la recuperación (teóricamente 1-2 semanas tras vacunación y 2-4 semanas tras intervención). Los beneficios se han demostrado incluso si los niveles de mTOR están en el límite bajo o incluso por debajo de los rangos recomendados de (5 to 15 ng/ml) [55].
Finalizar tratamiento: Fracaso del tratamiento tras 6 meses sin estabilizar AML a dosis máximas toleradas, si hay ERC progresiva con FGR 3 g/dl y en caso de efectos adversos inaceptables a pesar de ajustar dosis [56].
PUNTOS CLAVE
- El CET es una enfermedad rara, hereditaria, multisistémica y con un amplio espectro fenotípico. Caracterizada por el desarrollo de tumores benignos en múltiples órganos, causado por mutaciones en TSC1 o TSC2.
- Se debe realizar RM en el momento del diagnóstico. Posteriormente, seguimiento cada 1-3 años con RMN/Ecografía según características del paciente.
- Control de PA con objetivo de presión arterial en la consulta debe ser < 140/90 mmHg y < 135/85 mmHg. Los inhibidores del sistema renina angiotensina son los fármacos de primera elección.
- La embolización transarterial es la técnica de elección si hay hemorragia aguda. La segunda línea terapéutica es la embolización selectiva, si no fuera posible, nefrectomía parcial.
- Se recomienda el tratamiento con everólimus de los pacientes adultos con angiomiolipoma renal asociado a CET que presentan riesgo de complicaciones (AML > 3cm) a una dosis inicial de 10 mg/día.
- Nunca se debe olvidar que el manejo de CET requiere de la colaboración de múltiples especialistas.