Resultados globales del trasplante renal
Palabras clave
Trasplante renal, supervivencia, mortalidad, factores de riesgo, pronóstico, prevención, selección
Introducción
El trasplante renal (TX) es el tratamiento de elección en los enfermos con insuficiencia renal crónica terminal, pero estos pacientes presentan una elevada mortalidad, principalmente de origen cardiovascular (30-40%), con respecto a la población general [1] [2]. Las principales causas de pérdida de los injertos son la disfunción crónica del injerto (DCI) y la muerte del paciente con injerto funcionante [3]. Asimismo, la mortalidad de origen infeccioso (20-30%) y tumoral (10-20%) ha aumentado en el contexto de una población de donantes y receptores más envejecida que recibe una potente inmunosupresión. Estos hechos justifican que los excelentes resultados a corto plazo no lleven una trayectoria paralela a medio y largo plazo en muchos centros de trasplante. Con todo, existen diferencias en los resultados de supervivencia entre países con gran actividad trasplantadora como USA y España [4]
La (Tabla 1) muestra las tasas globales de supervivencia del paciente y del injerto en los trasplantes renales con donante fallecido y donante vivo, y en el trasplante simultáneo renopancreático, en el primer, quinto y décimo año post injerto, en la era de la moderna inmunosupresión [5] [6] [7]. El trasplante con donantes tras parada cardiocirculatoria controlada (donación en asistolia controlada Mastrich III) ofrece resultados similares de supervivencia que el trasplante renal con donante fallecido [8]. Sin embargo, estas tasas de supervivencia son inferiores en pacientes con diabetes pretrasplante [9]. Por tanto, prolongar la supervivencia del paciente y del injerto constituyen prioridades clínicas en estos enfermos. Las siguientes medidas pueden optimizar los resultados del TX: 1) Intervenir los factores de riesgo pre- y post-TX; 2) identificar las medidas subordinadas de la supervivencia; y 3) implementación de nuevas estrategias diagnósticas y terapéuticas (donación tras parada cardiocirculatoria, biopsias de protocolo, nuevos biomarcadores, medición precisa de la función renal); y 4) aplicar índices pronósticos para predecir la supervivencia del injerto y del paciente.
Supervivencia del injerto. Factores de riesgo y medidas subordinadas de la supervivencia
La introducción de los nuevos y potentes inmunosupresores ha permitido una excelente tasa de supervivencia de los injertos en el primer año, pero existe controversia a más largo plazo. Los Registros de Estados Unidos y Europa muestran tasas de fallo del injerto relativamente estables después del primer año desde finales de la década de 1980 [10]. Estudios observacionales de grandes registros muestran sólo un incremento marginal de la vida real de los injertos trasplantados entre 1988-1995 [11]. Por el contrario, estudios monocéntricos y multicéntricos más recientes muestran que la supervivencia de los injertos y la tasa de pérdida de función renal han mejorado notoriamente durante el periodo 1995-2005 [12] [13] [14]. Esto se debe, probablemente, al empleo de micofenolato mofetil y tacrolimus que han propiciado un menor número de rechazos y una mejoría en la función del injerto renal. En cualquier caso, los modelos exponenciales (p. ej. modelo de Cox) empleados habitualmente en el cálculo de la vida media de los injertos pudieran sobrestimar la supervivencia de los mismos [15] [16].
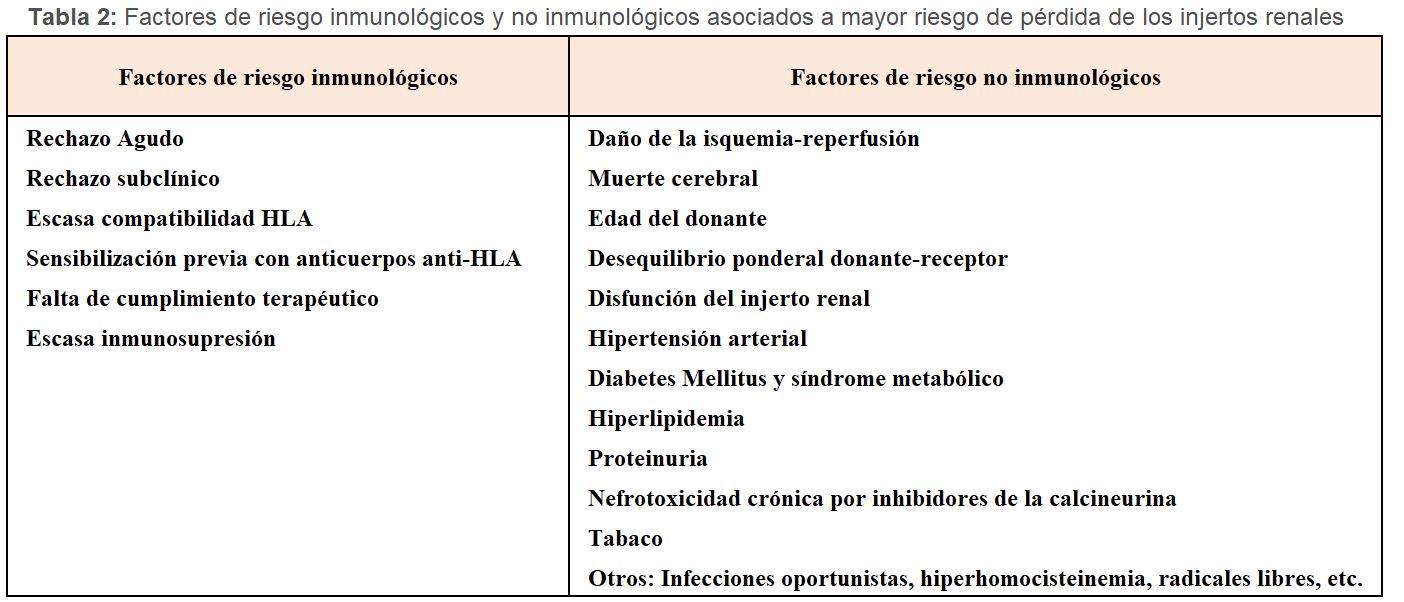
En la (Tabla 2) se muestran los principales factores de riesgo, inmunológicos y no inmunológicos, para la pérdida de los injertos renales [17] [18]. El rechazo agudo constituye un factor de riesgo de primera magnitud, especialmente si coexiste con otros factores no inmunológicos como la función renal retrasada (FRR), proteinuria o la edad avanzada del donante. A mayor número de rechazos y severidad de los mismos, peor supervivencia del injerto. En cualquier caso, debemos recurrir a marcadores de supervivencia más sensibles y más precoces que el rechazo agudo histológico tales como biomarcadores séricos y urinarios [19] [20] o la estimación más precisa de la función renal [21] [22].
La (Tabla 3) muestra los potenciales candidatos a marcadores subordinados de la supervivencia del injerto renal con capacidad predictiva variable. La elevación de la creatinina sérica se asocia a pérdida del injerto, pero es un parámetro poco específico. El cálculo de filtrado glomerular mediante ecuaciones matemáticas (Cockroft-Gault, el MDRD ó el CKD-EPI) puede predecir mejor la supervivencia del injerto, pero no reflejan con precisión la verdadera función del injerto [23]. El estudio de los cambios de la función del injerto en el tiempo, representa la medida clínica óptima para estimar la supervivencia del injerto [24]. Un descenso del 40% en la inversa de la creatinina en el tiempo, representa un excelente predictor de la supervivencia del injerto. Asimismo, una caída del 25% en el filtrado glomerular calculado se asocia de forma precisa a menor supervivencia del injerto. Otros métodos como la determinación de la cistatina C, el uso de radiofármacos (I-talamato ó Cr-EDTA) o el aclaramiento plasmático con iohexol pueden ser también útiles, pero requieren un excesivo consumo de tiempo y de recursos.
Las lesiones de rechazo agudo y otros hallazgos histológicos observados en las biopsias de protocolo, como la combinación de fibrosis intersticial y atrofia tubular (FI/AT) o el rechazo subclínico, pueden representar buenas medidas subordinadas de la supervivencia del injerto. De hecho, la combinación de FI/AT y rechazo subclínico detectados a los 3 y 6 meses post-TX, predicen el pronóstico del injerto [25]. Asimismo, el rechazo subclínico se ha asociado con rechazo humoral crónico [26] [27] [28] y mayor riesgo de pérdida de los injertos. Una elevada variabilidad en los niveles de tacrolimus se asocia a disfunción inmunológica e inflamación y lesiones crónicas histológicas que incrementan el riesgo de pérdida del injerto [29] [30]. Un coeficiente de variabilidad superior al 20% se ha asociado con un mayor score de cronicidad en las biopsias de protocolo y una peor supervivencia del injerto al año postrasplante [31]. En esta línea, la infiltración intersticial precoz de macrófagos puede incrementar el riesgo de pérdida de los injertos [32].
No obstante, el carácter invasivo, la gran variabilidad interobservador y la ausencia de una etiología específica de FI/AT pudieran limitar la generalización de las biopsias de protocolo. Con todo, queda por saber si la implementación de las biopsias de protocolo puede ayudar a la detección y el manejo de estas lesiones para mejorar las tasas de supervivencia. Estudios observacionales, utilizando estudios de propensión, no encontraron un claro beneficio en la supervivencia de los injertos en aquellos pacientes sometidos a biopsias de protocolo frente a los que no fueron biopsiados [33]. La proteinuria es un marcador de daño renal y se asocia a menor supervivencia del injerto [34]. Asimismo, la disfunción renal es un factor de riesgo para la pérdida de los injertos a largo plazo [35]. La combinación precoz (3º mes post-TX) o más tardía (1º año post-Tx) de albuminuria de baja cuantía (100-1000 mg/día) y disfunción renal (GFR 30-60 ml/min) o hipertensión arterial incrementa significativamente el riesgo de pérdida de los injertos y la mortalidad [36] [37] [38] [39].
Índices pronóstico para la supervivencia del injerto
Actualmente, un 30-40% de los TX sufren FRR y un 40% de los donantes presentan criterios de marginalidad en el estudio pre-TX. Ambos factores impactan negativamente en la supervivencia del injerto. Por tanto, predecir la FRR y estimar la calidad del órgano donado mediante índices pronósticos puede mejorar los resultados del TX.
Se han desarrollado un índice y un nomograma que cuantifican la probabilidad de FRR y pérdida del injerto agrupando factores de riesgo del donante y del receptor antes del TX [40]. Este índice ha sido validado en otras poblaciones [41]. Sin embargo, esta predicción también ha sido cuestionada por la gran variabilidad en los resultados [42].
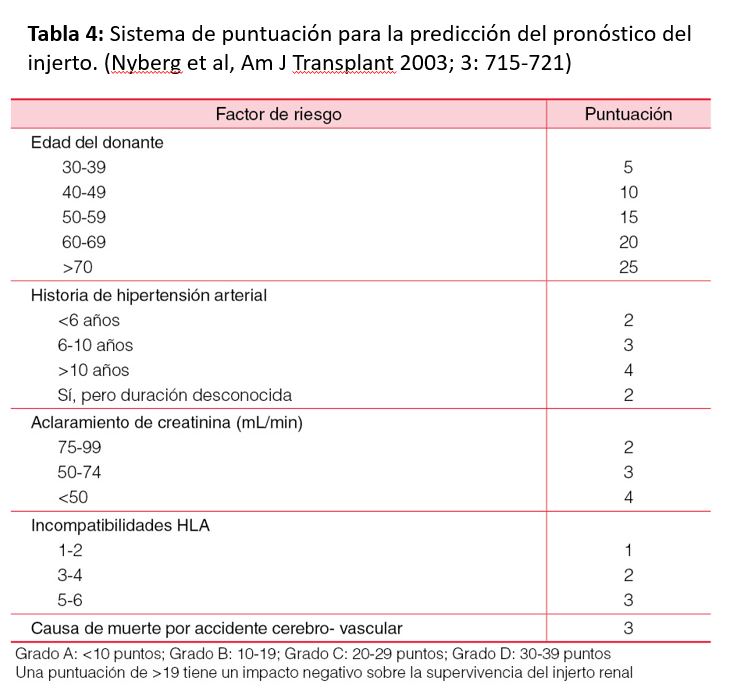
La identificación de donantes con criterios expandidos (DCE), puede ayudar a estimar la supervivencia de los injertos. Existe un sistema de puntuación, que permite identificar injertos en riesgo de disfunción precoz o tardía a partir de variables clínicas del donante (Tabla 4). Una puntuación>19 (grados C y D) tiene un impacto negativo sobre la supervivencia del injerto. La asignación de órganos procedentes de donantes marginales a receptores con similares características clínicas puede mejorar la vida media global de los injertos y del paciente [43] [44] [45]. Otros índices pronósticos elaborados para predecir la supervivencia del injerto, que incorporan características del donante y variables del proceso del trasplante, ofrecen una gran variabilidad en su capacidad predictiva. El análisis histológico del injerto puede ayudar a predecir el riesgo de pérdida del mismo, pero esto no ha sido confirmado en estudios controlados. La implementación de sistemas morfométricos computarizados pudieran de ser utilidad para predecir la supervivencia de los injertos renales frente al score histológico convencional de la clasificación de Banff [46].
A partir de variables clínicas se ha desarrollado un modelo predictivo de pérdida del injerto en el momento del TX, a la semana del mismo y después del primer año post-TX que pudiera constituir una herramienta clínica muy útil para instaurar estrategias profilácticas [47]. Recientemente ha sido validado en la población europea y americana un score de riesgo de pérdida del injerto (iBox Score) a los 3,5 y 7 años del trasplante, usando variables clínicas (GFR, tiempo postrasplante y proteinuria), histológicas (microinflamación, fibrosis/atrofia intersticial, glomerulopatía del trasplante) e inmunológicas (FMI de anticuerpos donante específicos antiHLA) con excelente capacidad de discriminación (índice concordancia> 0.80) y calibración [48].
Supervivencia del paciente. Factores de riesgo. Medidas subordinadas de la supervivencia
La mortalidad cardiovascular en el paciente con TX está incrementada (3-4 veces) con respecto a la población general. Esto se debe a la confluencia de múltiples factores de riesgo pre-TX y post-TX, en el marco del tratamiento inmunosupresor, que condicionan progresión de la ateromatosis y desarrollo de alteraciones estructurales y funcionales cardíacas. Sin embargo, esta elevada mortalidad cardiovascular no se explica suficientemente bien por los factores tradicionales de riesgo vascular, por lo que es posible que otros factores no tradicionales o "pobres" indicadores de salud (pobreza, inactividad fisica, sobrepeso, etc.) contribuyan a una menor supervivencia del paciente. La enfermedad cardiovascular pre-TX, el tiempo en diálisis, una historia previa de cáncer o diabetes mellitus y la disfunción del injerto renal constituyen factores de riesgo de eventos cardiacos [49]. Asimismo, la presencia de calcificaciones vasculares pre-TX, la hiperhomocisteinemia, la inflamación, el síndrome metabólico o la hipertrofia ventricular izquierda son entidades clínicas muy prevalentes en estos enfermos que pueden incrementar el riesgo de muerte post-TX. Algunos de estos factores deben ser implementados en la práctica clínica como medidas subordinadas de supervivencia en esta población.
Paralelamente, están aumentando la mortalidad infecciosa y tumoral. No se conocen exactamente los mecanismos de este fenómeno, pero una mayor inmunosupresión en el contexto de una población más longeva, pudieran ser las responsables de tal incremento. Estudios observacionales han mostrado una relación directa entre la inmunosupresión acumulada y la incidencia de procesos infecciosos y tumorales, pero otros factores de riesgo como la edad, el hábito de fumar, el antecedente de cáncer antes del TX y las infecciones víricas contribuyen a esta mayor mortalidad de origen tumoral [50]. Por tanto, la inclusión de biomarcadores virológicos y tumorales debería tenerse en cuenta para la optimización del seguimiento post-TX. Las complicaciones óseas, incluidas la pérdida de masa ósea y las fracturas, incrementan notoriamente la morbilidad de esta población. La osteodistrofia pre-TX, la insuficiente ingesta de calcio y/o vitamina D y los inmunosupresores son algunos de los factores involucrados en estos procesos [51].
Finalmente, los inmunosupresores tienen un impacto negativo en la supervivencia del paciente a través de magnificar los efectos deletéreos de los factores de riesgo cardiovascular [52].
Índices pronósticos de la mortalidad post-TX
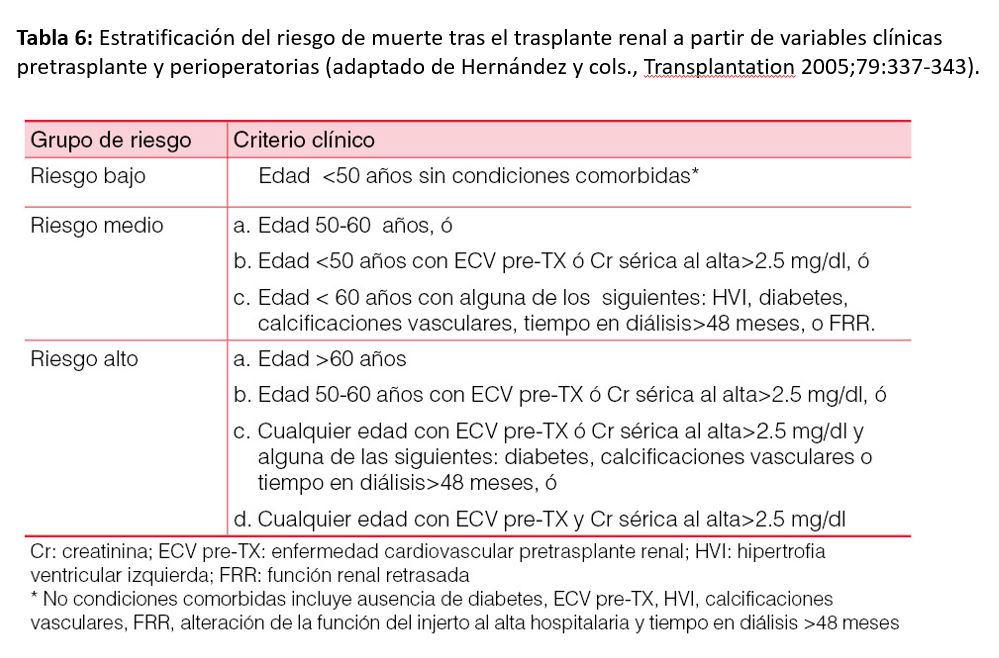
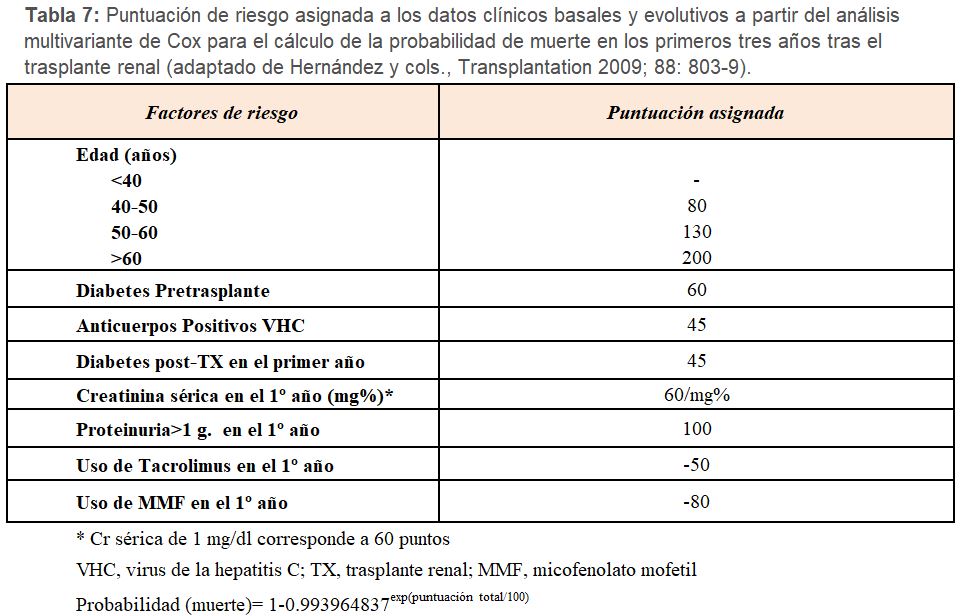
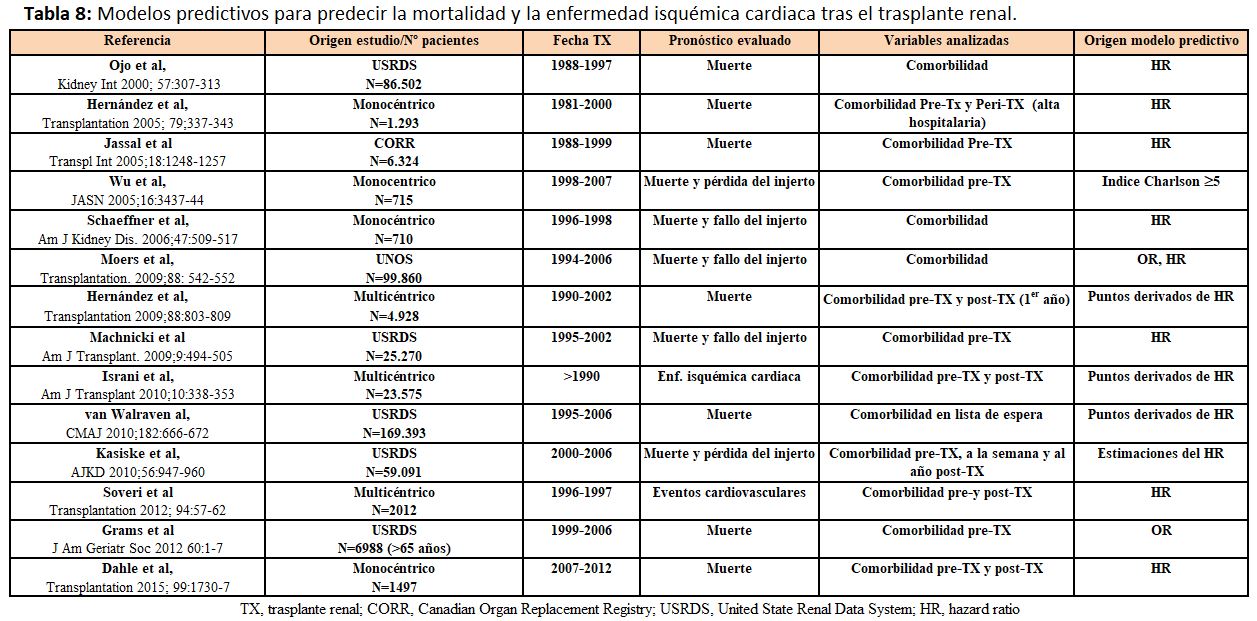
La estimación adecuada de la supervivencia puede ayudar a los clínicos a tomar decisiones en el manejo de estos pacientes para mejorar los resultados de esta población. Al mismo tiempo, la identificación de factores pronósticos facilita la generación de modelos predictivos para la detección de pacientes con elevado riesgo de muerte post-TX [53]. La aplicación de índices pronósticos permite estratificar el riesgo, predecir la mortalidad y elaborar estrategias para prolongar la supervivencia. El índice de comorbilidad de Charlson, que incluye 19 condiciones clínicas valoradas con una puntuación de 1-6 (Tabla 5), puede ser útil para predecir la supervivencia tras el TX. Una puntuación global de ICC≥5 incrementa el riesgo de mortalidad tras el TX [54]. Sin embargo, este índice no incluye condiciones comórbidas inherentes al TX, lo cual pudiera infraestimar el riesgo. La combinación de factores clásicos de riesgo pre-TX y datos clínicos perioperatorios puede ayudar a estratificar el riesgo post-TX (bajo, medio y alto), pero no incluye datos evolutivos del seguimiento post-TX (Tabla 6). Un nuevo índice pronóstico combina factores clásicos de riesgo con los inherentes a la evolución post-TX, incluida la inmunosupresión, para obtener una puntuación sumatoria de riesgo y calcular la probabilidad de muerte en los primeros tres años post-TX [55] (Tabla 7) y (Figura 1). Por ejemplo, una puntuación de 100, 200 y 300 correspondería a una mortalidad a los 3 años de 1.7%, 4.7% y 12%, respectivamente.
A partir de los datos del registro americano se ha elaborado un score de predicción de mortalidad para pacientes en lista de espera de TX, receptores de TX con donante de cadáver y TX con donante vivo. Los datos clínicos incluidos en este modelo fueron la albúmina sérica, el índice de masa corporal, la causa de la enfermedad renal y la comorbilidad. A medida que aumenta la puntuación de riesgo, se incrementa exponencialmente el riesgo de muerte dentro de los primeros 5 años post-TX [56].
Finalmente, la predicción de la cardiopatía isquémica post-TX mediante modelos predictivos pudiera contribuir a reducir la mortalidad en estos enfermos.
La aplicación de algunos de estos índices, que utilizan sistemas de puntos o ecuaciones a partir de la comorbilidad pre-TX y post-TX, pudiera contribuir a incrementar la supervivencia de estos pacientes a más largo plazo (Tabla 8). La fragilidad, como medio para estratificar el riesgo antes del trasplante, ha sido el foco de una considerable investigación en los últimos años. En la población dependiente de diálisis la fragilidad tiene una alta prevalencia, 42-73% en algunos estudios (EEUU y Canadá), casi 5 veces más alta que la prevalencia en la población general. Los datos disponibles en España son escasos, reportando una prevalencia de fragilidad del 5.6-55%. La presencia de fragilidad implica una peor evolución en los pacientes de todas las edades con enfermedad renal crónica aumentando el riesgo de hospitalización, deterioro cognitivo y mortalidad [57] [58]. Varios estudios observan una prevalencia de fragilidad del 15-20% tanto en los pacientes en lista de espera como en los que reciben un trasplante renal [59][60].
Las herramientas para evaluar la fragilidad, escalas e índices pueden ser útiles para identificar qué pacientes están en riesgo de padecer más complicaciones postrasplante. Existen distintas escalas [61], siendo la más utilizada en pacientes renales la escala de Fried, que se basa en la detección de cinco dimensiones fenotípicas.
Aspectos para mejorar los resultados del trasplante renal
Acorde a las guías de práctica clínica para el manejo de los enfermos con TX (KDIGO, Transplant Work Group, Am J Transplant. 2009; 9 Suppl 3:S1-155) [62] , las siguientes medidas terapéuticas y diagnósticas pueden optimizar los resultados de este tratamiento sustitutivo:
1. Selección del donante y receptor
Una adecuada evaluación y selección del donante y receptor puede contribuir a mejorar los resultados del TX en términos de supervivencia. Esto incluye a los pacientes más longevos y más frágiles donde una cuidadosa selección de estos enfermos para realizar un trasplante puede mejorar sustancialmente la supervivencia comparado con permanecer en diálisis [63] [64].
2. Prevención y tratamiento del rechazo agudo
La terapia de inducción (antagonistas del receptor de la IL2 o timoglobulina) previene del rechazo agudo y pude ayudar a mejorar los resultados del injerto renal. Se debe realizar biopsia antes de tratar un rechazo agudo, si las condiciones clínicas lo permiten. El tratamiento de elección inicial para el rechazo celular agudo son los corticoides. Si no responden a esteroides se debe administrar timoglobulina. Para el tratamiento del rechazo agudo mediado por anticuerpos se debe administrar alguna de las siguientes: inmunoglobulinas intravenosas, anticuerpos anti-CD20 (Rituximab®), recambios plasmáticos o timoglobulina.
3. Individualización y/o minimización de la inmunosupresión.
Es recomendable la combinación de inmunosupresores acorde a las características del paciente para optimizar la supervivencia del injerto renal. Los receptores de un trasplante renal no son una población homogénea tanto en términos de experiencia inmunológica como de susceptibilidad para la activación aloinmune de novo contra donantes HLA incompatibles [65]. Por lo tanto, la implementación de nuevas herramientas inmunológicas que identifiquen el riesgo inmunológico de cada paciente frente al donante está justificada para permitir estrategias inmunosupresoras individualizadas seguras y evitar tratamientos tóxicos innecesarios. En este sentido, la incompatibilidad HLA EPLET puede ayudar a estratificar el riesgo inmunológico inicial y guiar la toma de decisiones sobre la inmunosupresión [66].
Si no ha habido rechazos previos, reducir la inmunosupresión puede ayudar a mejorar el perfil individual de riesgo cardiovascular. La retirada de esteroides mejora las cifras de tensión arterial, la glucemia y los parámetros lipídicos, con un riesgo bajo de rechazo agudo (10%) si los enfermos reciben tacrolimus y micofenolato. Esto contribuye a mejorar la supervivencia. La sustitución de los inhibidores de la calcineurina (ICN) por fármacos anti-mTOR disminuye la tensión arterial y la masa ventricular izquierda al mismo tiempo que puede mejorar la función renal a través de frenar la progresión de las lesiones crónicas de la DCI. Con todo, no se sabe exactamente en qué momento de la evolución se debe realizar esta conversión. Asimismo, la combinación de dosis bajas de tacrolimus más dosis bajas de everolimus ofrece buenos resultados en términos de función renal y disfunción inmunológica, comparables a la combinación de tacrolimus y micofenolato mofetil. Al mismo tiempo se observa una menor tasa de infecciones víricas frente a la inmunosupresión convencional [67] [68]. Sin embargo, si estas estrategias pueden favorecer la aparición de anticuerpos específicos anti-HLA contra el donante a más largo plazo es desconocido. Los fármacos antimetabolitos como el ácido micofenólico pueden prevenir la progresión de la DCI.
4. Control estricto de factores de riesgo cardiovascular: HTA e hiperlipidemia
El control estricto de las cifras tensionales (<130/90 mmHg), especialmente en pacientes con proteinuria, puede minimizar la comorbilidad cardiovascular post-TX. El bloqueo farmacológico del eje renina-angiotensina disminuye la proteinuria, la tensión arterial y la masa ventricular izquierda, al mismo tiempo que puede disminuir la mortalidad [69]. Mantener unas cifras de LDL-colesterol adecuadas también puede ayudar a mejorar el pronóstico de estos pacientes.
5. Prevención y manejo adecuado de la diabetes postrasplante
El control de los factores de riesgo involucrados en el síndrome metabólico puede evitar o minimizar las consecuencias de esta alteración. El seguimiento de las alteraciones prediabéticas y evitar la administración de tacrolimus en pacientes de riesgo (obesos, virus C, antecedentes de diabetes, etc.) en los tres primeros meses post-Tx puede contribuir a disminuir el riesgo de aparición de la misma [70].
6. Monitorización estrecha de la función renal y diagnosticar precozmente la DCI
El seguimiento estrecho de la función renal y la cuantificación de la proteinuria constituyen herramientas clínicas muy útiles para predecir la supervivencia del injerto y del paciente. Ante cualquier disfunción renal mantenida o la aparición de proteinuria leve (< 1g/día) debe realizarse precozmente una biopsia renal para constatar la causa de dichas alteraciones [71]. Esto ayudará a establecer las medidas terapéuticas oportunas. La determinación precisa de la función renal mediante iohexol puede contribuir a mejorar los resultados del trasplante renal [72].
7. Manejo adecuado de la disfunción crónica del injerto renal
Esta alteración es una forma más de insuficiencia renal crónica que pude progresar hasta la entrada en diálisis. Por ello, debe ser monitorizada y tratada acorde a las guías de práctica clínica para la misma.
8. Vigilancia de la recurrencia enfermedad renal
Es recomendable monitorizar estrechamente la posible recurrencia de la enfermedad renal primaria, especialmente en los casos de glomerulosclerosis focal y segmentaria y de síndrome urémico-hemolítico atípico. La identificación de biomarcadores capaces de predecir la recurrencia de la enfermedad [73] o la aplicación de técnicas de inmunoadsorción pudiera mejorar los resultados en estos enfermos en términos de supervivencia [74].
9. Cribado del cáncer y prevención de la infección
La incidencia de cáncer, incluyendo las neoplasias cutáneas y los trastornos linfoproliferativos, es más alta que en la población general (Véase Neoplasias en trasplante renal). La estrecha vigilancia post-TX de las neoplasias más frecuentes (cáncer de piel, mama, pulmón, próstata y linfomas) puede prevenir las consecuencias de estos tumores. En ocasiones, la sustitución del ICN por fármacos anti-mTOR puede contribuir a la regresión de algunas neoplasias, principalmente las cutáneas como el sarcoma de Kaposi. El empleo de dosis bajas de ICNs (tacrolimus o ciclosporina) más dosis bajas de everolimus disminuye la aparición de infecciones víricas frente a la terapia convencional [75] [76].
La profilaxis universal del Pneumocistis jirovecii con cotrimoxazol y de la infección por CMV con valganciclovir en pacientes de riesgo ha disminuido considerablemente la mortalidad infecciosa post-TX. La monitorización del poliomavirus y del virus del Epstain Barr puede ser útil para evitar la pérdida de injertos, especialmente en aquellos que han recibido intensa inmunosupresión.
10. Cambios en el estilo de vida
Los pacientes con TX se beneficiarían de abandonar el hábito de fumar, hacer ejercicio regularmente y llevar una dieta equilibrada, evitando el sobrepeso.
11. Manejo e individualización de la inmunosupresión en pacientes añosos
Estos enfermos reciben habitualmente DCE, por lo que parece razonable utilizar regímenes inmunosupresores de baja toxicidad (dosis bajas de ICN y/o reducción de esteroides) o, en su defecto, conversión precoz a fármacos anti-mTOR. Adicionalmente, el control estricto de otros factores de riesgo vascular pudiera prolongar la supervivencia en estos enfermos.
12. Prevención de la enfermedad ósea postrasplante
El tratamiento de la enfermedad ósea con bifosfonatos, vitamina D o calcio mejora la pérdida de masa ósea post-TX, pero ninguno de estos tratamientos ha demostrado individualmente una reducción de la tasa de fracturas. La retirada de esteroides puede frenar la pérdida de masa ósea.
13. Incrementar la realización de trasplantes renales con donante vivo
Este tipo de TX mejora significativamente las tasas de supervivencia de injerto y paciente con respecto al TX con donante de cadáver. Esto es más relevante si el TX se realiza en la etapa prediálisis.
14. Trasplante anticipado
La realización de un trasplante anticipado (de donante fallecido o de vivo) puede mejorar la supervivencia frente a los pacientes que permanecen en diálisis [77]. Esta mejoría es más acentuada en pacientes diabéticos.
En resumen, los resultados del TX han mejorado en los últimos 15 años, pero queda por establecer la estrategia inmunosupresora idónea que prolongue las tasas de supervivencia del injerto y del paciente a más largo plazo. La individualización de la inmunosupresión, el manejo de la disfunción crónica del injerto y la proteinuria, la prevención del rechazo mediado por anticuerpos, el bloqueo del sistema renina-angiotensina, la prevención de las complicaciones infecciosas y tumorales, así como el adecuado tratamiento de las complicaciones metabólicas, sin duda contribuirán a este objetivo. Adicionalmente, alcanzar la tolerancia inmunológica pudiera contribuir a mejorar las tasas de supervivencia. Finalmente, el incremento en la tasa de obtención de órganos mediante la donación en asistolia puede minimizar, en parte, el disbalance actual entre la demanda y la oferta de órganos para trasplante.
Enfermedad renal base y supervivencia de pacientes e injertos
Nefropatía diabética
Si bien el trasplante renal (TX) mejora globalmente la supervivencia con respecto a permanecer en diálisis, los pacientes diabéticos tienen una mortalidad superior a los no diabéticos tras el TX [78] [79]. La mayor mortalidad del diabético frente al no diabético se debe fundamentalmente a la progresión de la ateromatosis y las comorbilidades asociadas a la hiperglucemia mantenida (enfermedad cardiovascular y neuropatía autonómica y sistémica). Asimismo, en pacientes con diabetes tipo 1 la opción terapéutica que ofrece mejores resultados en términos de supervivencia es el trasplante de riñón-páncreas (TXP). Pacientes diabéticos tipo 1 en lista de espera para TXP tienen una supervivencia en diálisis del 56% a los 5 años y del 44% a los 7 años, mientras que si reciben un trasplante aislado, la supervivencia es del 84% y 62%, respectivamente. En el caso de recibir un TXP, los resultados de supervivencia del paciente son del 88% y 82% a los 5 y 7 años, respectivamente [80]. Otros estudios muestran resultados similares con una supervivencia de pacientes en lista de espera de TXP del 93,4% al año y del 58,7% a los 4 años, mientras que los que recibieron un TXP del 95% y 90,3%, respectivamente [81]. Esto refleja que estamos ante un grupo de pacientes que durante el periodo de inclusión en lista de espera tienen una alta mortalidad, que se reduce de forma significativa con el TX; y sobre todo, con el TXP cuando está indicado.
Es obvio, que algunas de las complicaciones que añaden morbi-mortalidad en la diabetes con insuficiencia renal terminal mejoran con el TXP, especialmente la miocardiopatía y la neuropatía. Los pacientes con diabetes tipo 1 que solo reciben un trasplante renal aislado presentan mayor incidencia de hipertensión arterial al año (80 vs. 85%), a los dos años (84 vs. 64%) que los que reciben un TXP, así como una mayor incidencia de infarto agudo de miocardio (20 vs. 3%) y de disfunción cardiaca (20% vs. 3%). Por otra parte, la neuropatía autonómica del paciente diabético incrementa la mortalidad, especialmente ante intervenciones quirúrgicas como un TX. Con todo, la mortalidad de los enfermos diabéticos tipo 1 con neuropatía autonómica que reciben un TXP es del 13% a los 7 años frente al 66% de los que no reciben esta modalidad terapéutica. Asimismo, la neuropatía autonómica mejora tras el TXP.
La supervivencia de pacientes con diabetes mellitus tipo 2 con TX es significativamente mayor que los tratados con diálisis, aunque son pocos los estudios realizados que incluyan solo a pacientes con diabetes tipo 2. Un análisis unicéntrico de 290 TX de donante vivo en receptores adultos que incluyó pacientes con diabetes tipo 2 y sin diabetes, mostró que la supervivencia de pacientes a los 5 años era del 96,8% y 98,7%; y de injertos de 96,6% y 98%, respectivamente. Pese a que la edad de los receptores diabéticos era significativamente mayor (54,5±9,9 vs. 43,6±14,1) [82].
Los nuevos fármacos hipoglucemiantes con su dual beneficio metabólico y CV puedan minimizar las alteraciones CV post-TX, incluida la HVI, pero esto aún no ha sido estudiado en profundidad en esta población. A mismo tiempo podrían evitar la progresión de la disfunción del injerto renal en aquellos enfermos con DM post-TX En efecto, los inhibidores del co-transportador 2 Na-glucosa (iSGLT2) han demostrado un claro beneficio sobre estas alteraciones a través de sus efectos hemodinámicos, CV y renales. Estos fármacos controlan la hiperglucemia bloqueando la reabsorción renal de glucosa además de prevenir la inflamación, mejorar la función endotelial y reducir el estrés oxidativo, contribuyendo a frenar la progresión de la nefropatía y disminuir las complicaciones CV. De hecho, ensayos clínicos controlados en población general han demostrado que estos fármacos son capaces de enlentecer la progresión de la nefropatía diabética, al mismo tiempo que reducen la tasa de hospitalizaciones por disfunción ventricular y la muerte de origen CV en pacientes con DM2 [83] [84] [85].
Estos beneficios clínicos CV y renales no se explican en su totalidad por sus efectos sobre el control plasmático de la glucosa. Es muy posible que, independientemente de sus acciones beneficiosas hemodinámicas y metabólicas, estos fármacos tengan una acción directa sobre el remodelado miocárdico disminuyendo la masa ventricular izquierda (MVI) a través de la inhibición de la isoforma 1 del intercambiador Na+-K+ cardiaco y renal, lo cual puede inducir regresión de la fibrosis miocárdica. Al mismo tiempo, estudios experimentales han mostrado que empaglifozina es capaz de revertir la fibrosis cardiaca y renal a través de una mayor expresión de klotho [86], hormona sintetizada mayoritariamente en el riñón con propiedades antifibróticas y antiapoptóticas [87].
De hecho, dos ensayos clínicos controlados recientes, utilizando iSGLT2 en pacientes con DM2, han demostrado una reducción significativa de la MVI frente a placebo [88] [89].
Vasculitis
Vasculitis de pequeños vasos
Los pacientes con vasculitis de pequeños vasos reciben doble carga de inmunosupresión si sumamos la del tratamiento de la enfermedad y la del TX. Esto puede representar un mayor riesgo de tumores e infecciones con un impacto negativo en la supervivencia de pacientes e injertos a lo que se puede sumar el riesgo de recidiva. A pesar de ello, en grupos concretos como la poliangeitis granulomatosa y la púrpura de Schönlein-Henoch la supervivencia de pacientes e injertos es mayor si se compara con un grupo de enfermedad de base distinta [90] [91].
Un análisis retrospectivo del registro de la United Network for Organ Sharing (UNOS) compara 2.196 casos de vasculitis de pequeños vasos con TX primario, llevados a cabo entre enero de 2.000 y diciembre de 2.014, con un grupo control de 6.588 casos, emparejados 1:3 por edad del receptor, sexo, raza, año de TX y donantes (cadáver o vivo) del mismo periodo. El grupo de estudio incluía a 1.167 pacientes con poliangeitis granulomatosa, 675 con anticuerpos anti-membrana basal glomerular, 174 con púrpura de Schönlein-Henoch, 173 con poliangeitis microscópica y 7 con síndrome de Churg-Strauss. El grupo control incluía un 25.2% de enfermedad glomerular, 21.7% de diabetes mellitus, 17.4% de hipertensión arterial y 11.8% de poliquistosis renal y el resto de otras causas. El tiempo medio de supervivencia del injerto en el grupo de estudio fue de 13 años frente a 10,6 años del grupo control. La supervivencia del paciente fue de 14,3 años y de 12,3 años, respectivamente. La causa más frecuente de muerte en estos pacientes son las neoplasias (20-25%) [92]. Concretamente, los receptores con vasculitis microscópica de un TX tienen globalmente 2.4 veces más riesgo de desarrolar cáncer, siendo este riesgo mayor para vejiga (33 veces) y linfoma (11 veces). A pesar del riesgo de tumores e infecciones que supone la sobrecarga de inmunosupresión, estos pacientes tienen una supervivencia mayor de pacientes e injertos que pacientes con otra enfermedad base.
Glomerulonefritis primarias
La glomerulonefritis (GN) primaria representa una de las causas más frecuentes de insuficiencia renal terminal (20-25%) y su recurrencia (6-20%) tiene un impacto negativo en la supervivencia del injerto a largo plazo, condicionando la tercera causa de pérdida del injerto, después del rechazo crónico y la muerte del paciente [93]. La vida media del injerto en estos enfermos es de 10 años y el riesgo de pérdida del injerto es tres veces mayor que la de aquellos sin enfermedades glomerulares primarias. Los factores de riesgo de recurrencia son el sexo masculino, edad mayor de 50 años y el donante familiar [94]. Con todo, la supervivencia del paciente tras el TX es mayor que en diálisis. El paradigma de la recurrencia de la enfermedad primaria glomerular tras el TX lo constituye la glomerulosclerosis segmentaria y focal la cual muestra la mayor incidencia y precocidad en la recurrencia. Asimismo, la recurrencia en el primer trasplante predice un mayor riesgo en subsiguientes injertos.
Lupus eritematoso sistémico
La nefritis lúpica es una enfermedad inflamatoria de origen autoinmune que evoluciona insuficiencia renal terminal entre el 5% y 20% de los casos, aunque la proliferativa difusa tiene un peor pronóstico y alcanza el 30% [95].
Pacientes con insuficiencia renal terminal por nefritis lúpica tienen menor morbilidad y mortalidad si reciben un TX que en tratamiento con diálisis. Un análisis de datos de la UNOS que incluye a 1.959 pacientes con lupus con TX (1.170 de donante cadáver y 789 de vivo) realizados entre 1.996 y 2.000, muestra una similar supervivencia de injertos y pacientes que 63.879 (42.651 de cadáver y 21.228 de vivo) no lúpicos trasplantados en el mismo periodo, tras el ajuste de factores de riesgo. A los 5 años la supervivencia de injertos era del 67.8% vs. 67% en donante cadáver y del 77,6% vs. 79% de vivo, respectivamente; y la supervivencia de pacientes del 85,2% vs. 82,1% en TX de cadáver y del 92,1% vs 89,8% de vivo [96] .
Los estudios de recidiva de la nefritis lúpica en el injerto realizados sin biopsias de protocolo muestran una incidencia muy baja respecto a la realidad (2,4%) [97]. La recidiva de la enfermedad en el injerto es mayor de lo que se ha mantenido durante años. El cambio de criterio se basa en la aplicación de biopsias de protocolo con estudio histológico adecuado. El riesgo de pérdida del injerto por recidiva depende de la clasificación histológica. La nefritis lúpica clase IV tiene el peor pronóstico.
Esclerodermia
La esclerodermia es una enfermedad del tejido conectivo provocada por el depósito de colágeno en la piel, vasos sanguíneos y múltiples órganos, entre los que se encuentra el riñón. Las manifestaciones renales incluyen hipertensión arterial acelerada y deterioro progresivo de la función renal. Dado que se trata de una enfermedad no frecuente, los datos existentes y su evolución en TX son limitados. Un estudio retrospectivo de la base de datos de ANZDATA realizado entre el 15 de mayo y el 31 de diciembre que incluye a 40.238 pacientes tratados con diálisis, demostró que la supervivencia del injerto a los 5 años era del 53% en los casos de donante cadáver y 100% de los de donante vivo [98]. Otro estudio multicéntrico realizado en las 20 Unidades de Trasplante existentes en Francia, entre 1.987 y 2.013 recoge 34 receptores de un TX (2 de donante vivo). La supervivencia de pacientes a 1, 3 y 5 años era del 100%, 90,3% y 82,5%; y la de injertos censurada con la muerte del paciente del 97%, 97,2% y 92,8%, respectivamente. La afectación pulmonar por esclerodermia era un factor de riesgo independiente de muerte después del TX y en la evolución postrasplante el 45% presentaron disfunción cardíaca y el 26% digestiva [99].
En cuanto a la recurrencia de la enfermedad en el injerto, la información existente es muy limitada. Los factores de riesgo de recurrencia son la anemia severa, la rigidez de la piel, el derrame pericárdico y el fracaso cardiaco. No está claro el papel que pueden jugar el tratamiento con esteroides en la recurrencia. La supervivencia de pacientes e injertos a los 5 años era del 73% y 56,7%, respectivamente.