Alteraciones del Metabolismo Mineral y Óseo tras el Trasplante Renal
Palabras clave
Trasplante renal, metabolismo mineral, osteoporosis, riesgo fractura, hiperparatirodismo, hipofosfatemia, necrosis avascular
INDICE:
1. Introducción
2. Osteoporosis y fracturas óseas
2.1 Técnicas de valoración de la salud ósea
2.2 Valoración de la salud ósea en el trasplante renal
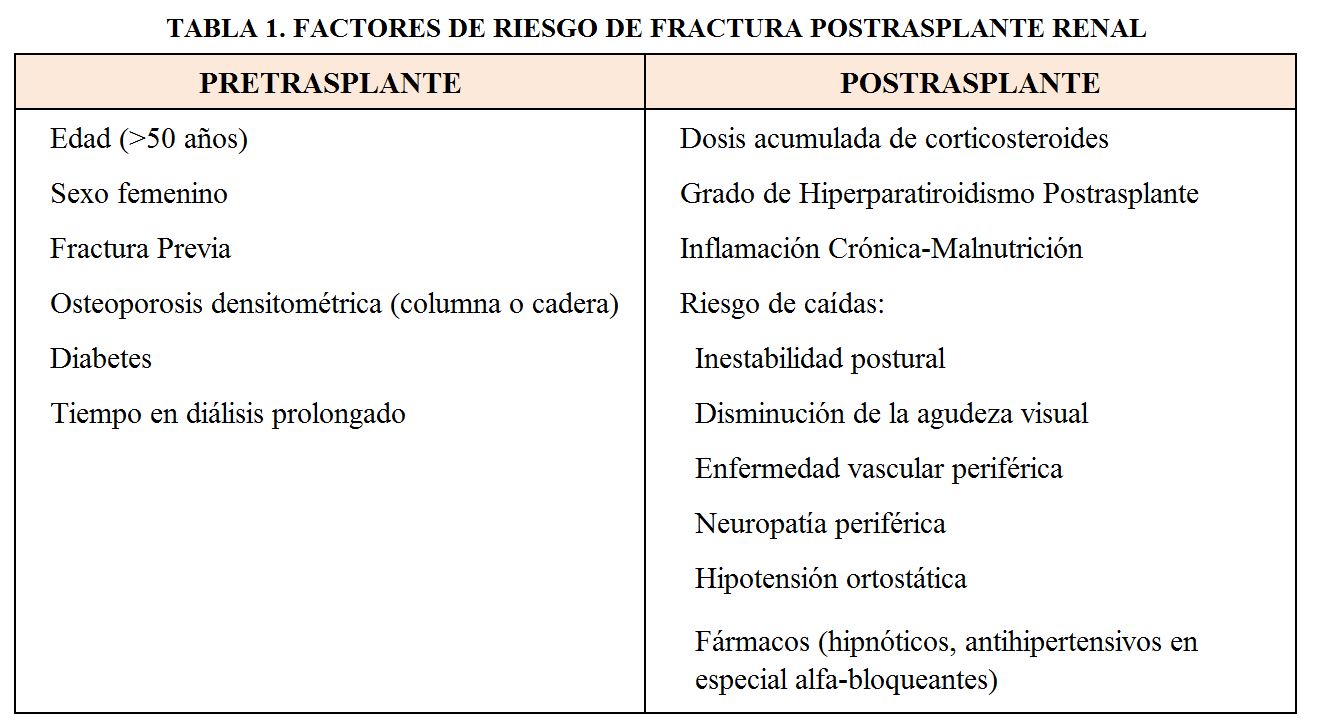
3. Factores de riesgo de fractura
3.1 Factores de riesgo generales de fractura
3.2 Factores de riesgo relacionados con el trasplante renal
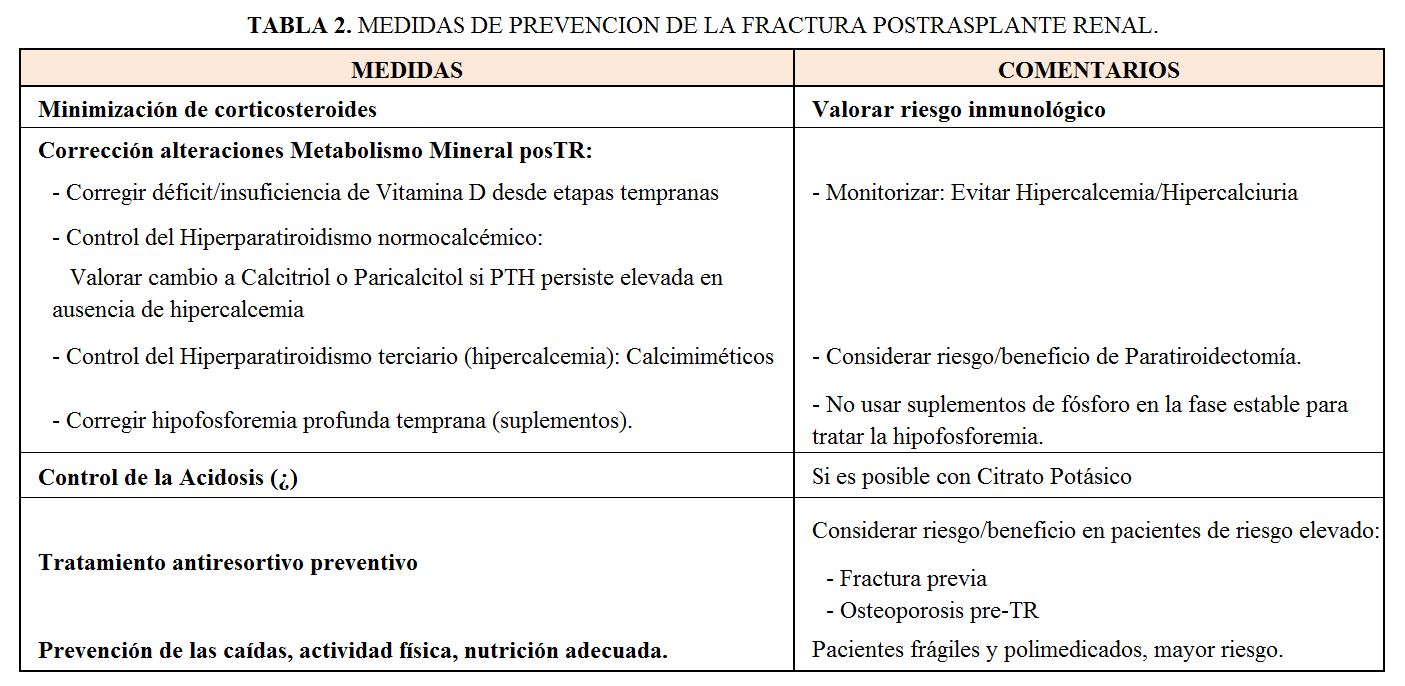
4. Prevención de la fractura
4.1 Minimización de corticosteroides
4.2 Control del hiperparatiroidismo
4.3 Corrección de la acidosis
4.4 Cuando considerar el tratamiento antirresortivo preventivo?
4.5 Prevención de las caídas
5. Tratamiento de la fractura establecida
6. Hiperparatiroidismo persistente
6.1 Historia natural
6.2 Tratamiento con vitamina D
6.3 Calcimiméticos
6.4 Paratiroidectomía
7. Hiperparatiroidismo secundario a la Enfermedad Renal Crónica
8. Hipofosforemia
9. Necrosis Ósea avascular
ABREVIATURAS:
TR: Trasplante renal
MOM: Metabolismo óseo y mineral
DMO: Densidad mineral ósea
DXA: Absorciometría de rayos X de doble energía
HRpQCT: Tomografía Axial Computarizada Cuantitativa de Alta Resolución.
RxCTL: Radiografía de Toráx y Lumbar lateral
MiO: Microindentación ósea
MRO: Marcadores de remodelado óseo
PTH: Hormona paratiroidea
FGF-23: Factor de crecimiento fibroblástico 23
NOA: Necrosis ósea avascular
ALTERACIONES DEL METABOLISMO MINERAL Y ÓSEO TRAS EL TRASPLANTE RENAL.
1. INTRODUCCION
El trasplante renal (TR) corrige al menos en parte las alteraciones del metabolismo óseo y mineral (MOM) propias de la ERC. Sin embargo, al mismo tiempo supone una situación única, resultado de una combinación de factores como la persistencia de las alteraciones del MOM, el efecto de los inmunosupresores, el grado de recuperación de la función renal, la presencia de acidosis, la función gonadal y el envejecimiento. Por tanto, tras el TR más que resolverse las alteraciones del MOM se asiste a un cambio de su fenotipo que también influye en la morbimortalidad.
2. OSTEOPOROSIS Y FRACTURAS ÓSEAS.
La osteoporosis se define como una reducción de la masa ósea con deterioro de su microarquitectura, que incrementa la fragilidad y la susceptibilidad a la fractura. Tradicionalmente, en el primer año del TR se ha detectado una pérdida importante de densidad mineral ósea (DMO), de hasta un 20%, que posteriormente se estabiliza [1] [2]. Esta magnitud de pérdida se ha relacionado con el riesgo de fractura osteoporótica puesto que a efectos comparativos, es muy superior a la que ocurre en la osteoporosis posmenopáusica a nivel lumbar que es del 1.7% anual [3]. Con la reducción de la tasa de rechazo agudo y el uso de protocolos de exposición reducida a corticosteroides (o de retirada rápida) dicha pérdida es inferior a la observada en etapas previas [3] [4] e incluso algunos estudios recientes no han detectado pérdida de DMO al año del TR en el esqueleto axial (columna y cadera) [5] [6]. Estas mejoras en la inmunosupresión y el mejor manejo de las alteraciones del metabolismo mineral en diálisis, han reducido la incidencia de fractura de cadera y de cualquier localización [7]. Un estudio unicéntrico demostró que la incidencia de fracturas en el primer año se redujo desde el 9.1% en el período 2004-2006 al 3.1% en el período 2009-2011 [8].
Las fracturas suelen ocurrir preferentemente a nivel del esqueleto apendicular (tobillos y pies), así como en la cadera [3] [4]. La prevalencia de fracturas vertebrales sintomáticas es de aproximadamente un 2%, pero la de las deformidades vertebrales asintomáticas de grado moderado a severo, consideradas como equivalentes a fracturas, fue del 15% en un estudio multicéntrico español [9]. Hay que destacar que la presencia de estas deformidades asintomáticas son un factor de riesgo destacable de fractura osteoporótica principal (cadera, vertebral clínica, de humero, o radio) [9].
Las fracturas también influyen en los resultados del TR. Así, en receptores >50 años, la fractura incidente vertebral, de cadera o extremidades, se ha asociado a un incremento del riesgo de mortalidad del 2.8, 1.34, y 1.85, respectivamente [10]. El riesgo de pérdida de injerto también se incrementa de 1.3 a 1.4 veces [10].
2.1 Técnicas de valoración de la salud ósea.
Analizar la salud ósea del paciente que recibe un TR es relevante porque permite analizar el riesgo de fractura de manera anticipada e intervenir para su prevención. Revisamos a continuación las técnicas disponibles para a continuación analizar la experiencia disponible en el TR.
- Densidad Mineral Ósea (DMO): La DMO estimada con DXA (absorciometría de rayos X de doble energía) es el estándar de práctica clínica para valorar la masa ósea entendida como la cantidad de mineral por unidad de área. En población general >50 años la herramienta FRAX mejora la predicción de fractura cuando se le añade la DXA a nivel de cadera [11].
- “Indice Trabecular Óseo” (Trabecular Bone Score, TBS): Analiza la textura ósea obtenida mediante DXA en la columna lumbar utilizando un software específico. El TBS analiza la microarquitectura ósea y valores bajos se asocian en población no renal a fractura osteoporótica principal con independencia de la DMO [12].
- Tomografía Axial Computarizada periférica de alta resolución (HRpQCT): Analiza a nivel del radio y la tibia la masa ósea volumétrica (mg de hidroxiapatita por cm3) del hueso trabecular, y la microestructura trabecular aportando su número y separación. A nivel de hueso cortical analiza su densidad volumétrica, grosor y porosidad. Finalmente, mediante análisis computacional estima la competencia biomecánica ósea [5]. Se trata de una técnica muy informativa sobre la salud ósea pero no disponible para la práctica clínica en la mayoría de los centros.
- Microindentación ósea (MiO): La MiO es una técnica mínimamente invasiva que analiza las propiedades mecánicas del hueso a través de medir la resistencia del hueso cortical a la apertura de grietas microscópicas. Cuanto más profundo penetre la aguja exploratoria en la cara anterior de la tibia, menos resistente será el tejido óseo al impacto [4]. El parámetro final utilizado es el índice de resistencia in vivo (BMSi) [4]. En un estudio se valoró el BSMi en mujeres con fractura reciente del radio distal o de fémur, y en controles sanos. Tras ajustar por factores de riesgo, incluyendo la DMO por DXA, un BSMi bajo se asoció al riesgo de fractura distal de radio, existiendo una tendencia significativa para la de cadera [13]. Resultados similares se han observado en varones con o sin ERC [14]. Con estos fundamentos se puede afirmar que la medición de la BSMi es un buen candidato para estudios prospectivos orientados a mejorar la predicción de la fractura por fragilidad.
- Histomorfometría Ósea: La biopsia ósea sin decalcificar tras doble marcaje con tetraciclinas [15] es el patrón oro para valorar el remodelado óseo y la mineralización pero no se relaciona con la masa ósea. Es una técnica invasiva disponible en pocos centros, pero en los casos de osteoporosis refractaria aporta información imprescindible para elegir el tratamiento más apropiado.
- Radiografía lateral de columna torácica y lumbar (Rx-CTL): La Rx-CTL lateral centrada en T7 y L3 es el método de elección para el diagnóstico de una fractura vertebral. Está especialmente indicada cuando se objetiva una pérdida de altura, cifosis torácica, o bien dolor dorso-lumbar de inicio reciente [11].
- Marcadores del remodelado óseo (MRO): La mayoría de las Guías de Práctica Clínica consideran que la principal indicación de los MRO está en el seguimiento para evaluar la adherencia y eficacia del tratamiento [11].
2.2 Valoración de la salud ósea en el TR.
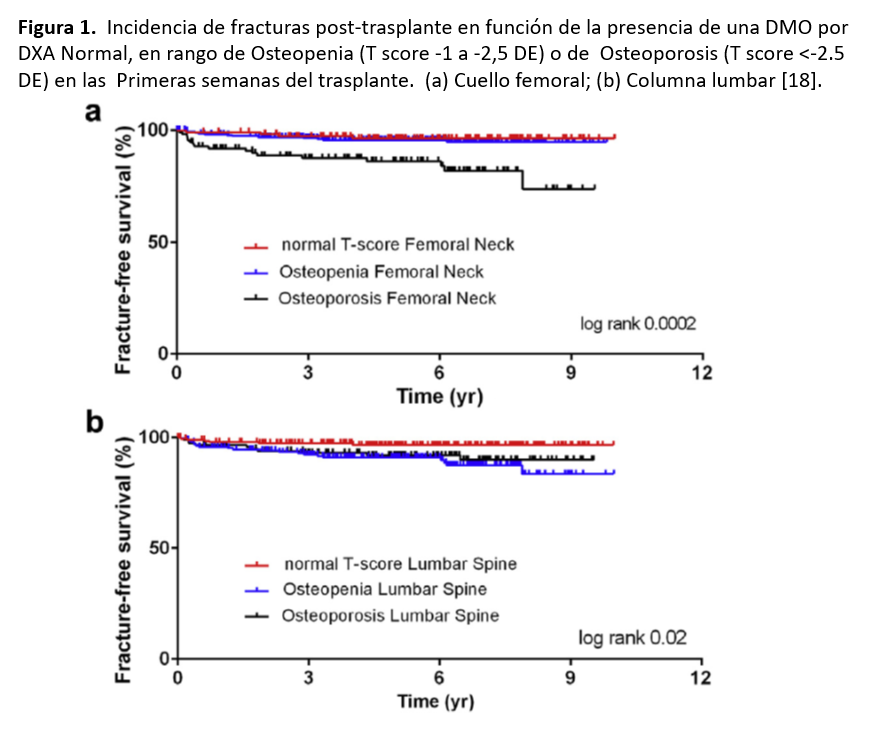
- DXA: Aunque la DMO estimada mediante esta técnica es una medida bidimensional y no valora la microestructura ósea ni su resistencia mecánica, varios estudios prospectivos han demostrado que la DMO a nivel de la cadera predice el riesgo de fractura en pacientes con ERC estadios 3 a 5D [16]. De manera similar, varios estudios prospectivos recientes han demostrado que una DMO baja en las primeras semanas del TR (en columna o cuello femoral), aumenta el riesgo de fractura posTR si bien de manera menos robusta que en la osteoporosis primaria [17] [18] [19] (Figura 1). Por tanto, las Guías KDIGO actualizadas a 2017 recomiendan la utilización de esta técnica en pacientes de riesgo siempre que sus resultados vayan a tener un impacto en el tratamiento [16].
- TBS: En una cohorte de pacientes con TR se ha demostrado que una TBS baja, indicativa de una microarquitectura ósea anormal, fue frecuente siendo además un predictor de fractura independientemente de la DMO por DXA [20]. En un estudio prospectivo se compararon los cambios de TBS y de los distintos parámetros de la HRpQCT en el primer año del TR [20]. Se demostró una correlación de la TBS con los parámetros derivados de la HRpQCT, tanto a nivel de hueso trabecular como compacto, así como con la rigidez ósea [21]. Estos resultados sugieren que el TBS puede ser un método útil para monitorizar los cambios de calidad y competencia biomecánica ósea, así como facilitar una estratificación del riesgo de fractura tras el TR.
- HRpQCT: Su utilización en el TR ha sido escasa y no existen estudios que describan su utilidad para predecir la fractura. No obstante, un estudio prospectivo analizó los cambios de masa ósea, así como de microarquitectura y competencia biomecánica, durante el primer año, en 47 receptores de TR con retirada rápida de corticosteroides [5]. También se analizó la DMO por DXA no observándose cambios significativos tanto a nivel de columna lumbar como de cadera, aunque sí a nivel del radio distal (pérdida entre 2.2 y 2.9% según la localización). La HRpQCT en el radio distal demostró una pérdida ósea tanto cortical (3.9%) como trabecular (4.4%), así como de la competencia biomecánica del hueso [5]. De manera destacable, los niveles promedio de PTH se asociaron negativamente a la pérdida de hueso cortical. Por tanto, este estudio demuestra que con las nuevas pautas de reducción de corticosteroides se suele preservar la masa ósea a nivel del esqueleto axial. En cambio, a nivel del hueso apendicular, donde suelen ocurrir las fracturas, existe una pérdida de hueso cortical dependiente del grado de hiperparatiroidismo [5].
- MiO: En un estudio prospectivo, Perez-Saez y col [22] han observado que con una exposición reducida a corticosteroides (5 mg/día de prednisona a partir del día 42 del TR), sin ningún tratamiento óseo, la MiO y la TBS se mantienen estables durante el primer año. Esto resalta la importancia de la exposición reducida a corticosteroides para mantener la salud ósea tras el TR. Se necesitan estudios adicionales que establezcan el papel de la MiO para predecir la fractura en el TR.
- Histomorfometría ósea: En los pocos estudios disponibles con biopsias óseas repetidas antes y después del TR se ha observado una disminución de la resorción y de la formación óseas, con cambios variables en la mineralización [6] [23] [24] [25].
- Rx-CTL: En un estudio multicéntrico español de 615 receptores de TR prevalentes, con más de 60 meses de promedio posTR, la incidencia de fractura vertebral asintomática grado 1 fue del 26% y de grado 2 del 15% [9].
- MRO: Los marcadores de resorción o de formación ósea solo han demostrado una correlación débil con los parámetros de la histomorfometría ósea en el TR, y tampoco han demostrado utilidad en la predicción de fracturas [26].
3. FACTORES DE RIESGO DE FRACTURA.
3.1 Factores de riesgo generales de fractura
Los más importantes son la edad (en especial >50 años), el sexo femenino, la diabetes, y la historia previa de fracturas [27]. La inflamación crónica-malnutrición también ha sido identificada como factor de riesgo de fractura en un estudio prospectivo en receptores prevalentes [28]. El riesgo de caídas (Tabla 1) es también un factor importante en la actualidad dada la demografía, comorbilidades y polimedicación de los receptores de TR [27].
3.2 Factores de riesgo relacionados con el TR
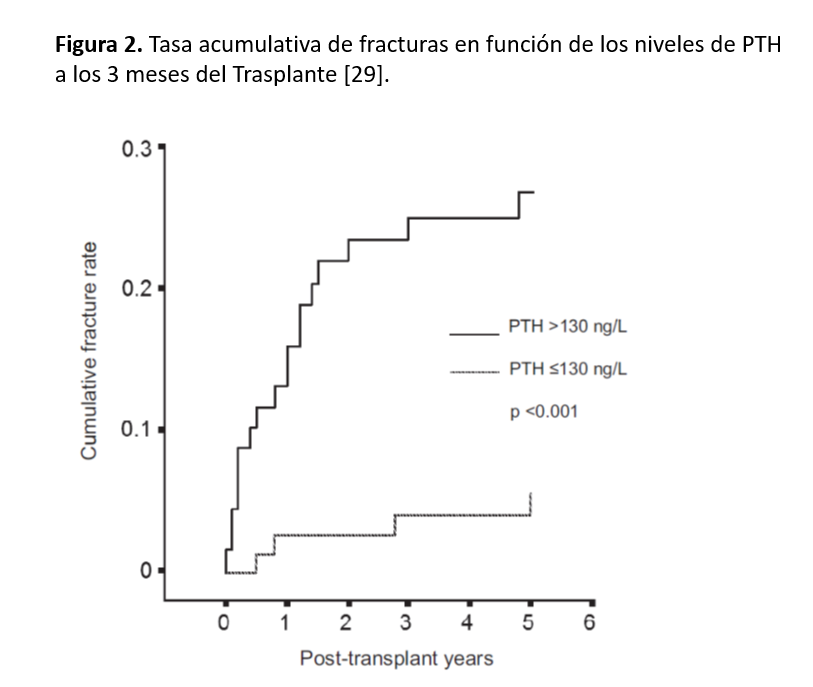
Son la dosis acumulada de esteroides, y el grado de hiperparatiroidismo post-trasplante. En un estudio unicéntrico francés, unos niveles de PTH ≥130 pg/ml a los tres meses del TR incrementó el riesgo de fractura 7.5 veces [29] (Figura 2). Los pacientes trasplantados prevalentes con fractura vertebral asintomática muestran niveles más elevados de PTH que los que no la tienen, de manera independiente a otros factores de riesgo [30]. Un hallazgo similar se ha descrito en España aunque solo en mujeres [9]. Además, como se ha comentado, en el primer año de TR los niveles promedio de PTH se relacionan directamente con la pérdida de hueso cortical apendicular (radio) [5].
Para la evaluación del riesgo de fractura en el momento del TR, la densitometría ósea (DXA), a pesar de sus limitaciones, ha demostrado ser útil. Varios estudios prospectivos han demostrado que una DMO baja a nivel de columna o cadera en las primeras semanas del TR, aumenta el riesgo de fractura posteriormente [17] [18] [19]. La herramienta FRAX (Fracture Risk Assessment Tool) que utiliza criterios clínicos (edad, sexo, IMC, fractura previa, padres con fractura de cadera, tabaco, alcohol, y otros), con o sin la DXA, estima la probabilidad de fractura principal (cadera, vertebral clínica, de humero, o radio) o de cadera solamente, a 10 años, de una manera precisa en la población general [31]. En el TR ha demostrado predecir el riesgo de fractura de manera aceptable aunque se necesitan más estudios de validación [32]. En la (Tabla 1) se resumen los factores de riesgo de fractura tras el TR.
4. PREVENCIÓN DE LA FRACTURA.
4.1 Minimización de corticosteroides
Los corticosteroides disminuyen la absorción intestinal de calcio y la actividad osteoblástica ósea, produciendo osteoporosis y favoreciendo el desarrollo de fracturas. La exposición reducida a corticosteroides tras el TR minimiza la pérdida ósea [4] [5] [6] y la retirada rápida de esteroides tras el TR se asocia a una reducción del 30% en el riesgo de fractura [33]. Como se comentó, la reducción de la dosis de prednisona hasta los 5 mg/día desde el día 42 del TR, preserva los parámetros pretrasplante de salud ósea [22]. En los pacientes que requieran dosis más elevadas de corticosteroides (rechazo agudo, elevado riesgo inmunológico) deben seguirse las recomendaciones para evitar la osteoporosis por corticosteroides [11].
4.2 Control del Hiperparatiroidismo
Como ya se comentó el grado de hiperparatiroidismo tras el TR es un factor de riesgo significativo de fractura, incluso en pacientes con exposición reducida o retirada rápida de corticosteroides. Para el control del hiperparatiroidismo normocalcémico pueden utilizarse los metabolitos de la Vitamina D, y para el asociado a hipercalcemia o hipercalciuria, los calcimiméticos (ver apartado 6) y (Tabla 2).
4.3 Corrección de la acidosis
La acidosis metabólica postrasplante no es infrecuente y puede favorecer la osteoporosis a través de incrementar la actividad osteoclástica [34]. En un ensayo clínico controlado de un año de duración, la corrección de la acidosis con citrato potásico mejoró la mineralización ósea con respecto al grupo control (cloruro potásico); sin embargo, no existieron ventajas en otros parámetros de salud ósea [35]. En un estudio retrospectivo, el tratamiento con bicarbonato sódico no influyó en la tasa de fracturas ni en la mortalidad [36].
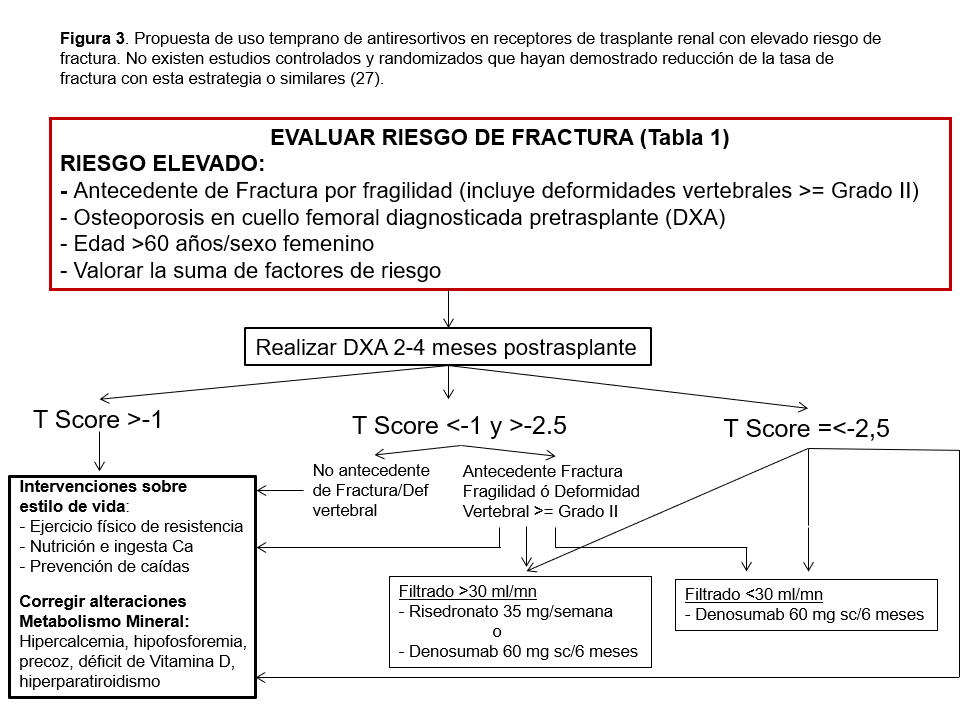
4.4 Cuando considerar el tratamiento antirresortivo preventivo?
No existe ningún estudio controlado y randomizado que demuestre una disminución de la tasa de fracturas posTR con la utilización de un tratamiento antirresortivo desde las primeras semanas o meses del TR (27). Sin embargo, es una buena opción para pacientes con alto riesgo de fractura como aquellos con fractura previa por fragilidad, o bien con osteoporosis diagnostacada antes del TR, especialmente si se prevé una exposición a dosis mayores de esteroides como los pacientes hipersensibilizados (Tabla 1) (Figura 3). Los bifosfonatos pueden utilizarse con filtrados de hasta 30 ml/mn [37] y el risedronato (35 mg/semana) es una buena opción [38]. Dos estudios controlados con biopsias óseas repetidas antes y después del TR, no han demostrado que los bifosfonatos incrementen el riesgo de enfermedad ósea adinámica [6] [39]. Una alternativa a los bifosfonatos es el Denosumab (60 mg s.c./6meses) que ha demostrado preservar durante el primer año la DMO tanto a nivel del esqueleto axial como apendicular [40] [41].
4.5 Prevención de las caídas
Dada la edad, comorbilidades y polimedicación de los receptores de TR en la actualidad (Tabla 1), se hace imprescindible informar a los pacientes y familiares sobre los cuidados para prevenir las caídas.
5. TRATAMIENTO DE LA FRACTURA ESTABLECIDA.
El objetivo es incrementar la salud ósea y prevenir nuevas fracturas. Además de las medidas generales para el tratamiento de la osteoporosis en la población general, y de la corrección de las alteraciones específicas del metabolismo mineral del TR, los agentes antirresortivos son los recomendados. Con filtrado >30 ml/min un bifosfonato oral es la primera elección dada la elevada experiencia en enfermos no renales o con ERC [11] [37]. En una revisión sistemática reciente se observó que los bifosfonatos reducen la tasa de fracturas tras el TR aunque con bajo nivel de certeza [42]. La duración del tratamiento no está establecida pero de manera similar a la población no trasplantada, no deben sobrepasarse los 5 años, reevaluando entonces el riesgo de fractura. Deben también aplicarse las medidas de prevención de necrosis ósea mandibular [11]. Con mayor deterioro de la función renal, el Denosumab, un anticuerpo monoclonal anti-RANKL que no se elimina por vía renal, es una buena alternativa (60 mg s.c/6 meses) [40] [41]. El Denosumab incrementa el riesgo de cistitis, aunque no de pielonefritis aguda, urosepsis u otras infecciones [40]. Al contrario de los bifosfonatos, el Denosumab no se incorpora a la matriz ósea y se han descrito fracturas vertebrales tras su retirada [43]. Por tanto, se recomienda un tratamiento alternativo de la osteoporosis cuando se suspenda.
Aunque no existe suficiente experiencia, en los casos con resistencia a los antirresortivos y sospecha de enfermedad de bajo remodelado óseo (PTH suprimida y fosfatasa alcalina ósea por debajo de los límites normales), es razonable el tratamiento con teriparatida por su efecto anabolizante osteoblástico e incluso la terapia secuencial anabolizante y antirresortiva [11]. En estos casos complejos es aconsejable disponer de una biopsia ósea confirmatoria antes de iniciar el tratamiento. El único estudio controlado con placebo en el que se ha investigado el efecto de la teriparatida sobre la densidad y la histomorfometría óseas tras el TR, tiene varias limitaciones importantes que impiden su extrapolación al tratamiento de la fractura establecida (escaso número de pacientes y período de exposición limitado a los 6 primeros meses del TR) [44].
El Romosozumab es un nuevo agente biológico que bloquea la esclerostina e incrementa la formación a la vez que inhibe la resorción ósea. En ensayos fase III ha demostrado un potente efecto positi vo sobre la DMO en la osteoporosis postmenopáuica [45]. La primera experiencia en TR se realizó en 12 pacientes, observándose que un año de tratamiento aumentó la DMO a nivel vertebral en un 15.18% y un 8.83% en la cadera total [46]. No tuvo efectos adversos destacables y parece que puede llegar a ser una buena alternativa en pacientes resistentes a otros tratamientos o con osteoporosis severa.
6. MANEJO DEL HIPERPARATIROIDISMO PERSISTENTE.
6.1 Historia natural
Los niveles de PTH mejoran rápidamente después del TR debido a la recuperación de la función renal y a la corrección de las alteraciones del metabolismo mineral, que condicionan una regresión de la hiperplasia paratiroidea. En los receptores con grados significativos de hiperparatiroidismo antes del trasplante (PTH >300 pg/ml) la PTH desciende rápidamente hasta los tres meses para luego hacerlo más lentamente hasta el año del TR [47]. En los receptores que parten de niveles de PTH <300 pg/ml, éstos ascienden ligeramente en los primeros meses para luego caer al año por debajo de los valores basales [47]. Globalmente, el hiperparatiroidismo se resuelve por completo en solo el 30% y 50% de los receptores al año y dos años, respectivamente, del TR [27] [48]. Los factores que favorecen el hiperparatiroidismo persistente son el grado de hiperparatiroidismo pretrasplante, la insuficiente recuperación de la función renal, y unos niveles bajos de vitamina D [27]. El denominado hiperparatiroidismo terciario se desarrolla cuando el tejido hiperplásico paratiroideo continúa de manera autónoma produciendo PTH a pesar de la recuperación de la función renal, asociándose a hipercalcemia. La incidencia de hipercalcemia puede alcanzar el 30% al final del primer año, manteniéndose en torno al 5-10% a más largo plazo [9] [48]. En biopsias de protocolo se ha demostrado que la hipercalcemia e hipofosforemia postrasplante se asocian a la aparición de microcalcificaciones tubulointersticiales [49] [50]. Su repercusión sobre la función renal es un tema de controversia y no ha sido confirmada en un estudio prospectivo [50]. Sin embargo, dos estudios retrospectivos recientes han demostrado una asociación entre hiperparatiroidismo postrasplante normocalcémico y supervivencia del injerto censurada para la muerte del paciente [51] [52]. En el primero de ellos se realizó un análisis multivariante convincente, ajustando por el filtrado estimado al año y por la puntuación de propensión [51]. Por tanto, aunque la influencia del hiperparatiroidismo postrasplante sobre la función y supervivencia del injerto es un tema controvertido, sí que se recomienda la monitorización de los niveles de PTH postrasplante y su control.
6.2 Tratamiento con Vitamina D
En los receptores de TR existe una alta incidencia de déficit de vitamina D, especialmente en las mujeres, que incrementa los niveles de PTH [9] [53]. El uso de vitamina D nativa (vitamina D3: colecalciferol) en el primer año del TR, comenzando con 100.000U/2 semanas los primeros dos meses y luego cada 2 meses, se asoció a una elevación de los niveles de 25OHD3 y a un descenso secundario de los niveles de PTH [53]. Así mismo, en un ensayo reciente el colecalciferol a dosis de 4000 UI/día durante el primer año del TR, elevó los niveles de 25OHD3, redujo los niveles de PTH y la pérdida de DMO a nivel de columna lumbar, frente a placebo [54]. El tratamiento con vitamina D explicó el 39% del efecto del tratamiento sobre la DMO [54]. La incidencia de efectos adversos, especialmente de hipercalcemia, fue similar en ambos grupos.
El uso de Calcitriol a dosis de 0.5 mcg/48h durante el primer año redujo la pérdida de densidad ósea así como los niveles de PTH frente a placebo [55]. Así mismo, en pacientes estables prevalentes, la administración de 600-1200 mg de calcio y 400-800 U de vitamina D3/día durante un año, corrige el déficit de vitamina D y reduce los niveles de PTH [56]. Por último, en el estudio PARIDOINAL se comparó el tratamiento con paricalcitol (1 m.c.g./día) vs calcidiol (20 m.c.g./día, equivalentes a 0.28 mg/2 semanas) durante los primeros 6 meses del TR, en receptores con hiperparatiroidismo significativo pretrasplante (PTH 250-600 pg/ml). En ambos grupos se redujo la PTH aunque lo hizo de manera más profunda con paricalcitol de tal manera que 2/3 de los casos mostraron valores <70 pg/ml. No hubo diferencias en la DMO entre grupos, y el filtrado estimado al final del estudio fue superior en el grupo de calcidiol [57].
Recientemente se ha publicado el estudio VITALE, un ensayo clínico multicéntrico que comparó los efectos esqueléticos y extraesqueléticos de la vitamina D nativa en receptores de TR no diabéticos, reclutados entre 12-24 meses del TR, y con deficiencia o insuficiencia de vitamina D (25OHD3<30 ng/ml). El grupo control recibió la dosis mínima de vitamina D (12.000 U de colecalciferol cada 2 semanas por 2 meses y luego mensual, por 22 meses, equivalente a 400 UI/día). El grupo de tratamiento recibió dosis elevadas de 100.000 UI cada 2 semanas por 2 meses, y luego mensualmente por 22 meses [58]. Los niveles de vitamina D se elevaron 6 ng/ml en el grupo control y 23 ng/ml en el de dosis alta, mientras que los niveles de PTH solo se redujeron en este último grupo. Por intención de tratar, el grupo de altas dosis tuvo menor incidencia de fracturas (OR 0.24; IC95% 0.07-0.86; p=0.03). En el análisis por protocolo, el grupo de altas dosis mostró una reducción de eventos adversos cardiovasculares mayores con respecto al grupo control (HR 0.37; IC95%: 0.15-0.9; p=0.03). La incidencia de efectos adversos potencialmente relacionados con una intoxicación por vitamina D fue similar en ambos grupos [58].
En resumen, en los últimos años se han añadido evidencias que apoyan la recomendación de las Guías KDIGO de corregir la insuficiencia o deficiencia de vitamina D en los receptores de TR desde fases tempranas [16]. Además, los pacientes con hiperparatiroidismo persistente no hipercalcémico ni hipercalciúrico, pueden tratarse con derivados de la vitamina D. Aunque un estudio unicéntrico relacionó el riesgo de fractura con unos niveles de PTH ≥130 pg/ml a los 3 meses [29], no existe consenso sobre el punto de corte ideal para intervenir. Lo más recomendable es hacerlo en base a la tendencia en el tiempo de los niveles de PTH y no por un valor aislado.
Finalmente, merece un comentario la reciente publicación de un ensayo clínico a doble ciego y controlado en el que se comparan 0.5 mcg/día de calcitriol frente a placebo durante el primer año del TR, en pacientes con retirada rápida de esteroides al 4º día . Todos los pacientes de ambos brazos recibieron 1.000 UI/día de vitamina D3. No hubo diferencias entre grupos en los niveles de PTH ni en ninguno de los parámetros de densidad (DMO) ni salud ósea cortical (HRpQCT) [59]. Sin embargo, la incidencia de hipercalcemia fue superior en el brazo de calcitriol. Por tanto, los resultados de estudio son aplicables a casos donde los esteroides no juegan un papel sobre los cambios óseos y la suplementación con vitamina D nativa suele ser suficiente.
6.3 Calcimiméticos
La introducción de los calcimiméticos ha supuesto un antes y un después en el manejo de la hipercalcemia postrasplante por hiperparatiroidismo terciario: la mayoría de los enfermos responden al tratamiento con Cinacalcet® 30-60 mg/día normalizando los niveles de calcio, elevando los de fósforo, y reduciendo los de PTH de manera significativa, sin modificar la función renal a pesar de la elevación de la calciuria [60]. Para los pacientes con hiperparatiroidismo severo en diálisis, que requieren dosis más elevadas de calcimiméticos (≥60 mg/día), se ha sugerido no discontinuar el calcimimético tras el TR para evitar una hipercalcemia por efecto rebote [48] [61]. En presencia de hipercalcemia moderada (<10.5 mg/dl) es razonable una monitorización inicial de la calcemia a la espera de su normalización. Con hipercalcemias superiores, en especial ≥11 mg/dl o sintomáticas, está indicado el inicio de calcimiméticos. En la actualidad no se conoce la duración óptima del tratamiento, ni se dispone de un biomarcador que guíe la toma de decisiones por lo que su supresión debe realizarse de una forma personalizada [48].
6.4 Paratiroidectomía
Un ensayo clínico controlado comparó el tratamiento con cinacalcet con la paratiroidectomía subtotal en receptores con hipercalcemia después de los seis meses del trasplante. La paratiroidectomía resultó superior para controlar la hipercalcemia, mejoró la densidad ósea a nivel del cuello femoral y fue más coste-eficaz [62]. Hoy se acepta por tanto, que existe una infrautilización de la paratiroidectomía como opción terapéutica del hiperparatirodismo terciario postrasplante [63] [64]. Sin embargo, las potenciales complicaciones de la cirugía (infección de la herida, parálisis del nervio recurrente, síndrome del hueso hambriento que requiere altas dosis de calcio y vitamina D, y deterioro de la función renal) aconsejan limitarla a aquellos casos que requieren altas dosis de calcimiméticos (>60 mg/día de cinacalcet) o que no responden a los mismos [48]. Dentro de las diferentes opciones, la paratiroidectomía subtotal, que consiste en la exeresis de las 4 glándulas, excepto una porción de glándula bien vascularizada y de apariencia macroscópica normal, ofrece buenos resultados y es menos agresiva [48].
7. HIPERPARATIROIDISMO SECUNDARIO A LA ENFERMEDAD RENAL CRÓNICA DEL TRASPLANTE
El 80% de los pacientes con más de un año de trasplante presentan insuficiencia renal crónica en estadios 3-5 [9]. Las recomendaciones para el control del hiperparatiroidismo secundario, la retención de fósforo, y las calcificaciones vasculares son las mismas que en pacientes no trasplantados.
8. HIPOFOSFOREMIA
En las primeras cuatro semanas del trasplante el 40-50% de los pacientes desarrollan hipofosforemia secundaria a un escape tubular de fósforo [47], consecuencia de unos niveles elevados de parathormona o/y de FGF-23 [65]. La hipofosforemia precoz, sobre todo si es <2 mg/dl, debe corregirse con suplementos orales de fósforo, ya que puede inducir apoptosis osteoblástica, deterioro de la mineralización ósea, y contribuir a la pérdida de masa ósea [66] [67]. En cambio, la hipofosforemia secundaria a hiperparatiroidismo persistente en fase estable no debe corregirse con aportes de fósforo pues estimulan la secreción de PTH y FGF23 al tiempo que reducen los niveles de calcitriol [48].
9. NECROSIS ÓSEA AVASCULAR (NOA)
Con la inmunosupresión moderna y la reducción significativa de las dosis de corticosteroides, la NOA postrasplante es un evento poco frecuente. En un estudio unicéntrico su incidencia fue del 2.2%, apareciendo los primeros síntomas al año del TR. Los factores de riesgo identificados en el análisis multivariante fueron la dosis acumulada de glucocorticoides (principalmente para el tratamiento del rechazo agudo) y un índice de masa corporal >26 [68]. En la Universidad de Minnesota su incidencia ha caído desde 7.2% a 1.1% en el período 2001-2024 [69].