Técnicas quirúrgicas en donante vivo y fallecido. Complicaciones. Indicaciones de embolización y nefrectomía del injerto.
Palabras clave
Trasplante renal, técnica quirúrgica, extracción, complicaciones, trombosis arteria renal, estenosis arterial renal, trombosis venosa, fístula urinaria, estenosis ureteral, colecciones líquidas, herida quirúrgica, embolización del injerto, nefrectomía del injerto
INTRODUCCIÓN
Las complicaciones quirúrgicas relacionadas con el trasplante renal (TR) han recibido escasa atención en la literatura médica, a pesar de su impacto en la morbimortalidad del receptor y en la viabilidad del injerto. La mayor parte de los estudios publicados son unicéntricos y retrospectivos, con una definición variable de estas complicaciones. Por tanto, resulta difícil extraer conclusiones sobre su verdadera incidencia, la eficacia de las actitudes terapéuticas instauradas y los factores de riesgo implicados en su desarrollo. Además, en los últimos años hemos asistido a cambios relacionados con el tipo de riñones trasplantados, la comorbilidad de los receptores y el uso de nuevas combinaciones de fármacos inmunosupresores. Todos estos cambios tienen un impacto sobre la incidencia y la gravedad de estas complicaciones.
El desequilibrio permanente entre los órganos disponibles y los pacientes en lista de espera para TR ha condicionado el desarrollo de estrategias para aumentar el número de donantes. En este sentido, se ha incrementado la utilización de donantes con criterios expandidos, tradicionalmente no aceptados para trasplante [1]. Uno de estos criterios, la edad avanzada del donante, se acompaña de un incremento en la patología vascular que podría condicionar a su vez la aparición más frecuente de algunas complicaciones en el postrasplante. También se ha incrementado la edad y comorbilidad de los receptores. El receptor mayor, frágil, con posibilidades de patología vascular, diabetes y un estado nutricional deficiente, puede presentar un mayor riesgo de complicaciones quirúrgicas [2]. Por último, las combinaciones inmunosupresoras con derivados del ácido micofenólico (AMF) o inhibidores de mTOR (imTOR) se pueden acompañar de un aumento del riesgo de complicaciones quirúrgicas postrasplante. En las antiguas pautas con uso de imTOR en combinación con AMF, se había descrito una mayor incidencia de complicaciones urológicas y de la herida quirúrgica [3], sin embargo, las nuevas combinaciones de imTOR con tacrolimus de novo, no parecen tener mayor tasa de complicaciones [4].
La presentación inicial de estas complicaciones puede ser muy similar a la de algunos problemas no quirúrgicos como el rechazo agudo o la toxicidad por fármacos, por lo que es necesario realizar un diagnóstico diferencial precoz con el objetivo de instaurar un tratamiento dirigido eficaz. Incluso aunque estas complicaciones no afecten a la función del injerto, pueden causar una morbimortalidad significativa en el receptor, por lo que los profesionales que asisten el proceso de TR deben tenerlas en cuenta para optimizar las estrategias preventivas y terapéuticas.
Las European Association of Urology Guidelines constituyen un compendio de evidencia y de información muy útil y actualizado sobre la prevención y manejo de las complicaciones quirúrgicas asociadas a la extracción e implante renales [5].
TÉCNICAS QUIRÚRGICAS DE EXTRACCIÓN Y TRASPLANTE RENAL
Extracción en donante vivo
La nefrectomía laparoscópica, pura o mano-asistida es la técnica de elección para la extracción renal en donante vivo, superando la clásica nefrectomía abierta por lumbotomía [6] [7]. Conlleva menor demanda analgésica, un alta más precoz, una incorporación laboral más temprana y menor alteración de la imagen corporal. Por el contrario, los tiempos quirúrgicos y de isquemia caliente son más prolongados, y la curva de aprendizaje más larga.
La incidencia global de complicaciones es semejante, aunque con perfiles diferentes. En la técnica abierta predominan las complicaciones pulmonares (atelectasia, neumotórax y neumonía) y las de la herida quirúrgica; en la laparoscópica predominan las complicaciones vasculares intraoperatorias, que exigen la reconversión a cirugía abierta. Además, un 25% de los donantes experimentan dolor o disconfort tras la cirugía, que puede durar meses [8]. La mortalidad perioperatoria por donación renal en vivo se ha establecido entre un 0.01% to 0.03%, sin cambios aparentes en la era moderna [9].
Vía laparoscópica
El abordaje puede hacerse por vía transperitoneal o retroperitoneal. El riñón izquierdo es preferido por la mayor longitud del pedículo vascular; sin embargo en casos de anomalías anatómicas o pedículos vasculares múltiples (10-30% de los casos), se utiliza el riñón derecho.
Tras el acceso a la cavidad intraperitoneal con 4 puertos laparoscópicos y con presión intraabdominal de 12-15 mmHg se procede en el lado izquierdo a la movilización y retracción medial del colon descendente y a la identificación y disección del uréter izquierdo, preservando su vascularización en la grasa periureteral. La basculación del polo inferior renal permite tensar el pedículo vascular y facilitar su disección, extremando la meticulosidad en el sellado de los linfáticos hiliares mediante Ligasure®. Completada la disección vascular en la máxima extensión posible se procede a la liberación de la cara posterior renal, a la sección de los ligamentos esplenorenales y del uréter. Se introduce la mano en la cavidad abdominal a través de mini-incisión (6-7 cm) periumbilical o en fosa iliaca, con ayuda de un dispositivo de cirugía mano-asistida que permite traccionar suavemente del injerto en el momento del clipaje y sección del pedículo vascular. Ello minimiza el tiempo de isquemia caliente y permite mayor control en caso de complicaciones vasculares durante la sección vascular. La alternativa a la extracción mano-asistida exige el embolsado del injerto, con aumento del tiempo de isquemia caliente y del traumatismo renal por la mini-incisión practicada. La arteria o arterias renales se controlan con hemoclips, mientras que para la vena se pueden utilizar hemoclips o EndoGIA™ en función de su diámetro.
En el lado derecho se procede de modo semejante tras la movilización del colon derecho y rechazar el hígado, pudiendo ser necesaria alguna modificación técnica que permita obtener una vena renal de la máxima longitud posible (reconversión final a técnica abierta mini-incisional, clamp Satinsky en la vena cava y sutura laparoscópica de la misma o modificación de la EndoGIA™).
Un reciente metaanálisis mostró que la nefrectomía laparoscópica mano-asistida presenta un tiempo de cirugía y de isquemia caliente menor que la técnica laparoscópica pura, aunque no se encontraron otras diferencias en cuanto a complicaciones intraoperatorias o supervivencia del injerto [10]. Técnicas endoscópicas como la nefrectomía con único puerto de entrada (normalmente el ombligo) o la cirugía transluminal a través de orifico natural (vagina), debe limitarse a centros altamente especializados, con profesionales entrenados en este tipo de técnicas [5].
En los últimos años, la cirugía laparoscópica asistida por robot se ha empezado a utilizar tanto en la nefrectomía del donante como posteriormente en el implante en el receptor [11] [12]. La nefrectomía con robot se asoció a mayor tiempo de intervención y de isquemia fría, aunque menos dolor postoperatorio y similar tasa de complicaciones o función renal remanente en el donante [12]. El implante con robot tiene especial interés en receptores obesos [11].
Vía abierta
Los abordajes posibles son laparotomía media, lumbotomía o técnica mini-incisional subcostal. La disección del pedículo vascular tiene lugar tras la liberación del riñón, a diferencia de la técnica laparoscópica. La meticulosidad en la disección vascular y en la preservación de la vascularización ureteral obviando la disección en el seno renal y manteniendo la grasa periureteral con su vascularización, junto con el sellado de los linfáticos del hilio son detalles importantes. La ligadura arterial y venosa se ve seguida de la sección de ambas estructuras junto de la del uréter. El tiempo de isquemia renal es inferior a 1-2 min.
Tras la extracción del injerto se procede a la perfusión del mismo con líquido de preservación para mantenerlo en isquemia fría de superficie a 4º C hasta el momento del implante. Este tiempo ha de ser el mínimo posible, y se hace coincidir la disección vascular del donante con el inicio de la cirugía del receptor.
Trasplante Renal
El implante renal se lleva a cabo en la fosa ilíaca derecha en localización extraperitoneal mediante incisión ilioinguinal. Esta fosa es la elegida habitualmente, ya que la disposición más superficial de la vena ilíaca facilita las anastomosis vasculares, que se realizan término-lateralmente con los vasos ilíacos externos. En caso de segundo trasplante o en situaciones patológicas arteriales (ateromatosis) o venosas (trombosis venosa previa) se elige la fosa ilíaca izquierda. En terceros o cuartos trasplantes se opta por reutilizar alguna de las fosas ilíacas colocando el injerto más alto conectado a vasos ilíacos primitivos. Excepcionalmente se realiza la implantación ortotópica en fosa lumbar tras nefrectomía izquierda. En estos casos las anastomosis vasculares se hacen con la arteria esplénica y la vena renal en término-terminal. Es necesario recordar que el implante del riñón de donante vivo exige una anastomosis termino-lateral a arteria iliaca de una arteria renal del injerto sin parche aórtico, lo que hace más compleja esa anastomosis y requiere una destreza mayor que la clásica anastomosis de una arteria renal con parche aórtico, habitual en los riñones procedentes de donante fallecido.
Realizadas las anastomosis vasculares y perfundido el riñón, se lleva a cabo la ureteroneocistostomia que establece la continuidad del tracto urinario entre el uréter del injerto y la vejiga del receptor. Existen dos variedades de técnicas de reimplantación ureteral: las intravesicales (Leadbetter-Plitano, Paquin) y las extravesicales (Lich-Gregoir, Barry, Taguchi). En todas se intenta conseguir un túnel submucoso ureteral (2-3 cm), que actúe como mecanismo antirreflujo. Las extravesicales suelen conllevar menos tiempo quirúrgico, apertura vesical menor, uréteres del injerto más cortos y tasa más baja de complicaciones.
Recientemente, un metaanálisis mostró que la técnica de Lich-Gregoir se asocia a menor incidencia de fístula urinaria, estenosis y hematuria post-operatoria [13].
Si el uréter es demasiado corto o la vejiga de baja capacidad sólo es posible realizar una reimplantación directa en vejiga sin mecanismo antireflujo asociado.
La reconstrucción de la vía urinaria tras implante ortotópico renal se lleva a cabo mediante pielopielostomia entre las pelvis del injerto y del receptor.
Aunque la utilización sistemática de un catéter doble J tutorizando la reimplantación ureterovesical fue controvertida en el pasado, meta-análisis recientes han evidenciado que su uso rutinario disminuye de modo significativo la incidencia de fistula urinaria [14]. Sin embargo, sería una fuente de infección urinaria potencial en el post-TR y además exige la realización posterior de una endoscopia para retirar el mismo a las 2 – 3 semanas de la intervención. De hecho, la retirada precoz (< 15 días postoperatorios) se ha asociado a menor incidencia de infección de orina [15].
COMPLICACIONES QUIRÚRGICAS
Como ya se ha comentado anteriormente, las complicaciones quirúrgicas aumentan la morbimortalidad de los receptores, y comprometen la supervivencia del injerto. No se dispone de estudios multicéntricos que evalúen las complicaciones urológicas en nuestro medio. Según datos del Registro de Enfermos Renales de Cataluña, en el periodo 2011-2017, un 3.7% de las pérdidas del injerto se atribuyeron a una complicación quirúrgica [16].
Complicaciones vasculares
Pueden afectar a los vasos de donante, receptor o ambos, y pueden resultar en morbilidad importante, pérdida del injerto y muerte. De hecho, en la actualidad podrían constituir la causa más frecuente de pérdida del injerto durante el primer año.
La incidencia de hematomas peri-injerto varía entre 0.2-25% de los pacientes trasplantados [17]. Son factores de riesgo la obesidad y los agentes antiagregantes o anticoagulantes recibidos por el paciente antes de la intervención. Si se mantuvo un tubo de drenaje post-quirúrgico, la sangre del receptor saldrá a través de él. Esto, junto con el descenso en la presión arterial y en el hematocrito son signos evidentes de sangrado. Con frecuencia la hemorragia cesa espontáneamente, aunque a veces es grave y requiere exploración quirúrgica.
La trombosis de la arteria renal del injerto ocurre en el 0.5-3.5% de los TR (usualmente alrededor de un 1%) [18] y suele ser precoz y causada por un problema técnico. Con frecuencia conduce a la pérdida del injerto. Factores de riesgo son la hipotensión durante la cirugía de implante, los periodos de anastomosis prolongados, la existencia de múltiples arterias o el daño arterial inadvertido durante la extracción renal. El rechazo agudo y un estado de hipercoagulabilidad pueden contribuir. El cuadro clínico consiste en la ausencia de diuresis post-cirugía o el cese brusco de la misma tras horas o días, y el diagnóstico realiza visualizando un injerto sin captación isotópica o sin flujo arterial en ecografía-doppler. La trombectomía urgente resuelve un número muy limitado de casos.
La trombosis venosa del injerto (0.5-4% [19]) suele resultar en pérdida del mismo. La causa puede ser un problema técnico de anastomosis, la torsión o angulación de la vena, la compresión extrínseca por linfocele o hematoma o la extensión de una trombosis venosa profunda femoral o ilíaca. Como la arterial, suele ser precoz, durante la primera semana post-TR. Se presenta con dolor intenso en la zona del injerto y ausencia de diuresis. Aunque puede diagnosticarse por ausencia de captación isotópica del injerto, la inversión del flujo diastólico es patognomónica en ecografía-doppler. La trombectomía no suele ser posible, y se requiere trasplantectomía.
La utilización en los últimos años de riñones provenientes de donantes en asistolia se ha incrementado exponencialmente en España (casi un 30% del total de trasplantes realizados en 2018, la mayoría provenientes de donantes en asistolia controlada) [20]. Este tipo de donante se asoció en series iniciales a un porcentaje mayor de complicaciones vasculares postrasplante, incluidas en la llamada “no función primaria”. El grupo español de trabajo GEODAS ha documentado una tasa de un 3.4% de fallo primario del injerto entre injertos de donantes en asistolia controlada [21].
La estenosis de la arteria renal del injerto suele ser tardía en su presentación y localizada en la zona distal cercana a la anastomosis. La incidencia es muy variable: se ha observado en un 1-25% de los receptores durante el primer año post-TR [22]. Los factores predisponentes más relevantes son los relacionados con la técnica quirúrgica y la aterosclerosis severa del receptor, y el signo más habitual es la hipertensión arterial severa difícil de controlar. A veces se detecta deterioro de función renal, edemas generalizados y/o cuadro de insuficiencia cardíaca. La ecografía doppler y la angio-RMN son útiles para cribado, aunque la angiografía de sustracción digital se considera la técnica de elección para su diagnóstico. Finalmente, la arteriografía, que permite dilatación transluminal con o sin implante de stent, soluciona más del 80% de los casos, aunque la tasa de recurrencia es elevada, y en ocasiones se hace necesaria la cirugía reconstructiva [23].
La trombosis de la arteria ilíaca del receptor es poco frecuente pero muy grave, ya que pone en serio peligro la viabilidad del miembro afecto. En ocasiones es muy precoz, incluso intra-operatoria, por lo que la exploración del miembro inferior ipsilateral al implante renal es obligada tanto antes de la cirugía con fines preventivos, como tras cada cirugía, para un diagnóstico muy precoz de la complicación. La enfermedad vascular previa, la diabetes y las infecciones son factores predisponentes.
La mayoría de los aneurismas de la arteria del injerto son pseudoaneurismas, que suelen resultar de una rotura parcial de la anastomosis. La rotura del aneurisma es una complicación grave que requiere intervención quirúrgica urgente. En ausencia de infección y hemorragia grave, la reparación del pseudoaneurisma y el rescate del injerto son habitualmente posibles.
Complicaciones de la vía urinaria
Las fístulas urinarias (0.09-3% de los TR) se originan fundamentalmente por problemas técnicos o isquemia. La utilización de un catéter doble J tutorizando la unión ureterovesical disminuye su incidencia [24]. Se diagnostican cuando se detecta una creatinina superior a la plasmática en el fluido drenado espontáneamente o en un aspirado de una colección periinjerto, y se clasifican según su localización. En la unión vesico-ureteral suelen manifestarse precozmente, están relacionadas con la técnica de anastomosis y normalmente requieren reconstrucción quirúrgica inmediata. Las ureterales se producen tras isquemia ureteral y son algo más tardías [25]. Los síntomas suelen iniciarse con hinchazón de la zona, dolor, disminución de diuresis y deterioro de función renal, a veces con fiebre. Al diagnóstico ecográfico de la existencia de colección, suele seguir una prueba radiológica con contraste para visualizar el lugar y extensión de la fístula. La punción percutánea ecodirigida del sistema pielocalicial del injerto permite la realización de una pielografía anterógrada que localiza la fístula, así como la colocación de una nefrostomía percutánea y/o de un catéter doble J anterógrado, medidas que en caso de fístulas de pequeño tamaño localizadas en la proximidad de la unión urterovesical pueden ser suficientes para su resolución [26]. Sin embargo, las de características isquémicas, que normalmente afectan a un segmento ureteral extenso, precisan reintervención encaminada a la resección del segmento isquémico y nuevo reimplante uretero-vesical tutorizado con doble J. En algunos casos con necrosis ureteral extensa es necesaria la anastomosis con el uréter o la pelvis nativa del receptor, con o sin nefrectomía asociada.
La estenosis ureteral es una complicación relativamente frecuente tras el TR, con incidencia que oscila entre el 0.6-10.5% de los pacientes. La estenosis ureteral precoz (< 3 meses tras el TR) se debe a la isquemia ureteral producida durante el procedimiento quirúrgico, mientras que las tardías (> 6 meses posTR) suelen ser provocadas por infecciones – como la infección por virus BK-, fibrosis, aterosclerosis progresiva y/o rechazo [25] [27]. Tras la detección ecográfica de dilatación pieloureteral, se procede a la colocación de una nefrostomía; la pielografia anterógrada permite localizar la estenosis y medir su longitud. La estenosis de la vía urinaria puede localizarse en la unión pieloureteral (un tercio de los casos), o en los segmentos distales del uréter. Su tratamiento puede ser abierto (ureteroneocistostomía tras resección del segmento estenótico o pieloureterostomía con la vía nativa del receptor) [28] o endourológico -normalmente las de menos de 3 cm- (dilatación con catéter balón de alta presión y colocación de doble J durante 2-3 semanas, endoureterotomia endoscópica e implantación de stent ureteral metálico autoexpandible (en casos seleccionados de deterioro funcional severo o riesgo quirúrgico alto). La tasa de éxito de las técnicas endourológicas es de un 50%, mayor en las estenosis < 1 cm [29] [30], y la recidiva es frecuente.
La hematuria precoz es una complicación frecuente (1-34 %) [31], y suele resolverse espontáneamente en 1-2 días. Los casos graves que producen obstrucción por coágulos son causa de deterioro de función renal y requieren irrigación intensiva de la vejiga.
Colecciones líquidas periinjerto
Las colecciones infra-aponeuróticas (las supra-aponeuróticas son complicaciones de la herida quirúrgica) se pueden clasificar según la sintomatología asociada (sintomáticas por compresión vascular o de la vía urinaria o incidentales, diagnosticadas radiológicamente) y según su composición (linfocele, hematoma, urinoma, absceso).
Las colecciones de linfa (linfoceles) son relativamente frecuentes 1-26 % [32] y secundarias a la sección de vasos linfáticos ilíacos en el receptor y del hilio del injerto renal en el donante durante la extracción. Los factores de riesgo clásicamente descritos son la necrosis tubular aguda, el retrasplante, el rechazo, y el uso de AMF y/o imTOR [33]. Suelen diagnosticarse a partir de las dos primeras semanas después del TR, cuando los síntomas compresivos afectan la vena ilíaca (edema del miembro ipsilateral) o dilatan la vía urinaria (deterioro de función renal). La ecografía lo detecta y el análisis del líquido drenado permite diferenciarlo del urinoma u otros tipos de colección. Los incidentales suelen ser pequeños y resolverse espontáneamente. Los sintomáticos pueden ser tratados mediante drenaje percutáneo, esclerosis con instilación diaria de diferentes sustancias (povidona yodada, bleomicina) [34] o, cada vez más frecuentemente mediante marsupialización, laparoscópica o abierta, con creación de una ventana peritoneal. El tamaño y localización del linfocele condiciona la elección de la técnica a seguir, pero la tendencia es a resolverlo con intervención quirúrgica [32] [33]. Para aquellos linfoceles grandes y sintomáticos, la marsupialización laparoscópica es la técnica de elección, con tasa más baja de recidiva (8%) y complicaciones (14%) comparado con cirugía abierta [33].
Complicaciones de la herida quirúrgica
Son las complicaciones quirúrgicas más frecuentes tras el TR. No suelen conducir a la pérdida del injerto renal o la muerte del paciente, pero se asocian a morbilidad significativa, prolongación de estancia hospitalaria y eventualmente a compromiso funcional renal.
No infecciosas
La incidencia es similar a la del paciente no trasplantado que se somete a cirugía. Los factores de riesgo más descritos son la reintervención a través de incisión del trasplante previo, la obesidad y, en estudios clásicos, uso de inhibidores de mTOR [3]. En el ensayo clínico Transform, que comparó 2 ramas de tratamiento en receptores de TR basadas en tacrolimus estándar + AMF + prednisona vs tacrolimus reducido + everolimus + prednisona, la incidencia de complicaciones de herida quirúrgica fue de un 19.8% en el grupo de everolimus vs 16.2% en el grupo de micofenolato [4].
Las complicaciones supraaponeuróticas no suelen precisar cirugía, y suelen ser la dehiscencia cutánea limitada o las colecciones subcutáneas (hematomas o seromas). Estas colecciones requieren con frecuencia drenaje. Si la dehiscencia supra-aponeurótica con separación de las capas superficiales (piel y tejido subcutáneo) se produce en el postoperatorio inmediato y no se documenta infección, suele resolverse con sutura quirúrgica.
La dehiscencia aponeurótica, con separación de la fascia muscular de la incisión en el período perioperatorio, requiere reintervención quirúrgica.
En el postoperatorio tardío, hasta un 4% de pacientes desarrollan una hernia incisional (4%) [35].
Infecciosas
Son más precoces que las no infecciosas. Las Guías Europeas de Urología de TR recogen una incidencia de infección de la herida quirúrgica del 4% [11].
Se clasifican en:
Supra-aponeuróticas: infección diagnosticada en los primeros 30 días del trasplante, limitada a piel o tejido subcutáneo y con, al menos, uno de los siguientes criterios:
• Drenaje purulento en la incisión superficial.
• Signos o síntomas de infección (dolor, calor, rubor)
• Diagnóstico de infección superficial de la herida establecido por el propio cirujano
Infra-aponeuróticas: diagnosticada en los primeros 30 días del trasplante, con afectación de la fascia o capa muscular y al menos uno de los siguientes criterios:
• Drenaje purulento en la incisión profunda
• Dehiscencia espontánea en el seno de fiebre (>38º), dolor localizado o fluctuación
• Absceso hallado en la exploración directa, la reintervención o en exploraciones radiológicas
• Diagnóstico de infección profunda de la herida
• Celulitis
Infra-aponeuróticas profundas: se tratan con drenaje (quirúrgico o percutáneo) y antibióticos. Las infecciones superficiales suelen tratarse con apertura de la herida y cierre por segunda intención; los antibióticos no son imprescindibles, a menos que se detecte afectación sistémica o celulitis.
La terapia VAC (vacuum assisted closure, por sus siglas en inglés) consiste en un dispositivo de presión negativa que se aplica a las dehiscencias de pared abdominal, cierres por segunda intención cuando existe infección de la herida quirúrgica, colecciones, etc. La literatura en TR es escasa, pero los datos apuntan a que su uso para manejo de complicaciones de la herida quirúrgica es creciente, pudiendo suponer hasta un 30% de las actitudes terapéuticas en los pacientes con complicaciones de la herida quirúrgica [36].
Complicaciones tras biopsia renal del injerto
Tras la realización de una biopsia del injerto renal con control ecográfico, puede observarse desde hematuria leve en el 10% de los casos, hasta hematuria severa que requiere transfusión en el 1% de casos y esporádicamente arteriografía y embolización selectiva [37]. Los hematomas post-biopsia son poco frecuentes y muy raramente requieren intervención. Aunque relativamente frecuentes si se exploran de rutina con ecografía-doppler, las fístulas arteriovenosas post-biopsia no suelen requerir ninguna maniobra terapéutica [38].
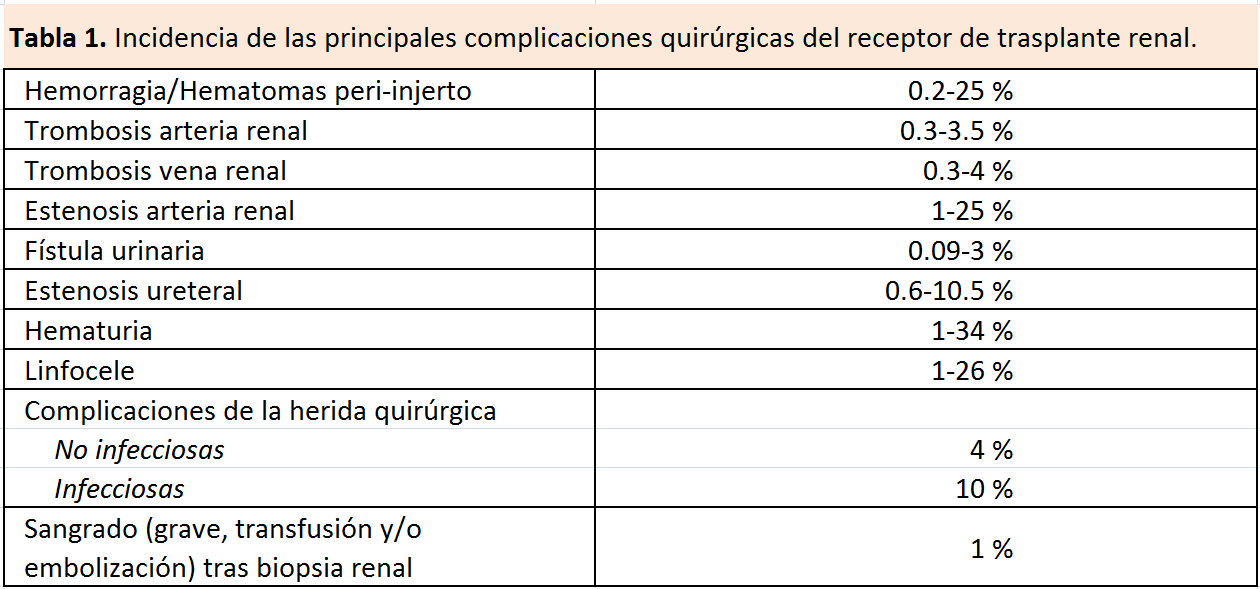
La incidencia descrita en la literatura de las principales complicaciones quirúrgicas postrasplante renal se resumen en la (Tabla 1).
MANEJO DEL INJERTO RENAL TRAS LA PÉRDIDA DE SU FUNCIÓN
Actualmente, entre el 4-10% de los pacientes que inician diálisis lo hacen tras la pérdida de un injerto renal [39]. Estos pacientes presentan similar supervivencia que los que inician diálisis por primera vez [40]. El injerto renal no funcionante puede mantenerse in situ o ser excluido del árbol vascular del paciente mediante embolización percutánea o nefrectomía (trasplantectomía).
Se recomienda realizar nefrectomía si la pérdida del injerto ha sido precoz, si hay riesgo de rotura (trombosis vascular, rechazo hiperagudo/agudo), o complicaciones técnicas (infección de lecho quirúrgico, linfocele, desinserción ureteral o rotura vesical) [41].
En caso de pérdida progresiva tardía la estrategia clásica ha sido mantener el injerto in situ, reduciendo gradualmente el tratamiento inmunosupresor hasta suspenderlo. Esta retirada pretende disminuir el riesgo de infección y los efectos secundarios a largo plazo, así como la toxicidad de los fármacos inmunosupresores. No existe consenso sobre la manera óptima de realizarla. Una pauta orientativa es: 1) suspender de manera inmediata el fármaco no inhibidor de calcineurina (AMF o imTOR), 2) reducir cada semana un 25% de la dosis del anticalcineurínico y 3) reducir cada mes 2.5 mg la dosis de esteroides, vigilando la aparición de insuficiencia suprarrenal secundaria. Aproximadamente, en unos 6 meses podríamos haber retirado toda la inmunosupresión [42].
En algunos casos, el injerto sufre un proceso degenerativo que condiciona una reducción de su tamaño y un aumento de su consistencia a la palpación, y puede terminar calcificándose. Por el contrario, en otros pacientes el injerto in situ pude causar problemas clínicos (síndrome de intolerancia al injerto, HTA renovascular, proteinuria severa, pielonefritis del injerto, etc.), debiendo realizarse entonces embolización o trasplantectomía. El síndrome de intolerancia al injerto es frecuente en los pacientes tras suspender el tratamiento inmunosupresor, sobre todo durante el primer año. Se caracteriza por la aparición de fiebre, cuadro pseudogripal con malestar general, naúseas, vómitos, dolor local, aumento del tamaño del injerto y hematuria. La fiebre es el síntoma más constante (90%). Debe sospecharse en pacientes que han reiniciado diálisis tras la pérdida del injerto y que presenten fiebre o febrícula prolongada de origen desconocido. También puede cursar con anemia, resistencia a agentes eritropoyéticos y aumento de los marcadores inflamatorios. Su diagnóstico se basa en la sospecha clínica, una vez descartados los cuadros infecciosos y febriles de otro origen, y en la confirmación de la persistencia de flujo en el injerto mediante técnicas de imagen (renograma o ecodoppler). El control de los síntomas iniciales se logra con prednisona (5-10 mg/día vo). El tratamiento definitivo consiste en embolización percutánea o trasplantectomía [43].
Indicaciones de embolización y nefrectomía del Injerto
La embolización percutánea del injerto es una técnica vascular intervencionista. En general, se aborda la arteria del injerto mediante punción arterial femoral, y se introducen sustancias que ocasionan trombosis de la microcirculación (etanol o partículas de polivinilalcohol) [44]. Se suele completar con la inserción de coils en la arteria principal. En un 60-90% de los casos, puede aparecer “síndrome post-embolización”, por necrosis del injerto (dolor en el injerto, fiebre o febrícula, malestar general, naúseas, vómitos, ileo paralítico, hematuria). Este síndrome se puede evitar con tratamiento peri-intervención con corticoides a 1mg/kg de peso. Si ocurre, se recomienda realizar un ecodoppler para comprobar la ausencia de flujo en el injerto.
La nefrectomía del injerto o trasplantectomía es el procedimiento quirúrgico mediante el que se extrae el injerto no funcionante. En los casos de pérdida tardía del injerto la localización y extracción del injerto es técnicamente más complicada ya que se encuentra inmerso en una amplia zona de fibrosis circundante [44] [45] [46]. Aunque inicialmente se describió que la práctica de la nefrectomía del injerto renal no funcionante debería generalizarse [45], datos recientes sugieren que la nefrectomía del injerto se asocia a una mayor sensibilización posterior del receptor, posiblemente asociado a una retirada más abrupta de la inmunosupresión [46].
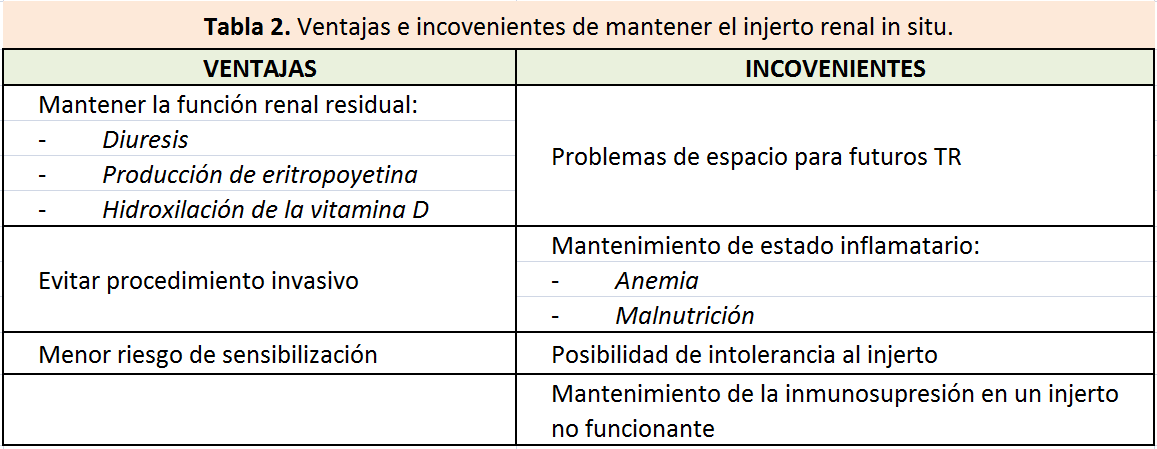
Las ventajas e incovenientes de mantener el injerto renal no funcionante in situ se describen en la (Tabla 2).