Trasplante de Riñón y Páncreas
Palabras clave
Trasplante renal, trasplante páncreas, diabetes, cirugía, indicaciones, inmunosupresión, complicaciones, supervivencia
Introducción
La nefropatía diabética (ND) es la primera causa de inicio de tratamiento sustitutivo por enfermedad renal crónica avanzada (ERCA) en la mayoría de los países occidentales [1]. Aunque el riesgo de ERCA es mayor en la diabetes mellitus (DM) tipo 1, la alta prevalencia de DM tipo 2, hace que ésta contribuya a un mayor porcentaje de pacientes con ERCA por ND. Para la mayoría, el trasplante de riñón (TR) será la mejor opción, y un grupo seleccionado se podrá también beneficiar de las ventajas de un trasplante de páncreas (TP) efectuado de forma simultánea. La disminución de las complicaciones quirúrgicas tras la mejoría de la técnica, así como de los episodios de rechazo agudo (RA) con la introducción de nuevos y más potentes fármacos inmunosupresores, ha permitido reducir la elevada morbimortalidad que inicialmente se asociaba a este trasplante combinado. En la actualidad, no existe ninguna forma ni pauta de administración de insulina que permita obtener un control glicémico tan correcto como el observado con el TP, incluyendo las bombas de perfusión de insulina o el páncreas biónico. Un injerto pancreático funcionante es capaz de producir insulina en función de las demandas metabólicas de cada paciente, estableciendo un estado euglucémico, que permite alcanzar unos valores normales de hemoglobina glicosilada (HbA1c) sin episodios críticos de hipoglucemia. Este correcto control metabólico permite también estabilizar e incluso revertir algunas de las complicaciones crónicas asociadas a la enfermedad diabética, como la enfermedad cardiovascular o la retinopatía y neuropatía diabética, lo que se traduce en una mayor supervivencia y mejor calidad de vida de estos pacientes [2] [3] [4] [5] [6] [7] [8] .
El trasplante de páncreas realizado junto al trasplante de riñón (TRP) es la modalidad más frecuente de TP, representando el 75-80% de los trasplantes realizados en todo el mundo. El TP puede también realizarse de forma aislada: a) en pacientes con función renal normal, pero con una diabetes lábil con requerimiento de repetidos ingresos hospitalarios por descompensación metabólica y/o episodios hipoglucémicos severos que se acompañan de pérdida de conciencia (Trasplante de Páncreas Aislado: TPA); o b) en pacientes que previamente han recibido un trasplante de riñón (Trasplante de Páncreas después de riñón: TPDR). Esta última opción, se considera fundamentalmente indicada en aquellos pacientes que tienen la oportunidad de trasplantarse de un riñón procedente de donante vivo. Aunque la realización de un trasplante de ambos órganos en dos tiempos tiene sus inconvenientes, ya que el paciente deberá de ser sometido a dos cirugías y la supervivencia del injerto pancreático es algo inferior (por mayor dificultad en el diagnóstico de RA), el hecho de poder trasplantarse con un riñón procedente de un donante vivo, ofrece la oportunidad de evitar el tratamiento sustitutivo con diálisis, una mejor supervivencia del paciente, y optar al mismo tiempo a los beneficios que le puede ofrecer un posterior TP [9] [10] [11].
Opciones quirúrgicas
En el TRP, los dos órganos se implantan a la vez de un mismo donante. El páncreas se implanta habitualmente antes que el riñón, dada su peor tolerancia a la isquemia, en el lado derecho del abdomen por motivos vasculares. La técnica quirúrgica utilizada para el implante del injerto renal no va a diferir de la utilizada en el trasplante de riñón aislado, aunque es conveniente el implante en la fosa iliaca izquierda para permitir el trasplante del injerto pancreático en el flanco derecho. El TP se realiza con el órgano completo, incluyendo la segunda porción del duodeno que contiene la ampolla de Vater para permitir el drenaje exocrino.
El drenaje venoso usado mayoritariamente es el sistémico [9] con anastomosis arterial y venosa a una de las ramas de la arteria y vena ilíacas respectivamente. Algunos grupos proponen utilizar el drenaje venoso portal, por el hipotético beneficio de mantener un nivel de insulina más fisiológico y evitar de esta manera la hiperinsulinemia atribuida a la derivación sistémica. No obstante, técnicamente es más complejo y sus potenciales ventajas metabólicas siguen siendo motivo de controversia.
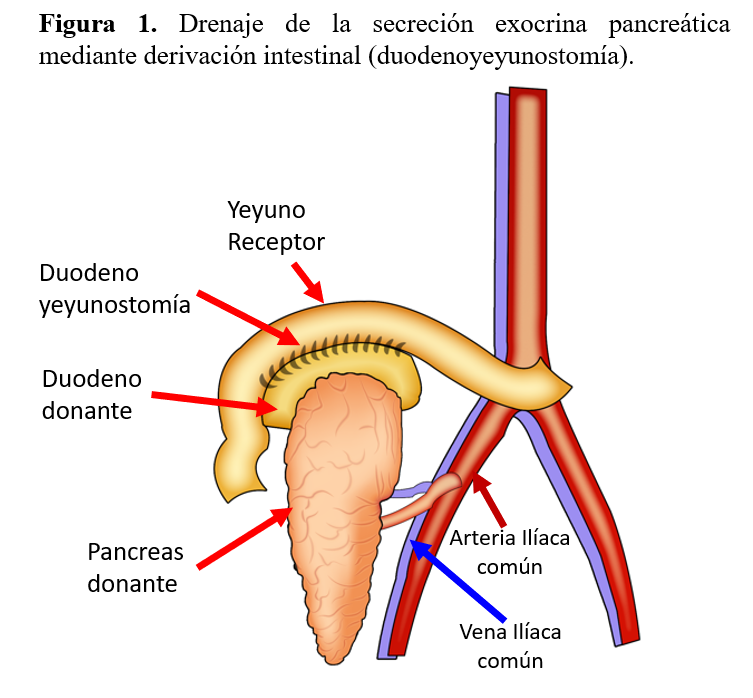
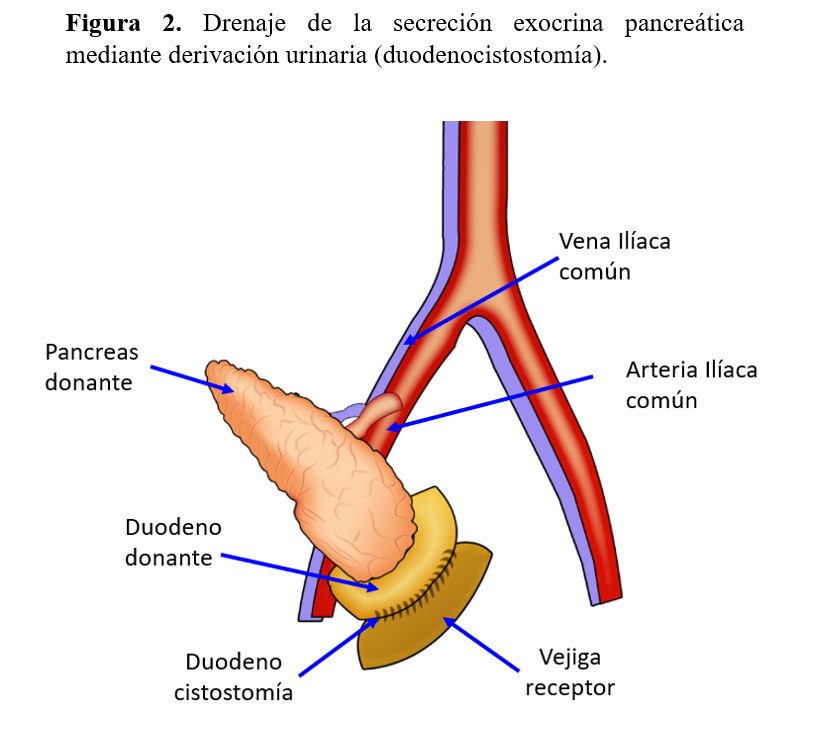
El drenaje de la secreción exocrina se realiza generalmente a vía intestinal (Figura 1). El drenaje entérico (duodeno-yeyunostomía o duodeno-duedenostomia) con o sin Y de Roux, es hoy en día la técnica de elección [9] [12]. El drenaje urinario, o duodenocistostomía (Figura 2), contribuyó extraordinariamente a consolidar el TP, ya que permite monitorizar el rechazo mediante la determinación de enzimas pancreáticas en orina. No obstante, la elevada incidencia de complicaciones asociadas a la misma, tales como cistitis, uretritis, infecciones urinarias de repetición, pancreatitis por reflujo, así como acidosis metabólica, obligan a la reconversión a drenaje entérico en muchos casos, por lo que actualmente es poco utilizado.
Indicaciones
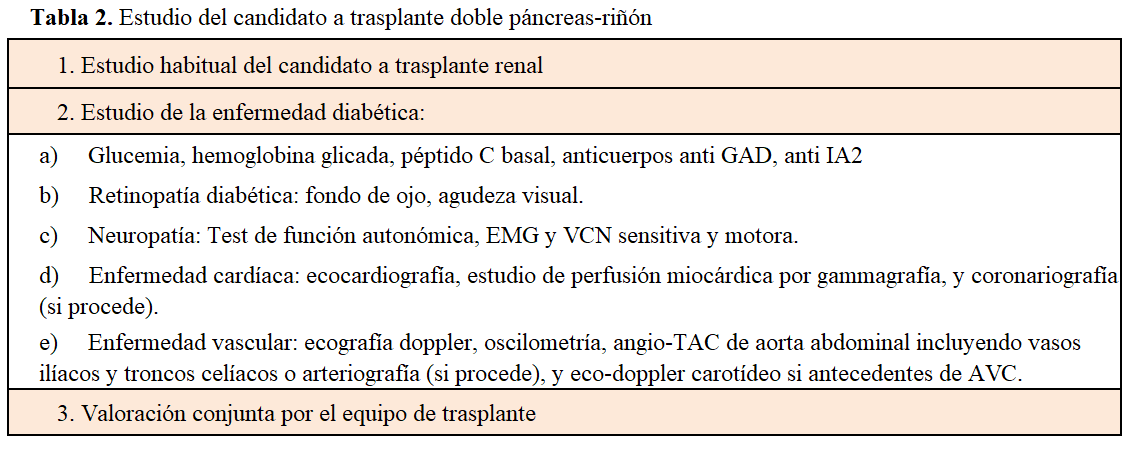
Las indicaciones para el TP (Tabla 1) incluyen fundamentalmente a pacientes afectos de una DM que a consecuencia de su enfermedad han desarrollado una ERCA. Otros parámetros a valorar serán: la edad, tipo de DM y estado de las complicaciones diabéticas [13] [14].
Edad
Aun cuando es difícil establecer un límite de edad [15], es habitual aceptar candidatos hasta los 55 años. Se considera que son los que más se podrán beneficiar, y con un menor riesgo, si bien suelen valorarse de forma individualizada aquellos con edades superiores [16].
Tipo de DM
El TP está indicado fundamentalmente en la DM tipo 1. No obstante, se ha observado que algunos pacientes con una DM tipo 2 (edad <55 años, índice de masa corporal < 30, necesidad de tratamiento con insulina, y niveles bajos de péptido C) podrían también beneficiarse de este tratamiento. Sólo representan el 8% del total de los trasplantes de páncreas realizados en los últimos años [9] y, aunque los resultados a corto plazo parecen satisfactorios y superponibles a los obtenidos en la DM tipo 1, a más largo plazo parecen algo inferiores, lo que hace imprescindible una mayor experiencia para valorar en un futuro los beneficios que el trasplante puede aportar a este colectivo [17]. También está indicado el TP en otros tipos de diabetes como en la diabetes tipo MODY [18].
Estado de las complicaciones diabéticas
La presencia y severidad de estas complicaciones, es otro de los parámetros a valorar antes de establecer la indicación del trasplante. La existencia de una vasculopatía severa es la que más puede condicionar la decisión [19]. Otras complicaciones secundarias a la diabetes, como la retinopatía y la neuropatía, acostumbran a estar siempre presentes, y se aconseja sean valoradas en el conjunto del paciente, aunque raramente representan por sí solas, una contraindicación. En todo caso y antes de establecer la indicación para TRP, se deberá de realizar un estudio completo de los posibles candidatos.
Las indicaciones para el TPDR, serían las mismas que para el TRP en cuanto a edad, tipo de DM y estado vascular, pero en éste caso, el receptor deberá tener una buena función renal. Los pacientes diagnosticados de una nefropatía crónica, con proteinuria y tasa de filtración glomerular baja (inferior a 40 ml/min) no serían considerados buenos candidatos al trasplante, aconsejando en todo caso la realización de una biopsia renal antes de establecer la indicación.
Evaluación de los candidatos
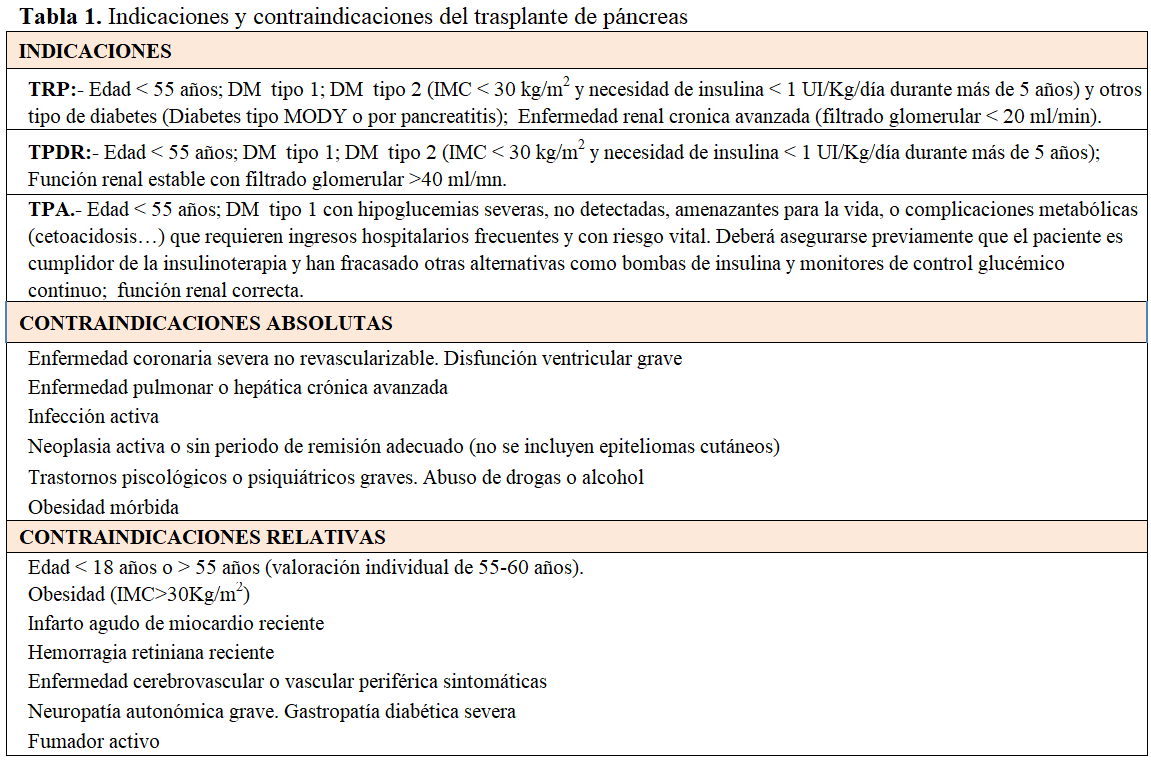
El estudio de los posibles receptores se realiza para determinar el riesgo operatorio, establecer la ausencia de algún criterio de exclusión y documentar el estado de las complicaciones diabéticas (Tabla 2).
Es bien conocida la implicación que la existencia de una cardiopatía isquémica puede tener en la mortalidad del paciente, tanto durante la cirugía como en el periodo postrasplante, por lo que se aconseja sea rigurosamente evaluada. Para ello, se suele realizar una prueba de esfuerzo con imagen, y si resultara patológica, una coronariografía [13].
Otros aspectos a valorar será el estado de los vasos sanguíneos donde van a realizarse las anastomosis vasculares de los injertos. Debe realizarse un angio TC para valorar los vasos ilíacos y el tronco celíaco; y un doppler de extremidades inferiores, fundamentalmente, si el paciente padece de claudicación intermitente. En paciente con antecedentes de accidente vascular cerebral, debe indicarse un doppler de troncos supraaórticos.
Si bien en ocasiones, las contraindicaciones para el TRP o TR aislado, pueden ser las mismas desde el punto de vista de la enfermedad cardiovascular, la implantación de dos órganos requiere de una cirugía mayor; un tiempo de anestesia más prolongado; y una mayor probabilidad de presentar algún tipo de complicación o reintervención quirúrgica. Por otra parte, la presencia de calcificaciones severas en los vasos iliacos, donde habitualmente se realizan las anastomosis vasculares, puede hacer desaconsejable la implantación de los dos órganos. En estos casos, se dará prioridad al TR.
Tratamiento inmunosupresor
El tratamiento inmunosupresor en el TP ha evolucionado al igual que en otros órganos trasplantados, y el objetivo es disminuir el riesgo de rechazo y minimizar los efectos secundarios de los inmunosupresores a largo plazo. Hay que tener en cuenta que el páncreas es un órgano más inmunógeno que otros, y por ello la terapia inmunosupresora debe ser intensa sobre todo en el periodo inicial postrasplante. La inmunosupresión es similar en los tres tipos de TP, aunque el TPA y el TPDR se consideran de mayor riesgo inmunológico por la dificultad de diagnóstico del rechazo y por lo tanto precisarán niveles de inmunosupresión más altos durante un periodo más prolongado.
Tratamiento de inducción
La utilización de tratamiento de inducción en TP ha ido incrementándose progresivamente, y en la actualidad más del 90 % de los pacientes lo reciben, siendo los fármacos de elección (aproximadamente en el 80 % de los casos) los sueros antilinfocitarios (Timoglobulina®/ATG-Fresenius®). En menor proporción se utilizan anticuerpos monoclonales bloqueadores del receptor de la IL-2 (Basiliximab) [9] [20]. En un 10% de los casos, se ha usado también Alentuzumab (Campath®) anticuerpo monoclonal anti CD-52, generalmente en dosis única de 30 mg. Se ha empleado sobre todo en protocolos con cursos cortos o sin esteroides [21]. No hay una evidencia potente en la literatura que apoye el uso de inducción en TP o grandes diferencias en los resultados con uno u otro agente inmunosupresor en la inducción, sin embargo, la valoración riesgo/beneficio y los buenos resultados obtenidos, con mejoría de la supervivencia de injertos y disminución de los episodios de RA han hecho que su uso hoy día sea prácticamente generalizado [9] [20] [22] [23].
Terapia de mantenimiento
A lo largo de los años se han utilizado una amplia variedad de protocolos de mantenimiento, pero la asociación actualmente más utilizada es tacrolimus con micofenolato mofetil/ácido micofenólico y esteroides. Según los datos del Registro Internacional de Trasplante de Páncreas (IPTR), esta fue la terapia utilizada en los últimos 5 años en más del 80% de los TP [9]. Existe también una tendencia creciente a utilizar protocolos de mantenimiento con un anti mTOR (sirolimus/everolimus) asociado generalmente a tacrolimus con buenos resultados [24]. Con el fin de evitar los efectos secundarios de los esteroides, se retiran en un porcentaje elevado de los TP, hasta en un 40% de los casos según los datos del registro americano (Organ Procurement and Transplantation Network/Scientific Renal Transplant Registry (OPTN/SRTR), y con buenos resultados a corto plazo [20]. Sin embargo la mayoría de los estudios son no aleatorizados, con escaso número de pacientes y de bajo riesgo inmunológico, por lo que el grado de evidencia es limitado [25].
Tratamiento profiláctico
Profilaxis antimicrobiana
La infección sigue siendo una de las principales causas de morbimortalidad después del TP. Por eso es especialmente importante la profilaxis en estos pacientes [26]. En el momento del trasplante y durante un periodo variable, se recomiendan diversas profilaxis:
Antibacteriana: antibióticos de amplio espectro para cubrir gram negativos, gram positivos y anaerobios. Se emplean de 3 a 5 días y varias asociaciones son posibles, generalmente cefalosporina + ampicilina o vancomicina.
Antifúngica: debido a la sutura intestinal. Suele emplearse fluconazol que se mantiene entre 4 a 8 semanas después del trasplante. Se está utilizando también micafungina como profilaxis, a dosis de 50 mg/día durante 14 días. Evita el problema de interacción con tacrolimus, aunque la experiencia es aun limitada.
Antivírica: Profilaxis anti citomegalovirus (CMV). La mayor parte de los pacientes reciben tratamiento de inducción con sueros deplectores de linfocitos que aumentan el riesgo de infecciones, sobre todo virales. Se recomienda profilaxis universal (excepto los casos de donante y receptor con serología negativa para CMV) con valganciclovir durante 3–6 meses. Una vez finalizada la profilaxis, es importante vigilar la carga viral en sangre, (mediante la determinación de la PCR cuantitativa o la antigenemia pp65) que deberían hacerse frecuentemente, en cada visita de seguimiento durante el primer año postrasplante [27].
Anti Pneumocistis carinii: con trimetropin-sulfametoxazol durante 6 meses, como en el TR.
Profilaxis antitrombótica
La alta incidencia de trombosis del injerto pancreático aconseja su uso. Generalmente se realiza con heparina de bajo peso molecular y/o AAS. Son factores de riesgo para trombosis el tipo de trasplante, con mayor riesgo en el TPA o TPDR, la isquemia fría del páncreas (principalmente si es superior a 12-14 horas) o cuando existen signos de pancreatitis del injerto [28].
Complicaciones
La incidencia de complicaciones en el TRP es más elevada que en el TR aislado. Ello es debido fundamentalmente a complicaciones relacionadas con la cirugía del páncreas (hasta un 30% de los pacientes es sometido a una reintervención quirúrgica, con impacto negativo en la supervivencia de los órganos y del paciente) [29]; así como a una mayor incidencia de rechazo agudo, e infecciones que el TR aislado.
Trombosis
La trombosis representa una de las causas más frecuentes de pérdida precoz del páncreas [9]. Acostumbra a ser una trombosis venosa y a presentarse en los primeros días de evolución del trasplante. Las causas que la producen no son bien conocidas, pero se han implicado: errores técnicos en la realización de las anastomosis vasculares, lesiones microvasculares producidas durante el periodo de extracción y preservación del injerto, así como a alteraciones hemodinámicas que reduzcan el flujo intrínseco del órgano, ya de por sí bajo. También se ha asociado a factores relacionados con el donante como la edad y la causa del fallecimiento, o un periodo de isquemia prolongado [28] [30] [31].
Fístulas pancreáticas
Su incidencia ha disminuido de forma considerable en los últimos años, y actualmente pocos injertos se pierden por esta causa [9]. Se atribuyen a isquemia o fallos técnicos, y se presentan habitualmente a nivel de la línea anastomótica del segmento duodenal, aunque también pueden estar causadas por infecciones o rechazo agudo y pueden presentarse a cualquier nivel del duodeno o del propio injerto [31].
Pancreatitis
Las pancreatitis del injerto pueden ocurrir en el postoperatorio inmediato, ya sea como resultado del daño sufrido por el páncreas durante el periodo de preservación o isquemia fría, o por la manipulación del órgano durante la cirugía [31]. No obstante, generalmente son autolimitadas y no acostumbran a tener una repercusión sobre el funcionalismo del órgano. Las pancreatitis más tardías suelen ser secundarias a un rechazo agudo, o bien a infecciones (CMV). Pueden también atribuirse a reflujo de la orina a través del conducto pancreático, en los pacientes con derivación vesical de la secreción exocrina. Como consecuencia de la pancreatitis del injerto pueden producirse: fístulas, colecciones peripancreáticas o abscesos y pseudoquistes pancreáticos.
Rechazo agudo
El RA puede presentarse de forma aislada o bien al mismo tiempo que el rechazo del injerto renal trasplantado de forma simultánea. Su incidencia oscila entre el 10-30% según las series [8] [20] [22], aunque establecer el diagnóstico no siempre es una tarea fácil, ya que no se dispone de marcadores con la suficiente especificidad y sensibilidad, que nos permitan predecir su existencia [32] [33]. La hiperglicemia es considerada como una manifestación tardía. Es por tanto imprescindible realizar el diagnóstico de RA e instaurar el tratamiento oportuno, antes de su aparición. Las amilasas y lipasas séricas, aunque se elevan en la mayoría de los episodios de RA se consideran unos marcadores poco específicos [4]. Recientemente se ha descrito el ADN libre circulante del donante (dd-cfDNA de la sigla en ingles) como un nuevo biomarcador con elevado valor predictivo negativo para rechazo del injerto pancreático. Es decir, si el valor del dd-cfDNA es bajo, se puede predecir con confianza la ausencia de rechazo del injerto [34]. La ecografía doppler-color puede ser de gran utilidad para control y seguimiento del injerto pancreático. No obstante, los cambios observados en el RA no son tampoco lo suficientemente específicos como para establecer su confirmación. La realización de una biopsia renal ha sido durante años una práctica habitual, al considerar que el rechazo afectaba generalmente ambos injertos. No obstante, el rechazo puede aparecer de forma aislada en el páncreas, por lo que la biopsia del páncreas es considerada en la actualidad como el único método diagnóstico realmente fiable para determinar la existencia de rechazo [32] [33] [35]. Es el único procedimiento que ofrece la posibilidad de obtener información relevante sobre el grado, la severidad, y el pronóstico del mismo; así como la opción de establecer el tratamiento terapéutico oportuno. Puede realizarse por cirugía laparoscópica, o por vía percutánea bajo control ecográfico. La histología se valora por una escala (Banff Grading Schema), dependiendo del grado de inflamación y de otros hallazgos histológicos como la eosinofilia, la inflamación acinar, la inflamación ductal, la endotelitis, la arteritis necrotizante, o la presencia de C4d en los capilares interacinares [36] [37].
Infecciones
Las infecciones son frecuentes en este grupo de trasplantados, y desempeñan un papel importante en la supervivencia del paciente y del injerto. Los esquemas de profilaxis actuales instaurados a partir del momento de la intervención, han logrado reducir su incidencia a corto plazo [26] [27] [31]. Sin embargo, sigue haciéndose necesaria la monitorización de las mismas, a más largo plazo, para optimizar el manejo y tratamiento de estos pacientes.
Supervivencia del injerto pancreático y renal
La definición de pérdida del injerto pancreático no es tarea fácil. El Comité de Trasplante de Páncreas de la OPTN/SRTR ha trabajado en ello y establecido en 2018 nuevos criterios, definiéndola como necesidad de insulina igual o mayor a 0,5 Un/kg/día durante 90 días consecutivos [38]. También en 2018 se publicó un documento de consenso de las asociaciones internacional y europea de trasplante de páncreas e islotes (IPITA/EPITA) que define 4 situaciones de resultados funcionales, considerando no funcionante cuando se requiere una dosis de insulina similar a la que se requería pretrasplante con producción de péptido C < de 0,5 ng/mL [39]. Por esta dificultad de definición, la forma de reportarlo no sigue criterios uniformes.
Pero aun teniendo en cuenta esta limitación, la supervivencia de injerto pancreático ha mejorado significativamente a lo largo del tiempo en las 3 categorías de TP. Según los últimos datos del registro americano, la supervivencia al año es 93%, 93% y 90%, y a los 5 años 73%, 65% y 53% en TRP, TPDR y TPA respectivamente. La supervivencia global del injerto pancreático al año y a los 5 años, en el grupo español (estudio EFISPAN) en período 2008-2012, se situó en un 88% y 83% , respectivamente [2] [3] [4] [5] [6] [7] [8] [9] [10] [11] [16] [20]. La causa más frecuente de pérdida del injerto pancreático en el período precoz postrasplante (3 primeros meses) es el fallo técnico, que se ha reducido hasta alcanzar un 8-9% [9], fundamentalmente trombosis vascular. A largo plazo (más de un año), las dos causas más frecuentes de pérdida de injerto pancreático son rechazo crónico (18% en TRP, 14% en TPDR y 36% en TPA) y muerte con injerto funcionante (38 % en TRP, 18 % en TPDR y 13% en TPA) [2].
La supervivencia de injerto renal en TRP también ha experimentado una mejoría progresiva a lo largo del tiempo, siendo en la actualidad y de nuevo según datos del registro americano de 95% y 80% a 1 y 5 años respectivamente y según el grupo español (estudio EFISPAN) del 91% a los 5 años [8]. Estos buenos resultados de supervivencia a largo plazo de los injertos renales en TRP se deben en parte a los criterios tan selectivos de los donantes.
Supervivencia del paciente
La supervivencia de los pacientes que reciben un TP ha mejorado a lo largo del tiempo, y supera en la actualidad el 95 % al año en las 3 categorías de TP [2] [20]. En un análisis con los datos del IPTR que divide los pacientes en dos épocas (2002-06 y 2007-11), la supervivencia de pacientes a los 3 años ha pasado de 91.5 a 93.2% en TRP, de 90.6 a 93.6% en TPDR y de 92.0 a 94.7 % en TPA [2]. A los 5 años del trasplante la supervivencia del paciente alcanza actualmente el 87% en TRP, 83% en TPDR y 89% en TPA, y a los 10 años más del 70 % de los pacientes trasplantados viven aún, siendo la mejor supervivencia la de los pacientes que reciben un TPA [2] . La supervivencia del paciente a los 5 años en el grupo español es del 94% Las causas más frecuentes de mortalidad en TP son cardiovascular/cerebrovascular e infecciones seguidas de neoplasias [2] [3] [4] [5] [6] [7] [8] [9].
Comentario final
En suma, el TP representa la mejor opción de tratamiento para el paciente con DM insulin-dependiente y ERCA. Es un procedimiento complejo y que aporta múltiples riesgos, pero cuando es realizado por un equipo con experiencia mejora la supervivencia del paciente, y disminuye la progresión de las complicaciones macro- y micro-vasculares asociadas a la diabetes mellitus [40].