Infecciones en el Trasplante Renal
Palabras clave
Trasplante renal Infecciones bacterianas, Clostridium, tuberculosis, infecciones fúngicas, infecciones virales, citomegalovirus, Epstein-Barr, varicela zoster, herpes simple, virus BK, virus influenza, virus respiratorio sincitial
INTRODUCCIÓN
El éxito del trasplante se basa en la necesidad crónica de un tratamiento inmunosupresor que previene el rechazo del órgano pero que aumenta el riesgo de complicaciones como la enfermedad cardiovascular, las infecciones y las neoplasias.
La era moderna de la inmunosupresión en el trasplante comenzó en los años ochenta del pasado siglo con la aparición de la ciclosporina, a la que siguieron otros inmunosupresores que mejoraron los resultados del trasplante convirtiendo esta terapia en un tratamiento rutinario para los pacientes.
De forma paralela, a medida que se mejoraba en los tratamientos inmunosupresores se asistía a un incremento de las complicaciones infecciosas. Hoy en día, a pesar de las estrategias de prevención, las infecciones continúan siendo una importante causa de morbilidad y mortalidad en los pacientes que reciben un trasplante renal [1].
En este capítulo revisaremos los factores de riesgo de infección, así como las infecciones más comunes que ocurren en el periodo postrasplante.
Factores de riesgo
El riesgo de infección de un paciente viene determinado por la interacción de dos factores:
1.- La exposición epidemiológica antes del trasplante, reflejado por la colonización o la presencia de infecciones latentes que puedan reactivarse tras el mismo.
2.- El estado neto de inmunosupresión, que incluye no sólo el tratamiento inmunosupresor recibido sino también otras situaciones médicas o iatrogénicas que incrementan el riesgo de infección [2].
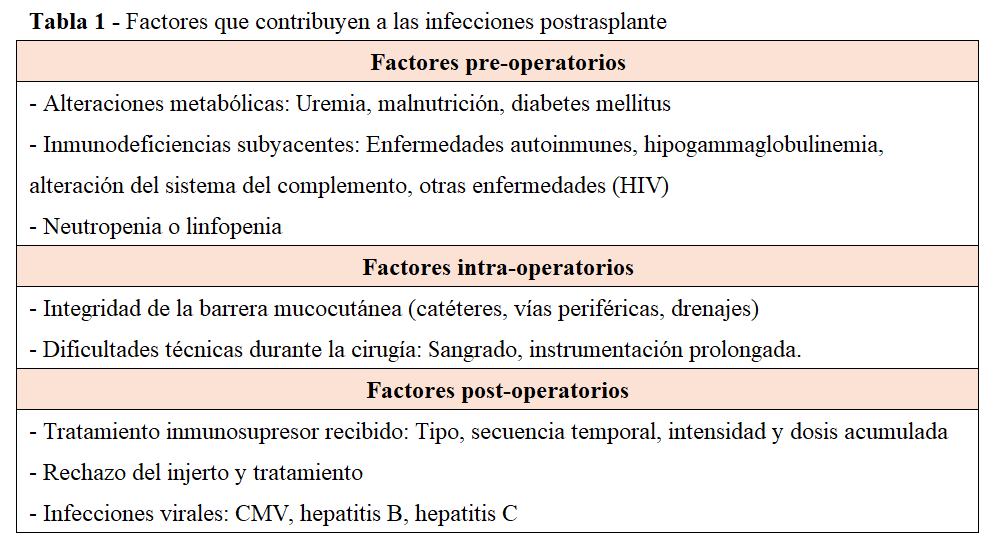
Los factores predisponentes para la infección se muestran en la (Tabla 1) [3].
Cronología de las infecciones postrasplante
Las infecciones en los pacientes trasplantados siguen un esquema de presentación de acuerdo con el momento después del trasplante (Figura 1). Las infecciones precoces (dentro del primer mes postrasplante) son fundamentalmente debidas a patógenos nosocomiales, problemas quirúrgicos y en ocasiones derivadas del donante. Las infecciones por gérmenes oportunistas ocurren más tardíamente, entre el primer y el sexto mes postrasplante, coincidiendo con el periodo de máxima inmunosupresión. Por último, las infecciones tardías (a partir del 6º mes) pueden ser secundarias a microorganismos comunitarios u oportunistas en función del grado de inmunosupresión del receptor [4].
Este modelo temporal nos puede servir de ayuda inicialmente, pero debemos conocer el tipo de inmunosupresión recibida, así como el tipo y duración del tratamiento profiláctico, ya que ambas características pueden alterar de forma significativa la aparición de las infecciones.
INFECCIONES BACTERIANAS
Infecciones del tracto urinario
Son las infecciones más frecuentes en los pacientes que reciben un trasplante renal. Su presentación clínica es variable desde pacientes asintomáticos hasta cuadros clínicos graves [3] [5] [6] [7] [8].
La bacteriuria asintomática es un proceso común después del trasplante renal y en algunas series se presenta hasta en el 51 % de los pacientes en los primeros 3 años postrasplante. En los últimos años varios estudios clínicos prospectivos y randomizados han demostrado que el screening sistemático y el tratamiento antibiótico de las bacteriurias asintomáticas que se presentan más allá del 2º mes postrasplante (o tras la retirada del catéter doble jota) no aportan ningún beneficio al paciente y no se recomienda su tratamiento.
Las infecciones urinarias sintomáticas pueden localizarse en el tracto urinario inferior presentando los síntomas típicos de cistitis aguda como disuria, polaquiuria, dolor suprapúbico e incluso hematuria. En otros casos la infección afecta al tracto urinario superior en forma de pielonefritis del injerto, el cual es un cuadro que presenta mayor gravedad. Estos pacientes suelen presentar fiebre, escalofríos, dolor en la localización del injerto renal y hematuria. En el caso de pacientes varones la infección puede afectar también a la próstata, en forma de prostatitis bacteriana aguda o crónica. Los episodios agudos se caracterizan por fiebre, escalofríos, disuria y una próstata voluminosa e hipersensible. Los episodios crónicos de prostatitis deben considerarse en los pacientes con bacteriuria recurrente y se caracterizan porque los síntomas remiten entre episodios y la próstata parece normal a la palpación. Algunos pacientes pueden presentar síntomas de obstrucción o dolor perineal.
La mayoría de los episodios de infección urinaria en los pacientes trasplantados están causados por bacilos gramnegativos al igual que en la población general.
Escherichia coli es el agente patógeno más frecuente. Pseudomonas aeruginosa debe tenerse en cuenta también en estos pacientes y especialmente en los casos de pielonefritis del injerto. Entre las bacterias grampositivas Enterococcus spp. es el principal patógeno causante de infección urinaria, especialmente a partir de la sexta semana post-trasplante.
Debe sospecharse la posibilidad de infección por Corynebacterium urealyticum en pacientes que presenten síntomas crónicos de infección urinaria con cultivos negativos, uropatía obstructiva, cálculos de estruvita, o piuria con o sin hematuria microscópica sin otra causa desencadenante.
En el tratamiento empírico de la infección urinaria del paciente trasplantado deben incluirse antibióticos con actividad frente a microorganismos gramnegativos, teniendo en cuenta los patrones de susceptibilidad antimicrobiana de cada centro.
Las pautas de tratamiento dependerán de la gravedad del paciente. En pacientes sin criterios clínicos de sepsis puede emplearse fosfomicina 500 mg/8 horas, trimetropim-sulfametoxazol 160/800 mg/12 horas (en pacientes que no lo estaban recibiendo en profilaxis), ciprofloxacino 500 mg/12 hs, norfloxacino 400 mg/12 hs, amoxicilina/clavulánico por vía oral (875/125 mg/12 horas o 1000/125 mg/12 horas de la formulación de liberación sostenida) o por vía intravenosa (1-2 gr/8 horas).
En los pacientes que presenten criterios clínicos de sepsis, previamente se hayan empleado antimicrobianos, haya una colonización previa o sospecha de pielonefritis deben incluirse antimicrobianos activos frente a enterobacterias productoras de beta-lactamasas de espectro extendido, P. aeruginosa y Enterococcus spp.
No existen recomendaciones generales sobre la duración del tratamiento antibiótico. En general se recomiendan pautas de tratamiento de 10-14 días en función de la respuesta clínica en los casos que se presenten con criterios clínicos de sepsis. En pacientes que presenten infecciones tardías del tracto urinario inferior sin criterios clínicos de sepsis pueden emplearse pautas más cortas de 5-7 días. Si la infección urinaria se presenta de forma precoz y está presente el catéter ureteral en la vía urinaria se aconseja su retirada lo antes posible para evitar recaídas.
Mención especial merecen, las infecciones urinarias por bacilos gram negativos multiresistenes como Pseudmonoas spp y Klebsiella spp, ya que antibióticos como meropenem-vaborbactam (MER-VAB) (ceftazidime-avibactam (CAZ_AVI), aztreonam avibactam, (AZT-AVI) ceftolozane-tazobactam (CEF-TAZ), imepenem-relebactam (IME-REL) y cefiderocol se presentan como una alternativa a la colistina y los aminoglucósidos. Sin embargo, es esencial, preservar estos nuevos agentes, solo para cuando sean realmente necesarios, ya que se han comunicado resistencias a los mismos.
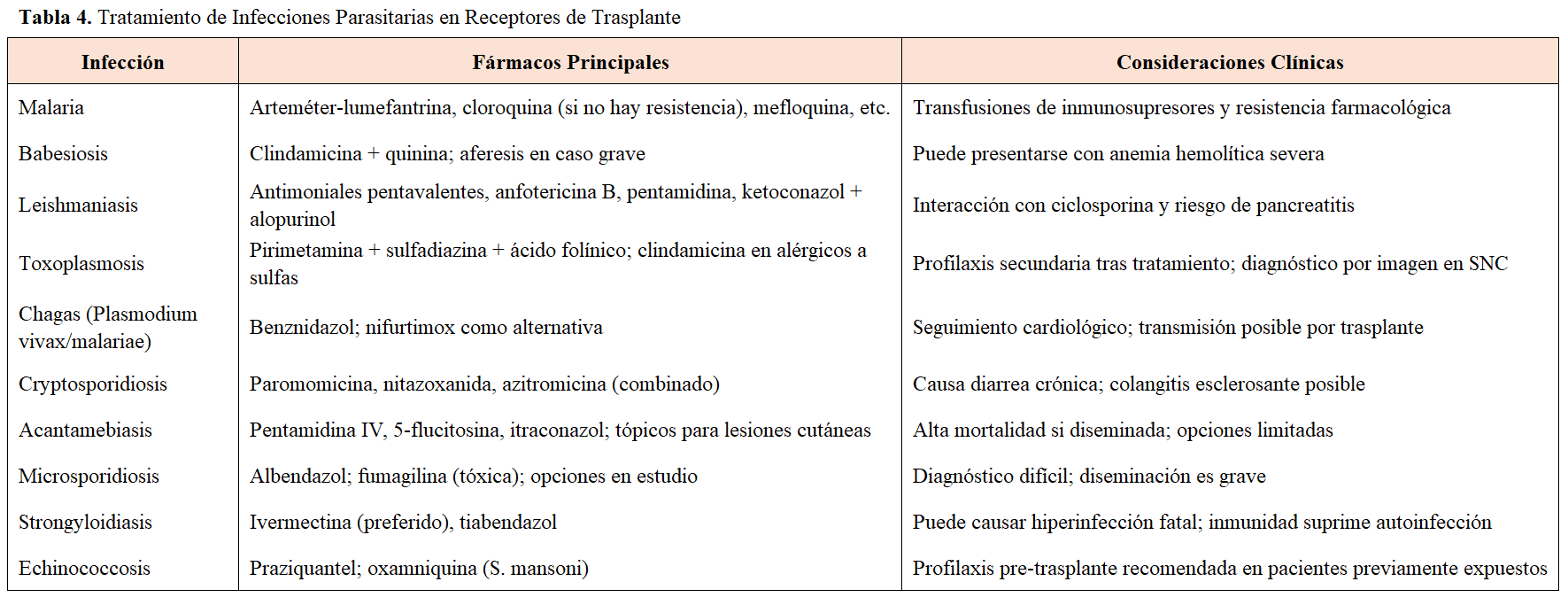
Al mismo tiempo se recomienda que estas infecciones por microorganismos multirresistentes sean consultadas con el infectólogo de referencia y los tratamientos se consensuen con un equipo multidisciplinar. Los tratamientos para estos microorganismos multirresistentes se resumen en la (Tabla 2) y (Tabla 3)
Las guías de la Sociedad Americana de Enfermedades Infecciosas [9] recomiendan para estos gérmenes multirresistentes, el tratamiento en el caso de las cistitis no complicadas con aminoglucósidos en dosis única y la administración de quinolonas, trimetoprim-sulfametoxazol y nitrofurantoina, en la medida de lo posible, mientras que, en el caso de las infecciones con foco urinario complicado o pielonefritis, se recomienda el tratamiento con los nuevos antibióticos [10].
La principal consecuencia de las infecciones urinarias es su alta tasa de recurrencia tras el tratamiento del primer episodio activo, que oscila entre el 4 y el 47% según los criterios diagnósticos empleados como episodios recurrentes. Se define como infección urinaria recurrente cuando el paciente presenta 3 o más episodios de ITU en 1 año o 2 o más episodios de ITU en 6 meses. La probabilidad de que un paciente desarrolle un 2º episodio de infección en 6 meses es del 25% y del 46% a los 12 meses [11]. En los últimos años se ha avanzado en el conocimiento de la fisiopatogenia de las infecciones urinarias recurrentes, la cual se puede explicar por 3 mecanismos [12] [13]:
1.- Inoculaciones por diferentes bacterias del tracto urinario inferior: Daría lugar a episodios de ITUs recurrentes por diferentes gérmenes patógenos y se considera como la visión histórica de la fisiopatogenia.
2.- Infecciones persistentes de cuerpos extraños alojados en la vía urinaria (stents, litiasis, drenajes) o de órganos (próstata, riñón, abscesos) que actúan como reservorios: Daría lugar a infecciones recurrentes por el mismo gérmen patógeno.
3.- Formación de comunidades bacterianas intracelulares que actúan como reservorios bacterianos intracelulares, protegidos y quiescentes, dentro de la mucosa de la vejiga: Daría lugar a infecciones recurrentes por el mismo germen patógeno en ausencia de cuerpos extraños o de órganos infectados. Se considera como la visión más reciente de la fisiopatogenia.
La capacidad de formar reservorios intracelulares se ha evidenciado en cepas de E.Coli y de Klebsiella Pneumoniae. Este mecanismo hace que las bacterias evadan la respuesta inmune innata del huésped, evitando la llegada de células inflamatorias, y escapen a la acción de los antibióticos.
La presencia de infecciones de orina recurrentes se ha asociado con:
- Aumento del riesgo de pérdida del injerto y de la mortalidad
- Peor función renal a largo plazo
- Mayor necesidad de ingresos hospitalarios e incremento de la estancia hospitalaria
- Aumento de los costes del trasplante
- Aparición de situaciones clínicas potencialemnte graves que aumentan la mortalidad como son la presencia de bacteriemia o de pielonefritis enfisematosa.
- Frustración y desesperación en el paciente y en el médico
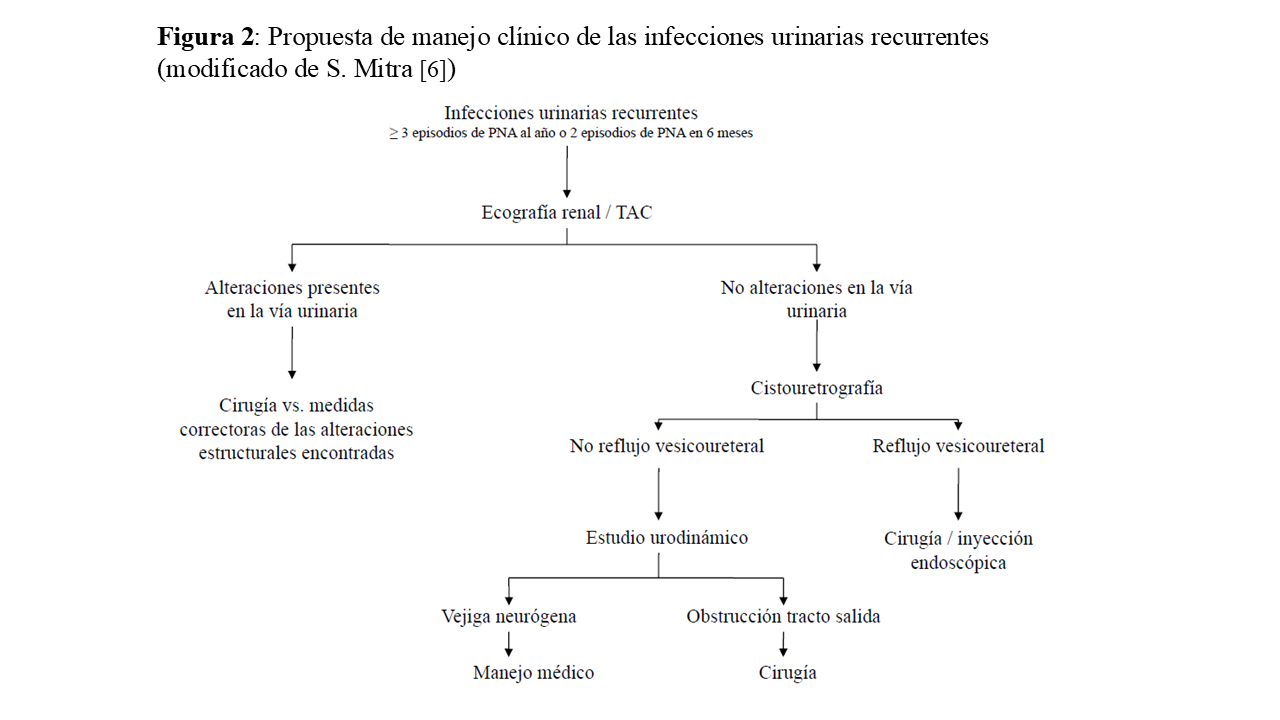
El manejo de estos episodios recurrentes debe incluir un algoritmo diagnóstico enfocado a identificar alteraciones funcionales o anatómicas del tracto urinario que sean subsidiarias de tratamiento quirúrgico o endoscópico (Figura 2), el tratamiento del episodio agudo de acuerdo con la epidemiología de las resistencias antibacterianas locales y el diseño de una estrategia de prevención de nuevos episodios de ITUs.
En la elección del tratamiento antibiótico empírico hay que tener en cuenta los siguientes factores:
- Mapa local de resistencias antimicrobianas
- Sensibilidad a los antibióticos en episodios previos de ITU
- Severidad de la infección
- Antibióticos previos usados
- Alergias del paciente
- Posibilidad de infección por cepas multiresistentes (BLEE, KPC, VIM, OXA-48) y las colonizaciones del paciente
Las estrategias de prevención de nuevos episodios de ITU no se han investigado de forma extensa en la población trasplantada y se suelen extrapolar las estrategias utilizadas en la población general. Estas medidas incluyen [14] [15]:
1.- Educación de medidas higiénicas y de conducta: Micciones frecuentes por el día: Cada 2-3 horas; Evitar aguantar la orina en la vejiga; Limpieza adecuada; Vaciar la vejiga tras las relaciones sexuales; Ingesta libre de agua para aumentar la frecuencia de las micciones.
2.- Profilaxis antibiótica: No existe consenso ni recomendaciones específicas en los pacientes trasplantados. En esta población existen pocos estudios y la mayoría de ellos ineficaces; sin embargo en población general hay más evidencia resultando una medida útil y eficaz en la prevención de las recurrencias por lo que en situaciones de recurrencias se puede probar en los pacientes trasplantados. En la elección de la pauta se debe tener en cuenta las resistencias previas. Se suele emplear: septrin 400/80 mg diario, cefuroxima 125 mg diario o fosfomicina 500 mg diario, de 3 a 6 meses, en función de la respuesta.
3.- Intervenciones no mediadas por antibióticos: Incluye medidas que aumentan la respuesta inmunológica (caso de las vacunas – Uromune: 2 puffs sublinguales diarios, 6 meses), medidas que inhiben la adherencia de las bacterias a las células del urotelio (arándano rojo americano: 1 cápsula cada 12 horas y D-manosa: 2 gramos al día) y medidas que evitan la colonización y replicación bacteriana acidificando la orina (L-metionina: 1500 mg al día, sólo para pacientes con FGe > 30 ml/min, ya que produce acidosis metabólica). Estas estrategias se han empleado en pacientes trasplantados consiguiendo reducir el número de episodios recurrentes.
Otras medidas empleadas en población general, como hipurato de metenamina, estrógenos vaginales o probióticos, no se han utilizado en población trasplantada y se desconoce su eficacia.
Infecciones por Clostridium difficile
Clostridium difficile es un bacilo gram-positivo, anaerobio, que se encuentra en el ambiente. En los receptores de trasplante la infección por este microorganismo aumenta la mortalidad del paciente, las complicaciones del injerto, la estancia hospitalaria y los costes sanitarios [16] [17] [18] [19] [20] [21] [22] [23].
La incidencia de infección por C. difficile en los pacientes trasplantados oscila entre el 0,5 % y el 16 % según las series estudiadas, presentándose habitualmente en los primeros 6 meses postrasplante, con una mayor incidencia entre el 6º y 10º día postrasplante.
Los factores de riesgo predisponentes de infección por C. Difficile son: uso de antibióticos de amplio espectro (especialmente cefalosporinas de primera y segunda generación), inmunosupresores, empleo de esteroides previamente al trasplante, profilaxis con ganciclovir, hipogammaglobulinemia, edad avanzada, diabetes mellitus, cirugía gastrointestinal, y uso de sonda nasogástrica.
Actualmente el diagnostico de infección por C. difficile puede establecerse practicando en primer lugar una prueba de detección de la enzima glutamato deshidrogenas mediante EIA (GHD). Dicha prueba identifica la presencia de C. difficile con un 95%de sensibilidad, pero no indica si la cepa es toxigenica. Si es positiva, se ha de confirmar que la cepa es toxigenica mediente una prueba de inmunocromatografia y /o PCR( detección de los genes de las toxinas).
Finalizado el tratamiento, se recomienda no repetir las pruebas para confirmar la curación, La colonización persiste en muchos pacientes a pesar de que la evolución sea favorable y las toxinas pueden detectarse en las heces hasta 6 semanas después del tratamiento y resolución de la diarrea [23].
Para el control de la infección por C. difficile la primera medida que debe considerarse es la interrupción del tratamiento antibiótico en los casos en los que sea posible. En los pacientes en los que no pueda suspenderse, se aconseja que reciban antibióticos de espectro reducido o con escasa asociación con el desarrollo de infección por C. difficile.
Fidaxomicina se ha posicionado como uno de los fármacos de primera línea para el tratamiento de la infección por C. difficile, presentando mejores resultados que vancomicina o metronidazol. De entre ellos cabe destacar un estudio post hoc en el que se comparó fidaxomicina con vancomicina en pacientes con tumores hematológicos o sólidos, donde fidaxomicina demostró proporcionar unas tasas de respuesta mantenida significativamente superiores (fidaxomicina 73,6 % vs. vancomicina 52,1 %, p=0,003). Además, también se ha visto que el uso de fidaxomicina en pacientes con insuficiencia renal crónica produce unas tasas de recurrencia inferiores a vancomicina, lo que le convierte en el tratamiento de elección en estos casos, si se encuentra disponible.
Recientemente, en un estudio de prevalencia de C. difficile llevado en Israel, se han observado resistencias a la fidaxomicina en el tratamiento de la infección por C. difficile [24]. Así mismo, anteriormente, se aconsejaba asociar al tratamiento antibiótico estándar, mencionado previamente, el tratamiento con Bezlotoxumab, en el primer episodio de infección por C. difficile en pacientes inmunodeprimidos (trasplante oncohematologicos y trasplante de órgano solido) para prevenir las futuras recaídas. Sin embargo, el año pasado el laboratorio dejo de comercializar el fármaco y no está disponible actualmente en ningún país europeo.
El tratamiento farmacológico de la infección por C. difficile en pacientes trasplantados puede realizarse según la siguiente pauta:
Primer episodio no grave (definido por la presencia de dolor abdominal leve o moderado, escasa diarrea y ausencia de síntomas sistémicos) Se podrá utilizar uno de los siguientes fármacos:
- Vancomicina oral (125 mg/6 horas) vía oral durante 10 días.
- Fidaxomicina (dosis 200 mg/12 horas vía oral) durante 10 días.
- Si no estuvieran disponibles ninguno de los agentes anteriores, se usará metronidazol 500 mg cada 8 horas, vía oral, durante 10 días
Primer episodio grave (definida por la leucocitosis < 15.000, creatinina < 1,5mg/L fiebre > 38,5 junto con diarrea abundante) se usará uno de los 2 agentes siguientes:
- Vancomicina oral (125 mg/6 horas) durante 10 días. Esta dosis puede incrementarse hasta 500 mg/6 horas en casos de infección grave asociada a complicaciones (megacolon tóxico, ileo paralítico o fallo multiorgánico), debiendo además considerarse la posibilidad de tratamiento quirúrgico.
- Fidaxomicina (dosis 200 mg/12 horas vía oral) durante 10 días.
En los casos en los que no es posible la vía oral y presentaran enfermedad grave se empleara:
- Vancomicina 500 mg cada 6 hora o fidaxomicina 200mg /12 h mediante sonda nasogástrica durante 10-14 días. Considerar la adicción de metronidazol 500mg /8 h iv o preferiblemente, tigeciclina [25].
Tratamiento de la primera recurrencia: si el primer episodio fue tratado con metronidazol o con fidaxomicina se recomienda tratar con vancomimicina 125 mg/6 horas durante 10-14 días.
Si, por el contrario, el tratamiento del primer episodio fue con vancomicina oral, se utilizará fidaxomicina (dosis 200 mg/12 horas vía oral) durante 5 días seguido de 200mg a días alternos, 20 días. Sino se dispone de fidaxomicina, se puede utilizar el tapering de vancomicina
Vancomicina cada 6 horas, de 10-14 días, a continuación
Vancomicina cada 12 horas, 7 días, a continuación
Vancomicina cada 24 horas, 7 días, a continuación
Vancomicina cada 2 o 3 días, de 2-8 semanas.
Para segundas recurrencias o posteriores se recomienda usar en dosis de tapering, vancomicina oral o fidaxomicina (dosis 200 mg /12 horas vía oral) o vancomicina 125mg mg/6 horas seguido de rifamiximina 400 mg 3 veces al día durante 20 días [15].
El trasplante de microbiota fecal, es una alternativa al tratamiento antibiótico en pacientes con múltiples recurrencias de infecciones por C. difficile, pero hay poca experiencia en pacientes con trasplante de órgano sólido, y su uso, aunque es controvertido, en algunos casos ha resultado eficaz.
Actualmente la FDA ha aprobado dos nuevos agentes terapéuticos, el RBX2660 (Rebyota) y el SER-109 (Vowst), Si están disponibles pueden emplearse en lugar del trasplante de la microbiota fecal [26] [27].
Tuberculosis
La tuberculosis (TBC) se presenta con mayor incidencia en los receptores de trasplante de órgano sólido que en la población general [28] [29] [30] [31] [32].
Los principales factores de riesgo de TBC en los pacientes trasplantados son la administración de OKT3 o anticuerpos antilinfocíticos, la intensificación de la inmunsosupresión por rechazo y el uso de tacrolimus y micofenolato mofetilo frente a ciclosporina y azatioprina. Los factores de riesgo presentes en la población general, como la desnutrición, el tabaquismo o la infección por el virus de la inmunodeficiencia humana, son también aplicables en los receptores de trasplante.
Evaluación del candidato a trasplante
El primer paso para la prevención del desarrollo de TBC en el paciente trasplantado es la evaluación en el momento en el que el paciente es candidato a trasplante. En estos pacientes resulta muy importante investigar la existencia de antecedentes de infección o enfermedad tuberculosa, así como si recibió tratamiento y si éste fue realizado correctamente.
Además, resulta imprescindible la realización de la prueba cutánea con PPD (purified protein derivative). Para interpretar esta prueba correctamente resulta necesario conocer si el candidato a trasplante ha recibido profilaxis frente a la infección tuberculosa latente (ITL) y si ha recibido vacunación con BCG (Bacilo de Calmette y Guérin).
En los pacientes con prueba cutánea con PPD positiva lo más importante es descartar la presencia de TBC activa. Para ello, en los pacientes sintomáticos o que presentan radiología compatible con TBC debe realizarse cultivo y PCR para micobacterias en sangre, esputo y orina. En los casos en los que no fuera posible la obtención de estas muestras estaría indicada la realización de broncoscopia con cultivo del broncoaspirado y del lavado broncoalveolar en los casos de pacientes sintomáticos o con radiología compatible.
En los pacientes con PPD negativo se aconseja su repetición en 7-10 días (efecto "booster"). Si la induración en inferior a 5 milímetros se considera negativa. Sin embargo, si la induración es igual o superior a 5 milímetros se considera positiva.
El valor de otras técnicas como la cuantificación de la liberación de interferón-gamma en respuesta a antígenos de M. Tuberculosis deberá ser establecido en estos pacientes.
Tratamiento de la infección tuberculosa latente
Las indicaciones de tratamiento de la ITL en los candidatos a trasplante o en pacientes trasplantados son las siguientes:
1. Prueba cutánea con PPD igual o superior a 5 milímetros.
2. Antecedente de TBC previa tratada de forma incorrecta.
3. Antecedentes de contacto con paciente con TBC activa.
4. Presencia de hallazgos en la radiografía de tórax compatibles con TBC pasada no tratada (adenopatías calcificadas, lesiones fibróticas apicales, nódulo solitario calcificado, engrosamiento pleural).
Además, se recomienda el tratamiento de la ITL en receptores de órganos procedentes de un donante que tenga historia o datos indicativos de TBC no tratada.
En cualquier caso, se recomienda que antes de iniciar el tratamiento de la ITL se descarte la existencia de TBC activa (cultivo y PCR para micobacterias en sangre, esputo y orina).
Los pacientes con antecedente de TBC tratada correctamente no requieren tratamiento de ITL.
En los casos en los que se encuentre indicado, el fármaco de elección para el tratamiento de la ITL es la isoniacida (INH) (300 mg/día) suplementada con vitamina B6 durante 9 meses. Este tratamiento debe iniciarse siempre que sea posible de forma previa a la realización del trasplante. Si no fuera posible finalizar dicho tratamiento antes del trasplante deberá completarse después de éste.
Además de la pauta habitual con INH, existen pautas alternativas como la rifampicina durante 4 meses, o la rifampicina con pirazinamida durante 3 meses o isoniazida más rifapentina una vez a la semana, durante 3 meses. Actualmente, se prefieren estas pautas de tratamiento más cortas siempre que sea posible. Hay más probabilidades de que los pacientes completen los tratamientos cuando tienen una menor duración.
Sin embargo, no hay que olvidar que las pautas que incluyen rifampicina se aconsejan únicamente para su administración antes del trasplante, debido a las interacciones medicamentosas de éste fármaco con la terapia inmunosupresora.
En los casos de toxicidad por INH se recomienda retirar dicho fármaco, y tratar de completar la profilaxis con otras pautas únicamente en pacientes de muy alto riesgo como son los conversores recientes de la prueba con PPD. En estos casos puede emplearse levofloxacino con etambutol durante al menos 6 meses.
Tratamiento de la tuberculosis
El tratamiento de la tuberculosis en los pacientes trasplantados presenta la dificultad de la interacción de las rifamicinas (rifampicina, rifabutina o rifapentina) con los inhibidores de la calcineurina. Las guías europeas para el tratamiento de la tuberculosis en el paciente trasplantado renal recomiendan una pauta similar a la de la población general con 2 meses de tratamiento con INH, rifampicina y pirazinamida seguidas por INH y rifampicina durante 4 meses más. Otros autores consideran iniciar el tratamiento con la combinación de INH, pirazinamida y etambutol, evitando así el empleo de rifampicina que podría incluirse en los casos de enfermedad diseminada o con riesgo de resistencia a INH.
Los fármacos inyectables (estreptomicina, amikacina, kanamicina o capreomicina) así como otros fármacos de segunda línea deben reservarse para los casos de multirresistencia o cuando exista alguna limitación para el empleo de los fármacos de primera línea.
Para el tratamiento de mantenimiento en los pacientes estables y sin afectación extrapulmonar se recomienda el empleo de INH y etambutol o pirazinamida durante 12-18 meses (en aquellas pautas que no incluyeron rifampicina en el tratamiento de inicio). Esta duración puede acortarse a 12 meses si se asocia un tercer fármaco como levofloxacino o pirazinamida.
En aquellos casos en los que no pueda utilizarse INH ni rifampicina deben emplearse pautas de inducción y mantenimiento que incluyan de 4 a 6 fármacos durante al menos 24 meses.
INFECCIONES FÚNGICAS
Infecciones fúngicas [33] [34] [35] [36] [37] [38] [39]
Infección por Pneumocystis jiroveci
Este microorganismo es causante de infecciones severas pulmonares en los pacientes trasplantados en los primeros 3 a 6 meses postrasplante. Sin embargo, actualmente con el uso de la profilaxis en los 6 primeros meses con trimetoprim-sulfametoxazol la incidencia de esta infección ha disminuido considerablemente.
La presentación clínica típica incluye fiebre, tos, disnea e hipoxemia. El diagnóstico se establece con la identificación del microorganismo en el esputo inducido, en el lavado broncoalveolar o en muestras de biopsia transbronquial. El tratamiento de elección consiste en la administración de trimetoprim (20 mg/Kg/día) más sulfametoxazol (100 mg/kg/d) dividido en 3 dosis durante 21 días. Como tratamiento alternativo puede emplearse pentamidina intravenosa (2-4 mg/kg/d), atovacuona (750 mg/12 horas) o la combinación de dapsona (100 mg/día) con trimetropim (20 mg/Kg/día dividido en tres dosis). En los casos en los que exista hipoxemia severa (p02 < 70 mmHg) se recomienda añadir esteroides al tratamiento antibiótico.
Dada la potencial agresividad del cuadro clínico se recomienda la profilaxis frente a este microorganismo en todos los pacientes trasplantados renales por un mínimo de 6 meses. Periodos más prolongados pueden indicarse en pacientes que requieren altas dosis de inmunosupresión. El agente profiláctico de primera elección es el trimetoprim-sulfametoxazol. En alérgicos puede usarse: dapsona, atovaquona o pentamidina inhalada. Si se va a usar dapsona, previamente hay determinar los niveles de glucosa-6 fosfato deshidrogenasa, para evitar los casos de hemólisis inducida por dapsona.
Otras infecciones fúngicas
Los pacientes trasplantados de riñón tienen las menores tasas de infección fúngica invasora de todos los trasplantes de órgano sólido. En estos pacientes las principales infecciones fúngicas que pueden presentarse son las producidas por Candida spp. y Aspergillus spp.
Entre las infecciones por Candida spp. destaca la candidemia y la candidiasis urinaria. Los principales factores de riesgo de candidemia son la presencia de catéteres venosos centrales, el empleo de antibioterapia de amplio espectro, la nutrición parenteral y la inmunosupresión. La especie de Candida spp. más frecuente es la C. albicans la cual es causante de la mayoría de episodios de candidemia, seguida de C. parapsilosis y C. glabrata. El fármaco de elección para el tratamiento de la candidemia es el fluconazol (400 mg/día, precedido de dosis inicial de 800 mg). En aquellos casos de colonización por C. glabrata, tratamiento previo con azoles o presencia de sepsis grave o shock séptico el tratamiento inicial de elección debe ser una equinocandina (caspofungina, anidulafungina o micafungina), las cuales presentan baja toxicidad y menores interacciones que los azoles.
Actualmente, se ha comercializado un nueva equinocanida, rezafungina, la cual ha demostrado la no inferioridad frente a caspofungina en candidemia y candidiasis invasora: Su principal ventaja, es que se puede administrar una dosis intravenosa semanal (400 o 200mg), lo cual permite el alta del paciente, de manera temprana [40].
La candiduria asintomática en el trasplantado renal, no suele requerir tratamiento, excepto en pacientes que presenten un stent ureteral, donde se recomienda la extracción del mismo y tratamiento antifúngico al menos 7 días con fluconazol si es sensible, aunque puede emplearse anfotericina B desoxicolato, si fuera resistente o una equinocandina.
La candiduria en el trasplante renal puede asociarse a infección de la vía urinaria superior o a obstrucción urinaria por la presencia de bolas fúngicas en la unión ureterovesical. Por ello en los pacientes con candiduria sintomatica el tratamiento que se recomienda es el empleo de fluconazol 200 mg/día durante dos semanas. En los casos de resistencia a fluconazol puede emplearse anfotericina B desoxicolato o flucitosina. En general no se recomienda la irrigación de la vejiga con anfotericina B salvo en casos de cistitis producidas por especies de Candida resistentes a fluconazol.
En los casos de pielonefritis debe emplearse fluconazol (200 mg-400 mg/día) durante dos semanas. En pacientes con infección por especies de Candida resistentes a fluconazol puede emplearse equinocandinas o anfotericina B liposomal. El tratamiento de las bolas fúngicas debe incluir la intervención quirúrgica además del tratamiento antifúngico.
La aspergilosis invasora (AI) constituye una de las principales infecciones fúngicas en los trasplantados de órgano sólido, aunque su frecuencia en el trasplante renal es inferior a la observada en otros tipos de trasplante como el pulmonar.
El periodo de máximo riesgo son los tres primeros meses postrasplante coincidiendo con el periodo de máxima inmunosupresión, aunque una vez transcurrido este periodo existe un riesgo elevado entre aquellos pacientes que requieren aumento del tratamiento inmunosupresor como consecuencia de rechazo crónico o disfunción del injerto y los que presentan fallo renal postrasplante.
El cuadro clínico más habitual es la aspergilosis pulmonar invasora, aunque puede existir también infección del sistema nervioso central y de los senos paranasales. Los síntomas clínicos de la aspergilosis pulmonar invasora son inespecíficos pudiendo presentarse tos, fiebre, dolor torácico y hemoptisis. Los signos radiológicos más frecuentes consisten en la presencia de nódulos o infiltrados cavitados siendo el signo del halo y de la media luna menos frecuentes que en el trasplante de progenitores hematopoyéticos (TPH). Para el diagnóstico definitivo de aspergilosis invasora probada se requiere o bien el aislamiento del hongo en un cultivo procedente de una localización estéril o bien la demostración histopatológica de hifas de Aspergillus spp. junto con la evidencia de daño tisular. Debido a la dificultad existente en muchos casos para la obtención de muestras mediante procedimientos invasivos, se han empleado métodos alternativos como la determinación sérica del antígeno de galactomanano, el cual presenta en estos pacientes menor sensibilidad y especificidad que en los pacientes sometidos a TPH. Esta sensibilidad y especificidad aumenta cuando este antígeno es determinado en muestras de lavado broncoalveolar. Al mismo tiempo se emplea para el diagnóstico el Beta-D-Glucano (BDG) que, aunque no es un marcador específico de infección fúngica, y también se encuentra en la pared celular de otros hongos patógenos como Cándida o Pneumocystis, no está presente en Mucorales, Cryptococcus y Blastomyces sp. y puede ayudar en el diagnóstico diferencial.
El tratamiento de elección de la aspergilosis invasora es el voriconazol. El tratamiento alternativo es el isavuconazol y la anfotericina B liposomal. El papel del tratamiento antifúngico combinado no está bien establecido en estos pacientes, aunque puede plantearse en casos de AI diseminada, mala respuesta clínica al tratamiento inicial o afectación del sistema nervioso central. En todos los casos hay que valorar la reducción de la inmunosupresión y monitorizar los niveles de fármacos inmunosupresores dado que la mayoría de antifúngicos empleados interaccionan con los inmunosupresores.
INFECCIONES VIRALES
Citomegalovirus
La infección y enfermedad por CMV sigue siendo una de las principales preocupaciones de los médicos dedicados al cuidado de los pacientes trasplantados. Es una complicación frecuente en los pacientes que reciben un trasplante renal. Suele aparecer en el primer año postrasplante y cuando aparece tiene consecuencias directas e indirectas sobre el paciente y el injerto tanto a corto como a largo plazo [41] [42] [43] [44] [45] [46] [47] [48] [49] [50].
En la era en la que las estrategias de prevención y monitorización viral no se usaban de forma generalizada la incidencia de infección y enfermedad por CMV eran elevadas (60 % infección y 30 % enfermedad) y tanto la combinación serológica frente al CMV entre el donante y el receptor como el uso de anticuerpos anti-linfocitarios se comportaban como importantes factores de riesgo de enfermedad por CMV. Esto sirvió para definir el riesgo de infección de los pacientes y clasificarlos en pacientes de alto, moderado o bajo riesgo de infección. Esta clasificación se sigue empleando actualmente para definir la estrategia de prevención.
Efectos clínicos y diagnósticos
Los efectos que tiene la activación del CMV en pacientes trasplantados se pueden clasificar en efectos directos e indirectos.
Los efectos directos son bien conocidos, se relacionan con altas tasas de replicación viral y se presentan en forma de infección o enfermedad por CMV. Se define infección al aislamiento del virus, la detección de proteínas virales (antigenemia) o la presencia de ADN/ARNm (viremia) del virus en cualquier líquido o tejido del organismo. También se conoce como replicación asintomática. La infección es primaria cuando el CMV se detecta en un individuo que previamente era CMV seronegativo. La infección es persistente cuando la detección del virus se mantiene de forma prolongada en el tiempo en pacientes que se encuentran asintomáticos y la infección es recurrente cuando se produce la detección del virus al menos cuatro semanas después de haberse controlado la primera infección.
La enfermedad por CMV se define cuando el paciente infectado presenta síntomas, bien en forma de síndrome viral o como afectación visceral. Se considera síndrome viral cuando existe fiebre > 38ºC, durante al menos 2 días en un periodo de 4 días, asociada a la presencia de leucopenia, trombocitopenia o elevación de transaminasas junto con la detección del virus en sangre. La afectación visceral por CMV se manifiesta por síntomas y signos en el órgano afectado. Las afectaciones viscerales más comunes son la neumonía, la enfermedad digestiva, la hepatitis, la encefalitis, la retinitis, la nefritis, la cistitis, la miocarditis y la pancreatitis. Para el diagnóstico de enfermedad se requiere la presencia de un cuadro clínico compatible junto con la presencia de lesiones histológicas en una biopsia y/o cultivo positivo para CMV.
Los efectos indirectos son más difíciles de reconocer y se deben a la interacción de bajas tasas de replicación viral con el sistema inmune. Se han asociado con un incremento de la morbilidad (infecciones oportunistas), pérdida del injerto y mortalidad a largo plazo.
No se ha establecido un umbral de carga viral de CMV determinado a partir del cual se diagnostica de enfermedad de órgano específico por lo que la ausencia de ADN viral en las muestras tiene un alto valor predictivo negativo. En este contexto, la dinámica de la carga viral en el tiempo resulta más relevante que un valor absoluto para el manejo clínico. Particularmente, el tiempo de duplicación del ADN viral podría servir como criterio más uniforme para iniciar la terapia anticipada, minimizando la variabilidad entre centros que utilizan distintas técnicas de cuantificación. Por último, se recomienda que la monitorización virológica durante la profilaxis universal se base en criterios clínicos y no se realice de forma sistemática.
Factores de riesgo
Estado serológico de donante y receptor
El trasplante de un órgano procedente de un donante seropositivo frente a CMV a un receptor seronegativo (D+/R-) constituye el principal factor de riesgo de enfermedad por CMV en el trasplante renal y en el resto de trasplantes de órgano sólido. En los receptores seronegativos que requieran la administración de hemoderivados se recomienda la utilización de filtros de leucocitos.
Carga viral
La enfermedad por CMV se ha asociado con el grado de replicación viral, de forma que a mayor replicación mayor probabilidad de desarrollo de enfermedad. Otros factores que influyen en la carga viral son la estrategia de profilaxis y el estado de inmunosupresión del receptor.
Tratamiento inmunosupresor
Los inmunosupresores empleados para disminuir el riesgo de rechazo disminuyen la respuesta inmune frente a CMV lo que favorece la replicación del virus latente. Entre estos inmunosupresores se encuentran la metilprednisolona, los agentes antilinfocitarios (inmunoglobulinas antilinfocitos y anti-timocito) y el mofetil micofenolato, el cual se ha asociado en trasplantados renales con mayor riesgo de enfermedad por CMV. Además el empleo de anticuerpos antilinfocíticos en inducción o para tratamiento del rechazo se ha asociado con un incremento de enfermedad por CMV.
El uso de inhibidores de mTOR, ya sea como inmunosupresión inicial (de novo) o tras conversión temprana desde otros inmunosupresores, ha demostrado reducir significativamente la incidencia de infección por citomegalovirus (CMV) tras el trasplante renal, especialmente en pacientes seropositivos (R+) con riesgo inmunológico bajo o moderado, e incluso en receptores de alto riesgo (D+/R−). Además, cambiar de ácido micofenólico a mTOR tras un primer episodio tratado de CMV en receptores R+ también se considera eficaz y seguro para prevenir recurrencias. Se postula que estos fármacos ejercen un efecto inmunomodulador favorable, estimulando la memoria antiviral y respuestas efectoras.
Otros factores
En receptores de trasplante renal, la reactivación de otros beta-herpesvirus como el herpes virus tipo 6 y el tipo 7 se ha asociado con mayor riesgo de enfermedad por CMV. Además otros factores como la edad avanzada del donante, el injerto renal procedente de cadáver, el retrasplante, y las trasfusiones repetidas de hemoderivados se han asociado con mayor riesgo de infección por CMV.
El control del CMV en receptores de trasplante ha mejorado en las últimas dos décadas gracias al desarrollo de antivirales eficaces, mejores técnicas diagnósticas y una mayor comprensión de la inmunidad celular del huésped.
El Grupo Español para el Estudio de las Infecciones en el Trasplante (GESITRA) y la Sociedad Española de Trasplantes (SET) han publicado recientemente la actualización de las recomendaciones del manejo de la infección / enfermedad por CMV en los pacientes con trasplante de órgano sólido, en las que se incluyen las novedades, tanto en la prevención como en el tratamiento de la infección por CMV, incorporadas en la práctica clínica con los nuevos fármacos antivirales y los métodos de evaluación de la inmunidad celular CMV específica, que a continuación resumiremos.
Prevención de la enfermedad por CMV
Las dos estrategias principales de prevención son la profilaxis universal y la terapia anticipada. La primera consiste en la administración de antivirales a todos los pacientes en riesgo, aunque se encuentran asintomáticos y no existan datos de infección. Esta estrategia reduce la replicación viral asintomática y otras infecciones por herpesvirus, aunque con riesgo de toxicidad y resistencia. La terapia anticipada, es más costo-efectiva, requiere vigilancia virológica activa y se inicia el tratamiento con antiviral cuando se detecta replicación. Aunque ambas son efectivas, su elección depende del riesgo individual del paciente, determinado por el nivel de inmunosupresión y el estado serológico donante-receptor.
1. En pacientes D+/R- se recomienda profilaxis universal con valganciclovir (900 mg/día) durante un máximo de 6 meses postrasplante. Como alternativas pueden emplearse ganciclovir intravenoso (5 mg/Kg/día) o valaciclovir oral (2 gr/6horas) durante 3 meses. La terapia anticipada podría ser una alternativa en aquellos centros que puedan asegurar una monitorización adecuada de los pacientes. Asimismo, en pacientes que reciban tratamiento con anticuerpos antilinfocíticos se recomienda valganciclovir durante 3 meses o ganciclovir intravenoso durante al menos 14 días.
2. En receptores seropositivos para CMV se recomienda el empleo de terapia anticipada con valganciclovir (900 mg/12horas) o ganciclovir intravenoso (5mg/Kg/12horas) en caso de intolerancia oral, durante 14-21 días o hasta que la antigenemia o carga viral sea negativa o indetectable. Como alternativa puede emplearse profilaxis universal con valganciclovir (450-900 mg/día), valaciclovir oral (2 gr/6 horas) o ganciclovir intravenoso (5 mg/Kg/día) durante un máximo de 3 meses en los casos en los que no pueda asegurarse una estrecha monitorización virológica. Se puede considerar también Letermovir como profilaxis universal en casos de neutropenia. .
Otra de las medidas que ha demostrado su utilidad, en estudios randomizados y prospectivos, como prevención de la infección o enfermedad por CMV ha sido el empleo de los inhibidores mTOR como parte del tratamiento inmunosupresor, bien utilizado de novo o como conversión precoz o tardía. El uso de este grupo de fármacos inmunosupresores se asocia con una disminución significativa del riesgo de padecer infección o enfermedad por CMV comparado con aquellos pacientes que no lo usaron, por lo que se recomienda su uso en pacientes con alto riesgo (D+/R-) o en aquellos pacientes con infecciones recurrentes o resistentes a los antivirales.
Prevención inmunoguiada
En los últimos años se ha puesto de manifiesto cómo la respuesta inmune celular, orquestada por los linfocitos T CD4 y CD8 específicos de CMV, desempeña un papel crucial en el control de la replicación viral.
El análisis de estas sub-poblaciones linfocitarias refleja la capacidad del paciente para controlar el virus, permite identificar pacientes en riesgo de desarrollar infección o enfermedad por CMV postrasplante y puede ayudar a los clínicos a definir mejor la estrategia de prevención específica para cada paciente.
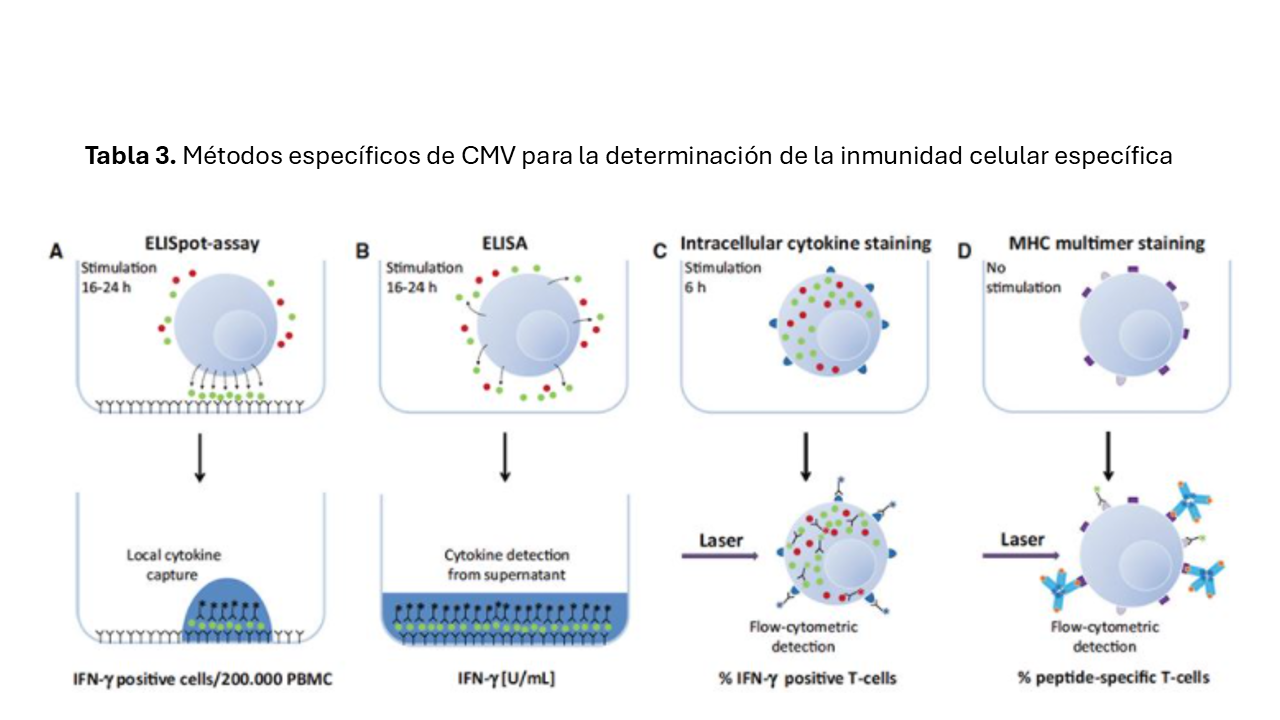
Existen distintos métodos analíticos que evalúan la inmunidad celular específica. El principio básico de todos ellos consiste en la estimulación en un cultivo celular de las células T con antígenos del CMV. Tras la estimulación las células T son fijadas o teñidas con anticuerpos o se utiliza el sobrenadante para medir la liberación de citoquinas. Las técnicas usadas habitualmente son: Citometría de flujo con el empleo de tinción de tetrámeros y citoquinas intracelulares, Inmunoknow (ensayo de liberación de ATP), ensayo Spot inmunoabsorbente ligado a enzimas (ELISpot) y el ensayo inmunoabsorbente ligado a enzimas (ELISA quantiferon CMV) (Figura 3).
Esta monitorización inmunológica está demostrando ser un avance importante en la capacidad de predecir qué pacientes tienen más riesgo de desarrollar la infección viral postrasplante y podría ser de utilidad en el control del CMV postrasplante, por lo que se recomienda monitorizar la inmunidad celular CMV específica, sin embargo, no se puede recomendar, a día de hoy, cuál de los métodos disponibles pudiera ser el mejor.
De acuerdo con las recomendaciones del Grupo GESITRA y SET, se recomienda que:
La monitorización postrasplante de la inmunidad celular específica contra CMV (CMV-CMI) debe utilizarse en pacientes R+ de alto riesgo para guiar la profilaxis antiviral. Esta estrategia también puede aplicarse a pacientes D+/R−.
La monitorización temprana (entre los días 15 y 30 postrasplante) debe emplearse en pacientes R+ de riesgo intermedio para estratificar el riesgo de infección por CMV.
En pacientes R+ de riesgo intermedio tratados con terapia anticipada, se puede monitorizar la CMV-CMI postrasplante para predecir la resolución espontánea del CMV.
La CMV-CMI postrasplante también podría utilizarse para predecir el riesgo de recurrencia tras la suspensión del tratamiento antiviral.
Tratamiento de la enfermedad por citomegalovirus
Tradicionalmente el tratamiento de la enfermedad por CMV se ha realizado con ganciclovir intravenoso. En la actualidad, disponemos además de valganciclovir, un derivado esterificado de ganciclovir que es hidrolizado rápidamente a ganciclovir tras su absorción en el intestino. Los resultados del estudio VICTOR, en el cual se incluyen mayoritariamente trasplantados renales, han demostrado eficacia similar entre ambos fármacos en términos de recurrencia clínica y virológica. En el consenso de GESITRA, se aconseja que en los pacientes con enfermedad leve o moderada se emplee valganciclovir (900 mg/12horas) pudiendo emplearse ganciclovir intravenoso en los pacientes con enfermedad grave o en situaciones en las cuales valganciclovir puede ser inadecuadamente absorbido. En estos pacientes, el tratamiento con ganciclovir intravenoso puede continuarse con valganciclovir oral cuando se produzca mejoría clínica.
La duración óptima del tratamiento frente al CMV se determinará en función de la evolución clínica y virológica del paciente, debiendo realizarse determinación semanal de carga viral o antigenemia para monitorizar la respuesta al tratamiento, el cual debe mantenerse hasta la obtención de una carga viral o antigenemia negativas o hasta la resolución de los síntomas. En cualquier caso, la duración mínima del tratamiento no debe ser inferior a 14 días. En algunas formas de enfermedad por CMV, como en el caso de la afectación del tubo digestivo, la ocular y la del sistema nervioso central, en las cuales puede no evidenciarse viremia detectable, puede emplearse mayor tiempo de tratamiento en función de la evolución clínica e histológica.
Durante el tratamiento antiviral debe monitorizarse la función renal, ajustando las dosis de ganciclovir o valganciclovir en función del aclaramiento de creatinina. Además, debe evitarse la reducción de los fármacos antivirales ante la presencia de leucopenia durante el tratamiento, aconsejándose inicialmente reducir la dosis de otras drogas potencialmente mielotóxicas como los derivados del ácido micofenólico, los inhibidores de la mTOR (sirolimus y everolimus), azatrioprina y cotrimoxazol. En los casos de leucopenia grave con recuento de neutrófilos inferior a 1000 cels/ml puede considerarse el empleo de factores estimulantes de colonias de granulocitos.
Una vez finalizado el tratamiento, no se recomienda de forma rutinaria el tratamiento con profilaxis secundaria. En algunos pacientes puede considerarse la administración de profilaxis secundaria con valganciclovir (900 mg/d) durante 1-3 meses. Entre estos pacientes se encuentran aquellos con alto riesgo de recurrencia, como los que han presentado una primoinfección, alta carga viral al inicio del tratamiento, enfermedad multiorgánica y aquellos que han requerido un aumento de la inmunosupresión por rechazo.
Alternativas a ganciclovir y valganciclovir en el tratamiento de la enfermedad por citomegalovirus
En los pacientes que no presentan respuesta a ganciclovir debe sospecharse resistencia a dicho fármaco. En estos casos las decisiones terapéuticas deben basarse en el análisis de los genes UL97 y UL54, el estado inmune del paciente y la gravedad de la enfermedad. En pacientes con enfermedad resistente debe considerarse como primera opción el tratamiento con Maribavir. Otras alternativas que pueden emplearse son el cambio a inhibidores mTOR.
Virus de Epstein-Barr
El virus de Epstein-Barr (VEB) se asocia con la enfermedad linfoproliferativa postrasplante (ELPT) [51]. Esta entidad comprende un amplio espectro de situaciones clínicas que van desde el síndrome mononucleósico hasta el linfoma. Al igual que ocurre con el CMV, los receptores seronegativos que reciben un órgano procedente de un donante seropositivo son los pacientes con mayor riesgo de desarrollar ELPT. Otros factores de riesgo son la enfermedad por CMV, el empleo de OKT3 y anticuerpos antilinfocíticos, la duración de la inmunosupresión y el tipo de trasplante, siendo el trasplante renal uno de los de menor riesgo de ELPT con una incidencia del 1-2 %. Esta enfermedad se presenta fundamentalmente durante el primer año post-trasplante (ELPT precoz), aunque puede presentarse de forma tardía una vez transcurrido este periodo.
Manifestaciones Clínicas
La infección por VEB puede manifestarse como un síndrome mononucleósico (fiebre, faringitis, linfadenopatías, hepatoesplenomegalia y linfocitosis atípica), enfermedad específica de órgano (hepatitis, neumonitis, afectación gastrointestinal) o hemopatía (leucopenia, trombopenia, anemia hemolígica y síndrome hemofagocítico). Además de estas manifestaciones clínicas, la infección por el VEB puede desencadenar el desarrollo de ELPT, cuyos síntomas son variados y en muchos casos inespecíficos.
Diagnóstico
El diagnóstico definitivo de la ELPT se realiza mediante el hallazgo de las presentaciones típicas de esta entidad en el estudio anatomopatológico. En pacientes trasplantados la serología resulta poco útil como herramienta diagnóstica de infección primaria por VEB y de ELPT ya que en pacientes inmunosuprimidos la respuesta inmune humoral puede encontrarse retrasada o ausente. La determinación de la carga viral de VEB presenta buena sensibilidad, pero escasa especificidad en el diagnóstico de ELPT, lo que resulta en un buen valor predictivo negativo (90 %) pero escaso valor predictivo positivo (28-65 %), aunque valores elevados de carga viral en pacientes con sintomatología compatible apoyan el diagnóstico de ELPT.
Prevención de la enfermedad linfoproliferativa postrasplante
En la actualidad no existen estrategias de profilaxis universalmente aceptadas. Los datos procedentes de estudios donde se empleó aciclovir o ganciclovir en profilaxis son limitados y no permiten establecer una recomendación definitiva a este respecto. En algunos centros se ha empleado profilaxis antiviral en pacientes D+/R-, existiendo algunos datos en trasplantados renales que sugieren que la profilaxis antiviral podría reducir el riesgo de ELPT en estos pacientes.
El papel de la administración de inmunoglobulinas anti-VEB es incierto, habiéndose publicado estudios con resultados contradictorios por lo que en la actualidad no puede realizarse una recomendación definitiva.
Tratamiento de la enfermedad linfoproliferativa postrasplante
En la actualidad no existe consenso sobre la mejor estrategia de manejo terapéutico de la ELPT. Entre estas estrategias, la reducción de la inmunosupresión representa la primera actuación de tratamiento en estos pacientes, pudiendo resultar en una regresión de las lesiones de la ELPT hasta en el 50 % de los casos. En algunos casos de enfermedad localizada la reducción de la inmunosupresión puede acompañarse de la resección quirúrgica de las zonas afectadas. En otros casos, como en la afectación del sistema nervioso central, se ha empleado radioterapia local.
Por otro lado, cada vez existen más datos que apoyan la administración del anticuerpo monoclonal anti-CD20 (rituximab) como siguiente paso después de la disminución del tratamiento inmunosupresor, aunque no se encuentran bien definidos los pacientes que más podrían beneficiarse de esta estrategia, así como la duración óptima del tratamiento.
Los antivirales aciclovir y ganciclovir se han empledado en la ELPT precoz de forma única o combinados con inmunoglobulinas. Debido a su mayor actividad frente al VEB, en los casos en los que se emplee tratamiento antiviral debe emplearse ganciclovir, aunque la eficacia de esta estrategia no se encuentra bien definida en ausencia de otras intervenciones como la reducción en la inmunosupresión o la terapia anti-CD20.
El empleo de quimioterapia citotóxica no parece indicado como tratamiento de primera línea en el caso de la ELPT precoz, siendo menos controvertido su empleo en el caso de ELPT tardía, en la ELPT VEB-negativa, o cuando existe afectación del sistema nervioso central, así como en pacientes refractarios a otras estrategias de tratamiento.
La inmunoterapia adoptiva empleando células T citotóxicas específicas frente al VEB derivadas del donante se ha empleado con éxito en el trasplante de progenitores hematopoyéticos, aunque la experiencia en el trasplante de órgano sólido es limitada y no permite realizar una recomendación a este respecto.
Virus Varicella zoster
Aproximadamente el 90 % de los receptores de trasplante de órgano sólido son seropositivos para el virus varizella zoster (VVZ) [52] [53].
Al igual que en la población general, la infección primaria, producida habitualmente por exposición directa a través de las lesiones cutáneas o por vía respiratoria, desencadena la varicela aguda la cual se manifiesta como fiebre y exantema vesicular y pruriginoso que se resuelve en 7-10 días. En ocasiones, la varicela aguda puede producir complicaciones graves como hepatitis, neumonitis, encefalitis y pancreatitis, las cuales pueden comprometer la vida del paciente.
Después de la infección primaria el virus permanece latente pudiendo reactivarse años después como herpes zoster en forma de exantema vesicular de distribución metamérica.
En general el diagnóstico puede sospecharse clínicamente dada la presencia de síntomatología clínica típica tanto de la varicela como del herpes zoster. Las pruebas de laboriatorio pueden emplearse en los casos de presentación atípica o en aquellos en los que se sospeche enfermedad diseminada o visceral. Entre estas pruebas se encuentran la PCR y la inmunfluorescencia directa.
El tratamiento de la varicela es el aciclovir intravenoso a dosis de 10 mg/Kg/8horas, el cual debe iniciarse lo más precozmente posible dado que la mayor precocidad implica mayor eficacia. En los casos de enfermedad grave puede considerarse el empleo de inmunoglobulina intravenosa.
El herpes zoster puede tratarse de forma ambulatoria con aciclovir oral, valaciclovir o famciclovir. En los casos de afectación oftálmica y ótica debe emplearse aciclovir intravenoso.
La prevención frente al CMV empleada durante el periodo post-trasplante precoz puede prevenir la reactivación del VVZ y por tanto no es necesaria profilaxis adicional durante este periodo.
En España existen dos vacunas autorizadas para el VVZ: una vacuna atenuada y una vacuna producida por técnicas de recombinación de ADN compuesta por una glicoproteína (HZ/su). La vacuna atenuada contiene virus de varicela modificados en el laboratorio para debilitarlos y en una concentración superior que las vacunas de varicela. La vacuna atenuada está contraindicada en pacientes trasplantados, recomendándose la vacunación con la vacuna de glicoproteína (HZ/su) en esta población.
En aquellos pacientes que estén siendo valorados para trasplante y que sean susceptibles al VVZ podría administrarse la vacuna de virus atenuados Oka, la cual se ha mostrado segura y efectiva en pacientes con enfermedad renal crónica avanzada. Esta vacuna deberá administrarse al menos 2-4 semanas previas a la realización del trasplante, aunque si la vacuna se administra de forma combinada con otros virus (parotiditis, sarampión, rubeola) debería administrarse al menos 4 semanas previas al trasplante. Una vez realizado el trasplante está contraindicado el uso de esta vacuna con virus atenuados.
Los receptores seronegativos que hayan presentado exposición significativa al VVZ deben recibir profilaxis post-exposición. Las opciones para esta profilaxis incluyen la inmunoprofilaxis pasiva y/o el tratamiento antiviral.
Virus herpes simple
Los virus herpes simple tipo 1 y 2 (VHS-1, VHS-2) son alfa-herpesvirus [54]. La infección por VHS-1 se asocia típicamente a afectación orolabial y es adquirida generalmente durante la infancia y la adolescencia. El VHS-2 produce afectación genital aumentando su prevalencia progresivamente desde el inicio de la actividad sexual. En comparación con los pacientes inmunocompetentes, los receptores de trasplante presentan mayor frecuencia de enfermedad grave por este virus. En estos pacientes la mayoría de ocasiones la enfermedad se produce como consecuencia de la reactivación del virus latente.
La presentación clínica más frecuente de la infección por el virus herpes simple es la afectación orolabial, genital o perianal en forma de lesiones vesiculadas o ulcerativas que pueden extenderse localmente. Además, en algunos casos puede producirse afectación diseminada o visceral como esofagitis, hepatitis, neumonitis y encefalitis.
El diagnóstico puede realizarse clínicamente cuando la infección se manifiesta con las típicas lesiones ulcerosas en boca y faringe. Sin embargo, en estos pacientes son frecuentes las presentaciones atípicas o graves por lo que la realización de técnicas de laboratorio como la PCR puede ser útil en casos de duda diagnóstica o de afectación diseminada o visceral.
El tratamiento de la enfermedad diseminada, visceral o de la afectación mucosa extensa debería realizarse con aciclovir intravenoso a dosis de 5-10mg/8horas. En casos de enfermedad grave podría igualmente considerarse la reducción de la inmunosupresión. En los casos de enfermedad cutánea limitada puede emplearse aciclovir, valaciclovir o famciclovir. En pacientes que no responden al tratamiento con aciclovir debe sospecharse resistencia a dicho fármaco, pudiendo emplearse foscarnet como alternativa.
En los pacientes que reciben profilaxis frente a CMV durante el periodo postrasplante no resulta necesario realizar profilaxis frente al VHS. En aquellos casos de recurrencia después del final del tratamiento puede considerarse la administración de terapia supresora antiviral hasta que el nivel de inmunosupresión puede ser descendido.
Virus BK
Epidemiología y factores de riesgo
El virus BK pertenece a la familia de los polyomaviridae al igual que el virus JC (virus de John Cunningham causante de la leucoencefalopatía multifical progresiva) [55] [56] [57] [58] [59] [60]. La infección primaria por el virus BK ocurre principalmente en la infancia, quedando posteriormente en estado latente en el urotelio por el que presenta un especial tropismo. Aproximadamente el 80 % de la población general presenta anticuerpos frente al virus, habiéndose estimado la prevalencia de viruria, viremia y nefritis en el trasplante renal del 30 %, 13 % y 8 % respectivamente.
En situaciones de inmunosupresión el virus escapa del control inmunológico y da lugar a la aparición de reactivación viral (replicación viral asintomática) o a la presencia de enfermedad clínica (nefropatía por VBK en pacientes portadores de trasplante renal). La aparición de enfermedad no sólo depende del estado global de inmunosupresión, sino que también depende de factores específicos del paciente y de la situación clínica para su desarrollo; de ahí que esta enfermedad sea típica de los pacientes con injerto renal y se produzca con mucha menos frecuencia en receptores de otros órganos sólidos, ya que el virus requiere para ejercer su patogenicidad la presencia de un daño o injuria en el lugar de la replicación viral, como es el urotelio.
Los factores de riesgo para el desarrollo de nefropatía por virus BK (NBK) son la serodiscordancia donante/receptor (D+/R-), la triple terapia con inhibidores de la calcineurina, el tratamiento con micofenolato mofetilo, incompatibilidad HLA, ser varón mayor de 50 años, el tiempo de isquemia, el trasplante de riñón procedente de cadáver y las lesiones isquémicas en el injerto.
Manifestaciones clínicas
La infección primaria se produce en la mayoría de las ocasiones sin síntomas específicos. La replicación viral en los pacientes trasplantados renales cursa de manera asintomática y la NBK se manifiesta como disfunción renal secundaria a nefropatía tubulointersticial, pudiendo presentarse ocasionalmente obstrucción ureteral e hidronefrosis.
Diagnóstico
Inicialmente la NBK no se asocia a sintomatología clínica, detectándose únicamente viruria de alto nivel, definida por la presencia de células Decoy (presencia de inclusiones virales en citologías urinarias) y carga viral en orina >107 copias/ml. En la mayoría de estos pacientes la presencia de viruria de alto nivel se sigue, en un periodo que oscila entre semanas o pocos meses, de la detección de viremia >105 copias/ml.
De acuerdo con las guías clínicas internacionales sobre el manejo de la infección por VBK publicadas en 2024, se recomienda realizar una monitorización regular de la replicación de VBK en los pacientes con trasplante renal. Este cribado se debe realizar mediante la determinación de la PCR de VBK en sangre de forma mensual hasta el mes 9º postrasplante y posteriormente cada 3 meses hasta el 2º año postrasplante.
En caso de que el paciente presente cargas plasmáticas de ADN de VBK en sangre de 1.000-10.000 copias/ml (o equivalente) es recomendable repetir la determinación para su confirmación en el plazo de 2-3 semanas, para conocer si aumenta, disminuye o se mantiene la carga viral.
En receptores de trasplante renal con cargas plasmáticas sostenidas de ADN de VBK >1000 copias/mL (o equivalente), se sugiere monitorizar la carga viral cada 2-4 semanas para evaluar la dinámica y la respuesta a la intervención.
En receptores de trasplante renal que requieran un aumento de la inmunosupresión o de tratamiento antirrechazo, se sugiere reanudar el cribado mensual de PCR VBK en sangre durante los 3 meses siguientes.
En entornos con recursos limitados, recomendamos utilizar la citología de orina para detectar células señuelo como método de cribado mínimo en puntos temporales similares a los anteriores. Si no se dispone de muestras de sangre o se considera inapropiado para el cribado, sugerimos medir las cargas de ADN de VBK en orina mediante PCR en puntos temporales similares a los recomendados anteriormente. Si se detectan células señuelo en orina o cargas de ADN de VBK en orina de >10 millones de copias/mL (o equivalente), se recomienda realizar la determinación de PCR de VBK en sangre para guiar el manejo clínico.
En los trasplantes combinados de riñón y órgano sólido, incluido el páncreas, se sugiere ampliar el cribado de la carga viral por VBK cada 3 meses hasta 36 meses después del trasplante.
El diagnóstico de la nefropatía por virus BK se realiza mediante biopsia renal en la que encontraremos las típicas inclusiones virales nucleares basofílicas en las células epiteliales y signos de inflamación con tubulitis, hallazgos similares a los descritos en un rechazo agudo celular. Con la técnica de inmunohistoquímica para SV40 podremos apreciar la tinción positiva nuclear e identificar al poliomavirus, lo que confirmaría el diagnóstico definitivo de nefropatía por virus BK. Según la extensión del infiltrado inflamatorio y la fibrosis asociada a la infección viral se establecen 3 patrones histológicos: Patrón A (cambios citopáticos virales con mínima o ausente inflamación y fibrosis tubular). Patrón B (cambios citopáticos virales con áreas de fibrosis e inflamación multifocal). Patrón C (escasos cambios citopáticos y extensa fibrosis tubular e inflamación).
Debido a la naturaleza focal de la NBK, en los casos en los que exista un alto grado de sospecha (p.e. pacientes con viremia mantenida con biopsia normal) debe realizarse una segunda biopsia.
Tratamiento
Hoy en día, no existen fármacos antivirales eficaces que sean capaces de controlar la replicación viral o curar la nefropatía por VBK, por lo que la principal estrategia terapéutica para la replicación del VBK así como de la NBK consiste en la monitorización virológica y la reducción de la inmunosupresión.
De forma general la reducción de la inmunosupresión debe plantearse como tratamiento primario de todo paciente trasplantado renal con replicación sostenida por VBK o con nefropatía por VBK en ausencia de riesgo inmunológico elevado o presencia de rechazo agudo concomitante. Esta reducción de la inmunosupresión debe comenzarse cuando la PCR de VBK en sangre se mantenga entre 1.000-10.000 copias/ml (o equivalente) en dos determinaciones consecutivas separadas 2-3 semanas o si la PCR de VBK en sangre inicial sea > 10.000 copias/ml (o equivalente) o se haya hecho un diagnóstico de nefropatía por VBK independientemente de que tengamos o no el resultado de la PCR de VBK en sangre.
Es aconsejable que cada centro disponga de un algoritmo de reducción de la inmunosupresión para pacientes con replicación de VBK.
Debemos monitorizar la carga viral durante el proceso de reducción de la inmunosupresión cada 2-4 semanas hasta su negativización o la estabilización en < 1.000 copias/ml. En aquellos pacientes en los que la carga viral se mantenga en < 1.000 copias/ml de forma mantenida podrá realizarse un seguimiento virológico cada 3 meses.
En relación con la reducción de la inmunosupresión no existe una pauta establecida debido a la falta de estudios prospectivos y randomizados y a las diferencias poblacionales entre los distintos estudios. Alguna de las estrategias recomendadas son:
Estrategia 1: Reducción del inhibidor de calcineurina entre un 25-50% en 1 o 2 pasos para niveles de tacrolimus de 3-5 ng/ml o de ciclosporina de 75-125 ng/ml. En aquellos casos en los que la carga viral no baje de > 10.000 copias/ml en un plazo de 4 semanas se recomienda continuar con la reducción de la antimetabolito un 50 % y en un tercer tiempo con la suspensión del antimetabolito.
Estrategia 2: Disminución del antimetabolito un 50 %. En aquellos casos en los que la carga viral no baje de > 10.000 copias/ml en un plazo de 4 semanas se recomienda continuar con la suspensión del antimetabolito y la reducción de la dosis de prednisona a 5-10 mg al día y en un tercer tiempo con la reducción de la dosis del inhibidor de calcineurina para niveles de 5 ng/ml de tacrolimus o de 100 ng/ml de ciclosporina.
En ambas estrategias se recomienda reiniciar tratamiento con prednisona a dosis de 5-10 mg, en aquellos pacientes que no la estuvieran tomando, para evitar mantener en monoterapia con inhibidor de calcineurina.
Reducciones mayores o más intensas de los niveles de inhibidores de calcineurina no están bien definidas y deben ser individualizadas. De igual forma, no existen suficientes datos que evalúen la eficacia del cambio a inhibidores mTOR para tratar la replicación o nefropatía por VBK.
Una vez que la PCR de VBK en sangre se ha negativizado se recomienda un incremento juicioso de la inmunosupresión de mantenimiento en función del riesgo inmunológico del paciente y con un cribado posterior de la PCR de VBK en sangre.
En aquellos pacientes con replicación de VBK persistente, con inmunosupresión reducida, se recomienda la determinación de anticuerpos anti HLA donante específicos en caso de deterioro de la función renal para poder tomar decisiones clínicas en base al resultado de la biopsia renal.
Para los pacientes con replicación o nefropatía por VBK con trasplantes combinados que incluyan o no el riñón se recomienda una reducción cuidadosa de la inmunosupresión como la mencionada arriba además de un seguimiento clínico y analítico estrecho balanceando riesgos y beneficios del rechazo agudo o pérdida del injerto.
El manejo de los pacientes que desarrollan un rechazo agudo mientras presentan replicación o nefropatía por VBK es un desafío para el clínico y no hay datos suficientes que definan la mejor estrategia terapéutica. La mayoría de los expertos recomiendan tratamiento del rechazo con dosis altas de esteroides y seguimiento estrecho de la función renal y la carga viral. Según la evolución clínica y virológica posterior se recomienda un incremento juicioso de la inmunosupresión o reducción de esta si la carga viral aumenta de forma significativa.
Existen pocos datos para guiar la reducción de la inmunosupresión en pacientes en tratamiento inmunosupresor de mantenimiento con inhibidores mTOR o en tratamiento con belatacept y están basadas en opiniones de expertos. Algunas aproximaciones para ello pudieran ser las siguientes:
- Para pacientes en tratamiento con inhibidor de calcineurina e inhibidor mTOR se recomienda: Reducir primero la dosis del inhibidor de calcineurina seguido de la reducción de la dosis del inhibidor mTOR si es necesario o bien cambiar a dosis bajas de ciclosporina y en un segundo tiempo reducir la dosis del inhibidor mTOR si es necesario.
- Para pacientes en tratamiento con belatacept se recomienda: Reducir o suspender el antimetabolito, incrementar el intervalo de administración de belatacept a cada 6-8 semanas o bien cambiar belatacept por dosis bajas de inhibidor de calcineurina o de inhibidor mTOR.
El uso de inmunoglobulinas intravenosa se pudiera plantear en pacientes con respuesta insuficiente a la reducción de la inmunosupresión para facilitar el aclaramiento del virus o en pacientes con alto riesgo inmunológico para prevenir el desarrollo de rechazo agudo mientras se reduce la inmunosupresión.
El uso de otros tratamientos como, cidofovir, leflunomida, fluorquinolonas o estatinas no está recomendado ni en la fase de tratamiento ni de prevención de la replicación ni de la nefropatía por VBK
Virus respiratorios
Entre los virus respiratorios se incluyen una gran variedad de virus que se han identificado como causantes de importante morbilidad y mortalidad en los pacientes trasplantados. Entre ellos se incluyen el virus influenza, virus respiratorio sincitial (VRS), parainfluenza, rinovirus, metapneumovirus humano, coronavirus y bocavirus [61]. Todos estos virus comparten algunas características comunes en los receptores de trasplante como la estacionalidad de sus infecciones, el amplio rango de manifestaciones clínicas las cuales no son características de ninguno de ellos y que oscila entre cuadros catarrales leves y neumonías graves y la mayor frecuencia de presentaciones atípicas y complicaciones.
Debido a que no puede realizarse una distinción clínica entre estos virus, el estudio diagnóstico debe incluir técnicas de amplio espectro de detección y que estarían especialmente indicadas en el periodo post-trasplante precoz, ante situaciones que conlleven aumento de inmunosupresión o durante los picos estacionales. En general, en todos los pacientes con sospecha de infección por virus respiratorios debería realizarse un aspirado nasofaríngeo para la realización de test de diagnóstico rápido que permiten detectar alguno de estos virus como influenza o VRS. Los resultados negativos de estos test no descartan la presencia de infección por lo que la realización de otras técnicas como PCR, inmunofluorescencia directa o cultivo pueden estar indicadas según la disponibilidad de cada centro. En los casos en los que las muestras respiratorias de vías altas no resulten diagnósticas y exista evidencia radiológica de afectación de las vías aéreas inferiores debe plantearse la realización de lavado broncoalveolar.
Tratamiento y prevención de la infección por virus Influenza
Existen dos clases de fármacos antivirales para el tratamiento de la influenza, los inhibidores M2 (amantadina y rimantadina), los cuales son eficaces únicamente frente a influenza A, y los inhibidores de la neuraminidasa (zanamivir y oseltamivir) que son efectivos frente a influenza A y B. En receptores de trasplante el tratamiento con estos fármacos ha demostrado disminuir las complicaciones infecciosas, la duración de los síntomas y la mortalidad.
Los pacientes con sospecha o diagnóstico de certeza de influenza deberían ser aislados del resto de pacientes, tomándose precauciones de aislamiento respiratorio. La vacunación inyectable de virus inactivados se ha mostrado eficaz y segura en los pacientes trasplantados y debe recomendarse a todos los pacientes. La vacuna inhalada de virus atenuados no se recomienda en la población de pacientes trasplantados. En caso de exposición a un individuo con infección gripal debe plantearse en las primeras 48 horas la administración de oseltamivir (75 mg/24 horas) durante 5 días.
Tratamiento y prevención de la infección por virus respiratorio sincitial
Los pacientes con sospecha o infección confirmada por el VRS deberían ser aislados del resto de pacientes. Aunque la administración profiláctica de inmunoglobulina específica y de palivizumab se ha mostrado eficaz en la población pediátrica, en los pacientes adultos receptores de trasplante de órgano sólido su eficacia no ha sido evaluada.
En los pacientes infectados puede considerarse una reducción en la inmunosupresión, especialmente en aquellos que presentan enfermedad grave. La ribavirina en aerosol ha sido aprobada para el tratamiento de infecciones respiratorias por el VRS, aunque los datos sobre la verdadera eficacia de este fármaco en los receptores de trasplante son todavía limitados.
Tratamiento y prevención de la infección por virus parainfluenza
Los pacientes con sospecha o infección confirmada por este virus deberán aislarse del resto de pacientes. En la actualidad no se ha aprobado la administración de vacunas ni de tratamiento antiviral de forma profiláctica en estos pacientes. Aunque ha sido considerado por algunos autores, no existen recomendaciones generales sobre el empleo de ribavirina en estos pacientes.
Parvovirus B19
El Parvovirus B19 pertenece a la familia Parvoviridae y se encuentra distribuido ubicuamente en la naturaleza [62]. La infección ocurre generalmente entre los 5 y los 15 años, de forma que el 80 % de los adultos presentan seropositividad frente a este virus. La incidencia de infecciones por Parvovirus B19 en los pacientes trasplantados es del 2 %, aunque se ha evidenciado desarrollo de viremia en aproximadamente el 30 % de los pacientes trasplantados. En estos pacientes, la anemia es el síntoma principal presentándose en prácticamente el 100 % de los pacientes, por lo que ante la presencia de anemia no justificada en un paciente trasplantado debe investigarse la posibilidad de infección por este virus. Otros síntomas incluyen la fiebre, las artralgias y el rash.
Para el diagnóstico de infección por este virus se recomienda la realización de serología (IgG e IgM) junto con PCR en suero o sangre total. En aquellos casos donde exista alta sospecha de infección por Parvovirus B19 y estas pruebas resultan negativas puede considerarse el estudio de médula ósea.
Para el tratamiento de los pacientes con infección sintomática se recomienda el empleo de inmunoglobulina intravenosa (400 mg/Kg/día) durante 5 días. En los casos de no respuesta o de recaída puede iniciarse otro ciclo de inmunoglobulinas a la misma dosis y duración del ciclo anterior.
Virus herpes 6 y 7
Los virus herpes 6 y 7 (VH-6 y VH-7) forman parte de los beta-herpesvirus linfotrópos los cuales producen generalmente infección primaria en los primeros años de vida [63] [64]. Esta primoinfección puede ser asintomática o bien manifestarse en forma de fiebre, rash o síntomas respiratorios. En los pacientes trasplantados la mayoría de las infecciones se producen como consecuencia de una reactivación de virus latentes generalmente durante el primer mes post-trasplante. En el caso de la infección por VH-6 la infección suele manifestarse por un síndrome viral similar al producido en la infección por CMV. Además, se han comunicado casos de hepatitis, gastroenteritis, neumonitis y encefalitis. Por el contrario, los datos sobre la sintomatología de la enfermedad por VH-7 no se encuentran bien documentados.
Para el diagnóstico se recomienda el empleo de PCR cuantitativa, siendo la serología de escaso valor debido a su escasa sensibilidad y especificidad en pacientes inmunocomprometidos.
Los pacientes que presenten coinfección por CMV y VH-6 o VH-7 no requieren tratamiento adicional al de la infección por CMV. En los pacientes que presenten infección exclusiva por VH-6 no se recomienda el tratamiento de forma sistemática excepto en los casos de enfermedad grave como la encefalitis. Para este tratamiento se han empleado foscarnet, ganciclovir y cidofovir. El VH-7 puede presentar resistencia a ganciclovir. Además del tratamiento antiviral se recomienda disminuir el grado de inmunosupresión.
Virus herpes 8
La infección primaria por virus herpes 8 (VH-8) se asocia en individuos inmunocompentes con síntomas como diarrea, fatiga, rash y linfadenopatías [65]. En estos pacientes se produce una respuesta inmune específica que controla la replicación del VH-8 y previene su progresión a enfermedad neoplásica. Por el contrario, en pacientes inmunosuprimidos, como en los receptores de trasplante, la infección por VH-8 se asocia frecuentemente con neoplasias como el sarcoma de Kaposi (SK), la cual se manifiesta en forma de lesiones muco-cutáneas con diseminación visceral, incluyendo el órgano trasplantado, en un tiempo medio de 30 meses post-trasplante. Además de con el SK, el VH-8 se ha relacionado con linfomas y con la enfermedad de Castleman.
A diferencia de la mayoría de herpes virus, el VH-8 no se encuentra distribuido ubicuamente en la naturaleza, sino que su prevalencia varía dependiendo de la región geográfica. De esta forma, la seroprevalencia estimada oscila entre el 0-5 % de Norteamérica, el 5-20 % del área mediterránea y al menos el 50 % en algunas regiones de África. Por tanto, la incidencia de infección activa por VH-8 en pacientes trasplantados viene influenciada por estas diferencias geográficas.
Para el diagnóstico de infección aguda la serología tiene un papel limitado. La inmunohistoquímica empleando anticuerpos monoclonales puede resultar útil para el diagnóstico de SK y otras neoplasias angioproliferativas, al igual que las técnicas de PCR.
El aspecto más importante del tratamiento de esta infección es la reducción de la inmunosupresión y el uso de inhibidores mTOR. En los pacientes cuyas lesiones no presenten mejoría a pesar de la reducción de la inmunosupresión puede plantearse la cirugía, la radioterapia o la quimioterapia. Los beneficios del tratamiento antiviral no están bien definidos se han comunicado casos de buena respuesta a foscarnet en trasplantados renales con afectación medular y hemofagocitosis.
Norovirus
Los norovirus forman parte de la familia Caliciviridae y representan la principal causa de gastroenteritis aguda en adultos y la segunda más frecuente en niños. La infección puede transmitirse a partir de agua o comida contaminada, familiares, trabajadores sanitarios y a través de fuentes ambientales [66] [67] [68] [69]. A diferencia de los pacientes inmunocompetentes donde la infección se presenta fundamentalmente en invierno y los síntomas duran pocos días, en los pacientes trasplantados la infección por norovirus no presenta un claro patrón estacional y puede producir diarrea crónica y fluctuante y pérdida importante de peso. En estos pacientes el virus es liberado en las heces durante largos periodos de tiempo pudiendo detectarse mediante PCR cuantitativa la cual es la técnica diagnóstica más ampliamente empleada para el diagnóstico. En la actualidad no se dispone de vacunas ni antivirales específicos frente a Norovirus por lo que el tratamiento consiste principalmente en medidas de soporte siendo necesario en algunos casos ajustar el tratamiento inmunosupresor.
INFECCIONES POR PARÁSITOS
Las infecciones parasitarias son una complicación significativa pero subestimada en pacientes receptores de trasplantes de órganos sólidos [70]. En el contexto de inmunosupresión crónica, estos pacientes se vuelven susceptibles a una serie de parásitos que, si bien representan solo el 5% de los agentes patógenos humanos conocidos, pueden desencadenar síndromes clínicos graves. Estas infecciones se documentan con mayor frecuencia en países industrializados, debido a mejores sistemas de reporte clínico. Los parásitos pueden infectar al receptor por tres vías principales: Transmisión con el injerto o transfusión sanguínea; Reactivación de infecciones latentes; Adquisición de infecciones nuevas del ambiente.
Las infecciones parasitarias se presentan clínicamente bajo dos perfiles:
1.- Afectación clínica sistémica: incluye enfermedades por protozoos como Plasmodium (malaria), Leishmania, Trypanosoma (Chagas) y Toxoplasma gondii. Se manifiestan con fiebre, anemia y compromiso multiorgánico.
2.- Afectación clínica localizada: frecuentemente gastrointestinal, causado por protozoos como Cryptosporidium, Microsporidia y nematodos como Strongyloides o Ascaris. Puede progresar a formas diseminadas si no se tratan adecuadamente.
El diagnóstico requiere técnicas especializadas: detección directa del parásito en tejidos o fluidos (histología, cultivos, PCR), serologías y estudios de imagen, sobre todo en manifestaciones neurológicas. El tratamiento suele ser eficaz con antiparasitarios específicos o de amplio espectro, aunque la resistencia farmacológica representa un desafío creciente. En la (Tabla 4) se especifica el tratamiento de las principales infecciones por parásitos en los receptores de trasplante.