Evaluación del donante cadáver, preservación renal y donante a corazón parado
Palabras clave
Trasplante renal, evaluación donante cadáver, tiempo de isquemia, preservación renal, donante en parada cardiaca, diagnóstico muerte cerebral, isquemia caliente, isquemia fria, soluciones preservación
INTRODUCCIÓN
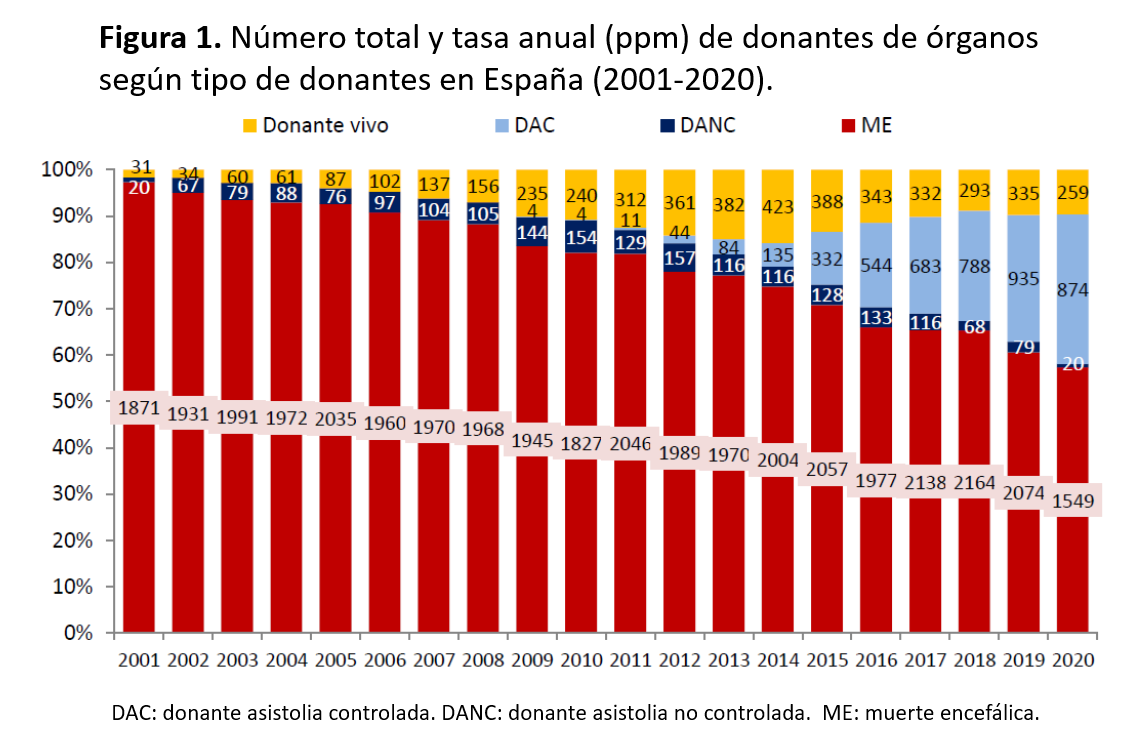
Actualmente, España es el país con la tasa más alta de trasplante renal de donante cadáver en el mundo, el segundo si tenemos en cuenta también el trasplante renal de donante vivo, con una tasa superior a los 50 por millón de población en 2020 a pesar de la pandemia SARS-Cov-2, gracias a la alta tasa de donación de órganos (41,2 donantes efectivos por millón de población en 2018, casi 40 en 2020). Así, en los últimos años el número de donantes ha ido aumentando progresivamente: 1335 donantes en 2001 y 2241 en 2018, cifras record, según datos de la Organización Nacional de Trasplantes [1], habiéndose enlentecido por el impacto de la pandemia por SARS-Cov-2. Los donantes cadáver son cada vez de mayor edad, con mayor afectación vascular y, en ocasiones, diabéticos, aspectos que dificultan el proceso de valoración y obligan a los clínicos a tomar decisiones acerca de la viabilidad de los órganos. Las limitaciones para incrementar el número de trasplantes a partir de donante cadáver clásico con corazón latiente han hecho que, en nuestro país, se haya incrementado el trasplante renal a partir de donantes a corazón parado y de donante vivo (directo, cruzado o ABO incompatible), ambos han presentado un notable incremento en los últimos años (Figura 1). En este capítulo nos centraremos en la obtención de órganos a partir de donante cadáver.
EVALUACIÓN DEL DONANTE CADÁVER
La identificación y selección de un donante cadáver es un procedimiento complejo y multidisciplinar que involucra varios equipos médicos, además de la infraestructura general del hospital, la ligada a aspectos forenses y jurídicos relacionados con la certificación de la muerte y el cumplimiento de las leyes y reglamentos de trasplante vigentes en cada país.
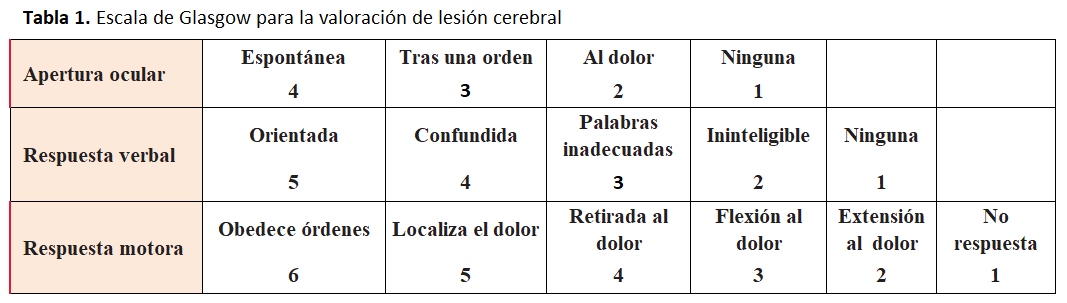
En general, son donantes todos aquellos cadáveres en situación de muerte cerebral por traumatismo craneoencefálico, accidente cerebrovascular, anoxia cerebral o tumores benignos no metastatizantes. Para la identificación y detección de donantes potenciales ayuda la valoración de la lesión cerebral según la Escala de Glasgow. Una puntuación de 6 ó menos orienta hacia la posibilidad de ser donante de órganos antes de que se establezca el diagnóstico de muerte cerebral (Tabla 1).
Diagnóstico de muerte cerebral
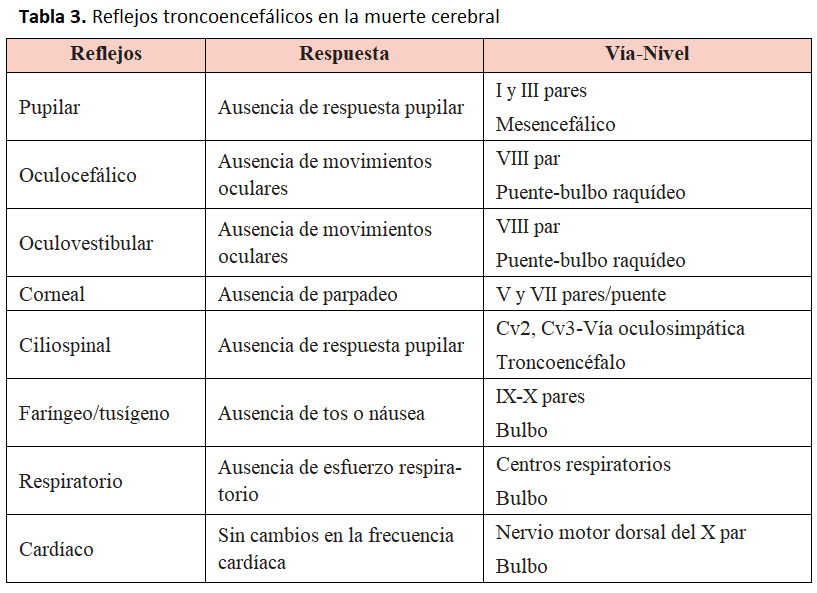
El diagnóstico de muerte cerebral debe ser establecido por médicos independientes del grupo de trasplantes para evitar un conflicto de intereses. Asimismo, se requiere la certeza de ausencia irreversible de función cerebral, que será confirmada con dos exploraciones neurológicas expertas, separadas por un intervalo de al menos 6 h, si se conoce la causa de la muerte, o de 24 h en caso de encefalopatía anóxica o desconocimiento de la causa de la muerte. En su defecto, puede ser válida una sola exploración neurológica más un electroencefalograma plano. En los niños se requieren dos exploraciones neurológicas y 2 electroencefalogramas con un intervalo de 24 h. Se puede substituir el electroencefalograma por la constatación de la ausencia de flujo cerebral mediante alguna prueba alternativa (potenciales evocados, gammagrafía cerebral, eco-Doppler cerebral, resonancia magnética cerebral, angioTAC o arteriografía cerebral). La ausencia de flujo sanguíneo cerebral es la manifestación más clara de muerte cerebral. En situaciones de impregnación barbitúrica u otros fármacos o drogas depresoras del sistema nervioso central, el diagnóstico de muerte cerebral debe establecerse también con una exploración clínica compatible, más alguna de las pruebas diagnósticas mencionadas que confirmen la ausencia de flujo cerebral. El electroencefalograma no es válido en esta situación. Los criterios clínicos de muerte cerebral se exponen en la (Tabla 2) y (Tabla 3).
Selección y valoración del donante
Los criterios de selección de un donante cadáver no son absolutos. Algunos son controvertidos y deben ser evaluados y discutidos sobre bases individuales, si bien siempre dentro de un contexto referencial amplio. En la medida en que se amplían los criterios de aceptación y se expande el grupo de donantes, se incrementan los denominados donantes expandidos o ampliados, susceptibles de deliberación clínica individualizada (Tabla 4).
Uno de los aspectos más relevantes para los grupos de trasplante es la consideración de la edad límite del donante cadáver, fundamentalmente por el incremento de la edad de éstos. Gracias a los buenos resultados de los programas de trasplante, la edad ha sido un factor que no ha cesado de incrementar con un techo que quizás no está todavía cerrado.
Los injertos de donantes pediátricos (= 6 años) tienen mayor probabilidad de presentar problemas técnicos. Además, el riesgo de hiperfiltración y glomerulosclerosis focal y segmentaria es mayor, principalmente si se ha sobreañadido toxicidad o rechazo. No obstante, algunos grupos obtienen buenos resultados con estos injertos, bien con el trasplante doble o en bloque de los 2 riñones a la vez, por lo que la aceptación de estos donantes depende de la experiencia del grupo trasplantador.
Cada vez son más habituales los donantes expandidos o con criterios ampliados: el donante con muerte por accidente vascular cerebral, con múltiples comorbilidades y de mayor edad, los donantes de 80 años o más, e incluso los donantes de menor edad con trastornos cardiovasculares, hipertensión o diabetes [2] [3] [4]. En general estos donantes deben ser objeto de una valoración muy cuidadosa. Inicialmente, algunos grupos recomendaban biopsiar estos injertos y rechazar aquellos con más de un 20% de glomerulosclerosis. Algunos grupos obtienen excelentes resultados con estos órganos, bien seleccionados y trasplantados a receptores adecuados, teniendo en cuenta su superficie corporal, edad y capacidad previsible de respuesta inmunológica al injerto, o incluso trasplantando ambos órganos al mismo receptor. Parece razonable realizar una valoración histológica de los riñones con criterios expandidos cuando el filtrado glomerular estimado es inferior a 60 ml/min/1.73m2. El “score” de la biopsia renal preimplantación tiene en cuenta las lesiones de cronicidad de los compartimentos glomerular, tubulointersticial y vascular. Sin embargo, la toma de decisiones basada en la histología no está validada, la interpretación de las lesiones tubulointersticiales puede ser difícil si no se realiza sobre muestras fijadas en parafina y puede desestimar riñones válidos para trasplante. De hecho, la interpretación de la biopsia suele ser la principal causa de descarte del riñón para trasplante. En muchos centros, la historia clínica del donante, la estimación de la función renal y la revisión exhaustiva del aspecto macroscópico del riñón suele ser suficiente para certificar la viabilidad del órgano. La histología se utilizaría en casos de filtrado glomerular límite, como un elemento más tener en cuenta. El uso de máquinas de preservación en hipotermia también puede ayudar a la toma de decisiones pues ofrece datos de resistencia vascular renal. Estos injertos procedentes de donantes expandidos suelen trasplantarse en receptores de baja demanda metabólica con estrategias tipo “old for old” en la que se recomienda no sobrepasar una diferencia de peso del 20% y de más de 15 años entre donante y receptor.
La neoplasia maligna es una contraindicación para la donación; aunque, algunos donantes con neoplasias que han superado 5 años libres de enfermedad, se pueden considerar como donantes. La excepción serían los donantes con neoplasias cerebrales primarias. En estos casos, debe realizarse un estudio histológico cerebral para confirmar este hecho y verificar que el tipo de tumor no se asocia a la posibilidad de metástasis fuera del sistema nervioso central. En el caso de donante mujer, en edad fértil y fallecida por hemorragia cerebral, debe descartarse la presencia de enfermedad trofoblástica susceptible de transmitir un coriocarcinoma. En general, debe solicitarse siempre un test de embarazo, incluso en donantes masculinos ante la posibilidad de tumores embrionarios productores de la hormona gonadotropina coriónica. Siempre que sea posible es recomendable introducir los marcadores tumorales disponibles en el centro, como antígeno especifico de próstata o antígeno carcinoembriogeno. La ONT ha elaborado un documento de consenso sobre donación y tumores (www.ont.es/infesp/Paginas/DocumentosdeConsenso.aspx) [5].
Otro tema importante, por el riesgo de transmisión, es la infección. Algunas infecciones contraindican el trasplante y otras requieren profilaxis adecuada en el receptor no inmunizado (p. ej., la infección por citomegalovirus). En el caso de los órganos procedentes de donantes con serología positiva al virus de la hepatitis C (VHC), y gracias a la aparición y gran efectividad de los nuevos fármacos antivirales, se esta empezando a aceptar la donación no sólo para pacientes VHC positivos sino también para pacientes VHC negativos. Según el documento de consenso de la ONT, en estos casos el paciente deberá firmar un consentimiento informado específico y conllevará un seguimiento exhaustivo de los receptores [5]. En cuanto a los donantes VHB, Existe controversia sobre la aceptación de órganos procedentes de donantes con antígeno de superficie para la hepatitis B (HBsAg) positivo. En general, los órganos procedentes de donantes con HBsAg positivo no son susceptibles de trasplante. No obstante, algunos centros los aceptan para receptores HBsAg positivos, siempre que la legislación lo permita y se descarte la existencia de antígeno delta en el donante. Los donantes con IgG HBcAc positiva, pero IgM negativa se pueden trasplantar en receptores también HBcAc positivos o con títulos protectores de HBsAc post-vacunación. Por último, el uso de donantes HIV+ para receptores HIV+ es una realidad en Estados Unidos y el estudio HOPE demostró buenos resultados al comparar la donación HIV D+/R+ vs D-/R+ [6]; por lo que es posible que esta sea una opción válida para ampliar el pool de donantes en los próximos años.
Las infecciones que complican los estadios finales del donante, tales como las relacionadas con el catéter urinario, una vía central o neumonitis con cultivos recientes negativos y, al menos, 24-48 h de tratamiento antibiótico, no excluyen a los donantes para trasplante. Tampoco deben excluirse los órganos en cuyo líquido de perfusión se obtenga un cultivo positivo para gérmenes habituales no virulentos de la flora cutánea. Por el contrario, se excluirán los órganos con cultivo en el líquido de perfusión positivo para Staphylococcus aureus, otros microorganismos gramnegativos u hongos.
Debido a los cambios demográficos experimentados recientemente en nuestro país, no es rara la valoración de donantes procedentes de otros países, que pueden presentar infecciones endémicas en su país de origen y que eventualmente podrían transmitirse al receptor, como la enfermedad de Chagas y la infección por el virus HTLV I y II. La ONT ha elaborado también un documento de consenso sobre donación e infección (www.ont.es/infesp/Paginas/DocumentosdeConsenso.aspx [5].
Mantenimiento del donante
El mantenimiento del donante está enfocado primordialmente a conseguir la perfusión óptima de los órganos y su correcta oxigenación. Para una adecuada perfusión se recomienda mantener una presión arterial sistólica superior a 90 mmHg, una presión venosa central (PVC) entre 10 y 12 cmH2O y una diuresis entre 100 y 300 ml/h. Si la expansión de volumen no corrige la presión arterial y la diuresis es escasa, ha de administrarse dopamina en dosis de 3-5 hasta 10 µg/kg/min. Si no es suficiente, puede asociarse entre 0,1 y 2 µg/kg/min de noradrenalina. Al revés que la dopamina, la noradrenalina está cada vez más extendida en el mantenimiento del donante ya que a dosis bajas permite optimizar la presión de perfusión de los órganos. Si pese a recuperar la presión arterial y la PVC el donante sigue oligúrico hay que añadir al tratamiento 100 mg de furosemida intravenosa o manitol al 20%. Si aparece hipernatremia asociada a poliuria debe considerarse la existencia de diabetes insípida o de glucosuria derivada de una diabetes mellitus. En este último caso, hay que añadir dosis horarias repetidas de insulina rápida. Si se trata de una diabetes insípida central, puede administrarse vasopresina (Minurin®) a razón de 50 U/h.
También es importante garantizar una buena oxigenación del donante de órganos. Para ello el hematocrito debe ser mayor del 30%, la presión parcial de oxígeno arterial de 70-100 mmHg, el pH debe mantenerse ajustado mediante aporte de bicarbonato y se debe controlar la presión parcial de CO2 arterial mediante ventilación apropiada.
La hipotermia interfiere en el mantenimiento del donante y puede llegar a causar bradicardia, acidosis y paro cardíaco per se. Es importante mantener la temperatura entre 35 y 37 °C mediante calentamiento de los líquidos que se van a infundir, mantas térmicas o inspiración de aire caliente. Para establecer el diagnostico de muerte encefálica es imprescindible que el cadáver tenga una temperatura superior a 35,5ºC.
Tiempo de isquemia caliente y fría
El incremento en el tiempo de isquemia caliente, que es el período entre el paro cardiocirculatorio del donante en quirófano y el comienzo del enfriamiento mediante soluciones de preservación, puede asociarse a una lesión tisular de mayor o menor gravedad (su reversibilidad sólo es predecible para períodos inferiores a 30-60 min) y necrosis tubular aguda. Con las técnicas actuales de extracción multiorgánica para cadáveres con latido cardíaco se puede minimizar a menos de 1 minuto.
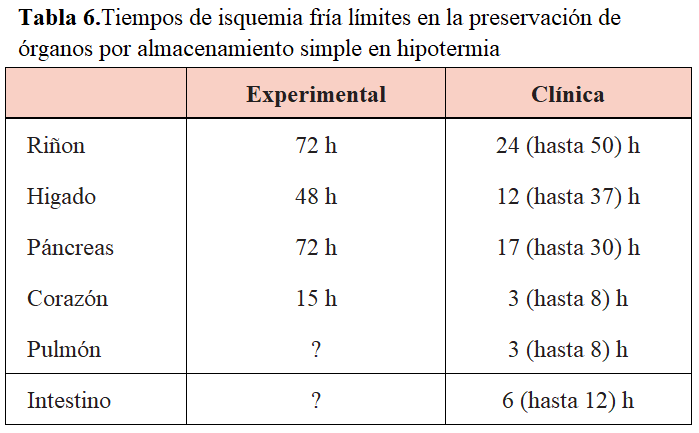
El tiempo de isquemia fría es el período transcurrido durante el almacenamiento en frío o con perfusión automatizada a 4 °C. Los métodos de preservación con almacenamiento hipotérmico estático o con máquina de perfusión son igualmente efectivos para tiempos de isquemia no superiores a 24 h, a partir de las cuales esta última parece más efectiva. Cuando se prolonga en exceso, más allá de 24 h, se correlaciona con retraso en la función inicial del injerto. Cabe destacar que en donantes con criterios ampliados es recomendable acortar cuanto sea posible el tiempo de isquemia fría (menor de 12 h).
Las máquinas de perfusión añaden costes al trasplante y son relativamente complejas, de ahí que la mayor parte de los grupos de trasplante opten por el almacenamiento en frío de los órganos con mantenimiento de tiempos de isquemia por debajo de las 24 h, siempre y cuando el riñón sea adecuado. Los dispositivos actuales (Lifeport®) son más autónomos y simplifican la logística y el coste de la preservación pulsátil.
PRESERVACIÓN RENAL
El desarrollo de soluciones de preservación en el trasplante de órganos sólidos ha mejorado los resultados en estos pacientes. La preservación de órganos sólidos se basa en exanguinar el órgano y reemplazar la sangre por una solución de preservación adecuada a temperatura de 4ºC. La composición de esta solución es un factor clave para optimizar la tolerancia del órgano a la hipotermia.
Principios de protección renal mediante soluciones de preservación
Todos los órganos mantenidos en preservación sufren cierto grado de lesión, generalmente reversible. El fundamento de la preservación es la hipotermia, que enlentece el catabolismo intracelular que conduce a la muerte de la célula [7] [8] [9] [10] [11] [12] [13]. La hipotermia permite prolongar en el tiempo de almacenamiento de los riñones. Asimismo, se precisa el lavado intravascular del órgano a una presión hidrostática baja que arrastre elementos formes, isoaglutininas y factores de la coagulación del árbol vascular. Para obtener un efecto protector óptimo, todos los compartimentos renales (vascular, extracelular y tubular) han de equilibrarse con el líquido. Esto se consigue en 10 ó 12 minutos de perfusión; se recomienda perfundir el riñón con un volumen 10 veces el peso renal. En la (Tabla 5) y (Tabla 6) se muestran los principios generales para la composición de las soluciones de preservación y el tiempo límite de isquemia fría de los diferentes órganos.
La situación de isquemia hipotérmica suprime la actividad de la bomba de Na/K-ATPasa. Con ello, el cloro y el sodio entran en la célula a través de un gradiente de concentración y la célula se edematiza. Para evitar esta situación, los líquidos de preservación tienen, en general, una baja concentración de sodio y alta de potasio (intracelular). Hoy día también se utilizan soluciones iónicas con composición extracelular, con buen resultado. Asimismo, contienen sustancias impermeables para la célula (impermeantes) a base de azúcares simples (glucosa, sucrosa, manitol), lactobionato y trisacáridos para mantener una osmolalidad similar al plasma (310 mOsm/kg).
La isquemia estimula la glucólisis y la glucogenólisis, generando acidosis tisular, la cual lesiona el metabolismo celular. Por tanto, las soluciones de preservación deben mantener el pH lo más fisiológico posible con sustancias tampón (bicarbonato, citrato, fosfato, lactobionato, histidina). Se recomienda que las soluciones de preservación contengan sustancias que aumenten la presión oncótica intravascular renal para evitar el edema intersticial y el colapso capilar. Históricamente se usaba albúmina. Hoy se utilizan derivados del almidón hidroxietílico (HES), aunque su elevada viscosidad en ocasiones produce una microperfusión heterogénea.
Los radicales libres liberados durante la isquemia fría y la reperfusión producen oxidación y lesión celular. Además, la producción de radicales libres supera la capacidad de extracción de los scavengers fisiológicos. Por tanto, la adición de sustancias scavenger exógenas (glutatión y manitol) potencialmente frenaría estas lesiones.
La isquemia fría produce pérdida de adenosintrifosfato (ATP) y de otros compuestos fosforados de alta energía, los cuales se necesitan para restaurar las vías metabólicas celulares tras la reperfusión
Soluciones de preservación
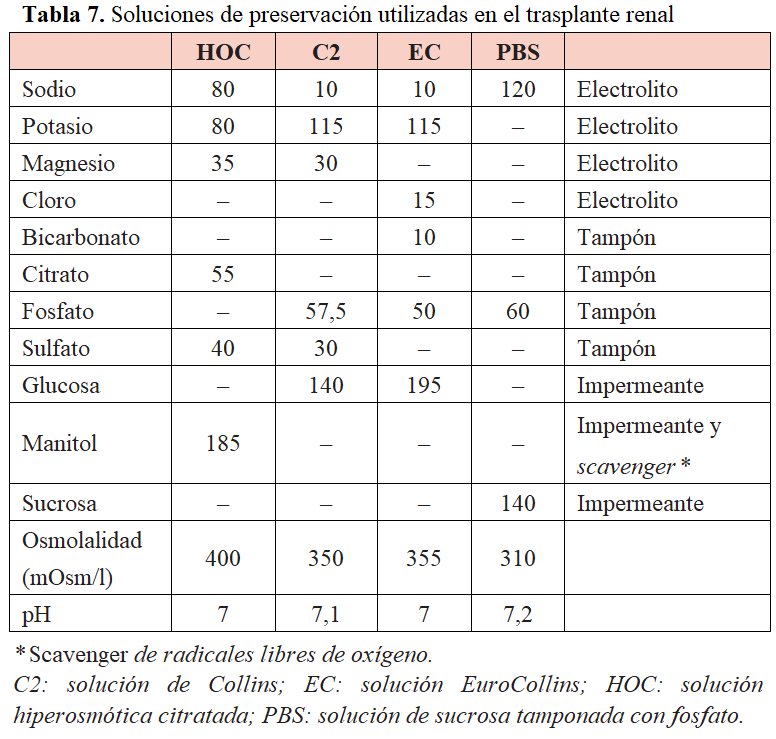
Las sustancias impermeantes son la base de la efectividad de las soluciones de preservación. En la (Tabla 7) se muestran algunas de las soluciones de preservación utilizadas en el trasplante renal. Es difícil establecer el grado de protección relativa que ofrecen los distintos líquidos de preservación debido a la gran variedad de factores que pueden influir en la aparición de necrosis tubular aguda. En general, las soluciones HOC, EC, PBS y M-400 fueron adecuadas para la preservación renal aislada.
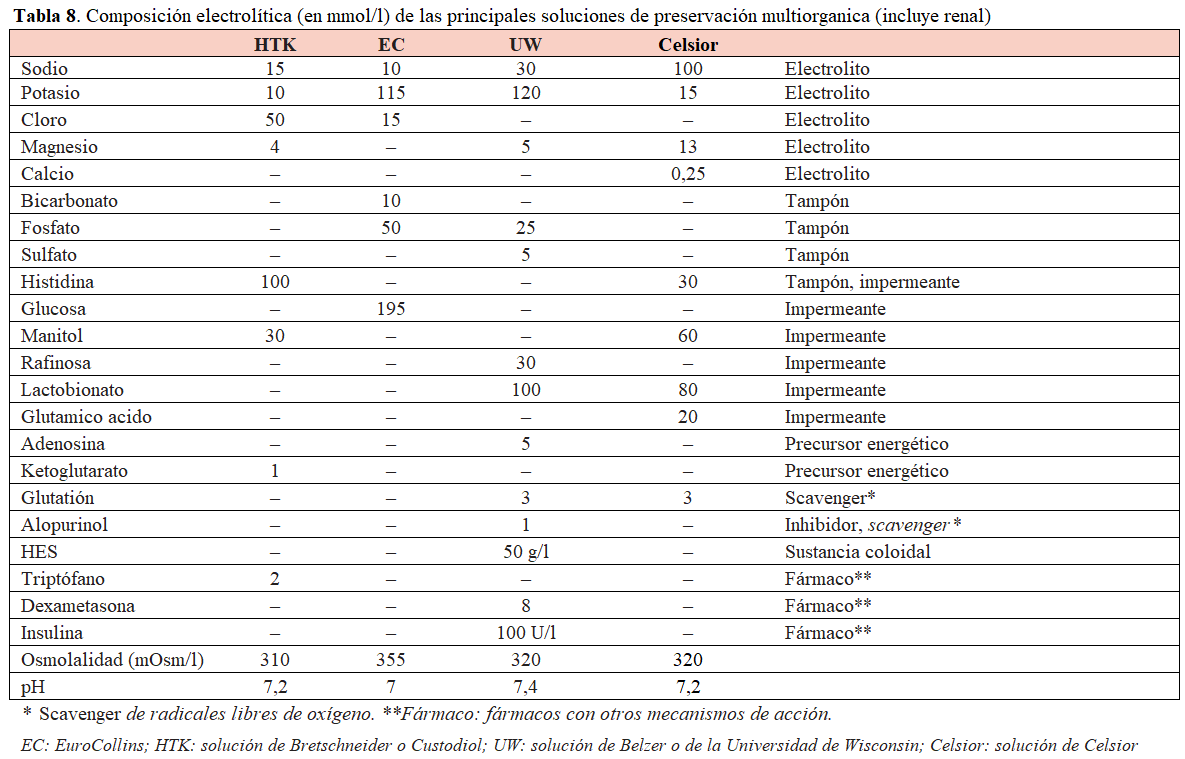
En la actualidad, la mayoría de los donantes son multiorgánicos, y se han desarrollado soluciones con mayor eficacia protectora. En la (Tabla 8) puede observarse la composición de algunas de ellas. La solución de la Universidad de Wisconsin (UW) o solución de Belzer ha mostrado una mayor reducción en la tasa de necrosis tubular aguda frente al EuroCollins, especialmente para una isquemia fría prolongada (> 24 h). La UW ha sido la más utilizada y, junto con el uso de la ciclosporina, fueron la base del éxito actual del trasplante de órgano sólido. Más recientemente se introdujo Celsior, una solución que aúna las ventajas de la HTK y la UW. Sus ventajas principales son que es menos viscosa que la UW y dispone de tampón histidina como la HTK. Celsior se ha mostrado eficaz también en la preservación de órganos, con una tasa de insuficiencia renal similar a la UW.
Métodos de enfriamiento. Perfusión en máquina
En la extracción multiorgánica en el donante a corazón latiente se canula la aorta abdominal y la vena porta. Se infunde aproximadamente 3.000 ml de solución de preservación a 4 °C por la cánula aórtica y 1.000 ml por la cánula portal. Tras la extracción del paquete visceral, se procede a la separación de cada uno de los riñones perfundiendo una cantidad adicional de solución de preservación.
En las extracciones renales aisladas, se canula la aorta abdominal a nivel infrarrenal, se clampa la aorta por encima de las arterias renales y se perfunden en bloque ambos riñones. Paralelamente se realiza la apertura de la vena cava para la exanguinación y drenaje de la solución restante. Generalmente se utilizan 2.000 ml de solución de EuroCollins o de Celsior, perfundidas en las mismas condiciones que en las extracciones multiviscerales.
Una vez extraídos los riñones se almacenan en frío a 4 °C. La perfusión con máquina permite una preservación más prolongada y más efectiva debido al aporte continuo de oxígeno y sustratos para la síntesis de ATP y otros metabolitos [14] [15]. También facilita el lavado continuo de los desechos del metabolismo celular. Esta técnica parece permitir preservaciones en frío más prolongadas, con una clara reducción de la tasa de necrosis tubular aguda. En la actualidad, la introducción de aparataje absolutamente automatizado y transportable ha mejorado las técnicas de perfusión en frío (LifePort®) e incluso se han introducido dispositivos de perfusión normotérmica.
DONANTE TRAS MUERTE POR PARADA CARDIOCIRCULATORIA
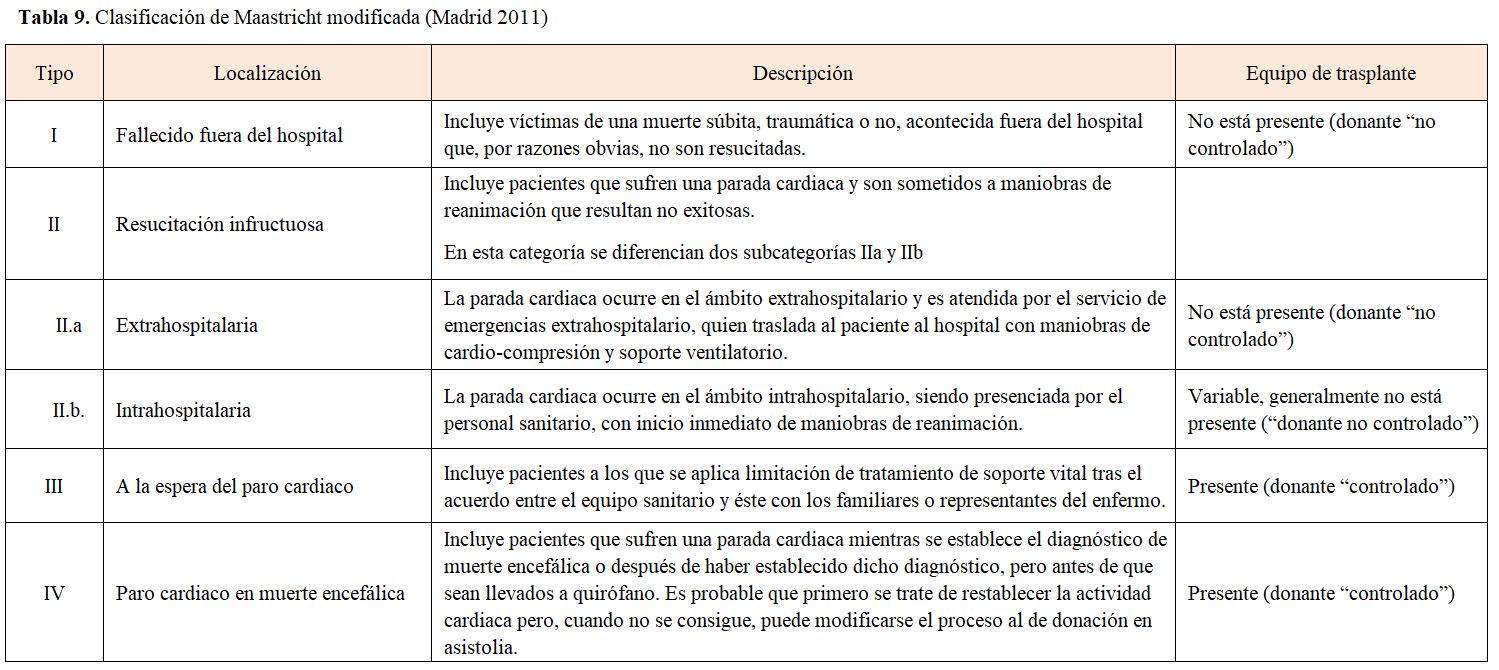
Son sujetos que fallecen por pérdida irreversible de la función circulatoria y que cumplen condiciones generales para ser donantes. En 1995, tras una reunión de consenso en Maastricht se describieron 4 tipos de donantes en parada cardiocirculatoria dependiendo de sus características [16]. Sin embargo, debido a que esa clasificación no capta con precisión y claridad la realidad del tipo de donante en parada cardiocirculatoria llevada a cabo en España de manera mayoritaria, se consideró necesario consensuar la clasificación de los donantes desarrollándose la clasificación de Maastricht modificada (Madrid 2011) que se presenta en la (Tabla 9) [17].
MUERTE POR CRITERIOS CARDIORRESPIRATORIOS
A la hora de diagnosticar la muerte por criterios cardiorrespiratorios, es importante determinar qué se entiende por pérdida irreversible y cómo se constata el cese de la función cardiorrespiratoria.
En el ámbito de los donantes tipo I y II, la irreversibilidad viene determinada por la imposibilidad de restaurar la función cardiorrespiratoria tras la aplicación de maniobras de RCP avanzada durante el tiempo y atendiendo a las pautas establecidas en los protocolos de actuación desarrollados por las sociedades profesionales competentes. En el caso de los donantes tipo III son pacientes, sin contraindicaciones aparentes para la donación en los que, por su patología de ingreso y su evolución posterior, se ha decidido conjuntamente con la familia la limitación del soporte vital y en los que se espera que, tras la retirada de estas medidas, se produzca la parada cardiocirculatoria dentro de un periodo de tiempo que sea compatible con la donación de órganos. La decisión de la limitación del soporte vital siempre debe preceder y debe ser independiente de la donación de órganos [17].
La condición de irreversibilidad también exige respetar un periodo de observación sin maniobras de cardiocompresión y ventilación mecánica durante el cual se constate el cese de la función cardiorrespiratoria para asegurar que no puede producirse el fenómeno de autorresucitación. En nuestro país, el RD 2070/1999 no diferencia específicamente entre los donantes controlados y no controlados, siendo el periodo de observación a aplicar en ambas se establece en 5 minutos.
A efectos prácticos, discutiremos los donantes según la presencia o no del equipo trasplantador, es decir si son o no controlados.
TECNICAS DE PRESERVACIÓN
El principal problema que aparece con estos donantes es que tras el paro cardiaco se produce una lesión isquémica irreversible que llevaría a la inviabilidad de los órganos a no ser que se emplee algún método de preservación hasta que éstos sean extraídos.
Para los donantes en asistolia controlada (DAC) existen cuatro métodos de preservación y extracción que de menor a mayor complejidad son: a) Técnica de extracción de órganos super rápida, sin ninguna medida de preservación previa; b) Canulación de arteria y vena femorales, premortem o postmortem, con perfusión fría in situ a través de cánula arterial estándar; c) Canulación de arteria y vena femorales premortem, y perfusión fría in situ a través de un catéter de doble balón y triple luz; d) Canulación premortem y preservación con oxigenación de membrana extracorpórea (ECMO). Hasta ahora, la mayoría de los equipos de trasplante se decantaban por la cirugía rápida, con menores costes e infraestructura. Sin embargo, estudios recientes parecen demostrar que, con el uso de la ECMO, se puede incrementar el porcentaje de órganos válidos para trasplante por cada donante [18].
La técnica de perfusión del órgano más usada en la donación en asistolia no controlada (DANC) es la perfusión regional extracorpórea en normotermia o hipotermia, con obtención de buenos resultados en ambos casos [19] [20]. Para ello, se canulan la arteria y la vena femorales y se conecta al sistema de circulación extracorpórea, que lleva un oxigenador de membrana y un intercambiador de temperatura (ECMO). A través de la arteria femoral contralateral se coloca un balón de Fogarty para la interrupción de flujo por encima del nivel de la arteria mesentérica superior.
Una vez extraídos los riñones se manejan igual que los de los donantes en muerte encefálica. Respecto a los métodos de preservación ex vivo, el uso de máquina de perfusión pulsátil para el mantenimiento ha mostrado resultados contradictorios en la literatura.
TIEMPO DE ISQUEMIA CALIENTE
Un aspecto muy importante a la hora de poder predecir la viabilidad de estos órganos es la monitorización exhaustiva de la isquemia caliente. En el donante no controlado (DANC) el tiempo de isquemia caliente se contabiliza desde que se produce la parada cardiaca hasta que se inicia la perfusión del órgano. En el donante controlado (DAC) el tiempo de isquemia caliente se mide desde que se retira el soporte vital hasta la perfusión del órgano. Sin embargo, lo realmente relevante es el tiempo de isquemia caliente funcional cuyo marcador de inicio es el primer episodio en el que se registra una tensión arterial sistólica (TAS) =60 mmHg determinada por monitorización arterial invasiva y/o una saturación arterial de oxígeno (SatO2) =80 % determinada por pulsioximetría [17]. El momento final sería el inicio de la perfusión del órgano. Otros estudios son más permisivos y ponen los límites de TAS en 50 mmHg y de SatO2 en 70 % [21].
CRITERIOS DE ACEPTACIÓN DEL DONANTE
Además de cumplir los criterios aplicables a los donantes en muerte cerebral, los donantes en parada cardiocirculatoria deben de cumplir otra serie de criterios.
DONANTES CONTROLADOS
Respecto a la edad del donante, no hay un límite absoluto claro. La ONT estableció en el documento de consenso los 65 años, indicando que esto debía estar sometido a valoración individual y podría reevaluarse a medida que se fuera adquiriendo experiencia. Actualmente se están utilizando donantes por encima de esa edad tras valoración rigurosa por parte del equipo trasplantador [17].
Debido a la importancia del tiempo trascurrido entre la extubación y la parada cardiocirculatoria en a la evolución del órgano trasplantado, se establecen límites en su duración para considerar válido al donante. En el documento de consenso de Madrid [17] se recomienda que la duración total desde la extubación a la parada cardiocirculatoria, no sea superior a 2 horas. Sin embargo, más importante son las condiciones hemodinámicas o respiratorias del paciente y el conocimiento del tiempo de hipoperfusión significativa. Para ello se utiliza el tiempo de isquemia caliente funcional cuyo límite superior establecen en 40 minutos la mayor parte de las unidades.
DONACIÓN NO CONTROLADA
Los criterios varían de unas unidades a otras pero en general son los siguientes:
1. Es totalmente imprescindible el conocimiento de la hora real de la parada cardiaca. Si ésta no es presenciada no debe aceptarse al donante.
2. La instauración del masaje cardiaco externo y la ventilación asistida debe realizarse en menos de 15 minutos desde la parada y si esta se produce fuera del hospital, el traslado al centro del sujeto debe realizarse manteniendo masaje cardiaco, ventilación asistida y perfusión de líquidos.
3. Tiempo de isquemia caliente menor o igual a 150 minutos.
4. Tiempo de derivación cardiopulmonar menor o igual a 4 horas.
5. Edad del donante: varía entre centros, estando el límite inferior entre 5-18 años y el superior entre 55-60 años, aunque se puede ser flexible en este punto valorando otros criterios como tiempo de parada, isquemia caliente, características del donante, etc.
6. Ausencia de lesiones sangrantes en abdomen para evitar fugas posteriores en el sistema de circulación extracorpórea.
OTRAS CONSIDERACIONES
En el donante no controlado se han definido diferentes factores pronósticos de no viabilidad de estos órganos como son sujetos fallecidos por traumatismo o por tromboembolismo pulmonar [22], edad superior a 60 años [23] tiempo de resucitación cardiopulmonar extrahospitalaria ≥ 75 minutos [22], tiempo de resucitación cardiopulmonar intrahospitalaria ≥ 50 minutos [22], tiempo total de isquemia caliente ≥ 130 minutos [23] y perfusión in situ como técnica de preservación [23].
Otro aspecto importante puede ser reducir, en la medida de lo posible, la isquemia fría. Existe consenso en que la larga isquemia fría se asocia con mayor riesgo de retraso en la función renal del injerto [24] [25]; sin embargo, su impacto sobre la viabilidad del injerto no está claro, hablando unos estudios de mayor incidencia de injertos no viables y otros, no [24].
Un factor adicional a la hora de no aumentar el impacto del efecto deletéreo que la isquemia, fundamentalmente la caliente, puede tener sobre el futuro del órgano es valorar cuidadosamente otras comorbilidades asociadas en el donante, como diabetes, hipertensión, enfermedad arterial periférica y edad, que pueden amplificar ese daño isquémico. Además siempre será beneficioso implementar distintas medidas premortem (como puedan ser uso de heparina, vasodilatadores, etc.), identificación temprana del donante, reducir tiempos de tipificación HLA, etc .