Disfunción Crónica Tardía del Trasplante Renal
Palabras clave
Trasplante renal, disfunción crónica, humoral, factores de riesgo, tratamiento, células T, recidiva enfermedad de base, calcineurina, hipertensión, diagnóstico, tratamiento
INTRODUCCIÓN
La disfunción crónica del injerto se define, desde el punto de vista clínico, como el deterioro lento y progresivo de la función renal. Habitualmente se acompaña de proteinuria de grado variable e hipertensión. La causa más frecuente es el rechazo humoral crónico activo [1]. En un porcentaje variable de pacientes, la causa de la disfunción crónica no siempre es evidente desde el punto de vista histológico. Estos pacientes presentan lesiones tubulointersticiales crónicas [2] que muchas veces se acompañan de un grado variable de inflamación intersticial. En el documento de Banff que resume el congreso de 2017 se definió el rechazo celular crónico activo, como la presencia de inflamación en las áreas de fibrosis intersticial y la presencia de tubulitis [3]. Otras causas comunes de disfunción crónica son la recidiva de la enfermedad primaria y las glomerulonefritis de novo.
Desde el punto de vista epidemiológico, la edad del donante, la función retardada del injerto, los antecedentes de rechazo agudo, la nefrotoxicidad por anticalcineurínicos, la hipertensión arterial y la diabetes se asocian a un riesgo aumentado de disfunción crónica. El diagnóstico de la disfunción crónica requiere la realización de una biopsia del aloinjerto renal.
EVOLUCIÓN DE LA CLASIFICACIÓN DE LA PATOLOGÍA CRÓNICA
En la primera reunión del grupo de Banff del año 1991 se decidió abandonar el término «rechazo crónico» y se introdujo el de «nefropatía crónica del trasplante» para referirse a la presencia de fibrosis intersticial y atrofia tubular. Esta decisión se justificó en aquel momento con el argumento siguiente: el término rechazo crónico sugiere que la única causa de disfunción crónica es el daño dependiente de la respuesta aloinmune. En aquel entonces se sabía que otros factores como la edad del donante, las infecciones y la nefrotoxicidad por fármacos que no dependen de la respuesta aloinmune, también contribuían a la lesión renal crónica [4]. El término nefropatía crónica del trasplante fue adoptado rápidamente por la comunidad de trasplante, pero, paulatinamente, fue utilizándose de forma inadecuada. Algunos autores utilizaban este término como si se tratase de una enfermedad específica y otros para referirse a la disfunción renal. Finalmente, el término «nefropatía crónica del trasplante» que se refería a lesiones inespecíficas fue abandonado.
RECHAZO CRÓNICO ACTIVO MEDIADO POR ANTICUERPOS
El conocimiento acerca de los mecanismos que contribuyen a la lesión renal evolucionó durante la década de los 90 gracias a la caracterización del papel de la respuesta humoral. En el primer documento de Banff ya se hace referencia al rechazo humoral hiperagudo por anticuerpos preexistentes en el receptor [4]. En 1997, se reconoce una forma retardada de rechazo mediado por anticuerpos que se denominó "rechazo agudo o acelerado" [5].
En el año 2003 [6], el grupo de Banff introdujo un cambio trascendental en la clasificación, el rechazo agudo mediado por anticuerpos, que se definió como: a.) la presencia de lesiones histológicas sugestivas (lesiones de necrosis tubular aguda, glomerulitis y necrosis arterial transmural), b.) El depósito de la fracción del complemento C4d y c.) La presencia de anticuerpos donante específicos (DSA). En el año 2005 [7], se definió el rechazo crónico mediado por anticuerpos de forma similar mediante tres criterios: a.) lesiones sugestivas (glomerulopatía del trasplante, reduplicación de las membranas de los capilares tubulares, fibrosis intersticial/ atrofia tubular y engrosamiento de la íntima), b.) C4d positivo y c.) DSA.
Durante los últimos años la definición de rechazo humoral ha ido evolucionando. En 2009, se introdujo el concepto de sospecha de rechazo crónico activo en los pacientes en los que la tinción de C4d o la determinación de DSA eran negativos [8]. En 2013 se definió el rechazo humoral con C4d negativo [9]. Los criterios de la clasificación del rechazo humoral crónico activo se revisaron en las reuniones de 2017 y 2019 y se resumen en la (Tabla 1) [3].
La modificación constante de la definición del rechazo humoral crónico activo ha creado dificultades en su diagnóstico. El requerimiento de la evaluación mediante microscopía electrónica en todos los casos para determinar la multilaminación de los capilares peritubulares no está disponible en todos los hospitales. La utilización de técnicas basadas en micro matrices de RNA tampoco está disponible en la práctica clínica en la mayoría de los centros. Por otra parte, estos cambios de criterio han dificultado la realización de estudios epidemiológicos que permitan conocer la historia natural de la enfermedad y estratificar adecuadamente a los pacientes en función de la probabilidad de pérdida del injerto.
FACTORES DE RIESGO ASOCIADOS AL RECHAZO CRONICO MEDIADO POR ANTICUERPOS ACTIVO
Los pacientes con anticuerpos donante-específicos que han recibido un tratamiento de desensibilización tienen un riesgo incrementado de padecer un rechazo humoral activo o crónico activo. En los pacientes sin anticuerpos, los factores asociados a la aparición de anticuerpos "de novo" son: el grado de histocompatibilidad, tanto a nivel alélico como molecular, entre donante y receptor, la presencia de inflamación subclínica diagnosticada mediante una biopsia de protocolo, la presencia de un episodio de rechazo celular, la exposición inadecuada a los fármacos inmunosupresores ya sea por falta de cumplimiento con el tratamiento inmunosupresor o por la utilización de políticas de minimización de los anticalcineurínicos. Las características de los anticuerpos donante específicos tales como la intensidad de fluorescencia máxima, la capacidad de fijación de C1q o C3d o el tipo de inmunoglobulina también se asocian al riego de pérdida del injerto [10] [11] [12] [13] [14]. En un estudio de biopsias de protocolo realizadas al año del trasplante, se ha descrito que la presencia de signos de rechazo activo humoral se asocia a la aparición posterior de glomerulopatía del trasplante y a un riesgo incrementado de pérdida del injerto [15].
TRATAMIENTO DEL RECHAZO CRONICO MEDIADO POR ANTICUERPOS ACTIVO
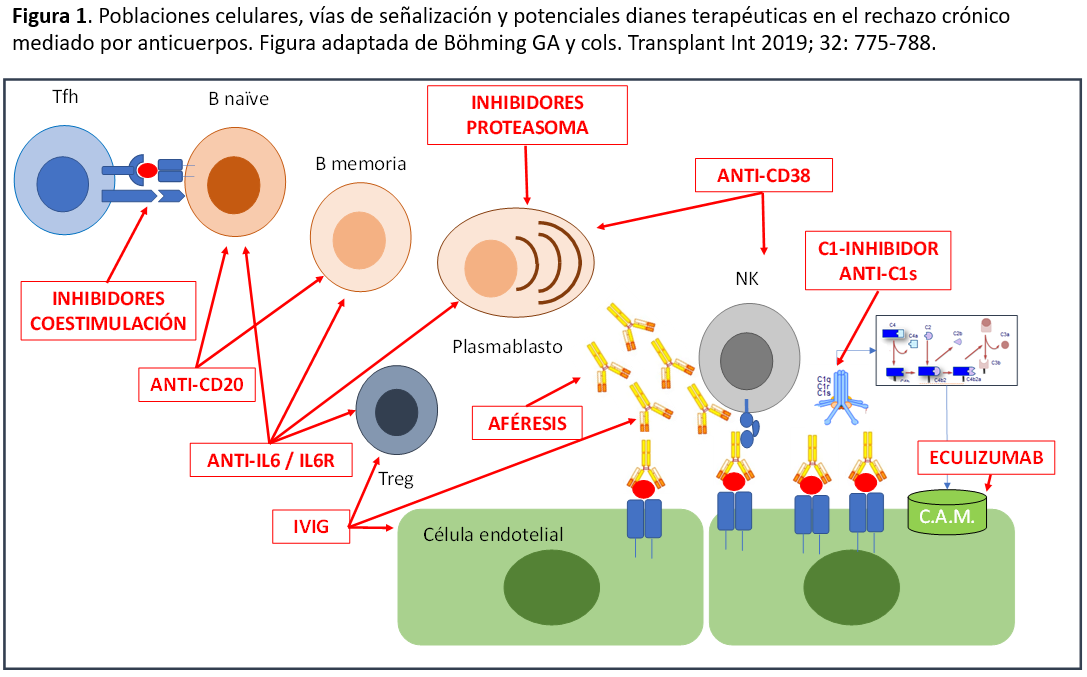
No se ha demostrado hasta la fecha la eficacia de ningún tratamiento para el rechazo humoral crónico activo en ensayos clínicos bien diseñados. Algunos estudios no controlados realizados durante los primeros años de este milenio sugirieron que el tratamiento con inmunoglobulina humana endovenosa y rituximab podía disminuir la tasa de pérdida de filtrado glomerular en los pacientes con rechazo humoral crónico activo [16] y en algunos centros, este tratamiento se convirtió en el tratamiento habitual. También se ha observado en un estudio retrospectivo, que el mantenimiento de niveles elevados de tacrolimus retrasa la pérdida del injerto en estos pacientes [17]. Afortunadamente, desde 2018 han aparecido en la literatura los resultados de diversos ensayos clínicos que han evaluado su utilidad en el tratamiento de esta entidad. El primer estudio prospectivo, aleatorizado, controlado con placebo no mostró ningún efecto beneficioso de la combinación de inmunoglobulinas y rituximab [18]. En otro ensayo clínico, no se pudo observar ningún efecto beneficioso del tratamiento con bortezominb [19]. Por lo tanto, existe un gran interés en el desarrollo de nuevos tratamientos con la finalidad de mejorar el pronóstico en los pacientes con rechazo humoral crónico activo. En la (Figura 1) se resumen las vías de señalización y las poblaciones celulares más relevantes, así como sus potenciales dianas terapéuticas. Entre los nuevos tratamientos en fase de desarrollo se encuentran los anticuerpos monoclonales anti-CD38 desarrollados para el tratamiento del mieloma múltiple como el daratumumab [20]), el inhibidor de la fracción C5 del complemento eculizumab [21], el C1 inhibidor [22], lo anticuerpos monoclonales contra C1s [23] y fármacos que interfieren en la vía de señalización interleucina 6 (IL-6) y su receptor (IL-6R). En 2017, se reportó la primera serie de casos (n=36) que mostró que el tratamiento con tocilizumab (anticuerpo monoclonal contra IL-6R) se asociaba a una reducción de los DSAs y a una estabilización de la función renal a los 2 años [24]. Posteriormente, un ensayo clínico prospectivo, aleatorizado, incluyó 20 pacientes con diagnóstico de rechazo crónico humoral más allá del primer año postrasplante. El tratamiento con clazakizumab (anticuerpo monoclonal contra IL-6) mostró una disminución de la pendiente de pérdida de función renal a los 3 meses, una disminución del nivel de los DSAs, una mejora en las alteraciones histológicas en las biopsias realizadas a 1 año y una modulación de los transcritos relacionados con rechazo [25]. Debe destacarse que el tratamiento de asoció con toxicidades infecciosas graves y con enfermedad diverticular intestinal complicada. Una revisión reciente sobre los casos tratados con tocilizumab concluyó que este tratamiento se asocia con una reducción de los DSAs, una disminución de la inflamación microvascular y una estabilización de la función renal [26]. Sin embargo, dado que otros estudios no han podido confirmar estos resultados prometedores [27], nos hallamos a la espera de los resultados de un ensayo clínico en fase III con clazakizumab (estudio IMAGINE, NCT 03744910). Finalmente, el tratamiento con belatacept en una serie de casos de conversión tardía (19 pacientes convertidos a los 44 meses de media) tratados con inhibidores de la calcineurina se asoció a una estabilización de la función renal y a una disminución en la expresión de transcritos relacionados con rechazo crónico mediado por anticuerpos [28]. Así pues, podemos esperar que durante los próximos años dispondremos de los resultados de múltiples ensayos clínicos diseñados para el tratamiento de esta entidad [29].
RECHAZO CRONICO MEDIADO POR CELULAS T
En la actualización del congreso de Banff de 2007, ya se mencionaba por primera vez la existencia de una forma de rechazo celular crónico mediado por células T que se definía como la presencia de fibrosis intimal con infiltración por células mononucleares de la neoíntima [7].
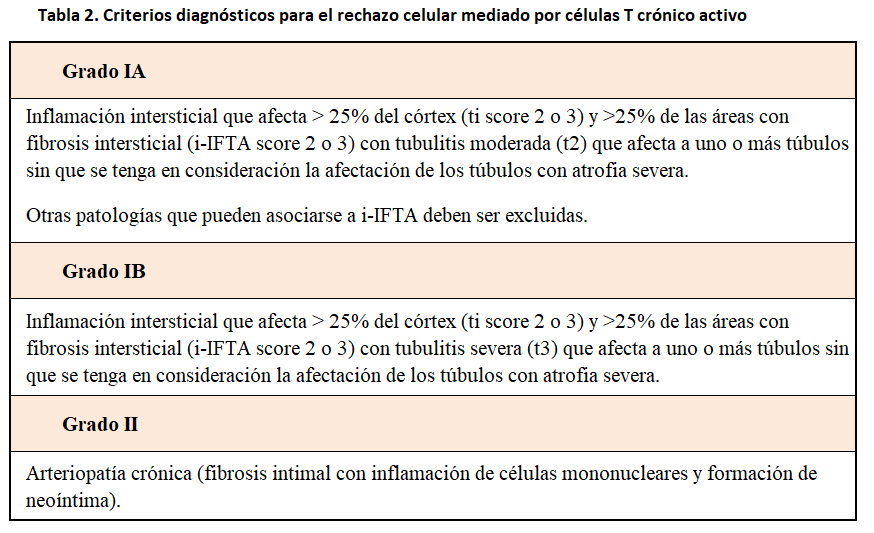
En un estudio realizado en biopsias por indicación, se describió que la presencia de células inflamatorias en las áreas de fibrosis intersticial y la presencia de tubulitis en túbulos atróficos se asociaba a una disminución de la supervivencia del injerto [30]. Posteriormente, dos trabajos independientes demostraron que la inflamación en áreas de fibrosis intersticial, especialmente cuando esta afectaba a > 25% de las áreas de fibrosis y se acompañaba de tubulitis moderada o severa, se asociaba a una disminución de la supervivencia del injerto [31] [32]. Este fenotipo histológico se asocia a la presencia de un episodio previo de rechazo celular agudo y a la utilización de una inmunosupresión insuficiente. Teniendo en cuenta estas observaciones, en el congreso de Banff de 2017, se definieron los criterios diagnósticos del rechazo celular crónico activo mediado por células T, tal como se describe en la (Tabla 2).
Aunque no se han realizado estudios controlados, para valorar el efecto de distintos tratamientos sobre el rechazo celular crónico, los datos disponibles sugieren que en estos pacientes deben mantenerse una inmunosupresión adecuada, con niveles de tacrolimus en rango terapéutico, asociados a micofenolato mofetilo y prednisona.
FIBROSIS INTERSTICIAL Y ATROFIA TUBULAR
En una proporción variable de pacientes con deterioro lento y progresivo de la función renal la biopsia muestra la presencia de fibrosis intersticial y atrofia tubular sin que se pueda especificar mejor el diagnóstico. En muchos de estos casos, la fibrosis intersticial y atrofia tubular se acompañan de cierto grado de inflamación tubulointersticial en áreas sanas o áreas de fibrosis sin superar el umbral que define el rechazo celular agudo o crónico.
RECIDIVA DE LA ENFERMEDAD DE BASE
Las enfermedades glomerulares y sistémicas constituyen una de las primeras causas de enfermedad renal crónica terminal en la mayor parte de registros de enfermos renales en tratamiento sustitutivo. En el Registro Español de Enfermos Renales de 2017, el 12.8% de los pacientes incidentes tenía una enfermedad glomerular y el 6.9% una enfermedad sistémica. A estos debe añadirse que una parte significativa de los pacientes con enfermedad renal de etiología no filiada pueden tener una enfermedad glomerular no diagnosticada. Por lo tanto, la recidiva de la enfermedad original va a ser una causa relevante de deterioro y fracaso del injerto. De hecho, es la tercera causa de fracaso del injerto tras la muerte del paciente con injerto funcionante y el rechazo crónico mediado por anticuerpos [1].
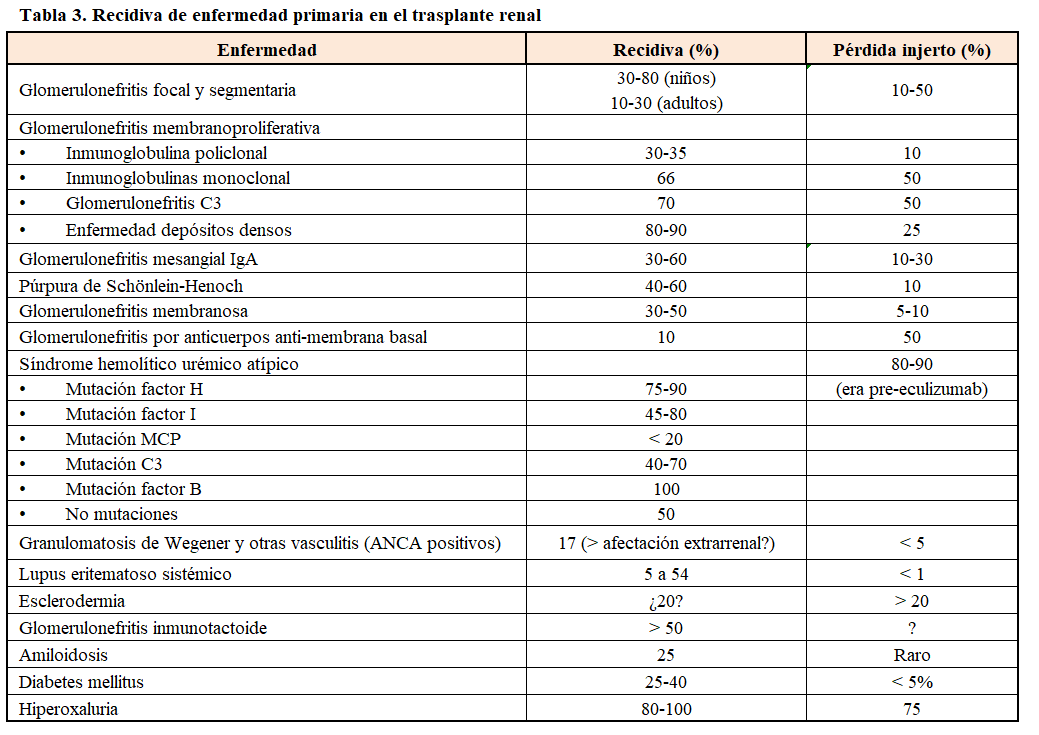
El diagnóstico de recidiva de la enfermedad de base requiere la misma caracterización histológica en el riñón nativo y en el riñón trasplantado y existen en la literatura amplias revisiones sobre este tópico [33] [34] [35] [36] [37]. Su incidencia (Tabla 3) es variable y depende del tipo de enfermedad primaria, del tiempo de evolución postrasplante (a mayor tiempo de evolución mayor probabilidad de recidiva) y de la política de biopsias de cada centro. Durante los últimos años se ha demostrado que la incidencia de recidiva es mayor y que el diagnóstico se puede realizar más precozmente mediante biopsias de protocolo realizadas durante los primeros años postrasplante [35]. Las consecuencias sobre el injerto fueron minimizadas durante años, pero estudios de registro recientes demuestran que los pacientes con diversas glomerulopatías primarias presentan un mayor riesgo de pérdida del injerto a corto, medio y largo plazo [35] [36] [37]. Las manifestaciones clínicas características son difíciles de separar de otras complicaciones del trasplante renal, pero un cociente proteína/creatinina en orina superior a 1 g/g y la presencia de un sedimento activo deben ser datos de sospecha en pacientes con el antecedente de insuficiencia renal por glomerulonefritis. En la (Tabla 3) se resumen las tasas de recidiva de distintas enfermedades glomerulares, así como el porcentaje de casos en que la enfermedad de base puede conducir al fracaso del injerto.
Glomerulonefritis focal y segmentaria
La glomerulonefritis focal y segmentaria (GNFS) se define por cambios característicos en el glomérulo observados en los estudios mediante microscopia óptica. Se clasifica como GNFS de base genética, primaria idiopática y secundaria a diversas entidades. En la patogenia de GNFS primaria idiopática se ha involucrado la presencia de diversos factores circulantes que modifican la permeabilidad glomerular y que conducen a una lesión progresiva de los podocitos con fusión de sus pedicelos. El mayor riesgo de recidiva se da en pacientes pediátricos (hasta el 80%) y jóvenes. La evolución rápida de la enfermedad hacia la insuficiencia renal crónica terminal (menos de 3 años), la proliferación mesangial en la biopsia y la recidiva en un trasplante previo son factores de riesgo asociados a una alta probabilidad de recidiva de la enfermedad. Otros factores de riesgo son el uso de terapia de inducción con sueros antilinfocitarios y la raza del paciente, siendo más frecuente la recidiva en pacientes de raza negra. La enfermedad en muchos casos se manifiesta en el postrasplante inmediato con proteinuria masiva y disfunción del injerto. En estos casos la microscopía óptica es inespecífica y el diagnóstico debe realizarse mediante estudio ultraestructural. La recidiva precoz se asocia con mayor frecuencia a función retrasada del injerto y rechazo agudo. Para su tratamiento se han utilizado diversas combinaciones que contienen corticoesteroides, plasmaféresis o inmunoadsorción, ciclosporina, ciclofosfamida y rituximab. Aunque se ha descrito una tasa de remisión del 90% combinando tratamiento con corticoides a altas dosis, plasmaféresis periódica y ciclosporina [38], otros grupos no han podido reproducir estos resultados y han añadido que estos tratamientos no están exentos de toxicidad [39]. El uso de inhibidores de la enzima de conversión de la angiotensina (IECA) y antiinflamatorios no esteroideos (AINE) pueden ayudar a controlar la proteinuria. El trasplante de donante vivo, que había sido desaconsejado en estas situaciones, presenta una menor pérdida de injertos por recidiva que el de cadáver, por lo que su indicación ha de valorarse en función de la situación del paciente.
Las formas familiares asociadas a diversas mutaciones genéticas en las proteínas del diafragma de filtración tienen menos riesgo de recidiva, pero durante los últimos años se ha descrito una elevada tasa de recidiva (38%) en los pacientes que tienen mutaciones en el gen de la podocina NPHS2 [40].
Glomerulonefritis membranoproliferativa (GNMP)
Durante los últimos años se ha alcanzado un grado de compresión mucho mayor de los distintos mecanismos que conducen a la aparición de este patrón histológico y ello ha permitido modificar la clasificación de esta entidad y caracterizar de forma más adecuada el riesgo de recidiva postrasplantey las posibilidades de tratamiento. Según datos de la Clínica Mayo [35], en los pacientes trasplantados, alrededor de ¾ partes presentan una GNMP con depósitos de inmunoglobulinas (Igs) y complemento (C), la mitad de ellos con depósito de Ig policlonal y la otra mitad con Ig monoclonal. El ¼ restante presenta un depósito predominante de C3 (glomerulopatía C3), siendo en la mayoría de los casos glomerulonefritis C3 con depósitos mesangiales y/o subendoteliales y en pocos casos enfermedad de depósitos densos intramembranosos.
La GNMP con depósito de Igs policlonal tiene un riesgo de recidiva bajo (Tabla 3) y habitualmente lo hace de forma tardía. En estos pacientes, la presencia de niveles bajos de las fracciones C3 y C4 del complemento se asocia a un mayor riesgo de recidiva. En estos casos, en las biopsias observaremos depósitos de C4d en los capilares glomerulares ya que se ha producido una activación del complemento por la vía clásica o de las lectinas; en cambio, en la glomerulopatía C3 (glomerulonefritis C3 y enfermedad de depósitos densos) la activación del complemento se produce por la vía alternativa y no observaremos depósitos de C4d.
La GNMP con depósitos de Ig monoclonal recidiva muy a menudo (66%), muy precozmente y presentan un curso clínico muy agresivo que conduce a la pérdida del injerto en muchas ocasiones. En el 70% de los casos no se detectará un componente monoclonal en suero/orina ni una discrasia de células plasmáticas en la médula ósea. En el 30% de los casos restantes se presenta una paraproteína circulante por lo que estos pacientes se incluyen en la categoría de gammapatía monoclonal de significado renal. En estos pacientes, a parte del depósito de la paraproteína, la Ig monoclonal puede asociarse a una alteración en la regulación de la cascada del complemento y permitir una sobreproducción de C3 activado.
La GNMP mediada por complemento se caracteriza por un depósito mesangial o de membrana de C3 en ausencia o con un mínimo depósito de Igs. La glomerulonefritis C3 y la enfermedad de depósitos densos comparten hallazgos en el estudio mediante inmunofluorescencia y mecanismos patogénicos, aunque tienen características clínicas distintas. La glomerulonefritis C3 recidiva con mucha frecuencia, de forma más precoz y se asocia con una elevada tasa de fracaso del injerto. La enfermedad por depósitos lentos suele recurrir de forma más tardía y progresa de forma más lenta. En estas dos entidades se han descrito alteraciones en las proteínas que regulan la vía alterna del complemento, con una hiperactividad de la C3 convertasa y a veces con una activación de la fracción C5-C9. Entre las causas de esta alteración se encuentra la presencia de anticuerpos contra la C3 convertasa (factor C3 nefrítico) o contra el factor H así como mutaciones en las proteínas que regulan la actividad de esta enzima.
Las características morfológicas y patogénicas de la nueva clasificación de la GNMP deben contribuir en la toma de decisiones terapéuticas. En las GNMP con depósitos de Igs parece razonable suponer que el tratamiento con Rituximab pueda contribuir a disminuir la producción de anticuerpos, aunque no existen estudios bien diseñados que apoyen este tratamiento. En la GNMP con activación del complemento cabría suponer que el tratamiento con anticuerpos contra la fracción C5 del complemento (Eculizumab) pueda contribuir al control de la enfermedad. Sin embargo, las evidencias derivadas de series de casos ofrecen resultados contradictorios.
Glomerulonefritis mesangial por IgA y púrpura de Schonlein- Henoch
La nefropatía IgA es la enfermedad glomerular más prevalente en nuestro ámbito. En su patogenia participan las alteraciones en la glicosilación de la IgA1, el desarrollo de anticuerpos (IgA o IgG) contra los glicanos de la IgA1 alterada y las alteraciones inmunes en la barrera inmune intestinal o respiratoria. Los estudios realizados muestran con frecuencia aparición de depósitos de IgA post-trasplante, aumentando la probabilidad de su detección con el paso de los años. Sin embargo, el significado clínico de estos depósitos es incierto, ya que se han observado tanto en pacientes con función renal e histología normal como en pacientes con proteinuria, hematuria, insuficiencia renal progresiva y proliferación endocapilar en la biopsia. En un estudio Español con biopsias de seguimiento durante los 2 primeros años postrasplantese observó una tasa de recidiva del 32%, que en el 50% de los casos ocurría en pacientes sin alteraciones urinarias. En este estudio, la recidiva fue menos frecuente en los pacientes tratados con ciclosporina y en los trasplantes con mayor compatibilidad en locus DR [41]. En la serie de la Clínica Mayo de Rochester con biopsias de protocolo (n=125) la tasa de recidiva fue del 12.5% al año y del 51% a los 5 años [35].
Aunque la tasa de recidiva es elevada, los pacientes con nefropatía IgA tienen una vida media del injerto similar a la de los pacientes con otras enfermedades renales, de tal modo que en menos del 10% de los casos la recidiva de la enfermedad conduce al fracaso del injerto. De todas formas, la serie de la Clínica Mayo muestra que en los pacientes con recidiva el pronóstico del injerto es peor que en los pacientes sin recidiva [29]. La recidiva se ha asociado con niveles circulantes elevados de IgA1 deficiente en galactosa, con niveles elevados de inmunocomplejos IgA-IgG y con niveles bajos de complejos circulantes IgA-CD89 soluble (el receptor mieloide para la IgA) [42]. Entre los factores clínicos de riesgo para la recidiva se citan la donación de vivo y el grado de histocompatiblidad.
No existe un tratamiento específico, aunque al igual que en la enfermedad primaria se puede utilizar el tratamiento con inhibidores del sistema renina-angiotensina y el tratamiento con corticoesteroides. No existen datos fiables respecto a los beneficios de combinaciones específicas de inmunosupresores, pero se ha sugerido que la recidiva puede ser menor en los pacientes tratados con timoglobulina y micofenolato mofetilo. Además, un análisis del registro australiano sugiere que la recidiva es menos frecuente en los pacientes a los que no se les retiran los esteroides.
La púrpura de Schönlein-Henoch es una vasculitis de pequeño vaso que puede aparecer a nivel renal, cutáneo, intestinal y articular. Desde el punto de vista renal se caracteriza por el depósito mesangial de IgA y al igual que en la enfermedad limitada al riñón la presencia de recidiva histológica es más elevada que la de recidiva clínica (78% vs. 22%, respectivamente). La enfermedad se manifiesta como proteinuria, hematuria y disfunción renal. La recidiva es más frecuente en los casos que presentan ANCA IgA y tiene peor pronóstico en los pacientes que presentan proliferación extracapilar.
Glomerulonefritis membranosa
La glomerulonefritis membranosa se caracteriza por un engrosamiento de la membrana basal glomerular debido al depósito de inmunocomplejos a nivel subepitelial. En su patogenia se ha involucrado la aparición de anticuerpos IgG contra diversas proteínas de los podocitos. Al igual que en el riñón nativo, el 70-80% de los casos presenta anticuerpos circulantes contra el receptor de fosfolipasa A2 (PLA2R). La tasa de recidiva descrita es variable (30-50%), pero es más elevada en los pacientes PLA2R positivos que en los negativos (70% vs. 30%) y se ha relacionado con la pérdida del injerto en tan solo el 5-10% de los casos. La información obtenida durante la última década sugiere que la monitorización de los anticuerpos PLA2R durante el seguimiento es de utilidad clínica para evaluar el riesgo de recidiva, el riesgo de progresión en los pacientes con recidiva y la respuesta al tratamiento. Debe tenerse en cuenta que existen casos en los que a pesar de no detectar anticuerpos PLA2R circulantes, se pueden detectar depósitos glomerulares de PLA2R mediante inmunohistoquimia indicando que la patogenia es la misma.
El diagnóstico se realiza habitualmente en pacientes que presentan proteinuria de rango nefrótico. Los estudios realizados con biopsias de protocolo han mostrado que la tasa de recidiva es del 19% al año y del 55% a los 5 años. En el paciente trasplantado renal los tratamientos a evaluar son los mismos que para el riñón nativo. Dado que todos los pacientes ya reciben tratamiento con inhibidores de la calcineurina y corticoides, debería evaluarse la posibilidad de utilizar agentes alquilantes (ciclofosfamida o clorambucil) y Rituximab. Dada la mayor toxicidad de los alquilantes, la terapia de elección en la actualidad es el Rituximab que se asocia con una tasa de remisión completa/parcial del 80%. Debe tenerse en cuenta, que en este contexto la determinación de anticuerpos PLA2R es útil ya que su disminución precede, en general, a la disminución de la proteinuria.
Glomerulonefritis por anticuerpos antimembrana basal glomerular
La recidiva es rara si han desaparecido los anticuerpos antimembrana basal glomerular circulantes al menos 6 meses antes del trasplante. La recidiva debe tratarse con esteroides, ciclofosfamida y plasmaféresis.
Síndrome hemolítico urémico atípico
Durante décadas la recidiva del síndrome hemolítico-urémico atípico (SHUa) postrasplanteera muy frecuente (50%) y, en muchas ocasiones, resistente al tratamiento convencional con recambios plasmáticos conduciendo al fracaso del injerto (>75%). Por ello, durante años la recidiva previa en un injerto se convertía en una contraindicación para el trasplante e, incluso, se llegaron a realizar trasplantes combinados de hígado y riñón para disponer de proteínas reguladoras del complemento no mutadas. Gracias a los estudios genéticos y funcionales de las distintas proteínas reguladoras del complemento, a día de hoy podemos caracterizar el riesgo de recidiva de forma individualizada e instaurar el tratamiento adecuado en los pacientes con mayor riesgo. Los aspectos relacionados con esta patología han sido ampliamente revisados en el Documento de Consenso español publicado en la revista Nefrología [43]. En dicho documento se recomienda el uso profiláctico de Eculizumab en los pacientes con riesgo moderado-alto de recidiva (mutaciones en CFH, CFI, C3, CFB- Gen híbrido CFH/CFHR1, mutaciones combinadas, mutación no identificada/con efecto desconocido, persistencia de anticuerpos anti-FH, recurrencia previa del SHUa, sin mutación, pero con polimorfismos en CFH del donante). Los datos recientemente publicados del registro internacional con 188 pacientes tratados con Eculizumab confirman que en los pacientes tratados con eculizumab de forma profiláctica la supervivencia del injerto y la función renal son mejores que en aquellos tratados posteriormente al trasplante [44].
Vasculitis anticuerpos anticitoplasma de neutrófilo positivos
La tasa de recidiva es baja, aunque la enfermedad puede aparecer en cualquier momento del seguimiento. Por ello, en los pacientes con enfermedad renal crónica secundaria a vasculitis, se aconseja realizar el trasplante una vez se ha conseguido la remisión clínica. En pacientes libres de enfermedad, la existencia de anticuerpos anticitoplasma de neutrófilo (ANCA) no es una contraindicación para el trasplante. Después del trasplante debe vigilarse la aparición de síntomas renales y/o extrarrenales, y en caso de recidiva valorar el tratamiento con plasmaféresis y considerar la substitución del micofenolato mofetilo por ciclofosfamida.
Lupus eritematoso sistémico
La tasa de recidiva del lupus eritematoso sistémico (LES) reportada por diferentes grupos es muy diversa (5-54%). Esta variabilidad se explica porque las indicaciones de la biopsia son distintas, las poblaciones estudiadas son diferentes, el tiempo de seguimiento es distinto y el método de estudio de la biopsia no siempre es completo. Clínicamente se caracteriza por hematuria y proteinuria que pueden asociarse a clínica extra-renal y datos biológicos de actividad. Desde el punto de visto histológico en la mayoría de las ocasiones se presenta una nefritis lúpica con proliferación mesangial (clase II), aunque también se han descrito casos de glomerulonefritis proliferativa focal (clase III) y difusa (clase IV).
Aunque la tasa de recidiva es relativamente elevada, en pocas ocasiones la recidiva de la enfermedad conduce al fracaso del injerto: los diversos estudios disponibles confirman que la supervivencia del injerto en los pacientes con LES no es distinta a la de los pacientes con otras nefropatías. Los pacientes que presentan anticuerpos antifosfolípidos y/o anticoagulante lúpico tienen más riesgo de recidiva y en ellos los eventos trombóticos son más frecuentes.
Recidiva de otras enfermedades
En la diabetes mellitus tipo 1, el trasplante renal aislado conlleva un peor pronóstico del injerto y del paciente que el trasplante reno-pancreático. Recientemente se han publicado los resultados de un estudio realizado en casi 1.000 pacientes con 3.500 biopsias de protocolo realizadas a lo largo de 5 años que incluía 164 pacientes diabéticos (el 90% con diabetes tipo 2). En dicho estudio se demuestra que la prevalencia de expansión mesangial es el doble en los pacientes con diabetes pre-trasplante que en los pacientes no diabéticos. Estos hallazgos se asocian con un mayor grado de proteinuria y no dependen del control glucémico, pero no se asocia a una peor función renal y no modifican la supervivencia del injerto [45].
En la hiperoxaluria primaria, la afectación del injerto tras el trasplante es la regla y, por lo tanto, el tratamiento de elección es el trasplante doble de hígado y riñón.
GLOMERULONEFRITIS DE NOVO
La glomerulonefritis membranosa puede aparecer tanto en adultos como en niños. Se asocia a infección por virus de la hepatitis C y B. Se ha especulado que en algunos casos pudiera representar una forma especial de rechazo humoral o alternativamente una respuesta inmunológica a antígenos extraños de origen tubular o glomerular. A veces responde a un incremento de la dosis de esteroides. La infección por virus de la hepatitis C también puede asociarse a una nefritis crioglobulinémica (con disminución del complemento) o membrano-proliferativa o membranosa. La llegada de los nuevos antivirales de acción directa para los pacientes con infección crónica por el virus de la hepatitis C ha reducido de forma espectacular esta patología.
Hasta en el 15% de los casos de síndrome de Alport puede detectarse una glomerulonefritis con anticuerpos anti-membrana basal glomerular de patrón lineal. Los anticuerpos se producen frente a los antígenos de la cadena de colágeno tipo IV. En un 3-5% de los casos se produce una glomerulonefritis extracapilar con mal pronóstico, que requiere tratamiento con plasmaféresis. El síndrome hemolítico urémico atípico en pacientes con otras enfermedades renales puede aparecer en el postrasplante en pacientes tratados con ciclosporina A, tacrolimus o sirolimus y se revisa en el documento de consenso español [37].
OBSTRUCCIÓN DEL TRACTO URINARIO Y PIELONEFRITIS CRÓNICA
Todo paciente que presente disfunción crónica tardía debe ser evaluado ecográficamente con el fin de descartar obstrucción de la vía urinaria. Las obstrucciones tardías obedecen generalmente a estenosis isquémica o inmunológica del uréter y a litiasis. El hallazgo ecográfico de hidronefrosis debe seguirse de la realización de un renograma isotópico con furosemida con el fin de establecer la repercusión funcional. En estos casos, los hallazgos en la histología se caracterizan por la dilatación de los túbulos renales, con la presencia de cilindros con proteína de Tamm-Horsfall.
En pacientes con infecciones urinarias de repetición, la existencia de reflujo del neomeato urinario incrementa el riesgo de pielonefritis aguda y crónica. Los pacientes con alteraciones de la vía urinaria (trasplante renal con neovejiga, vejiga neurógena, sondajes uretrales intermitentes, etc.) tienen un riego incrementado de pielonefritis crónica. En los pacientes con infecciones frecuentes, sobre todo en los que han padecido pielonefritis, está indicada la profilaxis antibiótica y la acidificación de la orina. Histológicamente, los pacientes con pielonefritis crónica presentan lesiones que se caracterizan por la presencia de células polimorfonucleares intratubulares o peritubulares y la formación de folículos linfoides.
INFECCIÓN VÍRICA CRÓNICA
Véase Infecciones en el Trasplante Renal
NEFROPATÍA HIPERTENSIVA
La hipertensión arterial tiene una elevada prevalencia en el trasplante renal y contribuye negativamente a la supervivencia del injerto y del paciente. Las lesiones histológicas asociadas a la hipertensión son el engrosamiento de la íntima arterial con reduplicación de la lámina elástica. Esta alteración puede confundirse con la vasculopatía del trasplante caracterizada por la formación de una neoíntima. La hipertensión se asocia a hialinosis arteriolar y cambios hialinos arteriolares que afectan a toda la pared vascular. La hialinosis nodular es más sugestiva de nefrotoxicidad por anticalcineurínicos.
NEFROTOXICIDAD POR INHIBIDORES DE LA CALCINEURINA
En el tratamiento inmunosupresor de mantenimiento el uso de inhibidores de la calcineurina (ICN), ciclosporina o tacrolimus, es muy frecuente en los receptores de trasplante renal. Existen suficientes evidencias experimentales y clínicas que confirman que dichos fármacos son nefrotóxicos y sin duda alguna su utilización contribuye a la progresión de las lesiones asociadas (esclerosis glomerular, arteriolopatía hialina, fibrosis intersticial y atrofia tubular). Sin embargo, los estudios recientes sugieren que la pérdida del injerto por nefrotoxicidad crónica es una situación excepcional. Durante las últimas 2 décadas se han desarrollado diversas estrategias para evitar esta toxicidad. La eliminación de los ICN y su sustitución por inhibidores de mTOR o la minimización de los ICN combinados con inhibidores de mTOR no han demostrado ser superiores a las pautas estándar. Finalmente, el tratamiento de mantenimiento con belatacept ofrece mejores resultados a 8 años que en el mantenimiento con ciclosporina, ya que mejora la supervivencia del injerto y la función renal a largo plazo [46]. Desgraciadamente, existen pocos estudios que hayan comparado el tratamiento de mantenimiento con belatacept o tacrolimus.
DIAGNÓSTICO DE LA DISFUNCIÓN CRÓNICA
La disfunción crónica se caracteriza por un incremento progresivo de la creatinina plasmática asociado con frecuencia a hipertensión arterial y proteinuria y el diagnóstico de la enfermedad responsable requiere la evaluación de los datos clínicos e histológicos. La indicación de la biopsia debe ser precoz, con el fin de poder iniciar el tratamiento lo antes posible en aquellas entidades en las que el tratamiento puede modificar la historia natural de la enfermedad, como es el caso de la nefropatía por polioma o la glomerulonefritis membranosa. Además del diagnóstico, la biopsia renal aporta información sobre el pronóstico de la enfermedad. Por ello, en algunos centros se realizan biopsias de protocolo en diferentes intervalos de tiempo con el fin de evaluar la aparición precoz de lesiones, aunque su uso rutinario no se ha extendido a la mayor parte de las unidades de trasplante.
No debemos olvidar que la fibrosis intersticial y la atrofia tubular pueden existir en el riñón del donante, especialmente en caso de donantes expandidos (edad avanzada, hipertensión arterial y diabetes) junto con la presencia de esclerosis glomerular y de cambios vasculares (hiperplasia de la íntima y hialinización arteriolar). Una vez considerados estos hechos, el diagnóstico diferencial entre lesiones del donante, nefrotoxicidad crónica por inhibidores de la calcineurina y fibrosis intersticial/atrofia tubular de origen no especificado supone un reto. Debe tenerse en cuenta que en la práctica clínica habitual en el injerto renal suelen observarse hallazgos asociados con factores inmunológicos, junto a nefrotoxicidad y otras lesiones. Esto hace difícil, en algunos casos, alcanzar un diagnóstico etiológico específico.
TRATAMIENTO DE LA DISFUNCIÓN CRÓNICA
Hasta la actualidad no se ha definido un tratamiento adecuado para el rechazo crónico activo mediado por anticuerpos. En el rechazo humoral agudo se han demostrado los beneficios de los recambios plasmáticos asociados a inmunoglobulinas y anticuerpos anti-CD20, pero en el rechazo crónico no existe evidencia de la utilidad de ningún tratamiento.
En los pacientes con fibrosis intersticial y atrofia tubular asociadas a inflamación, el ajuste de la inmunosupresión mediante pulsos de esteroides o asociando ácido micofenólico puede, ocasionalmente, estabilizar e incluso mejorar la función renal.
La sustitución de los inhibidores de la calcineurina por inhibidores de mTOR, sirolimus y everolimus, se asocia a una mejoría de la función renal si se realiza precozmente o en pacientes con función renal preservada. Puede asociarse a un empeoramiento de la proteinuria en los injertos que presentan una tasa de filtración glomerular < 40 ml/min, proteinuria > 1 g/día o un grado moderado de fibrosis intersticial y atrofia tubular severa en la biopsia renal.
Otras intervenciones no inmunológicas han ofrecido resultados variables. El control estricto de la presión arterial mediante antagonistas del calcio o IECA/antagonistas de los receptores de la angiotensina II (ARA II) parecería una aproximación adecuada, pero los resultados de un ensayo clínico prospectivo, aleatorizado y controlado con placebo a cinco años no han permitido demostrar que el tratamiento con losartán disminuya la progresión de la fibrosis intersticial [47].
La individualización de la inmunosupresión con los nuevos fármacos inmunosupresores puede contribuir a mejorar los resultados. Asimismo, la reducción en los tiempos de isquemia, la adecuada compatibilidad entre donante y receptor (considerando edad, peso y compatibilidad HLA) y el tratamiento agresivo de la hipertensión, la dislipidemia y la diabetes postrasplante pueden contribuir a reducir la incidencia de disfunción crónica tardía.