Inmunosupresión en el Trasplante Renal
Palabras clave
Terapia de inducción, corticosteroides, esteroides, anticuerpos monoclonales, anti-CD25, anti-CD20, anti-CD52, anti-CD3, Rituximab, OKT3, Eculizumab, anticuerpos policlonales, timoglobulina, basiliximab, alemtuzumab, azatioprina, anticalcineurínicos, ciclosporina, tacrolimus, inhibidores mTOR, sirolimus, everolimus, ácido micofenólico, mofetil micofenolato, bortezomib, leflunomida, belatacept, asistolia no controlada, imlifidasa
INTRODUCCIÓN
Tras el trasplante renal es necesario administrar un tratamiento que permita controlar la respuesta inmunológica de rechazo del receptor. Habitualmente es un tratamiento crónico que combina diferentes fármacos. Es esencial conseguir un equilibrio entre el efecto inmunosupresor de estos fármacos y la respuesta inmunológica del huésped, que evite el rechazo sin incrementar las infecciones oportunistas y las neoplasias o producir otros efectos adversos no deseados. Por tanto, antes de administrar una terapia inmunosupresora es necesario valorar la eficacia y potencial toxicidad de la misma, así como individualizar el tratamiento. Sin embargo, no hay consenso universal sobre el mejor régimen inmunosupresor que se debe administrar.
HISTORIA DE LA INMUNOSUPRESIÓN
A principios del siglo XX los estudiosos del trasplante ya suponían un origen inmunitario del rechazo de los órganos [1]. Sin embargo, fue en los años 40 y 50 cuando el conocimiento basado en la experimentación y posteriormente sus logros clínicos confirmaron la necesidad de emplear estrategias capaces de controlar la inmunidad si se quería extender el trasplante renal a receptores de donantes no idénticos [2].
Así se inició la etapa de la inmunosupresión. En 1959, una explosión atómica accidental en Yugoslavia motivó que una decena de obreros recibieran una exposición a una dosis subletal de rayos X y rayos gamma. En París, sometieron a estos hombres a trasplantes de médula ósea, que prendieron sin problemas. Por otro lado, entre 1955 y 1959, en EE.UU. se habían realizado experimentos satisfactorios de irradiación en animales, con objeto de destruir las células sanguíneas de la médula ósea y del tejido linfoide, y realizar un trasplante de médula ósea con un riñón del mismo origen. La primera experiencia de inducción con irradiación en humanos tuvo lugar en el Brigham Hospital de Boston en 1958 (el centro que había realizado en 1954 el primer trasplante renal con éxito entre hermanos gemelos). Administraron irradiación total con 600 Roentgen a una joven que había sufrido una nefrectomía de un riñón ectópico único por hemorragia. La paciente recibió varios trasplantes de médula ósea de diferentes donantes, el último de los cuales fue de un joven sometido a una nefrectomía terapéutica, que fue por tanto también su donante de riñón. A pesar de que el injerto renal recuperó lentamente la función renal y no se produjo rechazo, la paciente falleció por complicaciones hemorrágicas poco después. Se reprodujeron casos semejantes con muertes precoces, de manera que pronto se decidió modificar la estrategia descartando la realización del trasplante de medula ósea concomitante y reduciendo la dosis de irradiación. En 1959, se obtuvieron los primeros éxitos en dos casos de trasplante renal con irradiación entre individuos "no idénticos", gemelos bivitelinos, primero en Boston y después en París. En Boston, además, se utilizaron algunas dosis de corticoides y nuevas dosis de radiación para tratar "episodios de rechazo". Estos dos receptores consiguieron excelentes supervivencias de 20 y 26 años, respectivamente [3].
Desde principios de los años 50 se sabía que los corticoides eran capaces de disminuir la reacción de rechazo de la piel trasplantada. Goodwin en 1960 en la Universidad de California resolvió un episodio de rechazo con altas dosis de esteroides en un paciente inmunosuprimido con metotrexato y ciclofosfamida, mientras se buscaban alternativas a la irradiación en oncología. De forma casi paralela, en 1959, Roy Calne demostró que la 6-mercaptopurina prolongaba la supervivencia de los injertos renales en perros, y ese mismo año la utilizó en un trasplante renal humano. Posteriormente, encontró que el derivado imidazólico -azatioprina- era más activo [4]. A partir de entonces, se extendió el uso del fármaco en París, Londres y Boston. Thomas Earl Starzl desarrolló la inmunosupresión basada en la combinación de azatioprina y corticoesteroides e introdujo la globulina antitimocítica. En 1963, demostró que asociar esteroides a la azatioprina permitía revertir el rechazo agudo [5].
En 1960, en París, René Kuss y Marcel Legrain realizaron un trasplante entre hermanos no gemelos utilizando inmunosupresión con irradiación y corticoides en el receptor, pero también corticoides y 6-mercaptopurina en la donante. El resultado a corto plazo fue positivo, aunque el receptor falleció a los cuatro meses por diseminación de una neoplasia previamente conocida. A lo largo de los siguientes meses, el mismo equipo realizó dos trasplantes renales entre individuos no emparentados con buenas supervivencias de 16 y 17 meses, respectivamente [6]. Uno de estos injertos renales se perdió por rechazo crónico, introduciendo una nueva noción y necesidad en este campo. Se produjeron experiencias semejantes a ambos lados del Atlántico en Londres y en Boston en esos años. Y en 1962, el equipo de Hume en Richmond realizó el primer trasplante renal de donante cadáver - donante en asistolia de 52 años - con una supervivencia de 16 meses bajo inmunosupresión [7].
Los diferentes y escasos equipos trasplantadores fueron incorporando sobre la marcha conocimientos trascendentes en este campo: se empezó a conocer la semiología clínica del rechazo agudo, los riesgos de la excesiva inmunosupresión, el pésimo pronóstico de las neoplasias en receptores de trasplante sometidos a inmunosupresión, la existencia del rechazo crónico, etc. Y en 1963, tuvo lugar el Primer Congreso de Trasplante en Washington para poner en común las experiencias de 13 centros trasplantadores de Francia, Gran Bretaña y EE.UU., que hasta entonces habían realizado 244 trasplantes renales. A partir de aquel momento, el trasplante renal sufrió un importante desarrollo en el mundo occidental gracias a la modernización progresiva de fármacos inmunosupresores, el desarrollo del diagnóstico de la muerte encefálica -que facilitaría la extracción de órganos de cadáveres-, la creación de unidades de diálisis -que permitían mantener a los enfermos en lista de espera de trasplante renal-, y el desarrollo de la inmunología del trasplante, con el conocimiento del sistema HLA y la incorporación de la prueba cruzada a la práctica clínica.
Los anticuerpos policlonales antitimocítico y antilinfocitarios se incoporaron a la práctica clínica a mediados de los 70. La azatioprina y la prednisolona se convirtieron en el tratamiento de mantenimiento con el uso de anticuerpos policlonales como inducción o en el tratamiento de rechazo agudo. Con este protocolo, la supervivencia del trasplante renal al año era del 50%, con una tasa de rechazo agudo de 60%, y una mortalidad del 10-20%. En los años 80, se introdujo la ciclosporina revolucionando estas cifras, y posteriormente los fármacos empleados hoy en día que se describen a continuación [8].
USO DE INDUCCIÓN EN TRASPLANTE RENAL
La terapia de inducción surge en las primeras etapas del trasplante ante la necesidad de reducir la tasa de rechazo agudo en un momento en que el tratamiento inmunosupresor de mantenimiento, fundamentalmente prednisona y azatioprina, resultaban insuficientes para ello. Las primeras globulinas antilinfocitarias aparecieron a mitad de los años 60. Posteriormente aparecieron fármacos más potentes en inducción, como OKT3, que acabaron retirados del mercado por la gravedad de sus eventos adversos a medio y largo plazo. En las últimas décadas se desarrollaron fármacos en inducción caracterizados por un mejor perfil de seguridad, como los anti-CD25, circunstancia que favoreció la generalización de su uso [9].
Definición de terapia de inducción e indicaciones
La inducción se define como el uso de agentes inmunosupresores en el momento del trasplante, generalmente antes de la reperfusión del órgano, con el objetivo de mejorar la supervivencia del injerto y del paciente al disminuir la aparición de episodios de rechazo agudo o reducir su severidad histológica, factores relacionados con mayor riesgo de fracaso del injerto. El régimen inmunosupresor óptimo no está claro y la utilización de uno u otro fármaco de inducción, así como las dosis empleadas, dependerá del balance riesgo-beneficio de cada combinación donante-receptor [9] [10] [11] [12] [13].
Las guías KDIGO publicadas en 2009 recomendaron el uso de inducción en todos los receptores de trasplante renal: anti-CD25 en pacientes considerados de bajo riesgo inmunológico, y agentes que producen la depleción de linfocitos T en sangre periférica en los pacientes de alto riesgo inmunológico [12].
Sin embargo, la definición de riesgo inmunológico es compleja. Incluye, por una parte, circunstancias en las que el riesgo inmunológico depende de la capacidad del receptor de reaccionar frente al injerto (receptores con presencia de anticuerpos anti-HLA, donante específicos o no; receptores jóvenes, raza afroamericana, el elevado número de incompatibilidades HLA entre donante y receptor o el trasplante ABO incompatible) y situaciones en las que el riesgo inmunológico del receptor se considera menor, pero las características del donante (criterios muy expandidos, edad elevada, asistolia controlada y no controlada o tiempos de isquemia prolongados) se asocian a un elevado riesgo de función retrasada del injerto [13] [14]. El hecho de englobar situaciones tan diferentes en la definición de riesgo inmunológico ha favorecido la heterogeneidad de las pautas de tratamiento, según los criterios de riesgo inmunológico utilizados por cada autor, y como consecuencia existe una gran dificultad para comparar los resultados de los diferentes estudios. Esta falta de uniformidad se observa incluso cuando analizamos el tratamiento de inducción en receptores que reciben un retrasplante o en pacientes sensibilizados, en los que parecería deseable tener un consenso general para su tratamiento [14] [15].
En las últimas décadas, junto a los diferentes agentes de inducción se han desarrollado de forma paralela fármacos en mantenimiento mucho más eficaces frente al rechazo agudo, como la ciclosporina neoral, el tacrolimus, el micofenolato de mofetil o el sirolimus. Esta mayor oferta ha favorecido el desarrollo de múltiples combinaciones que se han demostrado ventajosas en la prevención del rechazo, tanto frente a placebo como frente a los agentes utilizados con anterioridad, como son la ciclosporina o la azatioprina [10]. No obstante, la ausencia de ensayos clínicos que comparen los resultados de los diferentes fármacos de inducción asociados con la terapia de mantenimiento actual, como la combinación de tacrolimus y micofenolato, limita nuestro conocimiento acerca de su necesidad en este momento [9] [16] [17] [18].
A pesar de ello, múltiples revisiones sistemáticas apoyan el uso de inducción en la prevención del rechazo agudo, aunque su uso no se relacione con una mejoría en la supervivencia del injerto o del paciente [18] [19] [20]. Por otro lado, el efecto protector de la inducción frente al rechazo agudo junto con una mayor eficacia del tratamiento inmunosupresor de mantenimiento han permitido el desarrollo de regímenes alternativos a la triple terapia convencional, permitiendo la reducción y/o suspensión precoz de los esteroides [21] [22], el desarrollo de pautas de inmunosupresión sin anticalcineurínicos [23] o el uso de pautas que combinan el uso de inhibidores de m-Tor con anticalcineurínicos a dosis reducidas [24] [25], todas ellas con buenos resultados en pacientes seleccionados.
Tipos de fármacos de inducción
Los principales fármacos de inducción han sido clásicamente los esteroides intravenosos y los anticuerpos monoclonales y policlonales.
Esteroides intravenosos (6- metilprednisolona)
Su mecanismo de acción es la inhibición de la síntesis de la IL1 (que activa las células T cooperadoras), IL6 (activa los linfocitos B), el factor de necrosis tumoral (TNF) y el interferón-gamma, interfiriendo así la respuesta celular y humoral. En inducción se utilizan dosis de 250-500 mg iv el día del trasplante [26]. Posteriormente, la dosis se ajusta en función de la práctica clínica de cada centro y las características de la pareja donante-receptor.
Anticuerpos
En función de su efecto sobre los linfocitos en sangre periférica se clasifican en la literatura entre anticuerpos depletores y no depletores y, según sus características distinguimos entre monoclonales y policlonales [26] [27].
a) Anticuerpos monoclonales
Los anticuerpos monoclonales son producto de la hibridación de esplenocitos de ratones inmunizados con un antígeno determinado (p. ej., células T humanas) con células de estirpe mielomatosa, de comportamiento neoplásico, lo que permite desarrollar de forma ilimitada un clon de células productoras de un anticuerpo específico. El mantenimiento y la expansión de clones celulares proporciona una fuente inagotable de anticuerpos monoclonales. La ingeniería genética ha permitido el desarrollo de anticuerpos monoclonales quiméricos o humanizados, en los que la fracción variable del anticuerpo es de origen humano, con lo que se evita la formación de anticuerpos anti-murinos. Su ventaja frente a los policlonales es su pureza y homogeneidad.
- Anti-CD25:
Este anticuerpo quimérico está formado por una IgG1 dirigida contra la cadena alfa (CD25) del receptor de IL-2 (antagonista selectivo), cuyo bloqueo inhibe la señal encargada de activar la proliferación clonal de linfocitos T. Su efecto es menos eficaz en la prevención de la respuesta de los linfocitos T de memoria.
Se comercializaron dos fármacos inicialmente, aunque actualmente únicamente disponemos solo del Basiliximab (Simulect®, Novartis), tras la retirada del mercado de Daclizumab (Zenapax®, Roche) en 2009.
La posología del único disponible hoy en día está bien definida, dos dosis de 20 mg por vía intravenosa los días 0 y +4 después del trasplante. Tiene una vida media prolongada (7 días) que permite la saturación del receptor de IL-2 durante unos 30-45 días. No induce la aparición de anticuerpos neutralizantes y es muy bien tolerado.
Su uso se extendió tras la recomendación de las KDIGO 2009 de su uso en inducción para la prevención del rechazo agudo en pacientes de bajo riesgo inmunológico o riesgo inmunológico estándar [12]. No está indicado en el tratamiento del rechazo agudo. La mayoría de los estudios comparan su uso frente a placebo y en pautas con ciclosporina, observando beneficio en la prevención del rechazo agudo. Pocos estudios comparan su uso en pautas con triple inmunosupresión convencional con tacrolimus, micofenolato y esteroides [17]. Aunque su potencia en la prevención del rechazo agudo es menor que la obtenida con anticuerpos policlonales, se ha descrito una supervivencia de injerto y paciente similar [19].
- Anti-CD20 (Rituximab, MabThera®, Roche y biosimilares)
Es un anticuerpo monoclonal quimérico frente al antígeno CD20 que se expresa en la superficie de los linfocitos B, de tal forma que inhibe su proliferación e induce apoptosis. Aprobado para el tratamiento de múltiples patologías, destaca en el tratamiento de los linfomas de células B, vasculitis y diferentes glomerulopatías. En el trasplante renal su uso se limita a tratamientos de desensibilización en trasplante ABO incompatibles, trasplantes con presencia de anticuerpos anti-HLA donantes-específicos (DSA) y al tratamiento del rechazo agudo mediado por anticuerpos. Su uso puede producir falsos positivos en la prueba cruzada con linfocitos B [28].
La dosis habitual es de 375 mg/m2 administrado al inicio y/o al final del ciclo de desensibilización, aunque dosis menores han resultado eficaces en la desensibilización en trasplante ABO incompatible con un mejor perfil de seguridad (menos infecciones graves asociadas) [29]. Se administra por vía periférica, y para evitar efectos secundarios (escalofríos, fiebre, hipotensión) se aconseja premedicación con clorhidrato de difenhidramina y esteroides.
Antes de utilizarlo se aconseja valorar el estatus serológico frente al virus de la hepatitis B e iniciar tratamiento en caso de receptor anti-HBc-positivo con HBsAg-negativo, ya que su uso se ha relacionado con un riesgo elevado de reactivación viral [30]. La complicación más temida derivada de su uso, aunque inusual, es el desarrollo de leucoencefalopatía multifocal progresiva.
- Anti-CD 52 (Alemtuzumab, Campath-1H®)
Es un anticuerpo monoclonal recombinante humanizado dirigido contra la glucoproteína CD52 que se expresa en la superficie de todos los linfocitos (proteína panlinfocítica). Inicialmente se desarrolló para el tratamiento de la leucemia linfocítica crónica, pero su prolongado efecto depletor de los linfocitos a nivel central y en sangre periférica no pasó desapercibido y empezó a utilizarse en trasplante.
Es cómodo de administrar, administrándose una única dosis intravenosa de 30 mg durante el acto quirúrgico. No induce tolerancia. No se ha comercializado en España y la mayoría de la información referida a su eficacia procede de estudios realizados en Estados Unidos, donde su uso se reduce a pocos centros [14].
Alemtuzumab se ha utilizado como tratamiento ahorrador de esteroides. Su uso sin esteroides en comparación con el uso de triple terapia convencional sin inducción se asoció a tasas de rechazo agudo similar en trasplante de donante vivo y de donante fallecido, pero con un incremento del riesgo de enfermedad por CMV, sin mostrar diferencias en la supervivencia del injerto o del paciente [19] [31]. Actualmente, su uso no está aprobado en trasplante renal y se ha retirado en el caso de la leucemia linfática crónica, aunque recientemente se ha vuelto a comercializar con indicación en esclerosis múltiple (Lemtrada®, Sanofi).
- Anti-CD3 (Muromonab-OKT3, Orthoclone OKT3®):
Es un anticuerpo murino dirigido frente a la glicoproteína de superficie CD3, asociada al receptor de los linfocitos T, cuya unión evita el reconocimiento antigénico por parte del linfocito T. Fue el primer anticuerpo monoclonal aprobado por la FDA, pero su eficacia frente al rechazo agudo se vio ensombrecida por sus efectos secundarios, tanto con la primera dosis, como a medio-largo plazo con un incremento de complicaciones infecciosas y neoplasias, sobre todo linfomas. Actualmente no está comercializado, pero es un fármaco presente en gran parte de la literatura histórica sobre inducción.
- Eculizumab (Soliris®)
Anticuerpo IgG2/4 monoclonal humanizado dirigido contra la fracción C5 terminal del sistema del complemento. Está aprobado su uso clínico para hemoglobinuria paroxística nocturna y síndrome hemolítico urémico atípico (SHUa). En trasplante renal se viene usando como tratamiento de inducción y mantenimiento para la prevención y/o tratamiento de SHUa postrasplante. Fuera de ficha técnica se viene explorando su utilidad en la prevención y/o tratamiento del rechazo agudo mediado por anticuerpos y de la microangiopatía trombótica de diferentes etiologías. Los pacientes que van a recibir eculizumab deben estar previamente vacunados frente a Neisseria meningitidis.
- Otros:
Últimamente se ha descrito el uso de otros anticuerpos monoclonales en el campo del trasplante tanto en protocolos de desensibilización [32], entre los que destacaríamos el tozilizumab (anticuerpo monoclonal frente al receptor de la IL-6) [33], como en el tratamiento del rechazo mediado por anticuerpos, entre los que destacaríamos el clazakizumab (anticuerpo monoclonal frente a IL-6) [34]. No obstante, estos fármacos exceden el objetivo de la revisión actual.
b) Anticuerpos policlonales
Los anticuerpos policlonales se obtienen de la inmunización de animales (conejos o caballos) con timocitos pediátricos humanos o con células de la estirpe celular linfoblástica Jurkat. Tras ello, se extrae el suero de estos animales y se purifica obteniendo un preparado rico en inmunoglobulinas IgG [11] [35] [36].
Su mecanismo de acción no está del todo claro, pero se sabe que estos fármacos contienen una gran variedad de anticuerpos contra los antígenos de superficie de las células T, incluyendo los antígenos del sistema de histocompatibilidad humano (HLA), cuya interacción generará una depleción de células T mediante lisis dependiente de complemento, tanto en sangre periférica como en tejidos linfoides secundarios. Favorecen la reducción de la expresión de integrinas y moléculas de adhesión del endotelio (ICAM, VCAM, PECAM, CD11b, CD62), lo que podría tener un papel en la reducción de la función retrasada del injerto. Además, estos fármacos modulan la expresión de citoquinas proinflamatorias como IL-1, IL-6 y TNF-alfa. Estudios in vitro, las han implicado en la apoptosis de células B activadas [27] [37].
Su principal problema es que no existe una formulación genérica, existiendo una gran variabilidad interlotes en cuanto a potencia y eficacia. Comparten un amplio espectro de efectos secundarios (fiebre, escalofríos, artralgias, reacciones anafilácticas, enfermedad del suero, plaquetopenia y leucopenia) que hacen necesaria la administración de premedicación con paracetamol, esteroides y clorhidrato de difenhidramina. Se aconseja ajustar las dosis ante la aparición de leucopenia o plaquetopeniaATGAM, .
La más utilizada ha sido la globulina antitimocítica de conejo (Thymoglobuline®, Sanofi) seguida de la globulina antitimocítica de caballo (ATGAM®, Pfizer) [35]. Esta última fue comercializada antes que la timoglobulina, pero se ha dejado de usar por una mayor frecuencia de eventos adversos [11]. Timoglobulina es la que mejor tolerancia y eficacia ha demostrado en la prevención del rechazo agudo en estudios comparativos con otros anticuerpos policlonales como ATGAM®, con menor tasa de complicaciones a medio-largo plazo [35]. Ha demostrado eficacia y seguridad en trasplante de donante vivo o en bajo riesgo inmunológico, con una reducción del rechazo agudo sin incremento de complicaciones postrasplante, en comparación con la no inducción [11] [15] [36]. En pacientes con alto riesgo de función retrasada del injerto el uso de timoglobulina en inducción se ha relacionado con menor riesgo de rechazo agudo comparado con el uso de basiliximab o alemtuzumab [38]. Es la terapia de elección en pacientes de elevado riesgo inmunológico y su uso se ha asociado con la expansión de células T reguladoras implicadas en la tolerancia inmunológica [13] [39].
Una de las complicaciones frecuentes relacionadas con su uso es la infección por CMV, por lo que se recomienda profilaxis antiviral, aunque su uso a dosis bajas (3mg/Kg) combinado con tacrolimus y everolimus a dosis bajas se ha asociado a menor necesidad de profilaxis [40].
La presencia de globulinas antilinfocitarias en el suero de pacientes puede inducir una prueba cruzada positiva por citotoxicidad mediada por complemento, especialmente con linfocitos T [41].
La dosificación difiere en función del preparado:
- Timoglobulina®, Sanofi: La dosis más habitual es la de 1,25-1,50 mg/kg en perfusión intravenosa a través de vía central. Se desaconseja su administración a través de vía periférica por el riesgo de tromboflebitis y trombosis. Se recomienda una primera dosis intraoperatoria y después cada 24h-48h en función del protocolo inmunosupresor del centro y del perfil de riesgo de la pareja donante-receptor. Históricamente se utilizaron dosis muy elevadas, pero con el tiempo y la mayor eficacia de los inmunosupresores de mantenimiento, las dosis se han ido reduciendo [41]. En pacientes de alto riesgo inmunológico se utilizan hasta 6-7 dosis de 1,25-1,50 mg/kg, aunque hay experiencias con la administración de dosis menores (3-4 dosis de 1,25 mg/kg o una dosis única de 3 mg/kg) con buenos resultados [43] [44]. En pacientes de bajo riesgo inmunológico se aconseja administrar 1-3 dosis de 1,25 mg/kg a días alternos [45] [46]. El efecto de depleción de linfocitos T se mantiene durante los primeros 3-6 meses postrasplante con dosis de 3 mg/kg, y se prolonga hasta el primer año con dosis superiores [47]. Dosis totales por encima de 6 mg/kg se han asociado a una mayor mortalidad en pacientes mayores a 60 años en datos del registro americano de trasplantes [48].
- Grafalon®, Neovii Biotech: Comercializado actualmente en nuestro país. Anteriormente se había utilizado fundamentalmente en Alemania en trasplante hematopoyético y en población infantil. Dado que el agente inmunógeno (células linfoblásticas Jurkat) es diferente al de la timoglobulina los efectos sobre la inmunidad y la reconstitución inmunológica pueden diferir de los obtenidos con la timoglobulina. La dosis no está definida y en la literatura se han descrito dosis variables desde 9 mg/kg el día 0, seguida de 4 dosis de 3mg/kg a días alternos (21 mg/kg dosis total) hasta dosis menores en pacientes de bajo riesgo inmunológico (9-12 mg/kg dosis total, repartidas en 3-4 dosis). Se administra en forma de infusión preferentemente por vía central. Estudios randomizados prospectivos apuntan a una eficacia similar a la timoglobulina en la prevención del rechazo agudo, menor frecuencia de infecciones por CMV y una reconstitución inmunológica más temprana, información limitada por la falta de ensayos clínicos comparando ambos fármacos en inducción [49] [50].
También se emplean como tratamiento de elección en el rechazo agudo celular del injerto de grados II y III de Banff o que no responde a los pulsos de esteroides.
INMUNOSUPRESIÓN DE MANTENIMIENTO
CORTICOSTEROIDES
Mecanismo de acción
La acción principal de los corticosteroides se ha comentado anteriormente en inducción. Su uso ha sido amplio, aunque los nuevos fármacos y protocolos inmunosupresores han permitido evitar o retirar los corticoides en muchos pacientes, y utilizar dosis bastante reducidas en aquellos en los que se siguen utilizando. La potencia antiinflamatoria no se correlaciona con la eficacia inmunosupresora.
Indicaciones
Los corticosteroides están indicados en la prevención (inmunosupresión primaria) y en el tratamiento del rechazo agudo del órgano trasplantado.
En la prevención del rechazo agudo se utilizan siempre en combinación con otros fármacos en regímenes de doble o triple terapia. También acompañan el tratamiento de inducción con anticuerpos monoclonales o policlonales [51].
En general, la dosis inicial es entre 0,5-1 mg/Kg/día, complementadas con una dosis de choque intraoperatoria o postoperatoria más elevada (125-500 mg). En los días siguientes se administran dosis decrecientes, hasta alcanzar los niveles de mantenimientos establecidos por cada equipo (5-10 mg/día) a los 2-3 meses de evolución. En pacientes seleccionados es posible no utilizarlos, administrarlos sólo unos días como inducción o suprimirlos totalmente a los 3-12 meses [12].
Para el tratamiento del rechazo agudo se utilizan dosis de 250-1000 mg/día (según los centros), durante 3-6 días. No es prudente superar una dosis total de 3 g.
Efectos adversos
Son frecuentes y potencialmente graves. Los más destacados son: aumento de la susceptibilidad a las infecciones, obesidad, osteonecrosis aséptica, hiperglicemia, HTA, dislipemia, úlcera péptica, hirsutismo y facies cushingoide. A largo plazo puede desarrollarse miopatía, osteoporosis, aterosclerosis, cataratas y atrofia cutánea.
AZATIOPRINA
Mecanismo de acción
La azatioprina es un derivado imidazólico de la 6-mercaptopurina que inhibe la síntesis de purinas, y por tanto la proliferación de linfocitos T [52].
Se metaboliza en el hígado (no se reduce la dosis en caso de insuficiencia renal). La dosis inicial es de 1,5-2 mg/kg cada 24 horas, en una o dos tomas, por vía oral. Puede administrarse también por vía intramuscular. Tras las primeras semanas se recomienda disminuir la dosis a 1-1,5 mg/Kg/día.
Indicaciones
En la actualidad sólo un pequeño porcentaje de pacientes reciben azatioprina. Su uso ha sido desplazado por otros fármacos, como los derivados de ácido micofenólico. No es eficaz para el tratamiento del rechazo agudo del injerto.
Efectos adversos
Puede ocasionar mielodepresión (neutropenia y con menor frecuencia trombopenia) y, a veces, anemia megaloblástica, que no siempre responde al tratamiento con vitamina B12 y ácido fólico.
Algunos pacientes presentan toxicidad hepática (colestasis intrahepática) a las pocas semanas de instaurar el tratamiento, que mejora rápidamente tras la reducción o suspensión del fármaco. El tratamiento prolongado aumenta la susceptibilidad a las infecciones y el riesgo de desarrollar neoplasias. El alopurinol (inhibidor de la xantino oxidasa), interfiere en la metabolización de la azatioprina pudiendo incrementar sus efectos secundarios (náuseas, vómitos, leucopenia y anemia).
INHIBIDORES DE LA CALCINEURINA: CICLOSPORINA A (NEORAL®) Y TACROLIMUS (PROGRAF®, ADVAGRAF®, ENVARSUS®)
CICLOSPORINA A
Mecanismo de acción
La ciclosporina A se une a un receptor intracelular (ciclofilina) y forma un complejo activo que se une e inhibe la actividad fosfatasa de la calcineurina. La calcineurina participa en el control de la transcripción de ácido ribonucleico (ARN) para la síntesis de citocinas (IL-2, IFN-gamma, IL-4 y TNF-ß). Así, inhibe la proliferación de células T evitando la expansión clonal de las células T cooperadoras y citotóxicas. Los linfocitos T supresores no se ven afectados [52].
Farmacocinética
La ciclosporina A se puede administrar por vía oral o intravenosa.
La solución clásica tenía escasa solubilidad en agua y requería la presencia de bilis para su absorción en el tubo digestivo. La formulación actual (Neoral®) en microemulsión facilita la dispersión de las moléculas lipofílicas en el intestino, con lo que mejora la absorción, independientemente de la presencia de bilis y/o alimentos.
Los niveles sanguíneos más elevados se obtienen 3-4 horas después de la ingesta. El fármaco se distribuye rápidamente por los órganos vascularizados y se acumula en el tejido adiposo. Se metaboliza en el hígado a través del sistema enzimático del citocromo P450 III-A. Los medicamentos que utilizan esta vía enzimática y que interfieren en su metabolización se muestran en la (Tabla 1).
Indicaciones
La ciclosporina A se utiliza exclusivamente en inmunosupresión primaria en asociación con otros inmunosupresores [53]. En pacientes con necrosis tubular aguda es aconsejable disminuir la dosis o incluso retrasar su introducción varios días, ya que podría prolongar el período de disfunción inicial del injerto.
Las dosis iniciales varían según el criterio de cada centro, el tipo de trasplante, las características de los pacientes y el protocolo adoptado. En general se administran entre 5 y 8 mg/kg/día por vía oral, repartidos en dos tomas. La primera dosis puede administrarse 2-4 horas antes del trasplante por vía oral, o bien en el periodo peroperatorio por vía intravenosa cuando la situación clínica del paciente no admite la vía enteral. La dosis intravenosa suele ser una tercera parte de la que correspondería por vía oral y se recomienda emplear perfusión continua.
Es necesario monitorizar los niveles sanguíneos para lograr una correcta dosis inmunosupresora. Los niveles valle o predosis deben determinarse en sangre total con un anticuerpo monoclonal específico. La frecuencia de monitorización recomendada es de cada 24-48 horas en la etapa de inducción. Las concentraciones a las 2 horas se correlacionan bien con el área bajo la curva, por lo que la monitorización en este periodo pueda ser útil para establecer la mejor dosis inmunosupresora. En general, los niveles valle de ciclosporinemia recomendados varían según el tiempo de evolución desde el trasplante.
Efectos adversos
La nefrotoxicidad aguda se asocia con niveles de ciclosporinemia elevados y es frecuente durante las primeras semanas del trasplante. Se origina por la intensa vasoconstricción de la arteriola aferente, que reduce el filtrado glomerular. Se manifiesta por oliguria, insuficiencia renal, hipertensión arterial, hiperuricemia e hiperpotasemia moderada, y revierte al disminuir la dosis. La nefrotoxicidad crónica es más importante y se debe a la exposición continuada de los efectos nefrotóxicos del fármaco. Se manifiesta por afectación progresiva e irreversible de la función renal. A nivel histológico se han descrito diversas lesiones, como arteriolopatía, fibrosis intersticial en bandas, atrofia tubular, y en casos graves microangiopatía trombótica, que clínicamente se manifiesta como un síndrome hemolítico urémico. Por esta eventual complicación debe evitarse el tratamiento con ciclosporina A en pacientes con antecedentes de síndrome hemolítico urémico/púrpura trombótica trombocitopénica como enfermedad renal de base, por el elevado riesgo de recidiva postrasplante.
Otros efectos adversos frecuentes se relacionan en la (Tabla 2). Entre las neoplasias malignas, las más frecuentes son las cutáneas, aunque la enfermedad linfoproliferativa (asociada a la infección por virus de Epstein-Barr) y el sarcoma de Kaposi (asociado a la infección por herpes-virus 8) se observan con mayor frecuencia que en la población general.
TACROLIMUS
Mecanismo de acción
El tacrolimus ha desplazado en los últimos años a la ciclosporina debido a su mayor eficacia en la prevención del rechazo agudo y a un perfil diferente de efectos secundarios. Es un macrólido que forma un complejo intracitoplasmático con una inmunofilina específica (FKBP) capaz de bloquear la actividad fosfatasa de la calcineurina, e inhibir así la transcripción de diferentes genes (IL-2 y otros). Inhibe la activación y proliferación de las células T y la síntesis de linfocitos T citotóxicos. También frena el crecimiento y diferenciación de células B, al interferir la expresión de receptores de IL-4 y la síntesis de IL-5.
Farmacocinética
El tacrolimus se absorbe en el tracto digestivo alto, independientemente del flujo biliar. La concentración máxima se alcanza en 1,5-2 horas. Los alimentos interfieren con la absorción, por lo cual debe tomarse con el estómago vacío, 1 hora antes o 2-3 horas después de las comidas. Existe una buena correlación entre el área bajo la curva y los niveles valle predosis, por lo que la determinación de éstos parece un buen método para monitorizar las concentraciones del fármaco.
Se metaboliza en el hígado, a través del sistema enzimático citocromo P450 IIIA, y se elimina por la bilis. De forma similar a lo que ocurre con la ciclosporina A, numerosos fármacos interfieren en su metabolización hepática a través de la inhibición o inducción enzimática del citocromo P450 IIIA (Tabla 1).
Existen tres formulaciones: la clásica, que requiere su administración cada 12 horas por su liberación inmediata (v.g. Prograf®), y otras dos que se administran una vez al día por su liberación prolongada (v.g. Advagraf® y Envarsus®). Cuando se emplee Advagraf® la dosis total diaria es la misma que con Prograf®, aunque algunos pacientes podrían requerir una dosis inicial mayor de Advagraf® si se plantea obtener los mismos niveles objetivo que con Prograf®. En el caso de utilizar Envarsus® se requiere solamente un 70% de la dosis utilizada con otras formulaciones (Prograf® o Advagraf®).
Indicaciones
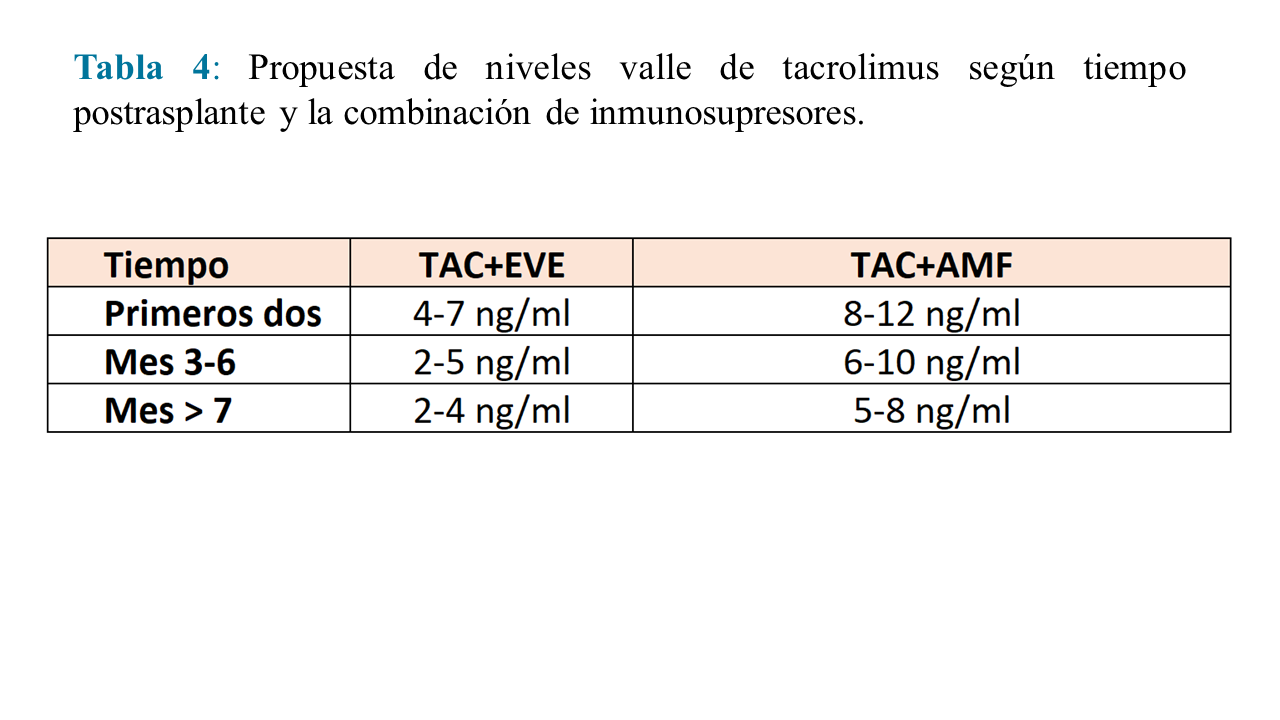
El tacrolimus se utiliza para prevenir el rechazo agudo del injerto [54] [55] [56] [57] [58] [59] [60]. Se administra en asociación con esteroides y derivados del ácido micofenólico o inhibidores de mTOR. La dosis inicial recomendada es de 0,1-0,2 mg/Kg. En días sucesivos, la dosis deberá ajustarse en función de las concentraciones sanguíneas. Actualmente se recomienda mantener niveles sanguíneos pre-dosis entre 8 y 12 ng/ml en el periodo de inducción, y posteriormente 4 y 8 ng/ml. Si se utilizan anticuerpos de inducción, puede mantenerse niveles entre 4 y 8 ng/ml desde el principio.
Efectos adversos
Los efectos adversos con mayor significado clínico son:
* Nefrotoxicidad: similar a la que produce la ciclosporina A.
* Intolerancia hidrocarbonada: la incidencia de hiperglicemia y de diabetes mellitus es más elevada que en los pacientes tratados con ciclosporina A
* Alteraciones neurológicas: temblor, cefalea, mareo, o cuadros neurológicos más severos (convulsiones, encefalopatía, disartria, psicosis, etc.).
* Mayor susceptibilidad al desarrollo de infecciones y neoplasias
INHIBIDORES DE mTOR: SIROLIMUS (RAPAMUNE®) Y EVEROLIMUS (CERTICAN®)
Mecanismo de acción
Los inhibidores de mTOR son macrólidos que actúan en una etapa de proliferación celular más tardía, inhibiendo las señales específicas para las citocinas. Para actuar, los inhibidores de mTOR precisan formar un complejo con una inmunofilina. Al igual que tacrolimus, se unen a FKBP-12, pero a diferencia de éste, no inhiben la calcineurina. El everolimus es un derivado del sirolimus con una semivida de eliminación más corta y mayor biodisponibilidad oral.
Los inhibidores de mTOR presentan, además de su efecto inmunodepresor, propiedades antivirales, bien demostradas en pacientes trasplantados en cuanto a la prevención y/o tratamiento de infecciones por citomegalovirus o virus BK.
Indicaciones
En inmunosupresión primaria se debe utilizar asociado a CsA o a tacrolimus. En el caso de everolimus, la dosis inicial recomendada es de 0,75 mg cada 12 horas o 1,5 mg cada 12 horas cuando se combina con ciclosporina o tacrolimus, respectivamente. La asociación tacrolimus-inhibidor de mTOR es al menos tan eficaz como la asociación tacrolimus-micofenólico.
En pacientes que van a ser sometidos a reducción/retirada de inhibidor de la calcineurina, la introducción de un inhibidor de mTOR se ha demostrado eficaz cuando la función renal previa a la conversión está suficientemente preservada (filtrado glomerular estimado por encima de 40-50 ml/min) y proteinuria por debajo de 500 mg/24 horas [61] [62] [63].
Efectos adversos
Los inhibidores de mTOR no son nefrotóxicos, pero si se administran en combinación con un inhibidor de la calcineurina pueden potenciar la nefrotoxicidad de éstos. Por otra parte, se ha descrito proteinuria relevante, especialmente tras su introducción tardía en injertos con función deteriorada.
Los efectos secundarios más frecuentes son: hipercolesterolemia, hipertrigliceridemia, mielotoxicidad, retraso en la curación de la herida quirúrgica y edemas. Los efectos adversos se previenen y se corrigen eficazmente con un cuidadoso ajuste de los niveles sanguíneos. En pacientes muy obesos se recomienda retrasar su introducción para evitar complicaciones quirúrgicas
La neumonía organizativa es un efecto adverso poco frecuente pero potencialmente grave, que debe tenerse presente en el diagnóstico diferencial de las complicaciones pulmonares en pacientes que reciben inhibidores de mTOR.
DERIVADOS DEL ÁCIDO MICOFENÓLICO: MOFETIL MICOFENOLATO (CELLCEPT®) O ÁCIDO MICOFENÓLICO CON RECUBRIMIENTO ENTÉRICO (MYFORTIC®)
Mecanismo de acción
El ácido micofenólico (AMF) inhibe selectivamente la síntesis de novo de las purinas, la proliferación de linfocitos T y B, la expresión de moléculas de adhesión y la proliferación de células musculares lisas de la pared vascular. Mofetil micofenolato es el éster 2-morfolinoetílico del AMF y por su parte el ácido micofenólico con recubrimiento entérico es una sal sódica.
Farmacocinética
Tras su administración oral el mofetil micofenolato se absorbe rápida y completamente y se hidroliza a AMF a su paso por el ambiente ácido del estómago. Por el contrario, el ácido micofenólico con recubrimiento entérico sobrepasa el estómago e inicia su liberación y disolución en el intestino delgado. En plasma, el ácido micofenólico se une a proteínas. A su paso por el hígado se metaboliza a glucuronato de AMF, que es un metabolito inactivo y se excreta por la bilis para posteriormente ser desglucuronizado por la acción de las bacterias intestinales y de nuevo es reabsorbido, dando lugar al ciclo enterohepático. A diferencia de la ciclosporina, el tacrolimus no bloquea el ciclo enterohepático, por lo que la biodisponibilidad es mayor. El 90% del ácido micofenólico se elimina por orina, preferentemente por excreción tubular.
Indicaciones
Suele emplearse con ciclosporina A o tacrolimus para prevenir el rechazo agudo del injerto.
La dosis habitual de mofetil micofenolato es de 500-1000 mg/12h y la de ácido micofenólico con recubrimiento entérico de 360-720 mg/12h. Debe ingerirse con el estómago vacío, 1 hora antes o 2 horas después de las comidas. Hay que tener precaución en pacientes con insuficiencia hepática y en los niños [52] [46].
Efectos adversos
Los más frecuentes son las alteraciones gastrointestinales (dolor abdominal, náuseas, vómitos y diarrea), que mejoran fraccionando la dosis en tres o cuatro tomas diarias, o bien disminuyéndola. Pueden aparecer alteraciones hematológicas (anemia, leucopenia o trombocitopenia) que no suelen ser graves y un riesgo incrementado de infecciones víricas, sobre todo por citomegalovirus. Presenta efectos teratogénicos en el feto por lo que está contraindicado su uso durante el embarazo. A pesar del riesgo teórico de malformaciones congénitas cuando es el varón quien recibe el tratamiento, éstas no se han descrito y en la práctica habitual no se suele aconsejar su sustitución o retirada.
OTROS INMUNOSUPRESORES
Bortezomib (Velcade®)
Fármaco aprobado para el tratamiento del mieloma múltiple, su mecanismo de acción se basa en la inhibición del proteosoma, de preferencia en las células plasmáticas, por lo cual se ha utilizado en tratamientos de rescate del rechazo mediado por anticuerpos refractario al tratamiento convencional.
Leflunomida (Arava®)
Es un inmunosupresor que disminuye la proliferación de linfocitos mediante la inhibición de la síntesis de pirimidina. Su uso está aprobado para el tratamiento de artritis reumatoide y artritis psoriásica. Tiene propiedades antivirales además de las inmunosupresoras, lo que hace que sea un fármaco utilizado en el tratamiento de la infección por BKV en pacientes trasplantados.
Belatacept (Nulojix®)
Es una proteína recombinante producto de fusión entre el dominio extracelular de CTLA-4 humano y un fragmento modificado del dominio Fc de IgG1 humano. La diana terapéutica de belatacept es el bloqueo del enlace CD28:CD80/CD86, señal de coestimulación requerida para la activación de células T.
Está indicado como profilaxis del rechazo agudo en trasplante renal y se utiliza en combinación con ácido micofenólico y corticosteroides e inducción con basiliximab, sin inhibidores de la calcineurina. Se administra por vía intravenosa, en dosis iniciales de 10 mg/kg los días 1 y 5, semanas 2 y 4, y meses 2 y 3 postrasplante, para continuar con 5mg/kg cada mes. A pesar de una más alta tasa de rechazo agudo, los pacientes tratados con belatacept, en comparación con ciclosporina A, presentan una mejor función renal, menor tasa de anticuerpos antilinfocitarios y mejor sobrevida del injerto a largo plazo [64].
Está contraindicado en receptores con serología negativa pretrasplante al virus de Epstein-Barr por el riesgo incrementado de presentar enfermedad linfoproliferativa.
PROTOCOLOS CLÍNICOS DE INMUNOSUPRESIÓN
Como se ha descrito a lo largo de capítulo existen múltiples fármacos inmunosupresores con diferentes mecanismos de acción que precisan ser combinados con el objetivo de evitar el rechazo agudo y crónico con los mínimos efectos secundarios, especialmente cardiovasculares, infecciosos y neoplásicos, en el paciente trasplantado [65].
La inmunosupresión en el trasplante renal se basa en la combinación de varios fármacos: 1) anticalcineurínico (ciclosporina o tacrolimus), 2) antiproliferativo (derivado de ácido micofenólico o inhibidor de mTOR) y 3) esteroides [54] [66].
No hay consenso sobre la mejor pauta terapéutica y la conducta más adecuada se basa en la individualización del tratamiento [67] (Figura 1). Para esta individualización hay que tener en cuenta algunas características del donante y receptor, que incluyen no solo el riesgo inmunológico HLA, sino también la edad, tipo de donante, la fragilidad del receptor, entre otras. Estas características se resumen en la (Tabla 3). Otros factores de interés para seleccionar o modificar la pauta de inmunosupresión son la evolución clínica inicial (función retrasada del injerto, rechazo agudo), la evolución a largo plazo o el coste del tratamiento.
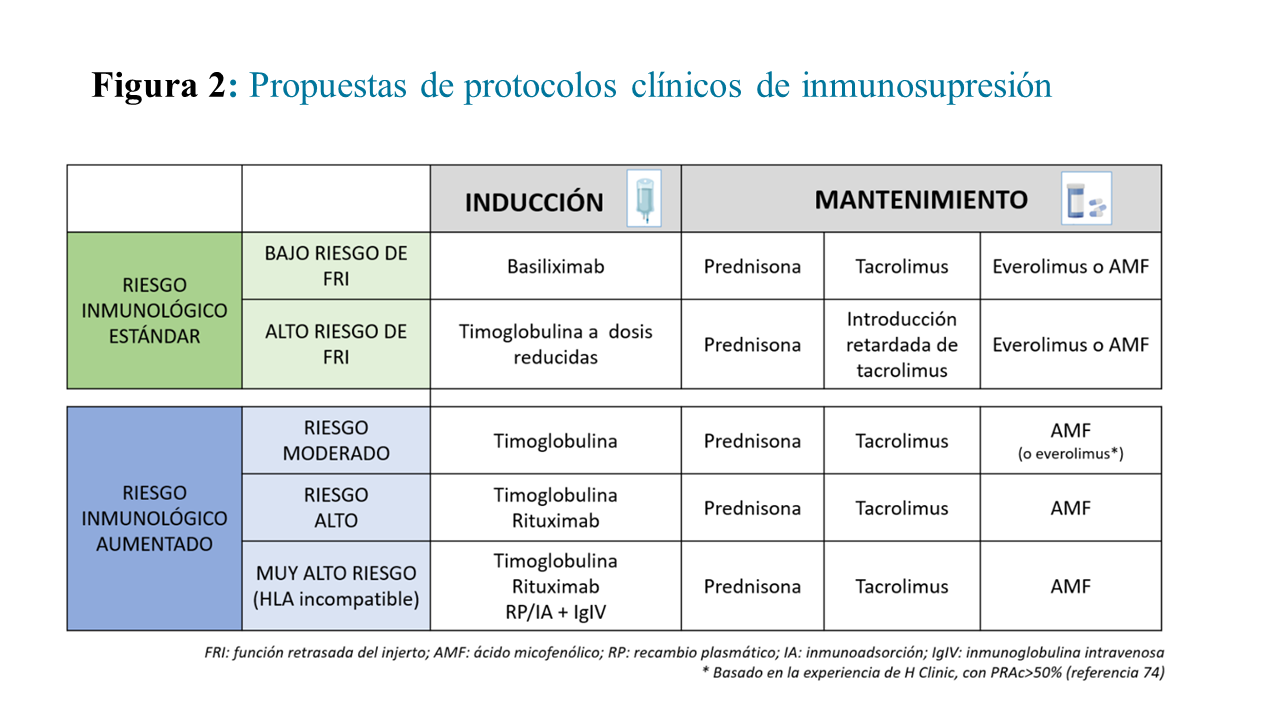
A continuación, exponemos los esquemas o estrategias de inmunosupresión más utilizados teniendo en cuanta algunas de las características de donante y receptor, aunque como se ha comentado previamente, se debe adaptar de forma individual a la evolución de cada paciente (Figura 2].
1. RIESGO INMUNOLÓGICO ESTÁNDAR o BAJO RIESGO INMUNOLÓGICO
Podemos considerar de bajo riesgo a los pacientes sin anticuerpos anti-HLA o con PRA (panel de anticuerpos anti-HLA) calculado bajo, primer trasplante o retrasplante si la pérdida del primer injerto no ha sido inmunológica.
Dentro de este grupo, diferenciamos dos subgrupos:
1.1. BAJO RIESGO DE FUNCIÓN RETRASADA DEL INJERTO (FRI)
En este grupo podemos considerar receptores de donantes óptimos con tiempo de isquemia fría bajos (<20 horas).
No existe evidencia para considerar los donantes en asistolia controlada dentro del grupo de alto riesgo de función retrasada del injerto y se podrían incluir en este grupo de inmunosupresión de bajo riesgo de FRI [68]. Sin embargo, la mayoría de los grupos de trasplante en nuestro entorno consideran que tienen alto riesgo de FRI y realizan inducción con timoglobulina siguiendo la pauta de los programas de asistolia no controlada (ver apartado 1.2).
INDUCCIÓN
Realizar terapia de inducción con el anticuerpo monoclonal basiliximab (Simulect®): una dosis de 20 mg intravenosa (iv) pre-quirófano disuelta en 50 ml de suero fisiológico o glucosado al 5% en 15 minutos, y una 2ª dosis idéntica el día +4 postrasplante. La administración se puede realizar por vía periférica.
MANTENIMIENTO
(1) Esteroides: dosis intraoperatoria de metilprednisolona al desclampaje, habitualmente de 500-250 mg (esta última es la más habitual, por la tendencia actual de ahorro de corticoides). El día +1 se administran 125 mg de metilprednisolona (o 250 mg si la primera ha sido de 500 mg y en ese caso, administrar dosis de 125 mg el día +3). Posteriormente, se continua con una pauta descendente de prednisona que varía según los protocolos de cada centro. De forma general, se utiliza prednisona oral en dosis inicial de 0,5-1 mg/día y reducción posterior, hasta alcanzar una dosis de 5 mg/día en el tercer o cuarto mes postrasplante. Se aconseja una reducción más rápida en los pacientes diabéticos.
Un ejemplo de pauta de esteroides puede ser:
- 250 mg de metilprednisolona iv intraquirófano
- 125 mg de metilprednisolona iv el dia +1
- Prednisona oral: 20 mg desde el día +2, 15 mg desde el día +15, 10 mg desde el día +29 y 5 mg desde el día +43.
No existe una evidencia clara para mantener dosis bajas de esteroides o hacer la retirada completa, parece que la retirada completa aumenta el riesgo de rechazo agudo, pero sin aumento de riesgo de pérdida de injerto a 5 años [51]. Por tanto, se puede plantear la retirada completa de esteroides a partir del 6 mes postrasplante en pacientes que se puedan beneficiar por mal control de DM, osteoporosis establecida u otras razones cuando se cumplan los siguientes criterios:
- No rechazo agudo previo
- No desarollo de anticuerpos anti-HLA de novo
- FG estimado (MDRD) >40 ml/min, estable o en mejoría
- Proteinuria < 300 mg/24 horas
- Enfermedad renal primaria de etiología no glomerular
- Combinación de inmunosupresión de mantenimiento tacrolimus y micofenolato
Para la retirada precoz de esteroides se recomienda el uso de una pauta cuádruple con anticuerpos policlonales de manera que puedan suspenderse los esteroides tras 5-7 días de Timoglobulina®.
(2) Tacrolimus: iniciar con dosis de 0,1 mg/kg/24 horas desde el día +1 postrasplante. Se prefieren formulaciones de liberación prolongada para facilitar el cumplimiento terapéutico. En caso de utilizar Envarsus® se debe emplear el 70% de la dosis.
Los niveles valle objetivo de tacrolimus dependerán del tiempo postrasplante y del segundo inmunosupresor con el que se haga la combinación. La propuesta de niveles valle es la utilizada en el Ensayo Clínico Transform [69] (Tabla 4).
(3) Antiproliferativo
En este grupo de receptores de bajo riesgo, la combinación de tacrolimus puede ser con micofenolato o con everolimus. El estudio Transform ha demostrado que ambas pautas son igual de eficaces en cuanto a la supervivencia del injerto y del paciente, función renal, rechazo agudo y desarrollo de anticuerpos donante-específicos (ADS) [70].
* Mofetil Micofenolato (comprimidos de 250 mg y 500 mg) o micofenolato sódico (comprimidos de 180 mg y 360 mg). Se puede administrar una dosis preoperatoria/intraoperatoria de 2000/1440 mg. Posteriormente continuar con 1000/720 mg cada 12 horas durante 15-30 días y bajar a 500/360 mg cada 12 horas.
No hay evidencia para la monitorización sistemática de los niveles valle de los derivados del ácido micofenólico. En general, el ajuste de dosis se hace en función de la tolerancia del fármaco (clínica gastrointestinal, infecciones, toxicidad hematológica). Según algunos estudios, los niveles recomendados serían entre 3-5 ng/ml los primeros meses y después 1.5-4 ng/ml, pero no existe consenso dado que la adecuada exposición al fármaco se debe evaluar mediante áreas bajo la curva de varias horas, que no son prácticas en la asistencia habitual [71].
* Everolimus: se inicia con dosis de 1.5 mg/12h v.o., desde el día +1 inclusive. El nivel valle objetivo es de 3-8 ng/ml. Es importante realizar niveles plasmáticos el día +4 postrasplante y si el nivel es <3 ng/ml, subir dosis al menos el 50% (es decir, subir a 2.5 mg/12h). De forma general, la propuesta más extendida es conseguir a medio plazo que la suma de niveles de ambos fármacos sea 8-10 ng/ml, siendo al principio los niveles de tacrolimus más elevados que los de everolimus para favorecer cicatrizaciones de la herida quirúrgica. Posteriormente, se debe ir reduciendo la dosis para alcanzar una suma de niveles alrededor de 8 ng/ml.
Las contraindicaciones relativas para el uso de everolimus son: enfermedad pulmonar intersticial u obstructiva crónica severa, obesidad con índice de masa corporal superior a 35 kg/m2, glomerulosclerosis focal y segmentaria primaria como nefropatía de base, síndrome hemolítico-urémico atípico, cirugías complejas vasculares, necesidad de utilización de dosis altas y niveles elevados de inhibidores de calcineurina [61]. Por tanto, en este grupo de pacientes se prefiere la combinación tacrolimus+ácido micofenólico.
1.2. ALTO RIESGO DE FUNCIÓN RETRASADA DEL INJERTO
Podemos considerar receptores con alto riesgo de FRI a aquellos que reciben un injerto renal procedente de donantes en asistolia no controlada, donantes con fracaso renal agudo (especialmente AKIN III) o tiempo de isquemia fría muy prolongado (>20horas). Además, se puede considerar en caso de donantes con criterios muy expandidos [72]. Como se ha comentado más arriba, la mayoría de las unidades de trasplante de nuestro entorno incluyen en este grupo a los donantes en asistolia controlada, aunque no existe una clara evidencia para ello.
La idea en este grupo es realizar inducción con anticuerpos policlonales con una introducción diferida de tacrolimus.
INDUCCIÓN
La terapia de inducción que se propone para este grupo es con anticuerpos policlonales (timoglobulina®) a dosis de 1-1,5 mg/kg/día [las ampollas son de 25 mg por lo que se recomienda hacer aproximación al múltiplo de 25 mg (50 mg, 75 mg, 100 mg…)]. La primera dosis se administra de forma intravenosa en el intraoperatorio iniciándose antes para contribuir a controlar la lesión de isquemia-reperfusión. La administración de timoglobulina requiere realizar premedicación con corticoides, paracetamol y dexcloferamina por el riego de reacción anafiláctica.
Posteriormente, se administrará una dosis cada 24 o 48 horas hasta completar 2-5 dosis. En algunos protocolos se recomienda usar una dosis reducida (2 dosis) en receptores de edad avanzada [73].
Se debe ajustar la dosis atendiendo a su toxicidad hematológica: se tendrá en cuenta el recuento plaquetario (reducir dosis si plaquetas <75000 y no administrar si <50000) y valorando su eficacia midiendo el porcentaje de CD3 (suspender la dosis si <10%, administrar mitad de dosis si 10-20% y dosis completa si >20%).
MANTENIMIENTO
(1) Esteroides: igual que en el apartado anterior
(2) Tacrolimus: iniciar con dosis de 0,1 mg/kg/24 horas. El inicio de este fármaco puede diferirse hasta alcanzar una función renal mínima (creatinina sérica<3 mg/dl) o el día 4-5 postraslante o no más de 48 horas antes de finalizar la pauta de inducción.
Como en el grupo previo, se prefieren formulaciones de liberación prolongada para facilitar el cumplimiento terapéutico. En caso de utilizar Envarsus® se debe emplear el 70% de la dosis.
Los niveles valle se pueden ajustar a límites más bajos 5-7 ng/ml en el primer mes postrasplante.
(3) Antiproliferativo: El tercer fármaco en la estrategia de la inmunosupresión de este grupo puede ser mofetil micofenolato/micofenolato sódico o everolimus con las mismas consideraciones que se han expuesto en el apartado anterior
>> Consideración especial en donantes en asistolia no controlada.
En la asistolia no controlada dada la elevada incidencia de función retrasada del injerto con una duración prolongada se recomienda inducción con timoglobulina y terapia de mantenimiento con esteroides, introducción retrasada de tacrolimus y ácido micofenólico. De momento, no se recomienda el uso de imTOR de inicio por la escasa evidencia en este tipo de donantes.
2. RIESGO INMUNOLÓGICO AUMENTADO
Podemos considerar tres sub-grupos:
2.1. RIESGO INMUNOLÓGICO MODERADO
Se puede considerar en este grupo pacientes con PRAc alto (>80%) sin ADS en ningún suero durante el seguimiento en lista de espera o durante el estudio para trasplante renal de donante vivo y a pacientes retrasplantados con pérdida inmunológica del primer injerto.
INDUCCIÓN
Con anticuerpos policlonales (timoglobulina®) a dosis de 1-1.5 mg/kg/día. La primera dosis se administra en el intraoperatorio en una infusión de al menos 6 horas y posteriormente, se administrará una dosis cada 24 horas durante 3-5 días (mismo ajuste de dosis que en el apartado previo).
MANTENIMIENTO
Con esteroides (mismo protocolo que en el apartado previo) + mofetil micofenolato/micofenolato sódico + tacrolimus iniciar con dosis de 0,15-0,2 mg/kg/24 horas desde el día +1 con objetivos de niveles valle los 3 primeros meses 8-12 ng/ml y luego 6-8 ng/ml.
Aunque esta es la pauta más extendida, el grupo del Hospital Clinic (Barcelona) ha publicado su experiencia con el uso de la pauta tacrolimus, everolimus y prednisona en un grupo de pacientes con PRAc>50% sin encontrar diferencias en rechazo agudo clínico/subclínico y función renal al año postrasplante [74].
Dado el elevado riesgo de rechazo, esta estrategia puede ser aplicable al trasplante renopancreático, así como al trasplante renal en niños y pacientes de raza negra, dada una mayor tasa de rechazos.
2.2. RIESGO INMUNOLÓGICO ALTO
Se puede considerar en este grupo los pacientes con ADS preformados en algún suero histórico con MFI baja (<5000), pero sin ADS en el momento del trasplante.
INDUCCIÓN
Con anticuerpos policlonales (timoglobulina®) a dosis de 1-1.5 mg/kg/día. La primera dosis se administra en el intraoperatorio y posteriormente, se administrará una dosis cada 24 horas completando las 5 dosis (mismo ajuste de dosis que en el apartado previo).
Además, este grupo de pacientes se puede beneficiar de una dosis rituximab dosis pre-implante (375 mg/m2) [redondear a múltiplos de 100 mg o administrar una dosis de 500 mg] para el control de la respuesta de la célula B.
MANTENIMIENTO
Con esteroides (mismo protocolo que en el apartado previo), mofetil micofenolato/micofenolato sódico y tacrolimus iniciar con dosis de 0,15-0,2 mg/kg/24 horas desde el día +1 con objetivos de niveles valle los 3 primeros meses 8-12 ng/ml y luego 6-8 ng/ml.
Según la evolución de los ADS postrasplante, puede ser necesario añadir una segunda dosis de rituximab +/- recambios plasmáticos +/- inmunoglobulina inespecífica intravenosa.
2.3. MUY ALTO RIESGO INMUNOLÓGICO ALTO o HLA incompatible
En este grupo de pacientes se recomienda un tratamiento para desensibilización HLA previo al trasplante en caso de trasplante de donante vivo y peritrasplante en caso de trasplante de donante fallecido.
No existe un procedimiento universalmente aceptado para llevar a cabo la desensibilización HLA. El grupo de A Coruña publicó su experiencia hace unos años con aceptables resultados y su protocolo de desensibilización incluye rituximab, recambios plasmáticos/inmunoadsorción, tacrolimus, micofenloto y prednisona [75]. En el consenso europeo publicado recientemente sobre el manejo de los pacientes con anticuerpos anti-HLA se recomienda con grado de evidencia 1C incluir en el tratamiento desensibilizador recambios plasmáticos/inmunoadsorción, inmunoglobulina policlonal y antiCD20 [76].
Otra estrategia para la desensibilización HLA es el uso de imlifidasa que es una enzima con capacidad para dividir todas las IgG de forma transitoria (4-5 días). De esta manera, se logra pasar de una prueba cruzada positiva a una prueba cruzada negativa. Actualmente, en Europa se está empleando en un ensayo clínico [77] y ha sido aprobado por la EMA y la AEMPS para su uso en trasplante renal de donante fallecido.
SITUACIONES ESPECIALES
Paciente con enfermedad renal secundaria a glomerulosclerosis focal y segmentaria (GFS) primaria
Aunque no está descrito un aumento de recidiva de GFS bajo tratamiento con inhibidores de mTOR, se recomienda la pauta de tacrolimus y ácido micofenólico, ante la conocida asociación de proteinuria nefrótica y casos de glomerulonefritis de diversos tipos y tratamiento con inhibidores de mTOR como potenciales inductores de podocitopatía.
Paciente con enfermedad renal secundaria a nefropatía IgA
Estudios observacionales han mostrado que el uso de corticoides tiene un papel protector en el riesgo pérdida del injerto por recidiva de IgA y el uso de pautas libres de corticoides se ha relacionado con un aumento significativo del riesgo de recurrencia de IgA [78].
Paciente con enfermedad renal secundaria a síndrome hemolítico urémico
Como se ha comentado al inicio del capítulo, en este tipo de pacientes se puede utilizar eculizumab como parte del tratamiento de inducción [79].
Receptores con VIH, VHB o VHC
En los pacientes, VIH se recomienda evitar la inducción con timoglobulina por el riesgo de reactivación. Si llevan fármacos antirretrovirales que interaccionan con tacrolimus (lo recomendable es realizar cambio de antirretrovirales antes del trasplante) puede ser útil el uso de tacrolimus con formulación cada 12 horas (Prograf®) para facilitar el ajuste.
Asimismo, en pacientes con infección por virus de la hepatitis C o B hay que modular la inmunosupresión y pudiera ser recomendable la inducción con Simulect® y posteriormente terapia doble con prednisona y tacrolimus en dosis más bajas. Se recomendó durante una época emplear ciclosporina A en casos VHC+ para reducir la probabilidad de desarrollo de diabetes postrasplante.
TRATAMIENTO DEL RECHAZO AGUDO
El rechazo agudo debe tratarse siempre de acuerdo con el mecanismo causante del daño y la severidad histológica siguiendo la clasificación de Banff.
* El rechazo celular agudo de grado leve-moderado (Banff 1A-1B y según grupos hasta 2A) se trata con dosis altas de corticoides, en forma de pulsos de 250-1000 mg/día, durante 3-5 días. Se recomienda no sobrepasar una dosis total de 3 gr. Los corticoides utilizados habitualmente son la prednisolona y la metilprednisolona. Posteriormente se continúa con la dosis de prednisona previa al episodio, o bien se administran 1-1,5 mg/kg/día y se disminuye de forma progresiva el tratamiento.
* El rechazo celular agudo severo (Banff 2A, 2B, 3) se tratará con bolos de metil-prednisolona y anticuerpos policlonales (5-7 días)
* Cuando aparece un rechazo agudo celular recurrente o resistente al tratamiento con corticosteroides, deben administrarse anticuerpos policlonales.
* El rechazo mediado por anticuerpos activo precoz (30 primeros días postrasplante) o asociado a la existencia de ADS preformados se recomienda tratar con bolos de metilprednisolona, recambios plasmáticos e inmunoglobulinas, pudiéndose asociar también rituximab o inhibidores del complemento [80].