Evaluación del receptor de trasplante renal
Palabras clave
Trasplante renal, estudio, receptor, contraindicaciones, evaluación cardiovascular, vacunación, infecciones, nefropatía de base, exploraciones
El trasplante renal es el tratamiento de elección en la enfermedad renal crónica estadio 5. En comparación con la diálisis crónica, mejora la calidad de vida y disminuye la mortalidad de la mayoría de los pacientes. Sin embargo, no todos los enfermos son trasplantables, y en muchos se requiere cirugía o medidas intervencionistas previas a su inclusión en la Lista de Espera de Trasplante (LE). Al mismo tiempo, los enfermos en LE >50 años, o con elevada comorbilidad (Indice de Charlson>3), o aquellos que inician diálisis con un catéter venoso permanente como acceso vascular, presentan una elevada mortalidad durante su permanencia en lista, especialmente en los primeros dos años tras su inclusión en LE [1] [2].
Los pacientes con ERC estadío 4-5 que se prevea que van a llegar a diálisis (excepto los que tienen contraindicaciones absolutas para trasplante renal) deben ser informados acerca del trasplante renal (TxR) y deben iniciarse los estudios para trasplante al menos 6-12 meses antes del inicio previsto de diálisis , con el fin de evaluar la posibilidad de trasplante de donante vivo y/o anticipado* y realizar las intervenciones necesarias de cara a corregir posibles contraindicaciones relativas que se puedan detectar en el estudio [3].
Contraindicaciones del trasplante renal
Existen contraindicaciones absolutas para el trasplante, que son generalmente aceptadas [4][5][6]:
- Neoplasia Activa con corta esperanza de vida.
- Enfermedad Crónica con corta esperanza de vida (< 1 año).
- Consumo activo de drogas o alcohol (>40 g/día en la mujer y >60 g/dia en el hombre)
- Insuficiencia orgánica severa sin posibilidades de corrección
- Psicosis no controlada.
- Amiloidosis AL con importante afectación extrarrenal, sobre todo cardiaca, por la elevada mortalidad asociada, aunque se debe evaluar de forma individualizada [3]. .
Además, existen otras contraindicaciones relativas en las que se requieren medidas diagnósticas y terapéuticas previas a la inclusión del enfermo en la LE:
- Infección activa (excepto virus de la hepatitis C)
- Enfermedad Coronaria
- Enfermedad Vascular Periférica severa
- Enfermedad Cerebrovascular
- Hepatitis en actividad o enfermedad hepática crónica
- Úlcera Péptica activa
- No adherencia al tratamiento demostrada
- Infección VIH si no cumpliese una serie de requisitos básicos relacionados con la carga viral e inmunidad.
- Hiperparatiroidismo severo [7]
Pasamos ahora a analizar pormenorizadamente las distintas situaciones.
Edad del receptor
La edad del receptor no debe considerarse una contraindicación para el trasplante. Sin embargo, muchas de las contraindicaciones relativas, en especial las cardiovasculares, son más prevalentes en la población añosa. Por ello, en general se acepta que la mayoría de los receptores menores de 50 años, sin enfermedad cardiovascular previa, sin diabetes, sin excesiva fragilidad física, con un tiempo en diálisis menor de 2 años y sin antecedentes familiares de patología cardiovascular pueden tener acceso libre al trasplante, mientras que los de edad superior o con comorbilidades adicionales deben ser evaluados individualmente. Debe hacerse especial hincapié en la patología cardiovascular y el screening de neoplasias, además de evaluar la fragilidad y aspectos psicosociales, aunque se sabe que el trasplante renal, incluso en receptores mayores de 70 u 80 años, ofrece mejor supervivencia y calidad de vida que la permanencia en diálisis, si bien presentan mayor morbilidad cardiovascular e infecciosa que receptores más jóvenes. Sin embargo no hay guías que establezcan claramente las pruebas a realizar y el intervalo de tiempo en que deben repetirse si el paciente no se trasplanta [5][8].
Patología cardiovascular
La enfermedad cardiovascular es la primera causa de mortalidad y morbilidad tras el trasplante, de ahí que sea muy importante una adecuada evaluación previa [4][9][10][11][12][13][14][15].
Enfermedad Arterial Coronaria
El análisis inicial requiere una evaluación clínica cuidadosa y una valoración de los factores de riesgo y los propios inherentes a la uremia (tiempo en diálisis, catéter central, etc); además de disponer de ECG y ecocardiografía convencional (modo M- y 2D). Se analizará la presencia o no de las siguientes alteraciones:
- Manifestaciones clínicas actuales o previas de enfermedad arterial coronaria.
- Factores tradicionales de riesgo cardiovascular e inherentes a la uremia:
- Edad > 50 años
- Diabetes
- Dislipemia
- Hipertensión Arterial
- Obesidad (IMC>30 kg/m2)
- Tabaco
- Historia familiar de muerte súbita o de enfermedad arterial coronaria precoz.
- Calcificaciones vasculares
- Tiempo en diálisis > 24 meses
- Alteraciones ECG sugestivas de isquemia o necrosis antigua miocárdica.
- Alteraciones ecocardiográficas. Son signos indirectos de enfermedad isquémica subyacente:
- Fracción de Eyección (FE) < 45%
- Defectos segmentarios de contractilidad de la pared miocárdica
- Signos de disfunción diastólica (onda E/A <1).
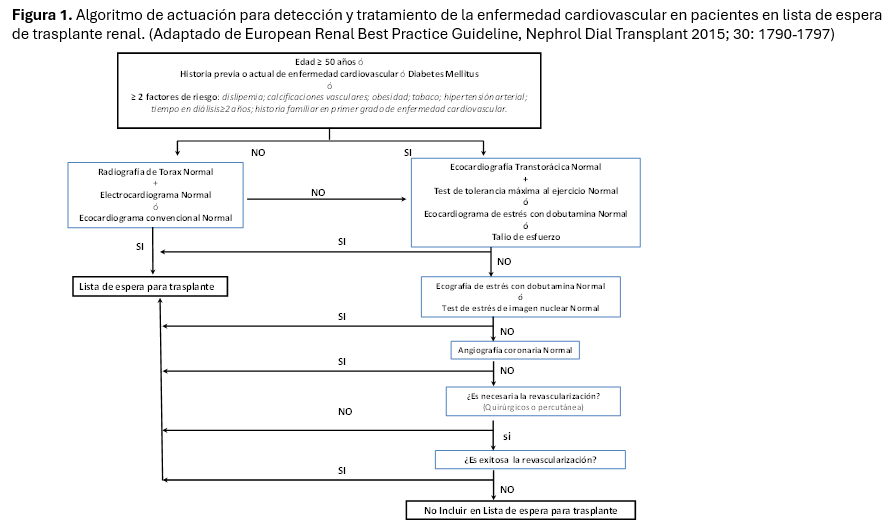
Los enfermos no diabéticos menores de 50 años sin alteraciones en estos dos niveles, y que no tengan fragilidad física manifiesta pueden trasplantarse directamente tras la constatación de una radiografía de tórax normal y de un EKG o una ecocardiografia transtorácica convencional (modo M y 2-D) también dentro de la normalidad (Figura 1). Los que no cumplan estos criterios deben ser sometidos a una ecocardiografía convencional más una prueba de tolerancia máxima al ejercicio. Las alteraciones ecocardiográficas sugerentes de cardiopatía isquémica incluyen: fracción de eyección <45% y defectos segmentarios de contractilidad de la pared miocárdica. En aquellos pacientes que por sus condiciones físicas no pudieran realizar un test de tolerancia al ejercicio o su resultado no sea concluyente, serán sometidos a una prueba de stress más específica como un talio de esfuerzo, un ecocardiograma de stress con dobutamina o aun angioTAC coronario [16]. La elección dependerá de la experiencia de cada centro.
Los que muestren un test positivo deberán ser sometidos a una coronariografía, así como quienes tengan clínica actual o previa de enfermedad arterial coronaria. Si se demuestra isquemia atribuíble a lesión de tronco o DA proximal, deberán revascularizarse (“factor de riesgo”) mediante Angioplastia Transluminal Percutánea (ATP) o by-pass coronario; la isquemia asintomática de otros territorios (p ej la CD), no precisan actuación, ya que no mejora el pronóstico (es “marcador de riesgo”). Se recomienda repetir la ETT cada 2 años si el paciente no se trasplanta y por supuesto, optimizar el tratamiento médico, sobre todo control de los lípidos, la tensión arterial y el peso y recomendar ejercicio físico (Figura 1) [17]. En el caso de realizarse revascularización coronaria con colocación de stent recubierto en arterias coronarias, dado que es necesaria la doble antiagregación durante al menos 6 meses, su inclusión en lista de espera debe retrasarse durante este periodo de tiempo por el alto riesgo de sangrado.
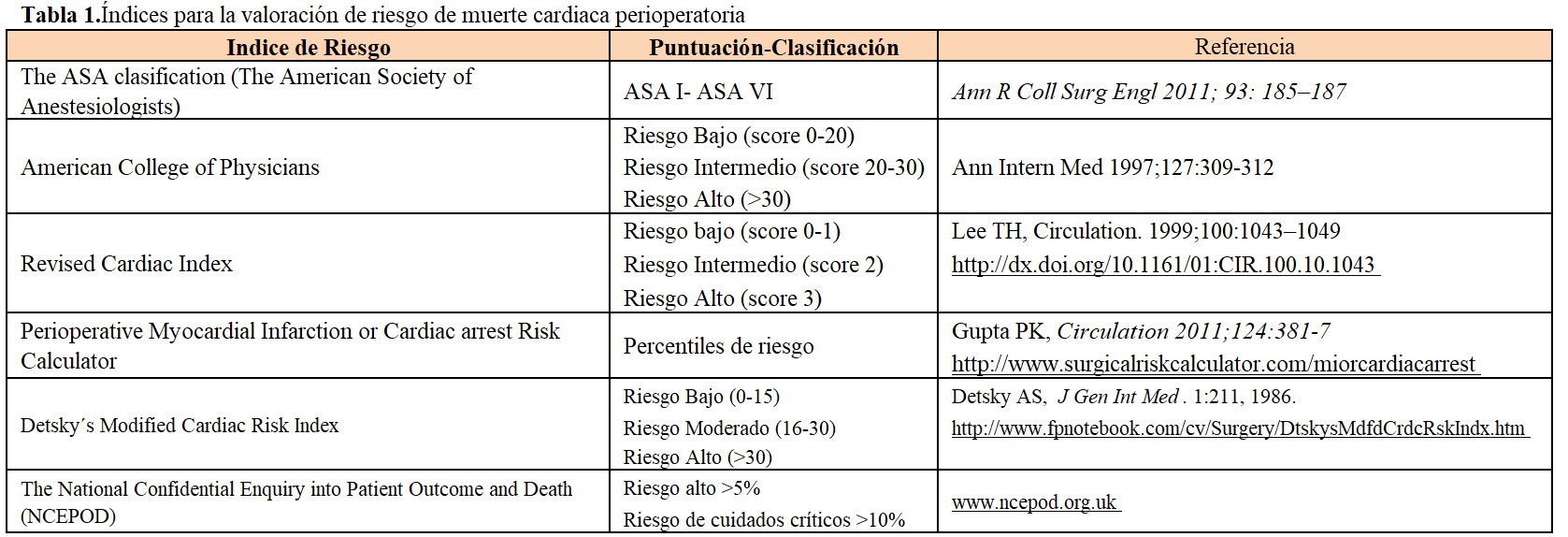
En general, debería evaluarse sistemáticamente el riesgo cardiaco y de morbi-mortalidad perioperatoria en pacientes en LE. Inicialmente es recomendable evaluar el riesgo perioperatorio a partir de la clasificación del Colegio Americano de Anestesiología (ASA) más la aplicación de algún índice de riesgo cardiaco que incluyen comorbilidades y la historia previa de enfermedad cardiaca (Tabla 1). Estas herramientas clínicas nos permitirán clasificar a los pacientes según el nivel de riesgo de muerte (bajo, intermedio y alto) a corto y más largo plazo. Obviamente, en los pacientes de riesgo intermedio y alto debería realizarse una cuidadosa evaluación de la enfermedad arterial coronaria.
Se puede considerar contraindicación relativa para trasplante renal si [18].
- IAM en los últimos 3-6 meses
- Miocardiopatía isquémica “no tratable” con disfunción sistólica severa (<30%); se podría considerar trasplante combinado cardio-renal en pacientes seleccionados.
- Angina a pesar de revascularización percutánea o quirúrgica.
Valvulopatías:
Los pacientes con enfermedad valvular severa deberán ser valorados y tratados por el cardiólogo pre-trasplante renal [18].
Los pacientes con ERC y estenosis valvular aórtica moderada, se pueden considerar “rápidos progresadores”, por lo que se les debe realizar ecocardio anual y monitorizar la aparición de síntomas precoces [17].
Enfermedad Vascular Periférica
La EVP es un factor de riesgo de mortalidad en los pacientes en LE y tras el trasplante renal [19][20]. Asimismo, la ateromatosis aortoilíaca severa puede suponer un problema técnico importante a la hora del implante, principalmente en diabéticos y, a más largo plazo, puede ser causa de amputación distal. Por ello, en general, se acepta que los enfermos sintomáticos o con signos claros de isquemia periférica o calcificaciones vasculares severas deben evaluarse con pruebas de imagen, como AngioTAC o angiografía completa, que incluyan exploración de la circulación más distal, realizando una corrección quirúrgica o angioplastia electiva de las lesiones significativas antes de incluir al paciente en lista de espera [21].
Enfermedad Neurológica
En los enfermos añosos (>60 años) con factores de riesgo vascular (hipertensión arterial, tabaco y dislipemia) debe de investigarse la presencia de estenosis carotídea, aunque las Guías KDIGO 2020 no recomiendan hacer screening en pacientes asintomáticos. Los pacientes en diálisis con antecedentes de ACV isquémico deben esperar al menos 6 meses antes de incluirlos en lista de espera. Durante ese tiempo debemos prescribir tratamiento antiagregante y corregir los factores de riesgo. Los pacientes con historia de isquemia cerebral transitoria deben ser evaluados con ecografía doppler carotídea con el fin de descartar la presencia de estenosis significativa y aunque no hay claro consenso, los expertos opinan que debe esperarse 3 meses antes de incluir en Lista de Espera [3]. Si la cirugía o angioplastia están indicadas deben realizarse electivamente antes del trasplante. Los enfermos con poliquistosis renal, con antecedentes familiares de aneurismas intracraneales o personales de hemorragia subaracnoidea, deben investigarse antes del trasplante mediante TAC de alta resolución o RMN.
Los pacientes con enfermedades neurodegenerativas progresivas, no se deben trasplantar si la expectativa de vida o calidad de vida esperada no so buenas.
No se deben excluir candidatos por déficit intelectual o deterioro cognitivo no progresivo.
Infecciones
La presencia de una infección activa es una contraindicación para el trasplante, sobre todo aquellas que amenazan la vida del enfermo. En este apartado hay que tener presente que existen infecciones que se mantienen relativamente asintomáticas hasta que se inicia el tratamiento inmunosupresor, por ejemplo la tuberculosis; por ello es recomendable su investigación protocolizada [4][5][22][23], y tratarlos adecuadamente antes del trasplante. No debemos olvidarnos de las infecciones dentales. La (Tabla 2) y la (Tabla 3) muestran las infecciones y situaciones más frecuentes a descartar antes del trasplante.
Inmunización
El calendario vacunal debe estar actualizado en el momento del TxR. La vacunación infantil debe seguir el calendario local. Las vacunas de virus vivos atenuados solo pueden emplearse antes del trasplante, mientras que las de virus inactivados se pueden administrar pre o postrasplante. El trasplante debe demorarse al menos 1 mes tras recibir vacunas de virus vivos atenuados [3].
Se recomienda la vacunación contra la hepatitis B, neumococo, haemophilus, meningococo, tétanos-difteria (Tabla 4). Es aconsejable que el paciente tenga el calendario de vacunación al día y lo lleve consigo.
Otras vacunas:
- Vacunación anual de la gripe estacionaria
- Revacunación frente al Neumococo cada 5 años
- Revacunación cada 10 años del Tétanos-Difteria
- Hepatitis A: 1 dosis basal y 6º mes si no está inmunizado.
- Revacunación hepatitis B (igual que pauta previa) si no respondedor.
- Vacunación antivaricela (VVZ): 1 dosis basal y a los 2 meses en pacientes IgG negativo, especialmente en población pediátrica.
- Vacunación frente al virus herpes zóster si IgG frente a VVZ es positiva(1 dosis basal y la 2ª a los 2 meses, pero puede administrarse hasta 6 meses después, si se requiere flexibilidad) con la vacuna recombinante adyuvada.
- Vacuna frente a Sars-cov2
- Triple vírica: 1 dosis en pacientes con Rubéola IgG negativo.
- Fiebre amarilla: en los procedentes de área endémica que puedan volver. Una dosis cada 10 años. Enviar a Sanidad Exterior.
Esperar un mes tras la vacunación para el trasplante en caso de de ser de virus vivos atenuados, aunque si la vacuna es de virus inactivados no hace falta esperar, si bien son necesarios al menos 15 días desde la vacunación para que el paciente se inmunice.
En los pacientes esplenectomizados y/o susceptibles de recibir tratamiento con inhibidores del complemento (por ejemplo en aquellos con SHUa como enfermedad de base) se recomienda la vacunación antimeningocócica con la vacuna tetravalente conjugada frente a los serotipos A;C; Y ,W135 (1 dosis) y vacuna frente al meningococo B (2 dosis). También se sugiere, en virtud de la exposición directa o del área endémica de donde se proceda, la vacunación contra rabia, encefalitis japonesa B inactivada, salmonella typhi inactivada, vacunación contra el virus del papiloma en jóvenes de ambos sexos (2 dosis separadas de 6 meses) previamente a su exposición al virus (para las cepas oncogénicas 16 y 18, que son las que se identifican en el 70% aproximadamente de los cánceres de cervix).
VIH
La infección por VIH tratada con los nuevos antiretrovirales no se considera una contraindicación absoluta para el trasplante renal siempre que los pacientes reúnan los siguientes requisitos: correcto seguimiento del tratamiento retroviral; RNA del virus indetectable durante al menos 3 meses; un recuento de CD4 mayor de 200/uL; ausencia de infecciones oportunistas en los 6 meses previos; y ausencia de leucoencefalopatía multifocal, linfoma o criptospordiosis crónica intestinal. Se recomienda consensuar con el Servicio de Infecciones el tratamiento antirretroviral a recibir post-trasplante, dadas las interacciones con los inmunosupresores de muchos de ellos. En estos casos, se podrían incluir, si no hay otra contraindicación, en lista de espera para trasplante renal ya que los resultados obtenidos son favorables Lo que sí se ha descrito en receptores VIH (+) es una mayor tasa de rechazo agudo con respecto a los VIH (-) [24] de causa multifactorial, lo que podría prevenirse utilizando anticuerpos monoclonales como terapia de inducción , así como tratamiento antirretroviral basado en inhibidores de las integrasas, que interaccionan menos con los anticalcineurínicos [5] [23] [25] [26].
Tuberculosis
Los pacientes con infección activa deben recibir tratamiento completo antes de incluirlos en lista de espera. A todos los candidatos a trasplante se les debe realizar una radiografía de tórax y eventualmente un PPD (Mantoux) o IGRA (Interferon Gamma Release Assay), como ELISPOT o Quantiferon TB Gold [27]. La quimioprofilaxis con isoniacida durante 6-9 meses (5 mg/Kg/día sin sobrepasar los 300 mg/día) debe realizarse en pacientes con: a) historia previa de infección activa no tratada, b) anomalías radiológicas sugerentes, c) PPD (+) (si no evidencia de que hayan sido vacunados previamente) o PPD(-) pero IGRA (+) ó d) procedencia de áreas de alto riesgo. La profilaxis se puede hacer pre o postrasplante, aunque es preferible que se lleve a cabo en el pretrasplante. En cualquier caso, sólo se realiza una vez. En general, antes de iniciar el tratamiento profiláctico se debe descartar infección activa mediante cultivo y PCR para micobacterias en sangre, esputo y orina.
CMV
La infección por CMV tiene un alto riesgo de morbimortalidad en los casos de receptor seronegativo y donante seropositivo.
En previsión de una profilaxis adecuada postrasplante, debe investigarse la presencia de anticuerpos anti-IgG y anti-IgM contra CMV en la pareja donante-receptor. En general se recomienda quimioprofilaxis con valganciclovir oral durante al menos 3-6 meses [28] [29]. Hay grupos que hacen profilaxis universal postrasplante, otros que sólo hacen profilaxis en los receptores de riesgo (D+/R-) y otros que hacen tratamiento anticipado, mediante seguimiento con PCR de CMV durante los 3-6 primeros meses o tras tratamiento de episodios de rechazo agudo.
Infección del acceso del acceso vascular para hemodiálisis
El riesgo de sepsis y endocarditis es alto en el caso de que el trasplante se realice en un enfermo con infección del acceso vascular, por lo que es importante descartar su presencia. En los pacientes en diálisis peritoneal con peritonitis, debe evitarse el trasplante hasta que no pasen 3-4 semanas de su tratamiento. Se recomienda obtener muestra de efluente peritoneal para células en el momento de la alarma de trasplante y retirar el catéter de DP en el acto del trasplante.
El concepto del receptor de trasplante como un potencial generador de bacterias multirresistentes debe ser reconocido y evitado. En los candidatos a trasplante se recomienda la detección de portadores nasales de MRSA y su tratamiento con mupirocina nasal (una aplicación cada 8-12 h durante 5-7 días). Otros microorganismos colonizadores son el enterococo resistente a vancomicina, y Klebsiella productora de carbapenemasas, aunque no está establecida su detección de rutina en todos los Centros ni hay consenso a este respecto, si bien estos gérmenes pueden causar infecciones graves en el postoperatorio inmediato de estos pacientes sometidos a inmunosupresión.
Otras
BK Polyoma Virus (BKV)
Se recomienda que en aquellos pacientes que han perdido un injerto previo por nefropatía por BK virus, la carga viral sea negativa antes del nuevo trasplante. En pacientes con carga persistentemente positiva debe considerarse la nefroureterectomía del injerto, pero no hay evidencias robustas que lo justifiquen.
Virus Epstein-Barr (VEB)
El riesgo de enfermedad por VEB es de 10 a 50 veces mayor en los receptores seronegativos comparados con los seropositivos. . La serología frente a EBV es útil para estratificar el riesgo de sd linfoproliferativo post-trasplante (SLPPT). Se sugiere monitorizar la serología y la carga viral periódicamente postrasplante, especialmente en los pacientes seronegativos y en los niños, para modular la inmnosupresión e iniciar profilaxis antivírica, dada su relación con los procesos linfoproliferativos. Por ejemplo está contraindicado el uso de belatacept en receptores seronegativos dado el riesgo de linfoma cerebral. Así mismo, el riesgo de desarrollar SLPPT en niños seronegativos que reciben órganos de donantes seropositivos es del 100%.
Herpes simple virus 1 y 2, varicela zóster
A efectos prácticos, aunque la determinación de anticuerpos específicos es norma habitual en los protocolos de evaluación del receptor, su utilidad en la práctica clínica puede ser cuestionable ya que, en muchas ocasiones, se indica la profilaxis con antivíricos una vez que se ha trasplantado al paciente.Recientemente la ONT ha recomendado repetir la serología frente a HSV I y II justo antes del trasplante a pacientes IgG (-), ya que existe un alto riesgo de mortalidad si la primoiinfección por estos virus ocurre en el postrasplante inmediato, procedente de un donante que pudiera hallarse en período ventana, si no hay sospecha clínica (hepatitis con fiebre, leucopenia y dolor abdominal) [http://www.ont.es/infesp/DocumentosDeConsenso/infecciondonante.pdf]. Sin embargo, no hay suficiente evidencia que respalde la profilaxis sistemática en receptores seronegativos de órganos de donante seropositivo.
Toxoplasma gondii
la determinación de anticuerpos específicos frente a este protozoo es obligada por las graves, aunque infrecuentes, complicaciones que puede originar. La mayor parte de la población adulta suele presentar anticuerpos que revelan una infección pasada y el establecimiento de un estado crónico. El marcador de elección serán los anticuerpos IgG específicos, siendo la determinación por ELISA el método más habitual en los laboratorios.
Treponema pallidum (sífilis)
Aunque la infección latente por esta espiroqueta no constituye una contraindicación absoluta para el trasplante, se recomienda realizar la detección serológica y, si es posible, determinar el estadio de la enfermedad y administrar el tratamiento correspondiente con penicilina IM pretrasplante. El cribado debe hacerse mediante una prueba reagínica o no treponémica (VDRL o RPR), si bien, un resultado positivo debe ser interpretado de acuerdo con las características del candidato, siendo obligada su confirmación mediante pruebas específicas treponémicas (TPHA, FTA-Abs).
Otras infecciones
En receptores procedentes de áreas endémicas se recomienda conocer la serología frente a HTLV I y II, Chagas, histoplasmosis y coccidiodomicosis, aunque en estos dos últimos una serología negativa no descarta una infección latente.
Enfermedad hepática
Elevación de aminotransferasas con serología vírica negativa
En estos pacientes se debe investigar la PCR en suero de los virus hepatotropos, excluirse causas no virales de enfermedad hepática (tóxicas, metabólicas, inmunitarias o fármacos), así como valorar hacer el diagnóstico de infección oculta por VHC [30]. Recordar que pacientes con cirrosis avanzada pueden no ser candidatos a trasplante renal aislado sino doble hepatorrenal.
Hepatitis Vírica B o C
Se debe tener en cuenta varios aspectos generales y válidos para ambos tipos de infecciones [31] [32] [33] [34] [35] [36].
a) Determinar anticuerpos anti-VHC y PCR de VHC y del VHB en todos los enfermos con insuficiencia renal crónica que vayan a iniciar tratamiento sustitutivo con diálisis o a entrar en lista de trasplante renal.
b) En los enfermos en diálisis con hepatitis B ó C pueden existir lesiones hepáticas importantes aún con enzimas normales, por lo que debe considerarse realizar biopsia hepática o elastometría (menos invasiva) en los pacientes portadores de HBsAg, o de anticuerpos contra el virus C o PCR positiva para alguno de estos virus independientemente de los niveles de enzimas.
c) Todo paciente que inicia tratamiento antiviral debe disponer de una analítica general, el genotipo y subtipo viral, una determinación de carga viral y una elastografía de transición u otro método no invasivo que evalúe el grado de fibrosis de forma fiable.
d) Todo paciente portador de virus de hepatitis B o C que va a recibir tratamiento inmunosupresor, deben ser evaluado y preferentemente controlado por el hepatólogo. Habrá de ser informado de que tras la inmunosupresión se puede reactivar la enfermedad viral hepática, lo que podría ensombrecer el pronóstico.
e) La hepatitis crónica activa es una causa importante de morbimortalidad en el postrasplante tardío y de disfunción del injerto renal.
f) El estado de inmunosupresión tras el trasplante renal puede favorecer la reactivación del virus y condicionar la supervivencia del paciente e injerto. Por tanto, la erradicación viral pretrasplante favorecería una mejor evolución tras el mismo.
g) Se recomienda determinar si los candidatos a trasplante renal con virus de la hepatitis C o B padecen también carcinoma hepatocelular haciendo uso de la guía de práctica clínica EASL-EORTC sobre el manejo del carcinoma hepatocelular (marcadores séricos y ecografías periódicas cada 4-6 meses), especialmente en pacientes con fibrosis avanzada (F3-F4).
El abordaje de los pacientes con VHB o VHC en diálisis abarcaría las siguientes sugerencias o recomendaciones:
Virus Hepatitis B
a) Retrasar el trasplante en los sujetos portadores de HBsAg con replicación vírica activa (HBeAg (+) ó DNA polimerasa (+) o Delta positivos) hasta ser tratados y haber obtenido respuesta.
b) Diversos estudios han demostrado que el tratamiento antiviral con análogos de núcleotidos disminuye muy significativamente el riesgo de reactivación del VHB. La administración de dichos fármacos debe iniciarse al menos una semana antes de iniciar el tratamiento inmunosupresor y mantenerse. El tratamiento antiviral preventivo es más eficaz que el tratamiento de la reactivación una vez producida. La lamivudina, por su elevada tasa de resistencias, ha sido sustituida por entecavir, que ha demostrado ser mucho más potente y con baja capacidad para producir resistencias por su elevada barrera genética, especialmente en pacientes no tratados previamente con lamivudina o sin resistencia previa a la misma, o por el tenofovir (análogo de nucleótido, es la opción indicada en los casos de resistencia a lamivudina, porque el entecavir tiene un perfil desfavorable en esos pacientes, se debe ajustar la dosis a una vez en semana para los pacientes en diálisis).
c) Se deben monitorizar PCR de DNA del VHB cada tres meses para detectar resistencias.
d) Se recomienda la vacunación del VHB en todos los pacientes con enfermedad renal crónica en etapa prediálisis o diálisis.
e) pueden recibir trasplante renal los pacientes con HBcAc +, independientemente de que el HBsAc sea + o -, teniendo en cuenta que el riesgo de reactivación es < 5%, por lo que se debe hacer PCR VHB c/3 meses durante el 1º año postrasplante [3].
Virus Hepatitis C
a) Los inmunosupresores no interaccionan significativamente con los antivirales de acción directa (AADs) a excepción de la combinación Ombitasvir, Paritaprevir, y ritonavir+Dasabuvir (OBV/PTV/rtv+DSV). El uso de esta combinación exige el ajuste cuidadoso de las dosis de los inmunosupresores, especialmente los inhibidores de la calcineurina. . En el caso de glecaprevir/pibrentasvir (GLE/PIB), aumenta 1,45 veces el AUC de tacrólimus, por lo que hay que monitorizar niveles estrechamente.
b) Los enfermos que hayan recibido un trasplante renal y permanezcan infectados por VHC deben recibir tratamiento antiviral libre de Interferón con los nuevos AAD.
Se recomienda tratar antes del trasplante renal a todos los pacientes ERCA con hepatitis C [36].
Con los nuevos AAD se obtiene éxito en un 97-100% de los casos; por lo tanto, el tratamiento de la hepatitis C con estos fármacos lleva a la respuesta virológica sostenida (RVS), esto es, a la curación virológica y beneficia a casi la totalidad de los pacientes con infección crónica. Esta RVS se asocia con reducción de la mortalidad global, de la de causa hepática, necesidad de trasplante hepático y disminuye la tasa de ca. hepatocelular, incluso en pacientes con cirrosis avanzada. [HCV Guidance: Recommendations for Testing, Managing and Treating Hepatitis C. AASLD. www.HCVGuidance.org].
Daclatasvir, Elbasvir, grazoprevir, ledipasvir y simeprevir tienen principalmente metabolismo hepático y se eliminan mínimamente por orina, por lo que no requieren ajuste de dosis en IR. Con aclaramiento de creatinina por debajo de 30 ml/min/1,73 m2 de sc no debe usarse sofosbuvir, ya que en el estudio HCV- TARGET se encontró mayor tasa de efectos adversos en pacientes con eGFR < 30 ml/min, aunque la respuesta al tratamiento fue alta y comparable a los otros grupos sin disfunción renal.
Cáncer
Una neoplasia activa (a excepción del cáncer cutáneo no melanoma) es una contraindicación absoluta para trasplante. Las Guías KDIGO de 2020 también consideran excepciones a esta norma el ca. próstata Gleason ≤ 6 y el tumor renal incidental ≤ 1 cm de diámetro máximo.
La inmunosupresión favorece el crecimiento de las células malignas, la supervivencia del paciente trasplantado puede ser pobre y las opciones de tratamiento limitadas. Por esta razón, en los enfermos de más edad en diálisis se debe investigar la presencia de neoplasia oculta.
Las Guías Europeas sobre manejo y evaluación de receptores y donantes renales recomiendan:
a) Screening de cáncer a los candidatos a trasplante renal siguiendo las mismas recomendaciones que para la población general. Se debe realizar Rx tórax a todos los candidatos y TACAR tórax (Tomografía Axial Computarizada de alta resolución) a los fumadores activos o exfumadores de ≥ 30 paquetes/tabaco/año
Se recomienda determinar PSA en varones > 50 años; si son de raza negra o tienen Hª familiar de ca. próstata, se recomienda que se determine a partir de los 40-45 años. En todas las mujeres > 20 años citología vaginal; en las > 40 años, se debe realizar mamografía, aunque esta prueba se debe adelantar a los 35 años si tienen Hª familiar en 1º grado de ca . mama. Además, se debe solicitar SOH y si es (+), hacer colonoscopia, si bien algunos grupos proponen colonoscopia en todos los pacientes > 50 años [37].
b) Ecografía para descartar cáncer de riñón, y a que la incidencia de cáncer renal está aumentada en pacientes con enfermedad renal crónica terminal (ERCT) [6]. Tanto la ERCT como el tratamiento con diálisis aumentan la incidencia de enfermedad renal quística adquirida (AKCD, siglas en inglés), que a su vez es un factor de riesgo de desarrollo de ca. de células renales. Además, la incidencia de AKCD aumenta con el tiempo en diálisis, desde un 10% en pacientes que llevan menos de 3 años en diálisis hasta más del 90% en pacientes que llevan más de 5 años en diálisis. Otros factores de riesgo de ca. renal son aquellos pacientes cuya ERC de base es una nefropatía de origen tóxico, infeccioso u obstructivo. Otros grupos proponen como screening TAC abdomen sin contraste, aunque esta prueba podría infraestimar la incidencia de ca. Renal, si son lesiones muy pequeñas [38].
c) Se recomienda descartar en receptores con VHC o VHB, la existencia de ca. hepatocelular, usando la guía de práctica clínica EASL-EORTC [39].
d) En pacientes con alto riesgo de cáncer de vejiga, como aquéllos que han recibido ciclofosfamida, se r4ecomienda realizar citología de orina y/o cistoscopia [4].
e) Los pacientes con Gammapatía Monoclonal de Significado Incierto (GMSI) deben ser evaluados pretrasplante renal por un hematólogo para excluir mieloma [40], si bien un porcentaje de estos pacientes pueden evolucionar post-trasplante a Mieloma. En pacientes con mieloma múltiple asintomático o quiescente debe considerarse individualmente la posibilidad de trasplante ya que con los nuevos quimioterápicos (bortezomib, talidomida, lenalidomida) y el trasplante de médula ósea, el pronóstico de estos pacientes está cambiando favorablemente.
f) En el caso de candidatos con antecedentes de cáncer, se recomienda que cada caso sea evaluado junto al oncólogo. El tiempo de espera libre de recidiva dependerá del tipo de cáncer, en general de 2 a 5 años, y comenzará a contar desde el final del tratamiento curativo. Véase Tabla de KDIGO Clinical Practice Guideline on the Evaluation and Management of Candidates for Kidney Transplantation [3].
De forma general, las Guías recomiendan:
f.1) incluir en LE de forma inmediata a aquellos pacientes sometidos a tratamiento curativo (quirúrgico u otro) con Ca basocelular o epidermoide de piel, melanoma in situ o carcinoma in situ (ductal o cérvix) , Ca Tiroides papilar o folicular de bajo grado < 2 cm y aquellos a los que se ha detectado de forma casual Ca renal ≤ 3 cm que ha sido extirpado con éxito completamente y ca próstata con score Gleason≤ 6 y ca. superficial de vejiga [3].
f.2) pacientes con cáncer curable extendido o metastásico como ca. testicular o linfoma, esperar al menos de 1-3 años sin evidencia de enfermedad para el trasplante.
f.3) pacientes con cáncer de mal pronóstico, como pulmón, estómago, cerebro, esófago, melanomas o mesoteliomas, se desaconseja totalmente el trasplante antes de 5 años.
f.4) pacientes con cualquier tipo de cáncer metastásico o extendido (excepto ca. testicular o linfomas): se desaconseja totalmente el trasplante.
Nefropatía de base
Muchas nefropatías pueden recurrir tras el trasplante aunque en la mayoría de los casos la reaparición tiene poca relevancia clínica y es responsable de la pérdida del injerto en menos del 5% de los casos [4][5][13][22][41]. Entre las que con más frecuencia recurren están la glomerulosclerosis focal y segmentaria (GSFS), GN membranosa, membranoproliferativa, mesangial IgA y diabetes. Siempre que se sospeche la recidiva de la enfermedad de base se debe realizar una biopsia del injerto. El tiempo óptimo para llevar a cabo el trasplante puede depender de la enfermedad de base. Se deben tener en cuenta, las siguientes consideraciones:
a) En la enfermedad por anticuerpos antimembrana basal y en las vasculitis ANCA positivo se debe retrasar el trasplante al menos 6 meses y cuando los anticuerpos se hayan negativizado.
b) En el Lupus Eritematoso Sistémico se debe retrasar el trasplante hasta alcanzar la quiescencia de la enfermedad con dosis bajas de esteroides (no más de 10 mg/día), debiendo estar la serología negativa o escasamente alterada de forma estable. En esta circunstancia la recurrencia clínica es menor del 1%. En la púrpura de Schönlein-Henoch, granulomatosis con poliangeítis y otras vasculitis, y en la escleroderma, también debe alcanzarse la quiescencia de la enfermedad.
c) En la glomerulonefritis esclerosante focal idiopática o primaria deben diferenciarse las formas de evolución maligna (< 3 años entre el diagnóstico y la uremia terminal) de las restantes. En el primer caso la recurrencia es aproximadamente del 50%, y del 10-30% en el segundo. La recurrencia es mayor (60-80%) cuando ésta ya ocurrió en un trasplante previo, y es la causa de la pérdida del injerto en más del 50% de los casos. En general estas cifras no contraindican el trasplante pero deben notificarse al enfermo y/o a la familia, y al donante en caso de que se considere el trasplante de vivo. Es importante distinguir la enfermedad idiopática de la HSF secundaria (ésta última no suele recurrir). En pacientes con alto riesgo de recidiva se recomienda no usar anticuerpos policlonales en la inducción [41]. La determinación pretrasplante del receptor de la urokinasa circulante pudiera ayudar a predecir las recidivas postrasplante de esta entidad [42].
d) Hasta un tercio de los enfermos con síndrome de Alport pueden mostrar anticuerpos antimembrana basal en una biopsia postrasplante (depósito de IgG lineal), aunque esto solo tiene traducción clínica en un número muy reducido de casos. Cuando la mutación del gen COL4A5 sea una deleción, el riesgo de enfermedad antimembrana basal parece ser mayor. Por tanto, si es posible un estudio genético de la familia, debería analizarse el tipo de mutación.
e) El síndrome hemolítico urémico (SHU) típico no es una contraindicación para el trasplante renal, ni de vivo ni de cadáver. En el caso del SHU atípico (SHUa) clásicamente se ha descrito un elevado porcentaje de recurrencia post-Tx (en torno 50%) , con una elevada tasa de pérdida de injerto ( de hasta 80-90%), aunque los resultados varían en función de la anomalía del complemento subyacente, de tal forma que las mutaciones en el factor H son las que se asocian con mayor riesgo de recurrencia o pérdida del injerto tras el TxR (75-90%);el riesgo también es muy elevado con las mutaciones en C3 y FI (40-80%) y en el caso de mutaciones en el FB, en el 100% casos se produjo recurrencia del SHUa y pérdida del injerto. Por el contrario, si lo que subyace es una mutación en MCP o la presencia de autoanticuerpos contra el FH el riesgo de recidiva es menor (en este último caso la recurrencia se relaciona con niveles elevados de autoanticuerpos) [43] [44]. A pesar de todo, el riesgo de recurrencia del SHUa en pacientes en los que no se detectan alteraciones genéticas en las proteínas del complemento también es elevado.
Se sugiere que pretrasplante todos los pacientes con ERCT debido a SHUa, Púrpura Trombocitopénica Trombótica (PTT), u otra microangiopatía trombótica, tengan hecho estudio genético del complemento. El pronóstico de estos pacientes con SHUa tras el TxR ha cambiado radicalmente desde la introducción de anticuerpos monoclonales frente a la fracción 5 del complemento (C5), que impiden la formación del MAC y previenen la recurrencia de la enfermedad, como eculizumab y ravulizuma. El utilizarlo de forma preventiva depende de la mutación genética de base. Su uso implica estar vacunado frente a gérmenes encapsulados (ver sección de vacunas) [45].
Los donantes vivos relacionados genéticamente se pueden considerar en pacientes con autoanticuerpos anti-FH o en aquel receptor en el que la mutación indiscutiblemente relacionada con la patogénesis del SHUa no está presente en el donante.
f) Cuando un paciente con Hiperoxaluria Primaria se encuentra en diálisis, el tratamiento óptimo es el trasplante simultáneo hepato-renal (en estadios más precoces de ERC) o secuencial primero hepatico y renal después si el paciente está en diálisis [46] lo más precozmente posible para evitar los efectos devastadores de la oxalosis. La aparición de RNA de interferencia como lumasiran, cuya diana es la glicolato-oxidasa, lo que resulta en una reducción de la síntesis de oxalato, puede cambiar el pronóstico y manejo de estos pacientes, ya que debe emplearse como tratamiento de primera línea en pacientes con hiperoxaluria 1ªconfirmada. Otro agente RNA de interferencia de 2ª generación es el nedosiran (Véase Hiperoxaluria Primaria. Nefrología al Día)
g) La tasa de recurrencias de la Nefropatía IgA y la de la glomerulonefritis membranoproliferativa tipo I y tipo II es de 80%, 40% y 80%, respectivamente. Sin embargo, la pérdida de injerto por esta causa ocurre en menos del 20%. No está indicada la nefrectomía de los riñones nativos para evitar la recurrencia de la enfermedad.
h) Pacientes con enfermedad de Fabry pueden ser trasplantados, manteniéndolos con terapia enzimática de sustitución.
Enfermedad gastrointestinal
Colelitiasis
En los pacientes con antecedentes de colecistitis aguda o en los diabéticos (un elevado porcentaje tiene colelitiasis), debe considerarse la colecistectomía previa al trasplante, aunque actualmente no se hace colecistectomía profiláctica.
Úlcera péptica
Los pacientes con úlcera péptica activa, incluyendo los portadores de helicobacter pylori, deben ser tratados activamente pretrasplante, y la curación de la enfermedad confirmada endoscópicamente.
Enfermedad diverticular de colon
Los pacientes con sospecha de haber sufrido un episodio previo deben ser evaluados con enema opaco o colonoscopia, si bien no se recomienda si no hay antecedentes, hacer screening de diverticulosis. En el postrasplante se deben evitar las resinas intercambiadoras.
Pólipos de colon, Enfermedad Inflamatoria Intestinal
En estos casos o cuando exista alto riesgo de ca. colon (p.ej Hª familiar) se debe realizar colonoscopia periódica de acuerdo a las Guías de población general.
Hepatitis activa o hepatopatía crónica
Ambas son contraindicaciones relativas para trasplante. Los pacientes con hepatitis B y C deben ser tratados y evaluados por hepatólogo pretrasplante. Cuando el grado de fibrosis hepática o cirrosis es avanzado (biopsia o datos clínicos), habría que considerar el trasplante combinado hepatorrenal.
Trastornos Hematológicos
Realizar screening de trombofilia en pacientes con trombosis repetidas de acceso vascular, pérdida por trombosis inexplicada de injerto previo o historia de trombosis arterial o venosa.
En pacientes con LES, determinar anticoagulante lúpico y Ac antifosfolípido
Se debe retrasar el trasplante en aquellos pacientes que reciben doble antiagregación (p.ej. tras revascularización coronaria) hasta que se pueda suspender uno de ellos, por el altísimo riesgo de sangrado.
Los pacientes con citopenias deben ser evaluados por el hematólogo para determinar la causa, ya que pueden empeorar con el tratamiento de inducción. En casos severos, pueden contraindicar el trasplante, dependiendo de la causa y la severidad. Uno de estos casos es el Síndrome mielodisplásico,
La Gammapatía Monoclonal de significado incierto (GMSI) no es contraindicación para trasplante, pero el paciente debe ser valorado por hematología.
Los pacientes con Mieloma múltiple latente o en remisión con tratamiento de mantenimiento pueden ser incluídos en lista de espera, tras valoración conjunta con Hematología, siendo advertidos del riesgo de progresión.
Enfermedad Pulmonar
Existe poca información sobre la estrategia a seguir para el despistaje de la enfermedad pulmonar antes del trasplante renal, ya que se asocia a mayor riesgo de pérdida del injerto y muerte del paciente [47].
Se debe descartar la Hipertensión Pulmonar (HTP) mediante ecocardiografía. La HTP se define como presión sistólica VD > 45 mmHg La HTP es frecuente en pacientes con ERCT y se asocia a insuficiencia cardiaca, sobrecarga 2ª a FAV y tabaquismo. Se aconseja confirmar la evidencia ecocardiográfica de HTP con cateterismo derecho (hay HTP si la presión media en arteria pulmonar es > 25 mmHg), si no hay causa secundaria (SAHOS, insuficiencia cardíaca derecha), se debe remitir al especialista con experiencia en este campo y se aconseja el uso de terapia vasodilatadora. Si la HTP es moderada-severa y no se corrige con el tratamiento adecuado, el paciente no se considera candidato a trasplante renal [17].
Las Guías de la Sociedad Canadiense de Trasplante 2005 [48], consideran que no son candidatos a trasplante los pacientes que:
Usan oxigenoterapia domiciliaria
Asma incontrolable
Cor pulmonale severo o HT pulmonar severa incorregible
EPOC severo o enfermedad restrictiva o fibrosis pulmonar, que se define por el volumen espiratorio forzado en el primer segundo (FEV1)< 25% del valor predicho o PO2 con aire ambiente < 60 mmHg.
Vía urinaria
La búsqueda rutinaria de anomalías anatómicas no está justificada. Cuando exista sospecha clínica de una anomalía anatómica se deben realizar, como exploraciones iniciales, una ecografía y una cistografía de relleno y miccional [4][5][5][9][13][22]. Este es el caso en los siguientes supuestos: niños, sujetos con infecciones urinarias de repetición, tuberculosis como nefropatía de base y varones mayores de 60 años (prostatismo).
En general cualquier cirugía dirigida a corregir una alteración anatómica, como la creación de una neovejiga, debe realizarse electivamente antes del trasplante. Sin embargo, la cugía de estenosis de uretra en pacientes oligoanúricos debe retrasarse al postrasplante, dada la alta tasa de re-estenosis en ausencia de diuresis residual [49].
Los pacientes con vejiga neurógena deben ser evaluados mediante estudio videourodinámico, cistomanometría y eventualmente entrenarse con el autosondaje intermitente.
La nefrectomía de los riñones nativos debe ser considerada en las siguientes circunstancias: reflujo e infecciones frecuentes; cálculos en parénquima infectados; sindrome nefrótico congénito, tipo Finlandes, con proteinuria masiva; y poliquistosis con quistes infectados, o gran nefromegalia sin espacio para el implante del injerto (en este caso nefrectomía unilateral). Se debe realizar estudio con cistouretrograma urodinámico en las personas con disfunción de la vejiga o historia de pielonefritis o reflujo vesicoureteral, así como citología de lavado vesical o cistoscopia en los pacientes con antecedentes de exposición a ciclofosfamida o con sospecha de posible malignidad del tracto urinario inferior o con antecedentes de neoplasia urotelial.
Aspectos Psicosociales y Obesidad
Idealmente, todos los pacientes deberían tener una evaluación psico-social realizada por asistente social/psicólogo, para identificar problemas económicos o de conducta que pudieran influir en la adherencia al tratamiento y fracaso potencial del injerto.
En los pacientes con consumo de alcohol o drogas se requiere al menos un año de abstinencia y de adherencia al tratamiento dialítico. Se debe considerar el ingreso en un programa de deshabituación y confirmar la ausencia de consumo actual.
En el caso de los consumidores de marihuana, no está claro si se deben excluir, aunque hay que saber que tienen mayor riesgo de aspergilosis pulmonar grave cuando se inhala, y aumento del riesgo de hipotensión, enfermedad cardiovascular e interacción potencial con los inhibidores de la calcineurina (Up to Date . Kidney transplantation in adults: Evaluation of the potential kidney transplant recipient. Enero 2024)
En los casos con trastornos cognitivos o de la personalidad se precisa una evaluación psiquiátrica para estimar las probabilidades de no adherencia al tratamiento.
Se recomienda no trasplantar pacientes con enfermedad pisquiátrica grave, inestable, que pueda afectar a la toma de decisiones y autocuidado. En general, estos pacientes deben llevar al menos 1 año estables desde el el punto de vista psiquiátrico, sin ingresos hospitalarios por este motivo, demostrar buena adherencia al tratamiento y tener apoyo familiar suficiente.
Obesidad
Aunque la obesidad no es una contraindicación absoluta para el trasplante renal, es recomendable la reducción de peso en pacientes con índice de masa corporal >35 kg/m2 (debe valorarse cirugía bariátrica).
Un metanálisis de 209.000 receptores de trasplante renal, demostró que los pacientes con IMC> 30 kg/ m2 tienen mayor riesgo de muerte (RR1.52), FRR (RR 1.52) , rechazo agudo (RR 1.17) , infección de la herida ( RR 3.13), dehiscencia de herida (RR 4.85) y diabetes de novo (RR 2.24) [50].
RETRASPLANTES
Los pacientes que reinician diálisis tras la pérdida de un primer injerto renal y vuelven a ser incluidos en LE pudieran tener mayor mortalidad mientras permanecen en LE frente a aquellos que son listados por primera vez. Esto se ha observado en estudios de cohortes de población europea y americana utilizando adecuados análisis de propensión [51] [52].
Hay que tener en cuenta cuál fue la causa de pérdida del trasplante previo, por ejemplo, en el caso de que ésta se debiera a recurrencia de la enfermedad de base, como en la GSFS 1ª, en caso de un nuevo trasplante la tasa de recurrencia puede ser > 75% y aparecer incluso más rápido que en el primer injerto [53]. En el caso de injertos perdidos por infección por BK virus, se recomienda que la viremia sea negativa previo a un nuevo trasplante
Los retrasplantes requieren una evaluación similar a los pacientes que nunca han recibido un trasplante previo, pero se debe profundizar en la valoración de:
a. Estado vascular aorto-iliaco
b. Estado cardiológico
c. Estado inmunológico: especialmente importante en estos pacientes, ya que muchos de ellos quedan con grado variable de alosensibilización, lo que limita su acceso al trasplante, aunque afortunadamente en España tenemos programas de intercambio de órganos a nivel nacional auspiciado por la ONT (PATHI) o regional (Andalucía) para pacientes con un porcentaje de reactividad frente a panel virtual (c-PRA) muy elevado (mayor o igual al 98%). En el caso de que se prevea que el retrasplante no se va a demorar mucho, se aconseja mantener la inmunosupresión para evitar la alosensibilización.
d. Via urinaria
FRAGILIDAD FISICA
La fragilidad física es muy prevalente en la población en diálisis [54], especialmente en los pacientes longevos, y se asocia a un incremento de la mortalidad y de la pérdida del injerto postrasplante [8] [55] [56]. Por tanto, en los pacientes en LE debería evaluarse el grado de fragilidad física a partir de alguno de los diferentes escalas validadas en aras de implementar estrategias en el manejo de estos pacientes.
Resumen de las exploraciones básicas necesarias
1. Historia Clínica completa: Incluir antecedentes quirúrgicos (cirugía abdominal) y de catéteres femorales (aumento del riesgo de trombosis venosa ileo-femoral en caso de múltiples punciones y catéteres in situ por períodos prolongados; en estos casos se aconseja realizar flebografía de MMII).
2. Exploración física completa: Especial atención a palpación de pulsos periféricos.
3. Hemograma completo, BUN, Creatinina, electrolitos, calcio/fósforo, PTH, albúmina, pruebas de coagulación, enzimas hepáticos, colemia. Estudio de coagulación específico en aquellos con historia de trombosis venosa profunda, trombosis repetida de fístula arterio-venosa, abortos de repetición o tendencia a la hemorragia
4. Serología vírica: CMV, varicela-zóster, herpes simple, rubeola, Epstein Barr, Virus Hepatitis C, HBsAg y anti core, PCR de VHC y VIH (cuando indicado)
5. Detección de Treponema palidum, toxoplasma.
6. PPD (Mantoux). Calendario de vacunación.
7. Urocultivo cuando exista diuresis residual, sospecha clínica de anomalías de la vía urinaria, o se trate de varones >60 años.
8. Rx de Tórax, ECG y Ecocardiograma. En pacientes diabéticos o mayores de 60 años, se recomienda ecocardiografía de stréss o Prueba de esfuerzo, si son +, realizar coronariografía y eventual revascularización coronaria pre-trasplante (Figura 1).
9. Rx simple de abdomen: Valoración de calcificaciones vasculares aorto-ilíacas, y cálculos en la vía urinaria (en caso de existir, implantar el injerto en el lado libre de cálculos en previsión de cirugía derivativa urológica post-trasplante: por ejemplo anastomosis pelvis-pelvis en caso de necrosis del uréter).
10. Ecografía abdominal: Despistaje de Enfermedad Quística Renal Adquirida en sujetos de riesgo (varones jóvenes con más de 5-7 años en diálisis). Sangre oculta en heces. Valorar colonoscopia en caso de dudas con sangre oculta en heces o con antecedentes familiares de cáncer de colon. Despistaje de carcinoma hepatocelular en pacientes portadores de VHC o VHB.
11. Ecografía de vasos iliacos en pacientes con sospecha de calcificaciones vasculares o clínica de enfermedad vascular periférica. En caso de pacientes diabéticos, añosos o con enfermedad vascular periférica se recomienda angioTAC aortoiliaco para valorar estenosis vasculares o calcificación de las arterias iliacas. En caso preciso, recomendamos revascularización de MMII pretrasplante.
12. Cistografía de relleno y miccional: Niños; sujetos con infecciones urinarias de repetición; tuberculosis como nefropatía de base; varones mayores de 60 años (prostatismo); y cuando se sospeche anomalía de la vía urinaria.
13. En hombres: Examen testicular, y en mayores de 50 años PSA y tacto rectal anualmente. Si el tacto rectal es sospechoso o el PSA-total elevado, está indicada una biopsia prostática multifocal antes del trasplante.
14. En mujeres: Examen físico mamario; mamografía en las >40 años anualmente (>35 años si hay historia familiar de cáncer de mama en un familiar de primer grado). Citología cervical anual en las mujeres mayores de 20 años de edad.
15. Grupo sanguíneo; número de transfusiones; tipaje HLA; anticuerpos contra el panel clase I y II, periódicamente cada 3 meses y tras cada transfusión o proceso inmunizante. Cross-match en caso de tener donante vivo.
16. Proteinograma en mayores de 60 años como despistaje de enfermedad hematológica.
17. Todos los pacientes procedentes de países con endemias, o que hayan viajado o vivido en dichas zonas o nacido de madre residente en zonas endémicas y que sean candidatos a trasplante, deberán ser estudiados por el Servicio de Enfermedades Infecciosas y tratados si hubiere indicación antes de ser incluidos en lista de espera: detección de malaria, leishmania, coprocultivo y parásitos en heces, strongyloides, histoplasmina, schistosomas, coccidiomicosis, trypanosoma cruzi, HTLV.
18. En pacientes con ERC 2ª a PQRAD e Hª familiar de aneurismas cerebrales o hemorragia subaracnoidea, especialmente si los pacientes son fumadores o hipertensos, se debe realizar screening para despistaje de aneurisma cerebral mediante angioRMN cerebral o angioTAC [57].
En general, cada dos años hay que hacer una reevaluación del paciente en lista de espera para trasplante renal que incluya al menos lo siguiente: examen físico (sólo hallazgos nuevos relevantes); serología vírica; status cardiovascular: ecocardiografía convencional y/o de esfuerzo cada 24 meses a todos los pacientes; en pacientes diabéticos, ateromatosos (ausencia de pulsos) o con clínica isquémica de EEII: eco doppler de vasos iliacos cada 12-18 meses y valorar AngioTAC o arteriografía según disponibilidad del centro y características del paciente. En pacientes de riesgo de neoplasias por edad (>50 años) realizar cada 12-18 meses: citología vaginal, PSA, sangre oculta en heces, mamografía y ecografía abdomen-renal. Registro de eventos infecciosos o cardiovasculares destacables.