Complicaciones médicas precoces tras el trasplante renal
Palabras clave
Trasplante renal, disfunción precoz, rechazo hiperagudo, necrosis tubular aguda, rechazo agudo, obstrucción urinaria, toxicidad anticalcineurínicos, biopsia renal en el rechazo, tratamiento disfunción aguda, diagnóstico diferencial de la disfunción aguda
INTRODUCCIÓN
El trasplante renal es el tratamiento de elección de la enfermedad renal crónica avanzada [1] [2]. Los receptores de un trasplante renal mejoran su calidad de vida y se reduce su mortalidad en comparación a continuar en diálisis [3].
La supervivencia del injerto al año del trasplante renal ha mejorado notablemente en la última década a pesar del aumento en el porcentaje de donantes con criterios expandidos y receptores de mayor edad y comorbilidad [4] [5]. Los nuevos fármacos inmunosupresores han disminuido la incidencia de rechazo agudo mejorando la función del injerto al alta y a los 6 meses del trasplante y permitiendo unos resultados excelentes a corto plazo [6][7][8]. A largo plazo, el pronóstico del injerto dependerá de diagnosticar y tratar precozmente las complicaciones inmunológicas o de otro tipo, que tendrán lugar incluso antes del acto quirúrgico durante el mantenimiento de donante y la preservación del órgano [9][10][11].
La aproximación a las complicaciones tras el trasplante renal resulta más fácil si se consideran en función de la cronología postrasplante. El periodo que abarca las primeras 12 semanas tras la cirugía se denomina periodo postrasplante precoz. Este a su vez puede dividirse en dos: postrasplante inmediato o primera semana postrasplante, en donde predominan las complicaciones relacionadas con la cirugía, y desde la semana 2ª hasta la semana 12ª, donde lo hacen las complicaciones inmunológicas y médicas.
Tras este periodo, aquellos pacientes que hayan evolucionado favorablemente tienen un buen pronóstico dependiendo de la edad y comorbilidad del receptor así como de la calidad del injerto. El desarrollo de complicaciones así como su diagnóstico y tratamiento precoz va a influir en la supervivencia del injerto y del paciente tanto a corto, como a medio y largo plazo. En este capítulo nos referiremos solamente a las complicaciones médicas.
MANEJO POSTOPERATORIO (PRIMER DÍA DEL TRASPLANTE-POSTRASPLANTE INMEDIATO.
La elevada prevalencia de enfermedad cardiovascular en el enfermo urémico y tras el trasplante renal obliga a una adecuada monitorización durante la cirugía del trasplante renal, para asegurar una función cardiovascular óptima, evitar la isquemia miocárdica, y obtener una adecuada perfusión del injerto.
El primer día del posoperatorio debe vigilarse: estado hemodinámico y respiratorio con monitorización continua del receptor, diuresis (considerando la diuresis residual del receptor), inmunosupresión (IS) administrada, ya iniciada antes y durante la cirugía, así como iniciar profilaxis antibiótica de herida quirúrgica, detectar problemas quirúrgicos y valorar necesidad de hemodiálisis (HD). Se han de mantener unas cifras de tensión arterial (TA) y presión venosa central adecuadas para una buena perfusión del injerto, controlando la saturación de oxígeno que puede alertarnos sobre trastornos cardiopulmonares. La hipertensión arterial (HTA) severa debe ser tratada para evitar sangrados quirúrgicos, edema de pulmón o eventos cerebrovasculares. La hipervolemia excesiva debe evitarse especialmente en pacientes longevos (>60 años), o con disfunción diastólica o coronariopatía.
La oligoanuria o anuria, especialmente en pacientes en los que se espera una diuresis inmediata (donante vivo, receptor y donante joven con isquemia fría corta, etc.), es una urgencia diagnóstica. Si a pesar de comprobar adecuado estado de volemia del receptor y descartar problemas de sondaje vesical, y ante no respuesta a expansión de volumen y furosemida u optimización hemodinámica de receptor, estaremos en la obligación de realizar pruebas de imagen (eco Doppler más accesible, rápida con posibilidad de realizarla a pie de cama del paciente tanto por nefrólogos, en los centros entrenados, como por radiólogos, o isótopos) para comprobar la vascularización del injerto o complicaciones de la vía urinaria.
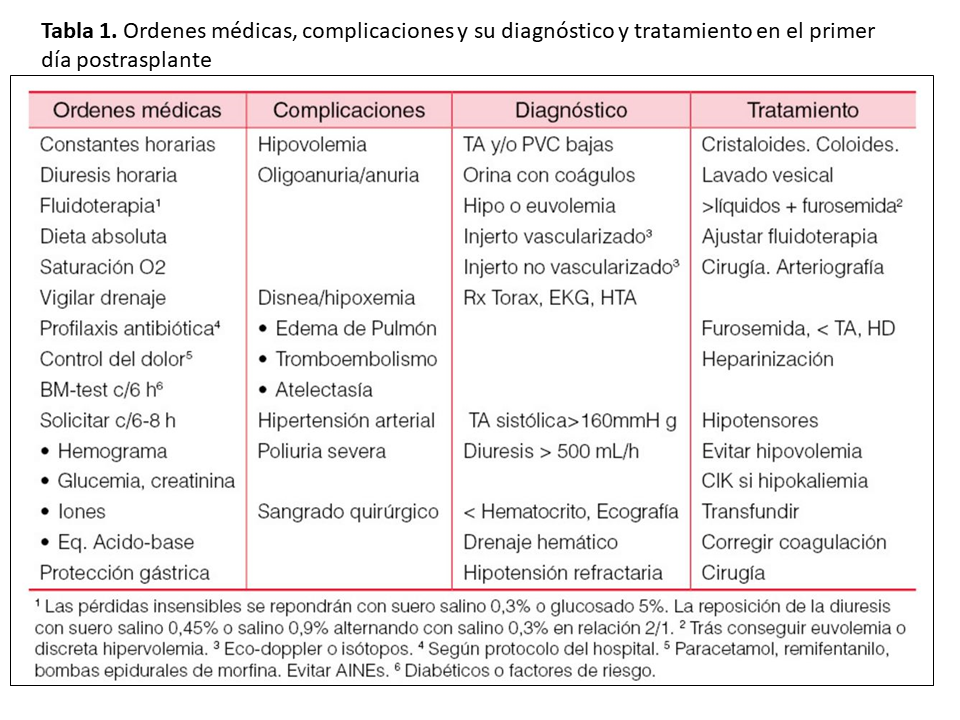
En los días siguientes, el paciente comenzará a sentarse y deambular, iniciando tolerancia oral, siendo importantes, además de la evaluación diaria de la diuresis y el peso, la situación hemodinámica y respiratoria, la detección de infecciones precoces (fiebre) y la dosificación de IS e inicio de profilaxis de infecciones oportunistas. Los estudios a realizar serán: hemograma y bioquímica c/24 horas, niveles de IS c/48 horas. Se valorará de forma individualizada la necesidad de radiografía de tórax y ECG en las primeras 24-48 horas, y cuando haya indicación clínica. Una eco Doppler de control en los primeros días (si no hay urgencia diagnóstica previa) y repetir si hay indicación clínica, aunque en centros donde el nefrólogo tenga experiencia y posibilidad de realización de eco Doppler sería recomendable la realización de una eco Doppler basal en las primeras 24 horas postimplante y posteriormente cada 48-72 horas en la primera semana para posteriormente realizar una vez a la semana si permaneciera durante más tiempo ingresado o ante cualquier disfunción del injerto. En la (Tabla 1) se muestran las órdenes médicas y las posibles complicaciones en el postrasplante inmediato.
En el paciente con diuresis inmediata y descenso de creatinina plasmática, el seguimiento es sencillo por lo que, salvo complicaciones, puede retirarse la sonda vesical a los 7 días y ser dado de alta. El paciente con diuresis y descenso lento de creatinina plasmática o con necesidad de diálisis requiere estudios más amplios (ver más adelante) y estancia hospitalaria más prolongada.
DISFUNCIÓN PRECOZ DEL INJERTO
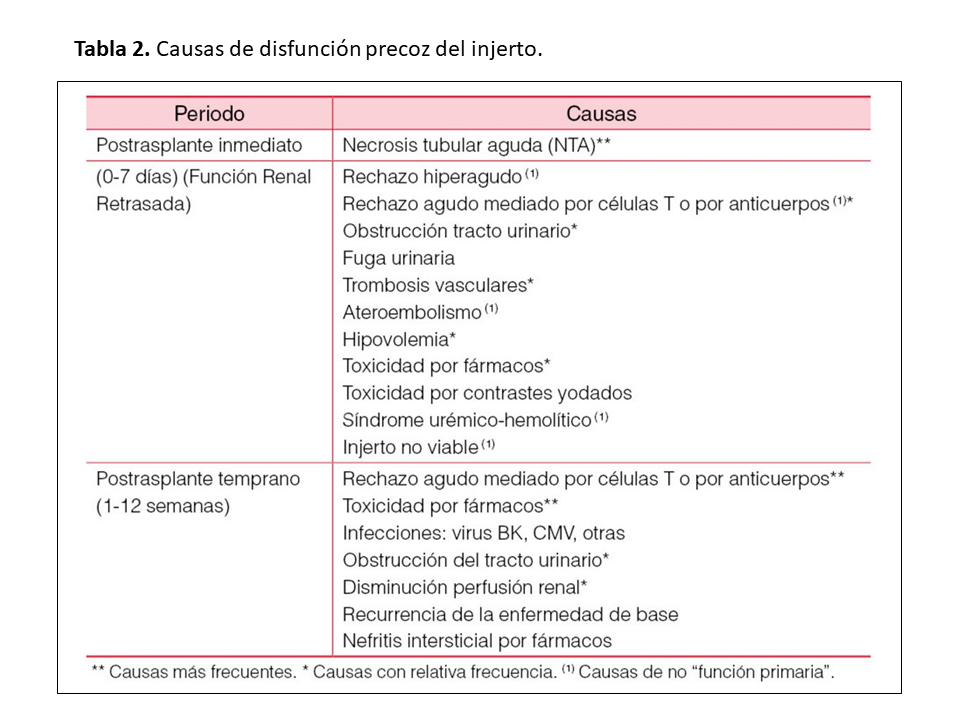
Es la complicación más frecuente tras el trasplante renal y tiene implicaciones pronósticas sobre la supervivencia del mismo. Su etiología y diagnóstico diferencial varían en función del momento de presentación (Tabla 2).
Postrasplante inmediato (0-7 días): en este periodo el injerto puede presentar evoluciones diferentes: (a) función inmediata del injerto (FII), con buena diuresis y descenso rápido de los productos nitrogenados; (b) función retrasada del injerto (FRI), definida como la necesidad de diálisis, oligoanuria o retraso en el descenso de la creatinina plasmática en la primera semana postrasplante [11][12][13] y (c) raramente (<5%) no función primaria del trasplante, que son injertos que nunca llegan a funcionar.
La FRI constituye un tipo de insuficiencia renal aguda característico del trasplante renal. Si bien la principal causa es intrínseca, relacionada con la agresión renal por el daño asociado a la isquemia y posterior reperfusión asociada a factores inmunológicos, en algunos casos puede existir un componente prerrenal o postrenal [11]. Recientemente, se ha considerado el término de FRI de tipo ”funcional”, basándose en la tasa de reducción de la creatinina plasmática postrasplante, que presenta una mejor correlación con la supervivencia a largo plazo del injerto que la necesidad de diálisis [13][14][15][16]. De cualquier forma, a pesar de la mejoría en el manejo del donante y del receptor, la incidencia de FRI y la repercusión a largo plazo no se han modificado en los últimos años en parte debido al aumento del número de donantes con criterios expandidos (DCE) o en asistolia, en cuyos receptores el riesgo de FRI es mucho mayor que en los receptores de un donante estándar (aquellos cuyo Kidney Donor Profile Index (KDPI) es < 85%) [17] o de un donante vivo.
Tras el trasplante, entre un 10-50% de los pacientes requieren diálisis o presentan un descenso lento de la creatinina plasmática (FRI). La FRI implica, de forma global, una peor supervivencia del injerto debido a una mayor frecuencia de rechazo agudo, peor función renal a corto y medio plazo y mayor riesgo de disfunción crónica del injerto [11] [13] [18].
Postrasplante temprano (1-12 semanas): Son pacientes que tras presentar función inmediata desarrollan deterioro de la función renal.
ETIOLOGÍA DE LA DISFUNCIÓN PRECOZ DEL INJERTO
Necrosis tubular aguda (NTA)
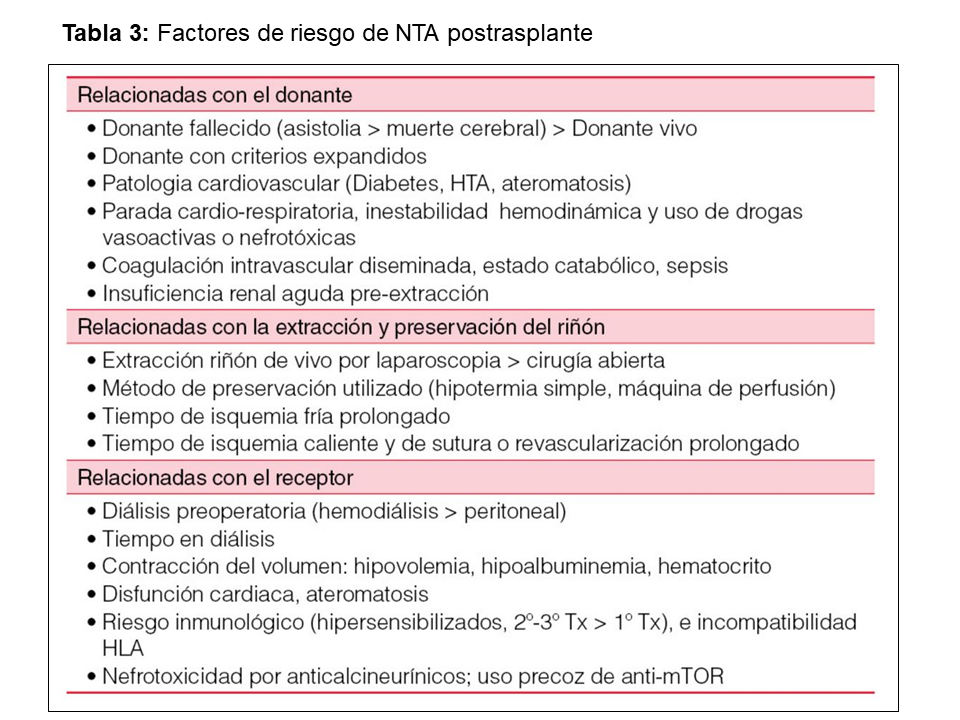
Es la causa más frecuente de FRI (5-50% si donante fallecido, 4-10% con donante vivo) [12]. Su incidencia aumenta en presencia de determinados factores de riesgo relacionados con características del donante, del receptor, la preservación del injerto y el manejo peri operatorio [11] [13] [18] (Tabla 3). Actualmente para predecir la NTA se estudia la validez de nomogramas o modelos matemáticos realizados a partir de la combinación de factores demográficos y clínicos relacionados con el donante y el receptor [19] o estudios analíticos mediante la determinación en suero y orina de biomarcadores indicativos de daño renal (u-NGAL, IL-18) [20]. Recientemente, se ha propuesto la determinación de C5a en orina del donante como predictor del riesgo de FRI en el receptor en ausencia de AKI en el donante [21]. Conociendo el riesgo pretrasplante, se pueden adoptar estrategias dirigidas a favorecer su rápida recuperación, como minimizar inicialmente la dosis de anticalcineurínicos o retrasar su introducción, evitar el uso de m-tor, acortar los tiempos de isquemia, selección adecuada del receptor, etc.
Se trata de un daño por isquemia-reperfusión, en el que la restitución de flujo al injerto, tras horas de isquemia, incrementa el daño celular. En una primera fase de hipoxia, en las células endoteliales renales del donante se va a producir un aumento del tono microvascular y expresión de las moléculas de clase I, lesión de la membrana celular y depósitos de fibrina. En las células epiteliales hay aumento de superóxidos, alteración metabólica y fallo en la bomba Na/K ATPasa. Tras el desclampaje, la revascularización va a producir una activación del complemento, atracción de linfocitos, liberación de interleukinas y moléculas de adhesión, presentación de los antígenos exógenos a los órganos linfoides del receptor y mayor producción de superóxidos. La consecuencia va a ser el desarrollo de necrosis y apoptosis, y estimulación de la respuesta inmune, por lo que estos injertos tienen mayor incidencia de rechazo agudo [11][13][15] . Por otro lado, los factores inmunológicos hacen que el injerto sea más susceptible a la lesión por isquemia-reperfusión (mayor incidencia de NTA en retrasplantes e hipersensibilizados). Si no se añaden otros insultos (rechazo, nefrotoxicidad por fármacos, reducción del flujo por bajo gasto cardiaco o estenosis arterial, etc.) el cuadro suele resolverse en los primeros 7-14 días. La coexistencia con rechazo agudo empeora el pronóstico del injerto, por lo que es fundamental diagnosticarlo y tratarlo precozmente.
La NTA puede aparecer en los primeros 3 meses en injertos con buena función previa, siendo la etiopatogenia la misma que la de los riñones nativos agravada por el uso de anticalcineurínicos.
Rechazo hiperagudo
Es una causa infrecuente de FRI, se debe a la existencia de anticuerpos preformados donante-específicos o incompatibilidad de grupos sanguíneos ABO, que se evita con la realización de la prueba cruzada pretrasplante. Otra causa es la presencia de anticuerpos antiendotelio monocítico del receptor frente al donante. Suele diagnosticarse en el quirófano en el momento del desclampaje, al observar un injerto cianótico y blando, o a tensión. La biopsia muestra coagulopatía intrarrenal con trombos glomerulares y en pequeñas arterias, y necrosis cortical. A veces se manifiesta más tarde, requiriendo diagnóstico diferencial con otras causas de FRI [22][23]
Rechazo agudo mediado por células T (RAMCT)
Se produce por la acción del sistema inmunológico del receptor frente a los antígenos extraños del injerto, influyendo la inmunidad innata y la adquirida. La inmunidad innata actúa de forma inespecífica ante la lesión de isquemia/reperfusión y favorece el reconocimiento de aloantígenos por células T del receptor (señal 1) y su activación. Esta presentación del antígeno puede ser de forma directa (el linfocito T reconoce péptidos de HLA en células presentadoras del antígeno (APC) del donante) o indirecta (el linfocito T reconoce péptidos de HLA del donante procesados por APCs del receptor). La presentación directa es responsable de los RAMCT tempranos, mientras que posteriormente al haber en el injerto un número limitado de APCs del donante, la principal causa de alorreconocimiento y rechazo agudo es la presentación tardía que se mantiene a lo largo del tiempo que el injerto esté in situ. El linfocito T requiere otro estímulo para su activación, la coestimulación (señal 2), tras lo que se producirá la expansión clonal de linfocitos T (señal 3) [22][23].
Este rechazo, se caracteriza por deterioro de la función del injerto (siendo ya poco frecuentes, con los regímenes inmunosupresores actuales, otros síntomas como fiebre o dolor en el injerto) o la presencia de FRI, con cambios histopatológicos específicos (infiltración del injerto por linfocitos y otras células inflamatorias). Es más frecuente en los primeros meses aunque puede aparecer en cualquier momento tras reducir o modificar la IS. En los últimos años, con los nuevos protocolos inmunosupresores, su incidencia ha disminuido llegando a alcanzar cifras en torno a un 10-15% en el primer año. Es más común en el trasplante de cadáver que en el de vivo. Son factores de riesgo para su aparición: niveles bajos de IS, pacientes hiperinmunizados, retrasplantes, receptores jóvenes y/o de raza negra, e incompatibilidad HLA. También existe mayor incidencia en presencia de NTA y de infección por CMV (aumento en la inmunogenicidad del injerto debido a una mayor expresión de los antígenos HLA) [23].
Se manifiesta precozmente en el paciente sensibilizado (3-5 días), y más tardíamente en el resto (> 7 días), dependiendo de la IS. El rechazo agudo tiene un efecto negativo en la supervivencia del injerto, especialmente si no se recupera la función inicial tras el tratamiento o si aparece tardíamente (>6 meses).
Rechazo agudo mediado por anticuerpos (RAMAc)
Conocido también como rechazo agudo humoral, es en la actualidad una de las principales causas de disfunción aguda y crónica del trasplante renal [24][25]. Aunque la relación entre anticuerpos anti-HLA y rechazo hiperagudo es conocida desde los años 60, desde hace pocos años la mayor posibilidad de detectar dichos anticuerpos mediante técnicas de fase sólida y el hallazgo en las biopsias de depósitos de C4d (un producto de degradación del complemento) han permitido un mejor conocimiento de la teoría humoral en el rechazo agudo y crónico del trasplante [26]. El RAMAc, en el periodo precoz, se produce por sensibilización previa a los antígenos HLA del donante tras transfusiones, embarazos o trasplantes previos, aunque otros antígenos como MICA, endotelio, receptor de AT2 y antígenos menores pueden igualmente producirlo. Es más frecuente en pacientes retrasplantes o hipersensibilizados. En la etiopatogenia juega un papel fundamental, aunque no único, el complemento mediante la unión antígeno-anticuerpo y la formación del complejo de ataque a la membrana (CAM) que produce lesión celular. El rol de las células NK y la lesión endotelial con formación de microtrombos son igualmente importantes en su desarrollo. Al expresarse los antígenos HLA en el endotelio vascular la lesión principal va a ser una inflamación de la microcirculación: capilaritis en capilares peritubulares (cpt) y/o glomerulitis en glomérulos, aunque esta puede estar ausente. Se manifiesta a los pocos días o semanas dependiendo de la IS utilizada o si ha habido desensibilización previa [22][23][24][25][26] . Para su diagnóstico se requiere evidencia morfológica de daño tisular, evidencia de interacción anticuerpo-endotelio vascular y presencia de anticuerpos circulantes donante-específicos (HLA u otros).
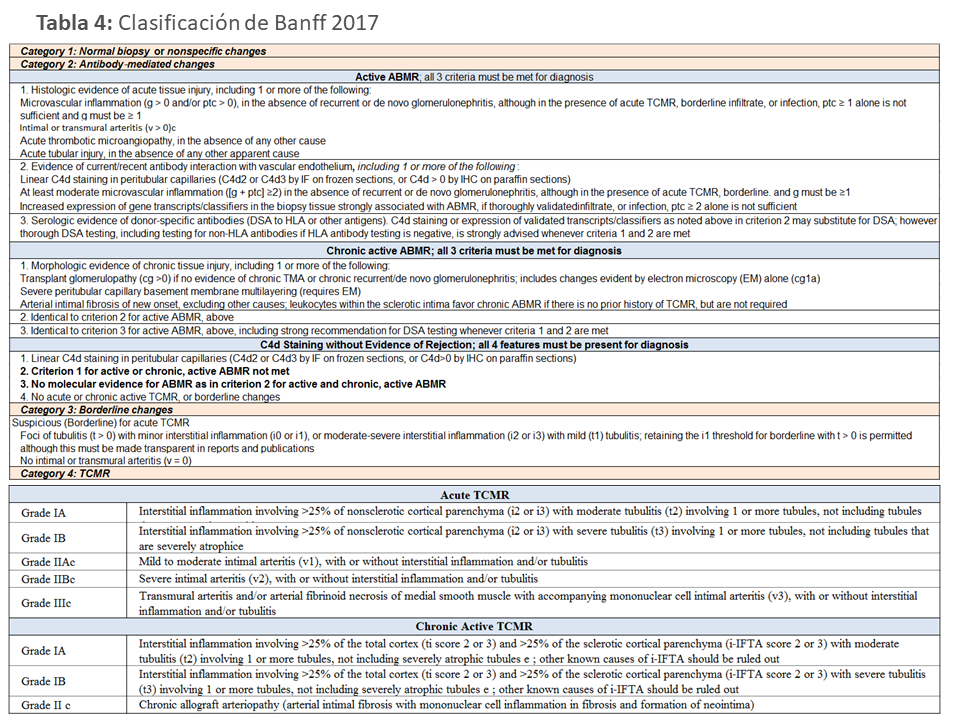
Si bien la revisión de la clasificación de Banff de 2013 establece también que el RAMAc puede ser diagnosticado en ausencia de C4d [27], en la clasificación de Banff de 2017, se establece que, en ausencia de anticuerpos detectables donante-específicos (ADEs) frente a antígenos HLA u otros, bien porque no es posible determinarlos, bien porque son falsos (-), la detección de positividad para c4d sería equivalente a la detección de ADEs y por tanto, puede hacerse el diagnóstico de RAMAc, aunque insiste en que debe investigarse la presencia de otros ADEs no anti-HLA (MICA, anti-AT2r etc..) [28] (Tabla 4).
Existen una serie de factores que pueden empeorar el pronóstico del RAMAc:
-Coexistencia de rechazo agudo celular (RAMCT)
-La presencia de glomerulopatía del trasplante y algún grado de daño crónico tisular (FIAT,cv,cg)
También hay características de los ADEs que se asocian a peor pronóstico:
• La presencia de Ac anti-HLA donante específicos (ADE) preformados en suero histórico se asocia a peor supervivencia del injerto, comparado con la existencia de Ac anti-LA no donante específicos o sin Ac anti-HLA; además el MFI (del inglés Mean Fluorescence Intensity) de los ADEs máximos históricos también se asocia a riesgo de RAMAc y pérdida del injerto, de forma que el riesgo de desarrollar RAMAc es 100 veces mayor en pacientes con ADE histórico máximo con MFI> 6000 U, comparado con pacientes con ADE histórico máximo con MFI < 465 U [29]
• Subclase ADE: el subtipo IgG3 se asocia con rechazo más precoz, mayor daño microvascular, depósito de c4d y fallo del injerto [30].
• Los ADE con capacidad de fijar el complemento (C1q) tienen peor pronóstico.
• ADE preformados tienen mejor pronóstico que los que aparecen de novo, ya que la aparición de estos últimos parece deberse a infrainmunosupresión o inadherencia terapéutica.
Obstrucción del tracto urinario y fuga urinaria.
Véase Complicaciones Quirúrgicas
Oclusiones vasculares
Diversas entidades pueden comprometer la perfusión del injerto renal, destacando: trombosis arterial y venosa, estenosis de la arteria del injerto, fístula arteriovenosa intrainjerto (capítulo de complicaciones quirúrgicas) y el ateroembolismo. En el ateroembolismo, la fuente de émbolos puede ser el árbol vascular del receptor o del donante asociándose este último a mayor carga de émbolos y peor pronóstico [31].
En cuanto a las trombosis, éstas pueden deberse a problemas técnicos quirúrgicos, o puede existir un estado de hipercoagulabilidad que lo favorezca, como es el caso del síndrome antifosfolípido, o trombofilias hereditarias como el déficit de Factor V Leiden [32].
Hipovolemia
Puede ser de cualquier etiología, habiéndose relacionado con la diálisis pretrasplante y una reposición inadecuada de volumen en la cirugía y el posoperatorio inmediato (Tabla 1). Otras causas son hemorragias y vasoconstricción de origen farmacológico. La vasodilatación, inducida por anestésicos o por la liberación de citoquinas cuando se usan anticuerpos del tipo OKT3, ATG y alemtuzumab es frecuente. Pasado este periodo, se debe considerar la hipovolemia (real o efectiva) como posible causa de disfunción aguda del injerto, que se presenta como una insuficiencia renal aguda prerrenal.
Toxicidad por anticalcineurínicos
Los anticalcineurínicos, la ciclosporina A (CsA) y actualmente el tacrolimus (Tac), son la base del tratamiento inmunosupresor en más del 90 % de los receptores de trasplante renal.
La nefrotoxicidad por CsA o Tac es un efecto adverso claramente establecido en el trasplante renal, pudiendo presentarse de forma aguda o crónica. La nefrotoxicidad aguda aparece en el postrasplante precoz siendo de carácter hemodinámico funcional, dosis dependiente y reversible. Afecta fundamentalmente a los vasos y los túbulos ocasionando disfunción endotelial, disminución en la producción de sustancias vasodilatadoras (prostaglandinas, óxido nítrico) y aumento de vasoconstrictoras (endotelina, tromboxanos, hiperactividad simpática), con vasoconstricción arteriolar, disminución del flujo y del filtrado glomerular. Las lesiones crónicas son debidas al mantenimiento de la vasoconstricción, isquemia, sobreexpresión de TGF-ß, apoptosis y mecanismos reparativos que ocasionan lesiones estructurales [33] (Tabla 5). La CsA tiene mayor efecto nefrotóxico que el Tac y un perfil tóxico extra-renal diferente. La asociación entre polimorfismos genéticos asociados a nefrotoxicidad aguda con CsA y no con Tac puede ser una de las causas de estas diferencias [33][34]. Otros factores que influyen en su desarrollo son: edad del donante, uso de AINEs, depleción de Na y uso de diuréticos, diferentes polimorfismos genéticos (TGF-ß, ACE, etc.) y sobreexposición sistémica y local al fármaco [33].
Se manifiesta clínicamente como FRI o retraso en su recuperación, especialmente con donantes marginales, o como disfunción aguda e hipertensión arterial en pacientes con buena función renal previa. Puede aparecer hiperpotasemia, hiperuricemia, acidosis metabólica, hipofosfatemia, hipomagnesemia e hipercalciuria por efecto tóxico tubular. En ocasiones puede inducir un cuadro de anemia hemolítica microangiopática [33].
Aunque considerada durante años como causa de pérdida precoz del injerto y especialmente de pérdida tardía [35][36], actualmente, sin descartar su efecto nefrotóxico, su papel en la pérdida tardía del trasplante renal ha sido cuestionado, proponiéndose una etiología inmunológica particularmente debida a anticuerpos antiHLA clase II [26][37][38].
Toxicidad por otras drogas
El injerto renal es especialmente susceptible al efecto nefrotóxico de contrastes y fármacos (AINEs, aminoglucósidos, anfotericina B, etc.). Las dosis de los antimicrobianos usados como profilaxis o tratamiento deben ajustarse al grado de función renal (cotrimoxazol, cefalosporinas, ganciclovir, valganciclovir), así como considerar anticipadamente su posible influencia en los niveles de anticalcineurínicos (fluconazol, macrólidos).
Cualquier fármaco puede producir una nefritis intersticial aguda inmunoalérgica similar a la que aparece sobre riñones nativos.
Riñón no viable
A pesar del mayor uso de donantes marginales, si se excluyen los casos con trombosis vascular o rechazo, menos del 0,5% de los injertos no son viables [11][37]. Habitualmente, se trata de riñones procedentes de donantes añosos, con afectación cardiovascular y/o isquemias frías prolongadas agravadas por la exposición a anticalcineurínicos. Se ha descrito un especial aumento del riesgo en donantes en asistolia con isquemias prolongadas [39]. Aunque la recuperación parcial de la función renal es posible, el pronóstico del injerto a corto-medio plazo es pobre.
Infecciones
Tanto las pielonefritis agudas como la infección por CMV y BK virus pueden cursar con disfunción aguda precoz del injerto.
DIAGNÓSTICO DIFERENCIAL DE LA DISFUNCIÓN AGUDA PRECOZ
De las expuestas en la (Tabla 2), la NTA, el rechazo agudo mediado por anticuerpos o células T y la nefrotoxicidad por anticalcineurínicos son importantes por las consideraciones terapéuticas y/o su influencia en la supervivencia del injerto.
Aspectos clínicos
Generalmente la FRI no se asocia sintomatología específica. Valoraremos diuresis y cifras de creatinina plasmática, siendo importante conocer la diuresis residual del paciente pretrasplante. Si la diuresis residual era escasa y no aumenta tras el implante estaremos ante una situación de FRI, y también en el caso de pacientes con diuresis residual importante sin descenso de productos nitrogenados. Tal y como hemos dicho anteriormente, la fiebre, el dolor y el aumento de tamaño del injerto en el rechazo agudo son infrecuentes con los inmunosupresores actuales. La desaparición del pulso femoral en el lado del injerto puede indicar trombosis o vasoespasmo arterial tras la cirugía. La existencia de edema en la pierna ipsilateral al injerto puede ser sugestiva de trombosis venosa iliofemoral o una compresión venosa extrínseca. La eliminación por el drenaje de líquido, sobre todo si es abundante, orienta a hemorragia si es sangre, a fuga urinaria si es claro y su análisis muestra una composición similar a la orina, o a linfocele. Una vez hechas estas observaciones, es preciso recurrir a otros métodos para un diagnóstico adecuado (Figura 1).
Pruebas complementarias
En primer lugar siempre se valorará la posibilidad de obstrucción de la sonda urinaria o hipovolemia. En un segundo paso hay que recurrir a pruebas que demuestren la existencia de flujo sanguíneo en el injerto, ya que las trombosis vasculares en el postrasplante inmediato suponen una emergencia, dado el alto riesgo de pérdida del injerto. La ausencia de detección de flujo con pruebas no invasivas (ecodoppler, gammagrafía) obliga a una arteriografía o revisión quirúrgica de urgencias. En los casos con disfunción tras buena función del injerto, además de una ecografía para descartar problema vascular u obstructivo, la realización de una biopsia es imprescindible.
Ecografía con doppler
Véase Ecogafía Doppler y complicaciones quirúrgicas del Trasplante
Es una técnica de gran ayuda. Una buena diferenciación seno-parénquima, unos índices de resistencia inferiores al 70%, e índices pulsátiles en torno a 1,26, se han considerado de ayuda en el diagnóstico diferencial de la FRI. Sin embargo, la sensibilidad y especificidad de estos parámetros para el diagnóstico de rechazo son bajas. Su utilidad principal reside en valorar si el injerto está vascularizado o no, y detectar colecciones perirrenales y/o hidronefrosis. En el diagnóstico de hidronefrosis pueden darse errores en casos de reflujo, diuresis forzada, y obstrucción aguda asociada a NTA.
Estudios isotópicos
Son complementarios de la ecografía siendo importante el estudio secuencial. Los patrones gammagráficos más característicos son: (a) secuencia normal; (b) buena vascularización con retraso o ausencia de eliminación del radiofármaco; (c) disminución de vascularización y excreción; y (d) ausencia de vascularización (trombosis vasculares, rechazo hiperagudo o agudo severo). La sensibilidad y especificidad diagnósticas son bajas.
Pielografía anterógrada
Está indicada ante la sospecha, tras los estudios previos, de obstrucción de la vía o fuga urinaria. Con ella, podemos localizar la fuga o la obstrucción urinaria.
Arteriografía o flebografía del injerto
Se realiza en la FRI si los estudios ecográficos o isotópicos son compatibles con ausencia de vascularización. Algunos autores prefieren realizar exploración quirúrgica. Puede ayudar a diagnosticar un problema técnico no trombótico.
Angiorresonancia Magnética Nuclear sin gadolinio
Permite el diagnóstico de estenosis de arteria renal con una sensibilidad y especificidad aún no conocida.
Biopsia renal percutánea
Es la técnica de elección para el diagnóstico diferencial de la disfunción aguda de causa parenquimatosa, considerándose el patrón oro, aunque tiene sus limitaciones (material insuficiente, patología del donante, lesiones incipientes o inespecíficas, etc.). Para considerar la muestra adecuada, debe contener al menos 10 glomérulos y 2 arterias. El estudio molecular de las muestras tomadas con biopsia mediante microarrays podría ser en un futuro la técnica de elección [42][43].
La clasificación de Banff ha ido introduciendo cambios en su nomenclatura desde que fue publicada por primera vez en 1993, como consecuencia de la aparición de nuevos fármacos (Tac, MMF...), nuevas entidades patológicas (RAMAc, nefropatía por BKvirus), y un mejor conocimiento de la relación entre el cuadro clínico, el pronóstico y la histología [40][41][42][43][44].
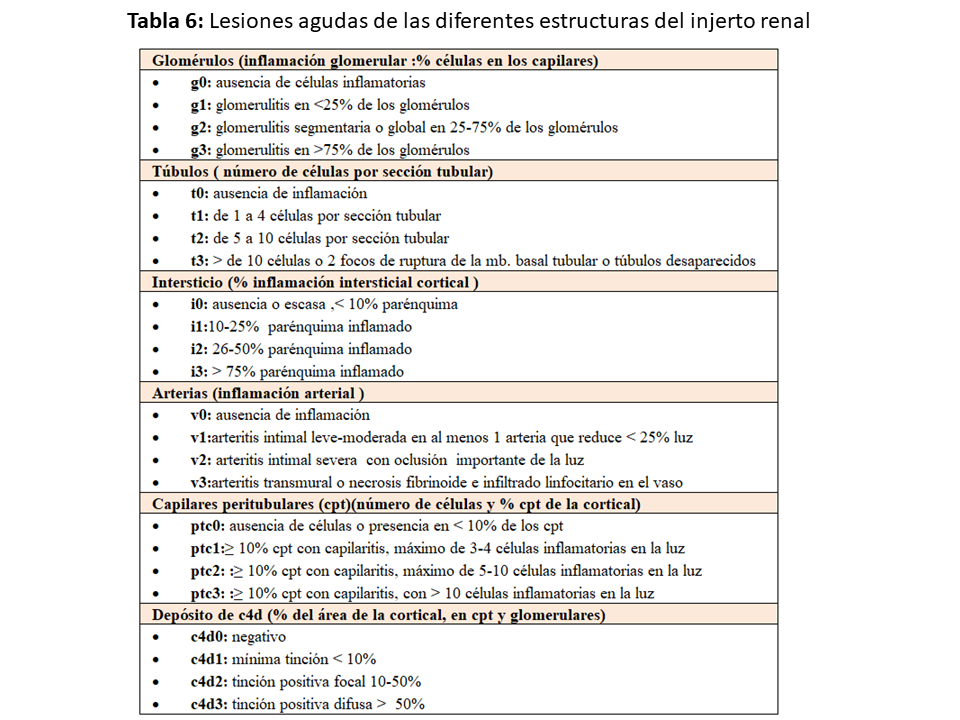
En la primera publicación, se definió una puntuación numérica de 0 a 3 para las lesiones agudas de los diferentes compartimentos (”t”, ”i”, ”v”, ”ah” y ”g”) (Tabla 6), y la necesidad de la presencia de tubulitis y/o arteritis intimal para el diagnóstico de rechazo agudo.
La hialinización arteriolar ”ah” fue considerada sugestiva de toxicidad por CsA si no hubiera existido en una biopsia previa [54]. Posteriormente se añadió la inflamación en capilares peritubulares ”ptc 0-3”, y se describieron las lesiones del rechazo agudo y crónico mediado por anticuerpos (ver capítulo Disfunción crónica tardía del trasplante renal) diferenciándolo del RAMCT. Varias actualizaciones de la clasificación de Banff [27][40][41][42][43][44] han añadido nuevos hallazgos quedando en la actualidad la clasificación de las lesiones como figura en la (Tabla 4).
En la reunión Banff de 2011, hubo numerosas propuestas, además de la definición de 2 fenotipos distintos en el RAMAc y la observación de que la llamada microcirculation inflammation (MI= glomerulitis y/o capilaritis) es el hallazgo que mejor presagia el desarrollo de rechazo crónico mediado por anticuerpos LINK (ver capítulo Disfunción crónica del trasplante renal). De ellas cabe destacar: 1) el término ”crónico” no hace referencia a un tiempo determinado postrasplante, sino a los cambios morfológicos de remodelado tras la agresión por RAMAc, pudiendo aparecer precozmente; 2) la glomerulitis puede aparecer en el RAMCT y responder a esteroides; 3) la presencia de dobles contornos puede deberse a causas diferentes al RAMAc como son la microangiopatía trombótica y la infección por virus hepatitis C; 4) la arteritis intimal (v1-v2) achacada habitualmente al RAMCT puede observarse en el RAMAc [43].
En la revisión de Banff de 2013, se actualizaron de los criterios diagnósticos del RAMAc [24], incluyendo el RAMAc c4d (-), en el que se sustituye la evidencia inmunopatológica (depósito de C4d en capilares peritubulares -cpt-) por la evidencia de interacción reciente/actual entre anticuerpos y endotelio, lo que incluye, pero no se limita al depósito de c4d en cpt (el otro criterio sería inflamación moderada de la microvasculatura renal (MI: g+ptc ≥ 2). Además, se incluye como criterio histológico de RAMAc la arteritis intimal aislada, aunque es más frecuente en el RAMCT o mixto, y la categoría de "glomerulopatía crónica precoz" (cg1a), evidente al ME pero no al MO [48] [44] (Tabla 4).
Banff 2015 puso de manifiesto la importancia de la inflamación en áreas de fibrosis ”i-IFTA” [45] . Estudios posteriores determinaron que i-IFTA era predictora de riesgo de pérdida de injerto, estaba relacionada con infrainmunosupresión, y generalmente aparecía tras RAMCT, por lo tanto representarían un rechazo crónico activo mediado por células T [49][50]. En la reunión de Banff 2017, se estableció la no obligatoriedad de detección de ADEs (frente a HLA u otros antígenos) para hacer el diagnóstico de rechazo mediado por anticuerpos, estableciendo en la nueva clasificación que todas las biopsias que muestran al menos depósito focal de c4d se encuadran en 1 de 3 categorías diagnósticas: RAMAc activo, RAMAc crónico activo y tinción de C4d sin evidencia de rechazo.
Tras la reunión de Banff 2019 como conceptos y cambios importantes: el diagnóstico molecular basado en FFPE (formalin-fixed paraffin-embedded), el Banff-Human Organ Transplant (B-HOT) gene panel (panel que incluye 770 genes) y el determinar como umbral para las lesiones límite (borderline) “i1t1“ [51][52][53].
Biopsia en el Rechazo agudo mediado por células T
Llamado previamente rechazo celular agudo/activo, se graduó de I a III en función de la severidad y pronóstico de las lesiones. El grado I o rechazo tubulointersticial se caracteriza por la presencia de tubulitis (t>1) e infiltrado intersticial superior al 25 % (>i1) siendo dividido a su vez en IA si es moderado y IB si es severo. Igualmente el grado II y III o rechazo vascular se caracteriza por la severidad de la arteritis intimal (v>0), grados IIA (leve) y IIB (moderado) o la presencia de arteritis transmural o necrosis fibrinoide de la media (v3) (Tabla 4).
Biopsia en el Rechazo agudo mediado por anticuerpos
Llamado también rechazo humoral requiere para su diagnóstico: 1) evidencia de daño agudo tisular con lesión similar a NTA-inflamación mínima, inflamación microvascular (g>0 y/o ptc>0) y/0 microangiopatía trombótica o arteritis (v>0); 2) evidencia de interacción reciente/actual entre anticuerpos y endotelio vascular, incluyendo uno de los siguientes: depósito de c4d en cpt y/o MI (g+cpt ≥2) y/o expresión aumentada de transcritos o marcadores moleculares validados ( esta técnica sólo está validada en algunos centros) y 3) detección de anticuerpos circulantes frente al donante antiHLA, antiMICA o antiendotelio (la expresión aumentada de transcritos o marcadores moleculares validados antes mencionada también puede sustituir a los anticuerpos donante específicos).
Biopsia en la toxicidad por CsA/Tac
Uno de los grandes problemas de esta entidad es la ausencia de datos específicos histológicos. La tubulopatía tóxica con vacuolización isométrica y cuerpos de inclusión en el citoplasma de células tubulares la sugiere pero pueden verse en un gran número de procesos [33], al igual que la microangiopatía trombótica se asocia a otras entidades que lesionan el endotelio, entre ellas el RAMAc [33][48]. Por otra parte la afectación crónica caracterizada por fibrosis en banda y glomeruloesclerosis es un hallazgo encontrado tras agresiones renales persistentes [33]. Las lesiones consideradas en su momento como claves para el diagnóstico de nefrotoxicidad como la hialinización arteriolar y los depósitos hialinos en la muscular de las arteriolas se han observado en pacientes trasplantados renales en tratamiento sin anticalcineurínicos [54]. Debe ser diferenciada de la hialinosis arteriolar característica del envejecimiento, la hipertensión y la diabetes. En estas tres condiciones, el depósito hialino es principalmente subendotelial, rara vez se extiende hasta la adventicia y no se observa la necrosis de las células musculares lisas de la capa media. También conocer las lesiones vasculares preexistentes en la biopsia del donante es de ayuda para evitar errores de interpretación de la biopsia postrasplante [55].
Por lo tanto, aunque el efecto nocivo de estos fármacos sobre el riñón es un hecho constatado en trasplantados de otros órganos sólidos o pacientes con psoriasis etc. [48], en la actualidad no existe un marcador histológico específico. El estudio genético de polimorfismos de un solo nucleótido (SNPs) puede en un futuro servir de ayuda para el diagnóstico de esta entidad [54].
Biopsias de protocolo y rechazo subclínico
De forma rutinaria, se monitoriza la función del injerto renal con la creatinina plasmática no siendo un marcador sensible de disfunción aguda. La realización de biopsias de protocolo, en determinados tiempos preestablecidos, ha demostrado que un pequeño porcentaje de casos presentan histología compatible con rechazo agudo, tanto mediado por células T como por Anticuerpos, sin deterioro de función renal. Estos rechazos subclínicos de no tratarse implican un peor pronóstico [56][59], aunque el grupo de París ha encontrado diferencias en la supervivencia del injerto según el tipo histológico de rechazo subclínico: en una cohorte de 1001 pacientes a los que se realizó biopsia de protocolo al año del trasplante, los que presentaban rechazo humoral subclínico eran los que tenían peor pronóstico, con una supervivencia del injerto a 8 años del 56%, frente a 88% en los que presentaban rechazo celular subclínico al año, o no presentaban rechazo (90% supervivencia del injerto a 8 años). En el análisis multivariado, el rechazo humoral subclínico se asociaba a 3,5 veces más riesgo de pérdida del injerto (p< 0.001) y estaba en relación con mayor progresión a glomerulopatía del trasplante [57].
Se ha descrito una técnica diagnóstica no invasiva que podría ayudar al diagnóstico de rechazo subclínico, evitando la biopsia renal y sus posibles complicaciones: se trataría de realizar un PET-TAC, inyectando 18F-FDG y medir la ratio del valor de captación medio estándar (mSUVR) entre la corteza renal y el psoas; ese valor fue significativamente superior en pacientes con rechazo subclínico frente a los que tuvieron una biopsia normal (interpretada con criterios de Banff 2017), de forma que el valor predictivo negativo de la prueba para descartar rechazo subclínico resultó del 98 %, aunque los propios autores consideran que aún debe validarse por otros grupos esta técnica[60].
TRATAMIENTO DE LA DISFUNCIÓN AGUDA PRECOZ
Necrosis tubular aguda (NTA)
Es importante prevenir e identificar factores de riesgo, modificándolos en lo posible (adecuada hidratación y mantenimiento del donante, acortar los tiempos de isquemia, etc). Se han utilizado agentes vasodilatadores (antagonistas del calcio, prostaciclina, péptido natriurético atrial, etc.), antioxidantes (N-acetilcisteina, etc.), antiinflamatorios (anticuerpos monoclonales contra ICAM o TNF, etc.) y factores de crecimiento sin que ninguno de ellos haya tenido un efecto claro en la reducción de la FRI [11][13][15] Tener en cuenta que el receptor puede precisar intraoperatoriamente volúmenes de resucitación de hasta el 5-10% del peso corporal para contrarrestar la vasodilatación ocasionada por la anestesia, previniendo así la FRI
Es necesario minimizar la nefrotoxicidad y evitar el rechazo agudo, mediante regímenes inmunosupresores adaptados. Soporte con diálisis asegurando estado de hidratación (filtros biocompatibles, evitar hipotensión y UF excesivas).
Realizar pruebas de imagen seriadas (ecodoppler, renograma isotópico), con el fin de descartar precozmente otras complicaciones, y biopsia precoz del injerto si se retrasa su recuperación más allá de 5-7 días en función del riesgo inmunológico.
Rechazo hiperagudo
No responde a ningún tratamiento (excepcional en la actualidad) está mediado por anticuerpos preformados contra determinados antígenos del donante en cantidad suficiente para producir una pérdida inmediata del injerto. Este tipo de rechazo es diagnosticado, en general, por el cirujano en quirófano al realizar la anastomosis vascular del riñón, ya que el injerto se vuelve tumefacto y hemorrágico y requieren trasplantectomía.
Rechazo agudo mediado por células T
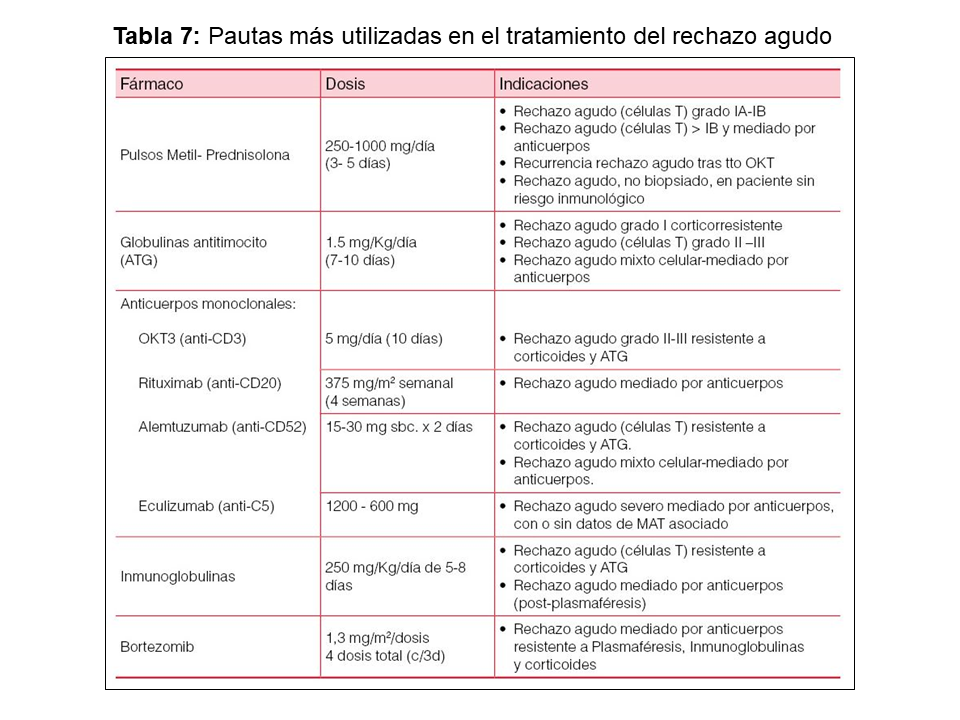
En el tratamiento del rechazo agudo mediado por células T se han utilizado principalmente, tres modalidades terapéuticas: (1) pulsos de esteroides; (2) anticuerpos policlonales anti células T (globulinas antitimocito, ATG); y (3) anticuerpos monoclonales OKT3 (Tabla 7).
Pulsos de esteroides
Es la primera opción terapéutica en el rechazo agudo mediado por células T con una tasa de respuesta entre el 60-70%. Se considera resistencia a los esteroides cuando no ha habido respuesta a los 5-7 días.
Anticuerpos policlonales anti células T (ATG)
Se recomienda su uso en el rechazo mediado por células T corticorresistente y/o rechazos recurrentes. Algunos equipos los usan en el rechazo grado IIA – IIB – III. Su efectividad varía en función de la procedencia del anticuerpo utilizado, con una mejor respuesta de la globulina de conejo (Timoglobulina®). También se utilizan en el rechazo agudo mediado por anticuerpos.
Anticuerpos monoclonales antiCD3 (OKT3)
Hoy día ya no se utilizan. Una revisión sistemática de la Cochrane (nivel de evidencia bajo-moderado) no encontró superioridad del OKT3 frente a anticuerpos policlonales en el tratamiento del rechazo celular corticorresistente y sí un aumento de los efectos adversos [61].
Otras terapias
Se aconseja asociar a la inmunosupresión de mantenimiento esteroides si no los recibían previamente, y conversión a Tacrolimus si el paciente recibía Ciclosporina previamente y/o asociación de Micofenolato.
Rechazo activo mediado por anticuerpos
Al igual que el tratamiento del RAMCT, debe ser precoz para evitar daño en las células endoteliales. Su finalidad se basa en varios conceptos básicos: 1) reducir los anticuerpos circulantes (plasmaféresis o inmunoadsorción) y neutralizar los residuales (inmunoglobulinas endovenosas); 2) evitar la sobreproducción de nuevos anticuerpos mediante la supresión/reducción de células B (Rituximab, esplenectomía aunque hoy en día es muy rara, MMF y anticalcineurinicos) y/o de células plasmáticas (Bortezomib); 3) disminución de la proliferación y diferenciación de las células B dependiente de los linfocitos T (anticuerpo policlonales antilinfocitarios, anticalcineurínicos) y 4) inhibición de la vía final del complemento (Eculizumab) (Tabla 7) [25][26][62].
Plasmaféresis (PE) para reducir los anticuerpos circulantes. El número de sesiones es variable, pudiéndose aplicar dos sucesivas y de dos a cinco alternas (1,5 volúmenes plasmáticos repuestos con albúmina y uso de plasma fresco congelado cuándo esté indicado) o hasta que la creatinina disminuya un 30%. Un tratamiento alternativo a la plasmaféresis, en espera de estudios prospectivos que lo confirmen, podría ser la inmunoadsorción con proteína A, más selectiva y costosa [25][26][62].
Inmunoglobulinas endovenosas (IGEV) para limitar la producción de anticuerpos. Tienen efecto inmunomodulador modificando la acción de diversas células inmunes (modifica actividad APCs, induce células T reguladoras y apoptosis células B activadas, reduce proliferación células T, etc.). Se han utilizado en dosis bajas (100-250 mg/kg post-plasmaféresis) o altas (2.000 mg/Kg con o sin plasmaféresis). La pauta de dosis bajas y plasmaféresis parece tener mejores resultados [25][26][62][63]
Rituximab (anticuerpo monoclonal anti-CD20) raramente utilizado como terapia única. Se suele utilizar tras una tanda de recambios plasmáticos e IGEV. Reduce la producción de anticuerpos contra el donante, inhibe acción APC de células B, disminuye producción de linfoquinas por células B, etc. Se ha utilizado en el tratamiento del rechazo mediado por anticuerpos, en dosis variables y con buenos resultados Cuando se utiliza, se suelen administrar de una a dos dosis de 375 mg/m2. Su efecto secundario más grave es el desarrollo de Leucoencefalopatía multifocal progresiva [25][26][62][63]. Se requiere serología reciente frente al VHB.
Bortezomib (inhibidor de proteosoma) aprobado para el tratamiento del mieloma múltiple, produce apoptosis de células plasmáticas. Utilizado con otros tratamientos en el RAMAc, con resultados controvertidos. Se utiliza a dosis de 1,3 mg/m2 intravenoso los días 1, 4, 8 y 11 en un solo ciclo. El efecto adverso más grave es la neuropatía periférica que puede ser invalidante y suele aparecer tras varios ciclos [25][26][62][63]]. Un estudio halló que su eficacia en el tratamiento del RAMAc parece mayor si se administra antes de que se produzca disfunción renal severa [64].
Eculizumab anticuerpo monoclonal humanizado con gran afinidad frente a la fracción del complemento C5, y aún más importante, que inhibe la acción proinflamatoria/coagulante del C5a y la formación de CAM. Aprobado en principio para la hemoglobinuria paroxística nocturna y posteriormente para el síndrome urémico hemolítico atípico ha sido utilizado con buenos resultados en el RAMAc sobre todo si se asocian datos de MAT en la biopsia. La dosis no está establecida, habiéndose utilizado 1200 mg en 1ª dosis, seguida de varias semanales de 600 mg [25][26][62][63].
Si coexiste un rechazo agudo celular se administrará ATG en las dosis descritas previamente. Se ha descrito efectividad tanto del ATG como de los esteroides en el tratamiento del rechazo agudo mediado por anticuerpo, incluso sin datos de rechazo celular asociado, por modulación indirecta de la respuesta de células B.
Es importante comentar que no existen estudios prospectivos randomizados amplios sobre las diferentes opciones de tratamiento, pero sin tratamiento el pronóstico del RAMAc es muy pobre. Futuros estudios en los que se compare como estándar el tratamiento PE + IGEV ofrecerán más datos. Hoy día el tratamiento de elección pasa por PE+IGEV asociando o no cualquiera de los otros fármacos en función del cuadro clínico [63][64][65].
Durante el tratamiento antirrechazo, se aconseja profilaxis contra las infecciones oportunistas (CMV, Pneumocistys jirovecii, candidiasis, etc.). A modo orientativo, es oportuno no iniciar un tratamiento antirrechazo, o suspender uno ya iniciado si: (1) La biopsia muestra datos de injerto no viable (múltiples infartos, etc.); (2) Existe área fotopénica en los estudios isotópicos; (3) Infección no controlada; (4) Inmunosupresión acumulada en exceso.
Nefrotoxicidad por ciclosporina/Tacrolimus
El tratamiento consiste en reducir la dosis, especialmente en pacientes de riesgo (donantes marginales, TIF prolongados, etc.). Si se produce un síndrome urémico hemolítico (descartando RAMAc), es necesario suspender el fármaco, incrementando la inmunosupresión con otras drogas para evitar el desarrollo de un rechazo. El efecto protector del uso concomitante de ácidos grasos O-3, misoprostol, calcioantagonistas no dihidropiridínicos (diltiazen y verapamil), IECAs y ARA-II (losartán), requiere estudios más amplios.
OTRAS COMPLICACIONES MÉDICAS EN EL PERIODO
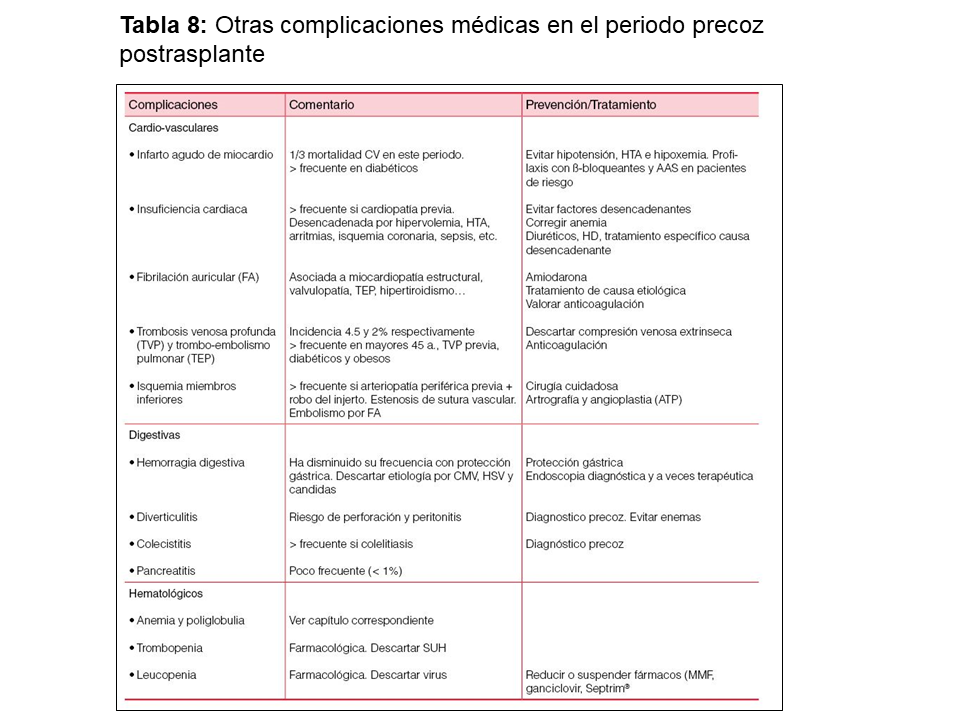
Otras complicaciones médicas aparecidas en los 3 primeros meses del trasplante pueden clasificarse en: infecciosas, cardio-vasculares, digestivas y hematológicas, y se resumen en la (Tabla 8).
Mortalidad en este periodo
En el trasplante de cadáver la mortalidad global en el primer año es aproximadamente del 5% y de ésta la mitad sucede en los primeros tres meses. En esta etapa, las causas principales de mortalidad son las cardiovasculares y las infecciosas. La reducción de las muertes por infección en las últimas décadas ha contribuido, entre otras, a disminuir la mortalidad global en el primer año. Por otra parte, las características demográficas de la población en lista de espera (aumentando el grupo de los de mayor edad y los retrasplantes), así como el tipo de donante, obligan a renovar y adaptar las estrategias que contribuyan a mejorar la supervivencia. En este sentido, el trasplante de donante de vivo ofrece las mejores perspectivas.
Mortalidad postoperatoria
Según datos de la USRDS el riesgo ajustado de mortalidad en los primeros tres meses postrasplante supera la mortalidad del paciente que permanece en lista de espera (diálisis), ampliándose hasta aproximadamente el año en el caso de receptores más añosos. Esto refleja en gran parte el riesgo y las secuelas asociadas al perioperatorio. Para maximizar la supervivencia en este periodo es necesario una correcta evaluación y preparación del candidato en lista de espera, identificar a los pacientes de riesgo, establecer pautas individualizadas de inmunosupresión, especialmente en los pacientes con riesgo de disfunción precoz del injerto y anticiparse en la detección de complicaciones médicas e infecciosas.
Mortalidad tras el alta y 3 meses
En la actualidad la probabilidad de supervivencia no ajustada a los tres meses de un primer trasplante de donante de cadáver es de 97,7% (3). Los pacientes con comorbilidad asociada (especialmente enfermedad cardiovascular previa y diabetes), aquéllos con mayor tiempo en diálisis y los pacientes con función subóptima del injerto presentan mayor riesgo de mortalidad por complicaciones médicas. En relación con estos factores, se han elaborado índices de comorbilidad que contribuyen a estratificar el riesgo de mortalidad del paciente tras el alta hospitalaria.
En este periodo se precisa un seguimiento ambulatorio estrecho para detectar de forma precoz disfunciones del injerto, pero también posibles efectos adversos relacionados con la propia medicación, aparición de infecciones de la comunidad o por gérmenes oportunistas e instaurar medidas para incidir en los factores de riesgo cardiovascular.