Hepatopatía en el Paciente Trasplantado Renal
Palabras clave
Hepatitis C, Hepatitis B, Hepatitis E, Antivirales de acción directa, hepatopatía por fármacos, Hepatitis colostática fulminante, enfermedad veno-oclusiva hepática, peliosis hepatica
Se trata de una entidad con una elevada incidencia tras el trasplante renal (TR) (varía entre un 4-38 % según los registros consultados y los criterios diagnósticos aplicados). La aparición de hepatopatía, se relaciona además con una reducción en la supervivencia tanto del paciente como del propio injerto, lo que motiva la gran relevancia que presenta un adecuado diagnóstico y manejo tanto en el periodo previo al trasplante como tras el mismo. La mayor parte de los casos son pacientes con antecedentes de hepatitis C (VHC) o hepatitis B (VHB), pero existe una amplia gama de procesos a considerar en el diagnóstico diferencial (Tabla 1).
Actitud ante alteraciones de la función hepática
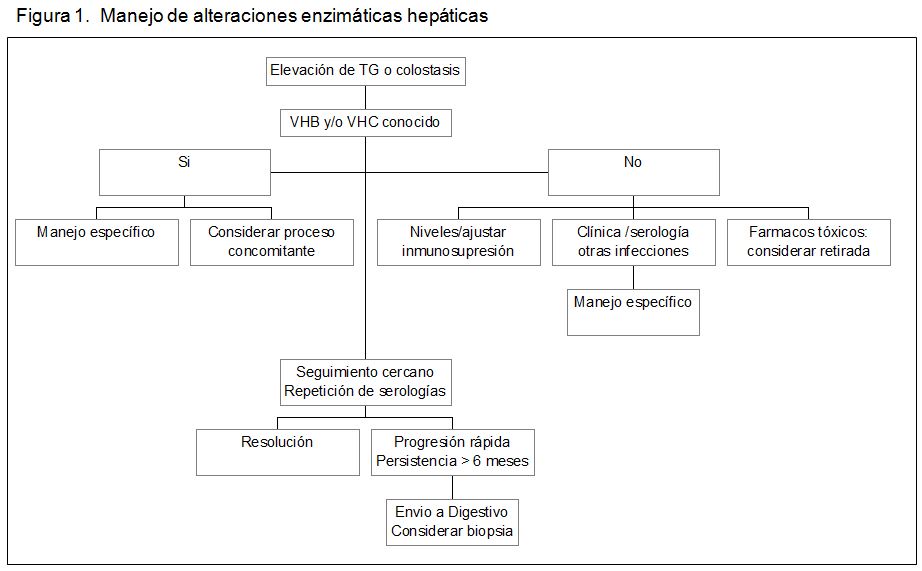
Las elevaciones de transaminasas o colostasis, sobre todo de grado ligero, son muy frecuentes en los primeros meses post-TR. En la (Figura 1) se muestra un esquema general del planteamiento diagnóstico; para su interpretación debe combinarse con el contenido de la (Tabla 1). En los primeros 6 meses deben descartarse la transmisión de hepatitis por el órgano en los sujetos seronegativos a VHB-VHC o la reactivación en los seropositivos; también la posible incidencia de otras infecciones propias del postoperatorio temprano. Cuando las alteraciones son leves o moderadas puede adoptarse una actitud expectante con vigilancia analítica estrecha, porque con frecuencia se trata de trastornos transitorios. Debe realizarse un estudio de imagen con ecografía y/o TAC/RNM, con especial atención en los casos de colostasis. Si las alteraciones son graves o el curso se prolonga, está indicado el estudio conjunto con especialistas de Digestivo, pudiendo ser necesaria la realización de biopsia hepática.
HEPATOPATÍAS DE CAUSA INFECCIOSA
HEPATITIS C
La tasa de infección por VHC en pacientes de TR, estimada por la positividad a anticuerpos por ELISA (anti-VHC+), varía según las zonas geográficas del 3 al 68 %. Entre los nuevos TR en España de los últimos años es de alrededor del 3-5 % [1]; el genotipo predominante, como en Europa, es el 1 (sobre todo el 1b). La gran mayoría adquirió el VHC antes del TR: son factores de riesgo la duración de la diálisis, el número de transfusiones y el TR previo. Muy ocasionalmente algún paciente se infecta a través del órgano trasplantado o de transfusiones peri-TR.
El estado de anti-VHC+ en el momento del trasplante renal es un factor pronóstico de peor supervivencia (SV) tanto del paciente como del injerto. Dos recientes metanálisis daban riesgos relativos de 1.69-1.85, y de 1.56-1.76, respectivamente, de peor SV del receptor anti-VHC positivo y de su injerto renal, en comparación con los anti-VHC negativos en el momento del TR [2] [3]. La asociación se mantiene incluso en la época más reciente con los actuales inmunosupresores [4].
En nuestro ámbito geográfico se ha comprobado esta asociación con el mismo orden de magnitud: el estudio colaborativo español de nefropatía crónica del injerto demostraba para los TR en sujetos anti-VHC+ un riesgo relativo de morir después del primer año de 1.59 y de perder el injerto de 1.31, en análisis multivariable con inclusión de los principales factores de riesgo [5]. En un análisis similar realizado en Andalucía para el periodo 2000-2013, los receptores anti-VHC (+) pre-TR tenían un riesgo relativo de fracaso del injerto censurado para muerte de 1.62, de magnitud similar al hecho de recibir un riñón de donante expandido o de estar inmunizado anti-HLA [6]. Los mecanismos por los que se produce este efecto perjudicial no están bien establecidos. En cuanto a la mortalidad, aparte de la esperable incidencia de enfermedad hepática terminal y de hepatocarcinoma asociados al VHC, podría haber una mayor incidencia de cáncer, infecciones y de enfermedad cardiovascular [7] [8]. Esta última asociación podría estar en relación, entre otros efectos directos e indirectos del VHC, con la mayor frecuencia de diabetes entre los trasplantados anti-VHC (+) según demuestran estudios monocéntricos y los metanálisis [9] [10]. Respecto al impacto sobre la SV del injerto (adicional a la muerte con riñón funcionante) podría atribuirse entre otros motivos a la mayor frecuencia de glomerulopatías relacionadas con el VHC [11], pero también de nefropatía crónica del injerto por mecanismos no bien establecidos [12].
Un aspecto decisivo de la asociación entre VHC y SV del trasplante es que parece estar ligada a la presencia de replicación del VHC en el momento del TR. Si bien la evidencia al respecto es limitada [13], un trabajo multicéntrico español [14] demostraba el efecto negativo de la replicación viral en comparación con los casos de serología positiva al VHC pero sin replicación, tanto sobre la SV del paciente como la del injerto.
En el momento del TR la mayoría (74-92 %) de los VHC+ presenta viremia detectable (ARN-VHC por PCR) que tiende a persistir indefinidamente. En una muy pequeña fracción de pacientes se demuestra viremia VHC en ausencia de anti-VHC, debido al déficit de producción de anticuerpos por la inmunosupresión. También podrían darse casos de VHC “oculto” (ARN indetectable en plasma, pero presencia del virus en leucocitos), aunque se ha puesto en discusión que representen una fracción significativa [15]. Desde el punto de vista clínico y analítico, la mayor parte de los pacientes se mantiene estable tras el TR; la carga viral aumenta como efecto de la inmunosupresión, pero no de forma progresiva. Excepcionalmente, la enfermedad hepática puede cursar más agresivamente. La forma más grave es la hepatitis colestásica fibrosante: replicación viral muy intensa, con un cuadro histológico característico y colestasis severa que puede desembocar en fallo hepático en pocas semanas. Existen estudios discrepantes respecto a la progresión histológica de la hepatopatía, pero probablemente en la mayoría el curso es lento e incluso permanece estable en una proporción elevada de casos (hasta el 60-80 % en algunos trabajos). La correlación de los parámetros bioquímicos, del genotipo viral (tipos concretos o infección por más de una cepa) y de la carga viral con la evolución histológica es escasa. Por tanto, la valoración de la gravedad y evolución de la afectación hepática precisa de estudios especiales a realizar en colaboración con el hepatólogo: valoración de la fibrosis (índices no invasivos, Fibroscan®) y de la presencia de hipertensión portal (ecografía abdomen y doppler esplenoportal; endoscopia oral) y, en casos seleccionados, realización de biopsia hepática con/sin medida de gradiente de presión portal (en este caso al tiempo de la biopsia por vía transyugular).
El manejo del paciente con VHC en relación con el TR ha cambiado de forma radical desde la disponibilidad de los nuevos antivirales de acción directa (AAD).
Preparación pre-TR. A pesar de su asociación con un peor pronóstico del TR, el VHC no supone por sí mismo una contraindicación, puesto que se ha demostrado una mejor supervivencia de los VHC+ trasplantados en comparación con permanecer en lista de espera. Los candidatos a TR deberán ser estudiados en colaboración con Hepatología para decidir acerca de dos principales cuestiones:
- Indicación de un TR aislado versus un trasplante combinado hígado-riñón. La presencia de hepatopatía avanzada con insuficiencia hepática o hipertensión portal significativa inclinará hacia el trasplante combinado.
- Pauta y momento de tratamiento con AAD del VHC (+) con replicación viral activa, indicado incluso con grados bajos de fibrosis (F<3), por el efecto potencial sobre la evolución del posterior TR.
Las terapias disponibles hasta hace poco, basadas en el interferón (IFN), eran inaplicables tras el TR, por la alta frecuencia de disfunción renal, muchas veces irreversible [16]. Por ello, las guías nefrológicas (KDIGO) y las elaboradas por las Sociedades de Hepatología venían recomendando el tratamiento del VHC antes de la inclusión en lista de espera de TR. El resultado con terapias basadas en IFN en pacientes con enfermedad renal crónica avanzada o en diálisis, especialmente el IFN pegilado asociado a ribavirina, era bastante satisfactorio en términos de respuesta viral sostenida (RVS), pero eran pautas de difícil manejo, de larga duración y agravadas por una tasa alta de efectos secundarios e interrupción de tratamiento [17]. En cambio, con los AAD se obtienen altas tasas de RVS con mínimos efectos adversos en tratamientos habitualmente de 12 semanas.
Actualmente, las últimas guías de la “American Association for the Study of Liver Diseases/Infectious Diseases Society of America” recomiendan el empleo de glecaprevir / pibrentasvir o sofosbuvir/velpatasvir (ambas combinaciones son pangenotípicas) o sofosbuvir/ledipasvir (no efectivo contra los genotipos 2 y 3) como primera línea de tratamiento [18]. Si bien sofosbuvir no se recomendaba hasta la fecha en pacientes con filtrado glomerular inferior a 30 ml/min/1.73m2 dado su aclaramiento renal, se ha demostrado su eficacia y seguridad en pacientes con ERC estadio 4-5, incluido en pacientes en hemodiálisis [19].
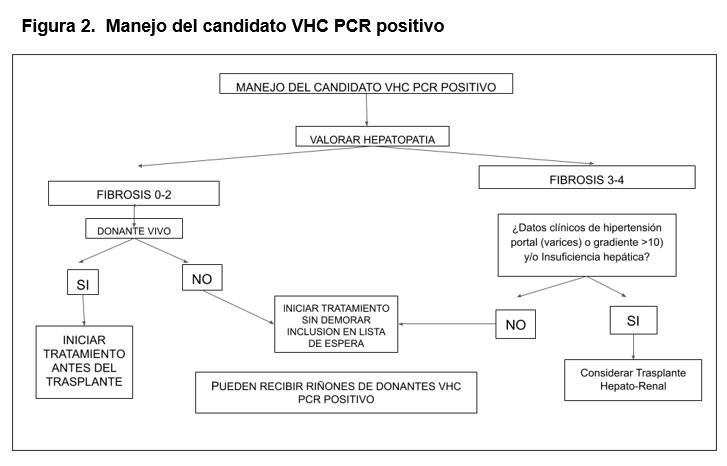
En cuanto a la decisión de cuándo tratar a los pacientes [20] antes del TR o si se pospone a la realización del mismo, se debe tener en cuenta el tiempo de espera previsible hasta el TR (en función del grupo ABO, estado de inmunización, posibilidad de un TR de donante vivo y donante VHC+) y las características de la enfermedad hepática (estadio de fibrosis, función hepática e hipertensión portal, tratamientos anteriores). En la (Figura 2) se muestra una propuesta de algoritmo de decisión para el manejo de esta situación.
Empleo de donantes VHC(+)
La tasa de transmisión del VHC por el TR de un órgano procedente de un donante VHC(+) es muy elevada (57-96 %). Por tanto, hasta hace unos años todos los donantes cadavéricos deberían tener una determinación de anti-VHC y en caso de positividad sus órganos no debían ser empleados en receptores VHC negativos. Hay un muy pequeño riesgo de adquisición del VHC a partir de órganos de donantes anti-VHC- con viremia (ARN-VHC+) por encontrarse en el periodo ventana o por falta de respuesta serológica [21]. Debe ser asumido dentro de los riesgos generales del TR, puesto que en la práctica ordinaria de la donación de cadáver no dispondremos del resultado pre-TR de pruebas nucleicas. Pero el escenario de trasplante de riñones procedentes de donantes anti-VHC+ ha cambiado desde la aparición de los antivirales de acción directa (AAD) de alta eficacia y pangenotípicos sin limitación de uso en filtrados glomerulares bajos.
Hay trabajos en el sentido de que la supervivencia de los pacientes VHC+ /ARN-VHC+ trasplantados con riñones anti-VHC+ es superior a la de los que permanecen en lista de espera, y a que la aceptación de un donante VHC+ acorta notablemente el tiempo en espera de un órgano [22]. Estudios realizados en el registro estadounidense indicaban peor superviviencia en los receptores de donantes VHC+. Sin embargo, una amplia experiencia en nuestro país ha mostrado buenos resultados a medio plazo de esta estrategia [23].
Existe la preocupación de que pueda transmitirse y sobreinfectar con VHC de un genotipo distinto al que portaba el receptor, hecho que se ha demostrado ocasionalmente, por esto a pesar de las recomendaciones, el TR utilizando donantes VHC+ en receptores VHC+ ha sido y sigue siendo controvertido. No obstante, investigaciones recientes corroboran que el menor tiempo en lista de espera al aceptar donantes VHC+ contribuye a mejorar la supervivencia del injerto (muerte censurada) comparada con los receptores VHC+ trasplantados con riñones de donantes VHC-. Por tanto, las guías KDIGO siguen recomendando el trasplante de donantes VHC+ en receptores positivos.
El éxito de los AAD hace que el uso de riñones VHC+ en dichos receptores sea más seguro a largo plazo. Sin embargo, el acceso a los AAD hará desaparecer los posibles receptores VHC+, puesto que se tratarán precozmente. Ante este hecho surge esta nueva cuestión: En la era de los AAD, ¿debemos plantear la donación de riñones de donantes VHC+ y receptores VHC-?
Existen publicaciones [24] [25] [26] donde se ha demostrado que en trasplantes con donantes VHC virémicos a receptores VHC negativos, donde el porcentaje de infección fue cercano al 100 %, el inicio de tratamiento precoz con AAD durante 12 semanas se asoció en el 100 % con RVS.
Se recomienda el inicio temprano de tratamiento con AAD, pues se ha observado de forma retrospectiva que el retraso en su inicio, si bien consigue la misma tasa de aclaramiento viral, se asoció a un aumento de complicaciones como rechazo, infección por CMV o BK, diabetes mellitus de novo y, ocasionalmente, aunque infrecuente, hepatitis colestásica fibrosante [27].
La política de usar donantes VHC ARN+ en receptores VHC- ofrece la posibilidad de aumentar el pool de donantes y disminuir la lista de espera, aunque la experiencia aún es escasa [28].
Según datos de la ONT, los donantes eficaces con serología positiva para VHC suponen en torno al 1 % de la muestra total de donantes eficaces, por lo que la propia ONT ha elaborado un documento de consenso de reciente publicación ante el cambio en el panorama actual [29]. En dicho documento, se establecen 2 premisas esenciales para que se puedan dar estas donaciones:
1. Habilitar el acceso universal a los AAD
2. Proporcionar información al candidato a recibir un órgano de un donante VHC+, información que ha de plasmarse en un consentimiento informado específico.
Aunque el impacto cuantitativo no se espera elevado (estimación por ONT 5-10 donantes anuales), en el contexto actual no procede contraindicar la donación de forma sistemática.
La ONT reconoce que la experiencia es corta, por lo que teniendo en cuenta que el contagio desde un donante VHC+ no virémico es excepcional y que la transmisión desde un donante VHC+ virémico se da en la práctica totalidad de los casos, son necesarios protocolos de consenso y un seguimiento estrecho en caso de realización de trasplante, así como el inicio temprano de AAD.
En el TR de donante vivo es obligado realizar una determinación de ARN-VHC del donante, además de la serología. Ante un donante vivo VHC+ podría plantearse igualmente la donación a su receptor VHC+ si se considera más ventajoso que esperar al tratamiento efectivo de la pareja. La donación procedente de un sujeto VHC+ con viremia negativa espontánea o tras tratamiento efectivo, para un receptor VHC-, se puede llevar a cabo ya que el donante se puede considerar curado y sin riesgo de transmisión; ya se han realizado donaciones de este tipo con buenos resultados [30].
Manejo postrasplante del paciente VHC+
Los nuevos AAD son utilizables tras el TR y ofrecen resultados óptimos con buena tolerancia y seguridad. De ahí que las últimas recomendaciones de las Sociedades de Hepatología ya aconsejen el tratamiento sistemático del VHC tras el TR (si no es posible hacerlo antes) con pautas libres de interferón. En pacientes con TR se han comunicado ya resultados excelentes del uso de sofosbuvir en combinación con otros antivirales (simeprevir, daclatasvir y especialmente en combinación coformulada con ledipasvir) con o sin ribavirina [31] [32] [33]. En España dos estudios multicéntricos han comprobado ya las altas tasas de respuesta viral con buena tolerancia con diversas combinaciones de AAD [34] [35].
Una vez demostrada la eficacia y seguridad de sofosbuvir en pacientes con función renal reducida (filtrado glomerular inferior a 30 ml/min), las principales combinaciones recomendadas, independientemente del filtrado glomerular, son glecaprevir / pibrentasvir o sofosbuvir/velpatasvir (ambas son pangenotípicas) o sofosbuvir/ledipasvir (no efectivo contra los genotipos 2 y 3) como primera línea de tratamiento [18]. También se ha demostrado la eficacia y seguridad de sofosbuvir/daclastavir en pacientes trasplantados renales [36] y grazoprevir/ elbasvir [37] aunque solo en genotipos 1a, 1b y 4.
Ante la posibilidad de realización de TR de donantes VHC+ en receptores VHC-, con la presencia de fármacos sin limitación de uso por filtrados glomerulares bajos o en pacientes en diálisis, es posible y necesaria la realización de protocolos de tratamientos con pauta de primera dosis pretrasplante y continuación del tratamiento en el postrasplante inmediato, haciendo un seguimiento conjunto con los hepatólogos.
Además, se ha sugerido que el tratamiento con AAD podría asociarse a reactivación del virus de la hepatitis B en los individuos coinfectados y a un mayor riesgo de recurrencia tumoral en pacientes con hepatocarcinoma que han recibido tratamiento ablativo del mismo [38].
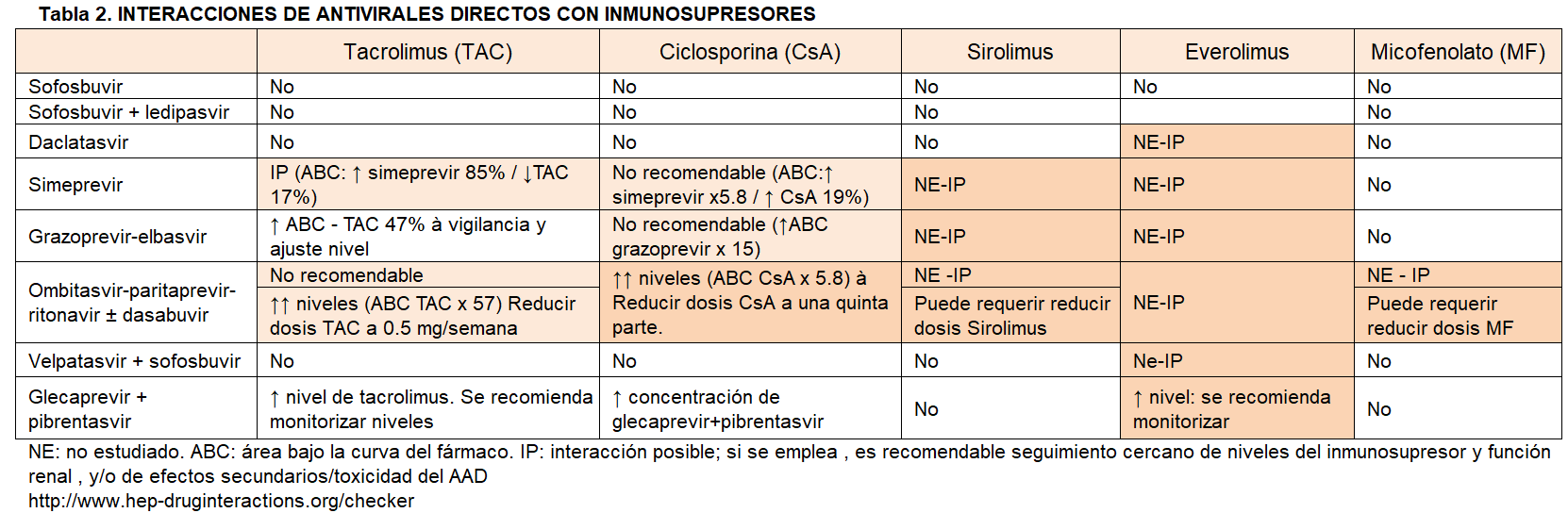
En términos prácticos la actitud aconsejable es el abordaje de forma coordinada con la Unidad de Hepatología. Como en el caso del tratamiento preTR, la pauta (combinación de fármacos, dosis y duración) se establecerá por el hepatólogo en función de las características de la hepatopatía y del tratamiento inmunosupresor de base (Tabla 2). El nefrólogo por su parte mantendrá un seguimiento muy estrecho del paciente respecto a función renal, efectos secundarios y niveles de inmunosupresores. Pueden ser necesarios ajustes de dosis (aparte de la retirada transitoria de diversas medicaciones con interacción con los AAD), y en particular se ha descrito un descenso de niveles de anticalcineurínicos durante o al final del tratamiento por mejoría del metabolismo hepático.
No se ha establecido cuál es la pauta de inmunosupresión ideal en el TR en VHC+. No se ha podido demostrar un efecto nocivo de la inducción con anticuerpos, que usados adecuadamente incluso podrían mejorar la superviviencia según un estudio retrospectivo [39]. En el trasplante hepático se ha asociado el empleo de bolos de esteroides con una peor evolución; en cambio no parece existir problema con dosis bajas de mantenimiento. Esta cuestión no está aclarada en el TR, aunque hay que recordar que el tratamiento del rechazo agudo con dosis altas de esteroides o anticuerpos podría ver incrementada su tasa de complicaciones infecciosas en este grupo de pacientes. Respecto a la elección de anticalcineurinicos, se han señalado dos aspectos: el tacrolimus resulta particularmente diabetógeno en pacientes VHC+; la ciclosporina muestra capacidad inhibitoria del VHC in vitro. Por ello se han propuesto el empleo inicial preferente de ciclosporina y la conversión a CsA en los casos que desarrollan hiperglicemia [40], pero la ventaja de estos enfoques respecto a la superviviencia no está adecuadamente probada. Se dispone de poca información sobre la repercusión del micofenolato o los iMTOR. La conversión a micofenolato (que muestra actividad virustática in vitro) se asoció en un estudio con un aumento de la carga viral; en contraposición, también se ha observado asociación a unos mejores resultados de SV [39]. Los iMTOR deben ser empleados con cautela dado el riesgo de que produzcan disfunción hepática. Como conclusión, en ausencia de evidencias sólidas, se recomienda el empleo de la pauta estándar de cada centro. Este enfoque se ve reforzado al considerar que el tratamiento efectivo con AAD probablemente sitúe al paciente en una condición similar a la del paciente VHC negativo.
El cuidado post-TR del paciente con VHC, especialmente aquellos con grado avanzado de lesión hepática, comprende también la prevención de nuevas agresiones al hígado y de las complicaciones (Tabla 3).
Respecto al alcohol lo más prudente es recomendar la abstinencia completa. La vacunación para las hepatitis A y B da resultados pobres tras el TR mientras que está bastante bien conservada la respuesta a la dosis de recuerdo en vacunados pre-TR. Por tanto la actitud más recomendable es proceder a estas vacunaciones antes del TR. A la vista de lo expuesto antes, también es prudente mantener la vigilancia de reactivación de la hepatitis B y, sobre todo en casos de evolución prolongada del VHC, de la aparición postratamiento de un hepatocarcinoma [41], mediante seguimiento ecográfico y de la alfafetoproteina semestralmente en pacientes con cirrosis o fibrosis avanzada (F3).
La erradicación del VHC de nuestros programas de TR genera la esperanza de un mejor pronóstico del paciente VHC+ y de su injerto, pero se trata de una hipótesis a demostrar en los próximos años.
HEPATITIS B
Impacto de la infección por virus de la hepatitis B en el trasplante renal
La infección crónica por el virus de la hepatitis B (VHB) continúa siendo un problema de salud a nivel mundial [42]. Es importante el despistaje y conocimiento del manejo de esta infección, ya que se trata de una posible causa de daño hepático severo tras el trasplante debido a la inmunosupresión que reciben estos pacientes. Antes de la disponibilidad de fármacos antivirales, presentaba un impacto negativo en la evolución del paciente tras el TR, disminuyendo la supervivencia global y del injerto [43] [44]. Un metanálisis de 6 estudios observacionales (6050 pacientes) publicado en 2005 mostró que el HBsAg (+) es un factor predictivo independiente que aumenta la mortalidad en el TR (RR=2,49) y el riesgo de pérdida del injerto (RR=1,4) en relación a los pacientes HBsAg (-) [43]. Un segundo metanálisis posterior publicado en 2014, que incluyó 10 estudios observacionales (82690 pacientes), confirmó los resultados anteriores y el HBsAg se asoció a un riesgo aumentado de mortalidad por todas las causas (RR=2,21) y de pérdida del injerto (RR=1,44) [44]. Sin profilaxis, la enfermedad hepática asociada al VHB progresa y el 85 % de los pacientes presentan hepatitis crónica, el 28 % cirrosis y el 23 % de los pacientes con cirrosis desarrollan hepatocarcinoma, tras una mediana de seguimiento de 66 meses [45].
La prevalencia de HBsAg (+) en las unidades de diálisis de los países desarrollados va del 0 % al 7 % [46]. En España esta prevalencia ha ido disminuyendo de forma progresiva en las últimas dos décadas, hasta situarse en valores en torno al 1,03 % según datos del último estudio observacional publicado [47]. Este descenso ha sido debido a: la generalización de la vacunación frente al VHB desde 1990, la estricta separación en las unidades de diálisis de los pacientes HBsAg (+), el cribado de las bolsas de sangre, la reducción de las transfusiones por el uso de eritropoyetina y ferroterapia, además de las medidas de higiene y profilaxis universales [42]
Evaluación y tratamiento pretrasplante renal
En todos los pacientes candidatos a recibir un TR, se debe de realizar un despistaje de infección por VHB mediante serología que incluya HBsAg, antiHBc, antiHBs [42] [48] [49]. En los pacientes que presenten infección activa por el VHB, al igual que cualquier otro paciente HBsAg (+), deberemos evaluar dos aspectos: el estado de la infección por VHB y la gravedad de la enfermedad hepática [8] [9]. El estudio serológico también debe de ampliarse, añadiendo las determinaciones de: HBeAg, antiHBe y ADN-VHB. Además, deberemos de investigar si existe coinfección por virus delta (VHD), virus de la inmunodeficiencia humana (VIH), VHC y el virus de la hepatitis A (VHA) ya que en el caso de ser el paciente IgG negativo se debe recomendar la vacunación contra dicho virus [49] [50] [51] [52].
Respecto a la valoración de la enfermedad hepática, hay que señalar que las transaminasas suelen estar poco elevadas en los pacientes con enfermedad renal crónica terminal y que los tests no invasivos para estimar la fibrosis hepática, no están adecuadamente validados [53] [54]. Dada la importancia que tiene de cara al TR, debemos conocer si el paciente tiene una cirrosis y la existencia o no de hipertensión portal (HTP). De no existir signos evidentes de HTP, será necesario realizar una biopsia hepática, preferiblemente por vía transyugular que, al mismo tiempo que reduce el riesgo de sangrado que tienen estos pacientes, permitirá medir el gradiente de presión portal [53] [54] [55] [56]. Los pacientes con cirrosis descompensada o con HTP (se considera clínicamente significativa si el gradiente de presión portal es >10 mmHg) deben ser candidatos a doble trasplante hepático y renal [53]. Los pacientes sin cirrosis o con cirrosis compensada sin HTP clínicamente significativa pueden recibir TR aislado [53].
La indicación del tratamiento antiviral en el candidato a TR infectado por el VHB es igual que en otros pacientes HBsAg (+) y debe hacerse cuando el nivel de ADN-VHB es > 2000 UI/ml y exista lesión hepática con inflamación y/o fibrosis al menos moderada (= A2 y/o = F2 de la clasificación METAVIR o similar), sin tener en cuenta el nivel de ALT que puede estar normal o poco elevado en esta población. De existir cirrosis hepática, el tratamiento está indicado cuando el ADN-VHB sérico es detectable, independientemente de la carga viral [54].
Hay dos familias de fármacos disponibles frente al VHB: los análogos de nucleós(t)idos (lamivudina [LAM], adefovir dipivoxil [ADV], entecavir [ETV], telbivudina [TBV] y 2 profármacos de tenofovir: tenofovir disoproxil fumarato [TDF] y tenofovir alafenamida [TAF]); e interferon (IFN) α-2a y α-2b convencionales y una forma pegilada de alfa-2a (IFN-PEG alfa-2a). Entre los análogos, actualmente no se recomiendan LAM, ADV y TBV debido a su menor barrera genética a la resistencia, mientras que en IFN, las formas pegiladas han reemplazado a las formas tradicionales debido a una administración más fácil (dosis semanal en lugar de 3 dosis por semana), mejor eficacia y mejor tolerancia [57] [58] [59] [60] [61] [62] [63]. El TAF (tenofovir alafenamida) es un derivado de tenofovir (la formulación habitual es la forma tenofovir disoproxil fumarato -TDF-) con similar potencia antiviral y mejor perfil de seguridad renal y ósea y puede sustituir al TDF, especialmente en los casos de daño renal o enfermedad ósea [54] [55]. En caso de resistencia a lamivudina, debe utilizarse tenofovir-TDF o TAF, y si existe resistencia a lamivudina y adefovir ha de hacerse tratamiento combinado con tenofovir-TDF o TAF y un análogo de nucleósido (lamivudina, entecavir o emtricitabina). Es necesario ajustar la dosis a la función renal, y en el caso de pacientes en hemodiálisis, se administran en una dosis semanal, tras una sesión de diálisis [42] (Tabla 4).
Manejo tras el trasplante renal.
1.Receptores HBsAg positivo
Todos los trasplantados HBsAg(+) deben recibir terapia antiviral independientemente de los niveles séricos de ADN-VHB, para prevenir la reactivación del VHB (en aquellos casos en los que no estuviesen recibiendo tratamiento) secundario a la inmunosupresión y evitar la progresión de la fibrosis hepática [42] [49] [50] [51] [52] [53] [54]. En los pacientes que no están recibiendo tratamiento antiviral antes del TR, éste debe iniciarse en el mismo momento del TR y ha de mantenerse indefinidamente. En los receptores de un injerto de donante vivo, se recomienda iniciar la profilaxis antiviral 4-6 semanas antes del TR [54].
El tratamiento antiviral ha demostrado mejorar el pronóstico a largo plazo del paciente e injerto [53] [57] [59] [60] [61] [62] [63]. Los análogos son los fármacos de elección tras el trasplante (ETV en pacientes naïve y TAF (mejor que TDF por menor daño renal y óseo) en naïve o pretratados, aunque no se dispone de datos de eficacia y seguridad en este subgrupo). Pese a los buenos resultados previos se ha dejado de emplear LAM (por el riesgo de resistencias) y tampoco IFN (por aumentar la incidencia de rechazo del órgano). Debemos monitorizar de forma estrecha el filtrado glomerular de estos pacientes, dado que todos antivirales precisan ajuste de dosis salvo el TAF [51] [59] (Tabla 4).
2. Receptores HBsAg negativo/antiHBc positivo (infección previa)
El riesgo de reactivación en estos pacientes es bajo, con tasas que han oscilado del 0 al 9 %, que en conjunto se sitúan en < 5 % [64] [65] [66] [67] [68]. El tiempo de aparición ha variado de las 8 semanas a los 15 años tras el TR y en un estudio, en todos los casos salvo en uno se produjo en receptores con títulos de antiHBs negativos o < 100 UI/ml [24]. De aquí, que se recomiende la administración rutinaria de dosis de vacuna de refuerzo en estos pacientes cuando los títulos de antiHBs desciendan por debajo de 100 UI/ml [42][53].
Hay dos estrategias aceptadas en seguimiento de estos receptores antiHBc(+): se recomienda realizar la determinación del ADN-VHB sérico y si es detectable indicar profilaxis antiviral (igual que si fuera HBsAg(+)), si por el contrario es ADN-VHB(-) se recomienda la monitorización de ALT, ADN-VHB y HBsAg cada 1-3 meses para detectar precozmente la reactivación en caso de presentarse. En aquellas situaciones en las que no sea posible este seguimiento exhaustivo, se recomienda profilaxis indefinida con ETV o TAF. [53] [64].
En aquellos pacientes en los que estemos realizando monitorización aislada, se recomienda iniciar profilaxis: en los períodos de intensificación de la inmunosupresión (p. ej., durante el tratamiento de un episodio de rechazo) [44] y cuando empleemos fármacos asociados con un alto riesgo de reactivación del VHB (p. ej., medicamentos que eliminan las células B CD20+, como rituximab, u otros inmunosupresores de potencia similar, como belatacept o alemtuzumab) [42].
3. Donantes antiHBc positivo
El uso de donantes antiHBc(+) se asocian a baja probabilidad de contagio del VHB, motivo por el cual se consideran válidos para el TR. Este riesgo es prácticamente inexistente en aquellos receptores inmunizados previamente [64] [66] y además la vacunación previa al TR con la obtención de títulos de antiHBs > 10 UI/ml también ha demostrado ser protectora [67]. Por tanto, es preferible emplear estos órganos en este tipos de receptores.
Una revisión sistemática de 9 estudios que incluyó 1385 pacientes mostró que 45 (3,24 %) desarrollaron algún marcador del VHB tras el TR y sólo 4 (0,28 %) fueron HBsAg (+) [69]. Por ello, no parece justificada la profilaxis sistemática en estos pacientes, aunque sí la monitorización de ALT, ADN-VHB y HBsAg cada 3 meses en los receptores no inmunes frente al VHB [42][64]. En este sentido, la monitorización de los títulos de antiHBs y la administración de dosis de vacuna de refuerzo cuando los títulos descienden parece una práctica recomendable [54].
4. Donantes HBsAg positivo
En nuestro medio y en los países occidentales en general no se acepta el uso de donantes HBsAg(+), si bien hay evidencia de buenos resultados de supervivencia del paciente y del injerto con el uso de donantes HBsAg(+), tanto en receptores HBsAg(+) como en receptores HBsAg(-) con o sin antiHBs, con diferentes estrategias de vacunación y profilaxis antiviral [66] [67] [70] [71] [72] [73] [74]. Esto hace que su utilización sea una práctica asumible en los países con alta prevalencia de HBsAg(+), siempre de forma individualizada valorando el riesgo-beneficio mediante: la evaluación del riesgo infectivo del donante, la asignación óptima a los receptores apropiados, la elección de regímenes inmunosupresores apropiados, la optimización de la terapia profiláctica y la monitorización estrecha tras el trasplante [66].
Vacunación frente al VHB en el entorno del trasplante renal
Desde las consultas de Enfermedad Renal Crónica Avanzada, debemos remitir a todos los pacientes no inmunizados (título de antiHBs < 10 UI/ml) para actualización del calendario vacunal frente al VHB. Pese a ello las tasas de respuesta son subóptimas (40-60 %) en comparación con la población general (>95 %). Debemos recordar además, que durante el tiempo que el paciente se encuentre en diálisis los títulos obtenidos son bajos y van disminuyendo, por lo que se recomienda su determinación periódica y administrar dosis de recuerdo en aquellos pacientes que lo precisen [75] [76]. La pauta recomendada en pacientes en diálisis es la administración de 4 dosis dobles (40 µg) por vía intramuscular a los 0, 1, 2 y 6 meses, que puede repetirse si no se obtiene respuesta [36][1]. En no respondedores pueden utilizarse la vía intradérmica o vacunas con mayor inmunogenicidad potenciada por el uso simultáneo de adyuvantes [77] [78] [79] [80].
Debido al efecto de los agentes inmunosupresores, tras el trasplante los pacientes también presentan una pobre respuesta a la vacunación, por dicho motivo se recomienda esperar a bajar la potencia inmunosupresora para vacunar (a partir de los dos meses, según la mayoría de los estudios disponibles). De igual forma, los títulos antiHsAg descienden rápidamente por lo que se recomienda monitorizarlos cada 6-12 meses y administrar dosis de recuerdo cuando caen < 10 UI/ml [42]. A tal respecto, Valeria Moal et al [79] evidenciaron que la pérdida del título protector fue significativamente superior en aquellos trasplantados con un título en el momento del trasplante de antiHBs < 100 UI/ml.
Recomendaciones
- La serología del VHB (HBsAg, anti-HBc, anti-HBs) debe evaluarse en todos los pacientes con enfermedad renal crónica avanzada, vacunando a aquellos pacientes que no se encuentren inmunizados. Esta estrategia es más efectiva realizarla previa a su entrada en diálisis, ya que los títulos adquiridos a posteriori son menores y de menor duración. La monitorización de anti-HBs se realizará cada 6-12 meses, utilizando dosis de refuerzo cuando estos caen por debajo del título protector (<10 UI/ml). La misma estrategia debe seguirse después de un trasplante de riñón.
- Las indicaciones de tratamiento antiviral previo al trasplante, frente al VHB son las mismas que para cualquier paciente (ADN-VHB > 2000 UI/ml y lesión hepática con inflamación y/o fibrosis al menos moderada (=A2 y/o =F2 de la clasificación METAVIR o similar). Los antivirales de elección son: entecavir [ETV] y tenofovir alafenamida [TAF] (ajustes de dosis según FG) (Tabla 4).
- Antes del TR debe evaluarse la gravedad de la enfermedad hepática mediante la realización de biopsia hepática, preferiblemente por vía transyugular para medir el gradiente de presión portal, que no será necesario realizar cuando haya signos evidentes de cirrosis e hipertensión portal. Los pacientes con cirrosis descompensada o con hipertensión portal clínicamente significativa (Gradiente de Presión Venoso Hepático (GPVH) > 10 mmHg) deben ser evaluados para doble trasplante hepático y renal. Los pacientes sin cirrosis o con cirrosis sin hipertensión portal clínicamente significativa pueden ser candidatos a trasplante renal aislado.
- Todos los pacientes trasplantados renales HBsAg (+) deben recibir tratamiento antiviral indefinido con ETV o TAF, que debe iniciarse en el mismo momento del trasplante o 4-6 semanas antes en el caso de un trasplante de donante vivo. En el contexto del TR, el entecavir es el fármaco de elección por su mejor perfil de seguridad renal. El tenofovir-TDF o el TAF son los fármacos a utilizar cuando hay resistencia a la lamivudina. Debe monitorizarse periódicamente la función renal y ajustar dosis a la misma.
- Los receptores renales HBsAg (-)/antiHBc (+) deben recibir profilaxis en función del ADN-VHB sérico. Si el ADN-VHB es positivo, deben recibir la misma profilaxis que los pacientes HBsAg (+) (entecavir o tenofovir). Si el ADN-VHB es indetectable, se recomienda seguimiento de ALT, ADN-VHB y HBsAg séricos cada 1-3 meses. De no poder asegurarse este seguimiento, resulta más seguro indicar profilaxis indefinida con lamivudina o preferiblemente en la actualidad con entecavir o tenofovir.
- Los receptores de injerto renal de donante antiHBc (+) presentan muy bajo riesgo de infección por VHB tras el TR y no precisan profilaxis antiviral de forma sistemática. Si es posible, es preferible su utilización en receptores HBsAg (+) o antiHBc (+) o en receptores inmunizados. Se recomienda vacunación repetida para obtener títulos de antiHBs protectores (> 10 UI/ml). En los receptores no inmunes debe realizarse seguimiento de ALT, ADN-VHB y HBsAg séricos cada 3 meses.
- Con carácter general en nuestro medio, los injertos de donantes HBsAg (+) no deben ser utilizados para el trasplante renal, salvo en situaciones muy especiales o de urgencia. En estos casos debe solicitarse consentimiento informado al paciente y realizar profilaxis antiviral, que habría de ser similar a la del receptor HBsAg (+).
Hepatitis E
El virus de la hepatitis E (VHE), descrito por primera vez en 1983, es un virus ARN monocatenario pequeño (27-34 nm, no envuelto) de la familia Herpeviridae (gens Orthohepevirus A). Existen al menos cuatro genotipos distintos: el 1 y el 2 solo se han encontrado en el ser humano, y se trasmiten a través de aguas contaminadas por restos fecales infectados. El 3 y el 4 circulan en varios animales (entre ellos los cerdos, jabalíes y ciervos) sin causarles enfermedad, e infectan ocasionalmente al ser humano (zoonosis), consumiendo productos poco cocinados de estos animales.
La hepatitis E afecta a todas las zonas del mundo, siendo la forma más prevalente de hepatitis actualmente a nivel mundial. Fundamentalmente afecta a países con escasos recursos y precarios suministros de agua e higiene, donde se calcula hay cada año unos 20 millones de casos de infección por el VHE, que producen 3,3 millones de casos agudos y 56 600 defunciones. En estas zonas la mayoría de los casos son causados por virus del genotipo 1 y, con mucha menor frecuencia, del genotipo 2. En las zonas con mejor suministro de agua y saneamiento la hepatitis E es infrecuente y solo hay casos esporádicos, la mayoría causados por el genotipo 3, aunque cada vez se describen más casos, siendo una entidad emergente en países desarrollados [81] [82].
En zonas endémicas la infección suele ser asintomática, sobre todo en niños, y cuando es sintomática cursa como una hepatitis aguda autolimitada. Tiene una baja mortalidad (0,2-0,3 %), pero en embarazadas el genotipo 1 puede originar un fallo hepático fulminante con tasas de mortalidad entre el 20-30 %, y en pacientes con hepatopatías crónicas puede desencadenar una descompensación hepática grave con mortalidad del 70 % [81] [82] [83] [84].
El diagnóstico se basa en la detección de anticuerpos anti-VHE IgM específicos, si bien en pacientes inmunodeprimidos la sensibilidad de esta técnica puede descender hasta a un 75 %. Por tanto, para el diagnóstico de confirmación en pacientes trasplantados, es necesaria la detección mediante PCR del ARN del virus en la sangre o heces [82] [83].
En pacientes inmunodeprimidos, sobre todo en receptores de trasplantes y también en pacientes hematológicos con quimioterapia y VIH, con frecuencia la infección por VHE puede causar enfermedad hepática crónica y cirrosis (casi todos los casos por genotipo 3) [86]. Además de los métodos de trasmisión convencionales ya referidos, en los pacientes trasplantados existe la posibilidad de trasmisión por hemoderivados y por el propio injerto (documentado en trasplante hepático y recientemente se ha publicado el primer caso de trasmisión por un injerto renal).
La prevalencia de la infección por VHE en los trasplantados renales es difícil de determinar como sucede en la población general, y varía según las series publicadas entre el 2,3 hasta 43 % en función de la población estudiada y la diferente sensibilidad de los métodos serológicos empleados.
En España la prevalencia de pacientes VHE-IgG positivos se calcula del 2,1 % (13 % en el suroeste de Francia, 10,2 % en Italia). La incidencia confirmada mediante la detección de ARN-VHE oscila entre el 1 y 3,2 %. Sigue siendo una gran desconocida a pesar de su creciente prevalencia en los pacientes con un trasplante de órgano solido. En USA aun no hay guías respecto a esta infección en trasplante de órganos sólidos. Recientemente las guías de la Sociedad de Trasplante Británicas si recomiendan el screening de VHE cuando hay elevación de enzimas hepáticas [90].
Las manifestaciones extrahepáticas de la infección por VHE son fundamentalmente de índole neurológica (síndrome Guillain-Barré, amiotrofia y encefalitis), o renal (glomerulopatías mesangiocapilar o membranosa, y crioglobulinemia similar a las descritas por VHC). En menor medida se has descrito otras como la trombocitopenia grave, anemia aplásica, pancreatitis, miositis y tiroiditis [84] [85].
En un estudio retrospectivo multicéntrico europeo en trasplantados de órgano sólido, se detectaron 85 casos de infección por VHE, todos por el genotipo 3: el 34,1 % eliminó el virus espontáneamente pero un 65,9 % evolucionó a hepatitis crónica; un 9,4 % desarrolló cirrosis en un plazo llamativamente rápido de 2-3 años, lo que sugiere que el VHE puede ser más agresivo que otros virus hepatotropos. Este riesgo de peor evolución se asocia con la intensidad de la inmunosupresión recibida. Solo un 32 % de los pacientes mostraron síntomas que en la mayoría de casos era un cuadro asteniforme muy inespecífico y una mínima elevación de transaminasas, por lo que una alta sospecha clínica es fundamental para no pasar por alto esta entidad, una vez descartados otras causas más comunes de hepatolisis en paciente inmunodeprimidos [86].
Un estudio realizado en 255 pacientes de 30 centros Europeos ha demostrado la alta eficacia de la rivabirina en conseguir una respuesta virológica completa (81,2 % tras 3 meses de tratamiento y 90 % en los casos en que fue necesario un segundo periodo de tratamiento). La dosis media fue de 600 mg/dia y la duración media de 3 meses con un rango muy amplio que alcanzo ente los 0,25 y 18 meses en algunos casos. El tratamiento debe mantenerse hasta que el ARN-VHE sea indetectable tanto en plasma como en heces. Paralelamente se debe reducir la inmunosupresión (sobre todo anticalcineurínicos y mTOR) siempre que sea posible [87]. Curiosamente, en casos con curación espontanea o farmacológica del VHE no se ha descrito hasta la fecha ninguna reactivación en un siguiente retrasplante. En caso de documentarse la infección crónica en pacientes en diálisis o con ERC avanzada en lista de espera para TR, el tratamiento con IFN (no la ribavirina, por el alto riesgo de anemia hemolítica en pacientes con aclaramiento de creatinina reducido) suele ser efectivo [83] [87]. Algunos estudios con resultados aún muy preliminares demuestran potencial efectividad del sofosbuvir. El escaso número de pacientes que hasta la fecha necesitan tratamiento antiviral hace poco atractivo a la industria farmacéutica desarrollar ensayos clínicos específicos con nuevos antivirales o con diferentes fármacos que han demostrado capacidad de inhibir replicación VHE in vitro (azitromicina, ivermectina, gemcitabina, zinc). Otra opción de futuro podrían ser terapias con activación de linfocitos T especificos [83].
La adopción de medidas higiénicas adecuadas es vital en su prevención. En 2011 se ha usado en China con éxito hasta la fecha la única vacuna (Helicolin) disponible. Aunque es efectiva y segura para genotipos 1 y 4, hasta la fecha la OMS aún no ha aprobado su uso de manera generalizada basada en su costo efectividad y no disponer de datos suficientes sobre su efectividad en genotipo 3. La WHO promulga la necesidad de estudios más concluyentes en población vulnerable, inmunodeprimidos (en los que lógicamente seria esperable menor efectividad) y que incluya serotipos 3 y 4 [83].
Otras infecciones
Las infecciones virales del grupo herpes (citomegalovirus, herpes simple, herpes zoster y Epstein-Barr virus) suelen cursar con frecuencia con afectación hepática. En la mayoría de casos es leve y solo se manifiesta con elevación de transaminasas en el contexto del cuadro sistémico ocasionado (fiebre, malestar general y la diferente semiología específica de cada virus). Cuando la diseminación viral es generalizada, especialmente en primoinfecciones con afectación visceral severa y en pacientes muy inmunodeprimidos, se han descrito incluso casos de hepatitis fulminante.
Especialmente graves son los excepcionales casos de hepatitis aguda por virus herpes simple [81], que se instauran en el postrasplante inmediato en el contexto de fiebre, estomatitis y dolor abdominal, que en un elevado porcentaje cursan con bacteriemias concomitantes, hemorragia gastrointestinal, coagulación intravascular diseminada y sepsis, con una mortalidad del 67 %. Una alta sospecha clínica en fundamental para reducir esta elevada mortalidad. Ante todo paciente trasplantado en este periodo con fiebre, dolor abdominal y elevación progresiva de transaminasas se debe iniciar cuanto antes terapia empírica con aciclovir, incluso en ausencia de manifestaciones mucocutáneas, mientras se hace el diagnostico etiológico especifico con técnica de PCR [89] [90] [91] [92].
La infección por adenovirus suele cursar con fiebre, diarrea y en ocasiones hepatitis aguda que suele ser leve. La infección diseminada por micobacterias también es una causa conocida de afectación hepática. La prevalencia de tuberculosis en trasplantados renales en España se estima en torno al 0,7 %. Tanto la afectación extrapulmonar (12 % casos) como la diseminada (25 %) ocurren con más frecuencia que en la población general [91]. La afectación gastrointestinal preferentemente afecta al área ileocecal y se presenta fundamentalmente como fiebre, dolor abdominal, hemorragia digestiva, peritonitis, lesiones ulceradas, etc. La afectación aislada de otras partes del aparato digestivo como el páncreas y el hígado, son poco frecuentes, y aparecen generalmente, en el contexto de una tuberculosis diseminada. Se han descrito casos de abscesos hepáticos tras infección diseminada por mycobacterium kansasii. La afectación hepática por fármacos tuberculostáticos también es frecuente como se aborda en este mismo capítulo.
El diagnostico etiológico específico y su tratamiento de todas estas entidades se aborda más detenidamente en el capítulo de complicaciones infecciosas del trasplantado renal.
DAÑO HEPÁTICO POR FÁRMACOS HEPATOTÓXICOS
La lista de fármacos o productos de herboristería potencialmente causantes de daño hepático inducidos por fármacos (DHF, el término anglosajón es DILI: Drug-Induced Liver Injury) es cada vez mayor. Nos referiremos a los más frecuentemente usados en el TR, pudiendo consultarse una relación detallada en http://livertox.nih.gov [93].
Clasificación
Aunque se pueda clasificar el DHF en función de su mecanismo (dosis-dependiente o idiosincrático) o del tipo de daño histológico que produzca (necrosis, colostasis, esteatosis, fibrosis, granulomas, obstrucción sinusoidal) habitualmente se hará referencia al tipo de presentación clínica.
Así, el DHF, agudo o crónico, podrá aparecer como a) hepatitis con elevación desproporcionada de aminotransferasas comparada con la fosfatasa alcalina (FA) +/- hiperbilirrubinemia, b) como colostasis con elevación desproporcionada de FA comparada con las aminotransferasas +/- hiperbilirrubinemia o c) con un patrón mixto.
Fármacos Inmunosupresores.
Habitualmente es dosis dependiente.
Tacrolimus: elevaciones leves o moderadas asintomáticas y autolimitadas de aminotransferasas en 5-10 % pacientes que responden a disminución de dosis, bien por hepatotoxicidad directa o por interacción con otras drogas con las que comparta eliminación vía citocromo P450. En raras ocasiones se asocia a hepatitis colostásica.
Ciclosporina: hiperbilirrubinemia con escasa movilización de aminotransferasas. Se describió al inicio de su uso y en probable relación con las altas dosis usadas. Como el tacrolimus suelen ser asintomáticas y autolimitadas o que responden a reducción de dosis. Hay raros casos de hepatitis colostásica que curan al suspenderla y en la mayoría de los pacientes la conversión a tacrolimus es bien tolerada.
imTOR (everolimus/sirolimus): aunque hasta en un 25 % de los casos pueden producir alteraciones de la bioquímica hepática, también suelen ser leves, asintomáticas y autolimitadas o que responden a reducción de dosis. Solo en 1-2 % la elevación quintuplica las valores normales. Aunque el everolimus puede reactivar la hepatitis B en pacientes bajo tratamiento oncológico, no se han descrito casos de positivización del HbsAg en pacientes con antiHBc o antiHBs preexistentes. No obstante es recomendable en pacientes HBsAg + o Ac antiHBC + una monitorización de DNA VHB.
Micofenolato: frecuencia escasa; de comportamiento y manejo similar al tacrolimus; de aparición en 1º mes de su uso.
Anticuerpos: aparentemente no hepatoxicidad con los monoclonales (OKT3, daclizumab o basiliximab) o policlonales (ATG) a dosis y frecuencia usadas en el trasplante renal.
Rituximab: más que daño directo, muy raro, puede ser causa de reactivación de hepatitis B.
Eculizumab: no datos de hepatoxicidad en estudios preclínicos, aunque hay un artículo donde se describe daño leve y generalmente autolimitado en 5 de 11 niños con Síndrome Hemolítico Urémico atípico [94].
Azatioprina: tres tipos de afectación. La primera similar a la de otros inmunosupresores, leve, transitoria y limitada con reducción o suspensión de dosis. Una segunda, idiosincrática, más infrecuente (1:1.000 casos), consiste en daño agudo colostásico similar al producido por estrógenos o anabolizantes de aparición en el primer año de su uso y que no siempre se resuelve con su suspensión. Por último se ha descrito daño crónico con hipertensión portal e hiperplasia nodular regenerativa, que puede presentarse de forma abrupta como enfermedad veno-oclusiva hepática (o síndrome obstructivo sinusoidal) y que aunque lo habitual es la reversibilidad tras la suspensión de la droga no siempre es así y puede conducir a fallo hepático. Se ha implicado su uso crónico en aparición de hepatocarcinoma.
Fármacos Cardiovasculares
IECA: raramente (<2 %) elevaciones menores autolimitadas de aminotransferasas en los tres primeros meses de su uso o daño agudo colostásico con mismo perfil temporal. No suelen acompañarse de fiebre o eosinofilia. Excepcionalmente el lisinopril, a diferencia de otros IECA, se asociada a daño hepatocelular irreversible de presentación tras varios años de su uso. Es preferible evitar su uso como grupo si con uno de ellos hubo daño hepático (alta probabilidad de recurrencia).
ARA II: como los IECA en general.
Otros antihipertensivos: Betabloqueantes: muy poco frecuente, patrón hepatocelular leve, muy raramente fallo hepático (casos publicados con labetalol y acebutolol). La hepatotoxicidad de los calcioantagonistas también es poco frecuente, se ha relacionado sobre todo con verapamilo, pero pueden verse reacciones cruzadas con otros calcioantagonistas.
Amiodarona: hasta 15-50 % casos con varias formas de presentación: elevación habitualmente reversible de forma muy lenta de ALT o más raramente (1 %) daño similar a hepatopatía alcohólica aguda o síndrome de Reye. Está indicado control hepático cada 6 meses y suspenderla si se doblan las cifras de transaminasas. Con su uso parenteral incluso daño hepático agudo en el primer día de su uso.
Hipolipemiantes: todas las estatinas se han descrito como causa de elevaciones leves o moderadas asintomáticas de transaminasas, reversibles tras ajuste de dosis o suspensión. El efecto del ezetimibe es difícil de cuantificar dado que habitualmente se usa en asociación con estatinas, en ensayos clínicos no se asoció a mayor frecuencia de hepatotoxicidad comparado con placebo.
Antiagregantes: el AAS se asocia con Síndrome de Reye en niños, en adultos daño solo con dosis altas prolongadas. El clopidogrel se asocia a daño hepático en 1-3 % casos, de media a las semanas de uso, habitualmente con patrón hepatocelular leve reversible tras su suspensión.
Anticoagulantes: se describen elevaciones de transaminasas transitorias solo en 2-5 % de pacientes, sin diferencias entre anticoagulantes orales clásicos y los nuevos antiXa, salvo el rivaroxaban (más probable este último).
Diuréticos: no asociación con los de asa ni tiazidas; muy baja tasa de leve y reversible afectación hepática con eplerenona o espironolactona (posibilidad de reacción cruzada entre ambos)
Fármacos Antiinfecciosos
Amoxicilina-clavulánico: el más frecuentemente asociado con hepatotoxicidad (1 en 2500 prescripciones) Presenta período de latencia desde fin de su uso hasta la aparición de la misma de hasta 8 semanas, lo que puede dificultar su diagnóstico. Típico patrón colostásico, pero puede darse hepatolisis o patrón mixto de lenta resolución, de mecanismo idiosincrático, pero no siempre asociado a otras manifestaciones de hipersensibilidad. El causante es el clavulánico: debe evitarse su reintroducción. No hay inconveniente en el uso aislado de la amoxicilina.
Cefalosporinas: raras. La ceftriaxona parenteral se ha descrito como causa de seudolitiasis biliar por barro/cálculos de ceftriaxona, más frecuente con altas dosis en niños deshidratados, resuelta tras su cese.
Quinolonas: raras (1:100.000 exposiciones), efecto clase de mecanismo idiosincrático de hipersensibilidad pero con patrón hepatocelular severo de aparición entre 1ª y 4ª semana de su uso.
Macrólidos: efecto clase, frecuencia entre 1-5 %, más con patrón de elevación de transminasas reversible. No se ha descrito con la fidaxomicina por su escasa absorción intestinal.
Trimetoprim-sulfametoxazol: por hipersensibilidad, efectos sistémicos. Suele aparecer en primeros días o semanas con patrón colostásico o mixto, incluso con formación de granulomas. Excepcionalmente fallo hepático fulminante.
Fosfomicina: tasa baja de elevación transitoria y autolimitada de transaminasas.
Nitrofurantoina: la forma aguda con ciclos de 1 o 2 semanas de tratamiento es rara y pocas veces fatal. La forma crónica asociada a su uso prolongado como profilaxis de infecciones urinarias es más frecuente (1:1500 exposiciones), sobre todo en mujeres, clínica y analíticamente similar a hepatitis autoinmune, no siempre asociada a fiebre o eosinofilia y que puede llevar incluso a cirrosis si no se suspende su uso.
Ganciclovir (iv), valganciclovir: poca evidencia de asociación con daño hepático; resulta difícil discernir si es por su uso o por afectación hepática del CMV.
Antituberculosos: potencialmente hepatotóxicos, sobre todo su combinación, con formas muy diversas de daño que incluyen incluso el fallo hepático fulminante y muerte. Obligada consulta con el Servicio de Infecciosos para su manejo.
Antifúngicos: hasta en 20 % de casos, suele ser reversible (ketoconazol, fluconazol, anfotericina B, voriconazol).
Otros Fármacos
Alopurinol: Su uso crónico se asocia en 2-6 % de hepatotoxicidad, habitualmente reversible incluso sin suspender su uso. También existe una forma aguda de mucho peor pronóstico y de base inmunoalérgica en el contexto de afectación sistémica. Anticonvulsivantes: sobre todo fenitoína, valproico, carbamazepina, lamotrigina, de mecanismo idiosincrático.
Antidiabéticos orales: la mayoría sin efectos secundarios hepáticos, incluyendo los recientemente incorporados inhibidores de SGLT-2 y análogos GLP-1 (en el 2000 se retiró la troglitazona por daño hepático agudo).
Bifosfonatos: muy raramente asociados a hepatotoxicidad y de forma leve, y aún más raro el daño hepático por uso de denosumab.
Omeprazol: frecuencia <1 %, elevación habitualmente reversible de transaminasas en el primer mes de su uso.
Inhidores de los check-point: antiPD-1 (pembrolizumab, nivolumab, cemiplimab), antiPD-L1 (durvalumab, atezolizumab, avelumab) y ac antiCTLA4 (ipilimumab). Poca experiencia aún de su uso en trasplante tras su reciente irrupción en el campo de la Oncología. En otras poblaciones se describen cuadros de hepatitis aguda autoinmune con daño hepatocelular hasta en un 10 %, precoces (entre 2º y 6º ciclo) y habitualmente autolimitadas (no siempre).
OTRAS HEPATOPATÍAS
Los trasplantados renales pueden presentar todo el amplio espectro de hepatopatías (Tabla 1) con manifestaciones variables, desde alteraciones ligeras de la bioquímica hepática hasta cirrosis [95] [96]. En el caso de las afecciones preexistentes, el riesgo de fallo hepático postrasplante dependerá sobre todo de la capacidad sintética pretrasplante, cuya reducción marcada puede condicionar vulnerabilidad ante agresiones tóxicas o infecciosas tras el mismo.
Enfermedad Poliquística Autosómica Dominante: no muestra empeoramiento de la función hepática o aumento de los quistes tras el trasplante, pero sí mayor posibilidad de sobreinfección de quistes, cuyo tratamiento habitual será el drenaje percutáneo, más raramente precisará fenestración y de forma excepcional hepatectomía parcial o incluso el trasplante hepático.
Enfermedad Poliquística Autosómica Recesiva: ocasionalmente la enfermedad de Caroli con colangitis de repetición puede llegar a requerir trasplante hepático.
Hemosiderosis. Debida a transfusiones o uso inadecuado de suplementos intravenosos, con ferritinas superiores a 800 ng/ml. La ferritina tiende a bajar tras el TR con un mínimo a los 6 meses y la hemosiderosis puede resolverse espontáneamente, pero generalmente la sobrecarga de hierro es difícil de eliminar si hay ferritina muy elevada. Puede causar fibrosis y fallo hepático progresivo. La terapia precoz con flebotomías periódicas, puede normalizar la ferritina y función hepática, pero si la fibrosis está establecida puede resultar inefectiva.
No se ha descrito mayor incidencia de hepatopatías en el trasplantado tales como autoimunes (incluyendo la cirrosis biliar primaria, que puede beneficiarse del tratamiento inmunosupresor), colangitis esclerosante primaria, hepatopatía alcohólica o enfermedades genéticas (hemocromatosis, enfermedad de Wilson o déficit de alfa1-antitripsina).
Especial mención merece la esteatohepatitis no alcohólica en sus diversos grados, entidad cada vez más frecuente, como el síndrome metabólico del que es expresión en el hígado. Puede preceder o desarrollarse tras el TR, en el que la obesidad, diabetes y dislipidemias son muy prevalentes. Su diagnóstico se basa en la presencia de alteraciones bioquímicas y de pruebas de imagen (ECO, TAC, RM). El tratamiento se dirige a los factores causales, dentro del manejo general del riesgo cardiovascular del trasplantado; puede beneficiarse de una reducción sensata de los inmunosupresores.
CUADROS ESPECIALES
Hepatitis colestásica fibrosante
Forma agresiva de hepatitis virales (VHC o VHB) en el paciente inmunodeprimido, aunque también se ha descrito en ausencia de estos virus. Se asocia a elevadas cargas virales; la frecuencia tal vez sea mayor en casos que adquieren la enfermedad peri o posTR. Consiste en un cuadro de colestasis grave y progresiva de evolución espontánea fatal en el curso de semanas o meses, con una histología característica (fibrosis severa, degeneración hepatocelular en balón). Ante la sospecha, debe confirmarse de forma inmediata mediante biopsia. El manejo consiste en reducción drástica de la inmunosupresión y tratamiento antiviral.
Síndrome obstructivo sinusoidal (o enfermedad veno-oclusiva hepática)
Proceso oclusivo no trombótico de las venas hepáticas centrales o sublobulares que causa necrosis centrolobular. Se ha descrito en tratados con AZA, y en sobredosificación de tacrolimus (con uso concomitante con valaciclovir o AZA) aunque la causalidad es dudosa. Posible papel de virus hepatotrópicos (asociación frecuente con CMV o hepatitis viral). Cuadro clínico: hepatomegalia, colostasis e hipertensión portal con ascitis. Mal pronóstico, con muerte de la mayoría de casos en pocos meses. Se ha obtenido mejoría en casos ocasionales con abandono de la AZA, anticoagulación o derivación porto-cava; trasplante hepático si falla lo anterior.
Hiperplasia nodular regenerativa
Afectación nodular difusa con ausencia de fibrosis. Algunos casos están asociados a peliosis hepatitis o enfermedad veno-oclusiva. En la población general se asocia neoplasias hematológicas, estados de hipercoagulabilidad, enfermedades autoinmunes y diversos tóxicos. En el TR se ha atribuido a AZA (algunos casos remitieron al retirarla) y a infecciones virales. Suele expresarse como hipertensión portal intrahepática con función hepática conservada. El diagnóstico requiere biopsia.
Peliosis hepática
Formación de dilataciones o lagos venosos hepáticos, con hallazgos característicos en pruebas de imagen y biopsia. También ha sido relacionado con la AZA. La peliosis hepática bacilar está causada por infección diseminada por Bartonella. Se presenta con cuadro de fiebre, síntomas abdominales, adenopatías, hepatomegalia, lesiones cutáneas y anemia. Diagnóstico histológico con demostración de los pequeños bacilos gram-negativos por tinciones especiales o microscopía electrónica, y por serología. Tratamiento muy prolongado con macrólidos o tetraciclinas.