Complicaciones cardiovasculares en el trasplante renal
Palabras clave
Trasplante renal, complicaciones cardiovasculares, factores de riesgo, ateromatosis, hipertrofia ventricular izquierda, enfermedad valvular, disfunción ventricular, hipertensión pulmonar, arritmia, prevención
Enlaces KDIGO
Insuficiencia cardíaca en la enfermedad renal crónica: Conclusiones de Conferencia de Controversia de KDIGO (Kidney Disease Improving Global Outcomes) KIDNEY INT 2019. TRADUCCIÓN AL ESPAÑOL EN NEFROLOGÍA AL DÍA.
Enfermedad Renal Crónica y Arritmias. Aspectos más destacados de la Conferencia de Controversias KDIGO. KIDNEY INT 2018. TRADUCCIÓN AL ESPAÑOL EN NEFROLOGÍA AL DÍA.
IMPORTANCIA Y MAGNITUD DEL PROBLEMA
Los pacientes con trasplante renal (TX) presentan una mayor mortalidad de origen cardiovascular (CV) que la población general de similar edad y sexo. Aproximadamente el 40% de los trasplantados ha sufrido algún evento CV a los 10 años de seguimiento [1] [2] [3]. La tasa anual de eventos CV mortales y no mortales oscila entre 3.5-5%, y esta incidencia es 50 veces más alta que en la población general [4]. La mortalidad con injerto funcionante es la principal causa de pérdida del injerto, y una de las causas principales es la CV. Además, esta supone un motivo muy frecuente (hasta un 30%) de hospitalización posTX [5]. La coexistencia de una ateromatosis acelerada y el desarrollo de alteraciones estructurales y funcionales cardiacas inherentes al TX pueden justificar esta elevada morbi-mortalidad en el marco del tratamiento inmunosupresor.
Mecanismos y factores de riesgo cardiovascular
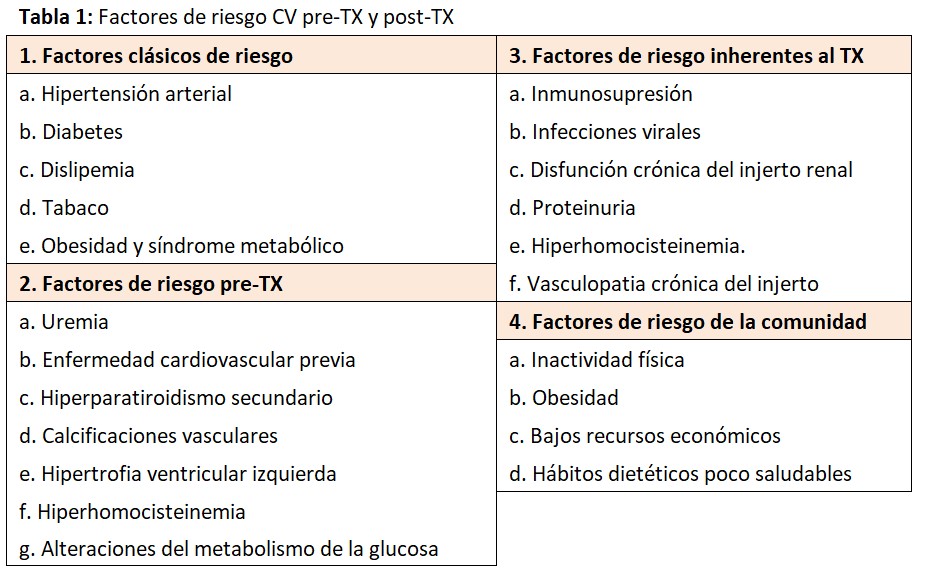
A pesar de que los factores de riesgo CV tradicionales son fácilmente identificados, diversos estudios han demostrado que el control de estos factores en trasplantados renales es pobre [5]. La (Tabla 1) muestra los factores de riesgo CV pre-TX y posTX. Los factores clásicos de riesgo CV no guardan una relación estrecha con los eventos cardiacos posTX.
Es posible que otros factores de riesgo no tradicionales (tiempo en diálisis, proteinuria posTX, hiperparatiroidismo, hiperhomocisteinemia, disfunción renal, etc.) más la presencia de factores de riesgo de la comunidad (hábito tabáquico, obesidad, inactividad física, pobreza, etc.) puedan contribuir al aumento de la morbi-mortalidad CV [6] [7] [8]. En esta línea, una deteriorada función del injerto renal o la persistencia de niveles elevados de PTH representan factores independientes de eventos cardiovasculares y muerte posTX [9] [10].
La inflamación crónica leve observada en receptores mayores en el contexto de inmunosenescencia y los cambios celulares (monocitos proinflamatorios) también se ha asociado a mayor riesgo de enfermedad cardiovascular [11].
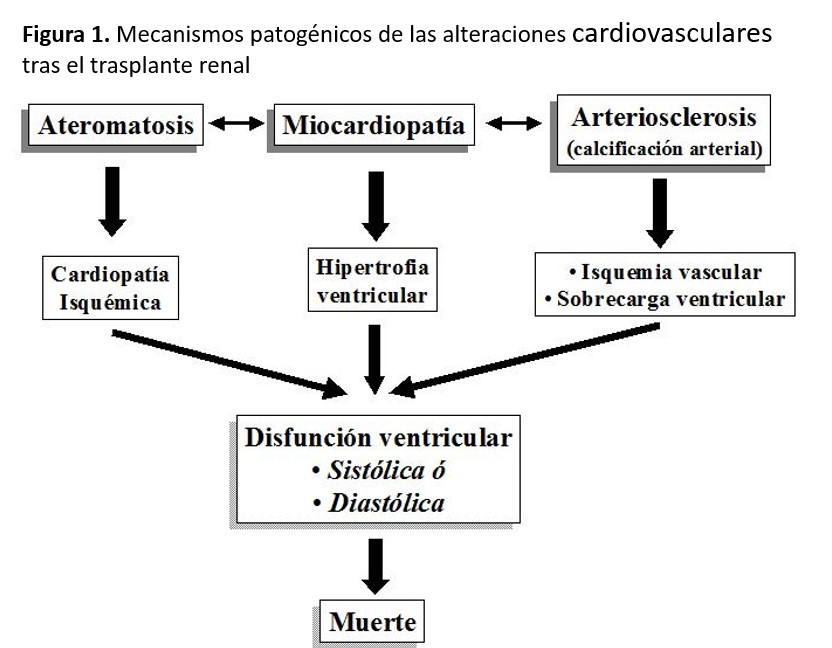
Patogénicamente, estos factores de riesgo confluyen en tres procesos que están interrelacionados: a) ateromatosis clínica e isquemia miocárdica; b) remodelación cardiaca anómala que genera hipertrofia ventricular izquierda (HVI) concéntrica o excéntrica; y 3) calcificaciones arteriales (calcificación de la capa media arterial). A esto hay que añadirle la cardiomiopatía urémica no isquémica que se asocia también a mayor riesgo de mortalidad. La traducción clínica puede ser disfunción ventricular, arritmias y muerte prematura (Figura 1). Asimismo, estos pacientes tienen también un mayor número de accidentes cerebrovasculares y de enfermedad vascular periférica que la población general [12] [13].
Hipertensión arterial
En un estudio retrospectivo [14] con 1.666 trasplantados renales, se observó que la prevalencia de HTA posTX era de un 80-90%. Durante el primer año del trasplante, sólo el 4% de los pacientes tenían una presión arterial (PA) normal sin uso de medicación. A pesar de la asociación de la HTA con el empeoramiento de la enfermedad CV, las cifras e PA aún son desconocidas, aunque se recomienda < 130/80 mmHg [15]. La mejor terapia antiHTA es desconocida, pero algunos expertos recomiendan calcioantagonistas dihidropiridínicos, o inhibidores de la enzima de conversión de la angiotensina (IECA) o antagonistas del receptor AT1 de la angiotensina II (ARA) cuando hay una proteinuria superior a 1g [14] [16] [17]. De hecho, si presentan proteinuria se recomienda comenzar con fármacos que bloquean el sistema renina-angiotensina (SRA): IECA o ARA2, siempre que no exista estenosis de la arteria del injerto renal. Estos fármacos, aislada o conjuntamente, disminuyen significativamente la proteinuria y la masa ventricular, lo cual puede optimizar el perfil CV y disminuir la mortalidad posTX como se ha reportado en estudios observacionales y controlados [18] [19]. Sin embargo, otros estudios observacionales no muestran diferencias en los eventos CV adversos entre pacientes recibiendo IECA/ARA2 frente a otros fármacos antihipertensivos [20]. En esta línea, un metaanálisis de 8 estudios randomizados no mostró reducción de la mortalidad en pacientes con TX recibiendo estos fármacos [21].
Cuando la situación clínica lo permita, reducir o suspender los esteroides y disminuir o eliminar los anticalcineurínicos puede mejorar las cifras de PA. No hay consenso sobre recomendar modificar la inmunosupresión, pero sí en optimizar los niveles de inhibidores de la calcineurina antes de intensificar la terapia antiHTA [22].
Ateromatosis
Ateromatosis subclínica
La ateromatosis subclínica, evaluada ecográficamente por un mayor engrosamiento íntima-media carotideo, es frecuente en el momento del trasplante y no revierte tras el TX normofuncionante. Esta lesión se asocia a alteraciones del metabolismo hidrocarbonado, concentraciones bajas de adiponectina plasmática y con la disfunción endotelial asociada a inflamación. De hecho, se ha observado una mayor expresión vascular de moléculas de adhesión como el VCAM-1 en los que presentan mayor grosor íntima-media carotídeo [23]. Esta alteración vascular se relaciona con una mayor mortalidad posTX, especialmente en aquellos pacientes que tras el primer año experimentan progresión de estas lesiones [24]. Asimismo, la determinación del índice tobillo-brazo (ITB) puede indicarnos también ateromatosis subclínica con enfermedad vascular periférica subyacente. Un ITB ≤ 0.9 o > 1.4 indican una enfermedad vascular periférica oclusiva o rigidez arterial, respectivamente. En este último caso, podría ser también útil la determinación del índice dedo-brazo [25][26][27]. Valores ≤ 0.7 confirman la rigidez arterial. Estas alteraciones también se asocian a mayor mortalidad posTX.
Ateromatosis clínica. Enfermedad isquémica cardiaca
La enfermedad isquémica cardiaca es muy prevalente tras el TX (10% a los 3 años posTX), lo que incrementa 2,7 veces el riesgo de muerte y de pérdida del injerto. Esta entidad es más frecuente en el primer año posTX, especialmente en diabéticos [28] [29]. Esto supone un riesgo seis veces mayor que en la población general de la misma edad y sexo. La cardiopatía isquémica preTX, la edad del receptor, la disfunción del injerto, el síndrome metabólico y la diabetes posTX (DMPT) son factores de riesgo de cardiopatía isquémica posTX [30] [31]. Adicionalmente, los fármacos anticalcineurínicos estimulan el SRA y la producción de endotelina-1, sustancias involucradas en el desarrollo de daño endotelial, ateromatosis y enfermedad isquémica cardíaca. La persistencia de troponina cardiaca elevada postrasplante, especialmente en aquellos con disfunción precoz del injerto, se asocia a mayor mortalidad. Por el contrario, su normalización se asocia a una reducción del riesgo [32]. Con todo, la evaluación sistemática de la enfermedad isquémica cardiaca preTX en pacientes asintomáticos no está justificada [33].
Accidente cerebrovascular
Los accidentes cerebrovasculares (ACV) son más frecuentes en pacientes con TX que en la población general y pueden explicar hasta el 40% de las muertes cardiovasculares posTX. El ACV isquémico es más frecuente que el hemorrágico [34], pero este último se asocia a mayor mortalidad. Los factores de riesgo asociados a ACV posTX incluyen una mayor edad, diabetes, tabaco, fibrilación auricular (FA) y el uso de esteroides. Algunas pruebas diagnósticas como la ecografía carotídea o la ecocardiografía no predicen la aparición de ACV posTX.
Enfermedad vascular periférica
Se estima que el 15% de los TX padecen enfermedad vascular periférica (EVP) [35]. La tasa de EVP posTX es elevada especialmente en los pacientes añosos y diabéticos. Su detección temprana, tanto antes como después del TX, y la reducción de factores de riesgo modificables pueden mejorar en gran medida los resultados del trasplante [27].
Se ha sugerido que el TX puede retrasar la progresión de la EVP en pacientes urémicos. Igualmente, factores de riesgo de ateromatosis y arteriosclerosis preexistentes pueden verse agravados por nuevos trastornos cardiometabólicos relacionados con la inmunosupresión, siendo fuertes predictores de EVP. También, la hiperhomocisteinemia se ha considerado un factor de riesgo aterogénico no tradicional [36]. Finalmente, se ha involucrado a la deficiencia de Klotho en la patogénesis de las lesiones vasculares ateroscleróticas [27].
Hipertrofia ventricular izquierda (HVI)
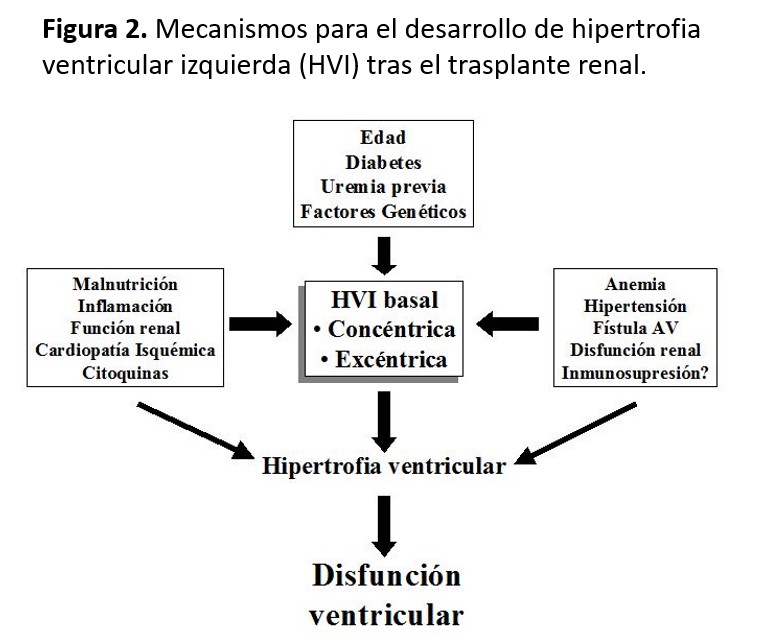
La HVI es frecuente tras el TX (30-60%) y contribuye a la elevada mortalidad CV. Se debe a un fenómeno de remodelación cardiaca anómala ante sobrecargas de presión y/o volumen inducidas por factores de riesgo preTX y posTX (Figura 2). La expresión clínica inicial corresponde a dos patrones geométricos de crecimiento cardiaco: la HVI concéntrica (por sobrecarga de presión), cuya presentación es una disfunción diastólica, y la HVI excéntrica (por sobrecarga de volumen) que suele debutar como disfunción sistólica [37]. La HVI limita la capacidad vasodilatadora de las coronarias, compromete la perfusión endocárdica y reduce la densidad de capilares miocárdicos. Estos patrones pueden normalizarse, pero en muchas ocasiones la HVI persiste tras el primer año de TX normofuncionante, especialmente en aquellos pacientes que no reciben IECA-ARA II, tienen disfunción del injerto renal o mayor masa miocárdica en la etapa prediálisis [38]. A largo plazo, también se observa una mayor regresión de la masa ventricular izquierda independiente de la estrategia terapéutica adoptada [39]. La HVI posTX predispone a isquemia miocárdica y a alteraciones de la repolarización miocárdica, lo que condiciona un alto riesgo de arritmias y muerte súbita, especialmente si existe disfunción del injerto renal [40]. El bloqueo del SRA o el empleo de fármacos anti-mTOR puede contribuir a la regresión de la masa ventricular posTX [41] [42] [43].
Enfermedad valvular cardiaca
La enfermedad valvular cardiaca es frecuente en pacientes urémicos y aumenta su prevalencia a medida que desciende el filtrado glomerular, especialmente la aparición de calcificación valvular. Muchos de estos pacientes son incluidos en programa de TX, pero no se sabe si el TX per se revierte la calcificación valvular. Un 20-30% de los pacientes con TX tienen calcificaciones valvulares cardiacas [44]. Asimismo, es desconocido si la progresión de las calcificaciones valvulares se enlentece con el TX comparado con la situación preTX. En cualquier caso, muchos pacientes necesitarán recambio valvular por técnicas quirúrgicas o transvasculares. La sustitución de la válvula aórtica es la más frecuente (66%) seguida de la mitral (25%). No obstante, la sustitución de la válvula mitral está asociada a mayor mortalidad [45].
Disfunción ventricular
La disfunción ventricular izquierda (DVI) es una causa frecuente de morbimortalidad en los pacientes en diálisis, incluidos aquellos en lista de espera para TX [46]. Tras el TX, la DVI es la responsable del 16% de las hospitalizaciones y representa el 78% de todos los eventos CV mayores que se producen en estos pacientes. Concretamente, la incidencia acumulativa de DVI de novo a los 12 y 36 meses posTX es de 10% y 18%, respectivamente [47] [48]. Con todo, tras el TX se observa en muchas ocasiones una mejoría sustancial de la función ventricular en relación con la reversibilidad del proceso urémico. Hay poca información derivada de estudios controlados sobre el tratamiento más idóneo de la DVI en pacientes con TX. Estudios controlados, han sugerido un efecto beneficioso tras la sustitución de un inhibidor de la calcineurina por un anti-mTOR [49] [50]. Aunque estudios observacionales han mostrado una reducción del riesgo de muerte posTX con el uso de IECA/ARA II [51] [52], un metaanálisis de 8 ensayos clínicos no demostró una reducción de la mortalidad de cualquier causa con el empleo de estos fármacos [53].
Hipertensión pulmonar
La hipertensión pulmonar (HP) es frecuente en pacientes en diálisis y representa un factor pronóstico pre y posTX. Cifras superiores a 50 mmHg de presión sistólica en la arteria pulmonar confieren un riesgo de 3,75 veces más alto de muerte posTX, respeto a aquellos con cifras inferiores [54]. El tratamiento con fármacos calcioantagonistas, el manejo de la volemia y de los estados hiperdinámicos o el tratamiento de los trastornos respiratorios pueden contribuir a mejorar las consecuencias de esta entidad.
Arritmias
Los pacientes renales tienen una elevada incidencia de arritmias y muerte súbita con respecto a la población general y la fibrilación auricular (FA) es la causa más frecuente de estas arritmias [55]. Un 6% de pacientes en diálisis se diagnostican de FA. Tras el TX, la incidencia de FA es de 3.6% y 7.3% a los 12 y 36 meses, y esto incrementa el riesgo de muerte y de pérdida de los injertos [56]. Los factores de riesgo de arritmias posTX son la edad, el género masculino, raza blanca, HTA, la cardiopatía isquémica, la DMPT y la disfunción del injerto. No hay evidencia sobre el uso de la ablación [57], y la anticoagulación oral está indicada en el periodo perioperatorio para prevenir los fenómenos trombóticos, vigilando las complicaciones hemorrágicas. De los nuevos anticoagulantes orales, apixaban y rivaroxaban son los que tienen mínimas interacciones con los inhibidores de la calcineurina. Todos tienen un mínimo porcentaje de eliminación renal, por ello, aunque no son necesarios ajustes de la dosis, se debe controlar con más frecuencia la función renal (1-3 meses después del inicio y cada 6-12 meses posteriormente) [58]. Las arritmias ventriculares posTX se asocian a muerte súbita (15% y el género masculino, la duración de la diálisis y la presencia de calcificaciones coronarias son factores de riesgo de estas.
Calcificaciones arteriales y arteriosclerosis
La calcificación de la capa media de las arterias (arteriosclerosis) es un fenómeno frecuente en pacientes que reciben un TX (25%) y puede generar isquemia en diferentes territorios vasculares y sobrecarga de presión ventricular. La detección de un ITB > 1.4 o un índice dedo-brazo ≤ 0.7 hacen sospechar la rigidez arterial por calcificación de la pared arterial. Este fenómeno no revierte tras el TX y puede coexistir con la ateromatosis (calcificaciones vasculares intimales), contribuyendo a la morbimortalidad CV posTX [59]. De hecho, en pacientes con TX se ha observado una mayor rigidez arterial (determinada por la velocidad de onda de pulso o la presión de pulso) [60], alteración que puede incrementar el riesgo CV en esta población [61]. Los factores clásicos de riesgo vascular y los factores inherentes a la uremia, como un mayor tiempo en diálisis, las alteraciones del metabolismo mineral (hiperfosforemia, deficiencia de vitamina D, hipomagnesemia, niveles elevados de esclerostina, fetuina, FGF-23-klotho, etc.) o la resistencia a la insulina, pueden contribuir a la transformación de la célula muscular lisa vascular en una célula formadora de hueso (osteoblástica-like). Sin embargo, estos parámetros muestran una pobre capacidad predictiva para la aparición de calcificaciones vasculares en relación con la capacidad discriminante de la edad [62] [63] [64].
Existen múltiples evidencias de que la inflamación precede la aparición de la arteriosclerosis y de la ateromatosis con mayor expresión de citoquinas proinflamatorias, moléculas de adhesión (ICAM-1 y VCAM-1) y factores de transcripción (NFkB). Una mayor expresión de VCAM-1 se ha asociado a una disminución de la supervivencia posTX [24]. Los fármacos anticalcineurínicos (CsA y Tac) generan disfunción endotelial, pero no está demostrado que participen directamente en la aparición de calcificaciones vasculares.
FACTORES DE RIESGO. PAPEL DE LA INMUNOSUPRESIÓN
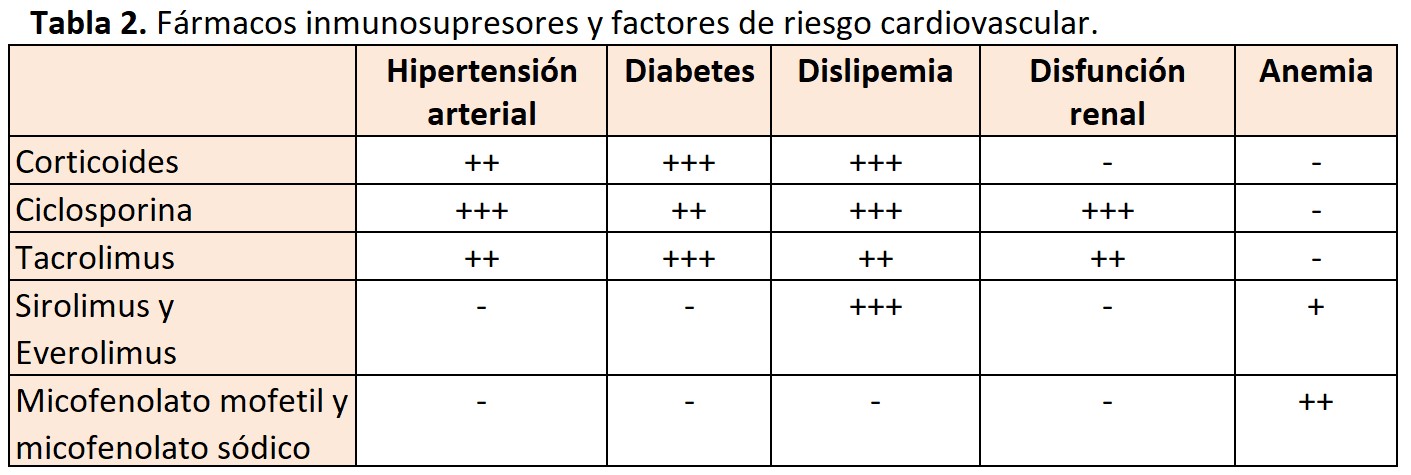
Aunque se han identificado factores previos o inherentes al propio TX, la diabetes, la HTA, la dislipemia, la obesidad y el hábito tabáquico son los factores que más contribuyen al riesgo CV. Adicionalmente, la disfunción del injerto renal, la proteinuria y la anemia, condiciones frecuentes en estos pacientes, también incrementan dicho riesgo. Los fármacos inmunosupresores al contribuir a la aparición de HTA, hiperlipemia y trastornos del metabolismo de la glucosa, empeoran el perfil CV de estos enfermos [65] [66] (Tabla 2).
Hipertensión arterial
La HTA es muy prevalente tras el TX (60-90%) y contribuye de forma independiente a la pérdida del injerto y a la morbi-mortalidad CV [67]. Aunque su patogenia es multifactorial, los fármacos anticalcineurínicos Ciclosporina (CsA) y tacrolimus (Tac), y los esteroides juegan un papel relevante en su desarrollo [68]. En la (Tabla 3) se enumeran las causas más frecuentes de esta entidad.
La CsA, y en menor grado el Tac, estimulan el SRA a la vez que alteran la liberación de óxido nítrico y la síntesis de prostaglandinas, incrementando las resistencias periféricas. La CsA es más hipertensinógena que el Tac. De hecho, la conversión de CsA a Tac reduce significativamente la PA, al mismo tiempo que mejora el perfil lipídico y reduce el riesgo vascular. Estudios observacionales han mostrado que el uso de Tac y micofenolato mofetil (MMF) se asocia a una reducción del riesgo de muerte posTX frente a CsA y azatioprina, pero esto no se ha confirmado en ensayos clínicos controlados [69].
Los esteroides generan HTA posTX a través de una mayor retención volumétrica y estímulo local vascular del SRA, lo que incrementa las resistencias periféricas. La reducción o suspensión precoz y tardía de estos fármacos se asocian a una disminución de la PA y de los eventos CV posTX.
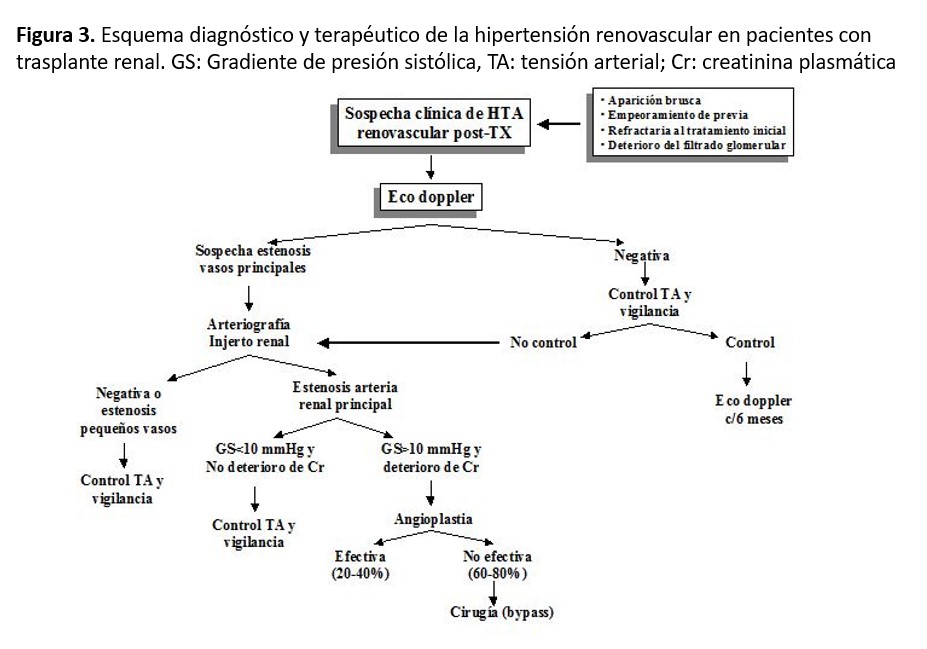
La estenosis de la arteria renal del injerto es una causa frecuente de HTA posTX. Debe sospecharse en pacientes con desarrollo brusco de HTA o empeoramiento de esta, especialmente si ello se acompaña de disfunción renal o soplo sobre el injerto no detectado previamente. La arteriografía renal constituye “el patrón oro” para el diagnóstico definitivo. En general, la angioplastia transluminal o el bypass quirúrgico deben emplearse en los pacientes con alto gradiente de presión sistólica a través de la estenosis (> 10 mmHg). La angioplastia transluminal debe ser el primer procedimiento terapéutico para utilizar, si bien sólo controla la PA en el 30-40% de los pacientes. En la (Figura 3) se muestra un esquema orientativo para el diagnóstico de HTA secundaria a estenosis de la arteria del injerto.
Obesidad
La media de ganancia de peso posTX es de 5-10% en el primer año y esto representa un factor de riesgo para el desarrollo de DMPT, hipertensión y dislipemia. Al mismo tiempo que puede exacerbar un estado inflamatorio preexistente. Los factores de riesgo para el incremento de peso son la edad > 45 años, sexo femenino, la raza negra y el estado de sobrepeso previo. Las recomendaciones dietéticas y el ejercicio moderado pueden llegar a controlar esta situación. La cirugía bariátrica puede mejorar el pronóstico en aquellos individuos con obesidad mórbida.
Diabetes mellitus
La glucemia basal alterada se observa desde la primera semana posTX en más del 45% de los pacientes, mientras que la DMPT aparece en el 16% durante el primer año y en el 24% a los tres años del trasplante [5]. Se considera a la DMPT como una entidad distinta de la diabetes tipo 2, ya que está causada por una resistencia a la insulina sumada a un defecto de secreción de ésta. [70]. Otras alteraciones prediabéticas son frecuentes tras el TX (30%) y comprometen la supervivencia del injerto y del paciente. Estos pacientes presentan un peor perfil metabólico y vascular lo que condiciona un mayor riesgo de cardiopatía isquémica, ECV y pérdida del injerto. La sustitución de Tac por CsA en aquellos pacientes que desarrollan DMPT puede revertir esta entidad [71]. Asimismo, en pacientes en riesgo de DMPT un régimen inmunosupresor con CsA más MMF puede disminuir la incidencia de DMPT, pero el precio a pagar pudiera ser una mayor tasa de rechazo agudo. El tratamiento con belatacept disminuye la incidencia de esta complicación [72]. Los factores de riesgo que predisponen al desarrollo de esta complicación y los mecanismos patogénicos de la misma se discuten en otra sección de este manual.
La presencia de síndrome metabólico, especialmente en aquellos que reciben Tac, se asocia a la aparición diabetes de novo posTX (NODAT) y es un factor de riesgo independiente de pérdida del injerto y mortalidad posTX [31] [73] [74] [75].
Respecto al uso de iSGLT2, la experiencia en TX es limitada. A raíz de sus efectos cardio y nefroprotectores, se están elaborando trabajos para evaluar su eficacia y seguridad. En un estudio observaciones multicéntrico español [76] con 339 TX se determinó que tras seis meses de tratamiento con iSGLT2 en este grupo de pacientes había un mejor control de la glucemia, peso, PA, anemia, proteinuria, ácido úrico y magnesio; con un aumento de la frecuencia de las infecciones urinarias, especialmente en mujeres. Aún está por analizar su impacto en la supervivencia y función del injerto renal [77] .
Hiperlipidemia
La hiperlipidemia es muy frecuente tras el TX (40-60%) y es un factor de riesgo para el desarrollo de enfermedad CV y pérdida del injerto. Se exacerba por la presencia de obesidad, diabetes, proteinuria y los inmunosupresores. Los esteroides incrementan las cifras de colesterol total y LDL-colesterol, y su retirada mejora las alteraciones lipídicas. Los fármacos anticalcineurínicos producen hiperlipidemia dosis-dependiente y el efecto es más intenso en aquellos pacientes que reciben CsA. Los fármacos anti-mTOR aumentan el colesterol total, LDL-colesterol y triglicéridos de una manera dosis-dependiente pero no está demostrado que aumenten los eventos CV posTX [78]. El uso de estatinas y/o ezetimibe puede controlar esta complicación, aunque no se conocen los efectos vasculares potencialmente negativos de la hiperlipidemia a largo plazo. El objetivo ideal de LDL-colesterol es desconocido, sin embargo, las guías KDIGO sugieren tratar con una estatina independientemente de la LDL. Se debe tener en cuenta la interacción de las estatinas con los anticalcineurínicos, particularmente con CsA [5].
Aunque la mayoría de los estudios sobre el uso de iPCSK9 se centran en pacientes con ERC no trasplantados, la similitud en los perfiles de riesgo cardiovascular podría permitir extrapolar estos resultados a este tipo de pacientes. Sin embargo, se requieren más investigaciones específicas para confirmar su eficacia y seguridad en esta población.
Hábito tabáquico
Muchos estudios apoyan la relación del hábito tabáquico con una peor supervivencia del injerto y paciente. Su impacto negativo sobre la supervivencia posTX es similar a la diabetes [79]. Esto supone también un mayor riesgo de hospitalizaciones posTX. Se asume un beneficio similar a la población general tras dejar este hábito, pero no hay estudios controlados que lo demuestren. De igual modo, el cese del tabaco debería ser prioritario en el pre y posTX.
Otros factores de riesgo no tradicionales
Disfunción del injerto renal y proteinuria
La disfunción del injerto renal es muy frecuente (60-70%) y constituye un factor de riesgo independiente de morbimortalidad CV y de pérdida del injerto [80] [81]. CsA y Tac producen vasoconstricción de la arteriola aferente (nefrotoxicidad aguda) y nefrotoxicidad crónica irreversible (fibrosis, atrofia e hialinización arteriolar), inducida por episodios repetidos de isquemia y liberación de citoquinas profibrogénicas. Existen evidencias de que el Tac proporciona una mejor función renal a largo plazo que la CsA, pero queda por aclarar si esto se debe a una mayor potencia inmunosupresora o a un menor efecto nefrotóxico. En general, la sustitución de anticalcineurínicos por anti-mTOR o belatacept más MMF mejoran significativamente la función renal [82] [83]. Si estas medidas reducen la mortalidad CV es, por ahora, desconocido.
La proteinuria posTX (> 300 mg/día) es frecuente y constituye un factor de riesgo para la supervivencia del injerto y la mortalidad a través de la lesión crónica del injerto y la disfunción endotelial [84]. La combinación de albuminuria precoz (> 100 mg/día al 3º mes posTX) y deterioro de la función del injerto renal (GFR 30-60 ml/min) aumentan el riesgo de pérdida del injerto y la mortalidad, lo cual puede ser más relevante en aquellos pacientes con HTA [85] [86]. El empleo de IECA/ARA II reduce la proteinuria posTX, pero no está demostrado que esto tenga un beneficio sobre la supervivencia [87].
Anemia
Básicamente, la anemia es una complicación asociada al uso de antimetabolitos (azatioprina o MMF) y fármacos anti-mTOR. Como en la población general, constituye un factor de riesgo vascular, principalmente por sus acciones sobre la masa ventricular y el gasto cardíaco [88]. El empleo de eritropoyetina desde etapas precoces del TX puede minimizar los efectos de esta complicación, aunque esto no se ha confirmado en estudios controlados. De hecho, cifras de Hb > 12.5 g/dl pueden incrementar la mortalidad posTX [89]. Actualmente se están utilizando en la anemia refractaria en la ERC terapias como los inhibidores orales del factor inducible de la hipoxia (Roxadustat). En el TX, su uso aún no ha sido bien estudiado. Recientemente se ha publicado un ensayo con 150 TX [90]. a los que se randomizó en dos grupos: uno bajo tratamiento con ferroterapia y Roxadustat y otro solo con hierro, con un seguimiento a tres meses. Se objetivó que Roxadustat aumentó los niveles de Hemoglobina en TX, sin mayores efectos adversos que con el uso de hierro. Se deben realizar más estudios para evaluar su eficacia en este tipo de pacientes.
Hiperhomocisteinemia y FGF-23
Unos niveles de homocisteinemia > 11 mmol/l son frecuentes tras el TX y pueden estar asociados a la enfermedad CV posTX. Sin embargo, el tratamiento con altas dosis de ácido fólico y vitaminas B6 y B12 no reduce la mortalidad posTX [91]. Los niveles plasmáticos de factor de crecimiento fibroblástico (FGF-23) constituyen un factor de riesgo de mortalidad tras el TX [92]. La administración de paricalcitol en pacientes con TX disminuye los niveles de PTH y FGF-23, pero no se sabe en la actualidad si esta medida terapéutica reduce la mortalidad posTX [93].
MEDIDAS PARA PROLONGAR LA SUPERVIVENCIA TRAS EL TRASPLANTE RENAL
La (Tabla 4) muestra alguna de las medidas para disminuir el riego CV tras el TX [3]. La individualización de la inmunosupresión puede optimizar los resultados de tales estrategias, pero no existen aún evidencias que confirmen tal afirmación.
Estudio de la enfermedad vascular periférica.
En caso de sospecha diagnóstica debe evaluarse el árbol vascular periférico especialmente en las extremidades inferiores. Las guías KDIGO 2020 [35] sugieren estudiar a todos los candidatos de trasplante de alto riesgo para EVP asintomáticos mediante estudios no invasivos. Aquellos con clínica de EVP deberán ser evaluados por un cirujano vascular.
El objetivo de la terapia para EVP en pacientes en lista de espera para TX y trasplantados, incluye la reducción del riesgo CV, además del riesgo de eventos en las extremidades y mejorar la sintomatología [27].
Las guías ACC/AHA recomiendan el manejo farmacológico de la EVP, principalmente con fármacos antiplaquetarios (aspirina o clopidrogel) y estatinas. Además, se recomiendan IECA/ARA para reducir el riesgo de eventos cardiovasculares en pacientes con EVP [26].
Manejo de la diabetes mellitus posTX
El abordaje terapéutico de esta entidad se comenta en otra sección de este manual. De manera general, el control estricto de la glucemia disminuye el riego de complicaciones metadiabéticas y pudiera evitar la glucotoxicidad de las células beta en las primeras semanas posTX. Por tanto, en aquellos enfermos con alteraciones del metabolismo de la glucemia se debe hacer hincapié en las medidas generales (dieta, control del peso, ejercicio físico, etc.) y considerar la individualización de la inmunosupresión, minimizando los fármacos más diabetógenos en los pacientes de riesgo.
Otras medidas
Otras medidas adicionales que mejoran el perfil CV de los enfermos con TX incluyen hacer ejercicio regularmente, evitar el tabaco, prevenir el sobrepeso y el tratamiento adecuado de la hiperhomocisteinemia. Asimismo, es posible que la optimización de la función renal mediante la individualización de la inmunosupresión, la profilaxis de las infecciones víricas (CMV), la administración profiláctica de antiagregantes plaquetarios y el tratamiento de la anemia posTX puedan mejorar el pronóstico en estos pacientes. El TX anticipado durante la etapa prediálisis puede disminuir el riesgo CV posTX y mejorar la supervivencia.
Papel potencial de los inhibidores de la mTOR en la enfermedad cardiovascular
Los fármacos anti-mTOR (sirolimus y everolimus) tienen potenciales efectos beneficiosos sobre las estructuras vasculares y cardiacas por sus propiedades antiproliferativas. Sirolimus puede disminuir la masa ventricular, pero no existen estudios controlados que lo confirmen. En el modelo animal, estos fármacos frenan la ateromatosis y la vasculopatía posTX, pero se necesitan estudios en humanos que aclaren estos aspectos. Estudios controlados en humanos han demostrado que la administración de fármacos anti-mTOR disminuye la masa ventricular posTX, especialmente cuando se asocian a fármacos que bloquean el SRA [42] [43] [94]. La reducción en la masa ventricular pudiera estar en relación con el descenso del péptido procolágeno tipo I N-terminal [95].
TRATAMIENTO DE LA CARDIOPATÍA EN EL TRASPLANTE RENAL. DOCUMENTO DE CONSENSO NACIONAL SET/SEC/SEN [22].
Nefrólogos y cardiólogos expertos en trasplante, con la colaboración de la Sociedad Española de Trasplante (SET), la Sociedad Española de Cardiología (SEC) y la Sociedad Española de Nefrología (SEN), tras revisar la evidencia científica disponible en el tratamiento actual de la cardiopatía en trasplantados renales, han elaborado un documento de consenso, mediante el método encuesta Delphi de 2 rondas, sobre enfoque y dirección de la enfermedad cardiaca en el trasplante renal, especialmente sobre temas no analizados por las guías de práctica clínica actuales, como: a) valoración cardiológica de los candidatos a TX; b) tratamiento de la cardiopatía en los receptores de trasplante renal, y c) criterios para trasplante cardiorrenal combinado en pacientes con insuficiencia renal terminal (IRT) y cardiopatía.
En base a la evidencia científica, los expertos estuvieron de acuerdo en que el TX es el tratamiento de elección para pacientes con IRT y cardiopatía concomitante dada la mayor supervivencia que aporta [96]. Los pacientes en lista de espera de trasplante con FEVI baja (< 30%) de forma persistente, a pesar de un adecuado tratamiento de los líquidos en diálisis, deben ser valorados para un trasplante cardiorrenal combinado, simultáneo o secuencial [96] [97][98] [99].Los pacientes con FEVI reducida deben recibir cuádruple terapia: IECA/ARA II o sacubitrilo-valsartán, bloqueadores beta, antagonistas de receptor de mineral corticoides (ARM) e inhibidores del cotransportador 2 de sodio y glucosa (iSGLT2) [100]. La diálisis peritoneal y las sesiones de hemodiálisis cortas y frecuentes en pacientes en diálisis con FEVI reducida son más eficaces y mejor toleradas[101].
EVALUACIÓN CARDIOLÓGICA DE LOS CANDIDATOS A TRASPLANTE RENAL
Todos los candidatos a TX deben ser valorados con historia clínica, exploración física, electrocardiograma, biomarcadores cardiacos (p. ej. fracción aminoterminal del propéptido natriurético cerebral [NTproBNP], troponina) y un ecocardiograma. Los biomarcadores pueden estar alterados en la insuficiencia renal crónica (IRC) y en los pacientes en diálisis, y deben utilizarse como punto de referencia para el seguimiento, teniendo en cuenta los cambios dinámicos que pueden producirse con el tiempo. En el caso de demorarse el trasplante, el estudio cardiológico pudiera repetirse cada 1-2 años dependiendo de la situación clínica del paciente.
a) Insuficiencia cardiaca y fracción de eyección reducida
Existen evidencias sobre el tratamiento cuádruple para candidatos a TX con insuficiencia cardiaca y fracción de eyección reducida (≤ 40%) con IECA, ARA2 o sacubitrilo-valsartán, bloqueadores beta, antagonistas del receptor de mineralocorticoides (ARM) e inhibidores del cotransportador 2 de sodio-glucosa (iSGLT2). La mayoría de las clases de fármacos son seguras y eficaces en la ERC hasta el estadio 3 b, aunque hay pocos datos en el estadio 4-5 [100].
Aunque no hay estudios aleatorizados que comparen la diálisis peritoneal con la hemodiálisis en pacientes con enfermedad renal terminal, insuficiencia cardiaca y FEVI reducida, se admite la diálisis peritoneal en estos pacientes por su mejor tolerancia hemodinámica, mejor calidad de vida y disminución de los ingresos hospitalarios [101]. Según el comité de expertos, aunque la diálisis domiciliaria (diálisis peritoneal o hemodiálisis domiciliaria) puede valorarse como la opción de primera línea [102] la hemodiálisis convencional puede ser necesaria para mejor ajuste volumétrico o en casos de eficacia subóptima de la diálisis con otras técnicas.
Debe de plantearse el trasplante combinado cardio-renal simultáneo o secuencial en aquellos pacientes con insuficiencia cardiaca refractaria y GFR<30 ml/min.
b) Tratamiento de la coronariopatía en candidatos a TX
Después de la publicación de la guía de la KDIGO de 2020 [35] tras los resultados del ensayo ISCHEMIA-CKD22, parece que en el subgrupo de pacientes con TFGe < 30 ml/min/1,73 m2 o en diálisis, una estrategia invasiva es más favorable que una estrategia conservadora en caso de isquemia basal grave [103]. Hubo consenso (91,1%) entre los expertos de que en pacientes con coronariopatía crónica demostrada, la revascularización no debería ser sistemática sino individualizada.
TRATAMIENTO DE LAS ALTERACIONES CARDIACAS Y SUS FACTORES DE RIESGO EN TRASPLANTADOS RENALES
1) Control de la presión arterial
Actualmente no hay objetivos óptimos de presión arterial establecidos para los periodos peritransplante o de seguimiento. La fisiopatología de la hipotensión crónica es desconocida, en ausencia de pericarditis, derrame pericárdico, amiloidosis u otras causas de hipotensión, y puede dificultar la recuperación de la función renal. Los fármacos vasoactivos para conservar una presión sistólica > 100 mmHg pueden ser beneficiosos en el posoperatorio inmediato [104]. Por otro lado, la presión arterial elevada puede aumentar la hemorragia quirúrgica por TX.
Comentado tratamiento antihipertensivo en otro apartado.
2) Dislipidemia
No hubo modificaciones respecto a lo comentado en este capítulo. Hubo un acuerdo del 97,6% en que la elección de estatinas debe tener en cuenta la función renal de los pacientes y las posibles interacciones farmacológicas. No hubo consenso para modificar la dosis máxima de estatinas en pacientes con TX tratados con inhibidores de la calcineurina ya que el riesgo de rabdomiolisis es pequeño. Existe riesgo de interacciones farmacológicas cuando se utilizan estatinas y se deben seleccionar las que menos interfieren con el citocromo P450 3A4 (CYP3A4). La administración de ciclosporina junto con estatinas puede requerir una reducción de la dosis de estas. No es necesario ajuste con el uso de tacrolimus [105]. En varios estudios se ha publicado una disminución importante de las tasas de eventos cardiovasculares y mortalidad cuando se utilizan estatinas en trasplantados renales [106].
3) Fibrilación auricular. Anticoagulación
Descrito en el apartado de arritmias.
4) Enfermedad coronaria
Falta evidencia para descartar la enfermedad coronaria en los trasplantados renales asintomáticos [5]. Los factores de riesgo asociados con la aparición de infarto de miocardio tras el TX son la edad, los antecedentes de angina, la vasculopatía periférica, la dislipemia, el infarto previo al trasplante, la disminución de la hemoglobina tras el trasplante, las pruebas no invasivas de isquemia positivas antes del trasplante y las arritmias [107]. El grupo de expertos estuvo de acuerdo con las directrices de KDIGO en que el tratamiento debe ser tan intensivo como en la población general respecto al tratamiento médico y el uso de estatinas y ácido acetilsalicílico en la enfermedad cardiovascular [108]. Se propone la prevención primaria de la diabetes con ácido acetilsalicílico en función de la evaluación de riesgos y las preferencias individuales.
5) Insuficiencia cardiaca
Los péptidos natriuréticos (péptido natriurético cerebral [BNP] y NT–proBNP) son importantes para el cribado de la insuficiencia cardiaca de nueva aparición en trasplantados renales. Los aumentos en el BNP plasmático después del TX están asociados con la disfunción del aloinjerto, mientras que las cifras de NTproBNP antes y después del trasplante se han relacionado con disfunción diastólica y complicaciones cardiacas graves [109][110]. Sin embargo, la capacidad del NT-proBNP predictiva de los resultados cardiacos es dudosa debido a numerosos factores de confusión (p. ej., el grado de función renal).
Existen pocos estudios sobre el tratamiento de la insuficiencia cardiaca en trasplantados renales. Los expertos estuvieron de acuerdo en que el tratamiento de la insuficiencia cardiaca de nueva aparición en trasplantados renales debe ser el mismo que para la población general [111]. Con todo, el tratamiento puede inducir hiperpotasemia en los trasplantados renales, especialmente aquellos con acidosis tubular renal por anticalcineurínicos y con función subóptima del injerto. Los tratamientos como el patirómero y el ciclosilicato de sodio y circonio requieren evaluación en trasplantados renales debido a la interferencia con la absorción del fármaco [96].
INDICES PRONÓSTICOS TRAS EL TRASPLANTE RENAL
Los índices de comorbilidad permiten estratificar el riesgo y predecir la mortalidad. Esto ayuda a diseñar estrategias terapéuticas para prolongar la supervivencia. El score de riesgo de Framingham se ha empleado en pacientes con TX para estimar su carga de riesgo CV, pero no considera factores inherentes al propio TX lo que podría infraestimar el riesgo de muerte. Este score es significativamente menor en los que reciben Tac frente a CsA. No se sabe si esto conlleva una menor mortalidad CV. El índice de Charlson puede ser útil para estimar el riesgo de muerte, pero tampoco tiene en cuenta factores inherentes al TX. Se han desarrollado otros índices pronósticos para la predicción de la mortalidad y la cardiopatía isquémica posTX, utilizando parámetros clínicos perioperatorios y evolutivos, que incluyen la inmunosupresión. En el capítulo titulado Resultados Globales del Trasplante Renal se detallan las características y los parámetros clínicos que incluyen estos índices pronósticos en el TX que se basan, principalmente, en modelos de regresión.
Finamente, la utilización de herramientas pronósticas como la inteligencia artificial puede ayudarnos a precisar el riesgo de mortalidad a partir de factores clínicos en pacientes con trasplante renal [112]. Esto sin duda, también, contribuirá a mejorar los resultados en estos pacientes en términos de supervivencia