VHC en hemodiálisis
Palabras clave
Hemodiálisis, hepatitis C, antivirales
INTRODUCCIÓN
La prevalencia de la infección por el virus de la hepatitis C (VHC), según la OMS, en el año 2022 fue de aproximadamente 58 millones de personas en el mundo, con una importante variabilidad geográfica de la misma [1]. Se considera un problema de salud mundial, siendo en países desarrollados la causa principal de cirrosis y trasplante hepático, así como la responsable de 290000 muertes al año [2].
Se considera una enfermedad sistémica debido a la variedad de manifestaciones extrahepáticas que desarrolla (renales, hematológicas, neurológicas…), siendo estas un factor de riesgo de mortalidad añadido [3]. Entre las manifestaciones extrahepáticas de la infección, está la afectación renal, no solo por el daño que la propia infección causa [4] [5], sino porque, además, los pacientes VHC positivos presentan un mayor riesgo de diabetes, enfermedad cardiovascular e hipertensión arterial (HTA), todos ellos, factores de riesgo para el desarrollo de la enfermedad renal crónica (ERC) y su progresión [6] [7]. Algunos autores han demostrado que los pacientes con infección por el VHC presentan mayor riesgo de desarrollar ERC, mayor velocidad de progresión y mayor incidencia de iniciar tratamiento renal sustitutivo [8].
CARACTERÍSTICAS DEL VIRUS C
El VHC pertenece al género Hepacivirus de la familia Flaviridae. La variabilidad genética es una de las características biológicas más relevantes del VHC. Hasta ahora, se han podido identificar 7 genotipos diferentes del VHC, diferentes entre sí en un 30-35% de los nucleótidos de cada genotipo. Se divide en subtipos, que difieren entre un 20-25% en la secuencia de nucleótidos [9].
Estructura del VHC
Es un virus pequeño, de unos 50nm de diámetro. Presenta una membrana lipídica derivada del retículo endotelial de la célula huésped con las glicoproteínas E1 y E2 incrustadas en la membrana. Bajo la membrana lipídica se encuentra la nucleocápside compuesta por múltiples copias de la proteína core rodeando al RNA genómico.
El genoma del VHC está compuesto por una única molécula de RNA de polaridad positiva. Contienen aproximadamente 9600 nucleótidos. Tiene un marco de lectura único, con 2 regiones en los extremos 5´ y 3´UTR, las cuales son la parte mejor conservada y que menos varía entre los diferentes genotipos, siendo esenciales para la replicación y traducción del RNA.
Ciclo vital del VHC
El VHC se replica sobre todo en el citoplasma de los hepatocitos, aunque también lo hace en células mononucleares, células dendríticas y del sistema nervioso central.
La partícula viral puede circular libre o unida a lipoproteínas. El virión interacciona con la membrana celular de la célula huésped y tras la unión a sus receptores, el VHC entra en el hepatocito por endocitosis. Tras la entrada, se produce la desencapsidación y el RNA viral circula libre por el citoplasma. En el retículo endotelial de la célula huésped se produce el proceso de traducción, procesamiento y replicación.
En el citoplasma, el genoma se traduce, generando una poliproteína viral precursora de 3000 aminoácidos. Por proteolisis da lugar a 3 proteínas estructurales (E1, E2 y core) y 6 proteínas no estructurales (NS2, NS3, NS4A, NS4B, NS5A y NS5B), cuya función se centra básicamente en el procesamiento de la poliproteína y en la replicación viral.
Las proteínas no estructurales son importantes como diana en el tratamiento con los nuevos antivirales de acción directa (AAD). El papel más importante los tienen NS3 y NS5.
NS3 se une a NS4A formando una proteasa implicada en el procesamiento del resto de proteínas no estructurales, esencial para el ciclo del VHC, por este motivo es una diana interesante en la terapia contra el VHC.
NS5A parece que regula diversas vías de señalización, aunque no se conoce bien su función.
NS5B es la polimerasa viral. Es una RNA polimerasa, capaz de sintetizar RNA de novo, haciendo posible la síntesis de RNA.
HISTORIA NATURAL DEL VHC EN HEMODIALISIS
La prevalencia del VHC en la población en diálisis es mayor que en la población general, aunque hay una tendencia a ir disminuyendo como se muestra en el registro DOPPS [10]. Probablemente, sea debido a la disminución del número de transfusiones por el uso de agentes estimulantes de la eritropoyesis (AEE), al aislamiento del VHC en las unidades de diálisis, así como el uso de medidas higiénicas universales en las mismas [11] [12].
En la población general, tras el contacto con el VHC, el 30% de los pacientes presenta una hepatitis aguda que se resuelve espontáneamente. El resto desarrollan una hepatitis crónica, de los cuales, entre un 10-40% terminarán desarrollando una cirrosis a los 20-30 años del contagio y entre el 1-23% de los pacientes desarrollarán un hepatocarcinoma [13].
La historia natural de la infección crónica del VHC en pacientes en hemodiálisis (HD), sigue sin estar bien aclarada, debido en parte a la alta morbimortalidad que tienen estos pacientes. La evolución de la infección del VHC es diferente en pacientes en hemodiálisis que en pacientes con función renal normal. Suele cursar de forma asintomática. Son muchos los estudios que sugieren que los pacientes infectados por el VHC en HD tienen una progresión más lenta [14] [15].
Presentan una menor carga viral y niveles más bajos de enzimas hepáticas, mostrando en la biopsia hepática un menor grado de actividad inflamatoria y de fibrosis que los que presentaban función renal normal [16] [14]. Por tanto, la ERC actúa como un factor protector de actividad inflamatoria, que es el factor principal para el desarrollo de fibrosis y afectación hepática severa [17].
Además, los pacientes presentan una menor incidencia de cirrosis y hepatocarcinoma que los pacientes con función renal normal, observándose en algún estudio una correlación inversa entre el tiempo en diálisis y la incidencia de cirrosis y hepatocarcinoma (menor incidencia en pacientes con más de 10 años en hemodiálisis) [18].
Los factores que influyen en una progresión de la enfermedad hepática más leve no han sido claramente identificados, aunque el estado de inmunodeficiencia que presentan estos pacientes con disfunción de linfocitos T y B, el aumento de factor de crecimiento del hepatocito (HGF) y las alteraciones en la capacidad antioxidante de los pacientes urémicos podrían estas influyendo en la menor actividad inflamatoria hepática y en el retraso de la progresión a fibrosis [19].
Pero no solo el sistema inmune comprometido juega un papel esta progresión, ya que en pacientes portadores de trasplante renal con más inmunosupresión la afectación hepática es más desfavorable [20] [21]. Por lo tanto, deben existir otros mecanismos implicados en el enlentecimiento del proceso. Entre las hipótesis que se barajan, la propia técnica de diálisis puede tener un efecto protector.
En el año 2002, se observó en un estudio in vivo, una reducción de la carga viral tras la sesión de HD con el uso de algunas membranas como la polisulfona y AN-69, sin observarse esta reducción con membranas de cuprofán, con lo que los autores sugerían que esta reducción es debida a la adsorción del virus por la membrana [22] [23] [24]. Otros autores sugieren un paso de partículas virales al ultrafiltrado [25] [26]. A pesar de estas reducciones, en la sesión siguiente de HD, volvían a presentar carga viral similar a la que presentaban prediálisis en la sesión previa.
Otras hipótesis se basan en la producción durante la sesión de hemodiálisis de sustancias endógenas con actividad antiviral [27] [28]. Entre ellas, destaca el Interferón-α que presenta un elevado efecto antiviral. Algún estudio demuestra que, durante la sesión de hemodiálisis, van aumentando los niveles de Interferón-α, lo cual podría contribuir a la reducción de la viremia que ocurre durante la misma. Sin embargo, no se evidenció una clara relación causa-efecto entre los dos fenómenos [29].
Otro factor que puede influir en la menor velocidad de progresión de la hepatopatía es el HGF, que estimula la proliferación de los hepatocitos e inhibe la apoptosis celular. Durante la sesión de hemodiálisis, se aumenta la producción del HGF e incluso como se observa en el gráfico, tras 24 horas postdiálisis, los niveles siguen siendo superiores que en pacientes con función renal normal, lo que puede jugar un papel en la menor actividad inflamatoria [30].
DIAGNÓSTICO Y EVALUACIÓN DE LA ENFERMEDAD HEPÁTICA
Como se ha mencionado previamente, la evolución clínica del VHC en la población en HD es diferente a la población general, por eso, las guías clínicas recomiendan realizar un screening para descartar infección por VHC a todo paciente que inicia tratamiento renal sustitutivo y posteriormente anualmente.
Existen varias técnicas
1. Detección de anticuerpos (Ac). La técnica más empleada es un inmunoensayo enzimático de tercera generación para la detección cualitativa de la presencia de Ac IgG frente al VHC en el suero o plasma del paciente [31]. Es la técnica inicial, que ha probado ser la más sensible.
2. En caso de un resultado positivo, se confirmaría por RIBA (Recombinant InmunoBlot Assay), que también detecta Ac frente al VHC pero es más específica [32].
3. Las dos pruebas anteriores implican contacto con el virus, pero puede tratarse un proceso agudo que se cronifica o se cura de forma espontánea, por tanto es necesaria la detección de RNA del VHC, que puede hacerse de forma cualitativa o cuantitativa (RT-PCR)
4. Detección del genotipo, mediante técnicas serológicas o moleculares, que es importante para la elección del tratamiento más adecuado.
Conocer el estadio de la enfermedad es importante de cara a la elección del tratamiento más adecuado. Las herramientas disponibles en el momento actual para conocer el estadio de la hepatopatía son:
1. Ecografía hepática: que da información acerca de la morfología hepática, así como la presencia de lesiones sólidas.
2. Elastografía (transient elastography, Fibroscan®): Evalúa el grado de fibrosis por la rigidez hepática [33]. Ha sustituido a la biopsia hepática para evaluar el grado de enfermedad hepática, así como para evaluar la progresión de la enfermedad
3. Biopsia hepática: Sigue siendo el gold standard para la evaluación del grado de fibrosis y severidad de la hepatopatía. En los pacientes en diálisis, se realizan menos biopsias que en la población general por el riesgo de sangrado, al asociar el riesgo por la propia hepatopatía con el de la propia uremia [34]. Aun así, se ha demostrado que puede ser segura también en la población en HD [35]. Las guías recomiendan realización de biopsia hepática para evaluar el grado de enfermedad hepática en pacientes candidatos a trasplante renal [12].
VHC TRATAMIENTO
A pesar de la lenta progresión de la hepatopatía en la población en HD, son muchos los estudios en los que se ha visto un peor pronóstico en HD, en los pacientes VHC positivos frente a aquellos sin infección [36], demostrando que el VHC es un factor de riesgo independiente de mortalidad global y cardiovascular en la población en diálisis [37].
Es por esto, que tanto las sociedades de Hepatología como las de Nefrología recomiendan el tratamiento en los pacientes con ERC y sobre todo en aquellos que son candidatos a recibir trasplante renal.
En pacientes VHC positivos tratados, hay una menor incidencia de manifestaciones extrahepáticas, y entre ellas, se ha observado que los pacientes tratados tienen una menor incidencia de ERC, así como menor riesgo de progresión a enfermedad renal crónica terminal [38]
Sin embargo, hasta hace relativamente poco tiempo, la única opción de tratamiento del que se disponía era el Interferón asociado o no a la Ribavirina, con un uso cada vez más limitado, debido a la pobre respuesta al tratamiento y los efectos secundarios [36].
El mayor conocimiento sobre el ciclo vital del VHC y la caracterización de las proteínas virales que participan en la replicación, ha permitido recientemente el desarrollo de nuevos fármacos que actúan directamente sobre el VHC impidiendo su replicación, proporcionando una alta tasa de respuesta al tratamiento, con escasos efectos adversos en la población general.
Fármacos antivirales de acción directa
Existen cuatro clases de antivirales de acción directa (AADs) definidos según su mecanismo de acción y objetivo terapéutico:
1. Inhibidores de la proteasa NS3/NS4A
2. Inhibidores de la NS5A
3. Inhibidores nucleósidos de la polimerasa NS5B
4. Inhibidores no nucleósidos de la polimerasa NS5B
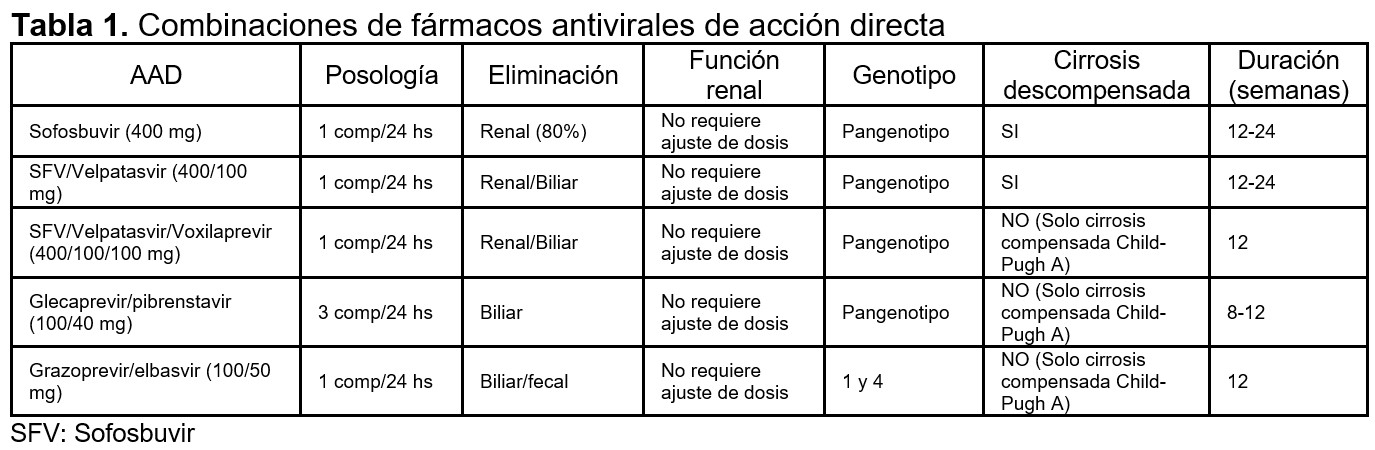
Siempre se usan en combinación, dada la alta tasa de resistencia al tratamiento. Los nuevos AADs son regímenes libres de interferón. En la (Tabla 1), se muestran algunas de las combinaciones que se emplean y la indicación.
A pesar de estos grandes cambios, todavía hay grupos especiales de pacientes, en los que hay dificultades para iniciar el tratamiento por la patología concomitante, entre los que se incluyen los pacientes con ERC. Algunos de estos fármacos de gran eficacia en la población general presentan metabolismo renal, por lo que en los pacientes con ERC estadios 4 y 5 hay pocos datos sobre su eficacia y seguridad, aunque cada vez van apareciendo más datos que demuestran una alta tasa de respuesta al tratamiento, aunque casi todos los estudios son series muy cortas de población en diálisis.
Selección del tratamiento viral en la población en hemodiálisis
La elección del tratamiento depende del genotipo, el grado de afectación hepática y el tratamiento previo. Las guías de Hepatología Americana y Europea y las guías americanas de nefrología han propuesto un tratamiento basándose en ensayos clínicos realizados en esta población [39] [40] [41]:
•Tratamientos con sofosbuvir: Sofosbuvir es un antiviral pangenotipo, inicialmente no estaba recomendado en pacientes con filtrado glomerular <30 ml/min/1,73m2. Recientes estudios sugieren que regímenes con sofosbuvir son bien tolerados y eficaces incluso en pacientes en hemodiálisis [42] [43].
• Grazoprevir/elbasvir: basándose en el estudio C-SURFER [44], está indicado en pacientes con hepatitis C con genotipo 1a y 1b. La duración del tratamiento es de 12 semanas. Presentando una respuesta viral sostenida (RVS, carga viral indetectable a las 12 semanas postratamiento) del 94% en pacientes con cirrosis y del 99% en pacientes sin cirrosis.
• Glecaprevir/Pibrentasvir: Son antivirales pangenotipos. El ensayo EXPEDITION-4 y EXPEDITION-5 [45],[46] incluyó pacientes en hemodiálisis con una RVS del 98%. La duración del tratamiento es de 8-16 semanas en función de la ausencia o presencia de cirrosis.
• Ombitasvir/Paritaprevir/ritonavir/Dasabuvir: basándose en el ensayo RUBY-I [47], en pacientes con genotipo 1b durante 12 semanas y asociado a ribavirina en el genotipo 1a y cirróticos durante 24 semanas. También está indicado en el genotipo 4 sin dasabuvir y asociado a ribavirina durante 24 semanas. Presenta una RVS del 95%.
El empleo de ribavirina en pacientes en hemodiálisis ha sido problemático, por lo que se recomienda no utilizarlo en pacientes con niveles de hemoglobina <10g/dl y ajustar dosis o suspenderlo si disminuyen los niveles 2g/dl. Sin embargo, el empleo de agentes estimulantes de la eritropoyesis permite el empleo de ribavirina manteniendo unos niveles adecuados de hemoglobina [48].
Aunque no hay experiencia, una vez finalizado el tratamiento, se recomienda retirar el aislamiento de estos pacientes en las unidades de diálisis tras presentar una RVS a las 12 semanas de finalizar el tratamiento.