Dosis de Hemodiálisis
Introducción
Se define diálisis adecuada como el tratamiento sustitutivo renal que satisface los requisitos de ser eficaz y suficiente, conseguir una buena tolerancia, mejorar la calidad de vida y prolongar la supervivencia de los pacientes [1].
Muchos autores utilizan indistintamente los términos diálisis adecuada o dosis de diálisis. Aunque la diálisis adecuada implica un concepto más amplio (Tabla 1), la dosis dialítica puede considerarse un buen marcador subrogado de diálisis adecuada, ya que ha sido relacionada con la corrección de la anemia, el estado nutricional, el control de la hipertensión arterial y la supervivencia global en diálisis [2]. Es por esta razón que este tema se centra básicamente en la dosis.
Métodos para medir la dosis de diálisis
La hemodiálisis, como cualquier otro tratamiento, necesita una dosificación y una pauta de administración. Para ello, se han diseñado y obtenido métodos cuantitativos que garantizan que el paciente reciba una dosis mínima adecuada.
Modelo cinético de la urea
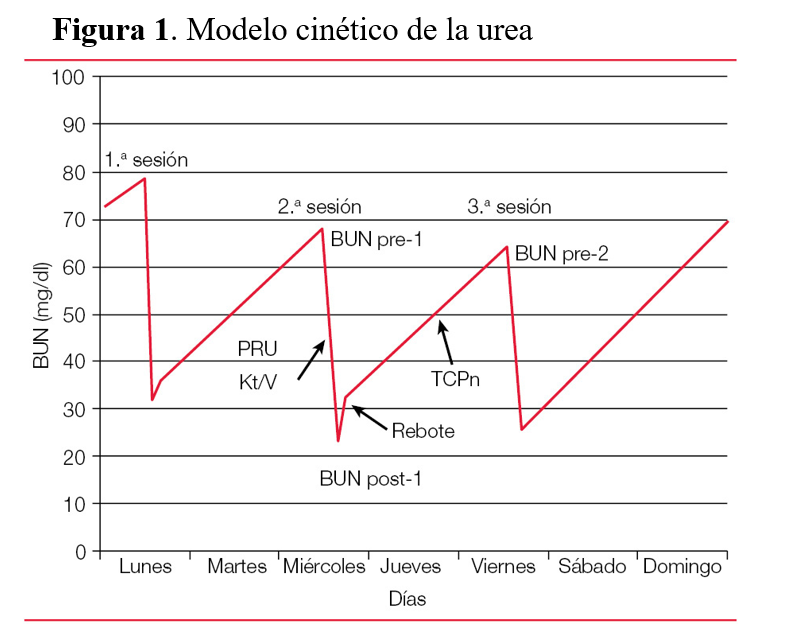
El modelo cinético de la urea (MCU) es la concepción matemática del comportamiento de la urea en el organismo y engloba la ingesta, la generación, la distribución y la eliminación de esta (Figura 1).
El MCU proporciona una triple información [3]:
1. Niveles de toxicidad urémica mediante el TAC (time average concentration) o concentración media de BUN:
siendo BUN1, BUN2 y BUN3 los valores de BUN prediálisis, posdiálisis y prediálisis de la siguiente sesión, respectivamente; el Td el tiempo de diálisis y el Tid el interdiálisis, en minutos.
2. El estado nutricional mediante la valoración de la tasa de catabolismo proteico o PCR (del inglés, protein catabolic rate), normalizado para el peso corporal (PCRn), que es equivalente a la ingesta proteica si el paciente está en estado de equilibrio (no infecciones, no enfermedades inflamatorias crónicas, no terapia con corticoides, no aumento del catabolismo endógeno):
siendo G la generación de urea y P el peso posdiálisis.
La cuantificación de la dosis de diálisis mediante el índice de diálisis o Kt/V, siendo K el aclaramiento del dializador, t el tiempo de duración y V el volumen de distribución de la urea. La dosificación de la hemodiálisis puede también determinarse utilizando el porcentaje de reducción de la urea (PRU).
Volumen de distribución de urea
El volumen de distribución de la urea es similar al del agua corporal [4][5]. El agua corporal oscila entre el 35-75% del peso corporal, en relación con variabilidad individual, sexo, contenido de tejido adiposo, estado de hidratación o área de superficie corporal. Se ha observado cómo las mujeres alcanzan un objetivo de Kt/V o PRU con mayor facilidad gracias a su menor volumen de distribución de la urea. Al ser difícil calcular V por el MCU, se propusieron las siguientes alternativas: 58% del peso corporal (53% en mujeres y 60% en hombres) o fórmulas antropométricas como las de Hume, Chertow o Watson. La recolección total o parcial del líquido de diálisis es un método preciso pero poco práctico. Recientemente, el análisis de la composición corporal mediante bioimpedancia eléctrica constituye una herramienta válida, segura y de fácil uso que permite el cálculo del V de una forma individualizada con gran exactitud. Como varias fórmulas del MCU precisan introducir un V, en la práctica diaria se utiliza la fórmula antropométrica de Watson [4]:
En varones:
En mujeres:
Función renal residual
Una minoría de pacientes en hemodiálisis mantiene función renal residual, que, si no se toma en consideración, conlleva una infraestimación de la dosis administrada. Es aconsejable la recolección periódica de orina para añadir al Kt/V habitual el Kt/V residual:
donde
Recirculación
La recirculación del acceso vascular es el paso de sangre de la línea venosa (ya dializada) a la línea arterial con la consiguiente pérdida de eficacia dialítica [6]. Las causas más frecuentes son la proximidad de las agujas (evitable) y la disfunción del acceso vascular, siendo la estenosis venosa lo más característico. Una disminución de la dosis de diálisis y/o presiones venosas elevadas debe hacer sospechar este fenómeno. La recirculación se calcula con la siguiente fórmula:
siendo Ca, Cv y Cp las concentraciones de urea arterial, venosa y periférica respectivamente.
Fórmulas monocompartimentales
Kt/V
Para el cálculo de la dosis de diálisis el parámetro más utilizado es el Kt/V. Se han descrito varias fórmulas para el cálculo del mismo, lo que puede ocasionar confusión a la hora de interpretar el Kt/V, ya que los resultados difieren considerablemente de un método a otro. En los últimos años el Kt/V monocompartimental se suele calcular usando la fórmula de Daugirdas de 2ª generación [7], que toma en consideración la generación de urea intradiálisis y la ganancia de peso interdiálisis:
Donde C1 y C2 corresponden a la urea inicial y final, respectivamente; T al tiempo en horas de tratamiento; y UF al cambio de peso pre - posdialisis en Kg.
La guía práctica para hemodiálisis (DOQI) de la National Kidney Fundation [8] recomienda este Kt/V y considera el PRU como única alternativa para calcular la dosis de hemodiálisis:
El PRU es el método más simple que se puede utilizar. Sin embargo, este no toma en consideración la contribución de la ultrafiltración, la función renal residual, ni la generación de urea intradiálisis, lo que hace que sea un método más impreciso.
Efecto rebote de la urea. Fórmulas bicompartimentales.
El modelo cinético de la urea asume un modelo monocompartimental, de forma que la urea se equilibra instantáneamente durante la diálisis a través de su V. Sin embargo, la extracción rápida de urea durante la hemodiálisis crea desequilibrios intercompartimentales de forma que, al final de la misma, se produce un aumento brusco de la urea, llamado efecto rebote, que es expresión del reequilibrio y que se alcanza a los 30-60 minutos de finalizar la diálisis.
donde CR es la urea medida en el equilibrio.
El cálculo del Kt/V corregido por el efecto rebote, bicompartimental o equilibrado, exige que la extracción final de urea se realice a los 30-60 minutos de finalizar la diálisis, lo que hace que sea poco práctico. Esta preocupación llevó a varios autores a realizar estudios y desarrollar fórmulas para la estimación del Kt/V corregido para el rebote sin que el paciente deba esperar más tiempo. Un análisis comparativo de las diferentes fórmulas propuestas observa una mejor precisión y correlación con el Kt/V medido a los 45 minutos posdiálisis de las fórmulas de estimación que solo toman en cuenta la urea inicial y final. Hay dos propuestas extendidas actualmente, la de Daugirdas bicompartimental [9]:
siendo T el tiempo de tratamiento en horas y la fórmula Maduell bicompartimental [10]:
Cambio de frecuencia
El cálculo de la dosis de hemodiálisis y sus recomendaciones se refieren a un esquema de tres sesiones semanales. Sin embargo, si la frecuencia de diálisis cambia, hay que utilizar fórmulas diferentes para calcular la dosis, siendo las fórmulas propuestas:
1. Aclaramiento renal equivalente de urea o EKR [11]:
2. Kt/V estándar [12]:
siendo Cm la media de los valores pico de urea prediálisis.
3. Porcentaje de reducción de urea semanal [13]:
donde C1 es la urea inicial o prediálisis y C2 la urea final o posdiálisis.
Extracción de muestras para el MCU
Se recomienda, como mínimo, una determinación mensual de urea pre y posdiálisis para realizar los cálculos del modelo cinético de la urea. La extracción pre y postdiálisis se debe realizar en la misma sesión, a mitad de semana, y las muestras procesarse al mismo tiempo y con el mismo autoanalizador. La muestra prediálisis debe obtenerse inmediatamente antes del inicio de la hemodiálisis, evitando la dilución de la muestra con suero salino o heparina [8]; la muestra posdiálisis debe obtenerse después del final de la sesión y, para su correcta extracción, se deben seguir los siguientes pasos:
a) Parar el flujo del baño y parar o disminuir al mínimo la ultrafiltración.
b) Bajar el flujo sanguíneo a 50-100 mL/min durante 20 segundos. Este paso es esencial para evitar la recirculación de la fístula arteriovenosa.
c) Extraer la muestra por el método de bajo flujo: con la bomba sanguínea a 50-100 mL/min, extraer la muestra de la línea arterial. La otra alternativa es el método de bomba parada: se para la bomba sanguínea, se clampan las líneas arterial y venosa, se clampa el tubo de la aguja de la línea arterial, se separa la línea arterial del tubo de la aguja y se extrae la muestra del tubo de la aguja arterial con vacutainer o aspiración con jeringa sin aguja.
Monitorización continua durante la sesión de diálisis
Biosensores de dialisancia iónica
Mediante dos mediciones de la conductividad del líquido de diálisis a la entrada y a la salida del dializador se aplica un modelo matemático de dos ecuaciones para dos incógnitas que permite conocer la dialisancia iónica efectiva (Di) (que es el valor de dialisancia de electrolitos corregidos para la ultrafiltración y la recirculación del acceso vascular) y la conductividad del agua plasmática (Cp). Esta medición sistemática del K por el tiempo transcurrido de diálisis permite obtener el Kt, una forma real de medir la dosis de diálisis, expresada en litros.
Otra gran ventaja de utilizar estos biosensores intradiálisis es que permiten valorar rápidamente la evolución de la sesión de diálisis, detectando si existe alguna incidencia (como punción de líneas invertidas, disfunción del catéter, tiempos muertos, etc.) que pueda ser fácilmente corregible cuando se detecta.
Además, el seguimiento crónico e informatizado de la dosis en cada sesión de diálisis permite detectar disfunciones del acceso vascular de forma precoz. Se dice que cuando existe un descenso de la eficacia superior al 25% se asocia en más del 90% de los casos a una disfunción de este.
El Kt/V medido por dialisancia es igual al medido en análisis en sangre
Diferentes estudios que han utilizado la dialisancia iónica en hemodiálisis la expresan como Kt/V y han llegado a la conclusión de que los valores de Kt/V medido por dialisancia iónica difieren de los medidos en sangre (el Kt/V determinado por dialisancia iónica infraestima respecto del obtenido con la fórmula Daugirdas de segunda generación) pero que existe una buena correlación entre ambos métodos.
Dosis mínima de tratamiento
El Kt/V infraestima la dosis dialítica para mujeres y hombres de bajo peso.
Sin embargo, un posterior análisis secundario del estudio HEMO [15] sí demostró que la dosis de diálisis medida por Kt/V es infraestimada en mujeres y hombres de bajo peso. Por esta razón algunos autores han propuesto utilizar el Kt/V estándar ajustado al área de superficie corporal [16][17][18].
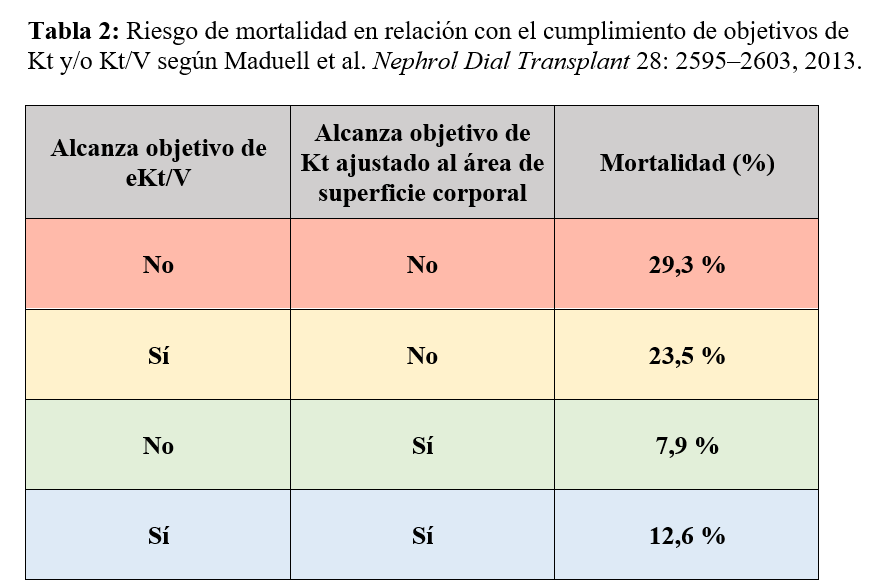
Esto se ha reproducido en otros estudios como el de Maduell et al. de 2016 [19], observacional prospectivo de 6129 pacientes en hemodiálisis que demuestra un incremento del riesgo de mortalidad cuando no se alcanza el Kt prescrito ajustado a superficie corporal. Más aún, este riesgo de mortalidad se reduce cuando se alcanzan de 1 a 3 litros más sobre el objetivo de Kt. Del mismo modo, se observó una reducción del riesgo de hospitalización cuando se superaba el objetivo de Kt en 9 o más litros. Además, la aplicación estadística del Propensity Score Matching sobre la muestra permitió identificar que los pacientes que reciben una mayor dosis de Kt tienen un riesgo de mortalidad reducido, independientemente del resto de las comorbilidades y del propio Kt/V. Y se observó que la mortalidad de los pacientes que cumplen el Kt/V pero no el Kt era del 23.5%, mientras que los que cumplen ambos era del 12.5%. (Tabla 2).
El stdKt/V ajustado a superficie corporal
En 2008, Daugirdas et al. propusieron un método para reescalar el stdKt/V a la superficie corporal (SAN-stdKt/V), lo que permitiría una mejor cuantificación de la dosis de diálisis y eliminaría la curva en «J» que se observa con el Kt/V y el eKt/V. Para su cálculo es necesario calcular previamente el spKt/V, eKt/V y stdKt/V, y definir el cociente V/S (donde V es el agua corporal total calculada con la ecuación de Watson y S la superficie corporal estimada con las ecuaciones de Gehan y George o de Dubois) del paciente que se corregirá por la mediana V/S de la población. Esta metodología tiene una altísima complejidad que hace que su implantación clínica sea muy baja, en favor de la simplicidad del Kt ajustado a superficie corporal.
El Kt como alternativa
En 1999, Lowrie et al. [20] proponen el Kt como marcador de dosis de diálisis y mortalidad, recomendando un Kt mínimo de 40 – 45 litros para las mujeres y 45 – 50 para los varones. En su estudio de 3009 pacientes observaron una curva de supervivencia en «J» cuando distribuyeron los pacientes en quintiles según el PRU, mientras que la curva era descendente cuando se utilizaba el Kt, es decir, que un mayor Kt se acompañaba siempre de una mayor supervivencia [21]. En 2005, se propuso individualizar la prescripción del Kt ajustada según el área de superficie corporal, cosa que fue validada en un estudio posterior [22]:
siendo ASC el área de superficie corporal en m2,
Recomendaciones actuales
En las guías prácticas para hemodiálisis tanto americana, europea, canadiense, australiana como española, persisten las recomendaciones mínimas de dosis para programas de hemodiálisis de 3 sesiones semanales: un spKt/V mínimo de 1.2 y/o un PRU del 65%, recomendando un spKt/V de 1.3 y un PRU del 70 % para asegurar estos mínimos.
Sin embargo, esas recomendaciones han sido validadas con analíticas de urea pre y posdiálisis, pero no con estimaciones por dialisancia iónica. Y la realidad es que esta se está imponiendo en el seguimiento de la dosis de diálisis en tiempo real en cada sesión hasta el punto de que muchas unidades de diálisis han abandonado la determinación de urea en sangre en su práctica habitual.
Sobre todo, las mujeres, pero también los varones de bajo peso, podrían estar infradializados con los objetivos mínimos antes mencionados, por lo que parecen necesitar una mayor dosis de Kt/V [23]. Se ha sugerido cambiar a un Kt/V ajustado a la superficie corporal, o mejor utilizar el Kt, como solución a este problema.
En busca del método ideal para monitorizar la dosis de diálisis.
El Kt podría ser el futuro de seguimiento de la dosis de diálisis [24], ya que estudios prospectivos asocian la dosis de este con una reducción progresiva de la mortalidad y hospitalización, por lo que supone una alternativa que permite evitar la curva de mortalidad en «J» que se observa con el PRU y el Kt/V al distribuir a los pacientes por quintiles. Es cierto que el SAN-stdKt/V también la elimina, pero, frente a la simplicidad del Kt, su cálculo es muy complejo.
Por otro lado, Maduell et al. encontraron que hasta un 25-40% de pacientes con un Kt/V dentro de las recomendaciones no alanzaría el objetivo de Kt ajustado a superficie, cosa que se ha asociado a una mayor mortalidad (23.5% frente al 12.5% de los pacientes que cumplen con ambos objetivos) [25]. Y ello nos hace pensar que el uso del Kt podría ayudar a evitar infradializar a las mujeres, hombres pequeños y portadores de catéter como acceso vascular. Se ha estimado que para obtener un Kt mínimo en pacientes portadores de catéter se requiere un tiempo adicional de 30 minutos si el catéter se mantiene en posición normal y de 60 minutos si está en posición invertida [26].
También hay que considerar que, para obtener Kt/V con dialisancia iónica, tenemos en cuenta tres variables, dos reales medidas por el monitor (K y t) y una estimada (V) a partir de fórmulas antropométricas como la de Watson, por cálculos entre el Kt medido dividido por el Kt/V analítico o por bioimpedanciometría, estimaciones o mediciones indirectas que hacen de V un valor poco preciso, sujeto a error y manipulable durante la sesión.
Optimización de la dosis de diálisis
Como ya se ha sido expuesto, la dosis de diálisis la calculamos con el Kt o el Kt/V. Si queremos intervenir sobre el mismo se deberá actuar sobre el K o el T ya que el V es constante para cada paciente y por tanto no se puede modificar.
El K de urea del dializador depende de:
a) Superficie y permeabilidad de la membrana. En cada dializador es diferente pero constante y está expresado por su coeficiente de transferencia de masas o KoA. A mayor superficie, mayor transferencia de masas. Actualmente se usan superficies de 1.5-2 m2, según la superficie corporal del paciente.
b) Flujo de sangre (Qb): es sencillo de modificar pero está limitado por el estado del acceso vascular. Una atención especial al acceso vascular, a la detección y corrección de su disfunción o complicaciones es esencial para alcanzar un rendimiento óptimo del dializador. Lo deseable sería disponer de un acceso vascular en condiciones de ofrecer un Qb entre 400-500 mL/min. Para un Qb > 400mL/min se debe utilizar agujas de calibre 15G para evitar elevadas presiones venosas.
c) Flujo de baño de diálisis (Qd): puede ser incrementado sin efectos adversos y el cambio del Qd de 500 a 750 mL/min mejora la eficacia del K entre un 5-10%.
d) Transporte convectivo: Añadiendo convección y dependiendo del volumen de reposición posdilucional se puede incrementar la dosis de diálisis entre un 5-15%.
Tiempo: Es el elemento más importante y siempre eficaz sobre el que podemos influir para mejorar la dosis. Las recomendaciones de las guías europeas y españolas son de un tiempo mínimo de 12 horas semanales [14] [27].