Hemodiálisis extendida
Palabras clave
Hemodiálisis extendida, cut-off, retrofiltración
ÍNDICE
1.Introducción
Importancia de las moléculas medias. Necesidad de desarrollo de nuevas membranas de hemodiálisis.
2.Membranas de medio cut-off
a.Concepto de cut-off y retention onset
b.Características de la membrana:
i.Fibras capilares y poro: tamaño, homogeneidad, número.
ii.Estructura y geometría.
iii.Filtración interna.
iv.Aclaramiento de moléculas
v.Pérdidas de albúmina
vi.Seguridad
3.Hemodiálisis extendida
a.Modelos teóricos y experimentales
b.Prescripción
c.Consideraciones especiales
4.Experiencia clínica. ¿Qué lugar ocupan las membranas de medio cutt-off?
¿Qué experiencia clínica tenemos?
¿Qué experiencia clínica tendremos?
1.INTRODUCCIÓN
Importancia de las moléculas medias. Necesidad de desarrollo de nuevas membranas de hemodiálisis
En las últimas décadas, se han llevado a cabo múltiples avances en las técnicas de hemodiálisis (HD) que han permitido mejorar la supervivencia y la calidad de vida de los pacientes con enfermedad renal crónica avanzada (ERCA). Originariamente, las membranas de hemodiálisis estaban diseñadas para eliminar únicamente toxinas urémicas de pequeño tamaño mediante transporte difusivo evitando las pérdidas de albúmina [1]. La identificación de toxinas de mediano peso molecular (PM) y su relación con algunas de las principales comorbilidades derivadas de la ERCA motivó el interés por el desarrollo de nuevas membranas sintéticas de alto flujo que permitían asociar transporte convectivo para mejorar la depuración de este tipo de moléculas. De este modo, se desarrollaron las técnicas de hemodialfiltración online (HDF-OL) que combinan transporte difusivo y convectivo, permitiendo una mayor eliminación de toxinas urémicas de mediano tamaño, lo cual se ha asociado con mejor supervivencia a largo plazo [2]. Sin embargo, existen todavía importantes limitaciones e incluso con las técnicas más sofisticadas de depuración extrarrenal las tasas de mortalidad y eventos cardiovasculares de los pacientes en HD son muy elevadas [3]. Por otra parte, las técnicas de HDF-OL han mostrado sus beneficios cuando se consiguen volúmenes convectivos elevados y para ello, se requieren flujos sanguíneos altos y un buen funcionamiento del acceso vascular, por lo que no están disponibles para todos los pacientes. Por este motivo, se ha desarrollado en los últimos años un nuevo tipo de membranas, llamadas de medio cut-off (MCO), que permiten eliminar un mayor número de moléculas de mediano tamaño en HD convencional.
2.MEMBRANAS DE MEDIO CUT OFF
Para entender el funcionamiento de este tipo de membrana es preciso conocer los conceptos de “cut-off” y “retention onset”, así como las características de sus fibras capilares, lo cual le confiere unas propiedades que permiten la eliminación de moléculas de mediano PM en HD convencional.
a.Concepto de “cut off” y “retention onset”
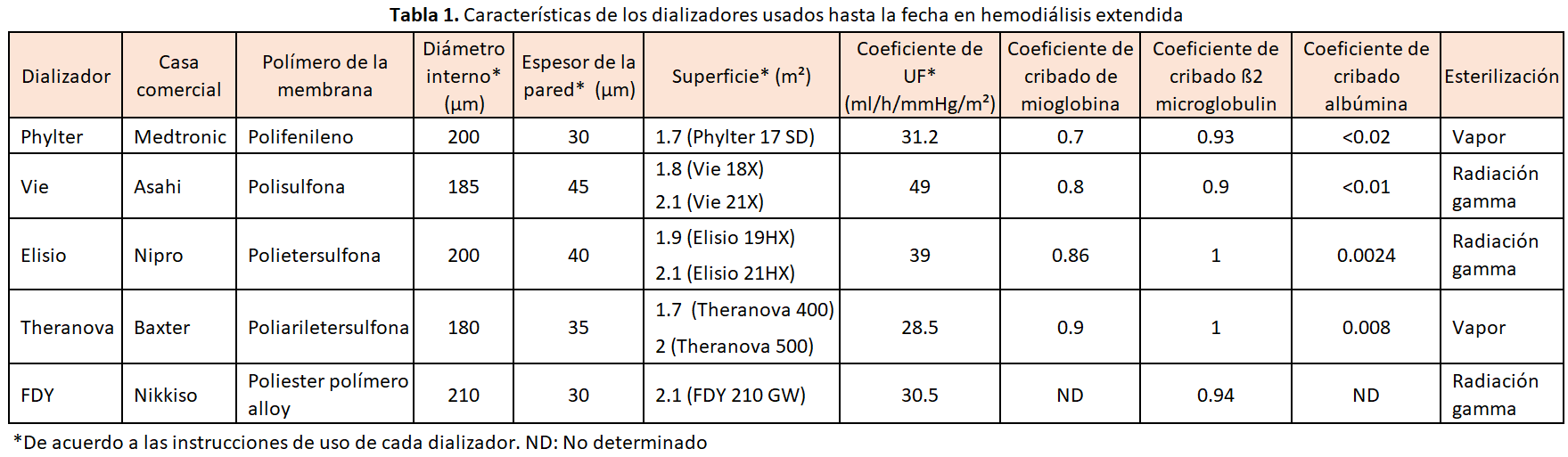
Para su explicación, nos valdremos de la (Figura 1) en la que se comparan las curvas de cribado de dos membranas diferentes: una de alto flujo (membrana 1, azul) y una MCO (membrana 2, rojo) [4].
Ambas curvas de cribado muestran la disminución progresiva del coeficiente de cribado conforme aumenta el PM de los solutos. El “cut-off” de la membrana viene determinado por el PM a partir del cual el 90% de los solutos va a quedar retenido o lo que es lo mismo, el coeficiente de cribado para las moléculas de dicho PM será de 0.1. Como podemos ver en la gráfica, el “cut off” es muy similar para ambas membranas (MWCO1 y MWCO2). Sin embargo, el comportamiento de ambas curvas de cribado es, como puede verse, muy diferente. Para comprender estas diferencias debemos definir el “retention onset” o punto de retención, que viene determinado por el PM a partir del cual se va a retener más de un 10% de los solutos, es decir el PM para el cual el coeficiente de cribado será de 0.9. En este caso, si comparamos ambas membranas (MWRO1 y MWRO2), podemos observar que sus puntos de retención muestran amplias diferencias. Como puede verse en la gráfica, el “retention onset” de la membrana 2 se encuentra en torno al PM de la ß2 microglobulina (12.000 Da), mientras que para dicho soluto el coeficiente de cribado en la membrana 1 es de 0.4 [5][6]. Esto se traduce en un mayor coeficiente de cribado de la membrana MCO y, por tanto, en un mayor aclaramiento de sustancias de mediano PM.
b.Características de la membrana
i.Fibras capilares y poro: tamaño, homogeneidad, número.
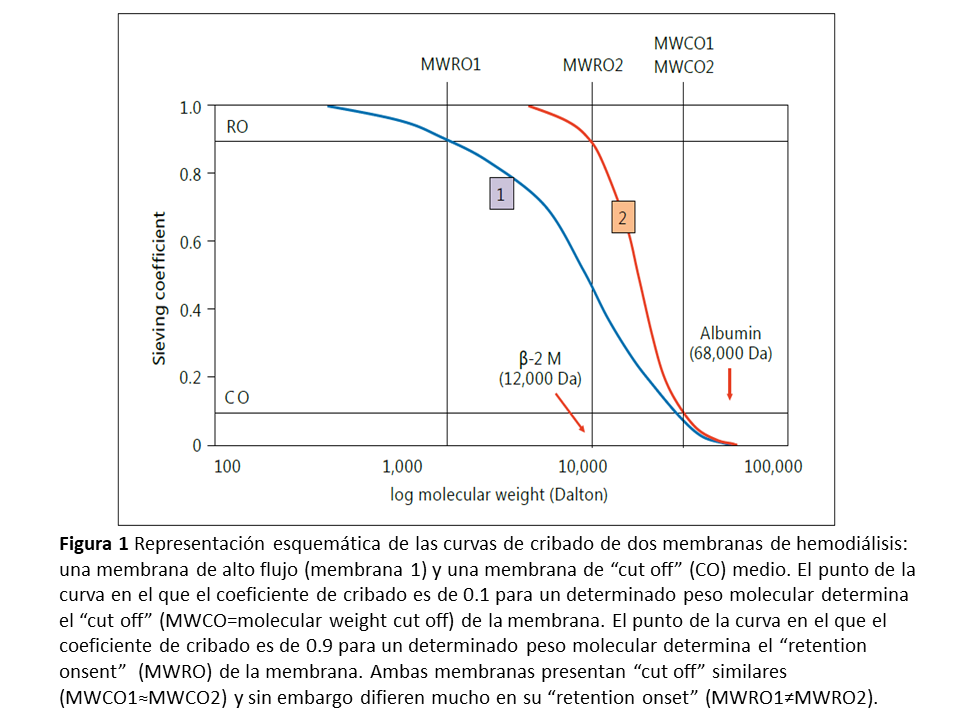
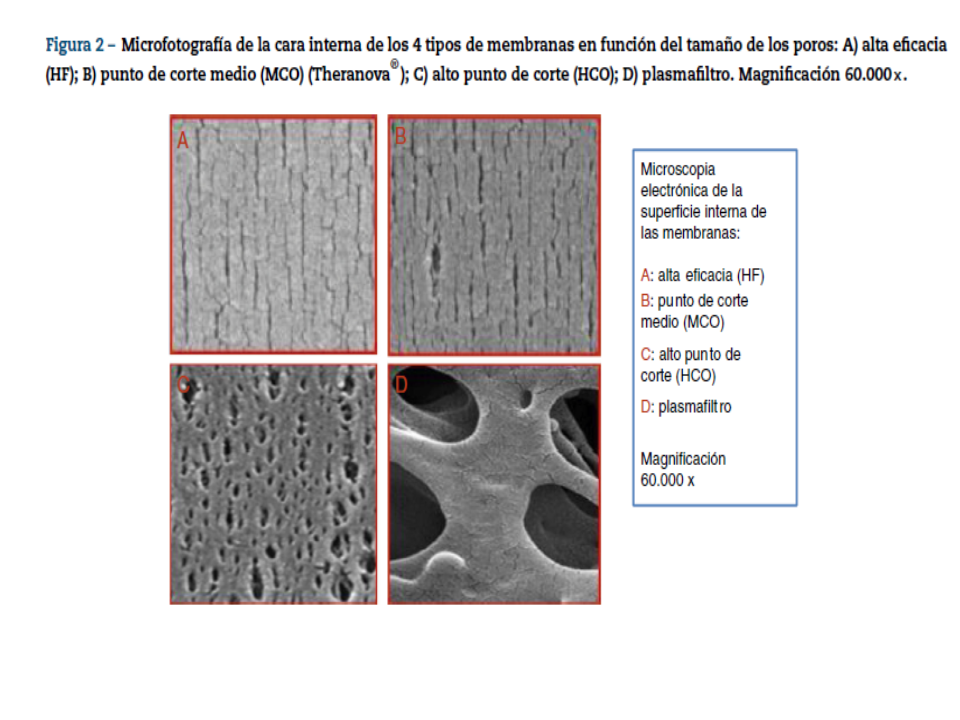
Las diferencias previamente descritas entre ambas curvas de cribado radican en la presencia en la membrana de MCO de unos poros de un diámetro superior al de las membrana de alto flujo y una distribución más homogénea del diámetro de los poros, como puede verse en las (Figura 2) y (Figura 3) [7] .
ii.Estructura y geometría
Además de presentar poros de mayor diámetro y distribución más homogénea, las fibras capilares de las membranas de MCO presentan un menor diámetro interno que favorece la caída de presión en el compartimento vascular a lo largo del dializador.
iii.Filtración interna.
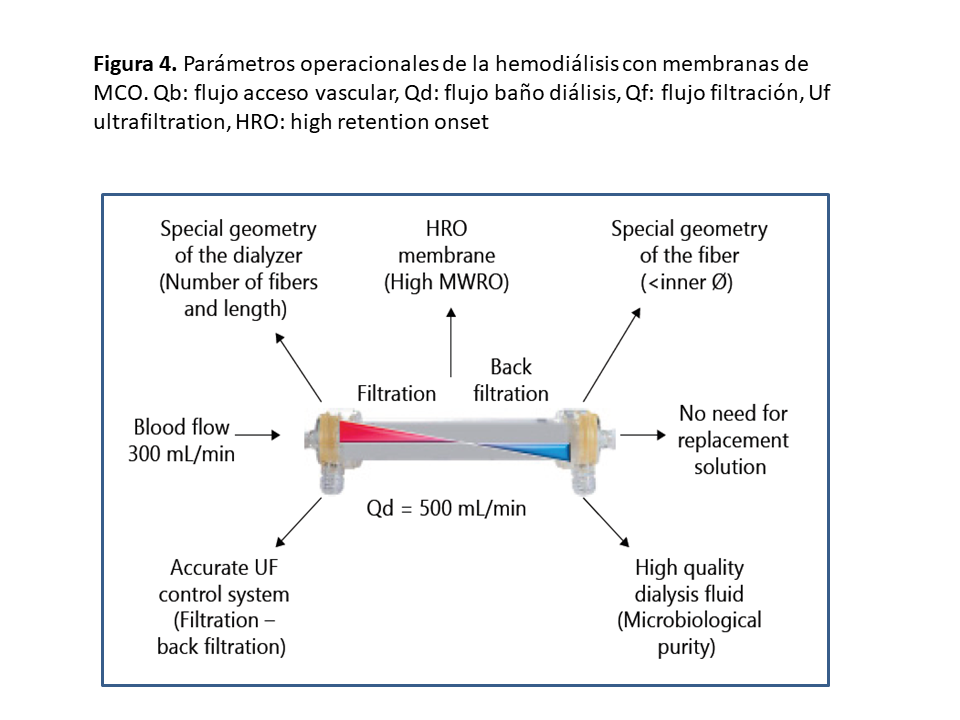
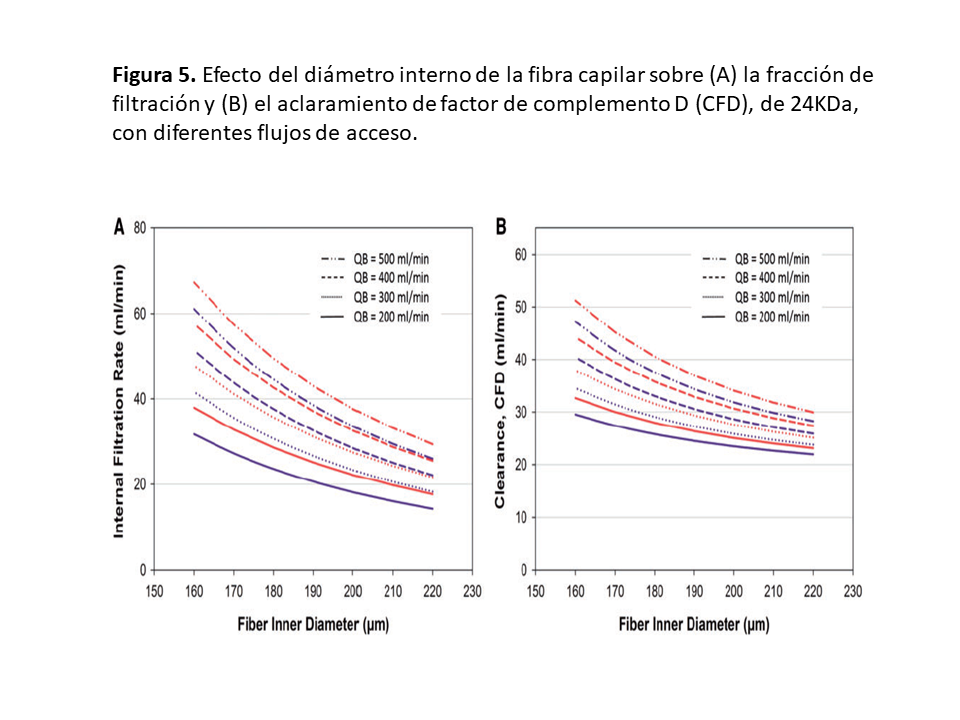
La longitud de las fibras y su diámetro interno son esenciales para optimizar la filtración interna en el dializador, así como los fenómenos de filtración-retrofiltración [8]. Este mecanismo, aunque resulta invisible para el clínico, permite conseguir una cantidad significativa de transporte convectivo dentro del dializador, donde se produce filtración en las partes proximales que se compensa con la retrofiltración que ocurre en las partes distales gracias a la caída de presión favorecida por el menor diámetro interno de las fibras (Figura 3) [4][9]. Esta cantidad de transporte convectivo se traduce en un aumento del aclaramiento de solutos como puede verse en la (Figura 4) [10].
Diversos modelos teóricos han permitido caracterizar la filtración interna y la retrofiltración que se produce en los dializadores de MCO [9][11]. En particular, para el dializador Theranova 400®Baxter, la filtración interna estimada con flujos de 300 y 400 ml/min fue de 30 y 40 ml/min respectivamente.
El sistema de control de la ultrafiltración del monitor de diálisis regula el proceso y determina la ultrafiltración neta requerida para alcanzar el peso objetivo del paciente. Debido a la cantidad de retrofiltración que se produce, es recomendable el uso de agua ultrapura para evitar la transferencia de toxinas al paciente durante el tratamiento.
iv.Aclaramiento de moléculas
Gracias a las características previamente detalladas, las membranas de MCO han permitido ampliar el espectro de toxinas urémicas de mediano PM eliminadas en HD convencional. Esto es debido, no solo a la filtración interna que tiene lugar en el interior del dializador, sino fundamentalmente a un mayor aclaramiento difusivo alcanzado con este tipo de dializadores [12]. En el apartado 4, “Experiencia clínica”, se describen los principales trabajos publicados hasta la fecha en los que se analiza el aclaramiento de moléculas de distintos tamaños moleculares con dializadores de MCO y se comparan con otros dializadores de alto flujo en HD y HDF-OL.
v.Pérdidas de albúmina
El mayor tamaño de los poros de la membrana de MCO se traduce en un aumento en las pérdidas de albúmina en las sesiones de HD convencional [13], lo cual ha supuesto siempre una preocupación para el clínico, por las posibles consecuencias derivadas de dichas pérdidas en el estado nutricional de los pacientes en HD. Diversos estudios han analizado las pérdidas de albúmina con las membranas de MCO en comparación con otros dializadores de alto flujo en HD y en HDF-OL, las cuales se han estimado en 2-4 g/sesión [13][14][15]. Estas pérdidas son equiparables a las descritas para diversos dializadores en HDF-OL [15], las cuales hasta la fecha no se han asociado a parámetros de malnutrición [16].
vi.Seguridad
Hasta la fecha, no se han publicado reacciones adversas a las membranas de MCO; sin embargo, al tratarse de una membrana sintética, es posible que puedan producirse reacciones de hipersensibilidad.
3.HEMODIÁLISIS EXTENDIDA
El término de hemodiálisis extendida (HDx) ha sido propuesto para definir el tratamiento en el cual se combina transporte difusivo y convectivo en el interior de un dializador con membranas de MCO [4][8][17].
a.Modelos teóricos y experimentales
Valiéndonos de las curvas de cribado expuestas en la (Figura 1) y de los modelos teóricos de filtración interna obtenidos para el dializador Theranova 400®Baxter, se puede realizar una simulación de la eliminación de ß2 microglobulina con ambos dializadores [17]. Para ello hay que tener en cuenta que el aclaramiento convectivo (K) resulta del producto de la tasa de ultrafiltración (Qf) y el cribado (S) de la molécula seleccionada (K= Qf x S). Puesto que los volúmenes de transporte convectivo que se han relacionado con un aumento de la supervivencia en HDF-OL son aquellos superiores a 23 litros/sesión [2] y dado que el coeficiente de cribado de la ß2 microglobulina para un dializador estándar de alto flujo se encuentra en torno a 0.5, el aclaramiento de dicha molécula en HDF-OL sería de 23x0.5=11.5 litros/sesión. Para alcanzar el mismo resultado con una membrana de MCO donde S=0.9 para ß2 microglobulina, se necesitarían solo 12,7 litros de transporte convectivo. De acuerdo con los modelos teóricos previamente expuestos [9][11], un dializador de MCO genera una filtración interna media de 40 ml/min, sin ultrafiltración. En una sesión de hemodiálisis de 4 horas de duración con Qb=400 ml/min, Qd=500 ml/min y Uf=16 ml/min, la filtración interna sería de 56 ml/min (40+16 ml/min) con una retrofiltración de 40 ml/min. Dicha filtración interna supondría un total de 13440 ml (56ml/minx240min), que multiplicada por 0.9 (S), supondría un aclaramiento total de 12,97 litros/sesión.
b.Prescripción
Un monitor de diálisis estándar puede llevar a cabo la técnica sin necesidad de un software especial ni tecnología específica. Únicamente se necesita un monitor con control de ultrafiltración en hemodiálisis convencional, siendo deseable emplear flujos sanguíneos ≥ 300 ml/min y flujos del líquido de diálisis ≥ 500 ml/min. Debido a las cantidades significativas de retrofiltración, las autoras de este capítulo recomendamos el uso de agua ultrapura para evitar el paso de toxinas al paciente durante el tratamiento [17].
c.Consideraciones especiales con las membranas MCO
En relación a cómo utilizar las MCO, no precisa ninguna consideración especial en relación a las dosis de heparina, ni en la dosificación de fármacos utilizados en diálisis como han demostrado en un trabajo realizado in vitro [18].
No obstante, existen dos situaciones en las que no se deben utilizar las membranas de MCO: la HDF y la ultrafiltración aislada. Con la técnica de HDF se pueden perder cantidades importantes de albúmina, en torno a 15 g por sesión (datos no publicados).
4.EXPERIENCIA CLÍNICA
¿Qué lugar ocupan las membranas de medio cutt-off?
En este apartado analizaremos los estudios clínicos realizados con las membranas de MCO. La mayoría de ellos se han centrado en la capacidad de eliminación de moléculas con estos dializadores, comparándolos bien con dializadores de alta eficacia (high-flux [HF]) o con la técnica de HDF.
Hay comercializada en el momento actual una membrana de MCO (Theranova) con dos superficies, 1.7 m2 y 2.0m2. Especificaremos en los distintos estudios la superficie utilizada en los mismos, aunque un estudio realizado por Maduell y cols [14] no muestra diferencias significativas en la eliminación de moléculas de distinto PM entre ambas.
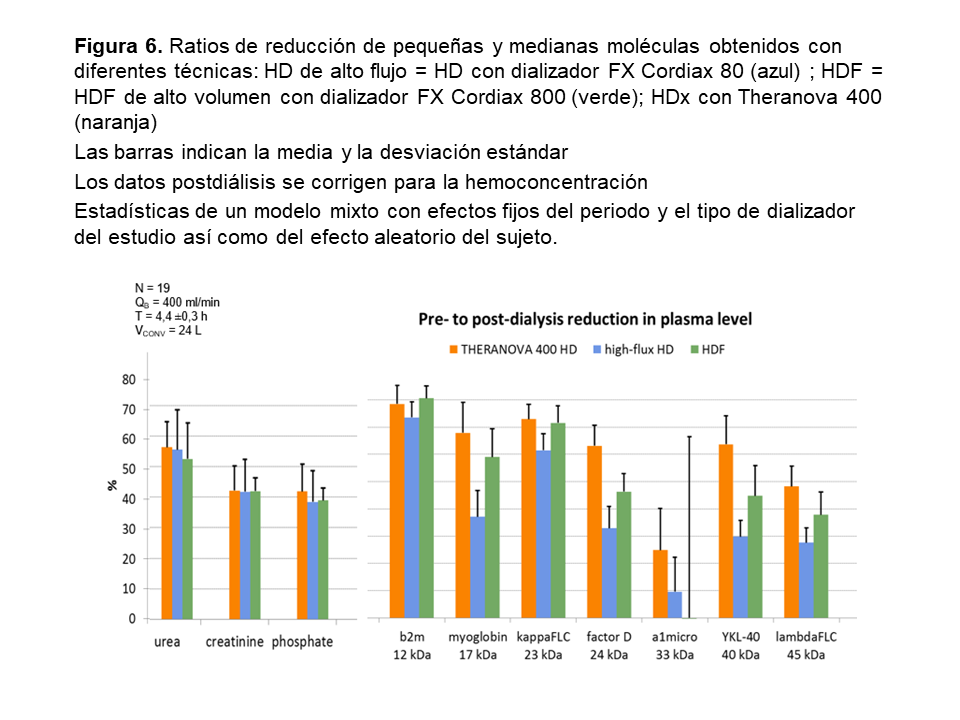
El trabajo de Kirsch y cols [11] prospectivo y aleatorizado incluyó a 19 pacientes y comparó entre otros dializadores de MCO, el dializador theranova 400 (1.7 m2) con HD HF utilizando FX Cordiax 80 (1.8m2) y con HDF utilizando FX Cordiax 800 (2.0m2). Los resultados se muestran en la (Figura 5) y se resumen en que en la depuración de sustancias de PM bajo, no se observan diferencias entre los tres grupos, mientras que a medida que el PM de estas moléculas aumenta, las diferencias se ponen de manifiesto con mejor eliminación con la HDF y la HDx. Así mismo, con PM superiores a 24.000 Da la HDx es superior a la HDF.
García-Prieto y cols [19] realizan un estudio similar en 18 pacientes comparando las tres técnicas y en el que además de los porcentajes de reducción de moléculas de distinto PM, incluyen las pérdidas de albúmina. Concluyen que la HD con MCO es superior a la HD HF en la depuración de moléculas medias y grandes, y no es inferior a la HDF. Con respecto a esta última encontraron una menor pérdida de albúmina (P<0.001) con la membrana de MCO (0.03 g vs 3,1 g/sesión con MCO HD vs HDF).
Reque y cols. [20], también concluyen en su estudio prospectivo y cruzado realizado en 10 pacientes, 24 sesiones comparando Theranova 500 con HDF con Polyflux-210H™, que ambas técnicas son igual de eficaces en el aclaramiento de moléculas pequeñas y medias, mientras que en las de mayor PM, la HDx podría ser superior a la HDF.
Belmouaz y cols [21], realizaron un estudio retrospectivo para evaluar eficacia y seguridad de Theranova 500 (2.0m2). Para ello incluyeron durante 6 meses, 10 pacientes y compararon la HD convencional con este dializador con HDF utilizando el dializador Polyflux-210H™ (poliariletersulfona/polivinilpirrolidona, de 2.1 m2) o Elisio-21H™ (polinefrona de 2.1 m2). No encontraron diferencias en la depuración de moléculas pequeñas ni medianas hasta mioglobina.
En los últimos años, son muchos los estudios publicados sobre la eficacia depurativa de esta terapia, por lo que recientemente se han publicado varias revisiones sistemáticas y metaanálisis resumiendo sus resultados. Yang et al [22] publicaron un metanálisis que incluye nueve estudios en los que se evaluó la eficacia depurativa de las membranas de MCO en comparación con membranas de alto flujo, concluyendo que los ratios de reducción de ß2 microglobulina, TNFα y cadenas ligeras fueron mayores con las membrana de MCO, sin diferencias significativas en los niveles plasmáticos. Los niveles de albúmina fueron inferiores en los pacientes que se dializaban con MCO incluidos en los estudios randomizados, sin encontrar diferencias en los pacientes incluidos en estudios no randomizados. En el mismo sentido, Hung et al [23] llevaron a cabo un metaanálisis de 5 estudios que incluían a 328 pacientes en los que se comparó la eficacia depurativa de la diálisis con membranas de MCO comparándola con HDHF. Demostraron mayores ratios de reducción de ß2 microglobulina y cadenas ligeras, sin diferencias en los niveles séricos de IL-6. Las pérdidas de albúmina fueron superiores con las membranas de MCO. Por último, la sociedad canadiense de Nefrología ha publicado dos revisiones sistemáticas y metaanálisis sobre la eficacia depurativa [24] y clínica [25] de las membranas de MCO en comparación con las membranas de alto flujo. En cuanto a la eficacia depurativa, tras analizar 26 estudios concluyen que las membranas de MCO eliminan un amplio rango de moléculas de mediano PM y probablemente de mediadores inflamatorios con una reducción transitoria de los niveles de albúmina en comparación con la HD HF. A nivel clínico, analizaron 22 estudios en los que encontraron moderada evidencia sobre el efecto de las membranas de MCO en calidad de vida y otros aspectos clínicos reportados por los pacientes en comparación con la HD HF.
Hasta el momento, la mayor parte de la evidencia disponible sobre dializadores MCO que ha sido previamente comentada proviene fundamentalmente de estudios realizados con el dializador Theranova, que fue la primera membrana MCO comercializada. Posteriormente se han ido comercializando otras membranas (Tabla 1) con comportamiento similar en estudios comparativos recientemente publicados [26][27][28][29].
¿Qué experiencia clínica tendremos?
Existen varios estudios en marcha sobre la eficacia de HDx en comparación con HDHF y HDF, así como sobre sus potenciales beneficios clínicos. Entre ellos queremos destacar el estudio MOTHER HDx (Estudio multicéntrico, abierto, prospectivo, aleatorizado para explorar la morbimortalidad en pacientes dializados con Theranova HDx en comparación con la HDF-OL) (Figura 6), que sin duda es uno de los más importantes, ya que tiene como objetivo determinar si la HDx no es inferior a la HDF para reducir el resultado combinado de muerte por todas las causas y accidente cerebrovascular (isquémico o hemorrágico) y el síndrome coronario agudo (angina e infarto de miocardio) y evento de enfermedad arterial periférica (amputación o revascularización) y colitis isquémica (trombosis mesentérica) en sujetos en HD. Las autoras de este capítulo participamos en el mismo, y en el momento de escribirlo son más de 50 los centros españoles participantes con más de 370 pacientes incluidos.