Complicaciones agudas durante la sesión de hemodiálisis
INDICE
INTRODUCCIÓN
Complicaciones cardiovasculares:
1.Hipotensión
2.Hipertensión intradiálisis
3.Arritmias
Complicaciones neuromusculares:
1.Calambres
2.Síndrome de desequilibrio
3.Convulsiones
4.Cefalea
5.Síndrome de piernas inquietas
Complicaciones hematológicas
1.Activación de complemento y neutropenia
2.Hemólisis aguda
3.Hemorragia
4.Trombopenia
Complicaciones pulmonares
1.Hipoxemia asociada a diálisis
COMPLICACIONES RELACIONADAS CON PROBLEMAS TÉCNICOS
1.Embolismo aéreo
2.Líquido de diálisis incorrecto: hipernatremia, hiponatremia, acidosis metabólica, alcalosis metabólica y mal funcionamiento de la temperatura del monitor
3.Pérdida de sangre
4.Coagulación del circuito
Reacciones en diálisis
1.reacciones alérgicas
2.Reacciones a fármacos
3.Tratamiento
Miscelánea
1.Prurito
2.Fatiga postdiálisis
3.Genitourinario: priapismo intradiálisis
4.Fiebre
INTRODUCCION
Aunque los avances técnicos en hemodiálisis (HD) han hecho que este procedimiento sea cada vez más seguro, aún existen importantes complicaciones agudas en la práctica clínica habitual. Una revisión de emergencias en HD encontró que la mayoría de los incidentes se deben a errores humanos, con la excepción de un pequeño número asociado con reacciones idiosincrásicas [1].
Las características de seguridad de las modernas máquinas de hemodiálisis han hecho que las emergencias asociadas al tratamiento, como la embolia gaseosa, la hemólisis, la hemorragia del acceso vascular y las reacciones alérgicas graves, sean relativamente raras.
Las complicaciones agudas que ocurren más frecuentemente son (2]:
Calambres: 5 a 20%
Náuseas y vómitos: 5 al 15 %
Cefalea: 5 %
Dolor en el pecho: 2 a 5 %
Dolor de espalda: 2 a 5 %
Prurito: 5 %
Fiebre y escalofríos: <1 %
Estas complicaciones generalmente se deben a diferentes mecanismos, algunos poco conocidos, complicándose más conocer su patogenia porque aparecen simultáneamente. Por ejemplo, la hipotensión, que tiene múltiples causas posibles, puede estar acompañada de náuseas, vómitos, dolor de cabeza y/o dolor en el pecho. De manera similar, los calambres pueden estar asociados con hipotensión y, a veces, son difíciles de tratar.
Este tema revisará estas complicaciones, sus causas y manejo terapéutico.
COMPLICACIONES CARDIOVASCULARES
1.HIPOTENSION INTRADIÁLISIS
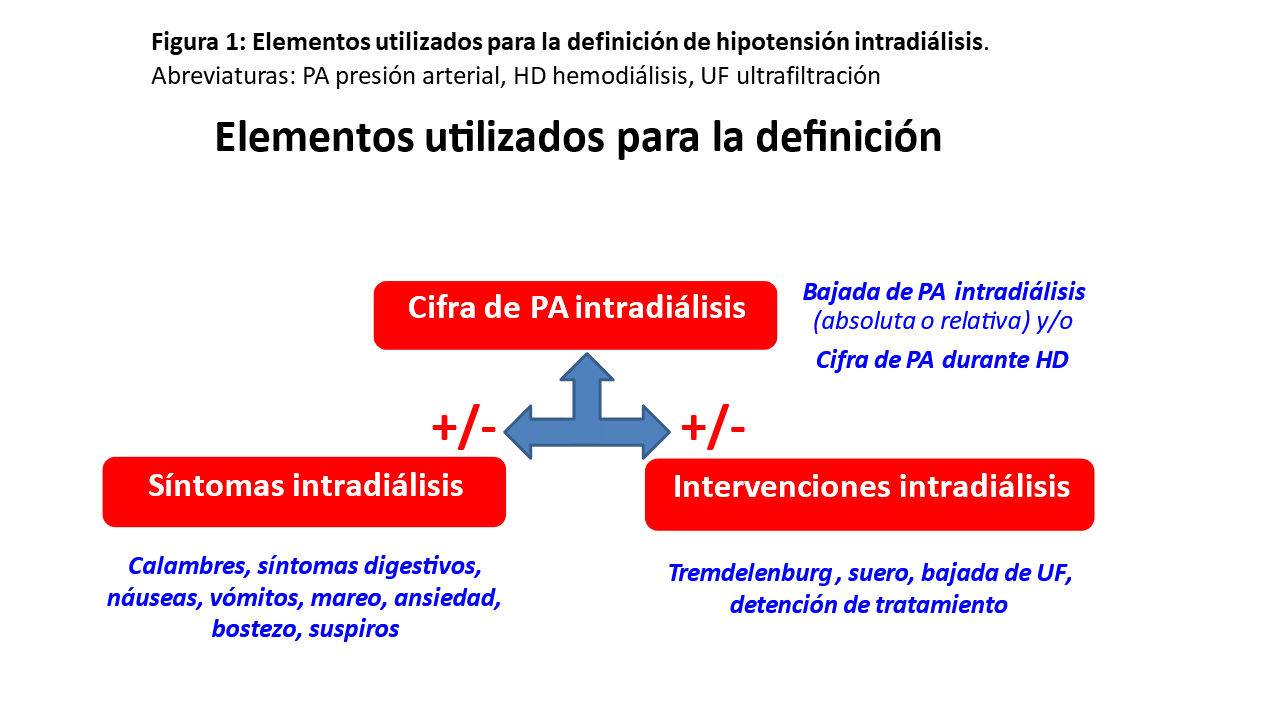
La hipotensión intradialítica (IDH) es la complicación más frecuente, con una incidencia que varía según las series del 5 al 40% de los tratamientos dependiendo de la población estudiada y la definición utilizada [3]. En la definición de IDH pueden tenerse en cuenta tres elementos (Figura 1): la presencia de síntomas, el valor de la presión arterial (PA) y la necesidad de intervención terapéutica o no. Esto da lugar a múltiples definiciones, aunque actualmente se considera que habría que definirla como cualquier descenso de la PA sintomática o PA sistólica (PAS) inferior a 90 mm de Hg, ya que ese valor es el que se asocia a un aumento de la mortalidad. [4] Porque la IDH, produce (Figura 2), además de los síntomas inmediatos, un compromiso en la perfusión de órganos, pudiendo producir isquemia miocárdica (que puede ser incluso subclínica, pero con datos de isquemia en el electrocardiograma, conocido como “aturdimiento miocárdico”), arritmias cardíacas, trombosis vascular, isquemia mesentérica, pérdida del conocimiento, convulsiones o muerte. [5]
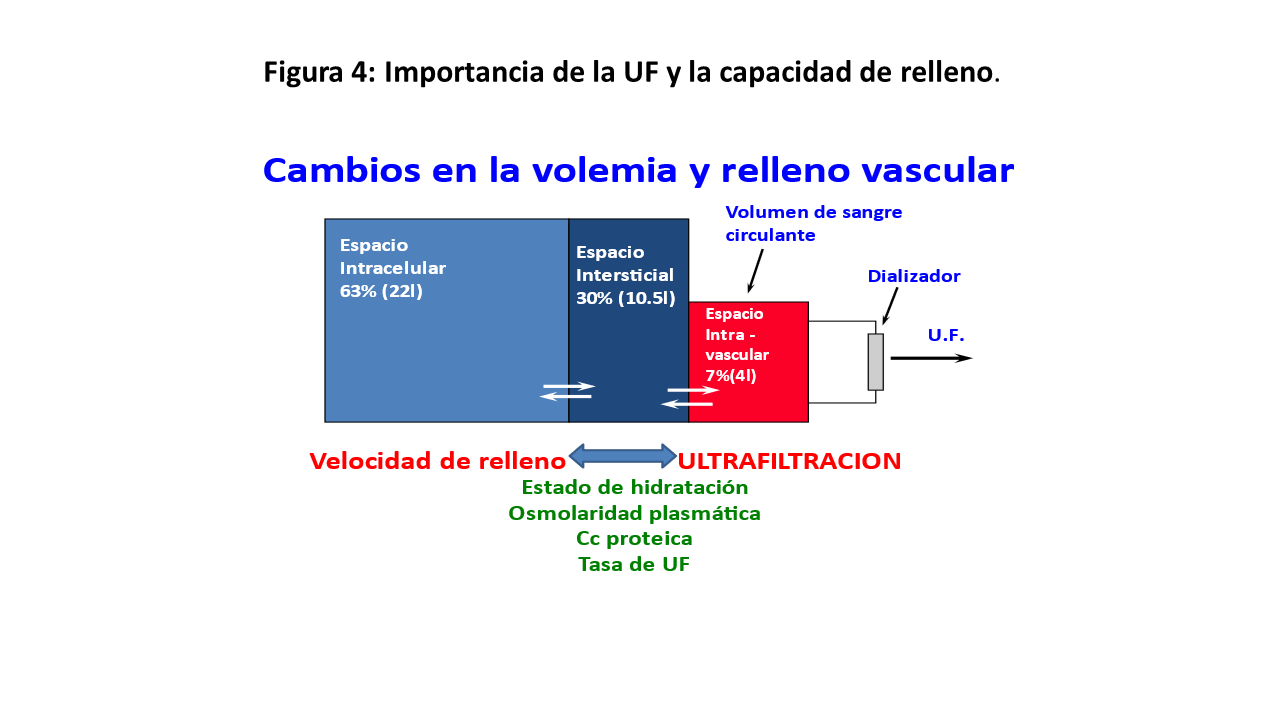
En la fisiopatología de la IDH se da una interacción compleja de factores que incluyen el volumen circulante, la velocidad de eliminación de líquidos, la velocidad de "relleno" del espacio intravascular, el gradiente osmolar entre los compartimentos y el deterioro de los mecanismos compensadores debido a causas médicas subyacentes, enfermedades o medicamentos (Figura 3). Sin embargo, lo más común es que la IDH se deba a una alta ganancia de peso interdiálisis precisando de una ultrafiltración (UF) que supera la tasa de llenado intravascular y que resulta en una disminución relativa del volumen intravascular (Figura 4). Los datos recientes demuestran un mayor riesgo de muerte a medida que aumenta la tasa de UF, independientemente del umbral utilizado [5]. Además, hay que tener en cuenta que algunos pacientes tienen más riesgo; los estudios apuntan a que las mujeres, los ancianos con hipertensión sistólica aislada, los diabéticos y aquellos con neuropatía autonómica documentada o cardiopatía tienen un mayor riesgo de IDH.
La hipotensión sintomática debe tratarse rápidamente colocando al paciente a la posición de Trendelenburg y reduciendo o deteniendo la UF para restaurar el volumen de sangre circulante. Si a pesar de estas maniobras la hipotensión persiste, deben administrarse bolos de entre 100 a 250 cc. de NaCl al 0,9%. La albúmina y otras soluciones hipertónicas no ofrecen ninguna ventaja sobre la solución salina isotónica y son más caras. La mayoría de los episodios sintomáticos se resuelven eficazmente con estas intervenciones. La tasa de flujo sanguíneo no debe reducirse de forma rutinaria para manejar la hipotensión, porque esto no es efectivo y comprometerá el aclaramiento de solutos.
Si la IDH grave persiste, es posible que la hipovolemia no sea la causa subyacente, y habrá que iniciar una investigación más extensa, que incluya exploración física, ECG, ecocardiografía de emergencia y pruebas de laboratorio. Las arritmias, el infarto de miocardio, el taponamiento pericárdico, la hemorragia, la hemólisis, la embolia pulmonar y la embolia gaseosa deben considerarse como diagnóstico diferencial (Figura 3). Una hipotensión persistente requiere discontinuar el tratamiento.
Las estrategias preventivas para evitar episodios posteriores son esenciales (Figura 5). Es fundamental una determinación adecuada del peso seco, además de aconsejar a los pacientes que controlen la ganancia interdialítica mediante una correcta ingesta de agua y fundamentalmente de sal. La corrección de la anemia y la hipoalbuminemia, evitar los fármacos antihipertensivos antes de la diálisis y evitar la ingesta antes y durante la diálisis son también medidas para tener en cuenta. Otras herramientas para mejorar la tolerancia hemodinámica en relación con la técnica de HD son: separar la ultrafiltración de la difusión, prolongar la duración de las sesiones y realizar sesiones más frecuentes, siendo estas dos últimas medidas de gran utilidad, ya que se ha visto que una tasa de UF de 13 ml/kg/h se asoció con una disminución en la tasa de eventos de IDH [6].
En Europa y muchos otros países, la hemodiafiltración (HDF) se ha convertido en la modalidad de HD de elección. Aunque las afirmaciones acerca de que esta modalidad mejora la mortalidad sigue siendo un tema de debate, la mayoría acepta que la HDF se asocia con una mejor estabilidad cardiovascular intradialítica e hipotensiones menos frecuentes, aunque esto también es discutido por algunos [7]. En cuanto al líquido de diálisis (LD), la alta concentración de sodio reduce la IDH, ya que reduce el desplazamiento de volumen desde el espacio intravascular al extravascular; sin embargo, esto puede conducir a una transferencia de sodio significativa, aumento de la sed después de la diálisis con el consiguiente aumento de peso y de la ingesta hídrica [8]. Se recomienda evitar LD con concentración baja de calcio, sin que se haya confirmado la necesidad de ajustar potasio, magnesio o glucosa. Sí que el LD con bicarbonato induce una mejora hemodinámica respecto al acetato, e incluso se están utilizando líquidos con citrato o cloro que eliminan totalmente el acetato y que pueden mejorar la tolerancia [9]. La temperatura corporal central aumenta durante los procedimientos de diálisis, lo que puede causar vasodilatación y disminución de la PA. Por ello se recomienda utilizar LD con temperaturas más bajas, aunque su eficacia es controvertida [10] (NAD: Monitores de hemodiálisis). Una revisión sistemática reciente de los ensayos controlados aleatorios con control activo de la temperatura corporal mediante BTM demostró reducciones significativas en la incidencia de IDH en comparación con la diálisis convencional [11]. Los avances tecnológicos actuales permiten una monitorización continúa del volumen sanguíneo (VS) intravascular con técnicas de biorretroalimentación, pero la mayoría vigilan el volumen sanguíneo relativo y no el absoluto [12]. Una disminución de VS superior al 15% durante una sesión de HD aumenta drásticamente el riesgo de IDH. Por otro lado, la IDH es inusual con una disminución de VS de menos del 5%. El control de UF por retroalimentación guiado por VS puede disminuir la frecuencia de IDH, aunque los datos de que la monitorización del VS pueda predecir la IDH o producir un beneficio de morbilidad y mortalidad a largo plazo, especialmente en la población en HD son limitados [13].
La midodrina, un agonista α1 selectivo oral, 5 a 10 mg, 30-60 minutos antes de la diálisis, puede ser una terapia preventiva útil en los pacientes con disfunción autonómica o hipotensión persistente, ya que, mejora la presión arterial intradialítica. La midodrina debe usarse con precaución en pacientes con ICC y en aquellos que usan betabloqueantes, digoxina y bloqueadores de los canales de calcio no dihidropiridínicos. Otros fármacos como la vasopresina, sertralina o carnitina se han descrito como beneficiosos, pero no existen evidencias [14].
2.HIPERTENSION INTRADIÁLISIS
La hipertensión arterial intradiálisis (HTAID) es el aumento de la PA durante la sesión de HD, un fenómeno que muchos describen como paradójico debido a que es contrario al que cabría esperar, sobre todo en aquellos pacientes a los que se les realiza ultrafiltración con depleción de volumen. No existe una definición aceptada de la HTAID, con criterios variables según los distintos estudios:
a) Incremento de la presión arterial media (PAM) ≥ 15 mmHg durante la sesión de HD [5] o en 2/3 de las últimas 12 sesiones [15]
b) Incremento de la presión arterial sistólica ≥ 10 mmHg durante la sesión de HD en 4/6 sesiones [16] [17]
c) Incremento de la presión arterial resistente a la ultrafiltración en más del 50% de las últimas 6 sesiones o durante 4 sesiones consecutivas [18] [19]
Tampoco se conoce su epidemiologia, ya que la prevalencia de la HTAID no ha sido sistemáticamente estudiada. Cuando se define la IDH como un aumento en la presión sistólica > 10 mmHg durante el curso del tratamiento, la HTAID ocurre en el 12% al 13% de los pacientes prevalentes [20].
Existen pocos datos sobre sus consecuencias, aunque parece que la HTAID constituye un importante factor de mortalidad CV, ya que se asocia con un mayor riesgo de hospitalización o muerte [21] [22]. Además de su efecto a largo plazo, esta situación nos obliga en muchas ocasiones a interrumpir precozmente la sesión de HD, a administrar fármacos antihipertensivos y a prolongar la estancia del paciente en la unidad de diálisis o en el hospital, con sus consecuencias inmediatas de infradiálisis, peor calidad de vida y mayor gasto sanitario.
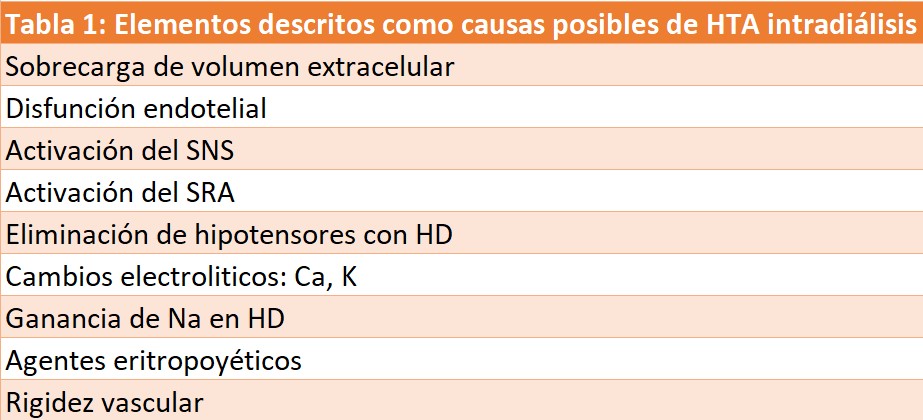
La fisiopatología no se conoce y probablemente sea multifactorial (Tabla 1): activación de los sistemas renina-angiotensina-aldosterona (SRAA) y nervioso simpático, disminución de la distensibilidad arterial, aumento de la producción de endotelina, disfunción de las células endoteliales y aumento de la resistencia periférica [23]. La eliminación de medicamentos antihipertensivos dializables también puede desempeñar un papel. Igualmente se han implicado a la sobrecarga de volumen subclínica, la ganancia de sodio durante la sesión de diálisis y el uso de agentes estimulantes de la eritropoyetina (AEE). Un estudio de Van Buren et al. [24] evaluó el papel del volumen extracelular (VEC) al final del tratamiento dialítico y encontró que los pacientes con HTAID presentaban proporciones más altas de VEC con respecto al agua corporal total y una mayor resistencia periférica total en comparación con los controles.
En cuanto al manejo terapéutico no existen estrategias claras. Suele intentarse un control estricto del VEC, con un ajuste del peso seco que puede precisar sesiones más largas o frecuentes. El ensayo Frequent Hemodialysis Network [25] observó un mejor control de la PA y una disminución en el número total de hipotensores con la reducción del peso seco. Una vez alcanzado el peso seco, si persiste la HTAID, se plantea optimizar el tratamiento farmacológico con bloqueantes del sistema nervioso simpático o del SRAA. Es preferible la administración de fármacos no dializables. El carvedilol se ha mostrado prometedor para reducir el número de episodios de HTAID, posiblemente a través del bloqueo de la endotelina 1 [26]. Sin embargo, el uso de agentes antihipertensivos complica alcanzar el peso seco y, además, si se usan fármacos vasodilatadores (hidralazina, minoxidil) pueden conducir a una mayor retención de líquidos que empeore la sobrecarga de volumen. Otras alternativas serían evitar rápidas correcciones de hemoglobina con AEE y reducir el sodio del LD [21].
3.ARRITMIAS
La aparición de arritmias cardiacas durante la HD constituye una complicación frecuente, siendo la fibrilación auricular (FA) la más frecuente de todas con una prevalencia del 13% al 27% [27].
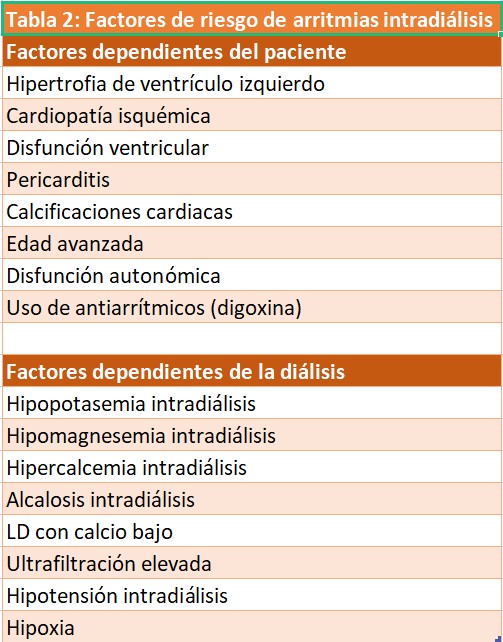
Existen múltiples factores predisponentes (Tabla 2). La presencia de patología cardiaca subyacente, especialmente la existencia de miocardiopatía hipertensiva, isquémica o hipertrófica, predisponen a su aparición. Por otro lado, existen factores dependientes de la HD que también pueden contribuir a la aparición de las arritmias, como los cambios bruscos en el potasio sérico, calcio, magnesio y pH séricos. La hipoxia y una ultrafiltración elevada también pueden desencadenar arritmias. Otro factor son los fármacos administrados como la digoxina (sobre todo en presencia de hipopotasemia), por lo que su administración en pacientes en HD ha de hacerse con precaución. En pacientes de riesgo, la eliminación gradual de potasio durante la diálisis mediante la técnica AFB-K, puede ser beneficiosa.
El cuadro clínico estará influenciado por la rapidez del inicio del trastorno del ritmo, el ritmo cardíaco y la patología cardiovascular preexistente. Los pacientes pueden estar totalmente asintomáticos, en cuyo caso se deberá completar su estudio y actuar sobre los factores que predisponen a su aparición. En los casos en que sean sintomáticos, se iniciará tratamiento específico, teniendo como objetivo mantener el control de la frecuencia cardiaca siguiendo las guías de práctica clínica [28]. Si se trata de una FA, el inicio de la anticoagulación se valorará en función del riesgo/beneficio de forma individualizada, ya que en comparación con la población general presentan más complicaciones hemorrágicas [29].
El paro cardiorrespiratorio y la muerte cardíaca súbita (SCD) también ocurren en casos muy graves [30] [31]. Aunque la implantación de un desfibrilador automático implantable (DAI) en pacientes en diálisis que se reanimaron después de un paro cardiorrespiratorio mejoró significativamente la tasa de supervivencia (el riesgo de muerte disminuye en un 42%) [32], un metaanálisis de los datos existentes en la literatura mostró que la tasa de mortalidad en los pacientes en diálisis con DAI es un 2,7% mayor que en los pacientes sin diálisis [33].
La parada cardiopulmonar durante la diálisis puede deberse a patología subyacente o a errores técnicos (embolia gaseosa, errores en la composición del LD o desconexión de línea entre otros). El aire en el dializado, la hemólisis o la hemorragia causada por la desconexión de la línea se pueden detectar fácilmente. Sin embargo, si no se puede identificar una causa obvia, la sangre no debe retornarse, sobre todo si el paro se produjo inmediatamente al inicio de la diálisis, a no ser que sea improbable que exista un problema con la composición del dializado. El manejo del paro cardiopulmonar durante la diálisis debe seguir los principios estándar de reanimación cardiopulmonar, siendo aconsejable que en las unidades de diálisis existan protocolos establecidos para el manejo del paro cardíaco y otras emergencias.
COMPLICACIONES NEUROMUSCULARES
Se repasan las complicaciones más frecuentes que pueden aparecer durante la sesión de HD y que también pueden revisarse en (NAD: Complicaciones por órganos y aparatos)
1.CALAMBRES
Los calambres son una complicación bastante frecuente apareciendo en un 5 al 20% de las sesiones. Se tratan de contracciones dolorosas de uno o varios músculos que se producen más frecuentemente al final de las sesiones y pueden anteceder a un episodio de hipotensión. Generan disconfort y dolor, lo que disminuye la calidad de vida además de que pueden provocar la interrupción de la sesión.
En la (Tabla 3) encontramos una clasificación etiológica. Su aparición se debe principalmente a la depleción intravascular por la ultrafiltración, aunque también pueden deberse a la hiponatremia, alcalosis, déficit de carnitina, hipomagnesemia o concentraciones elevadas de leptina. Los mecanismos patogénicos pueden relacionarse con la vasoconstricción y la defectuosa liberación de oxígeno al músculo en el contexto de hipotensión, así como con los cambios osmóticos y de los fluidos en las células musculares durante la HD. La acumulación de solutos urémicos, todavía no identificados, puede predisponer a los calambres musculares interdiálisis junto con una deficiencia de diversas sustancias nutricionales [34].
En el momento agudo, para revertir los calambres suelen infundirse 10 mL de suero hipertónico (al 10% o 20%) o 20 mL de glucosado al 50%. Si van acompañados de hipotensión suelen ceder con bolos de salino al 0,9% (lo más usado). Otras técnicas pueden ser el masaje sobre los músculos o la contracción isométrica de los mismos. La administración de L- carnitina puede ser beneficiosa ya que su déficit se ha propuesto como causa de calambres [35]. También la administración de vitamina E puede ser una alternativa, aunque con variable eficacia. Trabajos recientes muestran la eficacia de usar un líquido de diálisis con concentraciones de Mg altas (1.75 vs. 0.7 mEq/L) [36] aunque la revisión de Varghese y cols. [37] dicen que no hay datos suficientes. Finalmente, según algunos autores, la suplementación oral con vitamina K2 (360 µg/d) podría disminuir la frecuencia, duración y gravedad de los calambres [38].
Tan importante como el tratamiento es la prevención. Para ello se recomienda:
1.Primordial evitar hipotensiones (diálisis lentas, de mayor duración o más frecuentes) y depleción de sodio.
2.“Educar” al paciente para disminuir las ganancias de peso e intentar tasas de UF bajas.
3.Revisar y controlar el ‘’peso seco’’ rutinariamente.
4.Estimar el balance de sodio y no solo de agua.
5.Uso de sustancias miorrelajantes como diazepam una o dos horas antes de la sesión.
6.Tratar el déficit de carnitina con suplementos en malnutridos, nPCR baja y Kt/V adecuado.
7.Administración de vitamina E por vía oral [39].
2.SINDROME DE DESEQUILIBRIO
El síndrome de desequilibrio se caracteriza porque aparecen cambios en el estado neurológico desde convulsiones generalizadas o coma (que han disminuido por el inicio precoz de la diálisis), a síntomas leves, como náuseas, vómitos, cefalea, fatiga e inquietud. Los factores de riesgo son el primer tratamiento de diálisis, BUN prediálisis muy elevado (no hay valor de corte predecible), acidosis metabólica grave, hiperosmolaridad debida a hiperglucemia o hipernatremia, edades extremas (muy viejos o muy jóvenes), enfermedades neurológicas preexistentes tales como apoplejía, trastorno convulsivo, hipertensión maligna, o condiciones preexistentes que conducen a una mayor permeabilidad de la barrera hematoencefálica, como encefalitis, meningitis, síndrome urémico hemolítico o vasculitis [40].
Los síntomas se cree que están causados por el movimiento del agua hacia el cerebro provocando edema cerebral. Existen varias teorías de la patogenia, estando la primera más fundamentada [41] [42]:
-Cambio osmótico inverso: la hemodiálisis elimina rápidamente pequeños solutos como la urea. La reducción de la urea en sangre reduce la osmolalidad del plasma, creando así un gradiente osmótico transitorio que promueve el movimiento del agua hacia el interior de las células. En el cerebro, este cambio de agua produce edema cerebral. Esto ha sido demostrado por experimentos en ratas urémicas. Además, estudios en animales han sugerido que en el contexto de la uremia puede haber una disminución de los transportadores de urea y un aumento de los canales de agua que pueden potenciar este gradiente osmótico [43] [44].
-Acidosis intracerebral: existiría una disminución del pH cerebral por un aumento en la producción de ácidos orgánicos (a través de un mecanismo poco claro) que comprometería la capacidad del cerebro para regular el transporte de agua y solutos dando como resultado el movimiento de agua hacia el cerebro.
-Los solutos no identificados generados en la corteza cerebral conocidos como “osmoles idiogénicos” pueden preservar la osmolalidad intracerebral lo que produce edema cerebral [45].
Cuando iniciar la diálisis y cuidar la prescripción que hacemos son claves para prevenir este síndrome. Se recomienda un URR del 40%–45% en 2 h y una disminución de la osmolaridad plasmática inferior a 24 mosm/kg/24 h. Para lograrlo en los 2 o 3 primeros tratamientos se podría [46]:
1) prescribir tiempos de tratamiento más cortos, de 1,5 a 2 horas;
2) disminuir el flujo sanguíneo a 150 o 250 ml/min;
3) reducir el flujo del líquido de diálisis y utilizar un flujo concurrente
4) elegir un dializador de pequeña superficie (0.9-1.2 m2)
5) control del pH
También pueden ayudar aumentar la concentración de sodio del dializado o la administración de manitol intravenoso o incluso considerar técnicas de reemplazo continuo en pacientes con alto riesgo de síndrome de desequilibrio: trauma cerebral, hemorragia intracraneal, masa cerebral…
Si se presenta un episodio agudo de notable alteración del estado mental o convulsiones, se recomienda la finalización inmediata del tratamiento y el uso de manitol o salino hipertónico.
3.CONVULSIONES
En el capítulo (NAD: Complicaciones por órganos y aparatos) se revisan las convulsiones. La (NAD: Complicaciones por órganos y aparatos) (Tabla 8) recoge las causas más frecuentes.
La evaluación de una convulsión de inicio reciente es similar a la de los pacientes que no están en diálisis. Las causas relacionadas con la enfermedad renal o al tratamiento con hemodiálisis son: encefalopatía urémica, síndrome de desequilibrio de diálisis, inestabilidad hemodinámica intradiálisis, demencia por diálisis asociada al aluminio, embolia gaseosa, hipoglucemia, hipocalcemia e hiponatremia. Otras causas de convulsiones, como se ha dicho, son similares a las de la población general, pero pueden ser más comunes entre pacientes en hemodiálisis, por ejemplo, la enfermedad cerebrovascular (infarto, embolia cerebral, hemorragia y hematoma subdural) o son más vulnerables a las convulsiones inducidas por medicamentos como el carbapenem y ertapenem debido a que su depuración puede estar marcadamente reducida.
El tratamiento de emergencia de las convulsiones es:
Detener la diálisis, infundir suero y oxigenoterapia.
Proteger el acceso vascular de daños durante la convulsión.
Asegurarse de que se encuentre en un entorno seguro y sin riesgo de lesiones. Si es posible, colocarlo de lado y no poner nada en la boca durante la convulsión activa.
Si no hay respuesta rápida pueden administrarse benzodiacepinas iv y luego determinar el tratamiento a seguir.
Se deben tomar muestras de sangre para ver glucosa, calcio, sodio, magnesio y otros electrolitos, cuyos trastornos pueden ser la causa subyacente de la convulsión. Debe administrarse glucosa IV si se sospecha hipoglucemia, junto con tiamina IV, particularmente en individuos en riesgo (p. ej., antecedentes de consumo excesivo de alcohol).
Una vez que los pacientes han sido tratados por convulsiones y se ha detenido la diálisis, la evaluación de las convulsiones es la misma para los pacientes en diálisis que para los demás pacientes. Las posibles causas que deben excluirse incluyen la propia uremia, el hematoma subdural, los trastornos metabólicos (hiponatremia, hipoglucemia) y la encefalopatía inducida por fármacos y excluirse las causas que no son específicas de los pacientes en diálisis [47].
4.CEFALEA
En el capítulo (NAD: Complicaciones por órganos y aparatos) se revisa la cefalea. La prevalencia de cefalea oscila de 27 al 73% según criterios. Es una complicación habitual que puede causar mala adaptación [48] [49] [50].
Se suele definir como la cefalea que comienza o cambia de patrón cuando se inicia el tratamiento de diálisis. Inicialmente se describió como un dolor bifrontal leve, que también podía localizarse en región frontotemporal, y que a menudo pasaba a ser intenso y punzante, generalmente empeorando en la posición reclinada. Cuando es intenso puede acompañarse de náuseas y vómitos. Según otros autores puede ser palpitante o con patrón de migraña. En la mayoría de los casos comienza después de la segunda hora de diálisis y dura menos de 4 horas.
Es importante evaluar la presencia de cefaleas preexistentes (migraña y cefalea tensional), que son prevalentes ya que este grupo muestra mayor riesgo de desarrollar cefalea por hemodiálisis. De todos modos, un estudio mostró que el 6,7% de las cefaleas son “primarias” (sin cefalea previa al programa de HD). En este último estudio, la cefalea fue difusa, más bien de localización temporal, bilateral, pulsátil y de intensidad moderada [51].
Su aparición se ha asociado a depresión [52], hipertensión, cambios electrolíticos bruscos, síndrome de desequilibrio, descenso de serotonina o renina, alcalemia…, es decir una miríada de sucesos que pueden contribuir.
El diagnóstico es clínico y su tratamiento se basa, además de en la corrección de la causa, en analgésicos como el paracetamol o el metamizol (preferiblemente vía oral). Hay autores que proponen ajustar frecuencia y tiempo sobre todo en pacientes con un BUN o PA elevada pre-diálisis [48], cambiar a hemodiafiltración o dar cafeína intradiálisis, pero ninguna de estas medidas se ha mostrado perfectamente eficaz [53].
5.SINDROME DE PIERNAS INQUIETAS
El síndrome de piernas inquietas es común en los pacientes en hemodiálisis (NAD: Complicaciones por órganos y aparatos). Se trata de una sensación de incomodidad con necesidad de movimientos compulsivos de las piernas. Su prevalencia es mayor que en la población general con una gran variabilidad que va del 6-60%. Los síntomas empeoran durante la noche y pueden hacerlo durante la hemodiálisis. El déficit de hierro o de su transporte al sistema nervioso central parece estar relacionado con la aparición del síndrome al igual que la disfunción de los neurotransmisores dopaminérgicos y de glutamato.
Como tratamiento farmacológico son de utilidad el hierro, levodopa, gabapentina, opioides y benzodiacepinas. El clonazepam es el más agente usado. La administración, de 1 a 2 mg/día, puede mejorar los trastornos del sueño, pero puede causar ataxia, depresión respiratoria, reacciones paradójicas, y drogodependencia. La gabapentina modula la dopamina, norepinefrina y serotonina y disminuye los síntomas de piernas inquietas. Se recomiendan de 100 a 300 mg por sesión de diálisis. El pramipexol también ha mostrado su eficacia en el tratamiento. Se comienza con 0.125 mg/día con una titulación lenta ya que tiene excreción renal. Tienen múltiples efectos secundarios. También se ha probado con tramadol y con suplementos de vitamina C.
Además, debe hacerse un tratamiento no-farmacológico. Lo primero es revisar los fármacos ya que los síntomas se agravan con antidepresivos, litio, antieméticos bloqueantes de dopamina (metoclopramida), cafeína o antihistamínicos centrales. Dormir bien, masaje de piernas, aromaterapia, reflexología, ejercicio aeróbico moderado, actividades mentales como juegos de vídeo y crucigrama, y ejercicios de estiramiento (que es muy útil ya que se enfoca en la extremidad inferior) son consideradas intervenciones no farmacológicas que pueden ser beneficiosas para minimizar la gravedad. Usar un líquido de diálisis más bien frío (35.5ºC) puede mejorar la sintomatología al reducir la sensibilidad de la terminación nerviosa.
De todos estos tratamientos, decir que un metanálisis reciente concluye en la gabapentina y usar un líquido de diálisis más frío son los más útiles. El estiramiento muscular intradiálisis sería la segunda medida no farmacológica más eficaz [54] [55] [56] [57].
COMPLICACIONES HEMATOLOGICAS
1.ACTIVACION DEL COMPLEMENTO Y NEUTROPENIA
Durante la diálisis con dializadores de celulosa no sustituidos, que ahora se usan con poca frecuencia, los grupos hidroxilo libres presentes en la membrana provocan la activación de la vía alternativa del complemento (en concreto C3 y C5) [58], lo cual conduce a la activación y adherencia de los neutrófilos circulantes a la vasculatura pulmonar, produciendo una neutropenia transitoria dentro de los primeros 2 a 15 minutos de tratamiento. Esto se sigue de una leucocitosis de rebote una hora después. La activación del complemento y la neutropenia también se han descrito con otras membranas, como el acetato de celulosa y polisulfona, pero con una menor incidencia. La importancia clínica de la leucopenia transitoria sigue sin estar clara, pero suele autolimitarse.
2.HEMÓLISIS AGUDA
En cada tratamiento de HD por el trauma mecánico de los glóbulos rojos se produce algún grado de hemólisis. Una hemólisis aguda grave puede producirse por (Tabla 4) [59]:
1.Problemas mecánicos en las bombas o por líneas defectuosas, que producen una excesiva fragmentación de los hematíes
2.Cambios en el dializado:
a.Composición química inadecuada que produzca una hemólisis osmó tica
b.Aumento de temperatura
c.Contaminación por sustancias químicas como el formaldehído, las cloraminas, la lejía y el cobre.
Gracias al diseño de los nuevos equipos de diálisis y al uso generalizado de sistemas de ósmosis o desionización y filtros de carbón, la fragmentación traumática de glóbulos rojos (RBC) causada por bombas de sangre mal diseñadas, así como, la metahemoglobinemia causada por la contaminación del agua por cloraminas o cobre, rara vez se ven hoy en día.
Los signos y síntomas de la hemólisis pueden ser sutiles y simular una anemia de causa no aclarada y resistencia a la AEE. En los casos graves, se manifiesta con disnea, dolor torácico, náuseas, vómitos, dolor abdominal y de espalda, hipotensión y cianosis. La metahemoglobinemia puede visualizarse: las líneas sanguíneas pasan a ser de color marrón oscuro a medida que la haptoglobina se agota y se une a la hemoglobina, dejando libre de metahemoglobina.
Los biosensores de volumen, que basan su medición en el hematocrito ó hemoglobina, son también capaces de detectar eventos importantes de hemólisis como una caída inesperada en el VS.
La aparición de síntomas graves e inexplicables siempre ha de hacer sospechar hemólisis, y en ese caso, debe interrumpirse inmediatamente la diálisis sin retornar la sangre. Se obtendrá un análisis urgente que incluya hemograma, Na, K, CPK, GOT, GPT, así como, recuento de reticulocitos, haptoglobina, lactato deshidrogenasa (LDH), frotis de sangre, prueba de Coombs, medición de metahemoglobina, y es recomendable pedir pruebas cruzadas por si el paciente precisara una transfusión. Más importante aún, se recomienda comprobar la temperatura del LD y tomar muestras de este, para comprobar su composición, osmolaridad y pH, y descartar la presencia de cloraminas, desinfectantes, contaminantes o metales, así como un examen exhaustivo de las líneas en busca de bucles o acodamientos.
3.HEMORRAGIA
Los pacientes en diálisis presentan un riesgo aumentado de sangrado por la disfunción plaquetaria inducida por la uremia, a lo que contribuyen factores como la anemia, el aumento de la producción vascular de prostaciclina (prostaglandina) y óxido nítrico (potente inhibidor de la agregación plaquetaria), la disminución del factor Von Willebrand, e incluso el propio estrés mecánico que sufre la sangre durante la diálisis y que, ocasiona un consumo de las plaquetas jóvenes y aún activas. Por otra parte, el uso de medicamentos como los antiagregantes plaquetarios, sobre todo la terapia dual, de antagonistas orales de la vitamina K y los nuevos anticoagulantes que están comenzado a utilizarse [60], pueden aumentar el riesgo de hemorragia. Además, las complicaciones hemorrágicas pueden estar relacionadas con el uso de anticoagulación intradialítica, generalmente heparina. De ahí, la importancia de individualizar la dosis y pauta de anticoagulación, debiendo usarse la mínima dosis que sea capaz de mantener la cámara venosa y el dializador limpios durante toda la sesión y que al finalizar la sesión se pueda hacer hemostasia de los sitios de punción del acceso vascular en un tiempo prudencial.
Por estas razones, los pacientes en diálisis son propensos a sufrir hemorragias espontáneas en sitios específicos, como malformaciones arteriovenosas gastrointestinales, ectasias gástricas, úlceras duodenales, hematoma subdural, derrame pericárdico o pleural, hematoma retroperitoneal y subcapsular hepático o en la cámara anterior ocular.
El tiempo de sangrado, una medida de la interacción plaqueta-pared del vaso, sigue siendo la prueba más utilizada para evaluar plaquetas, sin embargo, es un mal predictor de hemorragia [61].
El manejo de las complicaciones hemorrágicas implica estabilizar al paciente con líquidos y transfusiones según sea necesario, pero es imperativo revertir la disfunción plaquetaria urémica. Las estrategias incluyen el uso de AEE o transfusiones de glóbulos rojos para lograr un hematocrito superior al 30%, para mejorar así la reología de los vasos plaquetarios. La desmopresina, por vía intravenosa o intranasal, a dosis de 0,3 mcg/kg, es capaz de mejorar los tiempos de sangrado durante varias horas con inicio rápido de acción. Estrógenos orales y conjugados intravenosos también mejoran los tiempos de sangrado [62]. Otros tratamientos incluyen recombinantes de factor VII y crioprecipitado [63].
En los pacientes con alto riesgo hemorrágico es aconsejable considerar la HD sin heparina, utilizando lavados de suero salino cada 15 a 30 minutos con ajustes de ultrafiltración. Otras alternativas, serían la anticoagulación regional con citrato o prostaciclina. Más recientemente, el uso de dializadores unidos a heparina (Evodial®) [64], o del líquido de diálisis que contiene citrato se han recomendado en pacientes con riesgo de hemorragia. No hay que olvidar que la diálisis adecuada puede tratar y prevenir la disfunción plaquetaria.
En los pacientes con cirugía programada debe considerarse el cese o reducción de dosis de fármacos que faciliten el sangrado, mantener el hematocrito > 30% y, en algunos casos, la desmopresina profiláctica.
En el caso de que existan problemas de coagulación en los puntos de punción de la fístula tras la presión digital continúa durante 15-20 minutos, se pueden emplear apósitos con colágeno, intentar redistribuir la dosis de heparina sódica y revisar problemas del acceso vascular.
4.TROMBOPENIA
La trombopenia inducida por heparina (TIH) tipo II es una complicación grave inmunomediada por heparina. Es un fenómeno cuya incidencia no se conoce, y aunque una cohorte japonesa ha comunicado un 4% [65] , en Reino Unido otro trabajo describió una prevalencia de 0,26 por 100 pacientes y una incidencia de 0,32 por 100 pacientes [66].
La fisiopatología de la TIH implica la formación de autoanticuerpos frente al PF4 o al complejo heparina-PF4, lo que lleva a la activación plaquetaria y al aumento del riesgo de trombosis. Los hallazgos incluyen una rápida caída de plaquetas a <60.000 /mm3 (de 4 a 14 días tras la exposición), trombosis venosa o arterial, y, con menos frecuencia, sangrado. El diagnóstico debe considerarse si tras recibir heparina las plaquetas descienden un 50%, teniendo en cuenta que la ausencia de anticuerpos no excluye el diagnóstico. Estos pacientes deben evitar todas las heparinas, y necesitan anticoagulantes alternativos: argatroban, danaparinoide, bivalirudina o lepirudina. Tras la retirada de la heparina la trombopenia se resuelve en 5 a 7 días.
Existe también la TIH tipo 1 que se caracteriza por: no estar mediada por anticuerpos, el recuento de plaquetas suele ser mayor a 100000/mm3 y aparece a de 1 a 4 días después del inicio de la heparina. Se da entre un 10 a 20% de los pacientes sin consecuencias clínicas y se resuelve espontáneamente sin retirar la heparina.
COMPLICACIONES PULMONARES
1.HIPOXEMIA ASOCIADA A DIÁLISIS
En la mayoría de los pacientes, la PaO2 arterial disminuye de 5 a 30 mm Hg durante la diálisis, alcanzando un pico entre los 30 y 60 minutos, y resolviéndose entre 60 y 120 minutos después de la interrupción de la diálisis. Esta disminución generalmente no tiene importancia clínica a menos que haya enfermedad cardiopulmonar crónica preexistente en los que la hipoxia puede llegar a ser sintomática.
La hipoventilación es el principal factor implicado y tiene un origen fundamentalmente central. Se debe a: 1) la disminución de dióxido de carbono por menor producción, cuando se usan LD con acetato o por pérdidas a través del dializador y 2) la alcalinización rápida de los fluidos corporales (particularmente con dializadores de gran superficie). Otros factores implicados son la fatiga de los músculos respiratorios inducida por acetato y la alteración en la relación ventilación-perfusión causada por el secuestro pulmonar de leucocitos debido a la activación del complemento o por bajo gasto cardíaco.
Las implicaciones a largo plazo no están claras. En un estudio retrospectivo de cohorte los pacientes hipoxémicos tenían mayor mortalidad, pero este grupo tenía más comorbilidades [67].
En pacientes de riesgo es importante su prevención ya que es una causa de mala tolerancia a la HD. Las medidas preventivas consisten en: corregir las causas subyacentes como la anemia y la sobrecarga de volumen, el uso de baños con bicarbonato, membranas biocompatibles y aportes de oxígeno intradiálisis cuando los pacientes están sintomáticos o cuando las saturaciones de oxígeno son inferiores a 92%. En cualquier caso, se evitará la alcalosis metabólica, pues puede agravar la hipoxemia, al favorecer la hipoventilación.
COMPLICACIONES RELACIONADAS CON LA TÉCNICA
1.EMBOLISMO AÉREO
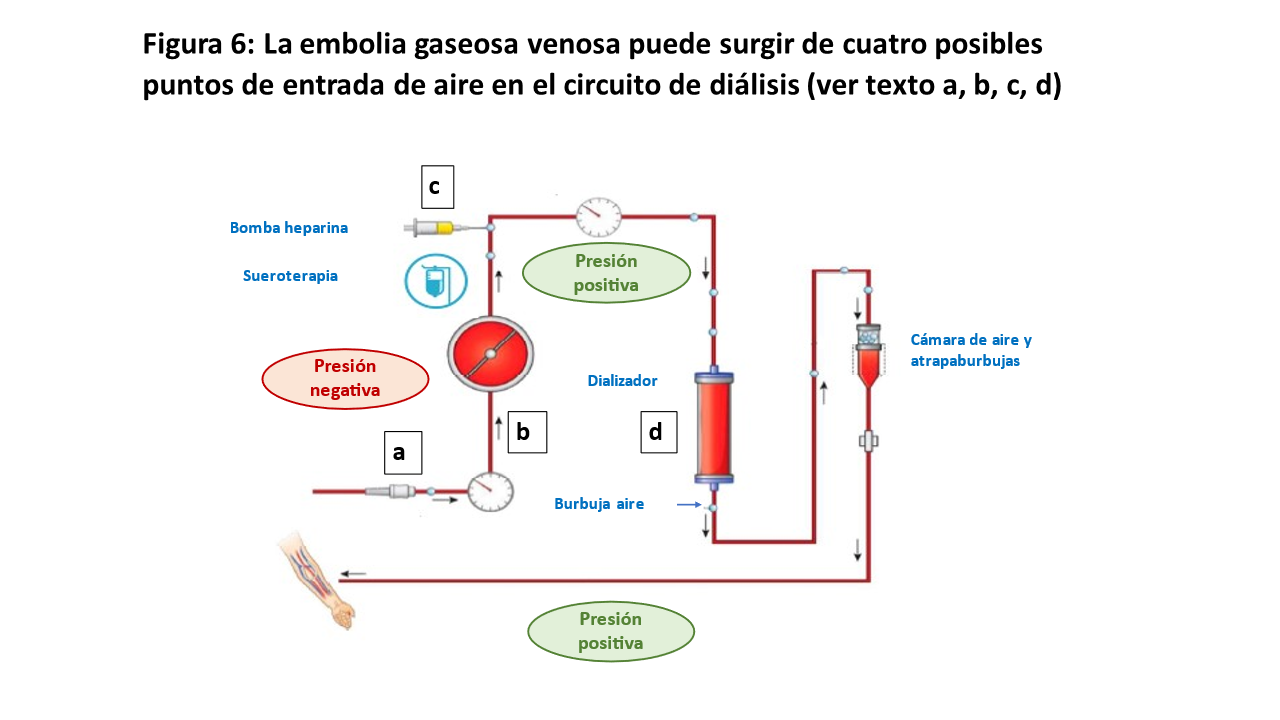
Gracias a las medidas de seguridad de las máquinas de HD modernas, la embolia gaseosa sintomática es extremadamente rara en la actualidad. La embolia gaseosa venosa puede surgir de cuatro posibles sitios de entrada de aire en el circuito de diálisis:
a.Una conexión rota o suelta entre la aguja arterial y la línea de sangre, ya que este segmento tiene presión intraluminal negativa
b.Un orificio en la línea de sangre arterial
c.Durante la administración de anticoagulación, infusiones intravenosas sobre todo si son de cristal, o manipulación de catéteres
d.Un cebado inadecuado puede provocar la entrada de aire desde el dializador.
Una rotura en la línea de sangre venosa no provocará la entrada de aire debido a la presión intraluminal positiva. El aire que pasa al circuito llega a la cámara venosa y forma espuma o burbujas en la parte superior. Cuando el nivel de sangre en la cámara cae, inmediatamente se activa una alarma y detiene el flujo sanguíneo de retorno. Como consecuencia, la embolia gaseosa venosa se produce por fallo en este sistema o por error humano (Figura 6)
Las manifestaciones clínicas dependen del lugar, volumen y velocidad del aire introducido, y de la posición del paciente. Si el paciente está sentado, el aire va a la circulación cerebral y puede producir convulsiones, coma o accidente cerebrovascular. Si está en decúbito supino, el aire se dirige al ventrículo derecho y de ahí al pulmón, pudiendo producir fallo cardiaco y sintomatología respiratoria como tos, disnea o incluso parada cardiorrespiratoria.
La prevención se basa en utilizar máquinas de diálisis equipadas con atrapa burbujas y detectores de aire ubicados detrás del dializador, y la HD nunca debería realizarse sin un sistema de alarma de detección de aire. Deben evitarse la administración de medicación o sueroterapia en botellas de vidrio porque crean efectos de vacío que pueden permitir la entrada de aire en el sistema extracorpóreo. Los catéteres de diálisis deben aspirarse y lavarse, y en el dializador deben eliminarse las burbujas de aire que pudiesen quedar antes de la conexión.
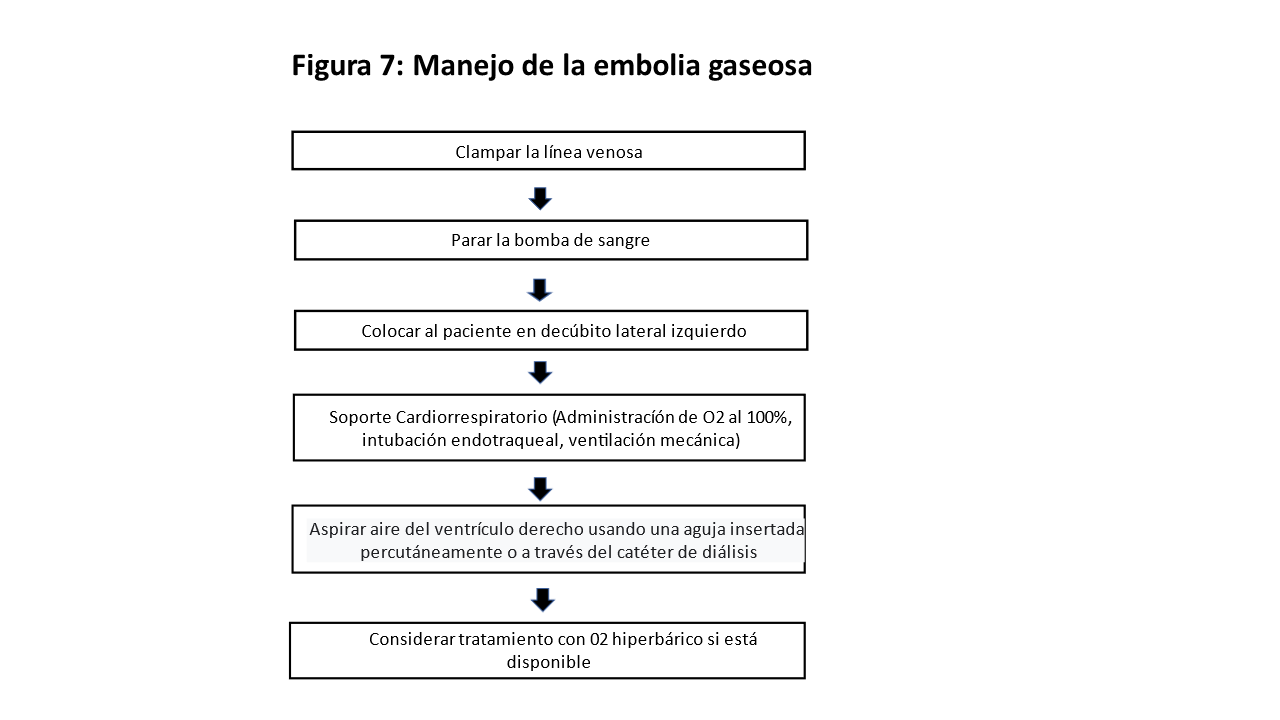
El manejo inmediato de la embolia gaseosa clínicamente sospechada se resume en la (Figura 7).
2.LIQUIDO DE DIÁLISIS INCORRECTO
La composición final del dializado resulta de una dosificación precisa de agua purificada, concentrados de electrolitos y buffer. Si es incorrecta puede inducir alteraciones electrolíticas y del equilibrio ácido-base graves.
Los monitores actuales disponen de alarmas de conductividad de forma que, si la conductividad está fuera del rango establecido se detiene el flujo del LD. Sin embargo, estas alarmas pueden fallar o estar ajustadas incorrectamente, o incluso una composición del dializado incorrecta dar una conductividad adecuada. Por eso, es importante llevar un chequeo de la composición del dializado cuando una máquina se haya esterilizado o movido, o cuando se utiliza un nuevo concentrado, es decir, el control humano de los parámetros siempre debe llevarse a cabo.
a.Hipernatremia
La hipernatremia ocurre cuando la proporción entre el concentrado y el agua es incorrecta y los monitores de conductividad o alarmas no funcionan correctamente.
La hiperosmolalidad da como resultado la deshidratación celular y las manifestaciones clínicas incluyen sed, dolor de cabeza, náuseas, vómitos, convulsiones, coma y muerte. El tratamiento incluye cese de diálisis, hospitalización e infusión de suero glucosado al 5%. La diálisis debe reanudarse con una máquina diferente; con una concentración de sodio en el dializado 2 mmol/l más bajo que el plasma, pero no superior, porque gradientes superiores predisponen al desarrollo de síndrome de desequilibrio.
b.Hiponatremia
La hiponatremia se produce por los mismos motivos que la hipernatremia. La hipoosmolaridad causa hemólisis con hiperpotasemia y hemodilución de todos los componentes del plasma. Los síntomas incluyen dolor torácico, cefalea, náuseas, vómitos, calambres incluso convulsiones. El tratamiento consiste en pinzar las líneas y desechar la sangre hemolizada en el circuito extracorpóreo. El oxígeno de alto flujo y la monitorización cardíaca son imprescindibles debido a la hiperpotasemia y la posible lesión miocárdica. Se debe reiniciar la diálisis con un LD con bajo contenido de potasio. La corrección de la concentración sérica de sodio no debe superar los 1 a 2 mmol/l/h, aunque se han comunicado correcciones mayores sin problemas.
c.Acidosis metabólica
Aunque la acidosis metabólica intradiálisis suele asociarse a problemas técnicos, bien por equivocación con los concentrados de diálisis o bien por fallos en el monitor, deben descartarse otras causas como la cetoacidosis diabética o alcohólica, acidosis láctica, ingestión de tóxicos, fármacos o las pérdidas digestivas producidas por la diarrea. El diagnóstico suele sugerirse por el inicio agudo de hiperventilación durante la HD y confirmado mediante la realización de gasometría. El tratamiento consiste en la corrección de la causa subyacente y el uso de dializado de bicarbonato con una concentración elevada.
d.Alcalosis metabólica
La alcalosis metabólica intradialítica es rara pero no menos importante. La causa más común es la pérdida de ácido clorhídrico como resultado de vómitos o succión nasogástrica, sin olvidar posibles fuentes de álcali añadido. Los síntomas no suelen aparecer hasta que se alcanzan cifras de bicarbonato superiores a 33 mEq/L y consisten en cefalea, confusión, tetania, convulsiones e incluso coma. En los pacientes con patología de base cardiorrespiratoria, puede provocar hipoventilación e hipoxia. El tratamiento consiste en disminuir la concentración de bicarbonato en el LD.
e.Mal funcionamiento de la temperatura del monitor
El mal funcionamiento del termostato en la máquina de diálisis puede resultar en la producción de dializado excesivamente frío o caliente. Mientras que el dializado frío no es peligroso y puede tener efectos hemodinámicos beneficiosos, el dializado sobrecalentado puede causar hemólisis inmediata e hiperpotasemia potencialmente mortal. En tal caso, la diálisis debe interrumpirse inmediatamente desechando la sangre del circuito, y realizar una analítica urgente para descartar hemólisis e hiperpotasemia.
3.PÉRDIDA DE SANGRE
La desconexión de un acceso de diálisis a la máquina puede provocar una hemorragia potencialmente fatal. Normalmente, la alarma de presión alertará al personal porque la resistencia cae rápidamente. Sin embargo, la salida de una aguja arterial o venosa puede no hacer sonar una alarma de presión si la aguja de pequeño calibre es la fuente de la resistencia. La ruptura de la membrana de diálisis a consecuencia de una alta presión transmembrana, es otra causa grave de hemorragia. El detector de sangre detectará hemoglobina en el dializado y alertará al personal.
4.COAGULACION DEL CIRCUITO
La coagulación del circuito extracorpóreo durante la diálisis es un problema común, que puede provocar la pérdida de 200 a 300 ml de sangre y que tiene muchas causas subyacentes. Los factores técnicos incluyen un cebado inadecuado o deficiente, lo que da como resultado la presencia de aire en el dializador. La dosis de carga incorrecta de heparina, un lapso insuficiente después de la dosis de carga de heparina para que ocurra la anticoagulación sistémica, el ajuste incorrecto de la bomba de infusión y la falta de liberación de la pinza de la línea de heparina, son importantes causas corregibles que también han de tenerse en cuenta. La HBPM se usa como un solo bolo al comienzo de diálisis, pero es posible que no mantenga la anticoagulación si el tratamiento dialítico se prolonga (por ejemplo, diálisis nocturna). Problemas relacionados con el acceso vascular debido a un flujo sanguíneo inadecuado, la recirculación del acceso o la interrupción frecuente del flujo sanguíneo también puede provocar la coagulación (Figura 8)
La gestión inmediata requiere el reconocimiento de la causa subyacente y la implementación de acciones correctores, incluido el ajuste continuo de la dosis de heparina, incluso, la revisión del acceso vascular.
REACCIONES EN DIÁLISIS
1. REACCIONES ALÉRGICAS:
Dentro de la sesión de diálisis pueden acaecer reacciones alérgicas o de hipersensibilidad ya sean al dializador, a fármacos u otras sustancias [68]. Es importante saber clasificar las diferentes reacciones según:
- La gravedad de la clínica: podemos encontrar desde cuadros leves a muy graves:
1. Prurito, reacción vasomotora, eritema, edema facial, rinorrea, conjuntivitis.
2. Náuseas, vómitos y dolor abdominal.
3. Dolor: torácico o de espalda.
4. Disnea, tos, broncoespasmo, taquipnea, estridor laríngeo o cianosis.
5. Shock, parada cardíaca.
- Momento en que se inician y evolución: más frecuentes al inicio o durante la primera hora.
- Utilización del dializador:
a.Primer uso: Sobre todo se relacionan con el óxido de etileno, esterilizante que hoy está en desuso, ya que se ha sustituido por rayos gamma o vapor de agua. El compuesto quedaba entre las fibras del dializador y al mezclarse con la albúmina sanguínea actuaba como alérgeno. Se podían encontrar anticuerpos IgE contra este compuesto en dos tercios de los pacientes con reacciones de este tipo e incluso en un 10% de los pacientes sin historia de reacciones. Una correcta perfusión de los dializadores de 1 - 2 L sería suficiente para evitar estos cuadros.
b.Reuso: Relacionada con otros desinfectantes utilizados en la reprocesamiento del dializador: formaldehido, glutaldehido… Son reacciones mediadas por anticuerpos IgE específicos que a veces se pueden detectar.
- Según factor desencadenante:
1. Desinfectante mal aclarado.
2. Esterilizante del dializador o las líneas: como el óxido de etileno ya comentado.
3. Reacciones de hipersensibilidad con relación al circuito extracorpóreo (como la membrana del dializador) (NAD: Reacciones alérgicas a las membranas sintéticas)
4. Asociación de membranas con carga negativa e IECA (mediada por bradicinina): la asociación de membranas de poliacrilonitrilo (AN69) y el tratamiento con inhibidores de la enzima de conversión de la angiotensina (IECA) pueden desencadenar una reacción anafiláctica mediada por bradicininas. La principal expresión clínica suele tratarse de un cuadro respiratorio precoz. La carga negativa de la membrana promueve la activación del factor XII (paso de precalicreína a calicreína) aumentando la producción de bradicininas. Los IECA a su vez impiden la degradación de estas prolongando el cuadro.La solución actual ha sido eliminar las cargas negativas de estas membranas de AN69 para evitar esta reacción.
5. Activación del complemento por membranas celulósicas.
6. Contaminantes del líquido de hemodiálisis.
7. Inducidas por fármacos intradiálisis: heparina, hierro, antibióticos…
8. Asociadas al reúso: esterilizante, contaminación.
2. REACCIONES A FÁRMACOS:
Se han descrito en un 0,6-1% de pacientes en HD reacciones con relación a la perfusión de hierro intravenoso, sobre todo con hierro dextrano de alto peso molecular o con la administración de altas dosis de hierro. Cursa con síntomas menores como prurito, rubor o artralgias y mialgias, pero puede llegar a hipotensión y colapso cardiovascular.
Otro grupo de fármacos, ya comentado, es la posible hipersensibilidad a heparinas, que siempre hay que tener en mente.
3.TRATAMIENTO:
Si se trata de una reacción grave (síntomas respiratorios, inestabilidad hemodinámica, dolor torácico…) y aparece justo al conectar al paciente al circuito sanguíneo extracorpóreo se debe interrumpir la diálisis sin retornar la sangre e infundir suero salino, además de tratar con esteroides y antihístamínicos intravenosos. Si fuera necesario iniciar medidas de soporte cardiorrespiratorias.
En caso de shock usaremos la adrenalina y se hará manejo de shock anafiláctico. En casos más leves, tardíos o poco agresivos se puede continuar con la sesión de diálisis tratando al paciente con corticoides o antihistamínicos.
MISCELÁNEA
1.PRURITO
(NAD: Complicaciones por órganos y aparatos)
Síntoma muy frecuente, aunque la prevalencia comunicada es muy variable, que puede afectar a la calidad de vida. La evaluación de la intensidad es compleja al tratarse de un síntoma subjetivo, y la herramienta más usada para evaluarlo es la escala visual analógica del prurito. Esta escala va del 0 al 10, donde 0 es la ausencia de picor y 10 es el mayor picor imaginable.
Tradicionalmente se ha relacionado con alteraciones en el metabolismo calcio/fósforo, la malnutrición, la afectación de las neuronas sensitivas aferentes primarias o interneuronas, los cambios continuos en el estado de hidratación que favorecen la xerosis, adecuación de diálisis y la más importante la desregulación del sistema opiode. Se hipotetiza que en los pacientes con ERC existe un desequilibrio entre los receptores de opioides μ y κ, que son antagonistas entre sí, con un disbalance en favor de los receptores μ. Aunque se desconoce el mecanismo exacto, el prurito es un efecto adverso común tras la administración de agonistas μ, y podría estar mediado por la modulación de la transmisión serotoninérgica, la activación de la asta dorsal y del centro del picor en el sistema nervioso central [69] [70].
Así habrá que diferenciar entre las causas provocadas por la propia enfermedad renal crónica y las desencadenadas por la diálisis, de modo que tendríamos el prurito que aparece o aumenta durante la sesión de hemodiálisis o el que es continuo o con predominio nocturno:
- Los primeros suelen ser reacciones de hipersensibilidad a componentes de la diálisis y se diagnostican con la eosinofilia o IgE aumentada. Responden bien a antihistamínicos.
Otros factores que pueden provocar prurito son: la alcalosis y la hipercalcemia.
- En el caso de pruritos continuos o fuera de la sesión hay que tener en cuenta:
* La dosis de hemodiálisis que recibe el paciente (si límite o baja aumentar) por si se trata de mala depuración de sustancias urémicas.
* Hiperpartiroidismo.
* Sequedad o xerosis en la piel.
En el abordaje terapéutico se incluyen tratamientos tópicos (emolientes, tacrolimus), filtros de diálisis, fototerapia, gabapentina, cromoglicato, difelikafalin, montelukast, mitazapina, sertralina, antihistamínicos, naltrexona, nalfurafina, ondansetron…
El difekikefalin, en un ensayo clínico (fase 3) se administraba por vía intravenosa durante las sesiones de HD, fue eficaz desde la primera semana.
En la revisión de Santos-Alonso y cols. [71] proponen dos algoritmos de tratamiento según la fragilidad y estado de los pacientes, dando prioridad a los tratamientos que tienen mayor evidencia y mejor perfil de seguridad, teniendo en cuenta que la mayoría de los ensayos clínicos existentes son pequeños y de corta duración, siendo la evidencia de estos limitada (Figura 9). Proponen como primer escalón en ambos algoritmos el más conservador de todos: adecuar la diálisis y buen control calcio-fósforo y tratamiento tópico con emolientes. El segundo escalón varía: en pacientes con comorbilidad se prefiere 10mg en la cena de montelukast por su eficacia contrastada, y sobre todo por su buena tolerancia [72]. Se opta por gabapentina si no tienen comorbilidad (100mg postdiálisis, con posibilidad de escalar dosis posteriormente si no se consigue el efecto esperado). Este es el fármaco con más evidencia para el tratamiento del prurito, pero en pacientes con mucha comorbilidad se relega a un tercer escalón por sus efectos secundarios. El cuarto escalón en ambos algoritmos sería la mirtazapina a dosis de 15mg diarios. La sertralina a dosis de 50mg diarios ocuparía la 5.ª posición. Finalmente, en aquellos pacientes con muy mal control se podría plantear el uso de naltrexona. La fototerapia se ha desestimado por la predisposición de estos pacientes a presentar cáncer de piel, considerando mayor el riesgo que el potencial beneficio. El difelikefalin parece ser bastante seguro y presenta resultados prometedores, por lo que podría considerarse cuando esté comercializado.
Por último, a pesar de la frecuencia con la que se utilizan los antihistamínicos en el tratamiento del prurito urémico, siendo en muchos centros el fármaco más usado (hasta un 57% lo usaron de primera elección), no existe evidencia sobre su eficacia.
2.FATIGA POSTDIÁLISIS
Alrededor de un tercio de los pacientes en diálisis describen la sensación cansancio o pesadez tras la sesión, aunque hay que tener en cuenta que no existe un método diagnóstico o cuestionario único, por lo que la prevalencia es variable.
Se trata de una complicación cuya causa no está bien establecida y se ha relacionado con bajo gasto cardiaco con hipotensión, enfermedad vascular periférica, depresión, hiponatremia, hipokalemia, hipoglucemia, encefalopatía urémica leve, miopatía por déficit de L-carnitina, lactacidemia y producción de citoquinas por bioincompatibilidad de la membrana de diálisis. [73] [74] [75] [76]
Desafortunadamente, no existen trabajos que evalúen de forma certera como disminuir este problema. La mayoría de los estudios han modificado la frecuencia, la concentración de Na o glucosa, la temperatura o carnitina, pero ninguna ha sido prospectivo o randomizado. La diálisis corta diaria o nocturna se han asociado a un tiempo de recuperación más corto.
3.GENITOURINARIO
Priapismo intradiálisis
Ocurre en menos del 0,5% de los pacientes varones. Los pacientes se despiertan repentinamente con una erección dolorosa durante la sesión de diálisis. La mayoría de las veces es idiopático, aunque se ha asociado a alteraciones en el flujo de sangre y como posibles causas están la hiperviscosidad sanguínea, hematocrito elevado por tratamiento con eritropoyetina o andrógenos, la hipoxemia, acidosis o hipovolemia por ultrafiltración excesiva (sobre todo en hombres con anemia drepanocítica), uso de heparina, alfa-bloqueantes o antidepresivos como la trazodona.
Es necesaria valoración urológica urgente para drenaje del pene o baipás quirúrgico para salida de la sangre venosa de los cuerpos cavernosos. Así, el tratamiento inicial conservador incluye hidratación, oxigenación, micción y posiblemente detener la HD [77].
4.FIEBRE:
Generalmente en los pacientes en hemodiálisis encontramos temperaturas corporales bajas y la respuesta pirética está disminuida por lo que una temperatura > 37º debe alertarnos, así como el inicio de los escalofríos. Principalmente debemos pensar en un proceso infeccioso, para lo que habrá que interrogar al paciente y ver los síntomas que presenta, explorarlo, realizar las pruebas bioquímicas y cultivos que consideremos apropiados. En el caso de sospecha de infección bacteriana habría que iniciar antibioterapia empírica. No hay que olvidar que la aparición de fiebre puede estar relacionada con el paso de pirógenos desde el dializado a la sangre, que es un diagnóstico de exclusión.
Los factores de riesgo de exposición a productos bacterianos son: agua contaminada, dializadores esterilizados incorrectamente, uso de catéteres y la canulación de accesos vasculares infectados. Los productos bacterianos solubles, como las endotoxinas, pueden difundir hacia la sangre, induce citoquinas y reacciones pirogénicas. Los dializadores de alto flujo tienen poros más grandes que potencialmente dejan pasar fragmentos más grandes, pero su pared gruesa es muy absorbente para los fragmentos de endotoxina, lo que evita principalmente este fenómeno. También en la HDF, que tiene potencialmente un mayor riesgo de reacciones pirogénicas, el uso habitual de agua ultrapura lo hace poco común. (NAD: Calidad del líquido de diálisis y sus componentes: Agua y concentrados). Las reacciones suelen ser subclínicas y tardías, pero en ocasiones producir fiebre e hipotensión. Existen múltiples estrategias para prevenir la contaminación bacteriana y así estas reacciones: usar germicidas apropiados, rigurosos controles del recuento microbiano y de endotoxinas en el todo el circuito, lavado con agua y jabón del brazo del acceso vascular, vigilancia de la inflamación o infección del acceso vascular, uso de clorhexidina antes de la canulación….
Cuando se desarrolla fiebre durante la HD, el primer paso es abordar la estabilidad hemodinámica. Si el paciente está hipotenso, a menudo se requiere la administración de líquidos, el cese de la ultrafiltración y la interrupción de la diálisis, y la hipotensión refractaria sugiere sepsis grave. El siguiente paso es identificar una posible fuente de infección. El acceso vascular de diálisis debe examinarse cuidadosamente. Si se identifica una fuente infecciosa relacionada con el acceso vascular, se debe instituir una terapia específica, sospechándose siempre de los catéteres o no como causa probable de infección, incluso en ausencia de signos locales de infección, como eritema y drenaje del sitio de salida. Los catéteres con signos evidentes de infección en el sitio de inserción deben retirarse y cultivarse la punta.
Deben administrarse antipiréticos y obtenerse hemocultivos (muestras pareadas si hay un catéter) antes de iniciar la terapia con antibióticos. La elección inicial de antibióticos debe incluir cobertura de bacterias grampositivas y gramnegativas, y el régimen debe ajustarse de acuerdo con los resultados del cultivo y las pautas locales. Se ha demostrado que las soluciones de sellado de catéteres que usan antibióticos o esterilizantes pueden ser útiles.
Un brote de bacteriemia entre varios pacientes de diálisis que involucre un organismo similar debe impulsar una búsqueda minuciosa de contaminantes bacterianos en el equipo de diálisis. También se debe prestar atención a los viales de usos múltiples que se perforan varias veces, como los viales de EPO, que se ha relacionado con un brote de infección del torrente sanguíneo.