Monitores de Hemodiálisis: evolución histórica
Palabras clave
Monitor, hemodiálisis, evolución, circuito, control ultrafiltración
INTRODUCCIÓN:
CIRCUITO HIDRAULICO:
A) Recuerdo histórico:
B) Control de Ultrafiltración:
a.- Sistemas abiertos o de flujo continuo
b.- Sistemas cerrados o de flujo discontinuo
1.- Circuitos cerrados de serpentín (4 válvulas)
2.- Circuitos cerrados de doble cámara bicompartimental (8 válvulas)
3.- Circuitos cerrados de doble cámara monocompartimental (8 válvulas)
C) Circuitos de los Monitores Actuales, Abiertos y Paso Único.
CIRCUITO EXTRACORPOREO SANGUINEO:
A) Circuito para Bipunción:
B) Circuito para Unipunción:
INTRODUCCIÓN:
Los monitores de hemodiálisis se componen básicamente de dos circuitos: circuito hidráulico o de baño y circuito extracorpóreo o sanguíneo.
Estos dos circuitos, se cruzan en un único punto (el dializador), donde se producirán los diferentes tipos de transportes de diálisis: difusión, convección, adsorción, absorción y filtración/retrofiltración.
CIRCUITO HIDRAULICO:
Recuerdo histórico:
En 1309, Juana I de Navarra, esposa de Felipe IV de Francia, funda el ¨Colegio de Navarra ¨ en París, que pasaría a ser posteriormente la primera escuela politécnica y el origen de la que hoy es la Universidad Parisina de “La Sorbona”. En 1748, el abad J.A. Nollet abre la cátedra de física experimental en la politécnica y describe, entre otras muchas cosas, el fenómeno de la “osmosis” y uno de sus principales agentes, como es la membrana semipermeable (hallazgos fundamentales para lo que muy posteriormente será la hemodiálisis).
Pero, hubo que esperar casi un siglo para descubrir las leyes que la gobiernan (“presión osmótica” - fuerzas generadas a través de una membrana semipermeable), descritas en 1828 por el médico-biólogo y físico francés Henri Dutrochet.
Entre los años 1854 y 1861, Thomas Graham publica los mecanismos de la “difusión” (diálisis), demostrando el paso de solutos a través de una membrana semipermeable, obedeciendo a gradientes de concentración [1] [2].
Pero esta vez hubo más suerte, ya que tan solo dos años después, el médico y físico alemán Adolf Fick, en 1856, desvelaría las leyes que la rigen – (“Leyes de la difusión” o “Leyes de Fick”).
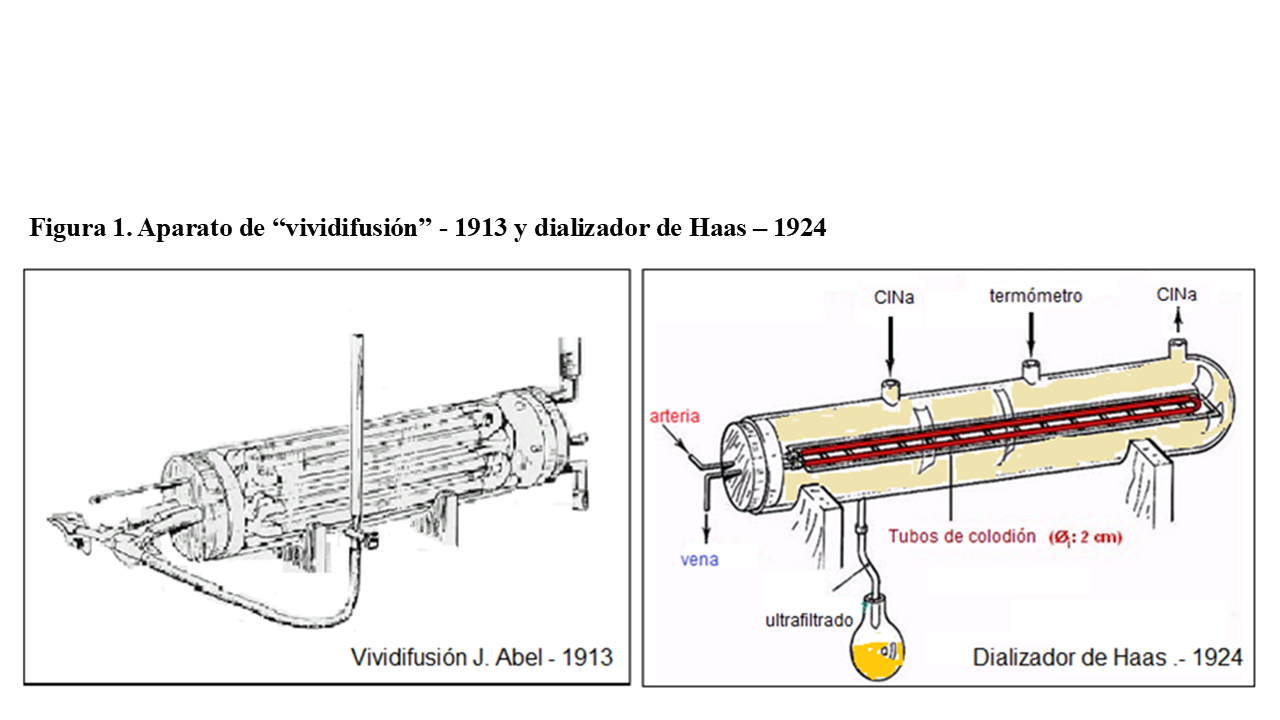
Otra vez tuvimos que esperar casi otro siglo, hasta que estos fenómenos fueron aplicados por primera vez “in vivo” en 1913. Fue en la Escuela de Medicina Johns Hopkins (Baltimore, Maryland, Estados Unidos) por John Jacob Abel y sus colegas Leonard Rowntree y Bernard Turne, mediante un aparato llamado de “vividifusor” (dializador de colodión) [3].
A partir de entonces, las investigaciones y avances se aceleran muchísimo. Y ya en el verano de 1924, Georg Haas modifica el vividifusor en la University of Giessen (Alemania) y utiliza por primera vez en humanos el denominado “Haas Dialyzer” (también de membranas de colodión) [4] (Figura 1).
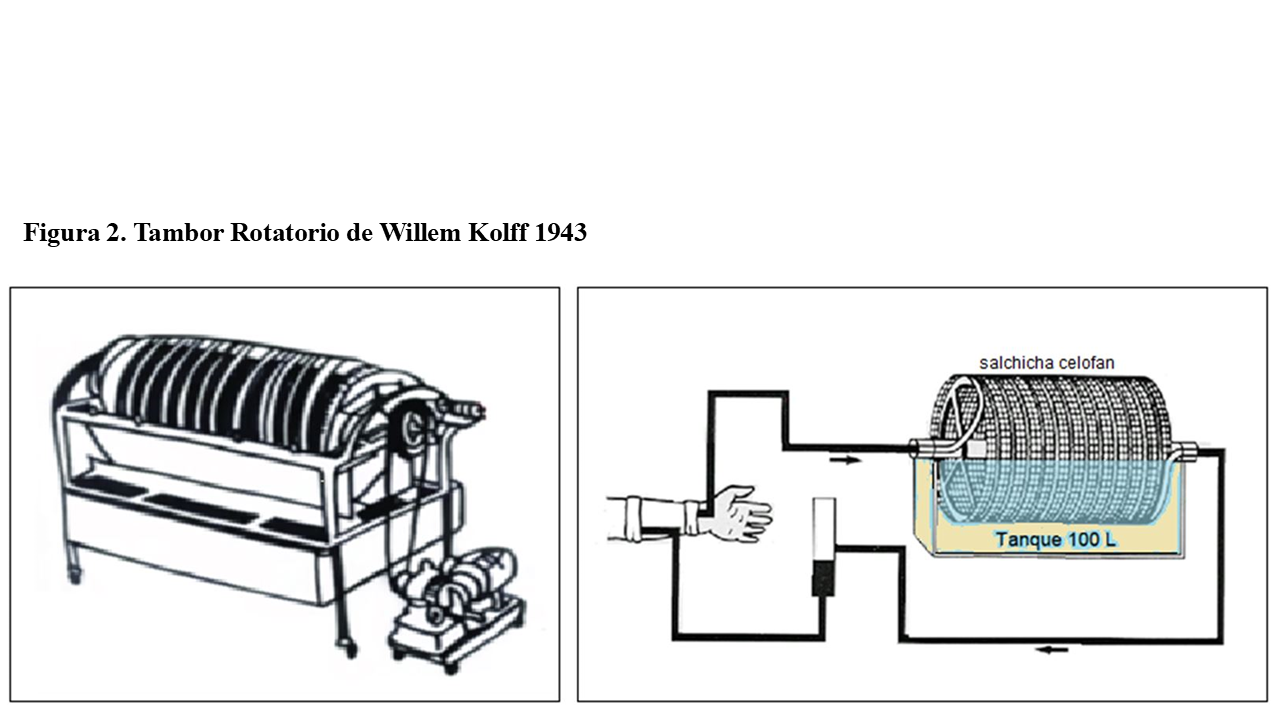
La hemodiálisis evolucionó de forma muy indudable y en 1950, se disponía ya para su utilización en clínica, del primer Riñón Artificial de “Tambor Rotatorio”. Diseñado por el Dr. Willem Kolff en 1943, utilizaba tubos membranosos hechos de un nuevo material a base de celulosa, conocido como celofán y que en realidad se usaba en el embalaje de alimentos [5] [6] [7] (Figura 2).
Este monitor fue modificado, llamándose posteriormente “Riñón Artificial de Kolff-Brigham”. Fue utilizado con gran éxito en la guerra de Corea de 1952. Entre los años 1954 y 1962, se exportaba ya con gran éxito desde Boston a todo el mundo.
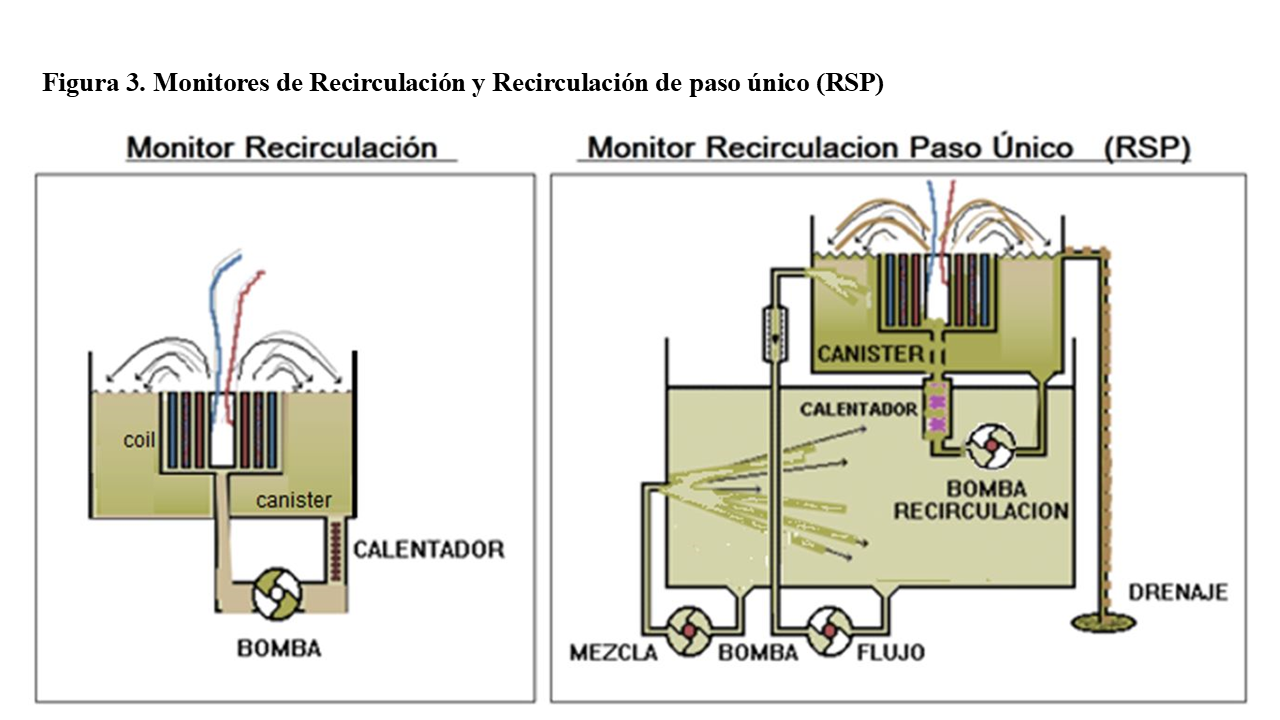
Los circuitos hidráulicos se fueron perfeccionando, pasando del Riñón Rotatorio, al “Monitor de Recirculación” de cuba o “canister” y posteriormente al de “Recirculación y Paso Único” (RSP- recirculation single pass, de la casa Travenol–Baxter®). Estos monitores, utilizaban inicialmente dializadores del tipo “coil” o bovina (Figura 3).
Entre 1946 y 1955, aparecen sucesivas generaciones de dializadores del tipo “Coil” y algo más tarde (1947-1959), de dializadores de flujo paralelo.
En 1955, surgen los dializadores tipo “Twin coil” (dos tubos de celofán en paralelo) de 10 metros de longitud, con una superficie total de 1.8 m2, con los que se conseguía un aclaramiento de urea de 140 ml/min. con flujos de sangre de alrededor de 200 ml/min.
Pero con estos filtros y circuitos tan abiertos, se presentaba un problema importante: resultaba muy difícil realizar balances y controlar el volumen ultrafiltrado, por lo que se realizaron mejoras significativas en el diseño del dializador y de los equipos.
Durante las décadas de 1940 a 1950, Nils Alwall desarrolló en 1947 un nuevo sistema con un riñón de tambor estacionario vertical y dializado circulante alrededor de la membrana [8]. También, fue responsable de aplicar presión hidrostática para lograr la ultrafiltración deseada [9]. Y las membranas de celofán utilizadas en este dializador, podrían soportar una presión mayor, debido a su posición entre dos rejillas metálicas protectoras.
Los monitores de Recirculación dieron paso a los de Paso Único (SPS- single pass system), que podían ser cerrados o abiertos, o mejor dicho, de flujo continuo o alterno, y con diferentes controles volumétricos de ultrafiltración.
A finales de los años 60, Frederik Kill en Noruega desarrolla un dializador de flujo paralelo, en el que se emplea por primera vez una nueva membrana de celulosa regenerada con cuproamino (Cuprophan), de mayor porosidad para los solutos y agua.
Posteriormente, el estadounidense Richard Stewart en 1964 moderniza los dializadores habituales por otros de fibra hueca, los llamados de “capilar”, que se convirtieron en los precursores de los dializadores actuales.
Control de Ultrafiltración:
Los sistemas más utilizados en los monitores de hemodiálisis, para de control de la ultrafiltración, se pueden dividir en dos tipos según el circuito básico que utilicen [10] [11]:
a.- Sistemas abiertos o (mejor dicho) de flujo continuo.
b.- Sistemas cerrados o de flujo discontinuo.
a.- Sistemas abiertos o de flujo continuo
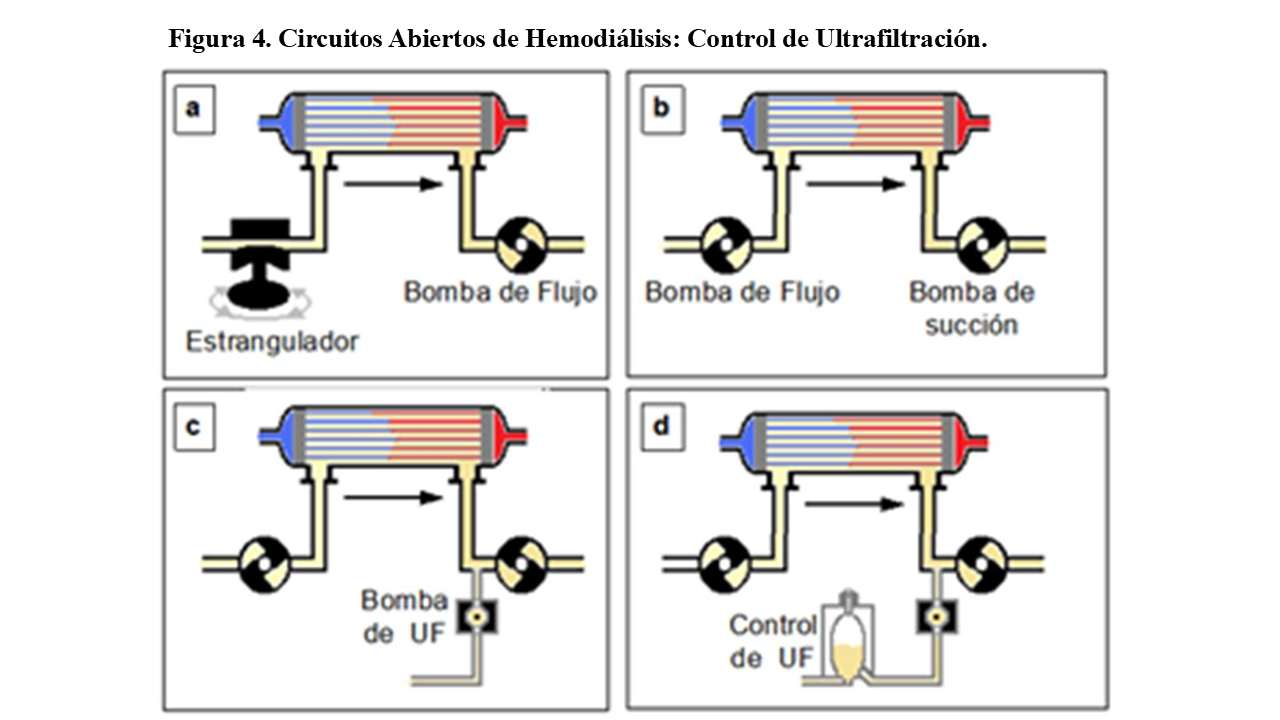
Inicialmente disponían de una sola bomba de flujo situada postdializador y se provocaba la presión negativa en el baño, mediante una estrangulación prefiltro (a) (Figura 4).
Pero este esquema de circuito no aseguraba un flujo de baño constante (variaba según el estrangulamiento) y era difícil el control de la ultrafiltración. Por esto, se colocaron dos bombas de flujo: una prefiltro para asegurar un flujo constante de baño de diálisis (normalmente 500 ml/min) y la segunda postfiltro (b), que podía demandar más y producir entonces presión de succión o ultrafiltración.
Pero, aunque se aseguraba un flujo de baño constante, no se podían regular ni controlar bien las presiones. Había que realizar un mejor control del balance de lo ultrafiltrado.
Entonces se añadió una tercera bomba (c). Las dos primeras son las que aseguran flujos constantes y conocidos de baño, cerrando además el circuito (“circuito cerrado”) para poder regular la presión transmembrana (PTM). La tercera bomba, realizaba y controlaba el trasporte convectivo.
Con el fin de tener un control volumétrico de lo ultrafiltrado (“monitores de control volumétrico”), el líquido extraído por la bomba de ultrafiltración pasaba a un recipiente de recogida (d), donde podía ser medido periódicamente de forma exacta, mediante diferentes sistemas de control de nivel, ultrasonidos, .. etc.
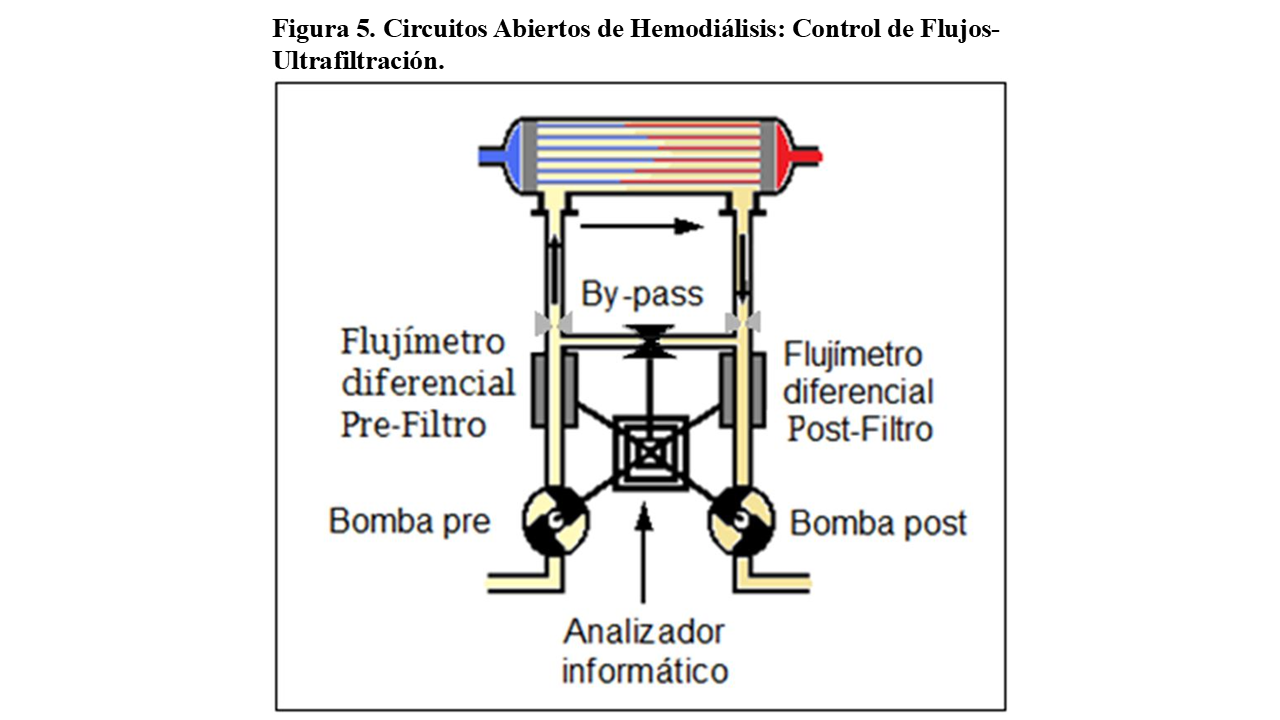
Dado que cada día se efectuaban balances convectivos más potentes, los circuitos abiertos debieron ser implementados (Figura 5), disponiendo ahora, no solo de bombas de flujo pre y post filtro (cerrando el circuito), sino de controles fiables de flujos pre y post dializados, mediante diferentes medidores o contadores de flujo, llamados “flujímetros o flujómetros”.
Estos podían ser de diferentes tipos:
-Flujímetros de turbina (monitor “Integra”-Hospal).
-Flujímetros electromagnéticos (monitor “AK-200”-Gambro).
-Flujímetros diferenciales de “Coriolis” (monitor “Formula Terapy”-Bellco),…etc.
Estas tecnologías, permiten cuantificar con muchísima exactitud los volúmenes de baño que entran y salen del dializador y evaluar las diferencias entre ambas (ultrafiltración).
Los flujímetros a su vez, están controlados por “ordenador” (analizador informático), que los evalúa y ajusta periódicamente mediante su estudio y su posterior calibración en situación de bypass.
b.- Sistemas cerrados o de flujo discontinuo
Estos sistemas son compartimentos cerrados y estancos, funcionando a ciclos intermitentes. Son circuitos con nula distensibilidad “compliance”, lo que impide el transporte convectivo (filtración) a no ser que previamente se reduzca la presión intracircuito, mediante la extracción de baño del circuito cerrado. En ese momento, pasará ultrafiltrado en la misma cantidad desde la sangre al baño para rellenar lo sacado.
Los circuitos más conocidos en el mercado fueron:
1. Circuitos cerrados de serpentín.
2. Circuitos de doble cámara bicompartimental.
3. Circuitos de doble cámara monocompartimental.
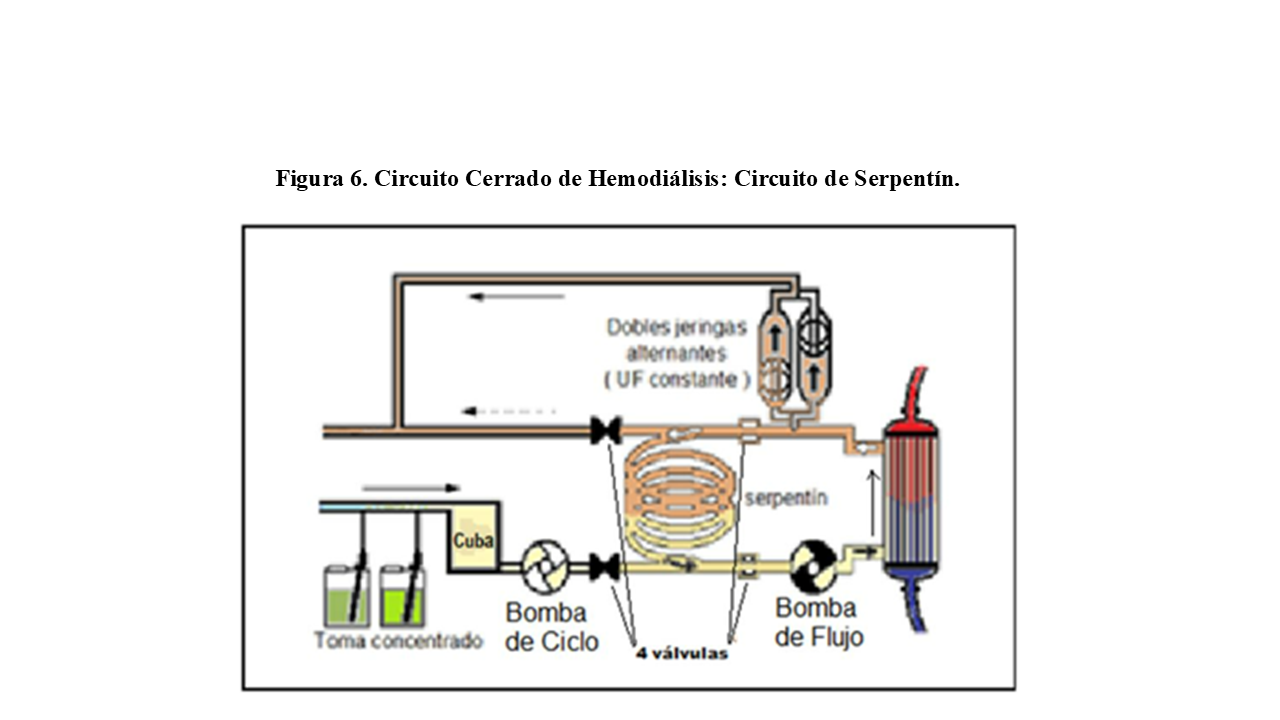
1.- Circuitos cerrados de serpentín (4 válvulas):
Este circuito (Figura 6), actualmente en desuso, necesitaba de una cuba previa con capacidad similar a la del serpentín (aproximadamente 2 litros), donde se preparaba con antelación el baño desgasificado, calentado y con la conductividad idónea.
Una vez listo, la bomba de ciclo traspasa el baño de la cuba para rellenar todo el serpentín, se cierra el circuito y la bomba de flujo lo recircula por el dializador (unos 2 minutos). Mientras, este tiempo es aprovechado para preparar otro baño de recambio en la cuba.
Cuando todo el baño del serpentín ha pasado por el dializador, se recambia por otro nuevo desde la cuba, mediante una parada de flujo de baño por el dializador de unos 6 a 18 segundos. Una vez reemplazado el baño, comienza un nuevo ciclo.
Si se desea realizar balance negativo (ultrafiltración), se saca baño del circuito cerrado no distensible, lo que obliga a ser restituido en similar cantidad a lo extraído desde el compartimento sanguíneo.
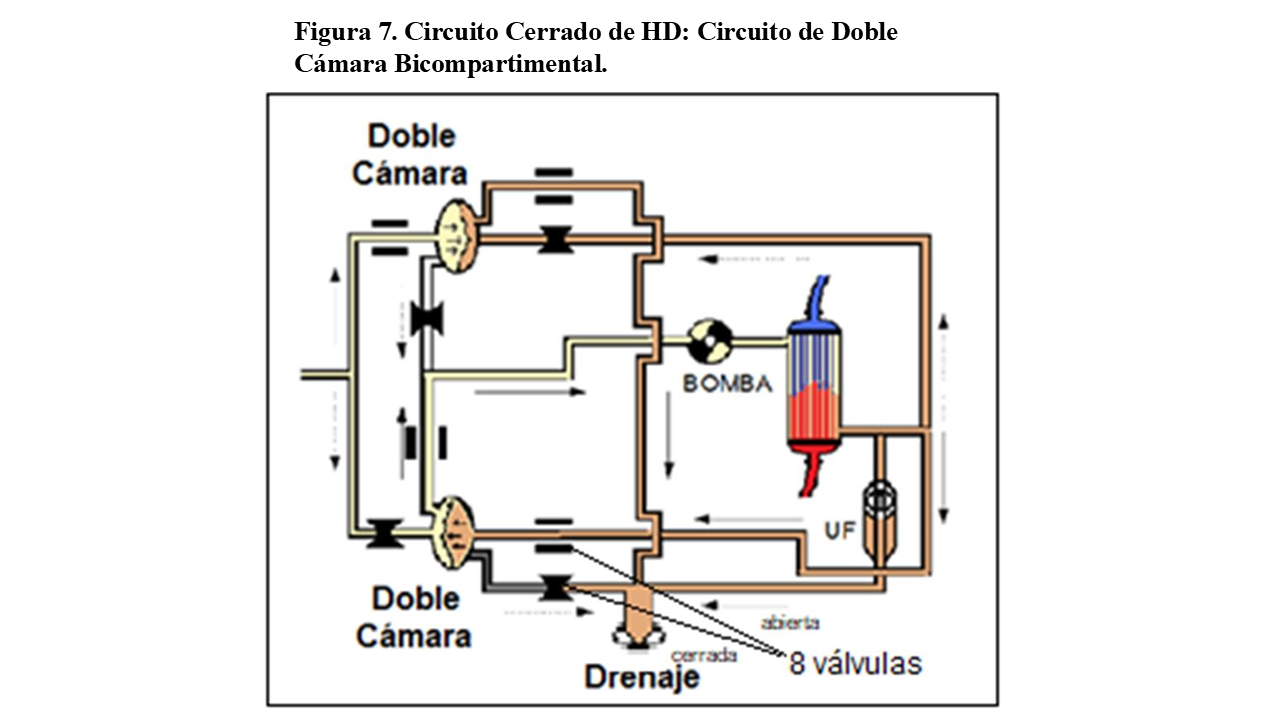
2.- Circuitos cerrados de doble cámara, bicompartimental (8 válvulas)
Se componen de dobles circuitos (Figura 7), cada uno con su cámara que hace las funciones del serpentín, divididas a su vez en dos partes o compartimentos separadas por una membrana impermeable.
El baño es fabricado y almacenado previamente a un lado de la cámara (compartimento con capacidad de 30 mililitros). Comienza a pasar el baño por el dializador, retornando al otro lado de la cámara. Cuando a pasado todo, se interrumpe el circuito, introduciendo nuevo baño en el primer compartimento, lo que desplaza la membrana del segundo provocando su vaciado. Mientras esto se realiza, la otra cámara suministra el flujo del baño.
El baño es suministrado al dializador de forma intermitente, cada 4 segundos y se interrumpe solo instantáneamente en cada recambio de cámaras. Para un flujo de baño de 500 ml/min, realizará unos 14 recambios por minuto, con 2 segundos de paradas por minuto (con pérdidas de unos 10 min de diálisis en 4 horas).
Al contrario que en el serpentín y su circuito, que son compartidos tanto por el baño nuevo (limpio) como por el utilizado (sucio), en este tipo de circuitos los baños están siempre separados. Al no compartir nunca espacios, estos circuitos son más seguros ante posibles contaminaciones.
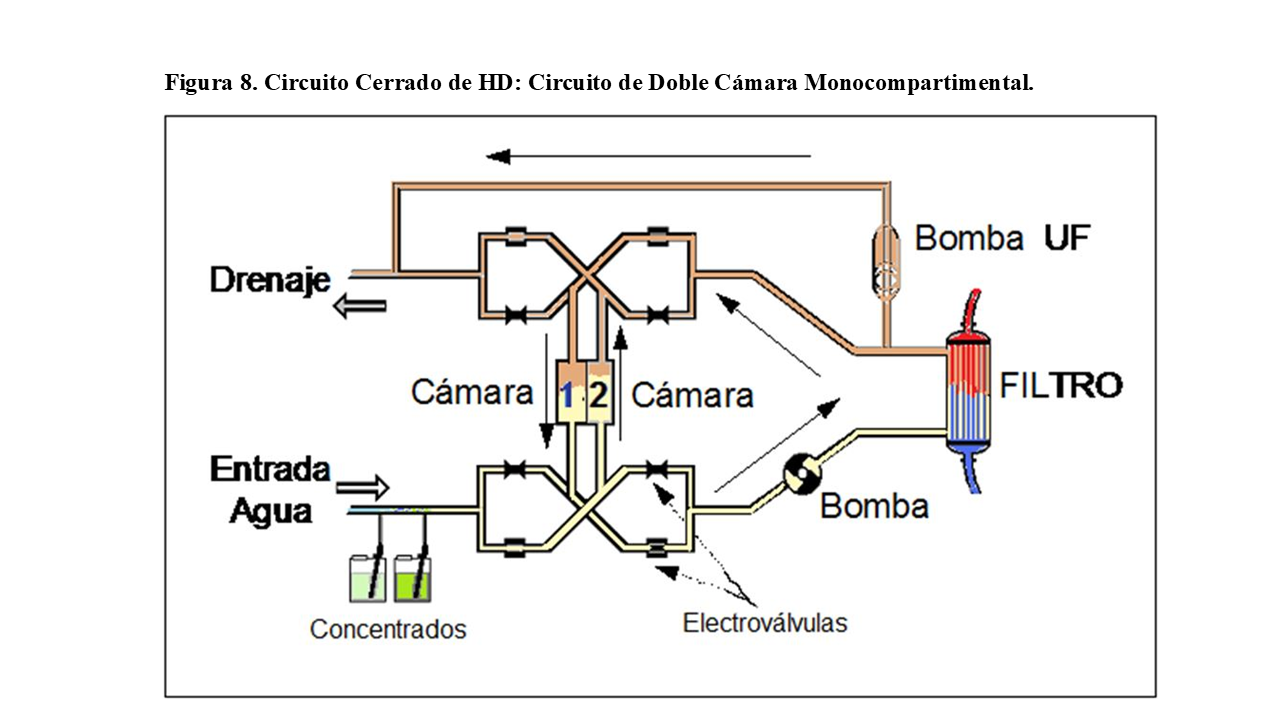
3.- Circuitos cerrados de doble cámara, monocompartimental (8 válvulas)
Fueron muy utilizado en su día, y constan de doble circuito y dos cámaras monocompartimentales (Figura 8).
El baño sale de una de las cámaras, pasa por el dializador y retorna a la misma cámara. Tanto cámara como circuito, son compartidos por baño nuevo y utilizado.
Mientras tanto, la otra cámara se llena de baño nuevo, vaciando por arrastre el baño ya utilizado en el ciclo anterior.
Al disponer de doble cámara y circuito, los cambios de ciclo son prácticamente instantáneos, no perdiendo demasiado tiempo de diálisis por falta de suministro de baño, como sucedía en el circuito de serpentín (con cámara única en serpentín).
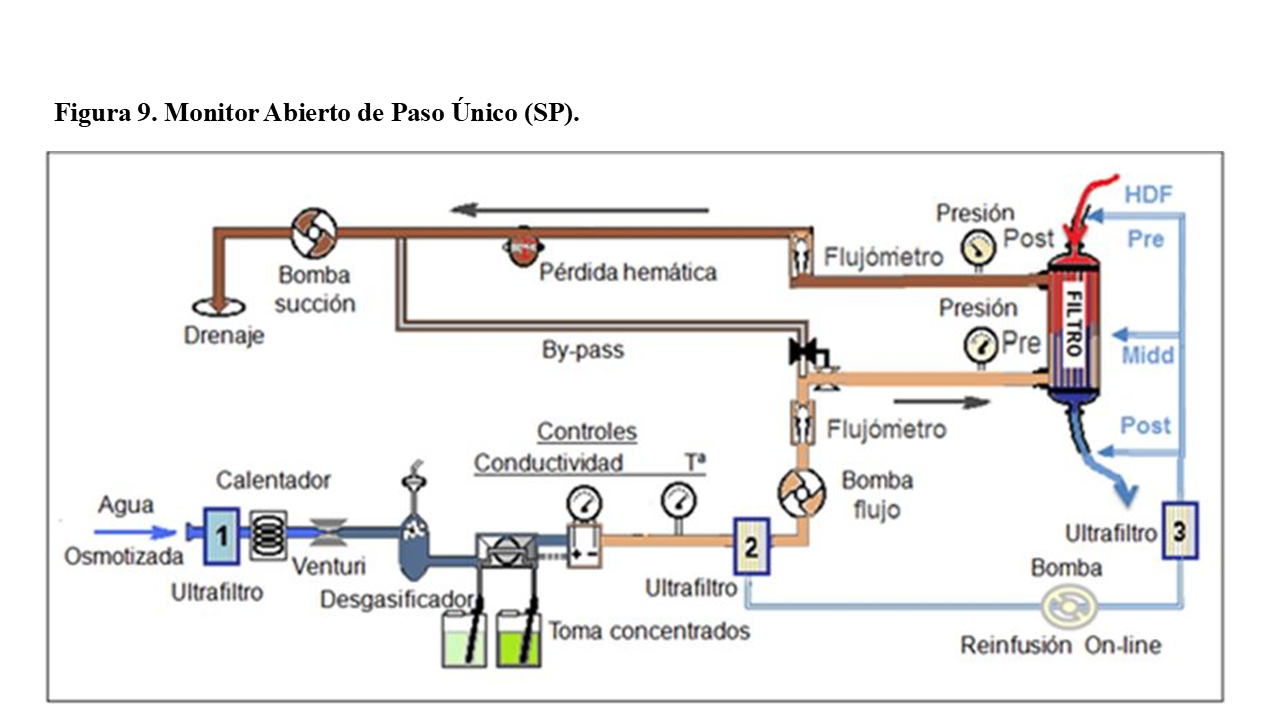
Circuitos de los Monitores Actuales, Abiertos y Paso Único:
Los Monitores actualmente suelen ser normalmente circuitos abiertos y de paso único.
Las principales características de todo monitor de “paso único” (Figura 9) son:
- la ausencia de recirculación del baño (desechado después de ser utilizado)
- la producción continua del “dialisate” (baño de diálisis de flujo continuo) y
- la utilización inmediata del mismo (sin almacenamiento previo).
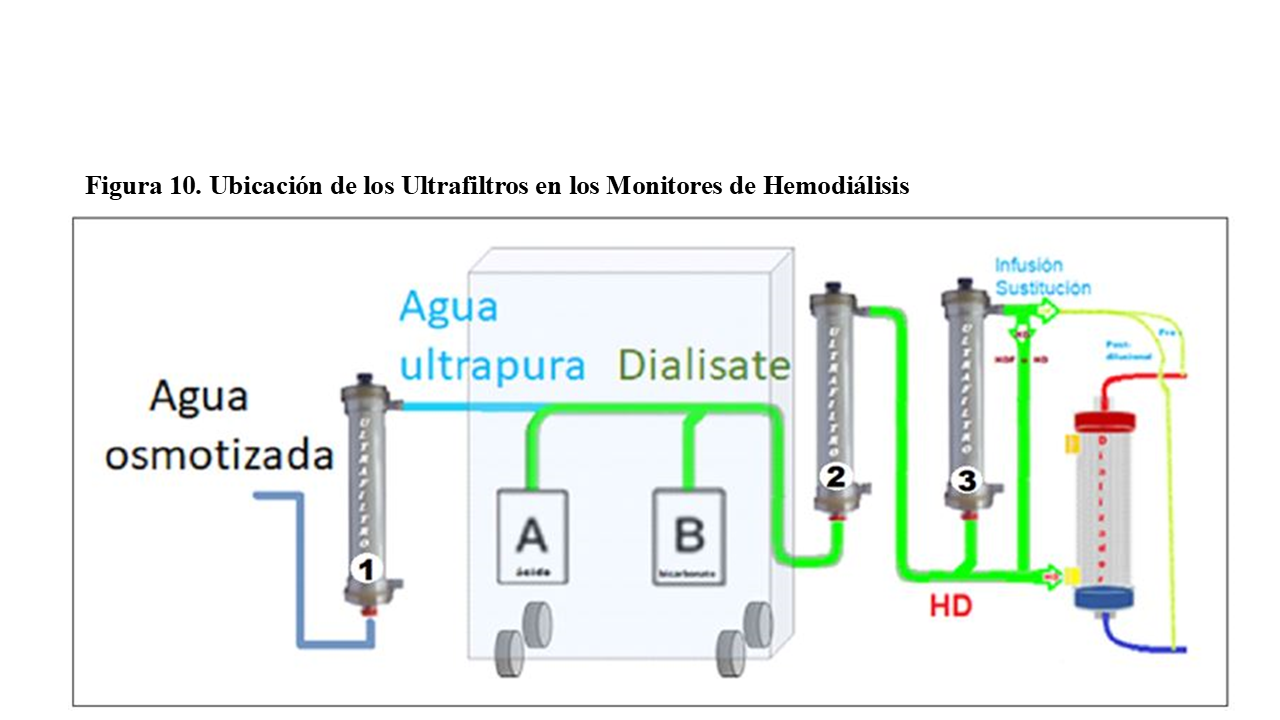
Los monitores de hemodiálisis, están conectados a la red de ósmosis inversa y pueden disponer de un primer Ultrafiltro 1º (opcional), que asegura un suministro de agua osmotizada y ultrapura (ultrafiltrada).
Con el fin de facilitar la disolución de las sales y la desgasificación del agua, su primera acción es calentar el agua ultrapura a unos 35º- 37º C. Después, mediante un ¨Venturi¨, se le somete a una presión negativa para desgasificarla totalmente, eliminando posteriormente las burbujas en el “desgasificador”.
El baño para hemodiálisis o ¨dialisate¨, lo prepara mediante la mezcla de unos concentrados de electrolitos y/o sales, con el agua osmotizada ultrapura. La mezcla se realiza con unas proporciones aproximadas de una parte de concentrados, por unas 32 a 36 partes de agua. Así, se consiguen la osmolalidad y concentraciones electrolíticas deseadas, estando siempre controlada por el examen continuo de su temperatura (termómetro) y conductividades eléctricas (bicarbonato y total) con “conductivímetros o resistivimetros”.
Una vez evaluadas conductividad y temperatura, si son correctas, el baño se envía a su paso por el dializador, en caso contrario, se desechará hacia el drenaje mediante un cortocircuito o “bypass”.
Al tratarse de una producción instantánea y de paso único por el dializador, se aminoran los riesgos de contaminación y se evita la saturación del baño, como sucedía en los monitores de recirculación.
Una “bomba de flujo” y el posterior control mediante diferentes tipos de flujómetros (mecánicos, turbina, electromagnéticos o por Coriolis), aseguran el suministro programado de baño al dializador.
En los monitores diseñados para baño ultrapuro o para hemodiafiltración “online” (HDF online), existe un segundo ultrafiltro (“ultrafiltro 2”), que será obligatorio para asegurar la ultrapureza del baño de diálisis.
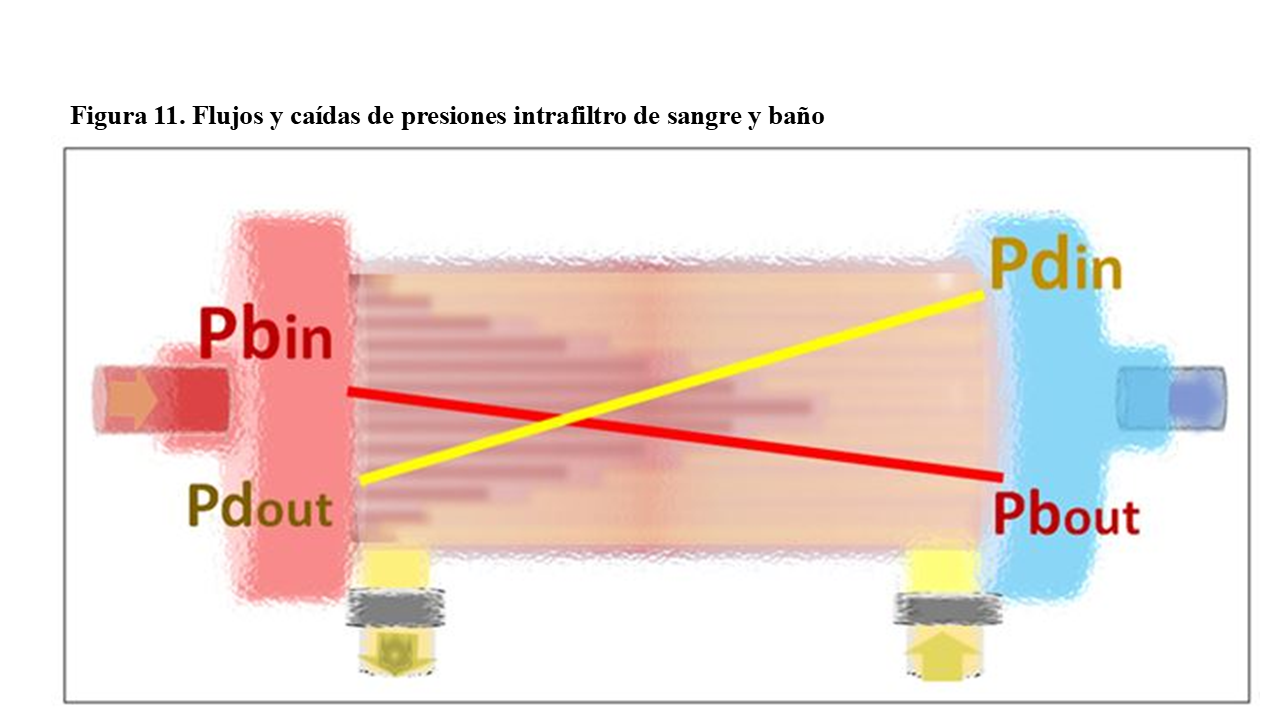
Todos los monitores controlan las presiones de salida (baño ”Pdout” y sangre “Pbout”) del dializador, pero no así las de entrada (”Pdin” y “Pbin”).
Los monitores más actuales controlan todas las presiones de entrada y salida. La incorporación del control de estas presiones les permite a los nuevos “software” realizar la evaluación de la retrofiltración (BF) o la denominada hemodiafiltración interna (HDFi) [12].
Los monitores más antiguos no controlaban la presión de entrada del baño al dializador, y si lo hacían, no la utilizaban para el cálculo de la presión transmembrana (PTM) y ni tan siquiera la suministraban como información.
Si el baño de hemodiálisis (HD) va a ser utilizado para cebar o retornar el circuito sanguíneo, e incluso para inyectar “bolus” intravenosos en caso de hipotensión o ser usado para reposición intravenosa en HDF online (pre, mid o postdilucional), puede necesario un tercer ultrafiltro (“ultrafiltro 3”) (Figura10).
La normativa internacional de seguridad exige dos ultrafiltraciones consecutivas inmediatas antes de cualquier utilización del dialisate para reinfusión o sustitución intravenosa directa, por lo que es obligatorio en los monitores que permitan utilizar el baño para su infusión IV, disponer de “dos” ultrafiltros sucesivos en el baño de diálisis (“ultrafiltros 2º y 3”).
Cuando se utiliza el baño para hemodiálisis estándar, no se exigen los “ultrafiltros nº 1 y 3¨, pero sí deberá disponer del “ultrafiltro nº 2¨, que es obligatorio. Y así, cuando realizamos hemodiálisis estándar con cualquier dializador, máxime si lo hacemos con membranas de alto flujo (HF) o con membranas de corte medio (MCO), siempre tendremos retrofiltración dentro del dializador (BF backfiltration).
Como siempre existirá hemodiafiltración interna (HDFi) en cualquier hemodiálisis [15], tendremos asegurado una primera ultrafiltración del baño en el ultrafiltro obligatorio nº 2 y la segunda ultrafiltración se realizaría por retrofiltración a través de la membrana del propio dializador HD.
Es necesario tener siempre presente que las membranas de los ultrafiltros se pueden deterioran con determinados desinfectantes (como los hipocloritos), por lo que estos solo se deberían utilizar si se procede al posterior recambio de los mismos.
A la salida del baño del dializador se deben realizar también varios tipos de controles: control de la presión salida de baño (Pdout), control de flujo del dialisate (flujómetro) y el control de posibles pérdidas hemáticas.
Este último, se realiza mediante un sistema óptico de infrarrojos o ultrasonidos, con sensibilidad para pérdidas de 0.5 ml. de sangre, para un 25% de hematocrito y flujos de baño de 500 a 800 ml /min. La regulación y ajuste del sensor suele ser automática y con autotest de calibración.
La diferencia observada en los flujómetros entre el volumen de entrada y de salida al dializador, será el volumen o balance de la ultrafiltración realizada (UF), que se genera por la diferencia de vueltas (flujos) entre la bomba de flujo de baño y la de succión.
Estos circuitos, aunque se les considera abiertos, en realidad están cerrados entre las dos bombas (flujo y succión). Estan reguladas y balanceadas por los flujómetros, que a su vez, están controlados por los sistemas informáticos, que les obligan a realizar los flujos de baño y balances negativos preprogramados.
Una de las aportaciones más interesantes de estos circuitos, es tanto la posibilidad de crear presiones, como la de neutralizarlas en el compartimento de baño permitiendo conseguir los balances deseados sin necesidad del cálculo de la presión transmembrana (PTM), ni de tener en cuenta el coeficiente de ultrafiltración del dializador (KUF).
La presión transmembrana (PTM) que nos suministran los monitores es un cálculo matemático teórico, que no tiene mucho que ver con la realidad. Su formulación varía según el monitor y la casa comercial. Pueden ser muy diferentes: [PTM= Pbout – Pdout], o con corrección de presión oncótica [PTM= Pbout – Pdout - 30]. Cuando controlan la presión prefiltro, el cálculo suele ser [PTM= (Pbin + Pbout)/2 – Pdout], con un factor de corrección de presión oncótica o no [13] [14].
Nunca calculan la presión transmembrana como se define habitualmente: la diferencia entre la presión media de sangre y la presión media en baño: [PTM= (Pbin + Pbout)/2 – (Pdin+Pdout)/2], dado que como se puede apreciar en la (Figura 11), resultaría habitualmente negativa. La PTM es diferente en cada capilar, cambiante a lo largo del mismo y además, puede ser positiva y negativa. Imposible definirla en una sola cifra.
La hidráulica de fluidos dentro de los dializadores es como se muestra en la (Figura 11). La sangre fluye de forma más abundante por los capilares centrales que por los periféricos, por lo que circula a más velocidad por el centro del mazo capilar y esto genera, una menor presión dentro de estos capilares favoreciendo la retrofiltración. Los capilares centrales, se van pues hemodiluyendo progresivamente, haciéndose cada vez menos viscosos y más rápidos.
En los capilares más periféricos sucede lo contrario. Tienen flujos lentos y con presiones internas elevadas, por lo que son filtradores netos y se van hemoconcentrando, progresando su viscosidad y haciéndose propensos a la coagulación [12] [16].
En el compartimento de baño, sucede un poco al revés. Los flujos preferenciales de baño son periféricos. Por lo que son más rápidos y con baja presión, facilitando aún más la filtración en los capilares periféricos y su hemoconcentración.
El baño tiene gran dificultad para penetrar al centro del mazo capilar, por lo que en su interior, los flujos de baño son lentos y con presiones elevadas, favoreciendo la retrofiltración en los capilares centrales de presión interna menor.
Globalmente, los capilares cuanto más periféricos más filtran, mientras que cuanto más centrales más retrofiltran. Por otro lado, a la entrada de la sangre en el filtro predomina la filtración y cuanto mas se aproxima la salida, más retrofiltración. Aproximadamente, solo 1/3 del dializador realiza la filtración (convección) y más de 2/3 partes están realizando retrofiltración (BF) [17].
Como “Norma General”, para todos los monitores de hemodiálisis, cualquier alarma en el circuito de baño (temperatura, conductividad, presiones y pérdida hemática), pone el monitor en Bypass. Y cualquier alarma en circuito de sangre (presión arterial, prefiltro y venosa o aire en circuito), detiene la bomba de sangre.
Si una alarma detiene la bomba de sangre, el problema lo tendremos en el circuito de sangre, pero cuando el monitor se pone espontáneamente en bypass, el problema está en el de baño.
En los últimos años, los mayores avances en los monitores están en su implementación con nuevos y mejores biosensores, que monitorizan e informan en tiempo real del desarrollo de la sesión de diálisis y las posibles repercusiones en el paciente.
CIRCUITO EXTRACORPOREO SANGUINEO:
Los circuitos sanguíneos para hemodiálisis pueden ser de dos tipos, según sea la técnica de acceso vascular utilizada: bipunción y unipunción.
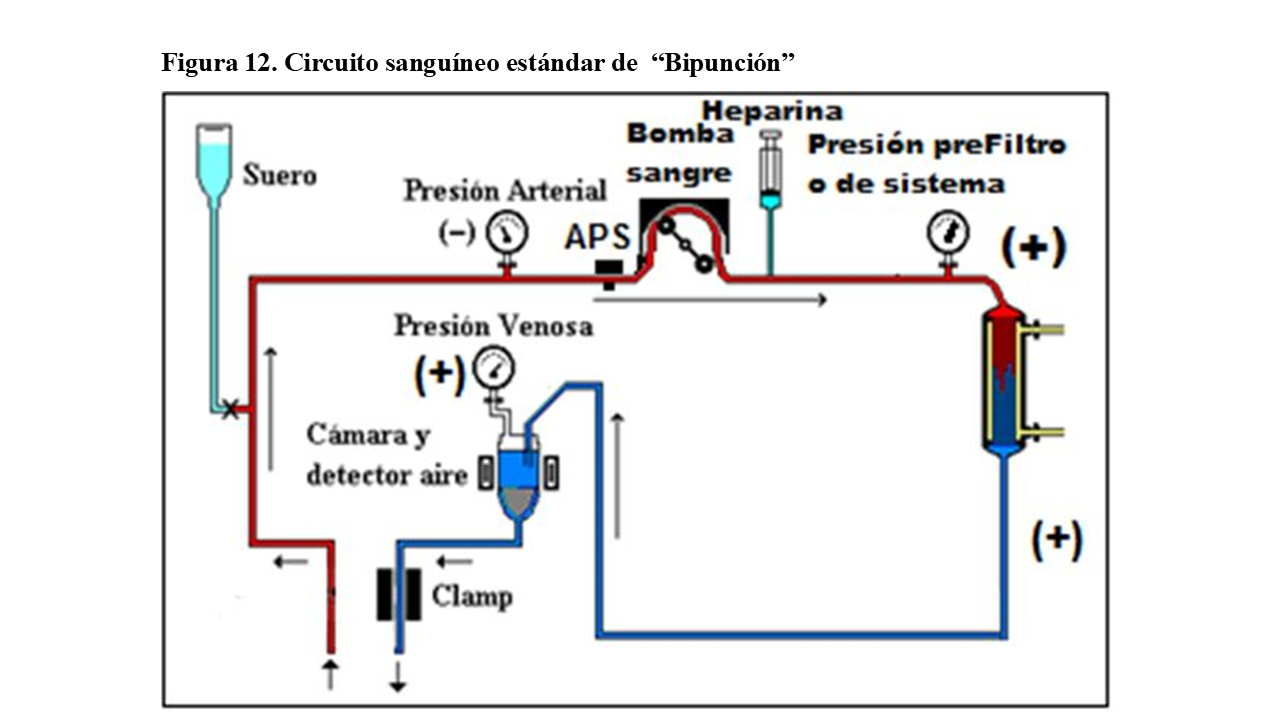
Circuito para Bipunción:
El circuito utilizado como estándar en hemodiálisis tiene dos puntos de acceso al torrente sanguíneo del paciente: uno para extracción de la sangre y otro para su retorno (Figura 12). Precisa de una sola bomba de succión en la llamada línea arterial, generando una presión negativa que debe ser controlada (Presión Arterial) bien por medidor de la presión, que suele estar alrededor de -150 mmHg (entre -100 y -200, no superando nunca el -300 mmHg) o por colapso en línea o en segmento prebomba (APS-arterial presión system). Esta presión negativa también se utiliza para la infusión de suero.
La presión postbomba (o prefiltro) se hace muy positiva (tanto mayor cuanto menor diámetro interno de las fibras capilares del dializador o cuanto mayor es la viscosidad sanguínea).
Posteriormente, dentro del dializador, se produce una caída sustancial de presión. En la línea venosa, se controlan la presión (“presión venosa de retorno”), que no se recomienda supere los +300 mmHg, y la detección de aire, normalmente por ultrasonidos, con su clamps posterior, que evitará la entrada de aire en el paciente parando la bomba de sangre.
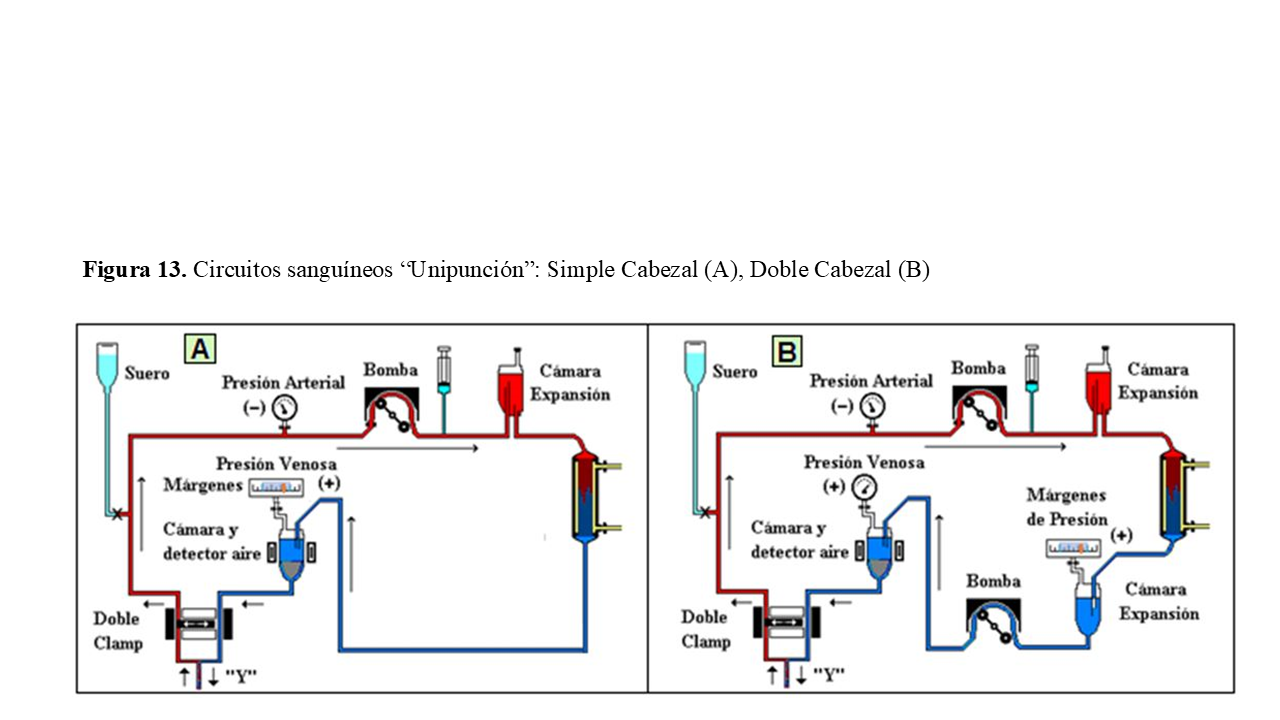
Circuito para Unipunción:
Si solo se dispone de un punto de canulación de acceso, se precisa de una conexión en “Y” para vincular las líneas arterial y venosa al único punto de acceso sanguíneo (Figura 13).
La técnica de unipunción se puede realizar de dos formas: con doble clamp y una sola bomba (“simple cabezal”) (A), o con doble bomba (“doble cabezal”) (B).
En ambos métodos, las líneas arterial y venosa deben disponer de cámara de expansión para aumentar la “compliance” del circuito sanguíneo y así poder movilizar más sangre en cada ciclo.
Los ciclos se pueden programar mediante el control de las variaciones de presión producidas entre los dos clamps o entre las dos bombas (“márgenes de presión”). En el “doble clamps”, la única bomba de rama arterial puede funcionar de forma constante. Ambos clamps controlan los ciclos alternando su funcionamiento. La diferencial entre presión máxima y mínima suele ser de unos 150 mmHg.
Cuando se consigue la presión máxima (entre 200 y 300 mmHg), se abre el clamp venoso o se pone en marcha bomba de rama venosa, y se cierra el clamp arterial o se para la bomba arterial (según se trate de doble clamp o de doble cabezal).
Y al revés, cuando baja la presión (entre +50 o + 75 mm de Hg), se abre el clamp arterial o entra a funcionar la bomba arterial y se cierra el clamp o se para la bomba venosa (según circuito).
Los rendimientos del método de doble cabezal son superiores al de cabezal simple de doble clamp, presentando recirculaciones alrededor del 20%.