Prevención del contagio de virus de transmisión sanguínea en hemodiálisis. Revisión basada en las guías de práctica clínica
Palabras clave
VHB, VHC, VIH, Serología, Vacunación, Aislamiento
ÍNDICE
1. Introducción
2. Detección y seguimiento serológico de la infección por VHB, VHC y VIH en hemodiálisis
2.1. Interpretación de la serología
2.2. Serología al inicio de hemodiálisis
2.3. Control serológico en pacientes prevalentes en hemodiálisis
2.4. Incidencias relacionadas con virus de transmisión sanguínea
3. Prevención de la transmisión del VHB, VHC y VIH en hemodiálisis
3.1. Medidas de precaución universales
3.2. Aislamiento de pacientes y monitores de hemodiálisis
3.3. Vacunación frente al VHB
4. Personal de hemodiálisis
4.1. Serología del personal de hemodiálisis
4.2. Formación y reciclaje del personal de la unidad de hemodiálisis
1.- INTRODUCCIÓN
Los virus de transmisión sanguínea han despertado siempre el interés de la comunidad nefrológica por el riesgo potencial de contagio que ocasionan en hemodiálisis, de paciente a paciente y entre pacientes y personal. En los años 90, antes de que se implantara la vacunación sistemática frente al virus de la hepatitis B (VHB) [1] y se desarrollaran fármacos para tratar la infección por el virus de la hepatitis C (VHC) y el virus de la inmunodeficiencia humana (VIH), la prevalencia de los virus de transmisión sanguínea en hemodiálisis era muy elevada. En España, en 1997-2001, la prevalencia del VHC en hemodiálisis ascendía al 22% [2], reduciéndose al 5,6% en 2013 [3] tras la implantación de las medidas de higiene universales y la mejora de las pruebas de detección serológicas. Con el aumento de la eficacia y disponibilidad de los antivirales directos [4], se espera que la prevalencia del VHC en hemodiálisis en España sea inferior al 1%, como es el caso del VHB [5].
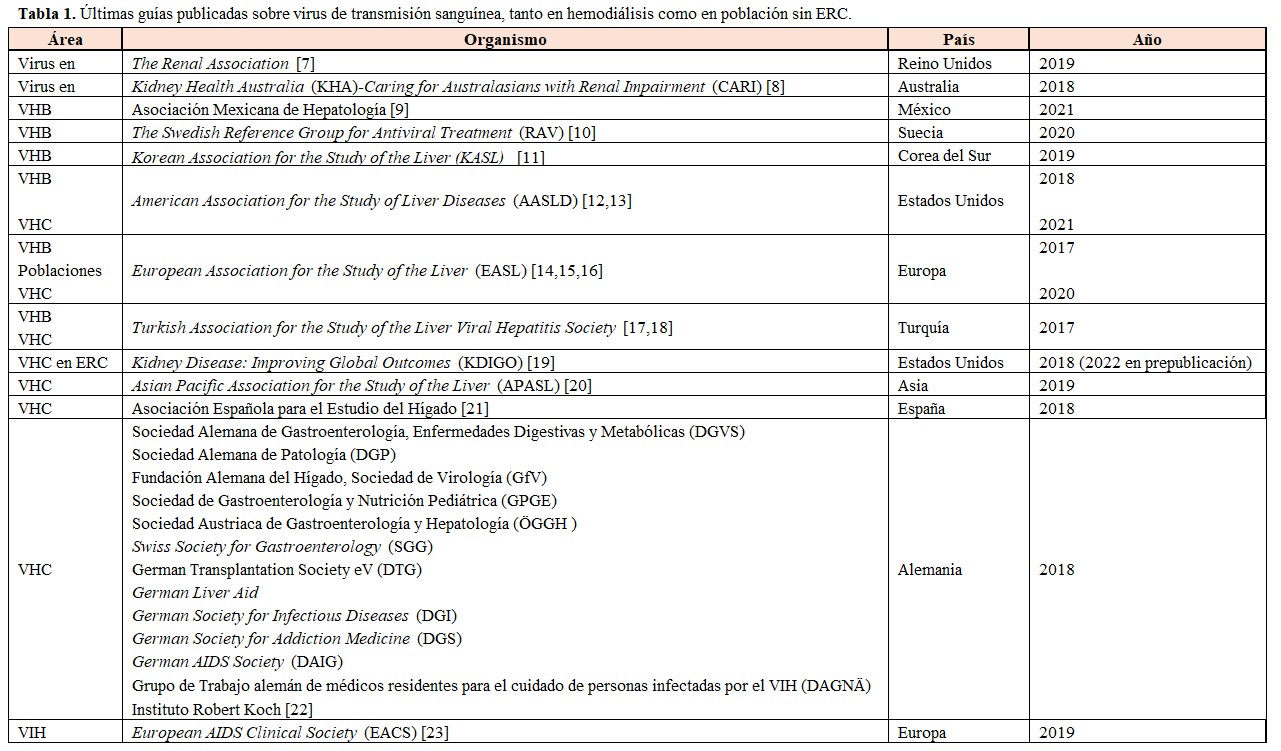
La disminución drástica y progresiva de la prevalencia de los virus de transmisión sanguínea en hemodiálisis es lo que puede haber llevado a que las sociedades científicas hayan dejado de actualizar sus guías de práctica clínica a este respecto. La Sociedad Española de Nefrología (S.E.N.) publicó su última guía en 2003; la European Renal Association (ERA-EDTA) realizó un documento de posicionamiento respecto al VHC en 2009 [6], aprobando las guías Kidney Disease Improving Global Outcomes (KDIGO); y las KDIGO han mantenido sus publicaciones sobre el VHC, pero nunca han llevado a cabo una guía sobre el VHB o el VIH. Solo han elaborado guías completas un par de sociedades nefrológicas, la británica y la australiana, y se ha de consultar el trabajo realizado por sociedades científicas de otras especialidades (hepatología, enfermedades infecciosas) para extrapolar las recomendaciones de manejo al área de hemodiálisis, aunque solo algunos de estos documentos dedican un apartado muy superficial y escueto a los pacientes con enfermedad renal crónica (ERC), sin dar respuesta a las cuestiones y necesidades de nefrología.
Este capítulo tiene como objetivo recoger las conclusiones de las últimas guías de práctica clínica de los virus de transmisión sanguínea, con el fin de aclarar las normas de actuación y poner de relieve la necesidad de que las sociedades científicas se reúnan y vuelvan a actualizar sus directrices, promoviendo que todas las unidades de hemodiálisis, en especial las de un mismo país, actúen de manera unificada y coordinada, mejorando las estrategias de coste-eficacia y la seguridad del paciente y del personal sanitario. Factores como la falta de adherencia terapéutica, el cambio en los hábitos sexuales o los movimientos migratorios han ocasionado que la prevalencia de los virus de transmisión sanguínea fluctúe en determinadas unidades de hemodiálisis, por lo que los nefrólogos deben seguir alerta ante un posible nuevo caso, manteniendo la vigilancia de los controles de calidad y poniendo en marcha estrategias de prevención de la infección y el contagio.
Ante la falta de guías específicas sobre el manejo del VHB en hemodiálisis, se han revisado las más recientemente publicadas por sociedades de hepatología o enfermedades infecciosas (Tabla 1). Se han tenido en cuenta las guías del VHC publicadas a partir de 2015, debido al impacto que los antivirales directos han supuesto en el manejo de la infección y la disminución de la prevalencia a todos los niveles.
2. DETECCIÓN Y SEGUIMIENTO SEROLÓGICO DE LA INFECCIÓN POR VHB, VHC Y VIH EN HEMODIÁLISIS
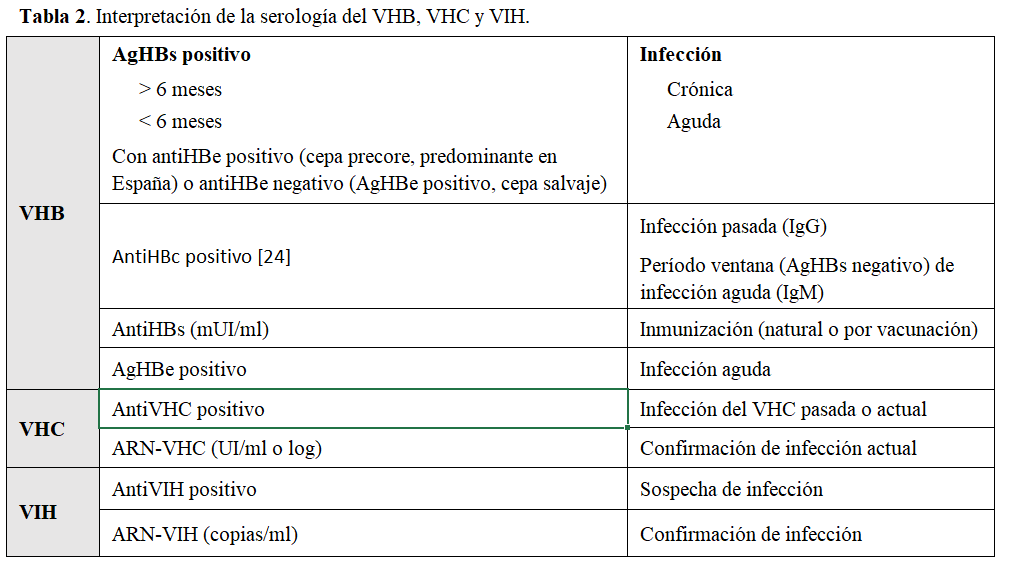
2.1. INTERPRETACIÓN DE LA SEROLOGÍA
Se resume en la (Tabla 2).
El antiHBc puede ser adquirido de forma pasiva por una transfusión reciente de hemoderivados, por lo que los tests serológicos deben realizarse antes de recibir la transfusión para evitar falsos positivos [7].
2.2. SEROLOGÍA AL INICIO DE HEMODIÁLISIS
-Todos los pacientes deben ser informados de las implicaciones de padecer una infección de virus de transmisión sanguínea y del riesgo de infectividad (evidencia no clasificada [7]).
2.2.1. VHB
-Se recomienda el cribado de infección por VHB en todos los pacientes que inician hemodiálisis (1A [7]; 1B [8][15][17]) como pacientes nuevos o transferidos desde otra terapia renal sustitutiva (TRS) (1A [7]).
-Para el cribado de infección por VHB, se recomienda el estudio del AgHBs, antiHBc y antiHBs [8][12].
En un paciente con AgHBs negativo, los antiHBc pueden utilizarse para diferenciar la infección actual (IgM) de la exposición previa (IgG). Algunas guías añaden también las pruebas de función hepática (1B [8]), dada su rapidez, disponibilidad y bajo coste. El aumento de transaminasas debe llevar a descartar una posible infección por virus hepatotropos.
2.2.2. VHC
-Se recomienda establecer las estrategias de cribado de infección por VHC de acuerdo con los datos epidemiológicos locales y los planes locales, regionales y nacionales de acción (1A [16]).
-Se recomienda el cribado de infección por VHC en todos los pacientes que inician hemodiálisis (1A [7][19]; 1B [8][9][12][18]) como pacientes nuevos o transferidos desde otra modalidad de TRS.
-Para el cribado de infección por VHC, se recomienda la realización de antiVHC a todos los pacientes que inician hemodiálisis (1A [8][13][15][16][19][22]).
-Se recomienda la realización de carga viral del VHC (ARN-VHC) en los pacientes con antiVHC positivo (1A [7]).
-Los pacientes con factores de riesgo de VHC, actuales o históricos, deben ser evaluados inicialmente por ARN-VHC y posterior control con métodos serológicos si no persisten los factores de riesgo (1A [7]), con el objetivo de confirmar una infección actual y evitar un falso negativo en período ventana.
Los factores de alto riesgo de infección por virus de transmisión sanguínea se encuentran en la (Tabla 3).
-En personas inmunodeprimidas, se recomienda el cribado de VHC mediante la realización de ARN-VHC [15][22], por la dificultad para desarrollar antiVHC.
-En pacientes con infección pasada por el VHC o respuesta viral sostenida al tratamiento de la infección por VHC, se recomienda el cribado de infección por VHC mediante ARN-VHC (1B [19]; 1A [7]), porque el antiVHC permanece positivo en la mayoría de los casos.
2.2.3. VIH
-Se recomienda el cribado de VIH en todos los pacientes que inician hemodiálisis (1C [7]; 1B [8]).
2.3. CONTROL SEROLÓGICO EN PACIENTES PREVALENTES EN HEMODIÁLISIS
-Se recomienda el análisis mensual de GPT en los pacientes en hemodiálisis (1B [8][19]; evidencia no clasificada [8]).
En los pacientes con infección de novo por VHB y VHC puede observarse un aumento de los niveles séricos de GPT antes de positivizarse la serología, por lo que la monitorización basal y mensual en pacientes susceptibles puede llevar a la detección precoz de una posible infección [7], que hay que confirmar con AgHBs y antiVHC. No hay que olvidar que los pacientes con ERC suelen tener niveles bajos de transaminasas, por lo que este control no sustituye a la serología habitual.
-Se recomienda que la prevalencia e incidencia locales de hepatitis B y C sean consideradas a la hora de determinar la frecuencia del análisis de aminotransferasas (GOT/GPT) (1C [8]).
-Se recomienda que todos los pacientes con infección crónica por VHB, VHC o VIH, sean derivados para estadiaje y tratamiento de la enfermedad (evidencia no clasificada [8]) al hepatólogo o infectólogo.
2.3.1. VHB
Según inmunización frente al VHB
-En los pacientes de hemodiálisis que sean inmunes frente al VHB, se aconseja determinar el AgHBs cada 6 meses (1C [7]). En esta recomendación están incluidos los pacientes con antiHBc positivo, cuyo riesgo de reactivación aumenta en estado de inmunosupresión.
-En los pacientes de hemodiálisis no respondedores a la vacunación frente al VHB, se aconseja determinar el AgHBs cada 3 meses (1C [7]), especialmente si los pacientes no inmunes viven en zonas de alta prevalencia del VHB (2C [8]).
Algunas guías contemplan que las unidades de hemodiálisis opten por la determinación rutinaria de AgHBs cada 3 meses a todos los pacientes para una mayor comodidad [7], aunque, en términos de gestión y coste-eficiencia, se debería valorar el estudio analítico de manera individualizada, lo que también mejora la atención sanitaria personalizada.
-Se recomienda que a los pacientes vacunados frente al VHB, con antiHBs iguales o superiores a 10 mUI/ml, se les realice serología del VHB anualmente y, en los pacientes con antiHBs inferiores a 10 mUI/ml, cada 6 meses (1C [8]).
-Se recomienda no realizar el AgHBs en las dos semanas posteriores a la vacunación de VHB para evitar falsos positivos (evidencia no clasificada [7]).
Reactivación del VHB
En pacientes con AgHBs negativo y antiHBc positivo, existe una reactivación del VHB cuando se observa el aumento de ADN-VHB en al menos x 102 UI o 1 log o si se vuelve a positivizar el AgHBs.
La aparición de antiHBc positivo se relaciona con la exposición previa a una infección por el VHB, de duración variable y, consecuentemente con mayor o menor riesgo de desarrollar hepatocarcinoma según el tiempo de exposición, por lo que debe individualizarse su vigilancia posterior [28]. La carga viral detectable indica infectividad, es decir, la capacidad del virus para ocasionar infección en el huésped. La supresión de la carga viral del ADN-VHB es el objetivo principal del tratamiento, pues representa la disminución de la actividad necroinflamatoria, de la progresión de la fibrosis hepática y de la aparición de hepatocarcinoma. La pérdida de AgHBs, con o sin seroconversión a antiHBs, indica la profunda supresión de la replicación del VHB y de la expresión de proteína viral.
-Se recomienda que los pacientes con antiHBc positivo reciban profilaxis antiviral en situaciones de riesgo de reactivación (evidencia no clasificada [7]).
El riesgo de reactivación se asocia con tres factores principales [9]:
Serología [26].
a) Riesgo bajo (inferior al 1%), en pacientes antiHBc-positivos que están inmunizados frente al VHB (antiHBs iguales o mayores de 10 mUI/ml).
b) Riesgo moderado (1-10%), en pacientes antiHBc-positivos sin inmunización frente al VHB (antiHBs inferiores a 10 mUI/ml).
c) Riesgo alto (mayor del 10%), en pacientes con AgHBs positivo.
Enfermedad concomitante. Se trata de patología que alteran de por sí el sistema inmune, como el cáncer y las enfermedades autoinmunes, entre otras.
Quimioterápicos e inmunosupresores [27].
a) Riesgo bajo (inferior al 1%): metotrexate, azatioprina, 6-mercaptopurina, esteroides durante menos de una semana.
b) Riesgo moderado (1-10%): inhibidores de la calcineurina; inhibidores de la tirosina quinasa (imatinib, nilotinib); inhibidores alfa-TNF (infliximab, adalimumab, etanercept); inhibidores de la citoquina (abatacept, ustekinumab); derivados de la antraciclina (doxorrubicina, epirrubicina) en pacientes con AgHBs negativo o antiHBc positivo; prednisona 10 mg/día o más durante cuatro semanas o más (o el corticosteroide equivalente) si AgHBs negativo o antiHBc positivo; menos de 10 mg/día de prednisona durante más de cuatro semanas (o el corticosteroide equivalente) si AgHBs positivo.
c) Riesgo alto (mayor al 10%): quimioterapia sistémica; agentes deplecionadores de células B (rituximab, ocrelizumab); derivados de la antraciclina (doxorrubicina, epirrubicina) si AgHBs positivo; prednisona 10 mg/día o más durante cuatro semanas o más (o el corticosteroide equivalente) si AgHBs positivo.
Infección oculta por el VHB (IOB)
Se define como la presencia de AgHBs negativo con bajos niveles de ADN-VHB (20-200 UI/ml) y, en la mayoría de los casos (80%), IgG antiHBc positiva. El diagnóstico se realiza mediante biopsia hepática, observándose ADN-VHB a nivel tisular, pero en su defecto puede usarse una muestra de sangre para el análisis de ADN-VHB. Actualmente no está indicado el cribado de IOB en las unidades de hemodiálisis y no se especifica en ninguna guía. Las guías de VHB siguen refiriéndose a los IOB con antiHBc positivo como pacientes antiHBc-positivo, que van a tener siempre ADN-VHB residual, a nivel monocitario y/o intrahepatocitario, detectable o no en sangre (20-200 UI/ml). Estos pacientes (antiHBc positivo) tienen riesgo de reactivación y deben ser vigilados como cualquier otro paciente y especialmente cuando se sometan a procesos o medicación que les cause inmunosupresión.
No está descrita la reactivación en los pacientes con IOB y antiHBc negativo, por lo que siempre que haya un aumento del ADN-VHB habrá que sospechar una infección de novo.
-Los pacientes con infección oculta e inmunización frente al VHB deben ser monitorizados periódicamente con GOT/GPT y semestralmente con serología (evidencia no clasificada [8]) para vigilar una posible reactivación (en la unidad de VHB-negativos).
En pacientes con IOB, el aislamiento o derivación a una unidad de VHB-positivos se valora según el estado de inmunización frente a la vacuna del VHB. Las guías disponibles no hacen referencia a la unidad donde estos pacientes deben dializarse durante la fase de vacunación. Si se cumplen las medidas de precaución universal, estos pacientes pueden permanecer en la unidad de VHB-negativos hasta valorar la respuesta a la vacunación. Cada unidad de hemodiálisis debe protocolizar sus pautas de actuación de acuerdo con los recursos disponibles y los servicios de medicina preventiva, enfermedades infecciosas y/o hepatología.
Infección previa por VHB
-En los pacientes VHB-positivos que hayan sido tratados con antivirales y hayan alcanzado AgHBs negativo y ADN-VHB indetectable durante al menos un año, se recomienda mantener las medidas de prevención que se realizan con pacientes VHB-negativos. En cualquier otro caso, se recomienda dializar con monitores exclusivos (evidencia no clasificada [7]).
2.3.2. VHC
VHC-negativos
-Se recomienda el cribado de infección por VHC cada 6 meses (1A [19]; 1C [8]).
Algunas guías establecen la periodicidad en 3-6 meses (1C [7]) o incluso anualmente [18].
VHC-positivos
-En pacientes de hemodiálisis con infección pasada o respuesta viral sostenida al tratamiento de la infección por VHC, se recomienda el cribado de infección por VHC mediante carga viral (ARN-VHC) y cada 6 meses, con el objetivo de detectar una nueva infección (1B [19]; evidencia no clasificada [7]).
El antiVHC puede seguir siendo positivo en los pacientes con infección por VHC a pesar de alcanzar respuesta viral sostenida, indicando infección pasada. Algunas guías recomiendan controles más frecuentes en pacientes con alto riesgo de infección por VHC (evidencia no clasificada [8]).
-Se recomienda el cribado del virus de la hepatitis A (VHA), VHB y VIH en pacientes con infección por VHC (1A [19]), con ARN-VHC negativo o positivo, y la vacunación frente al VHA y VHB, según corresponda (1A [19][10]).
-No está indicada la profilaxis antiviral ni una vigilancia más intensiva en los pacientes con infección pasada o respuesta viral sostenida al tratamiento del VHC, dado que no se ha observado mayor recurrencia de la infección por esta causa [18].
2.3.3. VIH
-En pacientes de hemodiálisis no es necesaria la vigilancia de antiVIH a menos que el paciente sea de alto riesgo (1C [7]) o tenga coinfección por VHB y/o VHC (1B [8]).
2.4. INCIDENCIAS RELACIONADAS CON VIRUS DE TRANSMISIÓN SANGUÍNEA
Cambio de unidad de hemodiálisis
-Se recomienda que todos los pacientes que inician hemodiálisis en otro centro, en zonas donde la tasa endémica de virus de transmisión sanguínea es alta y/o la adherencia a las medidas de control de infección es incierta, sean testados para VHB, VHC y VIH al inicio y a las 6 semanas (1C [8]) si los primeros resultados fueran negativos, para detectar una infección fuera del posible período ventana.
-Se recomienda el cribado de infección por VHC (antiVHC) en todos los pacientes transferidos desde otro centro de hemodiálisis [19].
Esta práctica sugiere que debe hacerse una serología del VHC antes y después de un período vacacional o un episodio de hospitalización. No hay guías específicas de VHB y VIH, pero se recomienda que, en zonas de alta prevalencia de infección, se realice una serología completa (de VHB, VHC y VIH). La falta de guías al respecto dificulta el posicionamiento sobre la petición de serología vírica en los desplazamientos del paciente entre distintos centros. Los autores recomiendan que hospitales de referencia y centros extrahospitalarios acuerden la determinación de la serología vírica cuando tenga lugar una hospitalización.
Riesgo de exposición a virus de transmisión sanguínea
-Los pacientes y el personal con riesgo alto de exposición deben ser asesorados respecto a profilaxis postexposición de VHB y VIH y monitorizados para VHB, VHC y VIH (evidencia no clasificada [8]).
Se puede asesorar sobre la postexposición del VHC, pero no sobre la profilaxis, dado que no existe en la actualidad.
-Se recomienda la determinación de AgHBs y ARN-VHC a pacientes en hemodiálisis con elevación inexplicable en la concentración sérica de aminotransferasas (1B [7]).
-Se recomienda que, ante cualquier infección de transmisión sanguínea en una unidad de hemodiálisis, se obtenga asesoramiento experto sobre la vigilancia de los pacientes y personal de alto riesgo y se organice el tratamiento de las personas afectadas (1C [7]).
-Se recomienda que, ante una nueva infección por virus de transmisión sanguínea, se realice la serología del VHB (AgHBs y/o ADN-VHB) y VHC (ARN-VHC) a todos los pacientes que hayan podido estar expuestos (1B [7][19]) o a todos los pacientes de la unidad (1C [8]).
-Ante un nuevo caso de infección de transmisión sanguínea en una unidad de hemodiálisis, se debe revisar el cumplimiento de los protocolos de control de infecciones, de limpieza y de desinfección (evidencia no clasificada [7]).
-Se recomienda que, ante una infección de novo por VHB o VHC, el paciente sea derivado al especialista correspondiente para la valoración de tratamiento y reducción del riesgo individual y poblacional [7].
Esta indicación es extrapolable a la infección de novo por VIH.
Algunas guías ponen como ejemplo repetir el cribado de VHC cada mes en los primeros tres meses, cada tres meses en los siguientes seis meses y cada seis meses en adelante [19]; otras guías sugieren repetirlo cada dos semanas durante tres meses (1C [8]).
3. PREVENCIÓN DE LA TRANSMISIÓN DEL VHB, VHC Y VIH EN HEMODIÁLISIS
3.1. MEDIDAS DE PRECAUCIÓN UNIVERSALES
3.1.1. Se recomienda que todas las unidades de hemodiálisis prioricen la adherencia a los procedimientos estándares de control de infecciones (1A [7][19]).
Las guías recalcan que las medidas de prevención son prioritarias frente al tratamiento antiviral de pacientes VHC-positivos. El método más importante de prevención de contagio de virus de transmisión sanguínea es la aplicación rigurosa de las precauciones universales de control de infecciones. Estas medidas incluyen las precauciones higiénicas que eviten la transferencia de sangre o fluidos contaminados entre pacientes, ya sea directamente o a través de equipos o superficies contaminadas [7][19]:
¿ Higiene de manos y cambio de guantes, especialmente entre el contacto con distintos pacientes, antes de procedimientos invasivos y después del contacto con sangre y superficies o productos potencialmente contaminados con sangre.
¿ Prácticas adecuadas de preparación y administración de la medicación inyectable, siguiendo técnicas asépticas.
¿ Uso de bata desechable y protección ocular cuando exista riesgo de salpicaduras de sangre u otros fluidos corporales.
¿ Desecho de material punzante en contenedores específicos sin llenar su capacidad más de dos tercios (1D [8])
¿ Evitar la reutilización de agujas.
¿ Cura de cortes o abrasiones del personal con apósitos resistentes al agua.
¿ Limpieza y desinfección exhaustiva de las superficies de la unidad de diálisis, en especial las superficies de contacto frecuente.
¿ Uso de protectores de contaminación sanguínea en los transductores de presión de los monitores de hemodiálisis.
¿ Adecuada separación de zona limpia y sucia.
3.1.2. Se recomienda que las unidades de hemodiálisis adopten medidas dirigidas a la promoción de la higiene de manos, higiene medioambiental, equipos de protección, reducción de contaminación cruzada, reducción de la carga de enfermedad de los pacientes y reducción de la posibilidad de colonización o infección de pacientes si se exponen a agentes infecciosos (1D [8]).
3.1.3. Se recomienda material de un solo uso que sea desechado posteriormente (1D [8]).
3.1.4. Se han identificado factores relacionados con la práctica del control de infecciones que pueden favorecer la transmisión del VHC en las unidades de hemodiálisis [19] y que serían extrapolables al VHB y VIH:
-Preparación de inyecciones en un ambiente contaminado.
-Reutilización de un vial de una sola dosis para más de un paciente.
-Uso del carro de curas para transportar fungible o medicación a los pacientes.-
-Inadecuación de la limpieza o desinfección de las superficies de la unidad entre diferentes pacientes.
-Fallo en la separación de áreas limpias y contaminadas.
-Fallo en el cambio de guantes y la realización de higiene de manos entre las tareas o los pacientes.
-Cambio rápido de los procedimientos.
-Bajo ratio de personal por paciente.
3.1.5. Material y equipos de protección
-Se recomienda que las unidades de hemodiálisis tengan un adecuado abastecimiento de equipos de protección, disponibles para su uso (1D [8]).
El estocaje de equipos de protección debe incluir variedad de guantes (distintas tallas y material de fabricación para las personas que presentan alergias), batas, pijamas, protectores oculares, mascarillas, etc [8].
-Se recomienda usar los equipos de protección cuando haya un alto riesgo de exposición a sangre u otros fluidos potencialmente contaminantes o cuando se vayan a insertar o manipular catéteres venosos centrales de hemodiálisis usando técnica aséptica (1D [8]).
3.1.6. Vigilancia del cumplimiento de los protocolos
-Se recomiendan auditorías de los procedimientos de control de la infección en las unidades de hemodiálisis (1C [7][19]).
Para garantizar las medidas de prevención, se recomienda que en todas las unidades de hemodiálisis se disponga de protocolos y guías de actuación claros y específicos. Además, se deberían realizar auditorías o revisiones periódicas para garantizar el cumplimiento de dichos protocolos a través de los siguientes indicadores [7]:
¿ Cumplimiento de los estándares de desinfección de monitores entre sesiones de hemodiálisis.
¿ Frecuencia y consecuencias de la contaminación de los sensores de presión con sangre o suero salino durante las sesiones de hemodiálisis.
¿ Proporción de pacientes prevalentes inmunes al VHB (antiHBs iguales o superiores a 10 mUI/ml) en el último año y proporción de pacientes no inmunes con AgHBs en los últimos tres meses.
¿ Proporción de pacientes incidentes en hemodiálisis de forma programada en el hospital con antiHBs mayores de 100 mUI/ml (inmunización óptima).
¿ Proporción de pacientes con infección por VHB conocida que se han dializado en aislamiento.
-Se sugiere que puede ser apropiado para las unidades de hemodiálisis modificar políticas de cribado, manejo clínico, limpieza y uso de equipos de protección según el riesgo local de prevalencia, infectividad y patogenicidad de los agentes infecciosos (2C [8]).
3.1.7. Desinfección del equipo y material de hemodiálisis
-Se recomienda que la pantalla del monitor sea desinfectada inmediatamente después de la conexión del paciente al monitor de diálisis y que los puestos de diálisis sean limpiados después de cada sesión (1C [7]; 1D [8]).
Las guías recomiendan disponer de protocolos de limpieza y desinfección de superficies y equipos de diálisis. Para cada agente químico y desinfectante se deben seguir las recomendaciones del fabricante, así como para la limpieza de los circuitos internos del monitor.
-Se recomienda que los monitores de diálisis estén equipados con protectores externos en los transductores de presión para minimizar el riesgo de salpicaduras y que sean reemplazados si fuera necesario (1D [8]) y que sean inspeccionados por el personal sanitario durante y después de cada sesión de hemodiálisis (2C [7]).
-Si se evidencia la rotura de los transductores externos de las líneas, el monitor debe quedar fuera de servicio y los componentes de la máquina que puedan haber estado en contacto con sangre deben ser reemplazados o descontaminados según las instrucciones del fabricante y por personal cualificado (2C [7]).
3.1.8. Preparación de la medicación parenteral
-Las viales multidosis se deben preparar y distribuir desde un área centralizada (1B [7]; 1C [8]).
-Se recomienda que se desechen los viales de medicamentos después de un solo uso y se eviten viales de usos múltiples (1B [7]; 1C [8]).
-Los viales de administración intravenosa etiquetados como de un solo uso no deben perforarse más de una vez (1B [7]) para garantizar la esterilidad del producto.
3.2. AISLAMIENTO DE PACIENTES Y MONITORES DE HEMODIÁLISIS
3.2.1. VHB
-En un paciente de hemodiálisis sin AgHBs conocido, se recomienda la diálisis en un área separada de la unidad de VHB-negativos y con aislamiento del monitor (1A [7]).
-Los pacientes infectados por VHB deben ser dializados en áreas separadas de la unidad de pacientes VHB-negativos (1A [7]; 2C [8]).
-Los pacientes infectados por VHB o con alto riesgo de infectarse deben usar monitores de diálisis independientes (1A [7]; 2C [8]).
-Un monitor usado por un paciente infectado por VHB puede volver a usarse en pacientes no infectados solo después de que se haya descontaminado mediante la desinfección que se considere eficaz contra el VHB (1A [7]).
3.2.2. VHC
-Se recomienda no aislar a los pacientes con infección por VHC (1C [7]; 2C [8][19]) siempre que se aseguren las medidas de precaución universales y se asegura la correcta desinfección tras cada sesión de hemodiálisis (1D [7]; 2C [8]).
-Se recomienda no dedicar monitores de diálisis exclusivos para pacientes con infección por VHC (2C [19]).
-En unidades de hemodiálisis con alta prevalencia del VHC (mayor del 15%) o ante un brote que no se haya podido contener, se recomienda dializar a los pacientes VHC-positivos en unidades de aislamiento y con monitor exclusivo (2C [8]).
-Los pacientes con infección por VHC y respuesta viral sostenida al tratamiento deben ser manejados de igual manera que los pacientes VHC-negativos (evidencia no clasificada [8]).
-Algunos autores sugieren que los pacientes con infección por VHC y alta carga viral (alto riesgo de transmisión del virus) se manejen de igual manera que los pacientes con infección por VHB, dializándose en unidades de aislamiento y con monitor exclusivo (evidencia no clasificada [8]).
3.2.3. VIH
-Los pacientes infectados por VIH no necesitan ser dializados en un área separada (1C [7]; 2C [8]) ni con monitores exclusivos (1D [7]; 2C [8]) si se cumplen correctamente las medidas de precaución universales y se asegura la correcta desinfección tras cada sesión de hemodiálisis.
-Los pacientes con carga viral elevada de VIH deben dializarse en aislamiento y con monitores exclusivos [8].
-Algunos autores sugieren que los pacientes con infección por VIH y alta carga viral (alto riesgo de transmisión del virus) se manejen de igual manera que los pacientes con infección por VHB, dializándose en unidades de aislamiento y con monitor exclusivo (evidencia no clasificada [8]).
3.3. VACUNACIÓN FRENTE AL VHB
En relación a los virus de transmisión sanguínea, actualmente solo existe vacunación frente al VHB.
3.3.1. Indicaciones de vacunación frente al VHB
-Se recomienda que los pacientes que vayan a requerir TRS se vacunen frente al VHB antes de desarrollar ERC G5 o dos años antes de que vayan a precisar terapia de reemplazo renal (1A [7]).
-Se recomienda vacunar frente al VHB a todos los pacientes de hemodiálisis que tengan indicación (1A [7][11][12]), esto es, AgHBs negativo y antiHBs inferiores a 10 mUI/ml, incluyendo a los pacientes con antiHBc positivo [7][12][17].
La vacuna no está indicada en pacientes con infección aguda o crónica por VHB (AgHBs positivo). Los pacientes con antiHBc positivo que no desarrollan inmunización natural frente al VHB (antiHBs iguales o superiores a 10 mUI/ml) tienen riesgo de reactivación del VHB, por lo que se debe prestar especial atención a su vacunación (2B [7]).
3.3.2. Pauta de vacunación frente al VHB
-Se recomienda que la vacunación inicial frente al VHB sea a dosis altas y frecuentes o ambas y por administración intramuscular (deltoides), aunque puede ser más efectiva la vía intradérmica (1A [7][14]).
La literatura reciente recomienda cuatro dosis dobles de vacuna convencional (40 mcg) o cuatro dosis de vacuna adyuvada (20 mcg) a los 0, 1, 2 y 6 meses [29].
-Si el título de antiHBs es inferior a 10 mUI/ml, se recomienda repetir el ciclo de vacunación con dosis alta de vacuna y realizar un control a las 4-6 semanas de la última dosis para confirmar que el título es mayor de 10 mUI/ml (1C [7]).
-Si el título de antiHBs sigue siendo inferior a 10 mUI/ml tras dos ciclos completos de vacunación, se debe considerar al paciente no respondedor y no inmune frente al VHB (evidencia no clasificada [7]).
-Se recomienda que las personas no respondedoras a la vacunación frente al VHB no reciban más dosis de vacuna, ya que la probabilidad de beneficio es baja y el coste es alto. Sin embargo, hay evidencia de que los no respondedores a un ciclo de cuatro dosis de 40 mcg podrían responder a una dosis por vía intradérmica (evidencia no clasificada [7]).
-Un paciente considerado no respondedor y, por tanto, no inmune frente al VHB, debe ser asesorado sobre la minimización del riesgo de exposición al VHB y las medidas a tomar en caso de potencial exposición al VHB (1B [7]).
3.3.3. Respuesta a la vacunación frente al VHB
-Se recomienda realizar un seguimiento postvacunal a los 1-2 meses y al año para valorar la respuesta a la vacunación [11][12].
Este seguimiento obedece a la rápida pérdida de la inmunización que tiene la población con ERC y su alto riesgo de exposición continua al VHB en hemodiálisis y extracciones sanguíneas.
-Se considera que un paciente es respondedor inadecuado a la vacuna frente al VHB si el título de antiHBs es menor de 100 mUI/ml a las 8 semanas de recibir un ciclo completo de vacunación (1C [7]).
-Se consideran respondedores los pacientes con un título de antiHBs mayor de 100 mUI/ml a las 8 semanas de completar el ciclo de vacunación (1C [7]).
La inmunización frente al VHB se produce a partir de un título de antiHBs igual o superior a 10 mUI/ml, pero se considera una respuesta pobre, por lo que las guías recomiendan que se consigan títulos más altos para asegurar la protección.
-Se recomienda que los pacientes respondedores reciban una dosis de recuerdo (booster) si el título de antiHBs desciende por debajo de 100 mUI/ml (1B [7]) o, según otras guías, por debajo de 10 mUI/ml [11].
-Se recomienda realizar un control de antiHbs a los pacientes respondedores a la vacunación frente a VHB antes de viajar al extranjero o de tener una exposición de riesgo y reciban una dosis de recuerdo si el título es inferior a 100 mUI/ml (1C [7]).
-Se recomienda realizar una vigilancia de todos los pacientes que no tengan una respuesta inmune adecuada (es decir, que no tengan antiHBs mayores de 100 mUI/ml en los últimos 6 meses) y que se hayan dializado en la misma unidad que un paciente con infección de novo desde la última prueba negativa de este (1B [7]).
-Se recomienda considerar una dosis de Ig de VHB en los pacientes no respondedores a la vacunación si han estado expuestos en los siete días previos (evidencia no clasificada [7]).
4. PERSONAL DE HEMODIÁLISIS
4.1. SEROLOGÍA DEL PERSONAL DE HEMODIÁLISIS
-Se recomienda que el personal que tenga contacto con pacientes sea testado frente a VHB y se vacune en caso de no ser inmune (1A [7]; evidencia no clasificada [8][11].
-Se recomienda vacunar frente al VHB al personal que pueda estar en contacto con equipos de hemodiálisis infectados (evidencia no clasificada [7]).
-Se recomienda que el personal no inmune frente al VHB no dialice a pacientes con infección activa por VHB (2Bvii; evidencia no clasificada [8]).
-El personal que dialice a pacientes VHB-positivos no puede dializar simultáneamente a pacientes VHB-negativos (1A [7]) o debe llevar un equipo de protección individual desechable y cumplir estrictamente con las medidas de higiene de manos antes de pasar de un paciente a otro (evidencia no clasificada [7]).
-El personal con infección actual por VHB no debe trabajar en una unidad de hemodiálisis (evidencia no clasificada [7]).
-Se recomienda que a los trabajadores sanitarios con hepatitis B crónica se les permita realizar procedimientos invasivos (con posible exposición sanguínea) si su carga de ADN-VHB es y se mantiene por debajo de 1.000 UI/ml; si es superior a 1.000 UI/ml, se recomienda terapia antiviral [30].
4.2. FORMACIÓN Y RECICLAJE DEL PERSONAL DE LA UNIDAD DE HEMODIÁLISIS
-Se recomienda que el personal de la unidad de hemodiálisis reciba formación sobre las medidas de precaución universales (en especial, la higiene de manos y las técnicas de asepsia) y que la adherencia sea auditada de forma rutinaria (1C [8]).
-La formación del personal debe incluir la educación sobre privacidad del paciente para proteger la confidencialidad sobre el diagnóstico de enfermedad vírica de transmisión sanguínea (evidencia no clasificada [8]).
-Para reducir la confusión y el estigma asociados a las enfermedades víricas de transmisión sanguínea, se debe informar a los pacientes y al personal sobre el nivel de riesgo de dichas infecciones y el propósito de mantener unidades de aislamiento en hemodiálisis (evidencia no clasificada [8]).
-Los pacientes y el personal con riesgo alto de exposición deben ser asesorados respecto a la profilaxis postexposición del VHB y VIH y deben ser monitorizados para VHB, VHC y VIH (evidencia no clasificada [8]).