Neoplasias y Trasplante Renal
Palabras clave
Inmunoterapia, tumores en trasplantados, neoplasias donantes de riñon
INTRODUCCIÓN
En los pacientes con enfermedad renal crónica terminal (ERCT) el trasplante renal mejora la calidad de vida y aumenta la supervivencia [1] [2] [3], en comparación con las técnicas de diálisis. Además, los nuevos regímenes inmunosupresores permiten reducir el rechazo y aumentar la esperanza de vida de los receptores renales. Por estas razones, el trasplante renal se ha convertido en la opción terapéutica de elección para los pacientes con ERCT.
Sin embargo, el potente esquema inmunosupresor conlleva efectos secundarios adversos como el alto riesgo de desarrollar infecciones y neoplasias malignas e novo [4]. Su presencia podría estar relacionada con la disminución de la inmunidad del huésped que suprime la inmunovigilancia, crea un entorno permisivo para los virus oncogénicos y puede ser en sí mismo oncogénico [5] [6]. La incidencia de tumores en la población trasplantada renal es aproximadamente 10 veces superior a la de la población general, y lo que es más preocupante es que exhibe un perfil y un comportamiento más agresivo [7] [8] [9]. Además, es una de las mayores causas de mortalidad [10] [11] [12]. A pesar de ello, desconocemos realmente el impacto del cáncer en la comunidad trasplantadora ya que, como sucede en España, no disponemos de registros.
Dentro de los factores que condicionan esta mayor incidencia está la medicación inmunosupresora, tanto por sus propiedades inmunosupresoras como por sus efectos secundarios, que jugaría un papel importante en que los tumores tengan diferente perfil si suceden en un paciente trasplantado o no, así como proporcionar un comportamiento más agresivo. Por tanto, la patología neoplásica en el paciente trasplantado no solo supone una de las mayores causas de mortalidad sino también de empeoramiento de la calidad de vida, por lo que su conocimiento y el establecimiento de estrategias de prevención y terapéuticas son cruciales.
EPIDEMIOLOGÍA DE LOS TUMORES EN PACIENTES TRASPLANTADOS
La muerte con injerto funcionante supone aproximadamente el 50% de las pérdidas de injerto [8] [12] y las neoplasias contribuyen de una manera muy importante a dicha mortalidad, y estarían superadas solo por la enfermedad cardiovascular y/o infecciosa según las series [11] [13]. En general, el cáncer es el responsable del 9-12% del total de los fallecimientos de pacientes trasplantados [8] y es importante constatar la alta comorbilidad de estos pacientes [14] [15].
Existe mucha variabilidad en los diferentes reportes sobre la mortalidad en el trasplante de órganos y esa variabilidad todavía se acentúa más dependiendo del tipo de cáncer [15]. La sensibilidad de los registros en detectar un caso de cáncer en la población trasplantada varía entre el 52.5% y el 84.3% [16]. Nos encontramos con especial discrepancia cuando comparamos la incidencia de cáncer reportada por los trabajos de Kasiske y cols [17] y el registro Australiano y Nueva Zelandés (ANZDATA) [11], con un respectivo 14.9% y 13% de incidencia acumulada en 3 años, y la reportada por el Registro Colaborativo de Trasplante (Collaborative Transplant Registry [CTS]) o por el del Organ Procurement and Transplantation Network/United Network for Organ Sharing (OPTN/UNOS), con un 4.7% y un 3.9% respectivamente [18]. Y es que uno de los principales problemas a la hora de estudiar la incidencia de la patología neoplásica es el diferente tiempo de seguimiento del paciente trasplantado en los diferentes trabajos y registros. Sin olvidar que el tiempo de inmunosupresión o de uso de la medicación inmunosupresora es considerado uno de los factores más importantes en la mayor incidencia de neoplasias en la población trasplantada.
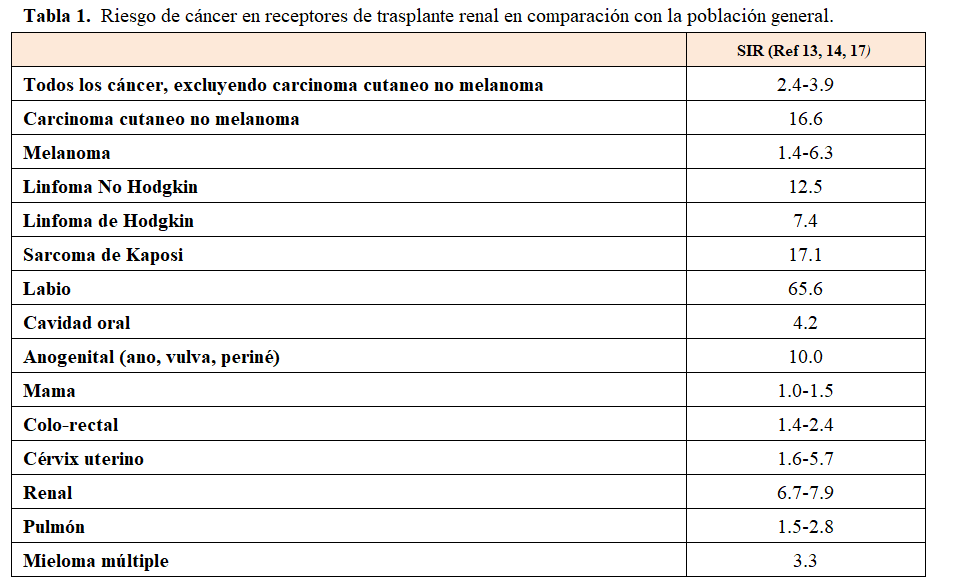
Como ya se ha comentado, el cáncer en el paciente trasplantado exhibe un patrón diferente de comportamiento respecto al mismo acontecido en un paciente no expuesto a la inmunosupresión o medicación inmunosupresora. A esto se suma el diferente espectro de los trasplantes de órgano sólido y sus diferentes peculiaridades. Pero cuando hablamos de cáncer hay que tener en cuenta la gran heterogeneidad de los diferentes tumores y que un tumor no tiene nada que ver con otro en términos de mecanismos, factores de riesgo, pronóstico y esquemas terapéuticos. Así, aunque el riesgo de desarrollar un cáncer en general en la población trasplantada es superior al de la población general, hay diferentes tumores que tienen una especial relevancia en cuanto a su incidencia en la población trasplantada. Las neoplasias malignas más frecuentes en comparación con una población normal no trasplantada corresponden a los cánceres cutáneos [4] [6] [19] [20] [21]. De ellos, el 95% son cánceres cutáneos no melanoma (CCNM), principalmente carcinoma de células basales (CCB) y carcinoma de células escamosas (CCE) [6] [22]. En cuanto a los cánceres no cutáneos, las neoplasias más frecuentes en comparación con la población general son el sarcoma de Kaposi (SK), seguido por el trastorno linfoproliferativo (ELPT) y el cáncer de riñón [23] [24] (Tabla 1).
Además, el paciente trasplantado ha pasado previamente por otras etapas de la historia natural de la enfermedad renal crónica en las que va a haber también mayor incidencia de cáncer, aunque con diferente incidencia según el tipo de tumor de órgano sólido del que estemos valorando. Por ejemplo, existen tumores asociados a la función renal como sería el cáncer renal que contaría con mayor riesgo cuando el paciente está en diálisis que cuando se trasplanta, y que su riesgo vuelve a incrementarse si el paciente pierde el injerto y vuelve a diálisis. En cambio, otros tumores como el melanoma o el tumor de pulmón, así como el SK, los CCNM o la ELPT no dependen tanto de la función renal sino del estado de inmunosupresión y/o existencia de oncovirus. Aunque no hay que olvidar que en general todos ellos tienen incidencia más alta que si ocurrieran en una persona no inmunodeprimida o enferma de riñón [25] [26] [27] [28]. Con todo ello hay que desarrollar estrategias específicas de prevención en el paciente renal ya incluso antes que su estadio avance, esté en diálisis o trasplantado. Dichas estrategias se deben sumar a las generales propuestas en la población general.
La oncogénesis y el comportamiento neoplásico en los pacientes trasplantados pueden venir por diferentes vías como sería la transmisión de las neoplasias por los donantes, la recurrencia de tumores previos y la existencia de neoplasias de novo post-trasplante.
Transmisión de las neoplasias por los donantes
A través del trasplante de órganos se pueden transmitir neoplasias procedentes de donantes con tumores malignos conocidos o desconocidos en el momento de la donación. Sin embargo, el riesgo de transmisión es reducido con una cuidadosa selección de los donantes, ya que sólo el 0,05% de los receptores de órganos desarrollan un tumor transmitido [29]. Aunque obviamente cuando sucede es muy relevante y proporciona una peor morbimortalidad por lo que nos lleva a tomar decisiones complejas, y en muchas ocasiones a la trasplantectomía inmediata. El incremento en la utilización de donantes de edad avanzada, en los que la posibilidad de neoplasia es mayor, puede aumentar el riesgo de transmitir un cáncer oculto [29].
En muchos pacientes con cáncer (ej. mama [30], colorectal [31], próstata [32] se detectan células tumorales circulantes (CTC) incluso en fases tempranas. Su presencia tiene un impacto clínico en la recurrencia y la supervivencia de cánceres metastáticos. Sin embargo, aún se está investigando su relevancia en el transcurso de la enfermedad o en el desarrollo de metástasis en estadios iniciales. Se han encontrado CTC en el 20% [33] y en el 42% [34] de pacientes con glioblastoma en diferentes estudios. Para ser clínicamente relevantes y causar metástasis, las CTC necesitan propiedades adicionales, como capacidad de implantación en focos favorables, protección frente a respuestas específicas y no específicas del huésped (disminuidas en pacientes trasplantados) y habilidades para inducir proliferación vascular e iniciar el crecimiento. En consecuencia, el hecho de que los tumores cerebrales raramente sean metastáticos puede explicarse por la capacidad limitada de las células del glioblastoma de sobrevivir fuera del cerebro. Por tanto, la detección de CTC en donantes de órganos no es apropiada en el momento actual, aunque podría convertirse en un método valioso en el futuro.
Aunque no se conoce con precisión la frecuencia de donantes con enfermedad neoplásica ni el riesgo de transmisión de tumores malignos a través del trasplante de órganos, sí puede realizarse alguna aproximación basándose en la información proporcionada por los registros, aunque es necesario interpretar con cautela estos informes, dado que algunos agrupan diferentes tipos tumorales en vez de describir información sobre tumores individuales con un diagnóstico definitivo y datos sobre el estadiaje, detalles que habitualmente no están disponibles. En España, entre 1990 y 2006 se informaron 117 donantes con enfermedad maligna (5,8 por mil donantes), todos con tumores diagnosticados después de la obtención de los órganos [35]. De estos donantes, cinco (0,29 por mil donantes) transmitieron su enfermedad maligna a 10 receptores (0,06% de todos los receptores en este intervalo de tiempo): un sarcoma de tejido blando (a tres receptores), un cáncer de células germinales (a tres receptores), un carcinoma no diferenciado (a dos receptores) y dos carcinomas renales. Estos dos últimos casos corresponden a dos receptores renales que se trasplantaron y posteriormente desarrollaron un adenocarcinoma y un carcinoma papilar, respectivamente. En ambos casos, el diagnóstico se realizó con una biopsia posterior al trasplante [35].
Con todo ello, en la evaluación del potencial donante, tanto si fuera de vivo como de cadáver, el screening de neoplasias se presenta como crucial dentro de las diferentes medidas de evaluación. La UNOS ha publicado guías de recomendación para la aceptación de potenciales donantes que presenten sospecha o confirmación de cualquier tipo de neoplasia. Así mismo, la Organización Nacional de Trasplantes (ONT) también publicó en 2019 su respectivo consenso [29]. Pero hay que entender que dichas recomendaciones en la evaluación médica de cada donante están basadas en parámetros que ofrecen diferentes grados de evidencia dependiendo del tumor que se trate, pero que sus recomendaciones de screening minimizarían la posible transmisión de una neoplasia no conocida en un candidato a la donación a un potencial receptor de órgano [29]. Un aspecto también importante a tener en cuenta es que no todas las neoplasias contraindicarían la donación porque su poca posibilidad de transmisión y su potencial patrón agresivo ofrecerían bajo riesgo a los receptores. En este grupo estarían tumores como los CCNM con bajo potencial de metastatizar, sobre todo basocelulares, algún carcinoma in situ, tumores renales considerados de baja malignidad y algunos tumores del Sistema Nervioso Central [36] [37] [38] [39] [40] [41]. Recientemente, el subcomité que vigila la transmisión de neoplasias por el donante (Malignancy Subcommittee) del comité Disease Transmission Advisory Committee (DTAC) de la OPTN/UNOS sugirió categorizar los riesgos de transmisión para específicos tipos de tumores [40].
Aunque se han sugerido múltiples estrategias de evaluación para evitar la transmisión de los tumores a través del donante, éstas no siempre son fáciles de aplicar y muchas veces están condicionadas por el corto tiempo de evaluación que se dispone a la hora de evaluar un donante cadáver. Por otro lado, y en relación a los casos de transmisión detectados, una vez realizado el trasplante nos lleva a tomar decisiones muy complejas sobre el abandono de la inmunosupresión y la consiguiente trasplantectomía o revisar el balance beneficio-riesgo de mantener el órgano y la inmunosupresión una vez realizado el tratamiento oncológico específico. Y es que aunque el tratamiento del tumor es lo principal a realizar, y se deben de considerar las primeras líneas de tratamiento oncológicas, se tiene que acompañar de una modulación de la inmunosupresión para minimizar la progresión y evitar situaciones de mal pronóstico [7]. Por lo tanto, se deben considerar utilizar estrategias de inmunosupresión lo menos oncogénicas posibles y que estén basadas en un fármaco en concreto con propiedades intrínsecas antineoplásicas como serían los inhibidores de mTOR (i-mTOR) [7] [5]. Varios trabajos han mostrado el beneficio de la conversión de un inhibidor de la calcineurina (ICN) a un i-mTOR en pacientes trasplantados con diagnóstico de neoplasia transmitida en la donación, en especial en el carcinoma renal [42] [43] [44].
Recurrencia de tumores previos al trasplante
En pacientes que han sobrevivido un largo tiempo tras el diagnóstico de neoplasias malignas para las que han recibido a un tratamiento agresivo, aumenta el riesgo de desarrollar neoplasias secundarias de novo [45] (ej. carcinoma de colon metacrónico 10 años después de un cáncer de colon) y de daño orgánico secundario al tratamiento recibido (ej. > 10 años tras el diagnóstico primario y tratamiento curativo con radioterapia o quimioterapia [46] [47]. Este riesgo aumentado puede incluir tumores de origen diferente al del tumor primario (ej. mesotelioma pleural después de recibir radioterapia torácica por un cáncer de mama, o cáncer de mama en mujeres tratadas con radioterapia tipo Mantle por un linfoma).
En la actualidad se está viendo un incremento de candidatos a trasplante renal con historia de patología neoplásica. En principio, estaría asociado a un perfil de candidatos de más edad y con mayor comorbilidad. Los pacientes con historial de neoplasia se exponen a mayor mortalidad en general y mayor incidencia de desarrollar neoplasias post-trasplante, y con ello más mortalidad asociada al cáncer [48] [49] [50] [51]. Con todo ello, el establecimiento del perfil de cáncer en la evaluación del candidato a trasplante renal tiene que tenerse en cuenta con tanta importancia o incluso más que el inmunológico, cardiovascular o infeccioso.
Si estamos evaluando a un potencial candidato a trasplante y nos cuenta que tiene historia de cáncer, se debe realizar un análisis en profundidad de la neoplasia que tuvo y de otras que pudiera desarrollar [48] [51] [52] [53] [54] [55]. Se debe establecer el pronóstico de dicha neoplasia y, al menos, que estimemos cuál va a ser el pronóstico del paciente en cinco años. En el caso que fuera inferior a 5 años de vida se debería considerar que no es un buen candidato para el trasplante [8]. Además, se debe tener en cuenta el papel de la inmunosupresión en la recurrencia de la neoplasia y con ello compararlo con la de seguir en diálisis [25] [26] [56]. Por otro lado, si el cáncer es correctamente tratado y el pronóstico oncológico adecuado, se debería considerar el trasplante dependiendo, eso sí, del tipo de tumor y su estatus, y en consecuencia establecer un tiempo libre de enfermedad neoplásica específico [8] [57] [58]. Todo ello debe ir acompañado de máxima información y firma de un consentimiento informado del tiempo de espera y de los riesgos que tendrá si se trasplanta [59].
Neoplasias de novo postrasplante
El desarrollo de neoplasias de novo en el postrasplante y no relacionadas con la transmisión y/o recurrencia, es lo más frecuente dentro del campo del cáncer en el trasplante de órgano sólido. Además de los factores comunes a la población general, como serían el tabaco, alcohol, exposición al sol, edad, género, y aquéllos relacionados con la enfermedad renal [60] [61], existen factores específicos a la inmunosupresión y a sus efectos secundarios. En este sentido estaría el estatus inmunosupresor per sé, la existencia de oncovirus con diferente grado de evidencia, y las propiedades oncogénicas y antioncogénicas de la medicación [7] [56] [62] [63] [64] [65]. Cuando comparamos con la población general, un paciente trasplantado tiene una incidencia 10 veces mayor ajustada por edad y género de desarrollar una neoplasia de novo. Pero esta incidencia todavía sería mayor según el tipo de tumor, llegando hasta 13 veces más en el CCNM o 500 veces más en el SK [66]. Estos datos han sido corroborados por grandes registros como el ANZDATA, con una incidencia de 3.27 con un tiempo medio de supervivencia del paciente trasplantado que desarrolla cáncer de 2.2 años [11].
Kasiske y cols [17] han trabajado en registrar las diferentes incidencias de los tumores de órgano sólido entre la población trasplantada y la población general. Un primer trabajo publicado en 2004 mostró que el CCNM, la ELPT y el SK eran 20 veces más frecuentes en la población trasplantada, y que el cáncer renal como tumor de órgano sólido más frecuente ocurría 15 veces más que en la población general. También vieron que aquellos tumores más frecuentes en la población general, como el de mama, pulmón, próstata o colon, eran mínimamente más frecuentes [17]. El mismo grupo revisó en 2012 sus datos y reportaron resultados muy similares y eso que incrementaron el número de pacientes incidentes y los tiempos de exposición y de seguimiento [67]. Nosotros revisamos la literatura en términos de incidencia de cáncer utilizando el indicador de incidencia estandarizada como la manera de poder comparar las incidencias de ambas poblaciones y por tipo de tumor [8] (Tabla 1). Independiente del registro o de las bases de datos sobre incidencia, lo que todo el mundo concluye es que aquellos tumores identificados como muy relacionados/específicos en la población trasplantada, como serían el CCNM, ELPT y SK, estarían relacionados con el estado de alta inmunosupresión y de los efectos de la medicación inmunosupresora [68]. Y que la existencia de las neoplasias de novo postrasplante se asociaría con mayor morbilidad y mortalidad de los pacientes [68] [9] [15] [25] [26] [27], así como con un riesgo incrementado de que haya una pérdida de injerto [69].
Cáncer de piel
El cáncer cutáneo es la patología neoplásica más prevalente de la población trasplantada renal, y está representado hasta en un 90% por los CCNM [70]. El carcinoma cutáneo epidermoide (CCE), a diferencia de la población general, sería más frecuente que el carcinoma cutáneo basocelular (CCB) dentro de los tipos de CCNM. En el registro ANZDATA, la incidencia de CCNM que ya es de un 30% a los 5 años puede llegar a un 82% a los 20 años del trasplante [11]. Se estima que pueden llegar a ocurrir hasta 250 veces más que en población general dependiendo de los diferentes registros o series de casos. Si el paciente lo hubiera presentado anteriormente al trasplante tendría una hazard ratio (HR) de 2.6 de desarrollar cualquier tipo de neoplasia de novo postrasplante. Una HR de 2.92 sería la de presentar un CCNM postrasplante y de 1.44 de padecer otro tipo de neoplasia de órgano sólido, todo ello con un incremento de mortalidad de un 20% y de pérdida de injerto de un 17% [71]. Son resultados equiparables a registros de trasplante de otros órganos sólidos como el cardíaco [72]. El International Transplant Skin Cancer Collaborative (ITSCC) publicó en 2016 unas recomendaciones y opiniones de consenso sobre el apropiado periodo de espera de los candidatos de trasplante con historia de cáncer cutáneo, tanto si hubieran padecido un CCNM, como un melanoma o un carcinoma de células de Merkel [73]. Proponen estratificar el CCNM pre-trasplante siguiendo el sistema de estadificación del cáncer de la American Joint Commission on Cancer (AJCC) y el sistema alternativo del Brigham Women’s Hospital (BWH). Dichos sistemas están basados en datos validados y un pronóstico estimado de supervivencia a los 5 años [73].
Los factores de riesgo de desarrollar un cáncer cutáneo serían los comunes a la población general (edad, perfil de piel y mucosas, exposición solar, historia de neoplasias previas o existencia de lesiones premalignas), según el estadio de enfermedad renal [74], los específicos de la población trasplantada en relación al estatus inmunosupresor [75] y la existencia de oncovirus (en particular el papilomavirus). Por ejemplo, el tratamiento inmunosupresor con ciclosporina acelera el desarrollo de tumores cutáneos en general y la azatioprina (AZA) el de CCE en particular. El uso de micofenolato mofetilo, aunque es controvertido como fármaco pro- o anti-neoplásico, parece que en este tipo de tumores reduce el riesgo [16] [76].
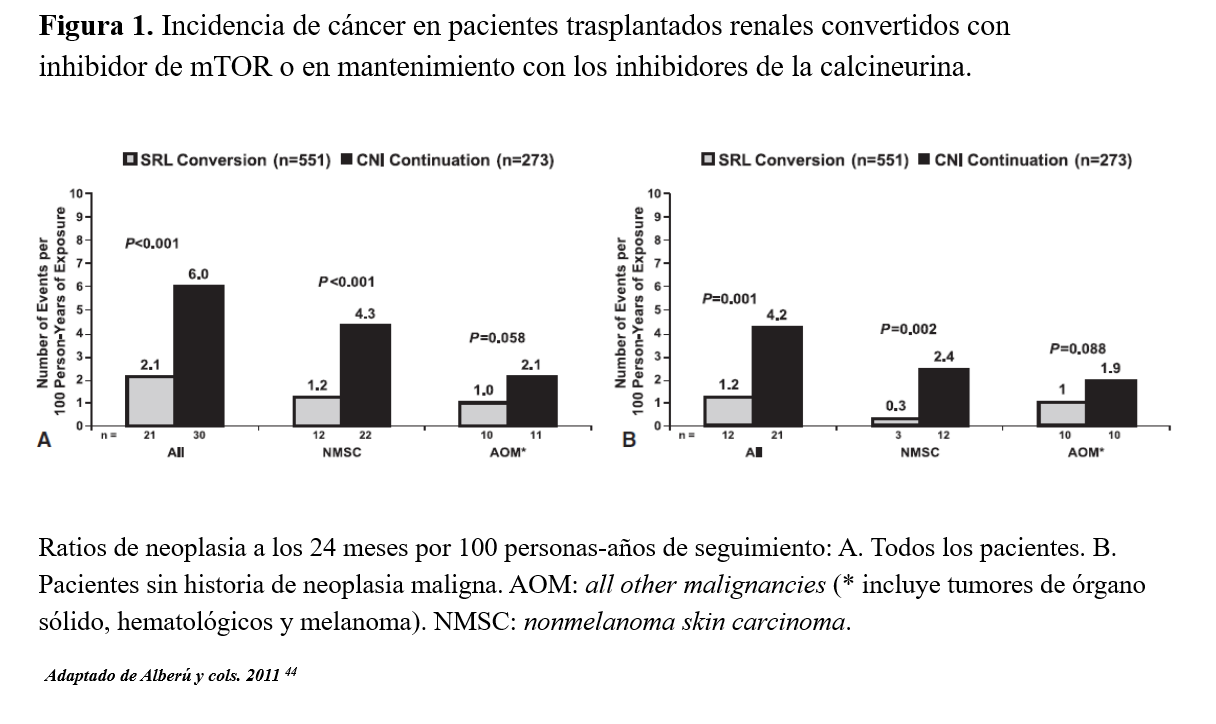
Recientemente se ha evaluado el impacto de los resultados del trasplante y de la influencia del largo uso de la medicación inmunosupresora sobre el cáncer cutáneo en un estudio de casos y controles. Se ha evaluado el papel de los tiempos desde el trasplante, el tratamiento hospitalario, el año de trasplante y el órgano trasplantado [77]. Los resultados mostraron que la AZA ofrece dos veces más de riesgo de desarrollar un CCE, y el micofenolato tendría menos riesgo. Esta relación inversa del micofenolato y el CCE se mantendría si no hubieran tomado previamente AZA y si concomitantemente se usaba un ICN. La conversión de AZA a micofenolato ofrecía un beneficio al paciente con menos riesgo de desarrollar un CCE [77]. El micofenolato puede inducir la apoptosis de la célula T activada, reducir el daño tisular (reduciendo la oxidación) y la sensibilidad a la radiación ultravioleta [77] [78] [79]. Pero con todo ello, había pocas recomendaciones específicas para el manejo de la terapia inmunosupresora ante un carcinoma cutáneo, hasta que recientemente se han publicado multitud de trabajos sobre menor incidencia de un primer episodio o recurrencia de CCNM en pacientes trasplantados en tratamiento con i-mTOR, tanto si se usan de novo como si se introducen en conversión de un ICN tanto en prevención primaria o secundaria (Figura 1) [42] [43] [44] [80].
Enfermedad Linfoproliferativa Postrasplante (ELPT)
La ELPT es una complicación bien conocida después del trasplante de riñón. Aunque es una enfermedad rara, se asocia con malos resultados. En la mayoría de los casos (aproximadamente el 90%), la ELPT está asociada al virus de Epstein Barr (VEB). El VEB es un virus común, y la mayoría de las personas adquieren el virus durante la infancia. La mayoría se presenta con síntomas leves o mínimos, pero el virus puede infectar las células B y permanecer inactivo en estas células durante la fase latente. Después del trasplante, estos virus pueden reactivarse debido a la supresión de la función de las células T, con una falta de control de éstas sobre la proliferación de las células B, y contribuye al desarrollo de la ELPT. La mayoría de las ELPT son de tipo de células B, y aproximadamente el 5% de los pacientes tienen el tipo de células T [81].
La incidencia acumulada de ELPT en los primeros 10 años tras el trasplante renal es de alrededor del 1-2% en receptores adultos y de aproximadamente el 3% en receptores pediátricos. Hay pruebas que sugieren que la incidencia de la ELPT ha disminuido en los últimos años. Un análisis reciente del Registro de Diálisis y Trasplantes de Australia y Nueva Zelanda informó de que la incidencia de la ELPT era mayor en el periodo 1995-2000 en comparación con la época actual, con una reducción del 8% en el riesgo de desarrollar ELPT a partir del año 2000 [81].
También parece haber una distribución bimodal en su incidencia, siendo su riesgo el más alto en los 12 meses posteriores al trasplante, y luego disminuye hasta el quinto año después del trasplante. La seronegatividad al VEB antes del trasplante y la infección primaria por el VEB son factores de riesgo importantes para la ELPT positiva al VEB temprana, especialmente en los receptores más jóvenes, y pueden explicar el mayor riesgo de enfermedad al principio del postrasplante. Por el contrario, una proporción significativa (aproximadamente entre el 40% y el 50%) de las ELPT de células B tardías implica lesiones negativas para VEB [81].
La relación del estado inmunosupresor y el tipo de medicación inmunosupresora con la ELPT es muy estrecha. Los pacientes que reciben esquemas de inmunosupresión más potentes o reciben medicación de inducción como el OKT3 y la timoglobulina/ATeGe (ATG) tendrían un riesgo mayor de desarrollar ELPT [82] [83] [84]. Últimamente ha adquirido especial interés el papel del Belatacept. En el estudio BENEFIT se vieron más incidencia de linfomas del sistema central en el seguimiento a un año en el grupo con altas dosis del fármaco, pero exclusivamente en los ELPT con serologías negativas [85] [86] [87]. El manejo de la profilaxis en grupos de riesgo como el que se acaba de mencionar está en entredicho. Así en 2015, Priya S Verghese y cols. [88] evaluaron el efecto de la profilaxis con valganciclovir en el donante sobre la transmisión viral al receptor en un estudio piloto, prospectivo, aleatorizado y doble ciego. Tras la profilaxis, la replicación del VEB en el donante desapareció, pero al dejar de tomar el fármaco repuntaba. Todos los receptores en el estudio recibieron profilaxis con valganciclovir y sólo se documentó enfermedad viral en el grupo placebo. El ADN del VEB del donante y la misma proteína de membrana latente-1 de la misma cepa del virus fue encontrada en el tejido linfoide del receptor con lo que ese virus provenía del donante en una alta probabllidad [88].
Sarcoma de Kaposi (SK)
El SK representa aproximadamente el 4% de todos los tumores postrasplante, y el riesgo de desarrollar un SK puede llegar a ser de 500 veces mayor en la población trasplantada que en la población general, como ya se ha comentado anteriormente [66]. Sin embargo, se ha visto que la incidencia de SK difiere según el área geográfica, con una alta incidencia en el área Mediterránea, que se pondría casi considerar zona endémica. El SK suele ser exclusivamente cutáneo pero podría ser también visceral o mucoso y afectar al pulmón, nódulos linfoides y tracto digestivo, lo que le conllevaría a su peor pronóstico [89] [90]. Como pasaba con la ELPT, el SK está asociado al nivel de inmunosupresión. Si usamos o reducimos el régimen inmunosupresor podremos hacer que regresen las lesiones del SK [91, [92]. Además, el SK es una neoplasia multifocal proliferativa vascular facilitada por la infección del virus herpes humano tipo 8 (VHH-8), tanto por la transmisión del donante como de una reactivación en receptores seropositivos para este virus [8]. El virus induce el factor de crecimiento endotelial vascular (VEGF) e interactúa con la vía de señalización oncogénica mTOR produciendo proliferación y supervivencia de las células endoteliales a largo plazo [93]. Este mecanismo explicaría las razones del efecto positivo de usar los i-mTOR en pacientes trasplantados que hayan desarrollado el SK y que ya fue publicada por primera vez por nuestro grupo en 2004 [94] [95]. Recientemente, hemos liderado un estudio multicéntrico español de trasplantados renales con SK en el que evidenciamos en todos ellos una infección por el VHH-8 y que la vía de señalización del mTOR estaba activada en diferentes estadios del tumor. Con todo ello, explicamos el beneficio de la conversión a i-mTOR de estos pacientes y que la supervivencia de los pacientes, así como de los injertos fue mayor que aquéllos que solo se les redujo la inmunosupresión [91]. Se necesitan nuevos estudios para validar si el uso de los i-mTOR en pacientes de alto riesgo de desarrollar un SK se debe tener en cuenta como estrategia de prevención ante un eventual trasplante.
Carcinoma de células renales (CCR)
En comparación con la población general, los receptores de trasplantes de riñón tienen un mayor riesgo (hasta siete veces) de padecer carcinoma de células renales [93]. Debido al aumento de las exploraciones complementarias abdominales, la mayoría de las masas renales detectadas en los pacientes tras el trasplante suelen ser masas renales tempranas, de bajo grado y de pequeño tamaño; de ellas, el 75%-80% son carcinomas de células renales, siendo el riesgo de metástasis en el momento de la presentación <2% [93].
El 90% de los CCR se desarrollan en los riñones nativos, a diferencia del aloinjerto. Los factores de riesgo para el desarrollo de CCR tras el trasplante son el sexo masculino, el aumento de la edad, la ascendencia africana y el mayor tiempo en diálisis. En cuanto a la etiología de la enfermedad, los pacientes trasplantados por insuficiencia renal secundaria a enfermedades glomerulares, nefroangioesclerosis hipertensiva y enfermedad vascular parecen tener el mayor riesgo asociado; en cambio, los pacientes con insuficiencia renal secundaria a diabetes o poliquistosis autosómica dominante tienen un menor riesgo de carcinomas de células renales [93].
Los CCR de novo deben tratarse definitivamente según las directrices urológicas sobre la base de la estratificación del riesgo y la estadificación junto con los factores del paciente (edad, comorbilidades, estado funcional) y las características de la masa renal (tamaño, hallazgos de la muestra de biopsia, cinética de crecimiento) [94] [95].
El CCR en el aloinjerto renal es raro, y los datos multicéntricos han demostrado una incidencia del 0,1%. La mayoría son lesiones T1 de bajo grado, carcinomas de células claras o carcinomas papilares de células renales, y ocurren más comúnmente en varones [93].
PATOGENIA DE LAS NEOPLASIAS POSTRASPLANTE
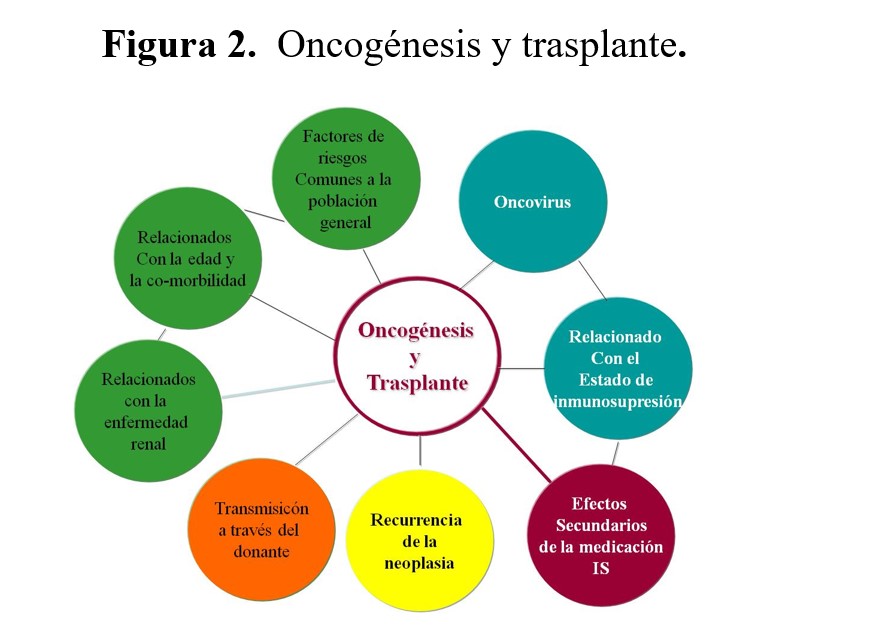
La oncogénesis y el comportamiento tumoral en el trasplante de órgano sólido es multifactorial y suele involucrar a múltiples factores de riesgo oncogénicos en el mismo paciente [64]. A los factores comunes de la población general se le suman factores específicos de la enfermedad así como factores inherentes al propio trasplante, como serían el estatus inmunosupresor, los oncovirus y los efectos secundarios pro- o anti- oncogénicos no inmunosupresores de la medicación inmunosupresora (Figura 2).
Como ya se ha comentado, los cánceres de mayor riesgo son los inducidos por virus, como la ELPT y el SK; y los causados por una vigilancia inmunitaria deteriorada o por daños directos en el ADN causados por los propios fármacos antirrechazo, como los cánceres de piel y de labio. Sin embargo, muchos otros tipos de cáncer se dan con mayor frecuencia en los pacientes trasplantados renales [96].
Factores de riesgo oncogénicos generales y específicos
El riesgo de desarrollar un cáncer ocurre en todos los estadios de la enfermedad renal crónica [60] [61], siendo el trasplante renal el que más riesgo acumula en comparación con los otros estadios, aunque no para todos los tipos de cáncer. Además, no hay que olvidarse del perfil del paciente a trasplantar y con ello de los factores de riesgo generales que comparte con la población no renal y no inmunodeprimida.
Los mecanismos oncogénicos propuestos incluyen la disfunción inmunitaria, la inflamación crónica, los cambios en la microbiota intestinal y la estimulación del sistema renina-angiotensina. La onconefrología ya ha sido reconocida como un campo emergente debido a la importancia de un abordaje multidisciplinar de los pacientes con ERC y cáncer [97].
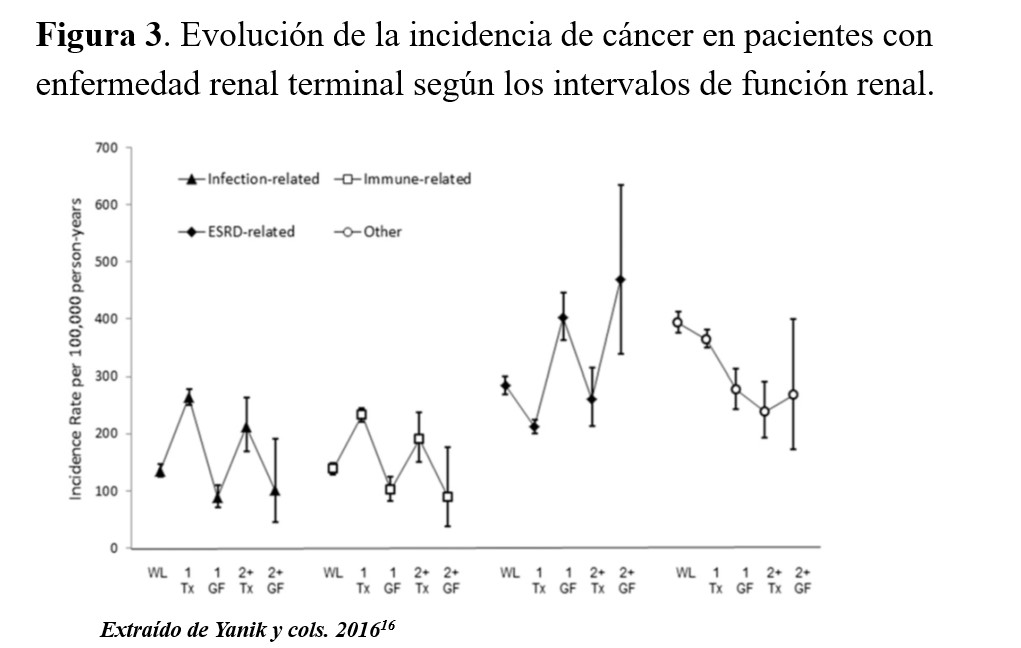
Como ya se ha comentado anteriormente, en función del estadio de ERC el paciente va a estar expuesto a mayor o menor incidencia de cáncer y a diferentes tipos de cáncer. En este contexto, Yanik y cols. [16] evaluaron la variación en las incidencias de cáncer entre pacientes con ERCT en función de diferentes fases o intervalos (Figura 3) [16]. Las frecuencias, incidencias e incidencias estandarizadas variaban según los intervalos de función renal entre estar en lista de espera, su primer trasplante, pérdida de injerto y volver a diálisis, volverse a trasplantar y volver a perder el órgano. Así, en las fases de ERCT sin estar trasplantado (en lista de espera y/o diálisis) los tumores relacionados con la función renal, como sería el cáncer renal, serían más elevados que en el trasplante. En cambio, aquellos tumores relacionados con las infecciones y con el estadio inmunológico, como el CCNM, SK y ELPT, serían más altas en los pacientes trasplantados. También hubo un grupo de tumores que no se pudieron categorizar en función de su relación y que se mostraron invariables independientemente de estos intervalos [16].
Recientemente, un trabajo ha publicado una situación parecida, pero analizando específicamente el CCNM [28], con concordancia en los resultados con otros trabajos previamente publicados por Hibberd y cols. [25] y van Leeuwen y cols. [26]. Los primeros evaluaron el efecto de la inmunosupresión utilizada en las enfermedades renales primarias sobre la incidencia del cáncer postrasplante con diferente impacto dependiendo del tipo de tumor. Los tumores asociados a infecciones virales eran superiores en pacientes inmunodeprimidos y los tumores asociados a la función renal serían menores, detectando ese mismo grupo de tumores no categorizables como invariable [25]. Lo mismo fue observado por van Leeuwen y cols. analizando esta vez el efecto de reducir la inmunosupresión una vez perdido el injerto renal en un análisis del registro ANZDATA [26].
Por último, y quizás de primera importancia por su potencial de intervención en los mismos, estarían los factores oncogénicos de la población trasplantada como sería el estadio inmunosupresor, la existencia de oncovirus o el paso de pro- a oncovirus y los efectos secundarios pro- o anti-oncogénicos no inmunosupresores de la medicación antirechazo. El impacto de todos ellos se sumaría al hecho de estar en riesgo durante mucho tiempo según la duración del trasplante con lo que afectaría a la oncogénesis y su comportamiento tumoral [7] [8] [56] [64] [65] [75]. Como creemos que es de enorme importancia se trata como un apartado en sí mismo que se desarrolla a continuación.
Mecanismos oncogénicos y la patogenia de las neoplasias postrasplante
Los clásicos mecanismos de oncogénesis asociados al trasplante serían la pérdida de inmunovigilancia o afectación del sistema inmune, la conversión de pro- a oncovirus y diversos mecanismos no inmunosupresores específicos de cada medicación que utilizamos en el trasplante [11]. Pero existen otros procesos como el daño del ADN y alteración de sus mecanismos de reparación, la disregulación de ciertas citoquinas y la existencia de mutaciones génicas inducidas de las vías de señalización oncogéncias [8] [98].
La inmunidad tumoral y el cáncer postrasplante
En la oncogénesis se parte de lesiones precursoras que evolucionan a lesiones tumorigénicas que crecen en continua vigilancia del sistema inmune. Existe la teoría del immunoediting con tres fases en donde la célula neoplásica y el sistema inmune interactúan [99]. En una primera fase las células inmunes controlan y destruyen aquéllas que ya presentan una conformación neoplásica en lo que se denomina fase de eliminación. Si sigue el estímulo o condicionante ya no hay un control tan estricto y se siguen sucediendo las mutaciones, cambios, etc que hacen que la célula neoplásica se produzca y se vaya haciendo más resistente. Así se llega a la fase de equilibrio entre proliferación y apoptosis, esta fase también se denomina de latencia inmunomediada. Por último, si sigue el proceso oncogénico y el sistema inmune no puede controlar, se produce la fase de escape inmunológico, con lo que se produce el crecimiento incontrolado y el desarrollo de metástasis [8] [99]. Este proceso afectaría no solo a las neoplasias de novo, sino también a las trasmitidas por el donante porque el sistema inmunocompetente del donante puede tener controlado el proceso neoplásico en las primeras fases y no llegar a dar signos ni síntomas de enfermedad, pero al pasar las células transformadas a un paciente en estado de inmunosupresión inducida pierde el control del sistema inmune y se produce el descontrol neoplásico y el riesgo alto de tener enfermedad diseminada mestastásica [64] [ 65] [75].
Oncovirus y neoplasias
Desde hace muchos años se ha venido relacionando el papel de los virus con la aparición de determinados tipos de tumores en la población general y trasplantada de órgano sólido [100]. Estos virus pueden modificar las señales de pro- y anti-proliferación de las células del huésped a través de la regulación génica de genes oncogénicos o supresores tumorales o a través de la interacción con proteínas oncogénicas. La replicación de partículas virales se perpetua y va hacia la generación de una clona tumoral. Además, los oncovirus juegan un papel indirecto oncogénico con el incremento de la probabilidad de tumores emergentes, aunque en este caso sin capacidad de inducir la transformación maligna [100] [101].
La inmunosupresión juega un papel en la oncogénesis viral, incrementando los riesgos de aparecer y persistir las infecciones virales, y con ello aumentar la probabilidad de que se produzca el escape inmune de la célula transformada neoplásica del sistema inmune y con ello la proliferación y diseminación. Con todo ello, se han identificado tumores relacionados con la existencia de oncovirus en diferentes grados de evidencia y que la mayoría de ellos también estarían relacionados con el sistema inmune, como serían el CCNM, el SK y la ELPT [8] [100] [101].
El virus del papiloma humano, los virus de la hepatitis B y C, el VEB y el VHH-8 tendrían ya demostrado su papel en el desarrollo de cáncer tanto en población general como inmunodeprimida. Siendo el primero asociado con los CCNM, los siguientes con el hepatocarcinoma, el VEB con la ELPT [102] y el VVH-8 con el SK90. El papel del citomegalovirus (CMV) es controvertido cuando hablamos de neoplasias postrasplante. Aunque los antígenos del CMV han sido identificados en células de ciertos tumores [103], no está claro si es un epifenómeno o si hay asociación causal. Recientes estudios han mostrado un efecto protector [104] mientras que otros han asociado un incremento de prevalencia asociado al CMV [105]. Rajeev Desai y cols [106] evaluaron el impacto de la infección por CMV en la supervivencia y la incidencia de cáncer en 22.461 trasplantados renales, hepáticos, cardiacos y pulmonares en Reino Unido entre 1987 y 2007. Los resultados en este estudio con gran número de pacientes y mucho tiempo de seguimiento mostraros que el CMV se asociaba significativamente con una mayor incidencia de mortalidad a largo plazo en los trasplantados renales y cardiotorácicos, sobre todo a expensas de causa cardiovascular pero no así de la neoplásica, así como tampoco de la incidencia de las neoplasias postrasplante [106]. En cambio, Germain Wong y cols. en un análisis similar con el registro Australiano y Nueva Zelandés vieron una asociación entre el estatus serológico del donante y receptor frente al CMV y un mayor riesgo de desarrollar cáncer postrasplante, en este caso sólo analizaron el trasplante renal [107]. Este grupo australiano además evaluó el sistema HLA (human leukocyte antigen) y vieron que si el paciente que recibió el injerto renal de un donante CMV negativo tenía un estatus serológico también negativo (CMV D–/R–) y pobre compatibilidad inmunológica (0-2 antígenos compatibles del HLA) tendría una incidencia acumulada menor de desarrollar un cáncer postrasplante que si previamente había estado expuesto al virus (y desarrollado anticuerpos, CMV D–/R+) o había recibido injerto de un donante con estatus serológico positivo (CMV D+/R+). Este efecto sólo se limitaba a un grupo de tumores, principalmente de origen genitourinario. Por tanto, concluyen que el efecto protector de un estado naïve del CMV en un receptor solo se mantiene cuando hay una buena compatibilidad inmunológica donante-receptor y no en todos los tumores [107].
Por último, muchas veces hay coinfección de diferentes virus como pasa con el VEB y el CMV. Ante este supuesto, se desarrolló un estudio piloto, prospectivo, randomizado, doble ciego, controlado con placebo para evaluar la profilaxis con valganciclovir en el potencial donante como protector de neoplasias postrasplante en el receptor. Se vieron menores transmisiones del donante al receptor y se potenció la efectividad de la profilaxis con valganciclovir en el receptor a la hora de reducir la enfermedad por VEB y/o por CMV. Aunque no se llegó a tener resultados que llevaran a un grado de evidencia de recomendar la profilaxis a todos los potenciales donantes [108].
Propiedades oncogénicas no inmunosupresoras de la medicación inmunosupresora utilizada en el trasplante de órganos
La medicación empleada en el trasplante de órganos con el sentido de evitar el rechazo y favorecer la aceptación del órgano cuenta con efectos secundarios que pueden llevar a comprometer la calidad de vida de los pacientes e incluso la pérdida del injerto y del paciente. Entre ellos se encuentran efectos pro- y antioncogénicos que son muy importantes de conocer porque de ello supone que se pueda minimizar o disminuir el riesgo de que aparezcan procesos neoplásicos, el poder manejarlos si ya se detectan y/o poder establecer estrategias terapéuticas basadas en el perfil oncogénico del paciente y el perfil del fármaco.
Fármacos empleados en inducción han demostrado efecto neoplásico sobre todo dependiente de dosis [82] [83].
En cuanto a la medicación de mantenimiento, se ha demostrado que la ciclosporina A (CsA) y el tacrolimus (Tac) regulan al alza el TGF-b1 [112] y el VEGF [113], ambos conocidos por contribuir al crecimiento del cáncer y a la angiogénesis [114]. ]También suprimen los genes antioncogénicos (p53 a través de NFAT-ATF3) [113] [114]. De hecho, un estudio de la década de 1990 en pacientes trasplantados renales que comparaba una dosis estándar frente a una dosis reducida de CsA demostró que la CsA tenía un efecto dependiente de la dosis en la inducción de cáncer de piel y no de piel [115]. No está claro si el riesgo de desarrollar cáncer es diferente con CsA frente a Tac. Por ejemplo, un análisis de un gran registro internacional mostró un mayor riesgo de linfoma postrasplante con Tac que con CsA en los receptores de trasplante renal, pero ninguna diferencia de riesgo entre Tac y CsA en los receptores de trasplantes de hígado, a pesar de un mayor número de casos en estos últimos [82].
La AZA comparte también mecanismos pro-oncogénicos con los ICN como la alteración del ADN y de los mecanismos de reparación. Sensibiliza la piel a la radiación UVA y provoca la acumulación de 6-tioguanina en el ADN, lo que conlleva un mayor riesgo de aparición de NMSC [98] [115]. Todos estos mecanismos oncogénicos explicarían la alta incidencia de tumores primarios o recurrentes en pacientes tratados con ICN y/o AZA como se ha confirmado en diferentes ensayos clínicos [98] [115].
En cuanto al micofenolato mofetilo (MMF), estudios recientes de gran registro no han encontrado diferencias en la incidencia de cáncer en los regímenes con/sin MMF18. Asimismo, el uso de esteroides no se asocia con una mayor incidencia de cáncer [117].
Por otro lado, los i-mTOR exhiben propiedades antitumorales como se ha mencionado previamente. El mTOR juega un papel crucial en múltiples vías de señalización que controlan el crecimiento celular, así ha sido relacionado con la mayoría de los tumores de órgano sólido a través de la activación de su vía de señalización oncogénica PI3K- AKT- mTOR y la aberrante expresión de reguladores del ciclo celular o proteínas anti-apopototicas [5]. Guba y cols. mostraron que la rapamicina, i-mTOR clásico, producía una reducción del crecimiento tumoral y las metástasis a través de la inhibición de la angiogénesis bloqueando la vía de señalización del VEGF [116. Nuestro grupo ha querido caracterizar diferentes tumores en población trasplantada respecto a la población general según las vías de señalización anteriormente comentadas. Elegimos los CCNM y el cáncer de colon, por ser tumores frecuentes en el primer caso y tumores especialmente agresivos en el segundo. En común a ambos tumores la vía de señalización PI3K- AKT- mTOR estaba activada en ambas poblaciones, por lo que habría un beneficio directo del uso de este fármaco en estos tumores. Yendo más allá, la vía de señalización mTOR también estaría involucrada en el comportamiento tumoral como nuestro grupo ha publicado en trasplantados renales con SK en un estudio multicéntrico español [91].
MANEJO DE LAS NEOPLASIAS POSTRASPLANTE
Las neoplasias postrasplante requieren una estrategia global con medidas de prevención en todos los pacientes trasplantados (no solo en los que ya tienen historia de cáncer) y estrategias terapéuticas de novo o de conversión basadas en medicaciones con propiedades antioncogénicas, o por lo menos en los que se intenten minimizar o evitar aquellos fármacos prooncogénicos. Además, se requiere la individualización de la medicación inmunosupresora en cuanto al riesgo de neoplasia de los pacientes.
Manejo del paciente en lista de espera
Las estrategias para pacientes en lista de espera están basadas en la prevención, screening de posibles neoplasias no conocidas (en paciente o donante) y en la evaluación del riesgo de recurrencia de neoplasias previas. Todos los pacientes en lista de espera deberían ser evaluados y caracterizados en cuanto a su perfil de desarrollar un cáncer, además de su perfil inmunológico, cardiovascular, quirúrgico o de infecciones [51].
Estrategias de screening en pacientes candidatos al trasplante
Las estrategias preventivas son necesarias para no solo evitar la oncogénesis sino la progresión tumoral si ya se han producido, en lo que sería prevención secundaria. A pesar de la falta de pruebas basadas en ensayos que respalden el cribado sistemático en este grupo de alto riesgo, se recomienda el cribado sistemático del cáncer de mama, colorrectal y de cuello uterino en la población y debería ajustarse a las directrices de la población general [93] [118]. Algunas directrices también sugieren controles rutinarios de la piel por parte de los dermatólogos en los receptores de trasplantes de alto riesgo, y las ecografías abdominales y los niveles séricos de alfa-fetoproteína deben controlarse cada 6 meses en aquellos con enfermedad hepática subyacente e infecciones crónicas por el VHB. En el caso de los pacientes con riesgo de desarrollar un carcinoma de células renales (como los que tienen antecedentes de enfermedad quística adquirida, los que tienen antecedentes familiares, los que son fumadores empedernidos y los que utilizan analgésicos a largo plazo), puede considerarse la posibilidad de realizar un cribado ecográfico (anual o bienal) de los riñones nativos para detectar una neoplasia oculta [93] [119].
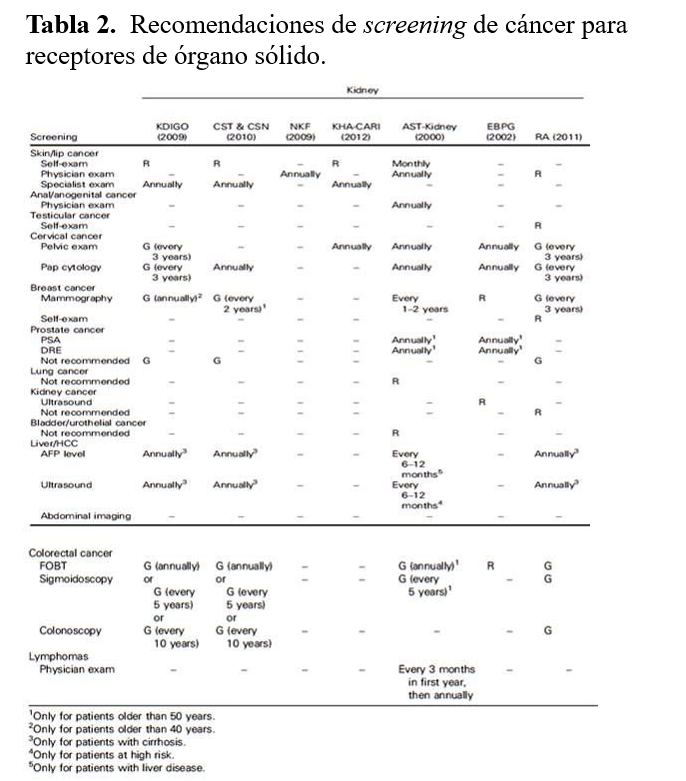
La American Cancer Society publica regularmente las recomendaciones de screening para la población general, y recomendaciones de screening para pacientes que tengan algún riesgo específico (denominado discuss with physician) [120]. Sería aconsejable que todos los especialistas del trasplante las conocieran y las aplicaran independiente de la guía específica de cada sociedad científica. Así mismo, en 2016 se publicó una revisión sistemática de las guías de práctica clínica para el screening de cáncer recomendables para los receptores de órgano sólido (Tabla 2) [121]. Se identificaron 2.763 datos de bases de datos (937 de MEDLINE, 1.712 de EMBASE, 99 de CINAHL, y 15 de PsycINFO). Después de revisar diferentes criterios de inclusión y a través de un algoritmo de selección se incluyeron en el análisis 13 guías de práctica clínica (10 guías originales: 7 de riñón y 13 de hígado), 1 aprobación, y 2 adaptaciones. Cada tumor fue evaluado de su búsqueda específica y categorizado para si se recomendaba o no, su frecuencia de los screening y sus niveles de evidencia y fortaleza en las recomendaciones reportadas en las guías de práctica clínica [121].
Cáncer pretrasplante y su impacto en las lista de espera y el trasplante
La detección de las neoplasias en el candidato a trasplante tiene que ser realizada en términos de diagnóstico, establecimiento del pronóstico del cáncer y del paciente y de la probabilidad de recurrencia. El tipo y estadio de tumor al diagnóstico son unos de los factores más importantes que habría que conocer para determinar qué probabilidad tendrían de recurrir, el pronóstico si los padecieran y el tiempo de espera para poder ser trasplantado [8] [50] [51] [57] [106].
Actualmente se están reduciendo las contraindicaciones para el trasplante en pacientes que han desarrollado cáncer, quedado prácticamente la enfermedad metastásica, algunos casos de cáncer de mama o próstata muy avanzados y el mieloma múltiple (y no todos). El resto de las neoplasias tienen que ser evaluadas individualmente para cada paciente candidato a trasplante y establecido el tiempo de espera [38] [50]. Consideraríamos una valoración positiva si está bien controlado y no tiene mal pronóstico según el grado y estadio de malignidad, y todo ello con un tiempo de espera prudencial recomendado [8] [50] [51]. Pero no todos los tumores tienen el mismo comportamiento de recurrencia tumoral. Por ejemplo, los tumores de testículo y tiroides tienen baja tasa de recurrencia en comparación al alto índice del mieloma múltiple o los CCNM. Además, el grado tumoral es básico también para evaluar la recurrencia, y en este caso el cáncer de mama y colon tendrían alto grado de recurrencia si se diagnostican en estadio avanzado [8].
Protocolos de screening postrasplante
La mayoría de las estrategias de screening se realizan en el periodo pretrasplante, pero hay escasa información de si se mantiene el screening del cáncer una vez que el paciente se ha trasplantado. Acuna y cols. [122] en 2017 determinaron el seguimiento de los test de screening para cáncer de mama, cervical y colorrectal e identificaron factores asociados a mantener al día dicha prevención. De 1.551 receptores de órgano sólido en riesgo de desarrollar un cáncer de mama, 2.252 de cervical, y 4.436 de colon, solo un 91.4% (1.417), 69.8% (1.572) y 77.5 % (3.437) respectivamente estaban al día de realizarse los screening de cáncer durante el periodo de observación. Aquellos pacientes con menores comorbilidades tuvieron las tasas más altas. Respecto a qué especialista debería realizar el screening y si cambiaría el resultado, se compararon los resultados dependiendo de si era el médico de primaria o el especialista en trasplante el que hiciera el screening y no hubo diferencias. Pero a pesar de ello los autores recomiendan involucrar al médico de primaria en los cuidados postrasplante para poder mejorar las tasas de screening, y concluyen que lo que es obvio es que el screening de cáncer para la mayoría de los pacientes trasplantados no se cumple según las guías de recomendaciones [122].
Manejo del tratamiento inmunosupresor
La individualización de la medicación inmunosupresora es imprescindible en todos los pacientes a trasplantar, y con mucho más motivo en los que tienen riesgo de desarrollar neoplasias. Después de haber sido sometido a un tratamiento contra el cáncer con intención curativa, la reducción de la carga inmunosupresora global y/o el cambio a un régimen farmacológico alternativo puede ser potencialmente muy beneficioso para evitar la recidiva del cáncer, pero debe sopesarse con los riesgos de rechazo y/o de acontecimientos adversos graves [96].
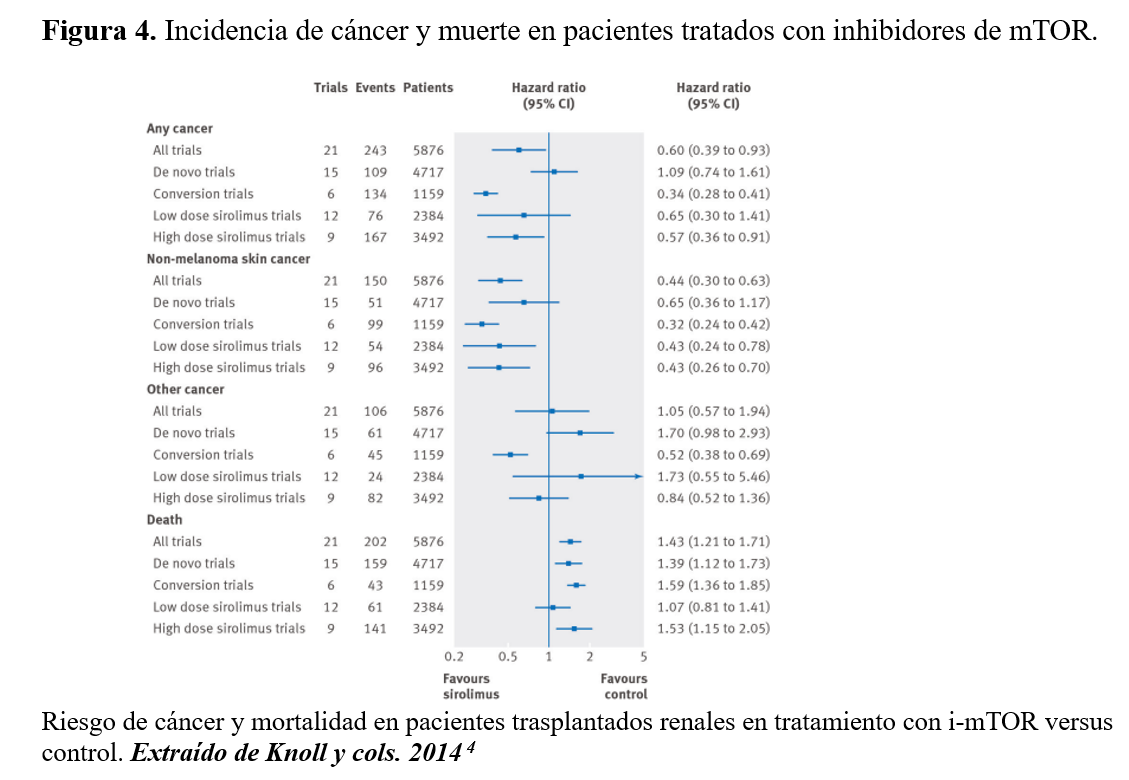
Los ensayos clínicos han mostrado una menor incidencia de neoplasias en regímenes basados en i-mTOR comparados con ICN [42] [44] [80] [123] [124] [125] (Figura 4) [44]. Aunque la decisión final sobre el tratamiento a emplear tiene que estar balanceada con el riesgo inmunológico, cardiovascular o infeccioso y los potenciales efectos secundarios de los diferentes fármacos. Recientemente se han publicado varios artículos acerca del manejo de las neoplasias postrasplante en el trasplante de órgano sólido, detallando a continuación las diferentes estrategias.
Estrategia de reducir el tratamiento general de mantenimiento contra el rechazo
La evidencia clínica soporta que la reducción de la inmunosupresión podría ser una alternativa para el SK de novo [90] [91] [92] [126] [127] y la ELPT [82] [84], pero no ha sido evidenciada para otros tipos de neoplasia. Además el reducir la inmunosupresión incrementa el riesgo de rechazo y pérdida de injerto y determinadas neoplasias pudieran acontecer o recurrir cuando la inmunosupresión fuera reintroducida para un nuevo trasplante como pasaría con el SK [90] [91] [92]. Si nos basamos en las pruebas (indirectas) disponibles, la reducción de los niveles sanguíneos de los ICN por debajo de los límites tradicionales (por ejemplo, reducir la dosis a la mitad y/o los niveles sanguíneos de Tac <5 ng/ml, CsA <100 ng/ml) podría ser la estrategia más eficaz para prevenir la recurrencia del cáncer, pero también la estrategia menos segura para prevenir el rechazo, especialmente si se produce al principio del trasplante (se ha demostrado que el riesgo de rechazo agudo a un año aumenta en un 10% en los regímenes sin esteroides, incluso en individuos de bajo riesgo, en los que la reducción se llevó a cabo a los 4-12 meses después del trasplante) [96] [128].
Es por ello que se buscan otras estrategias para el balance óptimo del riesgo inmunológico y los efectos secundarios de la medicación inmunosupresora con el fin de mejorar la supervivencia del injerto y del paciente. Dichas estrategias se basan en minimizar, convertir o suspender los ICN con la introducción de los i-mTOR [42] [44] [96] [123] [128].
Estrategia de cambio de ICN a i-mTOR
La estrategia de sustituir el ICN por un i-mTOR que tiene efectos tanto inmunosupresores como anticancerígenos podría ser una estrategia eficaz para prevenir la recurrencia del cáncer, aunque, la evidencia actual disponible sobre su eficacia se refiere principalmente a los cánceres de piel no melanoma y a los sarcomas de Kaposi [4] [6] [129]. Sin embargo, no está tan claro si los i-mTOR podrían disminuir también el riesgo de desarrollar otros tipos de cáncer tras el trasplante. Según los estudios realizados, parece que el efecto anticanceroso de i-mTOR depende de la dosis. Por desgracia, la dosis de i-mTOR más eficaz contra el cáncer suele ser mal tolerada.
El potencial uso de estos fármacos inmunosupresores viene soportado por la evidencia de estudios experimentales en que los i-mTOR reducirían el crecimiento tumoral y el desarrollo de metástasis. Sus beneficios no sólo radican en sus propiedades intrínsecas antineoplásicas sino que podría estar relacionado con una actividad sinérgica con otras medicaciones antineoplásicas [130] [131]. Recientemente se ha publicado un metaanálisis (Figura 4) [4] de dos grandes cohortes de pacientes del registro Americano de trasplante comparando con 15 registros de cáncer en la población general [20], y también resultados del Collaborative Transplant Study [6] acerca del efecto de sirolimus sobre la incidencia de neoplasias y la supervivencia de los pacientes trasplantados renales. El metaanálisis mostró una reducción en la prevalencia de cualquier tipo de cáncer, aunque con menor supervivencia acumulada si los pacientes estaban o habían estado con sirolimus. Además, el efecto sobre dicha reducción de neoplasia quedaba limitado a aquellos ensayos clínicos en los que se realizaba conversión a sirolimus y no se reprodujeron en aquellos que se había utilizado el i-mTOR de novo. También era un efecto dosis dependiente con menor incidencia en los ensayos con dosis de i-mTOR más altas [4]. Yanik y cols. también publicaron datos del registro Americano sobre el uso de i-mTOR y cáncer. Los pacientes expuestos a sirolimus en algún momento del trasplante experimentaban menor incidencia acumulada de todo tipo de cáncer excepto para el prostático que era mayor [20]. Dicha reducción en los tumores se produciría a partir de los 3 años postrasplante, y el efecto no esperado sobre el cáncer de próstata a los 2 años postrasplante. Desafortunadamente los autores no mostraron resultados de supervivencia del paciente [20]. Por último y diferente a las series previas, el Collaborative Transplant Study con datos de 78.146 receptores adultos de primer trasplante renal de donante cadáver acontecidos entre 1999-2013 no mostraron diferencias en los tumores de órgano sólido (HR 0.94; P = 0.59), excluyendo CCNM, entre los pacientes en tratamiento con i-mTOR de novo (4.279) y los que no lo habían llevado (73.867) [6]. Sin embargo, sí vieron menor incidencia de CCNM, pero solo a expensas del CCB (HR 0.56; P = 0.004) y no del CEC (HR 0.87; P = 0.54) que sería el más frecuente y el más agresivo. Los CEC tuvieron peor supervivencia del paciente con mayor mortalidad asociada (35%) que los CCB que fue 14% (P < 0.001) [6].
Estrategia de cambiar de CNI + MPA/MMF a CNI + i-mTOR
La estrategia de sustituir el MMF/MPA por un i-mTOR (objetivo de EVL 5,5 ng/ml) mientras se mantiene el ICN (Tac o EVL) a dosis bajas (objetivo Tac, 4 ng/ml; objetivo CsA, 50 ng/ml) podría ser más segura en términos de riesgo de rechazo, y de efectos adversos, en comparación con la estrategia anterior [132] [133].
En comparación con los regímenes basados e mTORi sin CNI, los regímenes con CNI + mTORi parecen ser mejor tolerados y más eficaces en la prevención del rechazo. El estudio TRANSFORM [132] [134] en 2.037 receptores de trasplante renal, demostró que un régimen con EVL (objetivo 5,5 ng/ml) más dosis bajas de ICN (objetivo Tac, 4 ng/ml; objetivo CsA, 50 ng/ml) [132] daba lugar a una función del injerto, tasa filtrado glonerular y riesgo de rechazo similares a los 24 meses, así como a un menor riesgo de infección por citomegalovirus y poliomavirus BK, frente a un régimen con dosis estándar de ICN y MMF [135]. A pesar de la dosis relativamente baja de i-mTOR, la interrupción del fármaco fue mayor en el brazo de EVL más dosis bajas de ICN (23% frente al 12%), posiblemente debido a efectos secundarios como, principalmente, el edema periférico (37% frente al 26%) [135]. Otros efectos secundarios que son más frecuentes con el EVL y que podrían aumentar las tasas de interrupción del fármaco fueron la hiperlipidemia (35% frente al 19%), la proteinuria (13% frente al 6%), la estomatitis/úlceras bucales (8% frente al 2%), la trombocitopenia (7% frente al 4%) y la enfermedad pulmonar intersticial (1,1% frente al 0,3%) [135]. En este estudio no se detectaron diferencias en el riesgo de cáncer, pero es probable que se requiera un seguimiento más prolongado para evaluar adecuadamente este aspecto.
Por tanto, el esquema de novo basado en un i-mTOR con exposición reducida de ICN debería ser considerado el esquema óptimo de los pacientes a trasplantar o por lo menos que no aporta peores resultados al clásico basado en ICN y micofenolato con más riesgo de neoplasia a largo plazo [132].
INMUNOTERAPIA EN PACIENTES CON TRASPLANTE RENAL
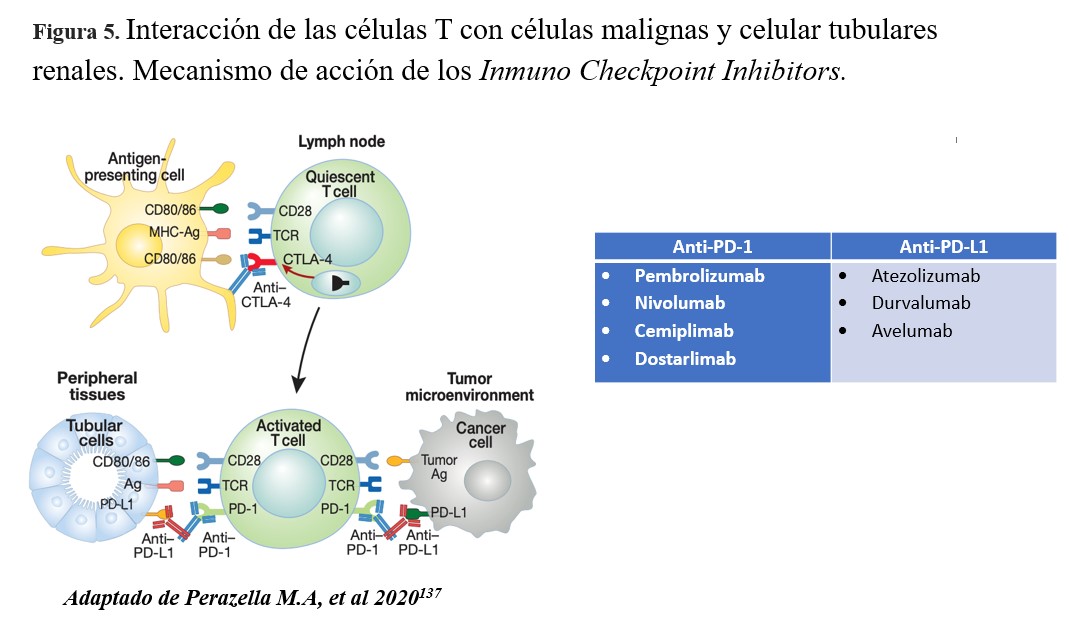
La inmunoterapia, específicamente los Inmuno Checkpoint Inhibitors (ICI), ha revolucionado el tratamiento oncológico de una variedad de neoplasias localmente avanzadas o metastásicas. Esta terapia consiste en la administración de anticuerpos monoclonales humanizados dirigidos a bloquear los puntos de control inmunitario (CTLA-4, PD-1, LAG-3) y ligando (PD-L1) expresados en los linfocitos T, con el objetivo de estimular la respuesta antitumoral del sistema inmunológico. Múltiples ensayos clínicos han demostrado la efectividad de los ICI en términos de supervivencia total y libre de progresión [136] [137] [138] (Figura 5) [137].
Sin embargo, su eficacia y seguridad no está definida en pacientes con trasplante de órgano sólido (TOS), ya que estos fueron excluidos en los ensayos clínicos, a pesar de tener una mayor incidencia de cáncer. Algunos autores mencionan que la exclusión de estos pacientes se debe a dudas sobre el porcentaje de rechazo del injerto y menor respuesta antitumoral debido al tratamiento concomitante con inmunosupresores [139].
La relación entre la terapia con ICI y el rechazo agudo de órgano sólido ha sido reportada en series de casos, y revisiones sistémicas [139] [140] [141] [142]. Se ha descrito hasta el 33% rechazo agudo del injerto en pacientes tratados con anti-CTLA-4 y 52% en anti-PD-1 [141]. Incluso se ha reportado episodio de rechazo acelerado con riesgo de ruptura del injerto, con requerimiento de nefrectomía [143]. El mecanismo que explicaría el incremento de rechazo celular después de la exposición a ICI, se debe a que los linfocitos T de memoria específicos contra antígenos del injerto preexistentes, que permanecieron inactivos bajo el tratamiento inmunosupresor, podrían activarse, proliferar y generar una respuesta inmune específica contra el injerto. Debido a la activación de las células T, se activan los linfocitos B a través de ligandos coestimuladores (CD40L) y las citoquinas (IL-4, IL-21, INF-γ) conduciendo al desarrollo del rechazo mediado por anticuerpos, a su vez la activación de células B puede estar mediada por la reducción en el uso de inmunosupresores tras el diagnóstico de la patología oncológica [144].
Portuguese et al. [145] realizaron una revisión sistemática donde incluyó 119 paciente con TOS que tras diagnóstico de cáncer avanzado recibieron ICI, 53% fueron pacientes con trasplante renal, de los cuales el 48% presentaron rechazo del injerto y el 25% fallo del injerto. La media de tiempo para el desarrollo de rechazo fue de 3 semanas, la mayoría ocurrió dentro del primer mes y casi el 80% dentro de las primeras 7 semanas. Porcentajes similares fueron descritos por Murakami et al. [146] en un estudio retrospectivo y multicéntrico de 69 paciente trasplantados renales, se observó que el 42% presentó rechazo agudo con un tiempo medio de 24 días luego del inicio de la terapia, de los cuales el 65% presentaron pérdida de la función del injerto a pesar de administrar tratamiento con corticoides e inmunoglobulinas. Sin embargo, la terapia con ICI se asoció a un menor riesgo de progresión de la enfermedad oncológica, se observó una respuesta clínica del 68% de paciente diagnosticados de carcinoma cutáneo de células escamosas, siendo los factores asociados a una mejor respuesta: el mayor tiempo desde el trasplante hasta el inicio de ICI y la reducción preventiva de la intensidad de régimen inmunosupresor como terapia de mantenimiento del injerto [145] [146].
En este contexto, debido a la falta de alternativa terapéutica y el riesgo vital asociado de la patología oncológica, es un desafío iniciar tratamiento con ICI en los pacientes con trasplante renal. Actualmente, se están estudiando estrategias para reducir y predecir el riesgo de rechazo del injerto, entre ellas, la reducción de inmunosupresión cuando se administra ICI. El tratamiento simultáneo mTORi e ICI busca mantener la anergia de las células T asociado a la reducción de citoquinas (granzima B, INF- γ, IL-15) y elevar la concentración de células T reguladoras en sangre periférica [147] [148] sin reducir la eficacia antitumoral. El uso de biomarcadores como el dd-cfDNA para detectar el rechazo en etapas tempranas [149], o la expresión de receptores de PD-1 o PD-L1 a nivel del injerto renal para determinar el riesgo de rechazo. Sin embargo, es necesario desarrollar ensayos clínicos prospectivos para determinar la estrategia óptima de la inmunosupresión y vigilancia del rechazo del injerto.
RESUMEN Y CONCLUSIONES
El cáncer en el paciente renal es un gran problema y cada vez va a ser más complicado con el nuevo perfil de pacientes y determinadas estrategias de tratamiento. Ocurre en los diferentes estadios de la ERC, aunque las incidencias de cada tipo de tumor varían según la historia natural de la ERC terminal, ya esté en estadios avanzados, en diálisis o trasplantado. Todo ello es fruto de la heterogeneidad de los tumores. Las neoplasias postrasplante son una de las principales causas de mortalidad en los pacientes trasplantados, además de que alteran significativamente su calidad de vida y compromete la supervivencia del injerto. Es por ello, que todos los candidatos a trasplante deben estar libres de neoplasia y haberse realizado un completo y exhaustivo screening de la patología neoplásica. Y particularmente los que ya han padecido un cáncer o se cataloguen de alto riesgo se debe establecer el pronóstico oncológico y del paciente y considerar un tiempo de espera que asegure que realmente esté libre de enfermedad. Los protocolos de screening deben realizarse antes del trasplante, pero es muy importante seguir realizándolos durante toda su evolución porque es cuando podemos hacer prevención primara y/o secundaria y hacer diagnósticos precoces porque de ello va a depender la supervivencia del paciente. Los principales mecanismos de neoplasia, tanto de oncogénesis como de progresión tumoral, sumados a los de la población general serían la inmunosupresión, la existencia de oncovirus y el efecto directo no inmunosupresor de la medicación inmunosupresora. Es por esto, que debemos caracterizar concienzudamente al paciente trasplantado desde un punto de vista oncológico e individualizar el esquema de inmunosupresión y la elección de la medicación antirrechazo. El protocolo ideal y recomendable en dichos pacientes sería la introducción de un i-mTOR junto a la minimización o eliminación de un ICN, que sería útil tanto en estrategias de prevención como de tratamiento. Por último, la incorporación de los ICI al arsenal terapéutico oncológico ha sido un gran avance, aunque tiene que tenerse precaución en los pacientes trasplantados dado el riesgo de rechazo y pérdida del injerto por su implicación con las células T y que un tratamiento simultáneo mTORi e ICI sería interesante para mantener la anergia de las células T asociada a la reducción de citoquinas y elevar la concentración de células T reguladoras en sangre periférica sin reducir la eficacia antitumoral.
En conclusión, la patología neoplásica debe estar en todo pensamiento y/o actitud médica ante cualquier enfermo renal independiente de su estadio, siendo mandatorio su estudio, aplicar los métodos de screening generales y específicos, y que siempre prevalezca la supervivencia y la calidad de vida de los pacientes, aunque ello conlleve estrategias complejas de implantar.