Efectos Renales Adversos de la Inmunoterapia
Palabras clave
Inmunoterapia, inhibidores del checkpoint, efectos adversos relacionados con la inmunoterapia
Autores
Angel Martin de Francisco. Hospital Universitario Valdecilla, Santander, España
Fabiola Alonso. Hospital Universitario Virgen Macarena, Sevilla, España
Patricia García. Hospital Universitario Candelaria, Santa Cruz de Tenerife, España
Manuel Macia. Hospital Universitario Candelaria, Santa Cruz de Tenerife, España
Eduardo Gutiérrez. Hospital Universitario 12 de Octubre, Madrid, España
Luis Fernando Quintana. Hospital Clínic Universitario, Barcelona, España
Borja Quiroga. Hospital Universitario La Princesa, Madrid, España
Isidro Torregrosa. Hospital Clínico Universitario, Valencia, España
Grupo de Onconefrología de la Sociedad Española de Nefrología
Este articulo se ha complementado y actualizado con el articulo del Grupo español de Onconefrología: Alonso F, Martín de Francisco ÁLM, Auñón P, García-Carro C, García P, Gutiérrez E, Mcía M, Quintana LF, Quiroga B, Soler MJ, Torregrosa I; Onconephrology Group of the Spanish Society of Nephrology.
INDICE
Introducción
Mecanismo de acción de los inhibidores del checkpoint (ICP)
Inhibidores del checkpoint aprobados por la FDA y EMA
Eventos adversos relacionados con el sistema inmunitario (EAri) causados por ICP
Mecanismos responsables
• ICP en pacientes de riesgo (enfermedad autoinmune previa)
• ICP en pacientes con Enfermedad Renal Crónica (ERC)
• Tratamiento de los EAri de los ICP
Efectos renales adversos causados por los ICP
1.- Insuficiencia renal aguda (IRA)
• Definición
• Incidencia
• Factores de riesgo
• Clases de ICP
• Nefritis intersticial aguda (NTIA)
• Necrosis tubular
2.- Alteraciones glomerulares
3.- Trastornos hidroelectrolíticos
• Hiponatremia
• Acidosis tubular
Biomarcadores de ICP-IRA
Cuando indicar una biopsia renal a pacientes tratados con ICP con daño renal
• A favor
• En contra
Manejo del paciente con IRA recibiendo tratamiento con ICP
Reanudación del tratamiento después de ICP-IRA (rechallenge)
Reanudación después de efectos inmunológicos adversos (EAri) no renales. ICP: recurrencia de los efectos
Reanudación después de IRA-ICP: recurrencia de IRA
Consideraciones para retratar o no a un paciente después de un ICP-IRA
Manejo del paciente trasplantado renal con cáncer recibiendo tratamiento con ICP
• Factores para considerar cuando se indican inhibidores inmunológicos del check-point en pacientes con trasplante renal
• Estudio multicéntrico sobre seguridad y eficacia de los ICP en pacientes trasplantados con cáncer
• Mecanismo del rechazo del injerto asociado a tratamiento con ICP
• Estrategias preventivas para control del rechazo en pacientes trasplantados con cáncer bajo tratamiento con ICP
Conclusiones
INTRODUCCIÓN
Se define inmunoterapia o terapia biológica al conjunto de estrategias de tratamiento para estimular o reponer el sistema inmunitario frente al cáncer, infecciones u otras enfermedades. Dentro de los tratamientos biológicos están los anticuerpos monoclonales, las vacunas y los denominados factores de crecimiento.
Tras la aprobación de las citoquinas antitumorales y tratamiento con BCG (Bacillus Calmette-Guérin), la investigación del cáncer continuó buscando nuevas formas de inmunoterapia, utilizando el sistema inmunitario para combatir la proliferación. Actualmente, el enfoque más utilizado en inmunoterapia es la administración de anticuerpos monoclonales (mAb) dirigidos contra moléculas reguladoras del control inmunitario que actúan inhibiendo la activación de las células T, los llamados inhibidores del check point (ICP) también referidos como inhibidores de puntos de control inmunitarios o simplemente como inhibidores de puestos de control [1]. Se ha demostrado que los ICP prolongan la supervivencia general en diferentes tipos de cáncer como melanoma, cáncer de pulmón de células no pequeñas, cáncer urotelial, cáncer de células renales y muchos otros. Pero estos ICP pueden producir efectos adversos que con el aumento de pacientes tratados van definiéndose con más precisión, entre ellos los efectos producidos sobre el riñón.
En los últimos dos años, diversos estudios multicéntricos han confirmado un aumento de la incidencia de nefropatías glomerulares asociadas a inmunoterapia, especialmente con el uso de terapias combinadas de ICP. Además, la introducción de nuevos biomarcadores como la podocalixina y la nefrina permite una detección más precoz del daño glomerular (Chen Y, et al. Lancet Oncol. 2025;26(3):345-353)
Existen aún áreas de controversia sobre el daño renal inducido por los ICP especialmente sobre su prevención, indicación de confirmación histológica, actitud de continuación o suspensión, reanudación del tratamiento (“rechallenge”) y especialmente su indicación en el tratamiento del cáncer en el paciente trasplantado renal. En el presente artículo actualizamos el conocimiento actual sobre los efectos renales del tratamiento inmunoterápico, incorporando las últimas evidencias científicas y recomendaciones de guías internacionales actualizadas hasta 2025 [American Society of Clinical Oncology - ASCO 2024; Sociedad Española de Oncología Médica – SEOM 2024: Sociedad; National Comprehensive Cancer Network NCCN 2025].
MECANISMO DE ACCIÓN DE LOS INHIBIDORES DEL CHECKPOINT (ICP)
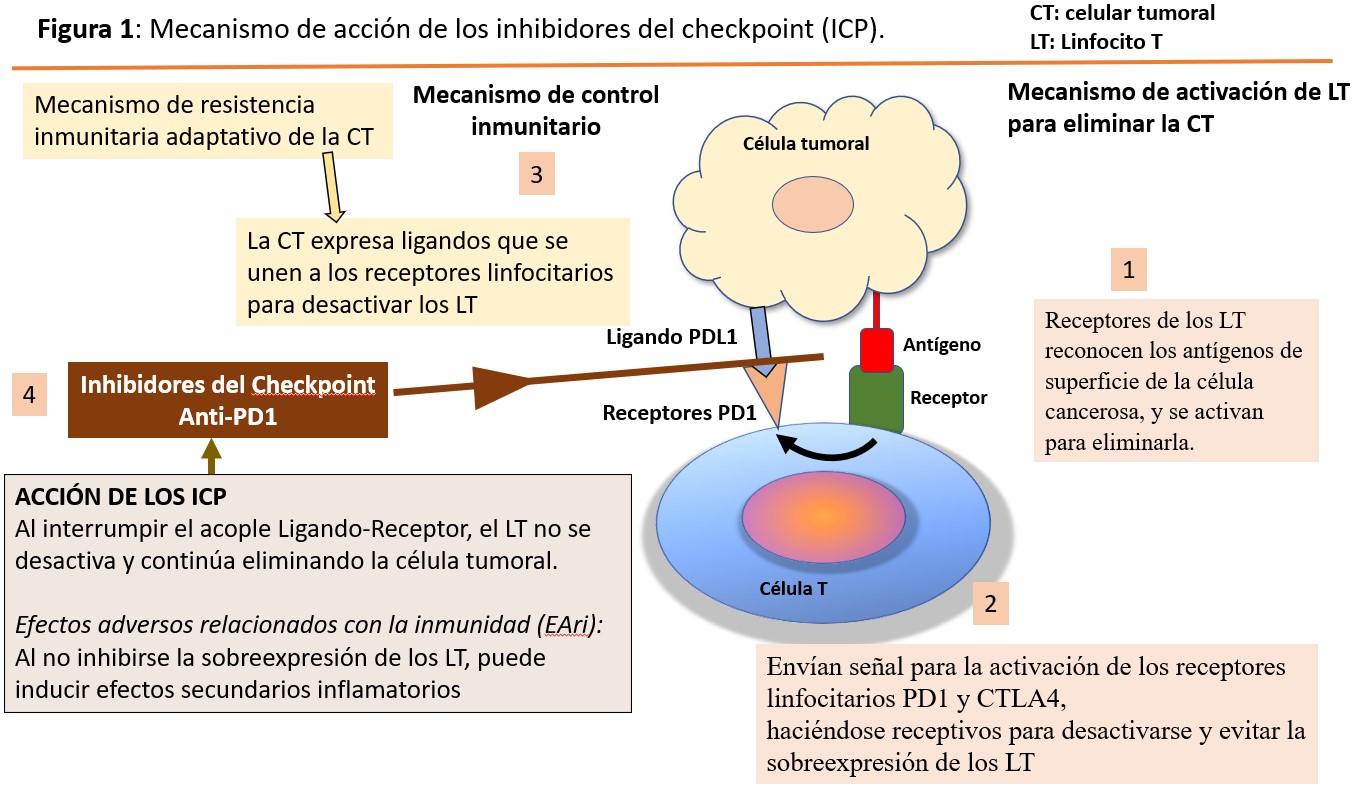
Cuando los receptores de los linfocitos T reconocen los antígenos de superficie que identifican a una célula como cancerosa, se activan para eliminarla. Pero cuando una célula T es activada, también es necesaria una señal de stop que asegure que no se producirá una sobreactivación que pudiera conducir a un proceso de autoagresión inmunitaria. Una de las vías por las que se regula esta activación de los linfocitos T es mediante receptores de inhibición como el PD 1 (receptor de muerte programada) y el CTLA 4 (cytotoxic T lymphocyte–associated antigen) presentes en la superficie de las células T y que son como “frenos de mano” que impiden la activación en exceso de la célula T (Figura 1).
Tras la activación, los linfocitos T aumentan la expresión del receptor PD 1 y CTLA 4 que les permitirá estar en situación de recibir la señal para desactivarse. Esta señal se producirá tras la unión de este receptor a su ligando PD L1 o PD L2, o B7 1/B7-2 que normalmente se expresan en la superficie de células dendríticas y macrófagos, y que provocará su desactivación con reducción de la producción de citocinas y la supresión de la proliferación de las células T.
Y es precisamente este mecanismo el que han integrado multitud de tumores mediante la expresión en su superficie de los ligandos PD L1 y PD L2 o B7-1/B7-2, logrando escapar así de la acción del sistema inmunitario. Es decir, la célula tumoral aprende a activar el “freno de mano”. La ruta PD 1/PD L1 y CTLA 4 representa, por lo tanto, un mecanismo de resistencia inmunitario adaptativo que desarrollan las células tumorales en respuesta a la actividad antitumoral endógena.
Los IPC son agentes contra PD 1, PD L1 y CTLA 4. Bloquean el receptor del linfocito o bloquean el ligando del tumor, de manera que estos dos no se encuentren y si no lo hacen el linfocito va a continuar activado para destruir el tumor [2].
Por eso es tan importante la inhibición de esta interacción. Gracias a la tecnología, ahora existen más de siete anticuerpos de diferentes casas farmacéuticas que inhiben el PD 1 o CTLA-4 del linfocito o inhiben el PD L1 del tumor y de esa forma el linfocito puede destruir el tumor y causar una regresión del cáncer. Veremos no obstante que estos fármacos ICP al mantener la sobreactivación del linfocito T pueden producir efectos adversos relacionados con la respuesta inmune.
Recientemente, se ha descrito un papel destacado de la vía IL-17 en la amplificación de la respuesta inmunitaria mediada por los ICP, lo que explica en parte la mayor incidencia de eventos adversos inmunomediados, incluida la nefritis intersticial aguda observada en pacientes tratados con terapias combinadas (Smith et al. J Immunol Res. 2024;58(4):456-463).
Por otra parte, la farmacocinética de los nuevos inhibidores del checkpoint desarrollados en los últimos dos años, como dostarlimab, ha mostrado una mayor afinidad por el receptor PD-1, lo que ha resultado en un perfil de toxicidad renal distinto, con aparición más temprana de disfunción tubular en pacientes vulnerables [Dostarlimab – FDA Drug Report, 2024].
ICP APROBADOS POR LA FDA Y EMA
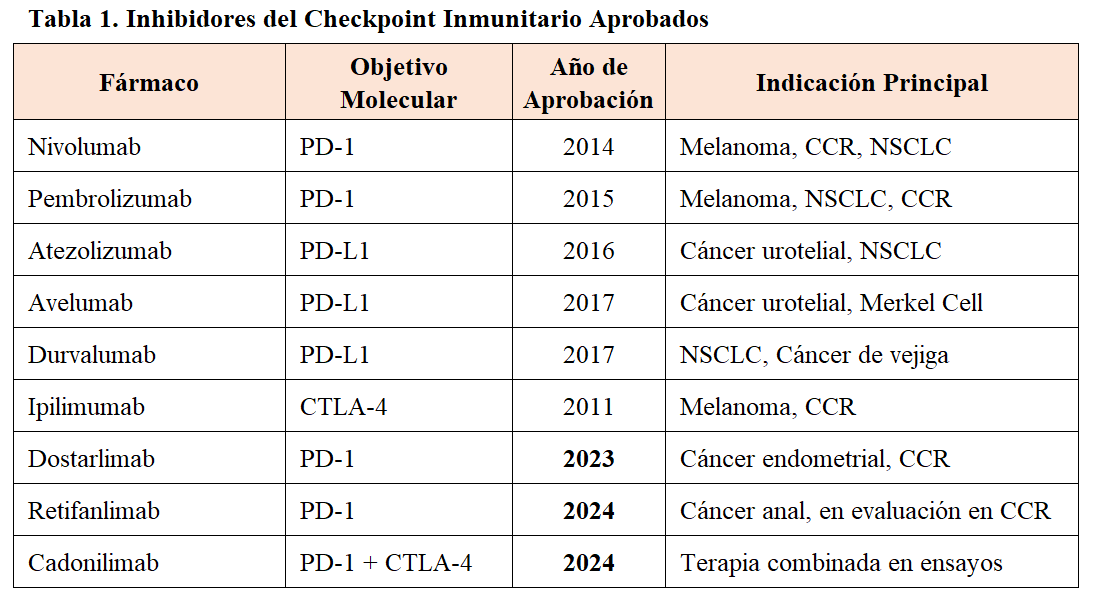
La inhibición de las vías de «checkpoint» inmunitario ha llevado a la aprobación de varios medicamentos nuevos para más de 50 indicaciones, entre otros: ipilimumab (anti CTLA 4), pembrolizumab (anti PD 1) y nivolumab (anti PD 1). En la actualidad los ICP ya se estiman que están indicados en cerca del 40% de los pacientes con cáncer [3]. En la (Tabla 1) se presentan un inhibidor CTLA-4, 3 antiPD-1 y 3 antiPD-L1 para varios tipos de tumores malignos aprobados. Actualmente se están realizando ensayos clínicos adicionales para ampliar la indicación de los ICP [4].
Durante los años 2023 y 2024, se han incorporado nuevos agentes terapéuticos aprobados por la FDA y EMA, ampliando el arsenal disponible para tratamientos tanto en monoterapia como en combinación [FDA Drug Approval Report 2024; EMA Update 2024].
La aprobación de dostarlimab en 2023 y retifanlimab en 2024 ha introducido nuevos perfiles de toxicidad, con particular relevancia en la afectación renal temprana, lo que ha llevado a las agencias reguladoras a recomendar controles estrictos de la función renal en los primeros meses de tratamiento [FDA 2024; EMA 2024].
Respecto a los efectos renales, estudios recientes han demostrado que los nuevos inhibidores, particularmente dostarlimab y retifanlimab, se asocian a un mayor riesgo de nefritis intersticial aguda de inicio temprano y disfunción tubular subclínica. En pacientes tratados con dostarlimab, se ha documentado una incidencia de toxicidad renal grado ≥2 en un 3,5% de los casos, con aparición media a las 6 semanas del inicio del tratamiento (Chen Y, et al. Lancet Oncol. 2025;26(3):345-353). Retifanlimab, por su parte, ha mostrado un perfil de toxicidad menos severo, pero con aparición de microalbuminuria persistente en hasta un 8% de los pacientes tras tres ciclos de tratamiento (Gupta N, et al. J Clin Oncol. 2024;42(2):215-222). Estos hallazgos refuerzan la necesidad de una monitorización estrecha de la función renal y biomarcadores urinarios durante las fases iniciales del tratamiento con estos fármacos.
Los ICP tienen vidas medias largas (6-27 días). Se eliminan principalmente por degradación proteolítica dentro del hígado así que la disminución de la función renal no afecta a la eliminación [5].
EVENTOS ADVERSOS RELACIONADOS CON EL SISTEMA INMUNITARIO (EAri) CAUSADOS POR LOS ICP
Es evidente que los ICP están revolucionando el tratamiento del cáncer con resultados muy positivos en las indicaciones aprobadas. No obstante, su uso está asociado con efectos adversos relacionados con un mecanismo de acción que es diferente de otros tratamientos sistémicos como la quimioterapia. Al aumentar la actividad del sistema inmunitario, los ICP pueden tener efectos secundarios inflamatorios. La incidencia puede ser tan alta como 59% a 85%, dependiendo del uso de un agente único o un tratamiento combinado con varios ICP [6].
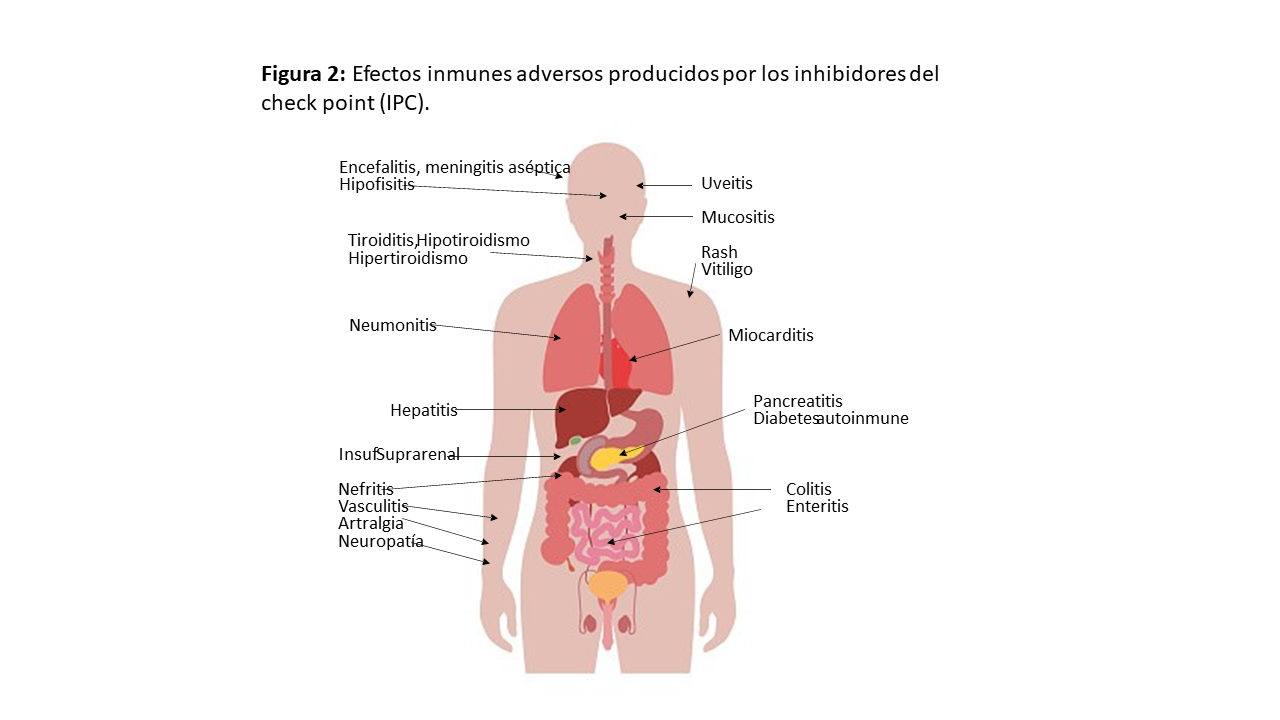
Se pueden afectar múltiples órganos y los más comunes son la piel, tracto gastrointestinal y pulmones, aunque también tiroides, suprarrenales, hipófisis, riñón, sistema musculoesquelético, nervioso, hematológico, cardiovascular y ojos (Figura 2).
Los anticuerpos anti-CTLA-4 inducen con mayor frecuencia colitis, hepatitis, hipofisitis, tiroiditis y dermatitis, con efectos graves en aproximadamente un tercio de los pacientes. Los agentes anti-PD1 tienen toxicidades similares, aunque menos frecuentes, y también pueden causar neumonitis, artritis inflamatoria y otros efectos adversos. Estudios recientes también han demostrado que estos agentes pueden causar ocasionalmente síndromes sistémicos que son aparentemente idénticos a los trastornos reumatológicos conocidos (p ej, síndrome de Sjögren, sarcoidosis). Aunque estos efectos secundarios generalmente se pueden controlar con corticosteroides y otros inmunosupresores, pueden ocurrir complicaciones secundarias importantes e incluso fatales en una pequeña proporción de pacientes [7].
Estos EAri generalmente se desarrollan dentro de las primeras semanas o meses después del inicio del tratamiento, pero pueden presentarse en cualquier momento, incluso después del cese del tratamiento con ICP y disminuir con el tiempo. Por su eventual gravedad requieren una detección temprana y un manejo adecuado. Además, el uso de ICP en pacientes con enfermedad autoinmune preexistente o antecedentes de trasplante de órgano, como veremos luego, requiere una discusión muy detallada de los beneficios y riesgos potenciales. Hay una guía de práctica clínica de la American Society of Clinical Oncology (ASCO) actualizada recientemente que aborda el manejo de estas complicaciones en pacientes adultos con cáncer tratados con ICP [8] [9].
Mecanismos responsables de EAri causados por los ICP
No se conocen muy bien, pero con seguridad están en relación con la función de los checkpoints en la regulación inmunitaria que es diferente si es PD-1 o CTLA-4. El CTLA-4 parece atenuar la activación de la célula T más precozmente en los linfáticos, mientras que el PD-1 lo hace más tardío en tejidos más periféricos. Las distintas funciones de CTLA-4 y PD-1 se reflejan en la diferente toxicidad observada en modelos de ratones knockout. Los ratones que carecen del gen CTLA-4 mueren por linfoproliferación mientras que los ratones que carecen de PD-1 tienen una autoinmunidad dependiente del modelo más limitada y variable, que incluye artritis y cardiomiopatía [10]. Así, los efectos adversos son diferentes: si es inhibidor CTLA-4 es más frecuente la colitis e hipofisitis mientras que la neumonitis y tiroiditis aparecen más en anti-PD-1.
Entre los mecanismos que pueden influir en la aparición de EAri, Postow [10] describe los siguientes:
- Aumento la actividad de las células T contra los antígenos que están presentes en los tumores y el tejido sano.
- Aumento de los autoanticuerpos preexistentes (anticuerpos antitiroideos por ejemplo) o a fármacos (haptenos) que habían sido tolerados previamente.
- Aumento de citocinas inflamatorias.
- Un efecto concreto en la hipófisis: aumento de la inflamación mediada por el complemento debida a la unión directa del anticuerpo antiCLA-4 con CTLA-4.
ICP en pacientes en riesgo (enfermedad autoinmune previa)
El tratamiento con ICP a pacientes con enfermedades autoinmunes o trasplantados o simplemente de avanzada edad es muy discutido pues ninguno de ellos se ha incluido en los ensayos clínicos. Para algunos autores los pacientes con un trastorno autoinmune subyacente deben ser considerados para el tratamiento con ICP si tienen un cáncer potencialmente mortal de manera que se sopesen los riesgos y los beneficios de dicho tratamiento.
Johnson y cols. publicaron un estudio retrospectivo de 30 pacientes con enfermedad autoinmune de 9 centros tratados con ipilimumab. Tenían una amplia gama de enfermedades, más comúnmente enfermedad inflamatoria intestinal (n = 6), artritis reumatoide (n=6) y psoriasis (n=5). El 27% experimentaron exacerbaciones autoinmunes y el 33% tuvieron un efecto adverso inmunológico. Todos estos eventos fueron manejables con corticosteroides, infliximab y/o suspensión de ipilimumab, excepto en un paciente. Varios pacientes con enfermedad inflamatoria intestinal tuvieron brotes. La mitad de los pacientes no experimentaron toxicidad y el 20% respondió al tratamiento [11]. Una serie adicional de 8 pacientes con artritis reumatoide demostró brotes de artritis frecuentes pero manejables (25% con grado 3), colitis frecuente (50%, todas se resolvieron con tratamiento) y altas tasas de respuesta (50%) [12].
Respecto a tratamientos con anti-PD1/ PD-L1 un estudio en fase III en pacientes con melanoma tratados nivolumab, que habían experimentado previamente efectos inmunológicos adversos con ipilimumab y cuya enfermedad había progresado previamente demostró que no hubo la reactivación de las toxicidades de ipilimumab en la gran mayoría de los casos [13]. En otro estudio en 52 pacientes con melanoma con varias enfermedades autoinmunes tratados con agentes anti-PD1/PD-L1, el 38% tuvo exacerbaciones autoinmunes (2 interrumpieron el tratamiento) y el 29% tuvo otros EAri [14]. Curiosamente, las enfermedades de tipo "reumatoide" (artritis reumatoide, psoriasis, polimialgia reumática) demostraron una alta probabilidad de brotes, mientras que ningún paciente con trastornos autoinmunitarios gastrointestinales o neurológicos experimentó exacerbaciones.
En lo que respecta a pacientes trasplantados renales, como comentaremos más adelante, las complicaciones de rechazo y pérdida de injerto son muy altas.
ICP en pacientes con Enfermedad Renal Crónica (ERC)
Es importante considerar que los pacientes con cáncer tienen una edad media de 65 años y que un 20-25% presentan una función renal disminuida con GFR < 60 ml/min/ 1.73m2 [15].
No obstante, ya que los ICP son anticuerpos que no son eliminados por los riñones o el hígado, su eficacia y seguridad en pacientes con insuficiencia renal o hepática deben ser similares a aquellos pacientes sin tal deterioro.
Hay algunos estudios que han sido incluidos pacientes en diálisis en los que no se observan más efectos adversos relacionados con el sistema inmunitario [16] [17].
Tratamiento de los EAri causados por los ICP
Se basan en retrasar la administración del ICP o añadir corticoides orales u otros inmunosupresores, que lógicamente pueden añadir efectos secundarios. En casos de colitis se recomienda infliximab [18] que ya en casos de nefritis intersticial refractaria a corticoides se ha usado con resultados prometedores [19]. No se ha visto por el momento una respuesta peor del tratamiento del cáncer en los pacientes que por los efectos adversos se han tratado con inmunosupresores, aunque son necesarios estudios más sólidos [20].
EFECTOS RENALES ADVERSOS CAUSADOS POR LOS ICP
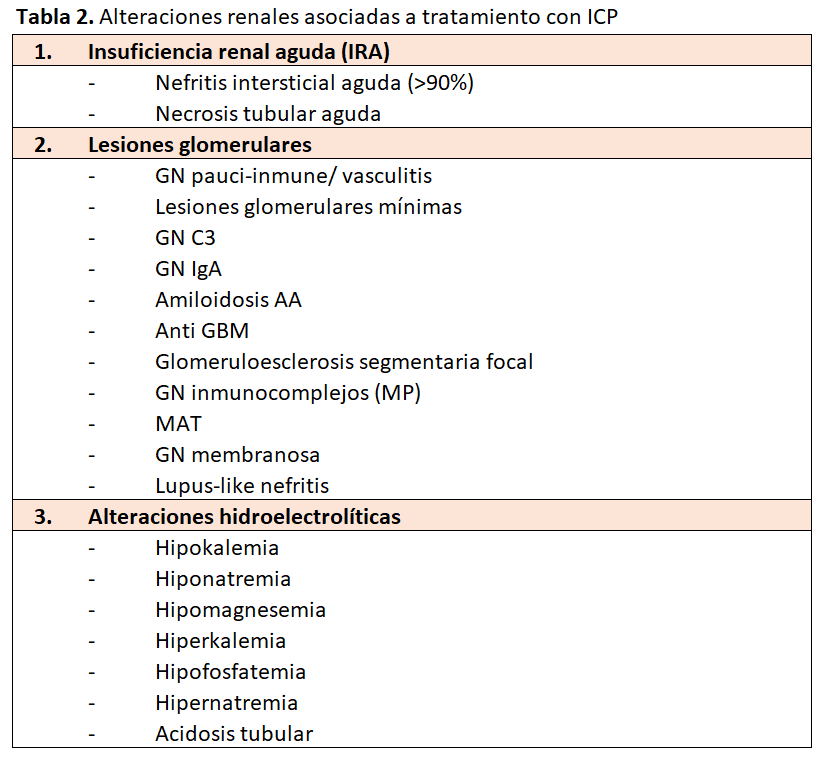
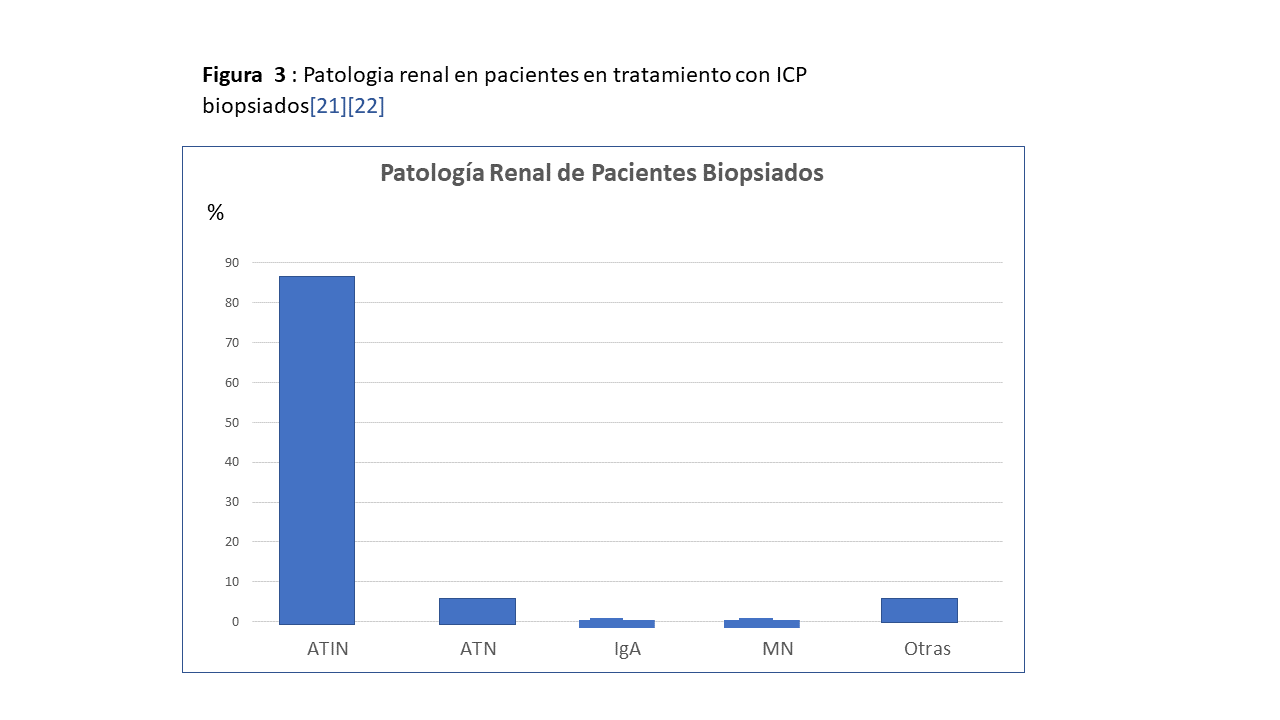
Las complicaciones renales asociadas a los inhibidores del check-point pueden observarse en la (Tabla 2) [21] [22]. De ellas la predominante es la nefritis intersticial aguda (NTIA) con más del 80-90% de los casos. Necrosis tubular y diferentes nefropatías glomerulares se presentan claramente en menor proporción (Figura 3).
1.- Insuficiencia renal aguda (IRA)
Definición
Un aspecto muy importante para graduar la frecuencia y gravedad de la IRA es clarificar su definición. Los criterios del Instituto Nacional del Cáncer (CTCAE) se basan en valores de creatinina que pueden “esconder” insuficiencia renal debido al deterioro de la masa muscular en pacientes con cáncer [23]. Es preferible la definición de KDIGO que incluye los cambios relativos al aumento en la creatinina sérica (Tabla 3) [24].
Incidencia
Cuando un paciente en tratamiento con ICP desarrolla IRA, a menudo existe incertidumbre sobre su etiología, ya que comúnmente puede deberse a una gran variedad de otras causas: infecciones, hipovolemia, contraste yodado, AINES, antibióticos... Por tanto, antes de asociar la IRA a ICP es necesario descartar muy minuciosamente otras causas ya que la decisión o no de suspender el ICP y administrar inmunosupresores puede tener serias consecuencias para la evolución del cáncer. Esto es importante en casos en los que se asocia la inmunoterapia a quimioterapia con fármacos que también pueden producir IRA como el cisplatino o carboplatino.
Hay varias publicaciones que estudian la incidencia. Manohar y cols. revisaron 48 ensayos clínicos con un total de 11.482 pacientes y encontraron un riesgo 4 veces más alto de IRA después del tratamiento con un inhibidor de PD-1 en comparación con agentes no nefrotóxicos. La incidencia estimada de ICP-IRA fue del 2% [25]. Seethapathy y cols [26] estudiaron 1.016 pacientes que recibieron ICP para una amplia gama de tipos de cáncer, desde mayo de 2011 a diciembre de 2016 en el Massachusetts General Hospital, y encontraron, dentro de los 12 meses tras iniciar tratamiento, un 17% de IRA y un 8% de eventos sostenidos de IRA, pero solo un 3% tuvieron IRA potencial relacionada con ICP con una media de aparición de 15 semanas después de iniciar tratamiento. Otras series estudiadas han reafirmado este porcentaje de incidencia de IRA estimado del 14.2-16.1% [27][28][29].
Factores de riesgo
Cortázar y cols. [22] en un estudio multicéntrico de 138 pacientes encontraron que son factores de riesgo independientes para ICP-IRA: un filtrado glomerular bajo, el uso de inhibidores de la bomba de protones (IBP) y la combinación de ICP.
El uso de IBP también ha sido encontrado en otros estudios [26]. Una posible explicación es que las células T pueden estar sensibilizadas por la exposición previa a fármacos como los IBP, y los ICP reactivan estas células T latentes específicas de fármacos (haptenos), lo que conduce a la pérdida de tolerancia. Los IBP, junto a otros medicamentos que se sabe que causan nefropatía tubulo intersticial aguda (NTIA), como antiinflamatorios no esteroideos (AINES) o cierto tipo de antibióticos, deben usarse con precaución en pacientes que reciben ICP y deben suspenderse en aquellos que desarrollan ICP-IRA [6]. Se ha visto que en aquellos pacientes en los que se produce ICP-IRA y que estaban recibiendo medicación que se ha asociado a NTIA, la interrupción de estos tratamientos facilita la recuperación completa de la función renal [22]. La existencia de un efecto inmune adverso (miocarditis, tiroiditis, colitis…) apoya la posibilidad de ICP-IRA pero solo hay un 43% de pacientes con ICP-IRA que tengan asociados estas complicaciones, así que su ausencia no descarta su asociación a ICP [22].
Clases de ICP
Con los diferentes estudios no se apreciaban diferencias en cuanto a la lesión renal producida en relación con los diferentes ICP con una incidencia estimada variable (3-5%). En general la asociación de inhibidores CTLA-4 y PD-1 parece condicionar esa cifra alta (5%) [26]. Seethapathy y cols. en un estudio retrospectivo de 599 pacientes que recibieron inhibidores PD-L1, 12 meses después del inicio del ICP, 104 pacientes (17 %) experimentaron IRA y 36 (6 %) experimentaron IRA sostenida; sin embargo, solo 5 (<1 %) experimentaron sospecha de IRA relacionada con PD-L1. La IRA relacionada con PD-L1 ocurrió una mediana de 99 días después de comenzar la terapia. Todos los pacientes recibieron simultáneamente otro medicamento que se sabe que causa NTIA (IBP, AINES, o antibióticos) en el momento de la IRA relacionada con PDL1 [30].
Nefritis tubulo intersticial aguda (NTIA)
La NTIA es con mucho (85-90%) el hallazgo histopatológico más frecuente encontrado en las biopsias renales de pacientes con ICP-IRA. Las primeras biopsias de pacientes con IRA asociado a tratamiento con ICP revelaron NTIA granulomatosa en tres casos y nefritis lúpica en uno [31]. Cortázar y cols. describen 13 pacientes de los que 12 presentaron NTIA y solo uno con granulomas por lo que no parece ser específica su presencia. De los 13 pacientes, 7 presentaron previamente manifestaciones extrarrenales de efectos adversos de los ICP [32]. Mamlouk y cols estudiaron 16 pacientes y encontraron NTIA en 14 presentado en casi todos los casos, bien como el hallazgo principal microscópico o como una forma leve, inflamación intersticial en asociación con otras patologías glomerulares (glomerulonefritis pauci-inmune, glomerulonefritis membranosa, glomerulonefritis C3, nefropatía por inmunoglobulina A (IgA) o amiloidosis AA) [33]. Cortázar y cols., en un estudio multicéntrico posterior con 138 pacientes encontró NTIA como lesión dominante en el 93% [22].
En la (Tabla 4) resumimos los aspectos más característicos de la NTIA asociada a ICP. La NTIA explica más de un 85% de los casos de IRA identificados por causa ICP. Coincide con otros procesos adversos extrarrenales en un 40-80%, aparece entre 12 y 14 semanas desde el inicio del tratamiento o antes si hay tratamiento con inhibidores de la bomba de protones. De hecho, puede aparecer a los pocos días de inicio del ICP o más de 10 semanas después de la última dosis. Se presenta con piuria estéril y proteinuria subnefrótica, si bien puede encontrarse una orina anodina.
Los mecanismos de desarrollo de la NTIA asociada al tratamiento con ICP son los mismos que en los efectos adversos del sistema inmunitario. Draibe et al estudiaron las posibles diferencias de la NTIA inmunomediada y la NTIA clásica asociada a otros fármacos. Encontraron un mayor período de latencia desde la introducción del fármaco al desarrollo de la IRA así como una mayor lentitud en la recuperación de la misma en el grupo de pacientes que presentaron NTIA mediada por inmunoterapia [34]. Con respecto a los IBP ya hemos comentado que una exposición previa pudiera actuar como un antígeno exógeno y desencadenar una respuesta inmune por sí misma o tras su unión a antígenos tubulares actuando como haptenos [6].
Necrosis tubular
No es la lesión predominante en la IRA asociada a ICP, pero hay algunas publicaciones que han observado esta lesión con más frecuencia de la habitual. Izzedine y cols estudiaron 12 pacientes tratados con pembrolizumab presentaron toxicidad renal (incidencia 1,77 %, con una mediana de edad 70 años). Los pacientes fueron remitidos por IRA (n=10) y/o proteinuria (n=2). Se realizó una biopsia renal a todos los pacientes, con una mediana de duración de uso de 9 meses (rango 1-24 meses) tras el inicio del tratamiento. La biopsia mostró que cuatro pacientes tenían NTIA, mientras que cinco tenían lesión tubular aguda (NTA) sola, uno tenía enfermedad de cambios mínimos (LGM) y NTIA, y uno sólo LGM [35]. Es posible que haya alguna explicación relacionada con la existencia de lesiones vasculares sugiriendo predisposición al desarrollo de necrosis tubular tras tratamiento con pembrolizumab. Pero lo importante es que en estos casos de necrosis tubular el tratamiento con esteroides no estaría indicado, lo cual enmarca la discusión que veremos más adelante sobre la necesidad de biopsia renal o no antes de tratamiento con corticoides en pacientes con IRA y tratamiento con ICP.
2. Alteraciones glomerulares
Como hemos visto la mayoría de las lesiones renales asociadas a ICP son NTIA. Por ello las guías ASCO desaconsejan la biopsia renal (salvo en casos graves) hasta no haber intentado un tratamiento con corticoides, aunque esa opinión no es universalmente aceptada [8].
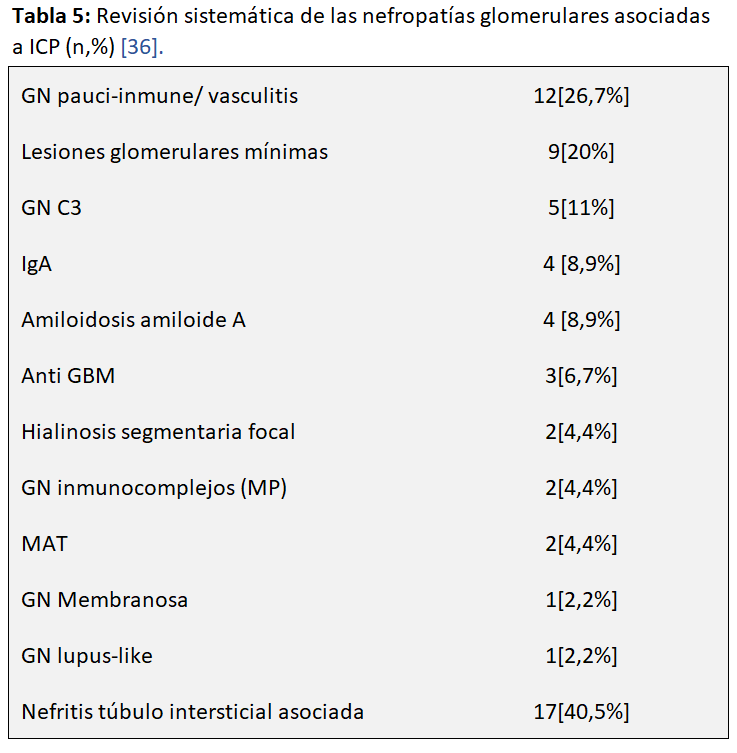
Se han descrito diferentes enfermedades glomerulares asociadas al tratamiento con ICP [36]. Kitchlu y cols. en una revisión sistemática y metaanálisis de 27 artículos con 45 casos biopsiados de enfermedad glomerular encuentran unos resultados que clarifican esta patología. Los pacientes habían recibido diversos tratamientos ICP: PD1/PDL1 (81%) nivolumab o pembrolizumab (35,7%) y agentes CTLA-4 (21,4%) entre otros. En la (Tabla 5) pueden observarse los diferentes tipos histológicos de nefropatías glomerulares encontrados destacando: 12 glomerulonefritis paucinmune y vasculitis renal (27%), 11 podocitopatías (lesiones glomerulares mínimas (n=9) y hialinosis segmentaria y focal (n=2)) (24%) y 5 glomerulopatía C3(11%). Es importante observar que en un 41% de los casos había una NTIA. Tan solo 2 de los pacientes con vasculitis fueron ANCA positivos. La mortalidad fue alta en este grupo a pesar del tratamiento con corticoides. Más del 60% de pacientes con podocitopatías remitieron total o parcialmente con la suspensión del fármaco y corticoides, y la mayoría de los pacientes C3 remitieron con esteroides únicamente. Ello hace posible que en algunos pacientes con daño glomerular pudiera reanudarse el tratamiento con ICP, particularmente en aquellos con podocitopatías aunque no tenemos datos sólidos para afirmarlo. Pero la evolución de los pacientes con enfermedad glomerular inducida “de novo” por ICP es mala. A la mayoría de los pacientes se les interrumpió el ICP (88%) y casi todos recibieron tratamiento con corticoides (98%). Se requirió dialisis en el 25%. La mayoría de los pacientes se recuperaron total (31 %) o parcialmente (42 %) de la IRA, aunque el 19 % permaneció dependiente de diálisis, y aproximadamente un tercio murió. La remisión completa o parcial de la proteinuria se logró en el 45% y 38%, respectivamente [36].
Tampoco conocemos los mecanismos por los cuales los ICP inducen enfermedad glomerular. Se han elaborado diferentes explicaciones todas ellas ya discutidas con anterioridad en los eventos adversos relacionados con los ICP: un aumento de los procesos inflamatorios por hiperactividad de las células T, producción de autoanticuerpos o inflamación relacionada con la producción de C5a que se ha visto aumentada cuando se bloquea el PDL-1[37].
3.- Trastornos hidroelectrolíticos
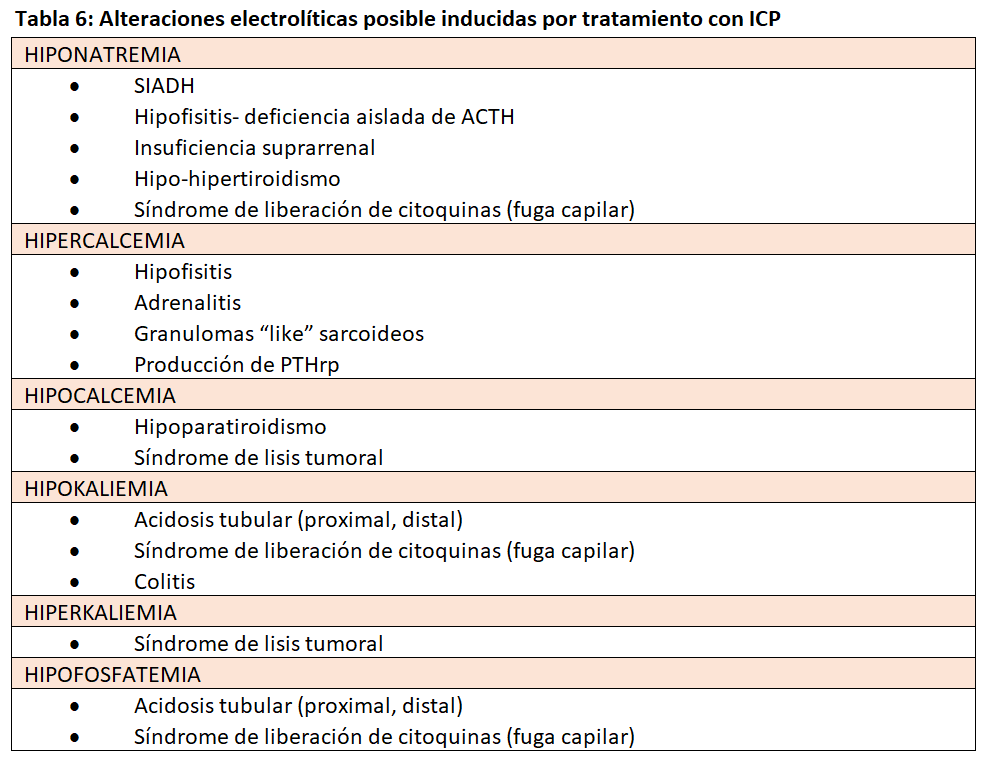
La afectación de órganos endocrinos relacionados con el tratamiento con ICP se ha descrito en algunas publicaciones. Se cree se debe a los efectos secundarios de la hiperactivación de las células T, que ya hemos descrito como efectos adversos relacionados con el sistema inmunitario, y se han citado: hipotiroidismo, adrenalitis e hipofisitis, todos ellos con posible asociación a trastornos electrolíticos (Tabla 6) [38][39][40].
Hiponatremia
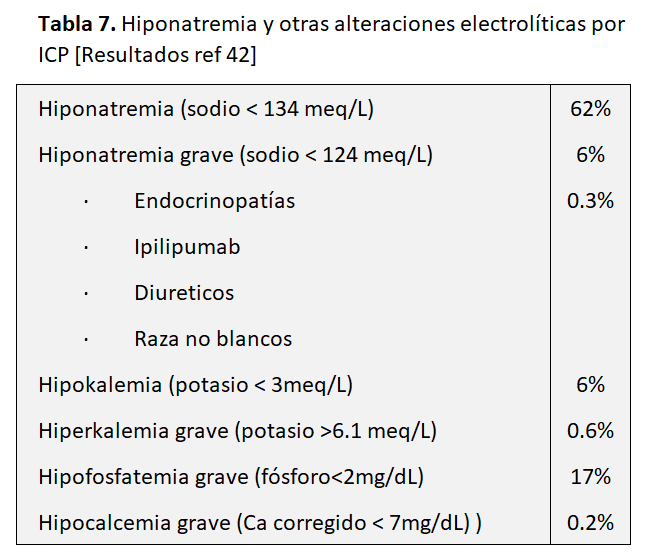
Entre estos trastornos se ha comunicado la hiponatremia sin precisar claramente su relación con los ICP, pues en el paciente con cáncer las causas de hiponatremia son muy variadas: SIADH, diarrea, vómitos, etc. [41]. En un estudio de un solo centro, en el Massachusetts General Hospital Cancer Center, con 2458 pacientes que recibieron diferentes ICP (inhibidores CTLA-4, PD-1, PDL-1 y combinación CTLA-4/PD-1) por diferentes tipos de cáncer encontraron diferentes alteraciones electrolíticas (Tabla 6). La hiponatremia fue la anomalía electrolítica más observada, ocurriendo en el 62%, con un 6% de hiponatremia muy grave (grado 3 o 4, sodio sérico < 124 mEq/l). La hiponatremia grave se relacionó con la presencia de SIADH y paciente terminal, que significaron dos tercios de los casos. La insuficiencia suprarrenal por adrenalitis autoinmune solo fue responsable de un 7% de esos casos graves, por lo que resulta excepcional. La incidencia total de endocrinopatías fue muy baja (0,3%) y el riesgo de hiponatremia muy grave incluyó el tratamiento con ipilipumab (anti CTLA4) uso de diuréticos y raza negra. Salvo la hipofosfatemia severa que ocurrió en el 17% de los casos, el resto de las alteraciones electrolíticas incluidas en la (Tabla 7) fueron escasas [42]. El hallazgo de la relación del ipilipumab con hiponatremia e hipofisitis es conocido y muy superior a los anti PD1 y PDL 1 [43].
Por tanto, aunque la hiponatremia es muy común en pacientes que reciben ICP, las causas de hiponatremia relacionada con efectos inmunes adversos son infrecuentes.
Acidosis tubular
La forma más frecuente de acidosis asociada al uso de ICP es la acidosis tubular distal que, en la mayoría de los casos, aún sin IRA, está relacionada con incipiente o moderada NTIA. Así que parece de origen autoinmune como sucede en el síndrome de Sjögren, cirrosis biliar primaria, hepatitis autoinmune, lupus o artritis reumatoide. Se produce como consecuencia de la alteración de la bomba H+/ATPasa o Cl- /CO3H- en las células del tipo A del túbulo colector [44]. Cursa con hipokalemia y en todos los casos precisa tratamiento con esteroides y bicarbonato.
Herrman y cols. encontraron que en algunos casos, la acidosis tubular distal puede persistir a pesar de la mejora de la función renal mientras se reducen los corticoides. En estos casos, el análisis de inmunofluorescencia con anticuerpos específicos de biopsias renales muestra pérdida de células intercaladas que expresan intercambiador de aniones tipo 1 y subunidades beta 1 y alfa 4 de H¿-ATPasa de tipo vacuolar en comparación con los controles, aclarando en parte el mecanismo de autoinmunidad [45].
También se han evidenciado casos de acidosis tubular proximal con reducción del cotransporte electrogénico sodio bicarbonato en el túbulo proximal [45]. PD-L1 se expresa en el epitelio tubular y los agentes antiPD-L1 pueden inducir daño inmunológico resultando en acidosis tubular renal pero no se conoce bien el grado de respuesta autoinmune que puede originar su bloqueo.
BIOMARCADORES DE ICP-IRA
La posibilidad de encontrar marcadores de daño renal que den información sobre el diagnóstico de la lesión renal aguda inducida por ICP está cada vez más cerca pero aún están en fases tempranas de desarrollo.[46] Isik y cols. estudiaron en la clínica Mayo 37 pacientes con ICP-IRA y 13 sin ICP-IRA. En el momento de la IRA, la proteína C reactiva (PCR) y el cociente en orina proteína ligada al retinol/creatinina (uRBP/Cr) fueron significativamente más altos en los pacientes con ICP-IRA en comparación con los pacientes sin ICP-IRA: PCR 54,0 frente a 3,5 mg/l y uRBP/Cr 1927 frente a 233 μg/g respectivamente, (p < 0,05 para todos). Este estudio es el primero en identificar 2 biomarcadores proteicos, PCR sérica y uRBP/Cr, como marcadores de ICP-AKI, con NTIA como lesión dominante en la biopsia renal [47].
Los autores de este estudio explican que las concentraciones séricas elevadas de PCR, particularmente junto con una uRBP/Cr elevada, pueden indicar la presencia de efectos renales adversos por el tratamiento con ICP. La RBP es una proteína de bajo peso molecular que es reabsorbida por las células del túbulo proximal renal donde se cataboliza y, en condiciones normales, muy poca de la RBP filtrada se excreta en la orina [48]. Por lo tanto, la RBP es un biomarcador de disfunción tubular proximal y se está utilizando como herramienta diagnóstica en algunas tubulopatías proximales y enfermedades renales intersticiales como la NTIA y es probable que refleje efectos inespecíficos de la inflamación intersticial. Consideran los autores que en circunstancias en las que se hayan descartado otras razones infecciosas e inflamatorias pueden servir para indicar la presencia de ICP-IRA. Y por el contrario cuando los dos marcadores (PCR y uRBP/Cr) son normales la posibilidad de ICP-IRA es muy baja [47].
Aunque las investigaciones de TNF-α, IFN-γ, IL-6, IL-8, TGF-β y otras citoquinas como predictores de las respuestas y eventos adversos del tratamiento con ICP produjeron resultados alentadores, es poco probable que una sola citoquina sea suficiente para predecir la respuesta a la inmunoterapia y los efectos inmunológicos adversos por la complejidad de las interacciones [49].
Lo cierto es que se requieren biomarcadores para predecir la respuesta tumoral y la aparición de efectos inmunológicos adversos por el tratamiento con ICP con la finalidad de evitar el sobretratamiento y minimizar el desarrollo de efectos adversos. Nakamura Y [46] revisa los avances recientes en la comprensión de los biomarcadores en pacientes con cáncer tratados con ICP, pero no hay todavía biomarcadores predictivos absolutos.
CUANDO INDICAR UNA BIOPSIA RENAL A PACIENTES CON DAÑO RENAL TRATADOS CON ICP
La discusión se basa en que como la mayoría de las lesiones renales producidas por los ICP son NTIA, se pueden evitar los riesgos de la biopsia renal si han sido descartadas otras causas y no se sospecha enfermedad glomerular, tratando inicialmente con esteroides y según la respuesta decidir más adelante. Muchos médicos creen que la sospecha clínica junto con datos de laboratorio que lo apoyen (por ejemplo, eosinofilia, piuria estéril, etc.) son suficientes para hacer un diagnóstico. De hecho las guías de la ASCO y National Comprehensive Cancer Network (NCCN) recomiendan que si no se identifica una causa alternativa de IRA, los médicos deben proceder directamente con tratamiento inmunosupresor con corticoides sin una biopsia renal a menos que se trate de una IRA renal moderada/grave potencialmente mortal [8][50]. En cambio, otros creen que, en la mayoría de los pacientes, la NTIA sólo se puede diagnosticar con una biopsia renal ya que muchos de esos datos clínicos están ausentes en pacientes biopsiados y solo un 50% presentan manifestaciones extrarrenales [5].
Oleas et al [28] demostraron en una serie de 826 pacientes con cáncer, que tan sólo 23 (18.4% de los que habían presentado IRA), fueron valorados por nefrología y tan sólo 8 fueron biopsiados. Esto es un reflejo del posible infradiagnóstico que puede existir en la etiología del daño renal.
Los razonamientos en favor o en contra de una biopsia renal en pacientes con IRA tratados con ICP son alguno de los siguientes [51]:
A favor de la biopsia renal
- Se debe obtener una biopsia renal porque los pacientes con cáncer tratados con ICP que desarrollan IRA pueden tener NTA y otras lesiones renales en lugar de NTIA.
- Asumir que los pacientes tienen NTIA puede exponerlos a corticosteroides innecesarios (con sus complicaciones asociadas) y dar lugar a una interrupción desacertada del tratamiento con ICP. En última instancia, este enfoque puede conducir a resultados inferiores en el tratamiento del cáncer.
- La confirmación histológica del tipo de lesión renal es fundamental de cara a poder reintroducir la inmunoterapia en caso necesario.
En contra de la biopsia renal
- La mayoría de los pacientes que reciben ICP presentan NTIA por lo que puede asumirse un tratamiento con corticoides.
- La biopsia renal es un método con eventuales complicaciones serias.
- Con el tratamiento con corticoides logra una remisión completa o incompleta en un 87%.
MANEJO DEL PACIENTE CON IRA RECIBIENDO TRATAMIENTO CON ICP
En los pacientes con cáncer que desarrollan IRA de entrada deben descartarse otras causas de IRA diferentes al tratamiento con ICP tales como uropatía obstructiva, uremia prerrenal o nefrotoxicidad inducida por fármaco, quimioterápicos u otros fármacos nefrotóxicos (p. ej., aminoglucósidos, medios de contraste, bisfosfonatos). Si diagnosticamos una NTIA hay que evaluar la suspensión del tratamiento con ICP y tratar con corticosteroides, si no existe contraindicación. Se trata de encontrar un equilibrio entre la prevención del fallo renal y mantener controlada la evolución del cáncer.
Los corticoides son la base del tratamiento de NTIA en pacientes que reciben ICP. Es cierto que no hay estudios aleatorizados pero los datos de estudios observacionales lo apoyan. En el estudio de Cortázar y cols [22] la mayoría de los pacientes se trataron con corticoides (86%) y un 40-45% tuvieron recuperación completa o parcial, respectivamente. Gupta y cols. [52] en un estudio multicéntrico sobre 429 pacientes con IRA asociada a tratamiento con ICP encontraron que la recuperación renal ocurría en aproximadamente 2/3 de los pacientes, y que el inicio temprano de corticosteroides se asociaba con una mayor probabilidad de recuperación renal. Otros estudios coinciden con un 85% de recuperación parcial o completa de la función renal [26][27][53]. Considerada la larga vida media de los ICP (por ejemplo 27 días el pembrolizumab) el tratamiento con corticoides puede ser preciso durante 8-12 semanas dependiendo de la respuesta. El tratamiento temprano con corticoides es esencial. En el estudio multicéntrico de Gupta y cols. [21] el inicio temprano de corticosteroides (dentro de los 3 días de ICP-IRA) se asoció con una mayor probabilidad de recuperación renal en comparación con el inicio tardío (más de 3 días después de ICP-IRA).
También se han investigado otros agentes inmunosupresores en el contexto de ICP-IRA. Cortázar y cols. [22] administraron micofenolato de mofetilo en 7 pacientes logrando una recuperación renal completa en un paciente y parcial en los 6 restantes. Otros agentes que se han estudiado incluyen rituximab, ciclofosfamida e infliximab.
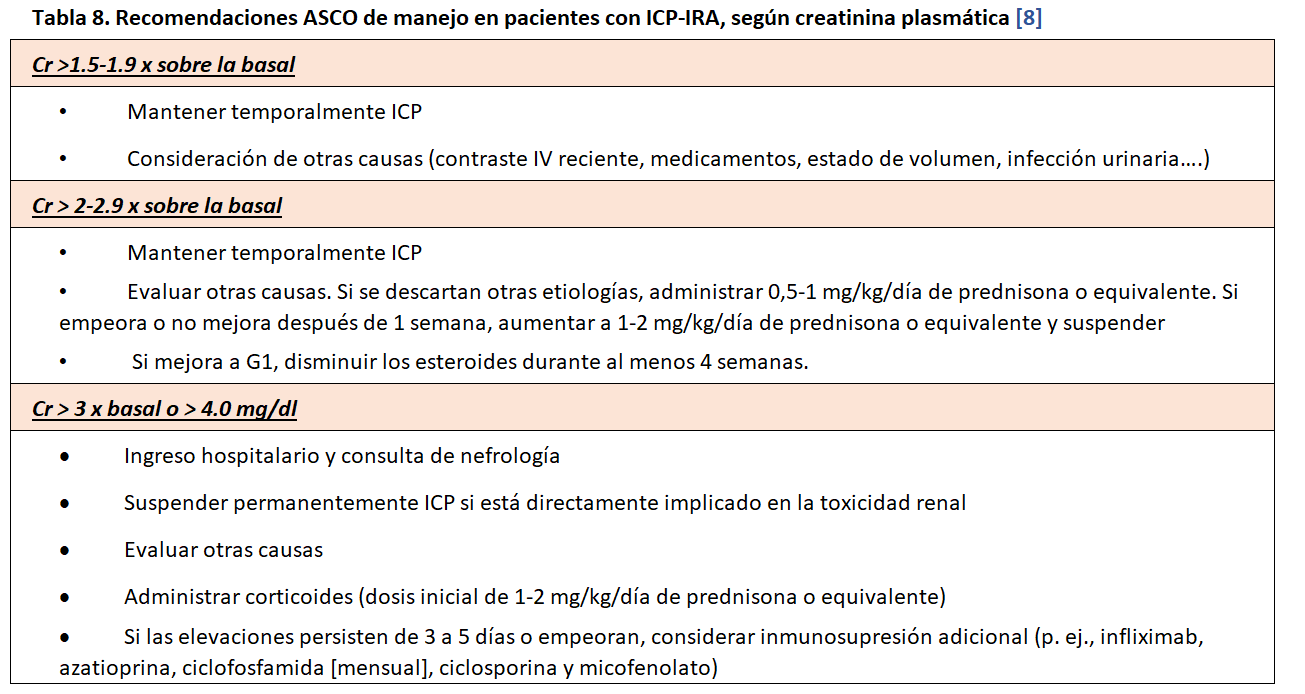
En la (Tabla 8) pueden observarse las recomendaciones ASCO [8] con alguna modificación.
En los últimos dos años, los registros clínicos internacionales han reportado un incremento de los EAri de presentación atípica, con afectación renal precoz en pacientes tratados con nuevas combinaciones de ICP, especialmente en esquemas que incluyen dostarlimab y cadonilimab [FDA 2024; Gupta N, et al. J Clin Oncol. 2024;42(2):215-222].
Los estudios multicéntricos recientes destacan que los eventos renales representan hasta el 5% de todos los EAri, con nefritis intersticial aguda como manifestación predominante. Además, se han reportado casos de glomerulopatías, como nefropatía por IgA y glomeruloesclerosis segmentaria y focal, en pacientes bajo terapias prolongadas [González M, et al. Nephrol Dial Transplant. 2025;40(1):112-119].
REANUDACION DEL TRATAMIENTO DESPUES ICP-IRA ("RECHALLENGE")
Dado que la mayoría de los eventos adversos relacionados con el sistema inmunitario (EAri) se resuelven en semanas o meses después del tratamiento con inmunosupresores (corticoides generalmente), uno de los temas más importantes en la práctica clínica es la seguridad de reanudar el tratamiento después de que se haya resuelto el evento adverso.
Reanudación después de efectos adversos inmunológicos (EAri) no renales. ICP: recurrencia de los efectos
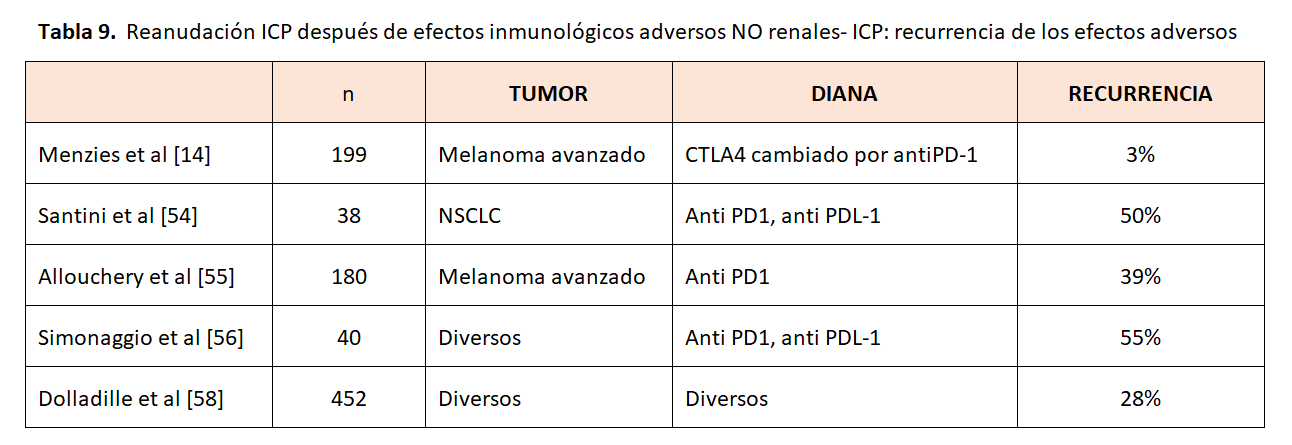
Tenemos estudios observacionales retrospectivos que analizan la incidencia de efectos inmunes adversos generales al reanudar el tratamiento (Tabla 9). Menzies y cols. estudiaron 119 pacientes con melanoma avanzado y trastornos autoinmunes previos o toxicidad con ipilimumab (anti CLA-4). El tratamiento posterior con anti-PD-1 se asoció con una baja tasa de eventos adversos recurrentes relacionados con el sistema inmunitario (3 %). Estos hallazgos sugieren que la toxicidad puede ser específica del tratamiento en lugar de generalizable entre los diversos tipos de ICP [14]. Santini y cols. describieron pacientes con cáncer de pulmón de células no pequeñas (NSCLC) tratados con terapia anti-PD-1 o anti-PD-L1 que tuvieron EAri que requirieron un retraso en el tratamiento, el tratamiento con glucocorticoides, o ambos, y que luego fueron tratados de nuevo con fármacos anti-PD-1 o anti-PD-L1. Entre 38 pacientes que se retrataron, el 50% no tuvo más eventos adversos relacionados con el sistema inmunológico, el 24 % tuvo recurrencia del evento inicial y el 26% tuvo un nuevo evento. Por lo tanto, el tratamiento con ICP después de la resolución de los EAri puede desencadenar eventos adversos recurrentes o nuevos [54]. Otro autor evaluó a los pacientes tratados con ICP con al menos un efecto inmune adverso de grado 2 que dio como resultado la interrupción de ICP, con una exposición posterior. Los autores demostraron que el 61,1 % de los pacientes que interrumpieron el tratamiento con ICP por EAri de grado 2 no experimentaron estos efectos recurrentes después del retratamiento con ICP [55]. Simonaggio y cols. describieron, en su cohorte francesa de 93 pacientes que se habían recuperado recientemente de un EAri grado 2 o superior, que un nuevo retratamiento condujo a la recurrencia de un segundo evento adverso en el 55% de los pacientes dentro de una mediana de tiempo de seguimiento de 14 meses. De ese 55 % de los pacientes, el 13 % tuvo un efecto adverso diferente al evento inicial. Los autores refieren que la gravedad del segundo evento no era mayor que la del primero [56]. Un estudio similar de Abu-Sbeih y cols. observaron la recurrencia de diarrea y colitis relacionadas con el sistema inmunitario después de la reexposición de ICP y encontraron que esto era menos grave en los medicamentos PD-1 en comparación con los inhibidores de CTLA-4 [57].
Un gran estudio de cohorte de farmacovigilancia de casos individuales de la base de datos de la OMS muestra la tasa de recurrencia de efectos inmunes adversos en pacientes tras intentar de nuevo el tratamiento con ICP que fue un 29% con mayor frecuencia colitis, hepatitis y neumonitis [58].
Una reciente revisión analiza desde un punto de vista crítico la evidencia disponible [59].
Reanudación después de IRA -ICP: recurrencia de IRA
La IRA asociada a ICP (ICP-IRA) ocurre como hemos visto en el 2-5 % de los pacientes que reciben inmunoterapia, pero la incidencia difiere según el agente administrado y la dosis del agente, con las incidencias más altas reportadas para tratamiento combinado anti-CTLA-4/anti-PD-1/PD-L1.[60] Entre las ICP-IRA, la NTIA es el hallazgo patológico más común y tiende a responder rápidamente en la mayoría de los casos al suspender la terapia ICP y con la administración oportuna de corticosteroides Cuando un paciente ha tenido un episodio de ICP-IRA, especialmente de grado 2-3, y es necesario ese tratamiento para la remisión del cáncer es compleja la decisión de reanudar el ICP pues podría conducir a nuevos episodios de IRA y empeorar gravemente el pronóstico. De acuerdo con las guías de la ASCO, el tratamiento con ICP debe interrumpirse de forma permanente en todos los pacientes que desarrollen IRA de grado 2 si no mejora tras unos días con esteroides y en grado 3 (es decir, un aumento en la creatinina sérica de más de tres veces el valor inicial o necesidad de tratamiento renal sustitutivo) [8]. El problema de esta opinión es que este enfoque puede privar a los pacientes de una terapia que podría salvarles la vida.
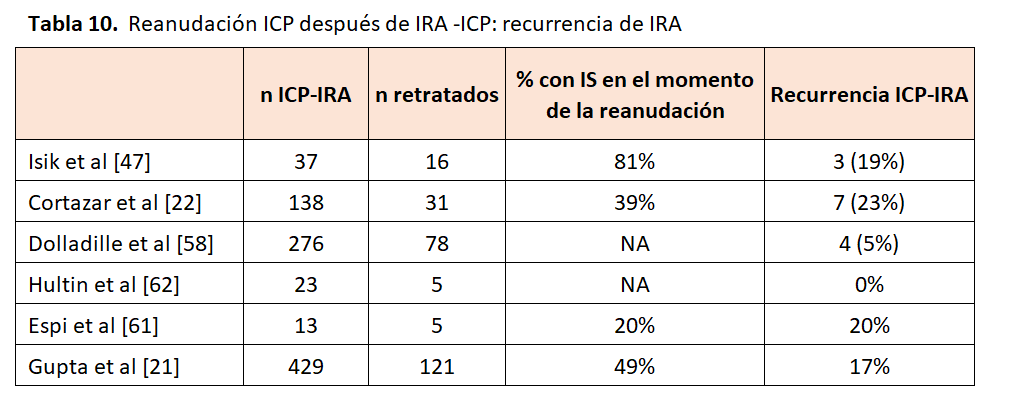
La recurrencia del ICP-IRA después de retratamiento se encuentra en varias publicaciones (Tabla 10). Cortázar y cols. en un estudio multicéntrico con un total de 138 pacientes con ICP-IRA, 31 (22%) se trataron nuevamente, aproximadamente 1,8 meses después del diagnóstico de ICP-IRA estadio 2 o 3. Se observó recurrencia de ICP-IRA en 7 pacientes (23%). La mayoría (85%) tuvieron una respuesta parcial (RP) o completa (RC) después del retratamiento. Al igual que otros estudios, la mayoría (87%) recibieron el mismo tratamiento ICP recibido en el episodio inicial de IRA, y alrededor del 40% seguían con corticosteroides en el momento de recibirlo [32]. Isik en 16 pacientes con ICP-IRA intentó un retratamiento con ICP y encontró recurrencia en 3 (19 %) [47]. Otros estudios revelan asimismo recurrencias dependientes del tratamiento inmunosupresor aplicado [61][62].
Gupta y cols. en 121 pacientes que se trataron de nuevo, 16,5% desarrollaron ICP-IRA recurrente. No detectaron una diferencia de supervivencia en estos pacientes frente a los no re-tratados; sin embargo, pudiera ser que los pacientes con neoplasias malignas más agresivas se hubieran seleccionado de manera preferencial para un retratamiento con ICP, lo que podría haber ocultado un beneficio de supervivencia. Según los autores dada la baja incidencia de ICP-IRA recurrente, parece razonable considerar la reexposición en pacientes para quienes los ICP son el tratamiento óptimo [21].
Consideraciones para retratar o no a un paciente después de un ICP-IRA
Como hemos visto en los estudios anteriores la posibilidad de reaparición de un nuevo episodio de ICP-IRA es cercano al 20%, lo que no se considera muy elevado. Aunque los eventos adversos recurrentes suelen ser menos graves que los eventos iniciales (probablemente debido a una mayor vigilancia), la decisión de reiniciar el tratamiento con ICP depende de la gravedad del evento anterior, la disponibilidad de opciones de tratamiento alternativas y del estado general del cáncer.
Ahora bien, hemos de considerar tres aspectos importantes. En primer lugar, la gravedad del evento adverso. Si hay toxicidad potencialmente mortal, en particular la toxicidad cardíaca, pulmonar o neurológica, miocarditis o liberación masiva de citoquinas no debemos considerarlo. Luego, la presencia de fármacos que puedan producir NTIA-IRA y que puedan ser retirados (IBP, AINES…), y finalmente, la combinación de tratamientos ICP. Con estas consideraciones y tras tratamiento inmunosupresor (corticoides preferentemente) y una vez alcanzada la remisión completa o parcial Hermmann [63] propone varias posibilidades:
1.- Cambiar la clase de ICP siempre y cuando sea aceptado por el oncólogo. Algunos producen diferentes efectos adversos que otros y por ejemplo la incidencia de ICP-IRA es menor del 1% con bloqueo de PDL1 en comparación con una incidencia del 2-5% con otras clases [30].
2.- Seguir con el mismo ICP o en caso de doble tratamiento suprimir CTLA-4 y continuar con monoterapia anti PD-1.
3.- Escenario de prevención secundaria en el que se reanuda la ICP concomitantemente con la terapia inmunosupresora. Tras resolución del episodio inicial de ICP-IRA la inmunoterapia se reanuda manteniendo dosis bajas de esteroides (generalmente 10-20 mg diarios) dependiendo de otros factores como la gravedad de la IRA y efectos adversos concomitantes. Esta prevención secundaria se puede mantener durante el primer mes o 1-2 ciclos.
Por tanto, oncólogo, médicos y equipos multidisciplinares hemos de equilibrar el beneficio clínico y el peligro de las toxicidades relacionadas con el tratamiento para cada paciente pues el tratamiento puede salvar vidas en varias ocasiones [64].
Según las nuevas guías NCCN 2025, la reanudación del tratamiento puede considerarse en pacientes con IRA grado 1 o 2 completamente resuelta, siempre que no se haya requerido biopsia renal con hallazgos de daño glomerular significativo.
Estudios recientes han demostrado que el riesgo de recurrencia de la IRA tras la reintroducción de ICP oscila entre el 25% y 40%, siendo mayor en pacientes que recibieron combinaciones de PD-1 y CTLA-4 [Chen Y, et al. Lancet Oncol. 2025;26(3):345-353]. Se recomienda realizar controles de creatinina y biomarcadores urinarios cada dos semanas durante los tres primeros meses tras la reintroducción.
Además, en pacientes de alto riesgo, las nuevas guías sugieren considerar la utilización de esquemas de inmunoterapia menos agresivos o la transición a agentes dirigidos no inmunológicos cuando sea clínicamente viable [SEOM 2024; ASCO 2024].
MANEJO DEL PACIENTE TRASPLANTADO RENAL CON CANCER RECIBIENDO TRATAMIENTO CON ICP
El cáncer es una de las mayores causas de mortalidad en la población general y trasplantada de órgano sólido. La incidencia de tumores en la población trasplantada renal es aproximadamente 10 veces superior a la de la población general [65][66]. La inmunosupresión puede predisponer al cáncer al inhibir la vigilancia inmunológica, suprimir la reparación del ADN y predisponer a infecciones virales oncogénicas. El número de pacientes viviendo con un riñón trasplantado es creciente por lo que la indicación de nuevos tratamientos inmunoterápicos también es progresiva.
Factores para considerar cuando se indican ICP en pacientes con trasplante renal
Hay varios factores a considerar cuando se usan ICP en receptores de trasplante de riñón [67]:
1.- La elección de ICP: existen diferentes estudios observacionales de casos aislados que marcaban diferencias en la inducción de rechazo agudo con los diferentes ICPs. Inicialmente, se notificó que los pacientes trasplantados toleraban ipilimumab (anti CTLA-4) [68]. Más tarde se vio que los anti-PD-1 (nivolumab, pembrolizumab) aceleraban el rechazo agudo del aloinjerto [69] al igual que la asociación de ipilimumab (anti CTLA-4) + pembrolizumab (anti-PD-1) [70].
Gupta y cols [6] en una revisión de casos y series de casos publicados encontró que la tasa de rechazo con monoterapia con ipilimumab fue del 33% en comparación con el 52% en pacientes que recibieron monoterapia con anti-PD-1. El uso secuencial de ipilimumab seguido de anti-PD-1 se asoció con rechazo en el 55% de los casos. Es difícil sacar una conclusión definitiva porque los pacientes habían sufrido diferentes reducciones o cambios en la inmunosupresión en el momento del diagnóstico de cáncer metastásico, lo que podría influir fuertemente en las tasas de rechazo. Se precisan pues más estudios.
2.- Tipo de inmunosupresión: diferentes asociaciones de diversos inmunosupresores pueden influir en la respuesta del injerto al tratamiento con ICP: esteroides, antimetabolitos, anticalcineurinicos, inhibidores de mTOR. Se ha visto que un aumento de la inmunosupresión en el momento del inicio del ICP o el uso de inhibidores de mTOR se asoció con un menor riesgo de rechazo [71].
3.- Tipo de cáncer: aunque hay muchas indicaciones para el uso de ICP la eficacia en el carcinoma de células escamosas de la piel y el melanoma avanzado, los dos cánceres más comunes en pacientes trasplantados, fue similar a la de los pacientes no trasplantados [72].
4.- Rechazo del órgano trasplantado: los nuevos tratamientos como los ICP producen rechazo celular y humoral del injerto en un 30-40%, de los que hasta un 60% motiva la pérdida del riñón [71].
5.- Otros: factores como la duración del trasplante, historia de anticuerpos donante específicos o una historia previa de rechazo son también importantes para considerar los riesgos.
Estudio multicéntrico sobre seguridad y eficacia de los ICP en pacientes trasplantados con cáncer
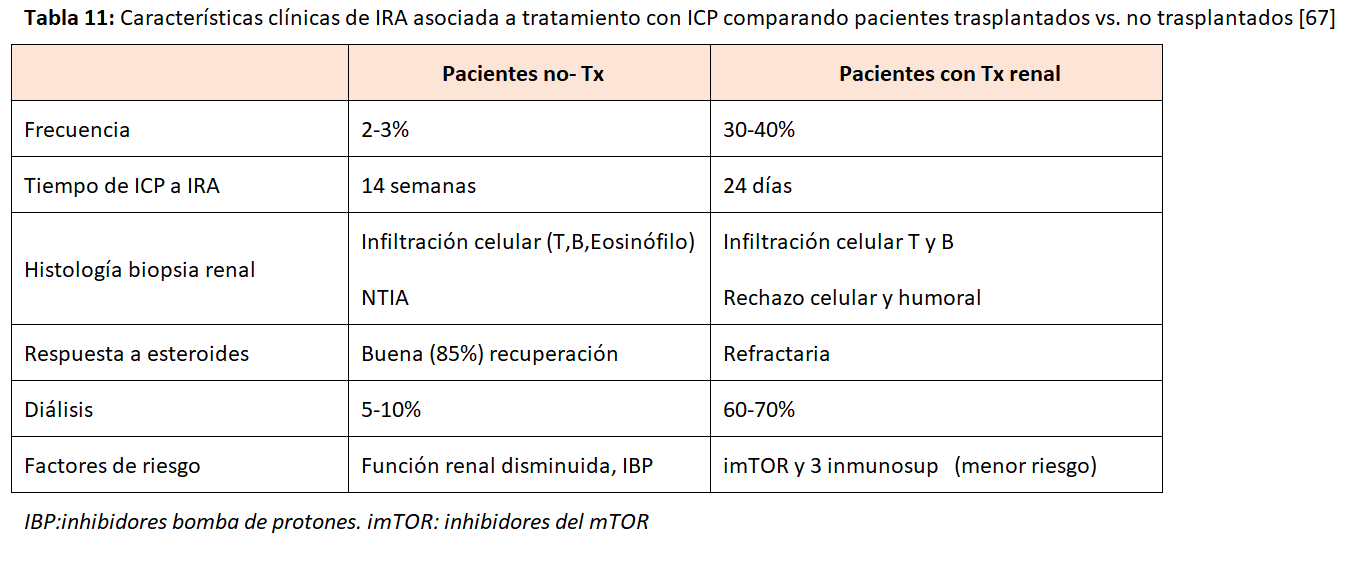
El estudio de Murakami es un estudio observacional multicéntrico reciente que examinó la seguridad y eficacia de los ICP en 69 pacientes con trasplantes de riñón de 23 instituciones [71]. El estudio mostró que el 42 % de los pacientes experimentaron un rechazo agudo del aloinjerto con una mediana de aparición de 24 días desde el inicio de la ICP hasta el rechazo. Una vez que se produjo el rechazo, el 65 % experimentaron fracaso del aloinjerto y requirieron diálisis. Los factores asociados con un menor riesgo de rechazo fueron el uso de inhibidores de mTOR y la inmunosupresión con tres fármacos. La proporción de respuesta objetiva fue del 36,4 % y del 40 % en los subgrupos de carcinoma de células escamosas y melanoma, respectivamente. En el subgrupo de carcinoma de células escamosas, la supervivencia general fue significativamente mayor en los pacientes tratados con ICP (mediana de supervivencia general de 19,8 meses frente a 10,6 meses), mientras que, en el subgrupo de melanoma, la supervivencia general no difirió entre los grupos.
En la (Tabla 11) podemos ver las características diferenciales del IRA entre los pacientes no trasplantados (NTIA generalmente) y los trasplantados (rechazo celular y humoral). En estos es mucho más frecuente, aparece más precozmente, es resistente a esteroides y con alto porcentaje de pérdida del injerto [71][72][73].
Mecanismo del rechazo del injerto asociado a tratamiento con ICP
El bloqueo de CTLA-4 y PD-1 aumenta la activación de las células T, no sólo contra las células malignas, sino también contra otras células que expresan antígenos extraños, como los antígenos de donantes de aloinjertos renales. PD-1 y PD-L1 se pueden encontrar en el aloinjerto y sus células T reactivas [69]. Esta activación de las células T podría conducir a un rechazo celular agudo y las células T CD4 activadas podrían conducir a la proliferación y activación de las células B a través de ligandos coestimuladores (p. ej., CD40L) y citocinas (p. ej., IL-4, IL-21 e interferón-γ) que conducen a rechazo mediado por anticuerpos, especialmente si se reduce la inmunosupresión [74]. Las células B también pueden activarse como un efecto directo sobre las células B de memoria que expresan PD1 si hubo una sensibilización previa del órgano trasplantado o una disminución de los medicamentos inmunosupresores [75].
Estrategias preventivas para control del rechazo en pacientes trasplantados con cáncer bajo tratamiento con ICP
Hasta el momento hay muy pocos casos publicados, pero parece que los inhibidores de PD-1 podrían ser más propensos que los antagonistas de CTLA-4 a causar rechazo en el riñón trasplantado. Esto es especialmente cierto cuando los pacientes reciben agentes anti-CTLA-4 antes del tratamiento con inhibidores de PD-1 [76].
Hay contradicción en el efecto que los corticoides pueden tener sobre la respuesta antitumoral de los ICP en estos casos En algunos ensayos, podría haber disminuido la respuesta antitumoral de los ICP [77] mientras que en otros la supervivencia general y el tiempo hasta el fracaso del tratamiento no se vieron afectados por el uso de glucocorticoides sistémicos [78].
Barnett y cols. [76] publicaron el caso de un paciente trasplantado de riñón con previa binefrectomía por cáncer renal y con diagnóstico de adenocarcinoma metastásico en tratamiento con nivolumab. Recibió prednisona y el tacrolimus fue sustituido por sirolimus con buena evolución del cáncer y función renal estable. El uso de inhibidores de mTOR (everolimus, temsirolimus y sirolimus) ha sido bien estudiado en muchos tipos de cáncer y en este paciente, sirolimus pudo haber jugado un papel antitumoral sinérgico además de ser un agente inmunosupresor. Jhaveri ha publicado una decena de pacientes con este enfoque terapéutico con buena evolución [73].
Sin embargo, los inhibidores de mTOR están asociados con un mayor riesgo de rechazo que los anticalcineurínicos. Dependiendo del riesgo inmunológico individual entre el órgano donante y el receptor, la decisión de reducir o interrumpir la inmunosupresión debe equilibrarse con el mayor riesgo de rechazo con ICP. Se necesitan más estudios para evaluar el efecto potencial de los mini pulsos de esteroides profilácticos con ciclos ICP y la conversión de inhibidores de la calcineurina a inhibidores de mTOR, tanto en la tasa de rechazo como en la respuesta del cáncer.
CONCLUSIONES
- Generales
1. Los EAri relacionados con ICP pueden deberse a la hiperactivación inmunitaria.
2. La incidencia de IRA con ICP es del 2,2% pero aumenta con la terapia dual hasta el 5%. Hay datos de incidencia superior no obstante.
3. El espectro de eventos adversos renales en la biopsia nativa incluye sobre todo NTIA (>80%), la NTA y la patología glomerular son menores al 10%.
4. El diagnóstico temprano, mediante biopsia renal y el tratamiento rápido con esteroides de ICP-AKI son de vital importancia. Suspender IBP, AINES y antibióticos inductores de NTIA.
5. En muchos casos, es factible repetir el tratamiento con ICP después del tratamiento de la IRA.
- Trasplante renal
6. Los pacientes trasplantados de riñón tienen mayor riesgo de desarrollar cáncer después del trasplante.
7. El tratamiento con ICP se asocia con un alto riesgo de rechazo celular agudo (42 %) con una alta tasa de pérdida del injerto (65 %).
8. La biopsia renal patología puede mostrar rechazo y también otras patologías, lo que puede orientar la terapia.
9. Un mayor número de fármacos inmunosupresores y el uso de anti mTOR se asociaron con un menor riesgo de rechazo.
10. Es necesario realizar tratamiento concomitante con esteroides no solo para preservar la función del injerto, sino incluso para evitar sangrado o ruptura del injerto renal que requerirán reiniciar diálisis
11. Los ICP pueden mejorar el resultado del cáncer en algunos tumores malignos (carcinoma cutáneo escamoso de células pequeñas metastásico no resecable) y siempre debe prevalecer la vida del paciente sobre la función del injerto renal .