Nefropatía por radiación
Definición y generalidades
La nefropatía por radiación (NR) es un término que hace referencia al daño renal causado o inducido por radiación ionizante. Las primeras descripciones de esta entidad datan de principios del siglo XX, fecha en la que se acuñó el término erróneo de “nefritis rádica”, dado que no es un proceso inflamatorio [1][2]. El descubrimiento de los rayos X fue en 1895 y en 1906 el reconocimiento inicial de sus potenciales efectos nocivos. Los primeros casos describieron el escenario típico del desarrollo de esta enfermedad tras la radiación externa en pacientes diagnosticados de tumores sólidos, especialmente seminomas, siendo en 1927 la primera descripción publicada de un caso [3]. Pese a que habitualmente en el tratamiento radioterápico se realizaba una exclusión de ambos riñones, la localización central y bilateral de los mismos dificultaba su completo aislamiento en tumores abdominales y retroperitoneales.
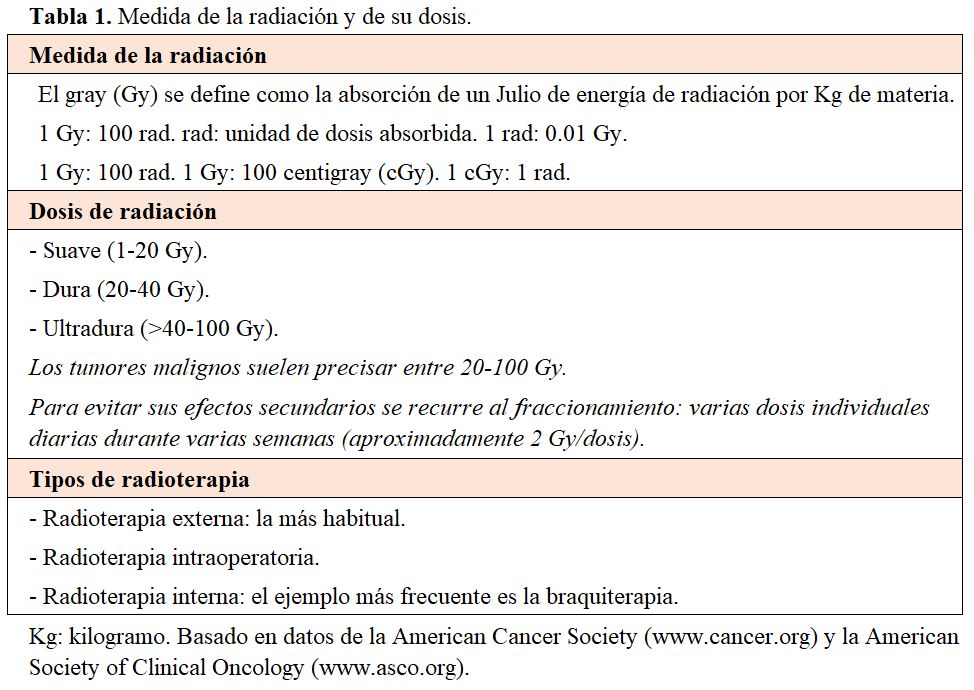
La radiación se mide en grays (Gy) y centigrays (cGy), que indican cuanta energía es absorbida por el tejido irradiado. El Gy se define como la absorción de un julio de energía de radiación por kilogramo (Kg) de materia (Julio/Kg). La dosis de radiación se divide en suave (1-20 Gy), dura (20-40 Gy) y ultradura (>40 Gy-100 Gy) y se clasifica en externa, intraoperatoria e interna (Tabla 1).
La radiación ionizante origina una pérdida progresiva de función renal cuando ambos riñones reciben una dosis suficiente como para ocasionar daño irreparable del ácido desoxirribonucleico (ADN). Una radiación ionizante de suficiente energía conlleva una alteración en la circulación habitual de los electrones fuera del átomo con la consiguiente generación de radicales de oxígeno que causan el mencionado daño sobre el ADN. La irradiación terapéutica causa la muerte de las células tumorales, pero también el daño de tejidos sanos circundantes, como es el caso de los riñones, especialmente en tumores gastrointestinales, ginecológicos, linfomas, sarcomas…
En 1961 Luxton describió la “dosis umbral” para poder desarrollar NR, estableciéndose en 23 Gy. Además de la dosis total, también incluyó otros parámetros en la evaluación como la superficie irradiada. Así, si ésta era inferior al 30%, las posibilidades de desarrollar enfermedad renal crónica (ERC) eran muy escasas, pero sí podrían inducir el desarrollo de hipertensión arterial (HTA). En el desarrollo de dicha nefropatía también se incluyó otra clave fundamental como es el “tiempo de exposición” a raíz de las observaciones tras las bombas atómicas de Hiroshima-Nagasaki, en las que se demostró el desarrollo de ERC varias décadas después de una exposición crónica de baja intensidad (inferior a 200 cGy) [4]. Tras el accidente en la central nuclear de Fukushima, en el pueblo de Kawauchi (a 20 kilometros de la central nuclear), se objetivó un incremento en la prevalencia de ERC del 16,1% en los años previos a la exposición hasta el 26,7% en los dos años posteriores a la presumible radiación, sin modificaciones en la incidencia y prevalencia de HTA [5].
Un concepto fundamental y estrechamente vinculado con el desarrollo de NR es el de la radiosensibilidad. La NR es un fenómeno tardío que puede aparecer meses o años después de la exposición a la radiación. Esta latencia está estrechamente relacionada con una lenta tasa de renovación celular (“cell turnover rate”) en las células del tejido renal en comparación con otros tejidos con respuesta temprana y rápidamente proliferativa como el epitelio gastrointestinal o la médula ósea (ley de Bergonié y Tribondeau o ley de la sensibilidad diferencial) (Tabla 2). El tejido renal tiene un bajo índice mitótico lo que explica el retardo en el desarrollo de daño renal tras exponerse a radiación ionizante. En líneas generales menos del 50% de los pacientes expuestos a la dosis límite o incluso superiores desarrollarán la nefropatía, añadiéndose otro elemento adicional como la susceptibilidad individual.
Modelos experimentales y patogénesis
Desde un modelo muy reduccionista se puede afirmar que la radiación libera energía que modifica la estructura celular. La célula pierde su capacidad de división y se detiene el crecimiento tumoral. En función de la dosis de radiación la célula tumoral muere con la consiguiente reducción del tejido tumoral.
Krochak y Baker describieron en 1986 que el mecanismo inicial es un incremento en la permeabilidad endotelial por daño glomerular temprano. Esta lesión incrementa el ultrafiltrado a través de los capilares fenestrados previamente dañados lo que originaría la pérdida de proteínas y otros componentes sanguíneos de alto peso molecular. Esta lesión transitoria sería la responsable de los cambios de permeabilidad y por ende de los cambios tempranos evidenciados pero también de las lesiones más tardías [6].
El tratamiento radioterápico va a estar limitado no solo por la radiosensibilidad de las células tumorales sino también por la respuesta del tejido sano circundante. En modelos porcinos se ha demostrado que el daño sobre el endotelio glomerular es el mecanismo de lesión más temprano aunque también va a existir daño mesangial prácticamente sincrónico. Se generan fibrina y otros mediadores que van a ser responsables de la esclerosis glomerular. Estos mismos mecanismos son los inductores tardíos de daño tubular que se traduce en la lesión y posterior muerte del epitelio tubular, lo que contribuye finalmente a la fibrosis túbulo-intersticial.
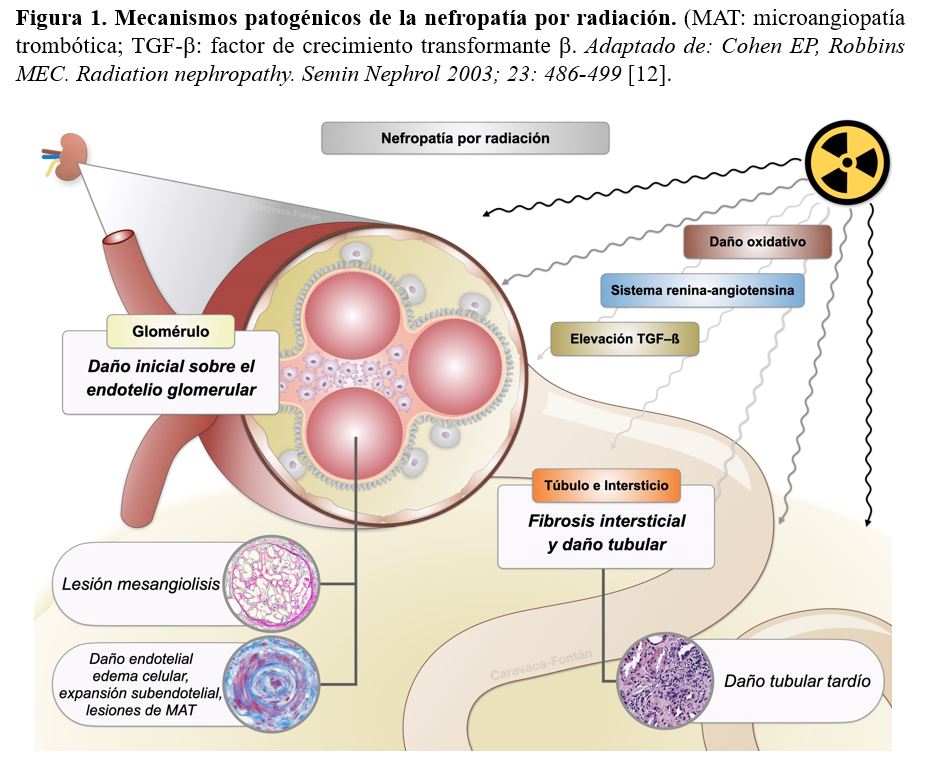
Se han postulado dos hipótesis: a) el daño vascular es el evento central y b) la radiación produce daño en las células parenquimatosas, especialmente en el epitelio tubular. La depleción de células tubulares explica, al menos parcialmente, la latencia en el desarrollo de las lesiones en la NR. Probablemente, en el momento actual se acepta un mecanismo mixto en la explicación fisiopatológica de la NR (Figura 1).
Desde un punto de vista celular, una radiación de al menos 20 Gy (dosis umbral más aceptada) produciría daño directo sobre la célula endotelial que incrementaría la secreción de factor de Von-Willebrand que se traduce en un aumento de la agregación plaquetaria con la formación de trombos vasculares y glomerulares. Las células mesangiales también participan en este proceso originando las típicas lesiones de mesangiolisis. Por lo tanto, se puede afirmar que en la NR existe daño glomerular, mesangial y tubular [7].
En modelos murinos con alta similitud con el humano, la supresión del sistema renina-angiotensina-aldosterona (SRAA) puede ser beneficiosa en la prevención del daño por radiación mientras que la infusión de angiotensina II (AII) exacerba el daño. Estos datos experimentales abren una ventana terapéutica al empleo de bloqueo del SRAA para prevenir dichas lesiones [8]. La AII puede jugar un papel primordial en el desarrollo de NR. Su incremento estimula la síntesis no dosis-dependiente del factor de crecimiento transformante β (TGF-β) aproximadamente a las 24-48 horas de la radiación. Estudios posteriores han demostrado un incremento concomitante en la expresión génica de componentes de la matriz extracelular como la fibronectina. A su vez, también en modelos murinos, se ha objetivado un incremento en la síntesis de TGF-β por las células mesangiales junto con un aumento dosis y tiempo dependiente de fibronectina y del inhibidor-1 del activador del plasminógeno (PAI-1). Este mismo escenario que se puede apreciar en los túbulos renales sugiere que el daño sobre la célula tubular puede tener más importancia que el daño glomerular. Estudios más detallados, desde un punto de vista mecanicista, hacen pensar que la radiación provoca cambios en el fenotipo de las células renales por un incremento del estrés oxidativo. Existe una evidencia creciente del papel etiológico de este estrés oxidativo en la fibrogénesis de la NR. La activación de fibroblastos en miofibroblastos, fibroblastos contráctiles que expresan actina del músculo liso, es la principal fuente de depósito de matriz extracelular a expensas de colágeno [9]. Asimismo, la radiación se ha relacionado con la senescencia celular, específicamente sobre las células endoteliales glomerulares aunque también puede inducir dicho efecto sobre los podocitos [10].
Presentación clínica
La dosis de radiación recibida va a condicionar la clínica que los pacientes van a desarrollar. La clínica puede ser aguda y generalmente irreversible o sutil con una gradual y progresiva pérdida de función durante años. En líneas generales suele haber un amplio período de latencia durante el cual la clínica es “silente”. Luxton analizó 137 hombres afectos de seminoma que tras recibir una dosis acumulada de 2.250-3.250 GY durante 5 semanas un 20% desarrollaron NR [11]. El uso concomitante de quimioterapia puede incrementar las manifestaciones clínicas. Las formas de presentación clínica son diversas, destacando:
a) NR aguda: acontece a los 6-12 meses tras la exposición y se manifiesta con: astenia, edemas, disnea, cefalea, insuficiencia renal, HTA maligna (HTAM) y anemia. En los casos de nefropatía asociada al trasplante de médula ósea (TMO) se pueden desarrollar casos de síndrome hemolítico urémico atípico (SHUa). La aparición de proteinuria es frecuente aunque no suele ser superior a 1,5 g/día [4] [12]. Puede haber anemia desproporcionada al grado de insuficiencia renal por mecanismos de hemólisis sobreañadidos al déficit habitual de eritropoyetina.
b) NR crónica: se desarrolla en general a partir de los 18 meses tras la radiación. Se suele clasificar en primaria cuando aparece a los 24 meses de la irradiación y en secundaria cuando es consecuencia evolutiva de una NR aguda [4][13].
c) HTAM: suele aparecer a partir de los 12-18 meses después de la radiación. Es una complicación relativamente frecuente y típica de la NR y puede tener un sustrato fisiopatológico en el daño vascular inducido por la radiación. Pese a que puede acontecer en ausencia de insuficiencia renal es habitual que se vincule a su desarrollo [14]. La activación del SRAA y la reducción de la síntesis de óxido nítrico, como consecuencia de la reducción del flujo renal, son los principales protagonistas del desarrollo de HTA; y en concreto, de HTAM.
d) HTA “benigna”: se puede relacionar o no con el desarrollo de insuficiencia renal y suele tener un período de latencia superior a 18 meses.
e) HTA tras irradiación renal bilateral: remeda a lo que sucede en el riñón de Page. En ocasiones se desarrolla estenosis de la arteria renal del lado irradiado [15].
Hallazgos histológicos
Los cambios histológicos no son patognomónicos de esta entidad pero puede haber datos histológicos de sospecha entre los que destacan:
a) Lesiones precoces: aparecen lesiones endoteliales de la microvasculatura con edema celular, expansión subendotelial y oclusión de las luces capilares. Es frecuente la presencia de lesiones de mesangiolisis (rarefacción del mesangio) y de daño tubular variable. En el estudio ultraestructural se suele apreciar material amorfo en el espacio subendotelial (“flutty stuff”).
b) Lesiones tardías: predominan las lesiones esclerosas (“scarring lesions”) con afectación de la vasculatura interlobular y de los vasos arcuatos. Se suele evidenciar un incremento de matriz mesangial, glomérulos esclerosados, atrofia tubular y finalmente lesiones de fibrosis extensa con reducción de la masa renal funcionante [16]. Es frecuente la esclerosis de la unión glomérulo-tubular, esclerosis que puede condicionar la rápida pérdida de filtrado glomerular.
Tratamiento
Debido al incremento de las medidas de protección la NR se ha convertido en una entidad clínica infrecuente de ahí la ausencia de ensayos controlados. El mejor tratamiento es sin duda la prevención de las lesiones de NR. Es importante destacar que la tolerancia se incrementa con el fraccionamiento debido a la reparación del daño producido por la radiación subtotal en el período comprendido entre la administración de las dosis fraccionadas. Por otro lado, la administración concomitante de quimioterapia incrementa el riesgo de desarrollar una NR. Un modelo de uso concomitante de quimioterapia y radioterapia es el TMO donde se pueden desarrollar insuficiencia renal aguda y ERC (10-30%) constituyéndose incluso como una entidad específica denominada nefropatía del TMO. La dosis total de irradiación administrada en el período de condicionamiento previo al TMO sigue un esquema habitual de 9 fracciones durante 3 días, esquema que podría no permitir un tiempo suficiente de recuperación renal. A esto hay que sumarle el uso de quimioterapia para el acondicionamiento que potencia los efectos deletéreos de la radiación ionizante [17]. Dentro de esta entidad se ha objetivado un incremento relativo de pacientes con SHUa.
No existe un tratamiento específico de la NR. Sí se recomienda el empleo de bloqueantes del SRAA, sobre todo en presencia de HTA y más aún si se manifiesta con HATM. Se han ensayado tratamientos con varios fármacos nefroprotectores con características antioxidantes, p. ej. WR2721, pero ninguno ha demostrado una clara eficacia. Los estudios para evaluar un potencial beneficio de bloqueantes del SRAA como captopril tampoco han tenido resultados sólidos y consistentes [18]. Sin embargo, el potencial efecto del bloqueo del SRAA sobre la modulación del PAI-1 podría ser una indicación de dichos fármacos como antifibróticos [19].