Efectos renales adversos del tratamiento del cáncer
Manucrito original NefroPlus 2019
Resumen
El aumento de los pacientes afectos de cáncer con enfermedad renal se relaciona en parte con las altas tasas de incidencia de muchos tumores malignos, así como con la reducción general de las tasas de mortalidad por cáncer debido a agentes quimioterapéuticos más efectivos que incluyen quimioterapia, terapias dirigidas e inmunoterapia. Estas terapias han conllevado un aumento en el número de pacientes con cáncer que presentan complicaciones renales.
Los fármacos utilizados para tratamiento del cáncer han ido cambiando con el tiempo y desde la quimioterapia clásica basada en cisplatino, aún muy presente, han aparecido tratamientos antiangiogénicos dirigidos a moléculas concretas como el epidermal growth factor (EGF) o el vascular endothelial growth facotr (VEGF) así como inmunoterapia (inhibidores del check-point) o transferencia celular adoptiva (Car-T cell). Todos estos tratamientos pueden asociarse en mayor o menor medida a lesiones renales glomerulares, insuficiencia renal aguda, nefropatías tubulointersticiales o trastornos hidroelectrolíticos.
Basados en las diferentes patologías renales revisamos la nefrotoxicidad evidenciada con la medicación oncológica actualmente utilizada.
Introducción
La incidencia de cáncer aumenta con la edad, así como la reducción en la tasa de filtración glomerular (FG). La edad media de los pacientes en el momento del diagnóstico de cáncer es de 65 años. Del 47% de los sobrevivientes de cáncer, casi la mitad tienen 70 años o más [1]. En el estudio EPIRCE [2] realizado por la Sociedad Española de Nefrología observamos que el 23% de los pacientes mayores de 65 años tenían enfermedad renal crónica (ERC) grados 3-5 (FG <60 ml/ min/1.73m2). En el estudio belga BIRMA [3] un 18% de los pacientes con cáncer estudiados tenían ERC 3-5. Los datos de otros países muestran un 22% en EE. UU. [4], un 25% en Japón [5] y un 15,5% en Austria [6]. En España, en pacientes hospitalizados en la sala de Oncología encontramos un 18,2% con MDRD <60 ml/min/1.73m2 [7]. Una población que envejece aumentará el número de pacientes cuyo cáncer se complicará por otras enfermedades renales agudas (IRA) o crónicas (ERC) y se espera que la asociación de casos de cáncer y de ERC se observe con mayor frecuencia en todo el mundo.
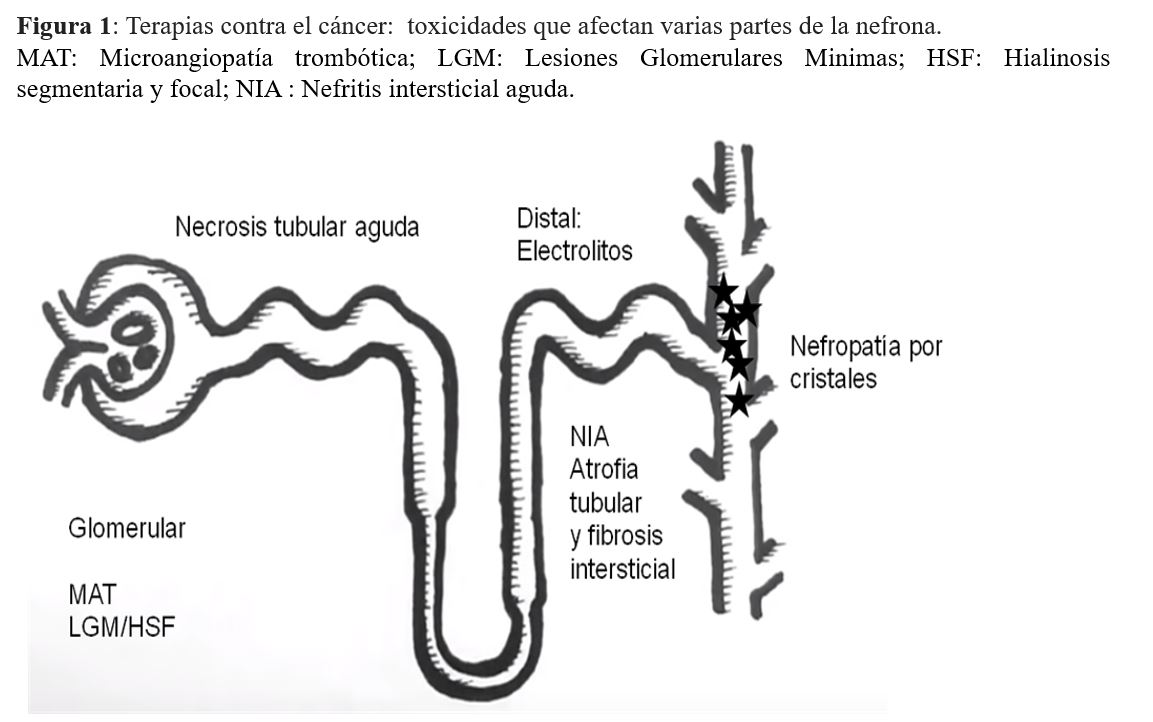
El potencial nefrotóxico de la mayoría de los agentes anticancerígenos aumenta dramáticamente en presencia de una ERC preexistente. En consecuencia, las áreas importantes de mejora en la atención de los pacientes con cáncer son, primero, una determinación correcta del filtrado glomerular y, en segundo lugar, una prevención de los efectos nefrotóxicos de los medicamentos anticancerosos. La evaluación del FG se utiliza para guiar las prescripciones, el ajuste de los agentes de quimioterapia y las decisiones quirúrgicas en pacientes con cáncer. Sabemos que el 50% de los medicamentos contra el cáncer se excretan predominantemente en la orina y que el 80% de los pacientes reciben medicamentos potencialmente nefrotóxicos para los cuales se debe ajustar la dosis [8]. Numerosos agentes quimioterapéuticos se han asociado con diversas toxicidades renales, y aquí discutimos las diversas toxicidades que afectan varias partes de la nefrona (Figura 1).
1.- Enfermedad glomerular asociada al tratamiento del cáncer
Las enfermedades glomerulares se asocian con muchas neoplasias malignas sólidas y hematológicas. La Nefropatía Membranosa se ha asociado clásicamente con tumores malignos sólidos; la nefropatía por Lesiones Glomerulares Mínimas se ha descrito comúnmente con neoplasias hematológicas, especialmente con linfoma no Hodgkin; y se reconoce cada vez más que la glomerulonefritis membranoproliferativa está asociada con neoplasias hematológicas crónicas como la Leucemia Linfocítica Crónica [9].
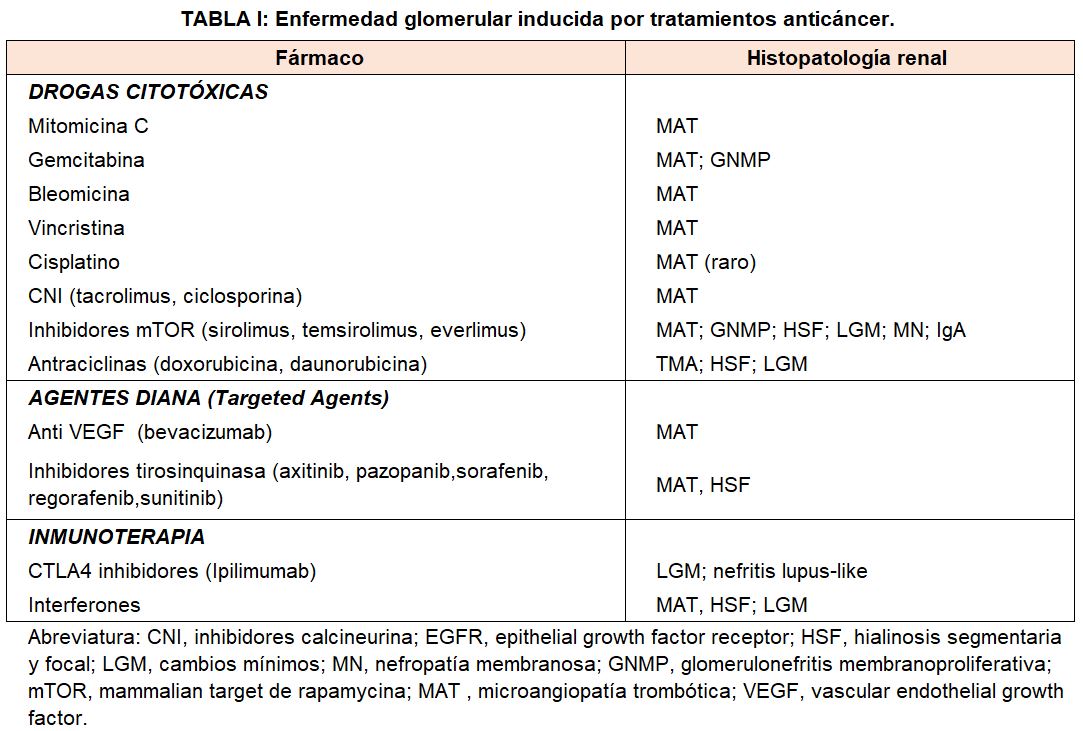
Además, varios fármacos quimioterápicos y nuevos agentes dirigidos a genes/proteínas específicos (“target therapies”) que son tratamientos eficaces contra el cáncer, pueden inducir una serie de efectos glomerulares renales adversos (Tabla 1).
1.a Microangiopatía trombótica (MAT) inducida por quimioterapia
La MAT representa la forma más grave de lesión de células endoteliales vasculares que ocurre sistémicamente y dentro del parénquima renal [10]. Es un síndrome caracterizado por anemia hemolítica microangiopática (esquistocitos, prueba de Coombs negativa, haptoglobina baja y aumento de la lactato deshidrogenasa (LDH)), trombocitopenia y grados variables de lesión del órgano terminal, incluida la lesión renal aguda.
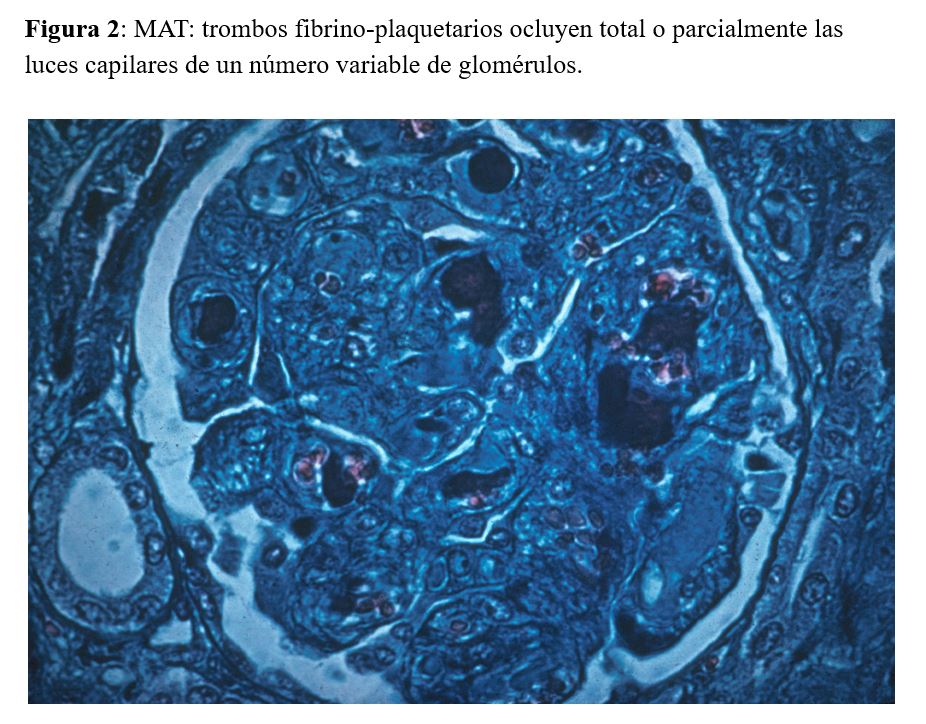
La MAT se define patológicamente por trombos vasculares localizados en las arteriolas preglomerulares o lesiones glomerulares como los trombos de fibrina en los capilares (Figura 2).
Aunque hay otras causas de MAT no relacionada con drogas, y que no contemplaremos aquí (deficiencia o mutaciones de ADAMTS-13, mutaciones del complemento, déficit de Factor H…etc), se han sospechado muchos medicamentos diferentes como causa de MAT:
• MAT inducida por fármacos (DITMA) (reacción inmune) que puede ocurrir después de la exposición a cualquier cantidad del fármaco y se debe a un mecanismo idiosincrásico, dependiente de anticuerpos, quinina y otros, con múltiples células afectadas por anticuerpos dependientes de fármacos.
• MAT mediada por fármacos (DITMA) (reacción relacionada con la dosis tóxica) que no involucra anticuerpos dependientes de fármacos. Los síndromes mediados por toxicidad generalmente están relacionados con la dosis. Existen medicamentos contra el cáncer que pueden causar MAT mediada por toxicidad [11] (Tabla 2).
La inhibición de la función VEGF en las células endoteliales renales y los podocitos causan el desarrollo gradual de la MAT glomerular [12]. Los inhibidores de la calcineurina (ciclosporina y tacrolimus) causan disfunción endotelial y agregación plaquetaria posiblemente a través de la inhibición de la prostaciclina. El cese del agente responsable era, hasta el momento, la única forma de aliviar la MAT pues los corticosteroides en dosis altas, la plasmaféresis y los agentes antiplaquetarios no habían demostrado efectividad [13].
El Eculizumab es un anticuerpo monoclonal inhibidor de C5 usado para el Síndrome Hemolítico Urémico atípico (SHUa) debido a anomalías del factor del complemento (es el único agente aprobado para el tratamiento del SHUa primario). Previene la formación de C5a y por ende el complejo de ataque a la membrana (C5b9) en la vía alternativa del sistema del complemento, lo que inhibe la coagulación sistémica inapropiada [14]. Dadas las similitudes de DITMA y SHUa, la idea de utilizar la inhibición del complemento como tratamiento en este trastorno parecía razonable. Weitz et al. reportaron una serie de casos de 7 pacientes con SHUa secundario a fármacos quimioterápicos (4 gemcitabina, 1 Bevacizumab, 1 Bleomicina y 1 Dasatinib) cuyo curso clínico y estudios de laboratorio fueron consistentes con dicho diagnóstico y que se trataron con éxito con eculizumab [15]. La respuesta de eculizumab también ha sido también positiva en la MAT inducida por gemcitabina y carfilzomib aunque no en todos los casos siendo muy dependiente de la rapidez en la instauración del mismo (16,17). En la reciente publicación de la serie francesa de MAT secundarias, se recogen 564 pacientes de los que el 27% (144 pacientes) desarrollaron la microangiopatía por fármacos. Dentro de éstos, destacaban 11 casos asociados a gemcitabina (8%) y 4 relacionados con inhibidores del VEGF (3%) [18].
1.b Enfermedad por cambios mínimos (LGM) y glomeruloesclerosis focal y segmentaria (HSF).
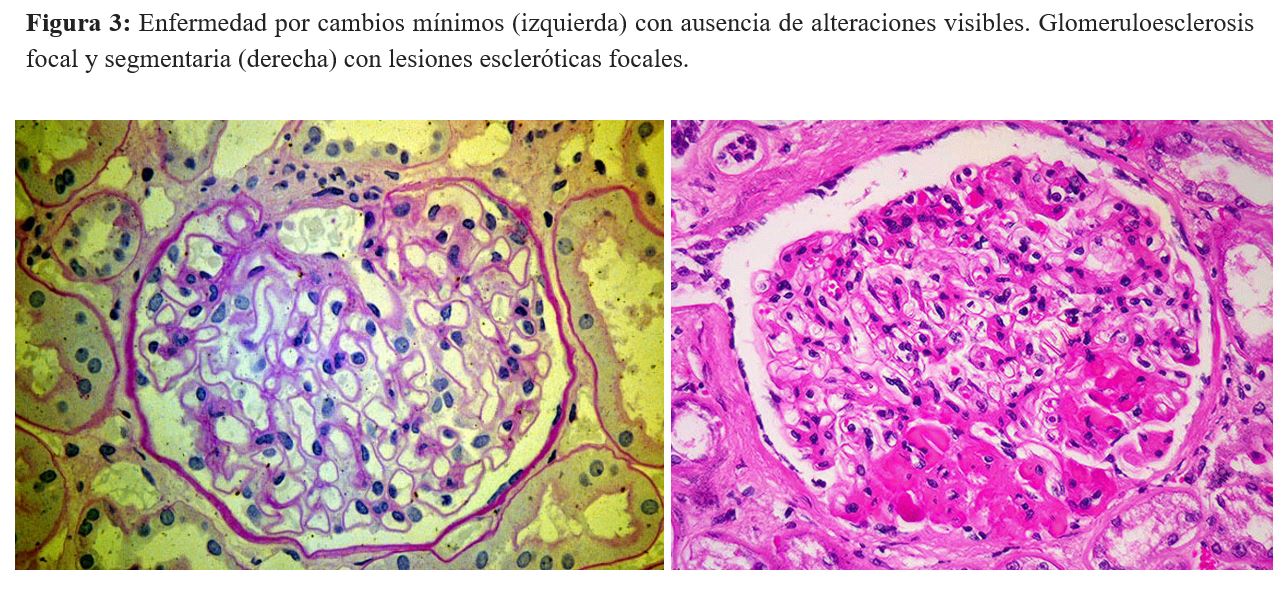
La enfermedad por lesiones glomerulares mínimas (LGM ) es una causa importante de síndrome nefrótico idiopático, que se caracteriza por una proteinuria elevada con síndrome nefrótico completo que conduce a edema. El rasgo patológico de la enfermedad es la ausencia de alteraciones visibles mediante microscopía óptica y fusión podocitaria difusa mediante microscopía electrónica [19]. En general, existe una buena respuesta a los esteroides, pero la recurrencia frecuente de la enfermedad requiere terapias adicionales asociadas con los esteroides.
La dependencia de fármacos y las recaídas frecuentes pueden causar la evolución de la enfermedad a glomeruloesclerosis focal y segmentaria (HSF) a lo largo del tiempo con la presencia de lesiones escleróticas que involucran segmentos focales de glomérulos (Figura 2). Las diferencias entre las dos condiciones no están bien definidas, ya que los mecanismos moleculares pueden ser compartidos por las dos enfermedades. La HSF y la enfermedad por cambios mínimos, se denominan "podocitopatías" [20].
Las LGM se han asociado comúnmente con neoplasias malignas hematológicas como: linfoma de Hodgkin, linfoma no Hodgkin y leucemias, mieloma múltiple, timoma, cáncer broncogénico, cáncer de colon y granuloma linfoide eosinófilo (enfermedad de Kimura).
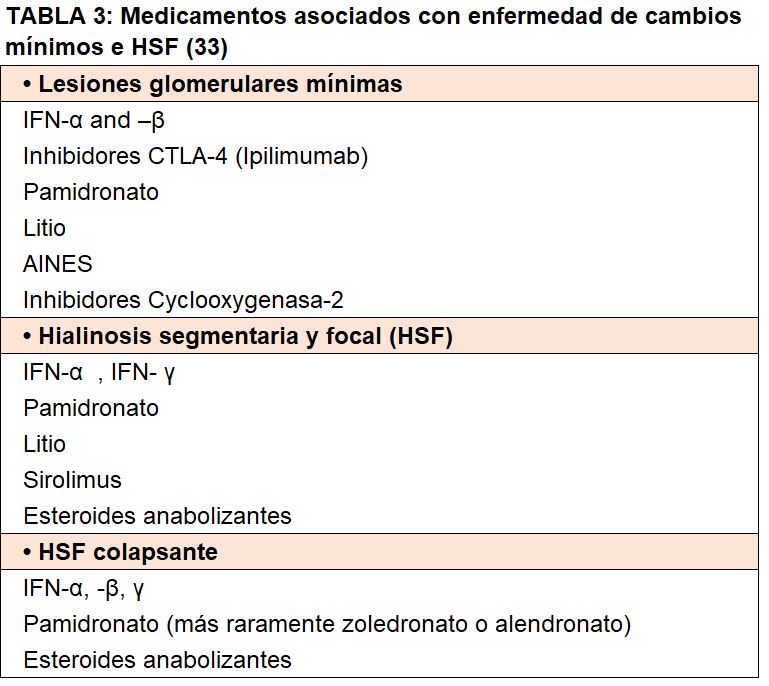
Hay casos de LGM secundarias para los cuales se ha planteado la hipótesis de una causa directa. Se han reportado asociaciones de fármacos como la D-penicilinamina, la salazopirina, el mercurio y el oro; en los que la proteinuria remite después de su retiro. La quimioterapia y los fármacos relacionados que se han asociado con las LGM son interferones, lenalidomida, pamidronato, antraciclinas e inhibidores de mTOR (Tabla 3). En este caso, la conclusión es que las moléculas pueden modificar la estructura de los podocitos, lo que induce un defecto reversible que subyace a la naturaleza transitoria del proceso del podocito. Las dosis altas de pamidronato se han descrito como el agente etiológico en la HSF colapsante, una variante morfológica distinta y más grave caracterizada por plegamientos y "colapso" del basamento glomerular [21].
La interrupción del fármaco (con o sin terapia con glucocorticoides) es eficaz para revertir la proteinuria en pacientes con enfermedad por cambios mínimos, pero menos efectiva en pacientes con HSF, especialmente en la variedad colapsante [22].
2.- Lesión (necrosis) tubular aguda inducida por quimioterapia.
La lesión renal aguda (LRA ó AKI: acute kidney injury; versión anglosajona), anteriormente llamada IRA, se define comúnmente como una disminución brusca o rápida de la función renal, que abarca tanto la lesión (daño estructural) como el deterioro (pérdida de la función). En los pacientes con cáncer, la LRAg tiene una etiología mixta donde la presencia de sepsis, isquemia y nefrotoxicidad a menudo coexisten y complican el reconocimiento y el tratamiento.
La clasificación de la LRAg incluye pre-renal, nefropatía obstructiva post-renal aguda y enfermedades renales agudas intrínsecas. De estos, solo la LRAg "intrínseca" representa una verdadera enfermedad renal, mientras que la LRAg pre-renal y post-renal son la consecuencia de enfermedades extra-renales que conducen a la disminución de la tasa de FG.
En la LRAg intrínseca, están involucradas cuatro estructuras del riñón, que incluyen túbulos, glomérulos, intersticio y vasos sanguíneos intra-renales. Las causas generales no particularmente específicas para pacientes con cáncer se muestran en la (Tabla 4) [23].
Los fármacos quimioterápicos convencionales y los fármacos dirigidos a genes o proteínas específicos del cáncer, aunque efectivos, desafortunadamente se asocian a toxicidad. El riñón es un objetivo particularmente vulnerable para las toxinas, debido a un rico suministro de sangre (recibe el 25% del gasto cardíaco) y por la excreción de estas toxinas por filtración glomerular y secreción tubular. La necrosis tubular aguda (NTAg) es la causa más común de lesión renal aguda.
Los mecanismos nefrotóxicos de la NTAg incluyen toxicidad directa por fármacos, vasoconstricción intrarrenal y obstrucción intratubular. El daño de las células tubulares y la muerte celular que caracterizan a la NTAg generalmente se deben a un evento isquémico o tóxico agudo.
Los fármacos utilizados en el tratamiento del cáncer que inducen NTAg se muestran en la (Tabla 5) [24].
La discontinuación de medicamentos y las medidas de apoyo son las únicas terapias bien establecidas para tratar estas formas de lesión renal aguda.
Medio de contraste radiográfico
Los medios de contraste radiográficos pueden causar nefropatía inducida por contraste (CIN) (nueva nominación de ESUR Lesión Renal Aguda Postcontraste PC-AKI ) [25]. Los pacientes con cáncer presentan con mayor frecuencia LRAg de cualquier etiología, tienen más enfermedad renal crónica que es un factor de riesgo para la LRAg, frecuentemente son sometidos a exámenes que requieren el uso de agentes de contraste yodados para controlar la progresión de su enfermedad y viven en un ambiente nefrotóxico inducido por medicaciones que en su gran mayoría se eliminan por vía renal [26]. La dosis acumulada de contraste yodado con procedimientos repetidos aumenta el riesgo de lesión renal y reduce la supervivencia [27]. De hecho, en las pautas de KDIGO (Kidney Disease: Improving Global Outcomes), se recomienda retrasar la exposición repetida durante 48 horas en pacientes sin factores de riesgo de lesión renal aguda inducida por contraste y durante 72 horas en pacientes con diabetes mellitus o ERC preexistente. Si se desarrolla una disfunción renal aguda después de la administración de contraste, la exposición repetida debe retrasarse preferiblemente hasta que el nivel de creatinina sérica haya regresado a la línea de base.
Se aconseja como medida preventiva una correcta hidratación intravenosa (sin diferencias entre suero salino y bicarbonato) y utilización de contraste isosmolar en los pacientes de riesgo (FG < 45 ml/min, especialmente en pacientes con cáncer y diabéticos).
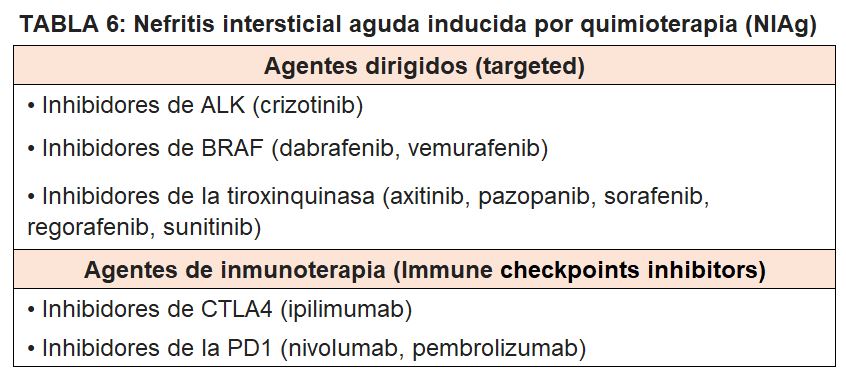
3.- Nefritis intersticial aguda (NIAg) asociada a la quimioterapia.
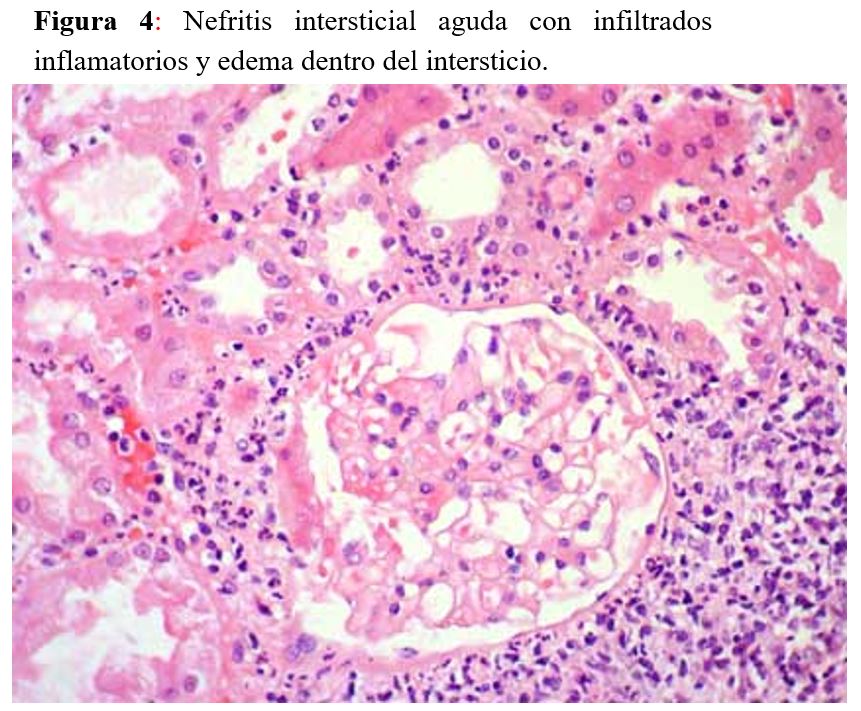
La nefritis intersticial aguda es una variedad de lesión renal aguda con hallazgos histológicos de inflamación intersticial, edema y tubulitis (Figura 3). Existen formas de enfermedad alérgicas/inducidas por fármacos, infecciosas, autoinmunes, sistémicas e idiopáticas. Los antibióticos, los inhibidores de la bomba de protones (IBP) y los antiinflamatorios no esteroideos (AINEs) son prescripciones frecuentes para los pacientes con cáncer y parecen ser los culpables más comunes en la nefritis intersticial aguda inducida por fármacos [28].
La presentación clínica de NIAg es altamente variable. En ausencia de reacciones de hipersensibilidad con hallazgos "clásicos" de NIAg (fiebre, erupción cutánea y eosinofilia), la manifestación clínica constante es una lesión renal aguda o subaguda, junto con posibles hallazgos urinarios de piuria, hematuria y cilindros leucocitarios; especialmente en un paciente hospitalizado expuesto a múltiples medicamentos que puede desarrollar un aumento progresivo e inexplicable de la creatinina sérica.
La nefritis intersticial aguda es la lesión renal principal inducida por los inhibidores de la coestimulación inmune (Immune checkpoints inhibitors): Ipilimumab y Tremelimumab (antígeno CT-4 anti-citotóxico de los linfocitos T CTLA-4) y Pembrolizumab y Nivolumab (anticuerpos dirigidos contra receptores PD-1 de muerte celular programada). El mecanismo de la lesión es presumiblemente el resultado de un aumento de la inmunidad mediada por células [29].
Para los antagonistas de CTLA-4 (Ipilimumab), la NIAg aparece de 6 a 12 semanas después del inicio del tratamiento, con una distancia de hasta 26 semanas. Cuanto más tardío el inicio, mayor es la gravedad de la NIAg precisando en muchas ocasiones diálisis. Para los inhibidores de PD-1 (Nivolumab y Pembrolizumab), aparece NIAg a los 3-12 meses después del inicio del tratamiento [30]. La mayoría de los pacientes recuperan la función renal total o parcial si la NIAg se reconoce temprano (lo ideal es que este período sea < 2 semanas) y el medicamento se retire de inmediato. Los esteroides son generalmente beneficiosos a menos que haya insuficiencia renal avanzada o exista una contraindicación [31].
Se debe considerar la exclusión de otros agentes potencialmente ofensivos (AINEs, IBP) ya que en muchos casos la NIAg se resolvió después de retirarse.
Otros fármacos contra el cáncer que inducen NIag son los inhibidores del gen que elabora una proteína que se llama cinasa del linfoma anaplásico (ALK) (Crizotinib), inhibidores del gen BRAF (Dabrafenib, Vemurafenib) e inhibidores de Tirosin Kinasa (Axitinib, Pazopanib, Sorafenib, Regorafenib, Sunitinib) (Tabla 6).
4.- Disfunción tubular asociada a quimioterapia y trastornos electrolíticos.
4.a: Síndrome de Fanconi (SF) (Platinos y Agentes alquilantes)
El túbulo proximal (TP) es el sitio más común de toxicidad en el riñón, ya que muchos medicamentos se excretan a través de él. El deterioro de la función normal del TP provoca la perdida urinaria de sustancias que se reabsorben de manera predominante o exclusiva en este sitio, con las características clínicas del SF renal que se muestran en la (Tabla 7). El TP también reabsorbe cantidades significativas de sodio, potasio, cloruro, magnesio y calcio, pero las vías alternativas de captación en el túbulo distal pueden compensar estas pérdidas [32].
Los compuestos que contienen Platino (cisplatino y carboplatino) y los Agentes alquilantes como la ifosfamida y la mercaptopurina-6 causan toxicidad aguda en el túbulo proximal, que a menudo es reversible. Sin embargo, algunas personas pueden desarrollar una tubulopatía crónica, que persiste durante muchos años y puede ser progresiva. La mayoría de la evidencia disponible sugiere que un defecto subyacente en el metabolismo de las células del TP es el mecanismo principal a través del cual la mayoría de los medicamentos causan SF [33].
En pacientes con SF establecido, el objetivo principal del tratamiento es prevenir las complicaciones derivadas de la pérdida urinaria de solutos. Para la hipofosforemia se pueden emplear los suplementos orales de fosfato y una dieta rica en fosfato. Por otro lado, dado que la 1-alfa-hidroxilasa se encuentra en el TP, los pacientes con SF también pueden requerir tratamiento con alfacalcidol o calcitriol para prevenir la desmineralización ósea. La acidosis metabólica crónica puede ser frecuente y se corrige con bicarbonato sódico oral. Sin embargo, el aumento de la pérdida renal de aminoácidos y glucosa no produce efectos desfavorables.
4.b: Agentes anticáncer que producen hiponatremia
La hiponatremia en pacientes con cáncer induce una complicación neurológica grave y reduce la supervivencia. La hiponatremia a menudo es causada por la secreción inadecuada de ADH o vasopresina (SIADH) en pacientes con cáncer de pulmón de células pequeñas o de cabeza y cuello. También en otros tumores sólidos y neoplasias malignas hematológicas, pero en tasas más bajas.
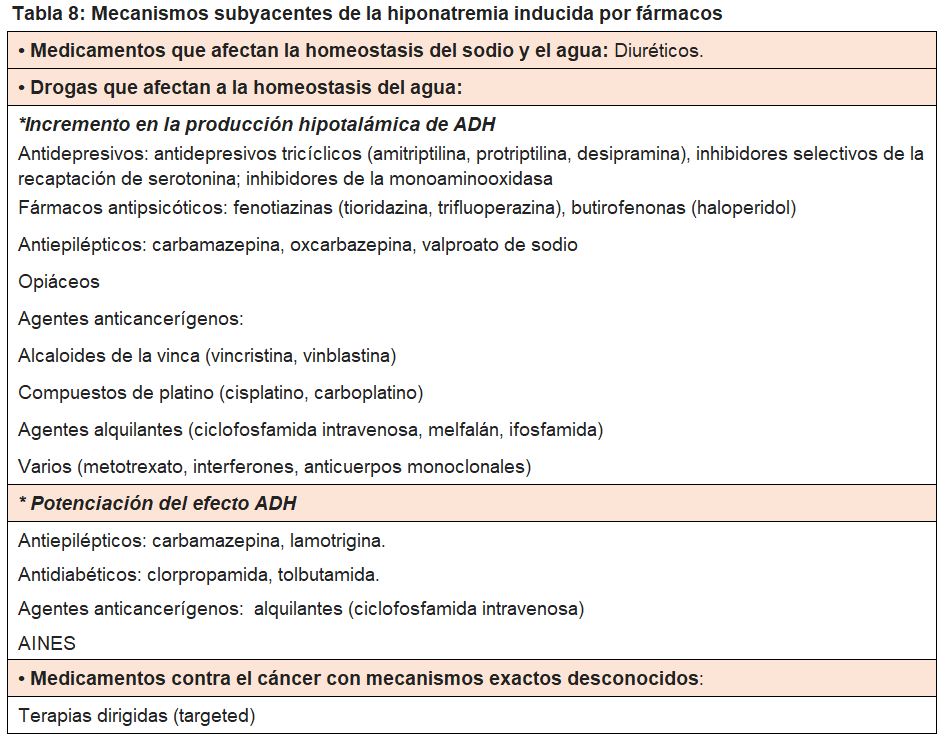
Las causas de hiponatremia en los pacientes por cáncer pueden ser por la producción ectópica de ADH por el tumor o por los efectos de medicamentos anticancerígenos y paliativos en la producción o acción de ADH. Las causas principales y los mecanismos subyacentes de la hiponatremia inducida por medicamentos se muestran en la tabla VIII [34]. La hiponatremia relacionada con el tratamiento con medicamentos es un problema cada vez más importante en la práctica clínica de Oncología y puede deberse a decenas de medicamentos. Otras causas de hiponatremia en pacientes con cáncer son hipovolémicas debido a la diarrea y los vómitos causados por el tratamiento contra el cáncer.
En relación a los agentes anticancerígenos:
- La vincristina y la vinblastina son tóxicas para la neurohipófisis y el sistema hipotalámico.
- El cisplatino induce hiponatremia por dos mecanismos: SIADH y necrosis tubular (con un aumento de las pérdidas renales de magnesio, potasio y calcio).
- La ciclofosfamida intravenosa puede causar hiponatremia por alteración en la excreción de agua al potenciar el efecto de la ADH y posiblemente al aumentar su liberación. También para prevenir la cistitis química, los pacientes que reciben ciclofosfamida deben beber grandes cantidades de agua (se recomienda la solución salina isotónica para reducir el riesgo de hiponatremia).
- SIADH se registra en pacientes bajo tratamiento con interferón, interleucina 2 y levamisol, así como anticuerpos monoclonales.
- El metotrexato en dosis altas puede causar hiponatremia debido a un efecto tóxico en las áreas neurosecretoras del cerebro.
- En un metaanálisis de ensayos clínicos para evaluar la incidencia y el riesgo relativo de hiponatremia en pacientes con tumores sólidos que reciben terapias dirigidas (“target agents”), se incluyeron 13 estudios aleatorios de fase III con 6.670 pacientes tratados con 8 agentes dirigidos (tabla IX). La incidencia de la hiponatremia de alto grado con los inhibidores de la angiogénesis y con fármacos anti-EGFR (anti TKI o mAb) fue cercana al 8%. Además, el riesgo relativo (RR) de hiponatremia de alto grado con inhibidores de la angiogénesis fue de 2,69 en comparación con los anti-EGFR (anti TKI o mAb) cuyo RR fue de 1,12 [35]. Los mecanismos exactos que subyacen a la mayor incidencia de hiponatremia en pacientes expuestos a estos agentes dirigidos aún no están claros. Estudios recientes demostraron la actividad del factor de crecimiento endotelial vascular en el metabolismo renal del sodio, lo que sugiere una actividad de los agentes receptores anti-VEGF/VEGF en la homeostasis del sodio [36].
En la hiponatremia en el curso del tratamiento con fármacos, se recomienda suspender el tratamiento con estos agentes y evitar la readministración. Hay muchos textos y algoritmos para el tratamiento de la hiponatremia a los que no hacemos referencia porque están fuera del alcance de este texto [37] [38] [39].
4.c: Hipomagnesemia inducida por agentes anticancerígenos
El cisplatino no se une a las proteínas plasmáticas (a diferencia del oxaliplatino o el carboplatino), se filtra libremente a través del glomérulo y se acumula en las células tubulares. El posible mecanismo por el cual el cisplatino induce específicamente la hipomagnesemia es la lesión directa que altera la reabsorción de magnesio en la extremidad ascendente del asa de Henle, así como en el túbulo distal [40]. La toxicidad del cisplatino es dosis-dependiente causando apoptosis y necrosis celular en todos los compartimentos renales. La nefrotoxicidad es generalmente reversible aunque un porcentaje de pacientes muy pequeño (<3%) se mantienen con un FG inferior a 29 ml/min/1.73 m2 [41] [42]. En la toxicidad renal por platinos parece existir un componente de susceptibilidad individual e incluso datos recientes apuntan hacia una predisposición genética [43].
Bifosfonatos: la hipomagnesemia puede ocurrir con los bifosfonatos como resultado de la unión de los bifosfonatos a los cationes de magnesio.
Los anticuerpos monoclonales de cetuximab y panitumumab que se unen específicamente al receptor del EGF se asocian con una tasa alta de hipomagnesemia (60% en el caso de cetuximab). El mecanismo está relacionado con la inhibición del canal de Mg2+TRPM6 que regula la absorción de magnesio en el intestino y los túbulos renales [44].
4d: Hipopotasemia, hipocalcemia e hipofosfatemia inducidas por agentes anticancerígenos
Además de la hipomagnesemia, los agentes de platino también pueden causar otras anomalías electrolíticas como la hipopotasemia, la hipocalcemia y la hipofosfatemia. Se consideran juntos debido a su relación con la deficiencia de magnesio y la resistencia a la corrección antes de la reposición de magnesio. Sin embargo, incluso en ausencia de un bajo nivel de magnesio, la pérdida renal de potasio, calcio y fosfato puede ocurrir como resultado del daño mediado por el platino en las membranas tubulares [40]. En pacientes tratados con platino, la hipocalcemia está relacionada principalmente con la deficiencia de magnesio, ya que el magnesio es un cofactor requerido para la liberación de la hormona paratiroidea (PTH).
Los pacientes con cáncer pueden presentar hipofosfatemia. La anorexia o la desnutrición, junto con la pérdida de fosfato renal como consecuencia de la quimioterapia son las causas principales. Se han descrito principalmente a la ifosfamida, cisplatino e imatinib como causantes de hipofosforemia debido a la inducción de tubulopatía proximal y Síndrome de Fanconi [45]. Los tumores mesenquimatosos raros también causan hipofosfatemia debido a la secreción paraneoplásica de la hormona fosfatúrica, factor de crecimiento de fibroblastos 23 (FGF23) induciendo la complicación conocida como osteomalacia inducida por tumor [46].
5.- Nefropatía por cristales
Se sabe que varios medicamentos que son insolubles en la orina humana precipitan dentro de los túbulos renales. La precipitación intratubular de medicamentos administrados de forma exógena o de cristales endógenos (inducidos por ciertos medicamentos) puede promover una lesión renal crónica y aguda, denominada nefropatía por cristales. El diagnóstico a menudo se realiza mediante la visualización de cristales característicos del fármaco en el sedimento de orina (especialmente cilindros cristalinos) o cristales intratubulares (con reacción celular circundante) en muestras de biopsia de riñón. Se sabe que la sulfadiazina, el aciclovir, el indinavir, el triamtereno y el metotrexato causan nefropatía cristalina [47].
La obstrucción tubular después de la precipitación de cristales intratubulares no es el principal mecanismo patógeno. La inflamación mediada por inflamasoma inducida por cristales ofrece una nueva explicación para la lesión renal causada por el depósito de cristales intratubulares [48].
La IRA en este contexto puede prevenirse con una dosis apropiada del fármaco, expansión de volumen con alto flujo urinario y alcalinización de la orina cuando sea apropiado. El riesgo de nefrotoxicidad inducida por metotrexato aumenta con una orina ácida (ya que el metotrexato es difícilmente soluble en una orina ácida). Por ello se recomienda la alcalinización de la orina a un pH> 7, con una solución de bicarbonato intravenoso (horas de inicio antes de la administración de metrotrexato), lo que puede aumentar la solubilidad del metotrexato hasta 10 veces, si bien se trata de una recomendación teórica pues no hay estudios que hayan demostrado su beneficio. La glucarpidasa, que metaboliza rápidamente el metotrexato en metabolitos inactivos, puede prevenir la toxicidad sistémica del metotrexato al reducir rápidamente los niveles séricos de metotrexato que siguen siendo inaceptablemente altos a pesar de la hidratación adecuada y la alcalinización urinaria [49].
6.- Nuevos tratamientos Car-T cells y nefrotoxicidad
Los linfocitos T portadores de un receptor quimérico (CAR-T) para un antígeno tumoral se han convertido en una prometedora estrategia para pacientes con cánceres hematológicos resistentes a otros tratamientos. Los medicamentos CAR-T aprobados por la Agencia Europea del Medicamento hasta este momento se dirigen a tratar la leucemia linfoblástica aguda de células B refractaria en recaída post-trasplante o en segunda o posterior recaída en pacientes pediátricos y adultos jóvenes así como el linfoma B difuso de célula grande en recaída o refractario tras dos o más líneas de tratamiento sistémico en pacientes adultos.
Pero también están siendo estudiados en tratamientos de tumores sólidos como el glioblastoma multiforme, el cáncer de ovario, el cáncer de páncreas, el mesotelioma y el cáncer de próstata.
La infusión de células CAR-T puede conducir a un síndrome de liberación de citoquinas debido principalmente a la IL-6 que se libera junto con otras citoquinas inflamatorias. La IRA es el resultado de una combinación de la hipopefusión renal por acúmulo de líquido en tercer espacio, la hipotensión, la miocardiopatía inducida por citoquinas y por los efectos inflamatorios directos. La IRA puede ser leve y prerrenal o grave por necrosis tubular aguda y entre las medidas para su prevención está la administración concomitante de anti IL-6 [50].