Síndrome de Lisis Tumoral
Palabras clave
Xantinuria, Síndrome de Lisis Tumoral espontáneo, Rasburicasa
INTRODUCCIÓN
El síndrome de lisis tumoral (SLT) constituye una de las principales urgencias oncohematológicas. Tiene lugar por la liberación masiva del contenido intracelular (y los productos derivados de su metabolismo) al torrente sanguíneo, tras la rápida destrucción de un elevado número de células tumorales, dando lugar a hiperuricemia, hiperpotasemia, hiperfosfatemia e hipocalcemia, una vez superada la capacidad homeostática del organismo. Estas alteraciones metabólicas pueden originar toxicidad orgánica e ir acompañadas de una respuesta inflamatoria sistémica, ocasionando daño renal agudo, arritmias, convulsiones o muerte [1] [2].
El SLT ocurre habitualmente en respuesta a un tratamiento antineoplásico eficaz, pero también puede aparecer espontáneamente en tumores altamente proliferativos. Clásicamente asociado a linfomas de alto grado o leucemias agudas, su epidemiología ha cambiado sustancialmente en los últimos años, con la introducción de nuevas terapias dirigidas altamente eficaces, aumentando el riesgo de SLT en neoplasias antes consideradas de bajo riesgo [2] [4].
Resulta fundamental la identificación de los pacientes en riesgo de presentar un SLT, de cara a instaurar medidas preventivas de forma precoz, antes de que ocurra el daño orgánico.
El SLT asocia elevada mortalidad, si bien estrategias tales como el tratamiento antineoplásico secuencial (con prefase) o con aumento progresivo de dosis (“ramp-up”) y el empleo de la rasburicasa, han mejorado su pronóstico [2] [5] [6].
DEFINICIÓN Y CLASIFICACIÓN
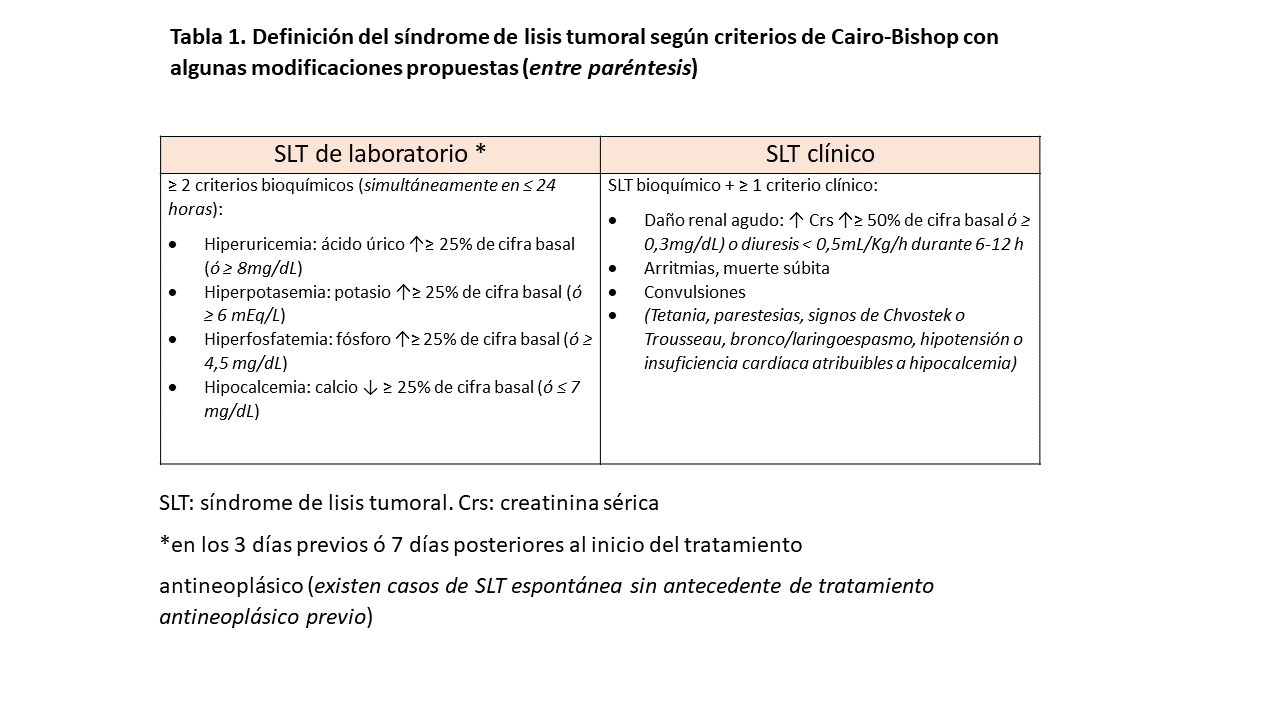
La definición del SLT está basada en los criterios de Cairo-Bishop publicados en 2004 [7]. Se requiere la presencia de al menos 2 alteraciones metabólicas (SLT de laboratorio) acompañadas o no de al menos 1 criterio clínico (SLT clínico) (Tabla 1).
A la hora de aplicar la definición, es necesario descartar otras causas de fracaso renal agudo (FRA). También resulta esencial tener en cuenta la secuencia cronológica, dado que el FRA de otras etiologías pueden dar lugar a elevaciones en las cifras de potasio, fósforo y/o ácido úrico, sin que exista un SLT, siendo el FRA la causa y no la consecuencia de dichas alteraciones metabólicas.
Ampliamente utilizada, la definición de Cairo-Bishop tiene algunas limitaciones [8]. En primer lugar, no tiene en cuenta algunos casos de SLT espontáneo, descrito sobre todo en linfomas de alto grado como el linfoma de Burkitt [9]. Howard et al. [2] sugieren algunas modificaciones a la definición, como requerir la presencia simultánea (en ≤ 24 horas) de las ≥ 2 alteraciones bioquímicas, puesto que la aparición diferida de una de ellas podría deberse a otra causa distinta de la lisis tumoral; proponen también sustituir los cambios porcentuales por valores absolutos (dentro del rango patológico), ya que variaciones del 25% pueden no tener relevancia clínica; e incluir cualquier hipocalcemia sintomática como como criterio clínico de SLT (aun siendo el descenso en la calcemia <25%).
PATOGENESIS
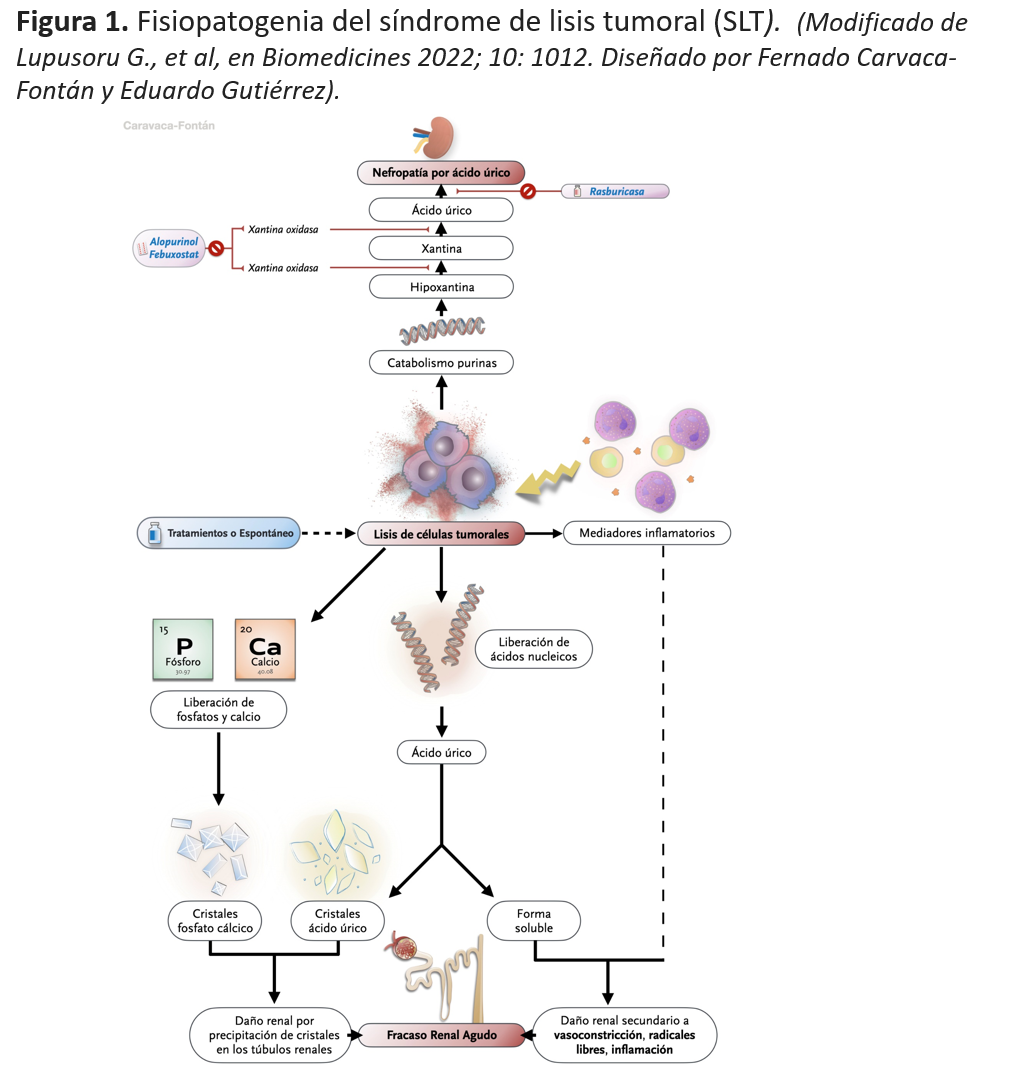
Los mecanismos patogénicos se basan en la liberación de altas concentraciones de potasio, fosfatos y ácidos nucleicos al espacio extracelular originando hiperpotasemia, hiperuricemia, hiperfosforemia y secundariamente hipocalcemia al exceder los mecanismos homeostáticos del organismo [10] [11].
Pese a que las complicaciones electrolíticas tienen un importante potencial mórbido, la liberación de ácidos nucleicos juegan un papel crucial en el FRA asociado a SLT [12] El riñón es, sin duda, el principal órgano afectado tras un SLT. La fisiopatología del FRA en el seno de un SLT no es comprendida en su totalidad debido a la escasez de datos. La principal vía etiológica del daño renal es dependiente de la formación de cristales. La formación de cristales de ácido úrico y de fosfato cálcico lesionan directamente las células tubulares. Sin embargo, también existen vías independientes de la formación de cristales originando respuestas inflamatorias sistémicas que pueden emular una sepsis y un fallo multiorgánico [13].
El empleo de rasburicasa ha disminuido significativamente la toxicidad renal por cristales de ácido úrico, sin embargo, los porcentajes de FRA no han descendido de manera correlativa [14]. De ahí se deduce, en los últimos años, que las teorías no relacionadas con el depósito de cristales hayan alcanzado mayor protagonismo. Siguiendo esta línea argumental, se han desarrollado recientemente modelos murinos con leucemia mieloide aguda que desarrollan SLT. Este modelo pone de manifiesto que la elevada concentración de histonas extracelulares, tras la destrucción celular, pueden ser las responsables del daño endotelial asociado a este síndrome. Las histonas extracelulares, compuestas por cinco proteínas catiónicas, tienen efectos citotóxicos activando las células endoteliales a través de los receptores Toll-like 4. De ello, se puede extrapolar, que estas histonas podrían convertirse en una nueva diana terapéutica [15].
Si nos circunscribimos a los principales elementos liberados tras una destrucción celular masiva, podemos destacar (Figura 1).
1.-Ácido úrico
Véase Ácido Úrico y Enfermedad Renal Crónica
La destrucción del ácido dexosirribonucleico celular provoca la liberación de purinas (monofosfato de adenosina y monofosfato de guanosina) que son metabolizados en adenina y guanina y consecuentemente la hipoxantina en xantina, la cual es finalmente convertida en ácido úrico bajo la influencia de la xantina oxidasa. En los mamíferos, el ácido úrico es finalmente metabolizado en alantoína (5-10 veces más soluble que el ácido úrico) que es excretada a nivel renal. Esta vía catabólica precisa de la participación de la enzima urato oxidasa, enzima ausente en humanos [15] [16].
El ácido úrico es poco soluble en agua, particularmente en el ambiente ácido de los túbulos distales y sistema colector. Su sobreproducción y elevada excreción pueden producir la precipitación y depósito de los cristales en los túbulos renales produciendo obstrucción e incremento, de manera progresiva, de la presión en los túbulos proximales y distales lo que se traduce también en un aumento de la presión de los capilares peritubulares y de la resistencia vascular [17]. Por consiguiente, el ácido úrico puede causar lesión renal a través de mecanismos independientes del depósito de cristales, en especial por cambios hemodinámicos (vasoconstricción renal) y alteración de la autorregulación renal por disminución en la liberación de óxido nítrico [18]. A su vez, los altos niveles séricos de ácido úrico afectan a las células musculares lisas con la liberación de citoquinas que causan un síndrome de respuesta inflamatoria sistémica [19]. Como consecuencia del daño renal, se inhibe la proliferación de las células del túbulo contorneado proximal y de las células endoteliales [20].
El rápido incremento de los niveles séricos de ácido úrico se correlaciona también con una marcada uricosuria. La muerte y degradación celular produce un incremento de la acidez urinaria lo que disminuye la solubilidad del ácido úrico. Cuando los niveles urinarios de ácido úrico exceden su solubilidad, tanto los micro como los macrocristales, precipitan en la luz de los túbulos distales y colectores provocando su obstrucción [21].
2.-Fósforo y calcio
La concentración de fósforo en las células neoplásicas es prácticamente cuatro veces el de las células normales [22]. La liberación de altas cantidades de fósforo al espacio extracelular suele causar hipocalcemia. La hiperfosforemia puede ocasionar la precipitación de los cristales de fosfato cálcico en el tejido renal (nefrocalcinosis), especialmente en presencia de orina alcalina. El principal factor para la cristalización del fosfato cálcico es presentar un pH urinario elevado, de ahí que la alcalinización urinaria no sea, en líneas generales, recomendable. Estos cristales también se pueden depositar a nivel cardiaco, especialmente en el sistema de conducción, y provocar arritmias fatales. La hipocalcemia secundaria también puede producir importantes manifestaciones clínicas (tetania, convulsiones, arritmias…) que pueden persistir tras la corrección de la hiperfosforemia en probable relación con déficit de 1,25 vitamina D [23].
Véase Trastornos del Fósforo, Calcio y Magnesio
3.-Xantinuria
El alopurinol bloquea el catabolismo de hipoxantina y xantina produciendo un incremento de los niveles séricos de estos metabolitos. La xantina es mucho menos soluble que el ácido úrico y la alcalinización urinaria no incrementa tanto su solubilidad como ocurre con el ácido úrico. De esta manera, el empleo de alopurinol origina un mayor riesgo de precipitación tubular de xantina ocasionando nefropatía por xantina y/o litiasis de xantina [24].
En resumen, existe un reconocido y extendido mecanismo de daño renal secundario al depósito tubular de los cristales de ácido úrico, fosfato cálcico y probablemente xantina. Estos cristales son tóxicos para el epitelio tubular renal y las células tubulares dañadas pueden liberar citoquinas. Los cristales de urato monosódico pueden también activar a los neutrófilos y monocitos directa o indirectamente, así como mediante la activación del complemento. Sin embargo, en los últimos años, han tomado protagonismo las teorías que hacen referencia a las vías patogénicas no dependientes del depósito de cristales. Estos mecanismos se inician por alteraciones agudas en la autorregulación del flujo sanguíneo renal. La reducción de la perfusión renal produce hipoxia tisular con daño de reperfusión y respuesta inflamatoria. El daño del endotelio y de las células parenquimatosas se sigue de la liberación de citoquinas y quimioquinas que inician una serie de pasos coordinados. Entre ellos destaca la reducción en la producción local de óxido nítrico y la activación del sistema renina-angiotensina-aldosterona que conllevan daño sobre la microvasculatura renal con un incremento de la vasoconstricción. Todo ello se traduce en la mencionada hipoperfusión renal con mantenimiento de la hipoxia, y secundariamente, activación de mecanismos inflamatorios que contribuyen al daño tubular y vascular [3].
EPIDEMIOLOGÍA
La incidencia y prevalencia del SLT no está bien definida porque muchos de los estudios publicados preceden a los criterios de clasificación de Cairo-Bishop y no se contaba con criterios uniformes para diagnosticar el SLT [21].
En la primera década del siglo XXI coincidiendo con el desarrollo de las nuevas terapias frente al cáncer altamente efectivas, la incidencia de STL se vio incrementada. Actualmente la incidencia varía según las series publicadas entre el 3 y el 26%, condicionada por diferentes factores como el tipo de neoplasia, el tratamiento tumoral, las características del paciente, el reconocimiento precoz del síndrome y las medidas profilácticas empleadas [25].
La frecuencia aumenta en neoplasias oncohematológicas con alto índice proliferativo y/o alta tasa tumoral como el linfoma no Hodking tipo Burkitt (30%), linfomas agresivos con masas tumorales voluminosas, la leucemia mieloblástica aguda (LMA) con hiperleucocitosis (19%) y la leucemia linfoblástica aguda (LLA) especialmente la tipo T (13%). También se ha descrito en otras neoplasias hematológicas como la leucemia linfática crónica (LLC) y la leucemia mieloide crónica (LMC) [26]. Los tumores sólidos que con mayor frecuencia desarrollan SLT son los que derivan de células germinales, neuro y meduloblastoma, el carcinoma de células microcíticas pulmonares, los tumores ginecológicos (mama, ovario y vulva), el hepatoblastoma y el hepatocarcinoma, el tumor gástrico, colono-rectal, los melanomas y sarcomas [27].
La alta sensibilidad a la quimioterapia, la afectación metastásica y la asociación de otras condiciones clínicas como enfermedad renal crónica previa, oliguria, deshidratación, hipotensión y orinas con pH ácido también aumentan su incidencia [2]. Sin embargo, la incidencia disminuye en pacientes con neoplasias de baja tasa de proliferación como las leucemias crónicas y el mieloma múltiple [28].
El SLT se presenta con mayor frecuencia al inicio del tratamiento citotóxico pero hasta en un tercio de los pacientes se desarrolla de forma espontánea, diferenciándose así entre SLT inducido y espontáneo respectivamente.
La mortalidad intrahospitalaria asociada al SLT se sitúa en torno al 5-20% consecuencia de las complicaciones relacionadas con la insuficiencia renal. Por esta razón, es crucial identificar a los pacientes en riesgo de desarrollar el SLT para poder aplicar de forma precoz medidas profilácticas de prevención y ajustar la dosis de los fármacos con el objetivo de reducir la incidencia y las consecuencias fatales de su desarrollo [1].
MANIFESTACIONES CLÍNICAS
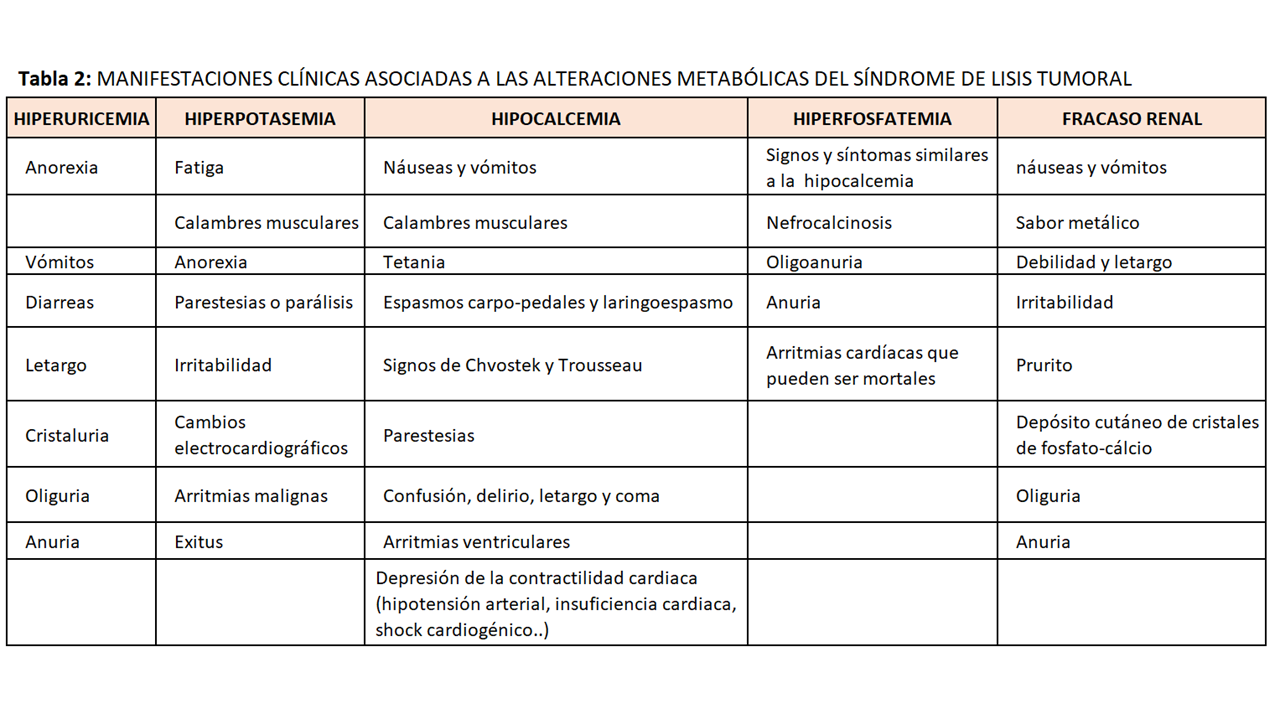
Las manifestaciones clínicas asociadas al SLT derivan del tipo de neoplasia que presente el paciente pero mayoritariamente de las alteraciones metabólicas que desarrolle principalmente hiperpotasemia, hiperfosforemia e hipocalcemia [29].
Lo habitual es que los síntomas aparezcan entre el 1º y 3º día de iniciado el tratamiento en las neoplasias hematológicas, y a la semana en las sólidas, aunque también pueden aparecer de forma espontánea. Si no se reconoce y se trata precozmente puede ser potencialmente mortal [30].
La sintomatología asociada a las alteraciones metabólicas del SLT se describen a continuación (Tabla 2).
Hiperuricemia
Los niveles elevados de ácido úrico en sangre asociados a una orina ácida favorecen la precipitación de los cristales de ácido úrico a nivel de los túbulos renales contribuyendo a la disfunción renal. Se manifiesta principalmente con anorexia, naúseas, vómitos, diarreas, letargo, oliguria y anuria [31].
Hiperpotasemia
Los niveles de potasio sérico por encima de 5mEq/l constituyen una urgencia médica. Provoca alteraciones del músculo esquelético y cardíaco manifestándose con arritmias potencialmente mortales. Los cambios electrocardiográficos incluyen ondas T picudas, complejos QRS ampliados y fusión del complejo QRS con la onda T. Los síntomas neuromusculares incluyen fatiga, calambres musculares, anorexia, parestesias e irritabilidad y parálisis [31].
Hipocalcemia
La gravedad de los síntomas depende de los valores de calcio iónico y de la velocidad de disminución del calcio. La clínica se manifiesta con naúseas, vómitos, tetania, calambres musculares, espasmos carpopedales, laringoespasmo, letargo, convulsiones y coma. También puede manifestarse con alteraciones en la conducción cardiaca que pueden llegar a ser graves (taquicardia ventricular polimórfica) y depresión de la contractilidad cardiaca condicionando insuficiencia cardiaca, hipotensión arterial y shock cardiogénico que pueden desencadenar la muerte del paciente [32].
Hiperfosfatemia
Si se asocia a hipocalcemia favorece la precipitación de cristales de fosfato-cálcico a nivel del parénquima renal condicionando la aparición de nefrocalcinosis especialmente en pacientes con orinas alcalinas. Estos cristales pueden precipitar en el sistema de conducción cardiaco desarrollando arritmias fatales. La sintomatología no suele ser evidente en pacientes con hiperfosforemia leve o moderada pero en situaciones de hiperfosforemia grave, las manifestaciones clínicas pueden confundirse con las de la hipocalcemia [32].
Fracaso renal agudo
Se produce principalmente por la precipitación de ácido úrico y cristales de fosfato-cálcico a nivel tubular condicionando la obstrucción de la luz tubular. Los cristales de fosfato-cálcico se depositan a nivel del intersticio y de la microvasculatura renal condicionando nefrocalcinosis. Suele cursar con oligoanuria. Las manifestaciones clínicas son las derivadas de la uremia: debilidad, letargo, naúseas, vómitos, sabor metálico, irritabilidad, prurito generalizado, depósito cutáneo de cristales de fosfato-cálcico, entre otros [1].
Véase Insuficiencia Renal Aguda
ETIOLOGÍA: PACIENTES EN RIESGO
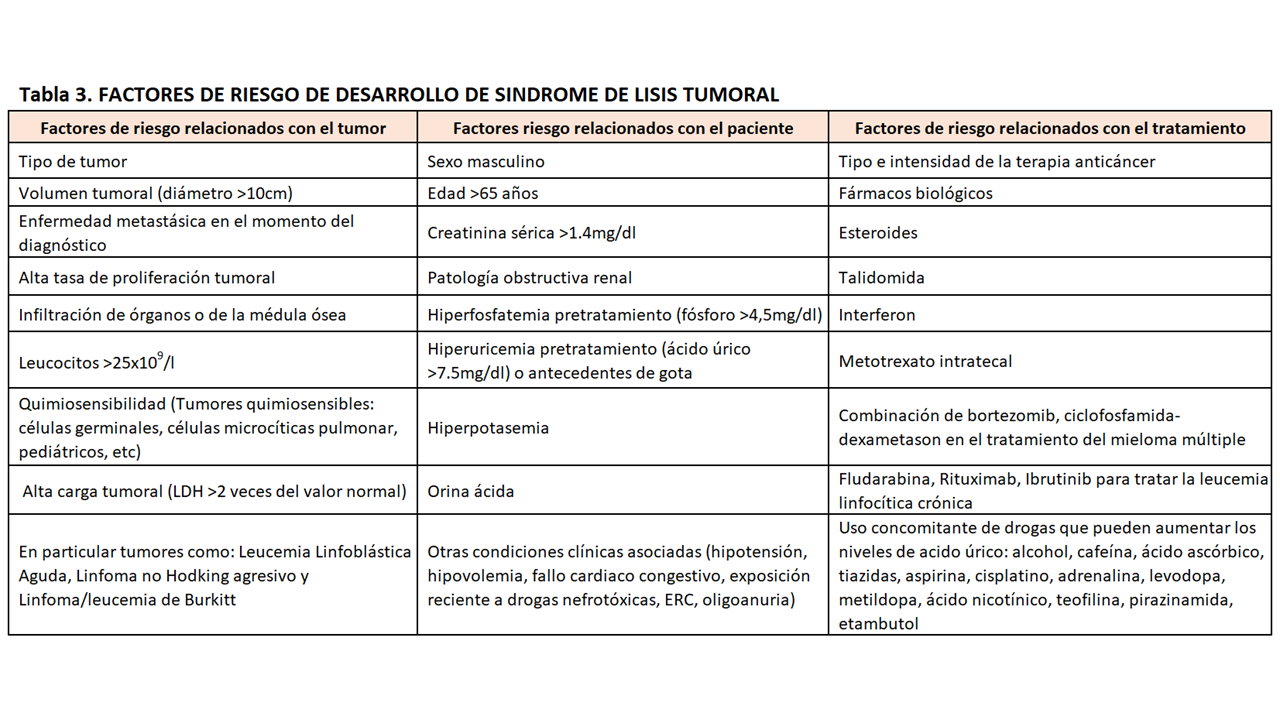
Todo paciente diagnosticado de una neoplasia onco-hematológica que vaya a recibir tratamiento quimioterápico debería ser evaluado acerca del riesgo de desarrollar un SLT. Por ello es fundamental conocer los factores de riesgo relacionados con el desarrollo del síndrome. Los factores de riesgo pueden ser agrupados en tres categorías diferentes: relacionados con el tumor, con el paciente o con el tratamiento como se muestra en la (Tabla 3) [33].
La insuficiencia renal de cualquier causa en pacientes con neoplasias malignas es un factor de riesgo independiente de mortalidad hospitalaria [34].
Los pacientes ancianos con antecedentes de enfermedad renal crónica, oliguria, deshidratación, hipotensión y/o cardiopatías presentan el mayor riesgo para desarrollar un SLT [35].
Síndrome de lisis tumoral asociado a fármacos
El SLT asociado a fármacos está descrito en un pequeño número de casos porque es difícil determinar la verdadera incidencia y la relación directa entre los fármacos y el síndrome. El desarrollo de fármacos altamente eficaces y dirigidos a la neoplasia, utilizados en monoterapia o en combinación con otros agentes citotóxicos convencionales, ha aumentado la frecuencia y gravedad del SLT en tumores que previamente no presentaban esta complicación.
Los principales grupos farmacológicos asociados a SLT son:
- Inhibidores de BCL-2 (familia de proteínas, B-cell lymphoma 2): La alta eficacia del primer inhibidor del BCL2 (venetoclax) usado en la LLC y en la LMA se ha asociado con un alto riesgo de desarrollo de SLT. Sin embargo, estrategias como ajustar y espaciar la dosis del fármaco, reducir con hidroxiurea los leucocitos por debajo de 25x109/L previo al inicio del tratamiento con venetoclax, o el uso de agentes quimioterápicos basados en inhibidores de BTK (Tirosina Quinasa de Bruton) y Ac monoclonal antiCD20 han disminuido la incidencia del SLT asociado al venetoclax [36].
- Inhibidores del proteosoma (bortezomib, oprozomib, carfilzomib y ixazomib): Son fármacos empleados principalmente para el tratamiento del mieloma múltiple. Tras su introducción, la frecuencia de SLT ha aumentado siendo del 1.4-5% para el bortezomib, 0,4-4,3% para carfilzomib y del 2,4% para oprozomib [37].
- Anticuerpos monoclonales antiCD-20: la incidencia de SLT tras la administración de anticuerpos monoclonales antiCD-20 de primera generación (rituximab) es baja, pero esta incidencia aumenta con los antiCD-20 de nueva generación como el obinutuzumab usado en combinación con clorambucil para el tratamiento de la recaída o refractariedad de la LLC o del linfoma difuso de células B. También se ha descrito en pacientes con alta tasa tumoral y elevada LDH al diagnóstico [1] [30].
- Inhibidores de la tirosin-kinasa: Hay casos descritos en la literatura de SLT asociado a ibrutinib en el tratamiento de pacientes con LLC y de pazopanib en pacientes con carcinoma de células claras renales [38].
- Esteroides: Poseen una actividad linfotóxica relevante y pueden desarrollar SLT especialmente en pacientes afectos de LLA, LLC y Linfoma no Hodking en tratamiento con altas dosis de dexametasona [39].
- Otras drogas que se han relacionado con el SLT incluyen lenalidomida, talidomida, paclitaxel, fludarabina, etopósido, ácido zolendrónico, trastuzumab entre otros [40].
Además el riesgo de desarrollo de SLT se ve aumentado con el uso concomitante de drogas que pueden elevar los niveles de acido úrico: alcohol, cafeína, ácido ascórbico, tiazidas, aspirina, cisplatino, adrenalina, levodopa, metildopa, ácido nicotínico, teofilina, pirazinamida, etambutol, entre otras [25].
Síndrome de lisis tumoral espontáneo
La incidencia real de este síndrome es difícil de determinar. Se presenta en menor frecuencia que el SLT inducido. Se asocia con hiperuricemia y FRA previo al inicio del tratamiento quimioterápico pero sin hiperfosforemia. Esto se puede explicar porque las neoplasias de rápido crecimiento y con alta tasa de recambio celular producen niveles elevados de ácido úrico a través de un rápido recambio de las nucleoproteínas y el tumor es capaz de reutilizar el fósforo liberado para la síntesis de nuevas células tumorales condicionando la ausencia de hiperfosforemia [41].
Otras situaciones
- Hay casos descritos aunque son raros de SLT inducido por radioterapia (RDT). En pacientes con gran esplenomegalia o enfermedad hepática difusa que reciben radioterapia deben ser monitorizados durante y tras la RDT por el riesgo de desarrollar SLT [42].
- También están en riesgo los pacientes a los que se les realiza una esplenectomía o una embolización arterial [43].
- Pacientes sometidos a cirugía general, mujeres embarazadas, pacientes con fiebres muy altas o con enfermedad de Castleman pueden desarrollar SLT aunque con muy baja frecuencia [44].
ESTRATIFICACION DE RIESGO
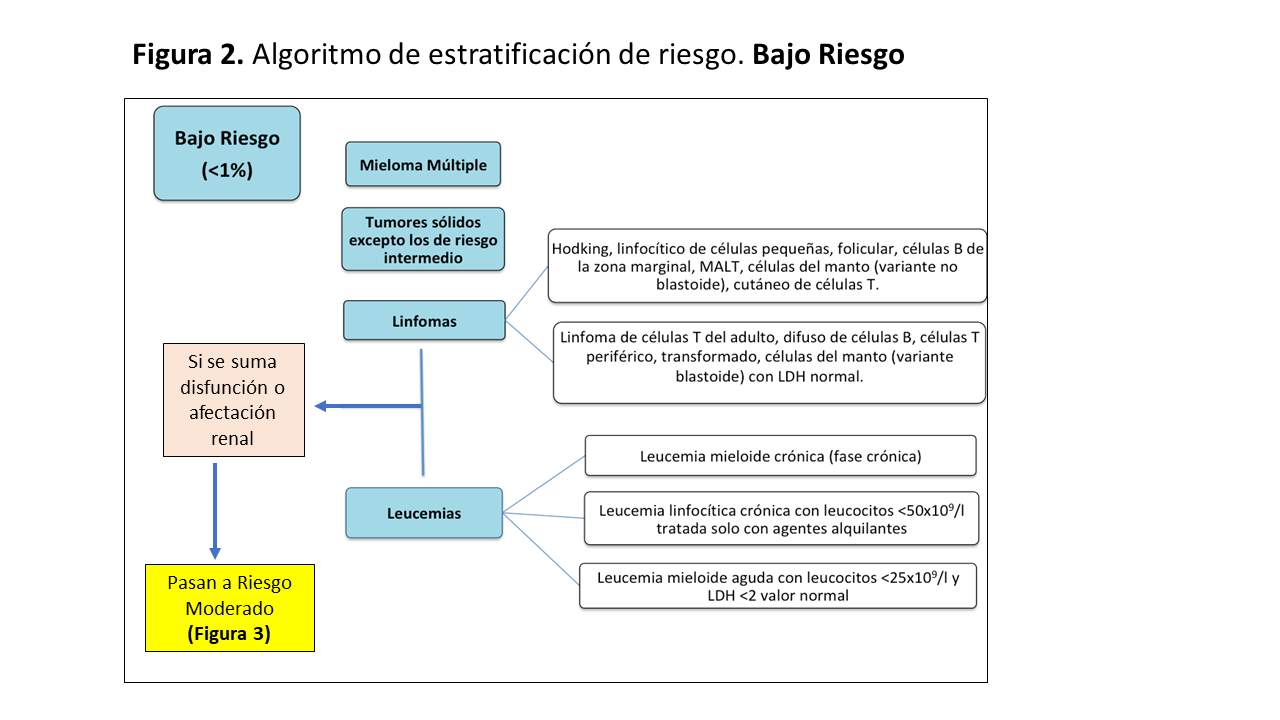
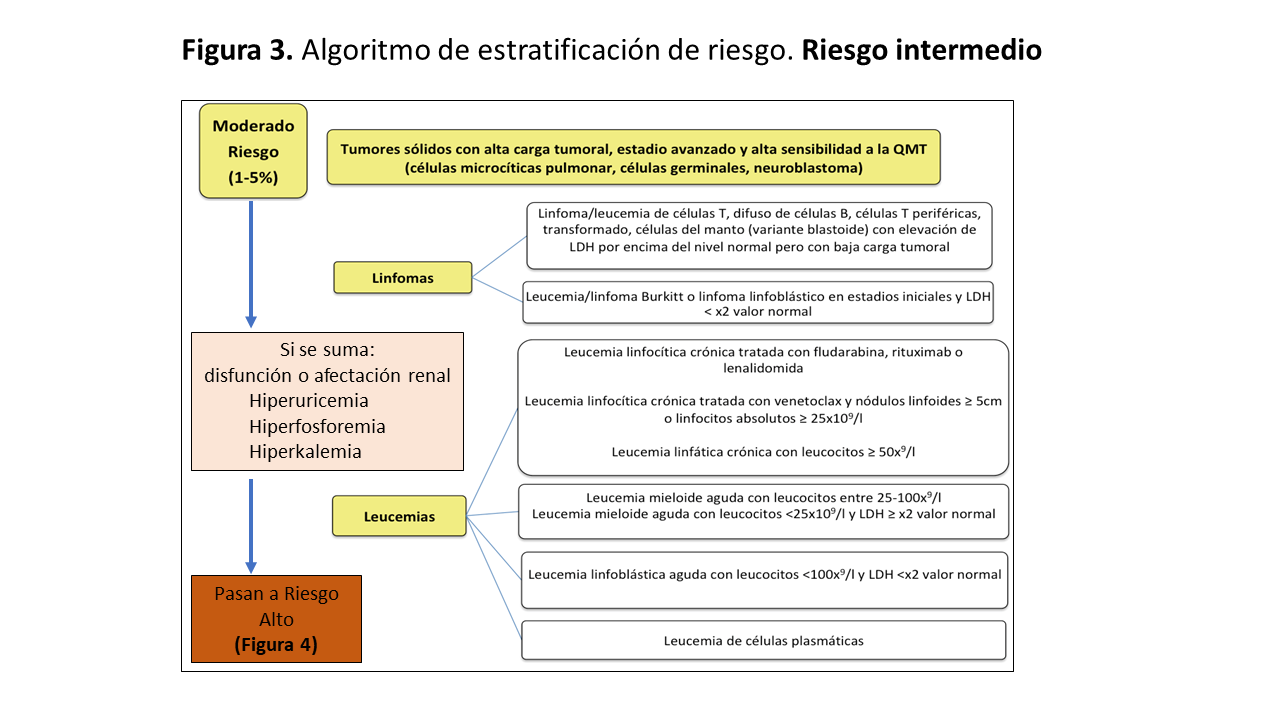
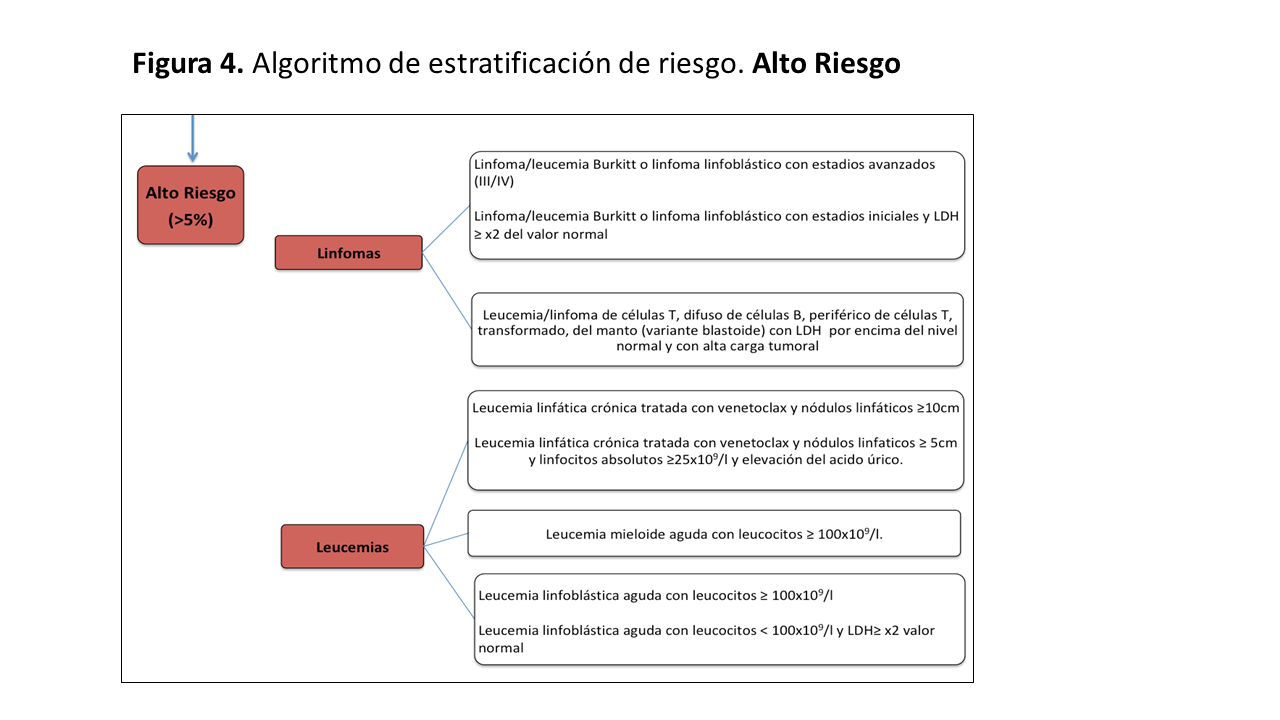
Basándonos en la definición de Cairo-Bishop y teniendo en cuenta parámetros que valoran el tipo de tumor, el nivel de leucocitos, estadio de enfermedad, aspectos histológicos, terapia antitumoral y función renal, se ha establecido un sistema de estratificación del riesgo de desarrollo de un SLT [45]: Bajo riesgo (Figura 2), Riesgo intermedio (Figura 3) y Alto riesgo (Figura 4).
Bajo riesgo (<1%):
– Mieloma múltiple
– La gran mayoría de los tumores sólidos excepto los que son altamente quimiosensibles (pulmonar no microcítico, células germinales, neuroblastoma) con estadio avanzado y de gran tamaño.
– Linfomas: Hodking, linfocítico de células pequeñas, folicular, células B de la zona marginal, linfoma de tejido linfoide asociado a mucosas (MALT), células del manto (variante no blastoide), cutáneo de células T. Linfoma de células T del adulto, difuso de células B, células T periférico, transformado, células del manto (variante blastoide), todos ellos con LDH normal.
– Leucemias: Leucemia mieloide crónica (LMC) (fase crónica), linfocítica crónica con leucocitos <50x109/l tratada solo con agentes alquilantes. Leucemia mieloide aguda (LMA) con leucocitos <25x109/l y LDH<2 valor normal.
Riesgo intermedio (1-5% lo desarrollan):
- Linfomas o leucemias de riesgo bajo que asocien disfunción renal y/o afectación renal.
- Tumores sólidos con alta carga tumoral, estadio avanzado y alta sensibilidad a la quimioterapia (células microcíticas pulmonar, células germinales, neuroblastoma)
- Linfomas: Elevación de LDH por encima del nivel normal pero con baja carga tumoral en linfoma/leucemia de células T, difuso de células B, células T periféricas, transformado, células del manto (variante blastoide). Estadios iniciales y LDH
- Leucemias: Leucemia linfática crónica (LLC) tratada con fludarabina, rituximab o lenalidomida, LLC tratada con venetoclax y nódulos linfoides ? 5cm o linfocitos absolutos ? 25x109/l. LLC con leucocitos ? 50x109/l. Leucemia mieloide aguda (LMA) con leucocitos entre 25-100x109/l, LMA con leucocitos <25x109/l y LDH ? x2 valor normal. Leucemia linfoblástica aguda con leucocitos <100x109/l y LDH < 2 valor normal. Leucemia de células plasmáticas.
Alto riesgo (>5% de los pacientes desarrollan SLT)
- Cualquier neoplasia de riesgo intermedio que asocie disfunción renal y/o afectación renal o elevación del acido úrico, potasio o del fósforo por encima del valor normal.
- Linfomas: Estadios avanzados (III/IV) en linfoma/leucemia Burkitt o linfoma linfoblástico. Estadios iniciales y LDH ≥ 2 valor normal en linfoma/leucemia Burkitt o linfoma linfoblástico. LDH ≥ 2 valor normal y con alta carga tumoral en leucemia/linfoma de células T, difuso de células B, periférico de células T, transformado, del manto (variante blastoide).
- Leucemias: LLC tratada con venetoclax y nódulos linfáticos ≥ 10 cm o nódulos linfáticos ≥ 5cm con linfocitos absolutos ≥ 25x109/l y elevación del ácido úrico. LMA con leucocitos ≥ 100x109/l. LLA con leucocitos ≥100x109/l o con leucocitos <100x109/l y LDH ≥ x2 del valor normal.
PREVENCIÓN
En la prevención es importante identificar los pacientes con riesgo de desarrollar un SLT, debido a su elevada morbilidad y mortalidad. Esto nos va a permitir una aproximación terapéutica más eficiente. En este sentido, se han publicado varios modelos de estratificación del SLT , la mayoría de ellos, teniendo en cuenta las características y comorbilidades del paciente y el tipo de neoplasia que ya hemos visto y de los que hay amplia literatura [46] [47] [48] [49] [50].
El manejo de estos pacientes debe estar centrado en identificar aquellos con riesgo de desarrollar un SLT para iniciar de forma precoz el tratamiento profiláctico.
En dependencia del riesgo de desarrollar SLT, los pacientes son clasificados en 3 categorías: Riesgo bajo (<1% de los pacientes), intermedio (1-5% de los pacientes) o alto riesgo (>5% de los pacientes)
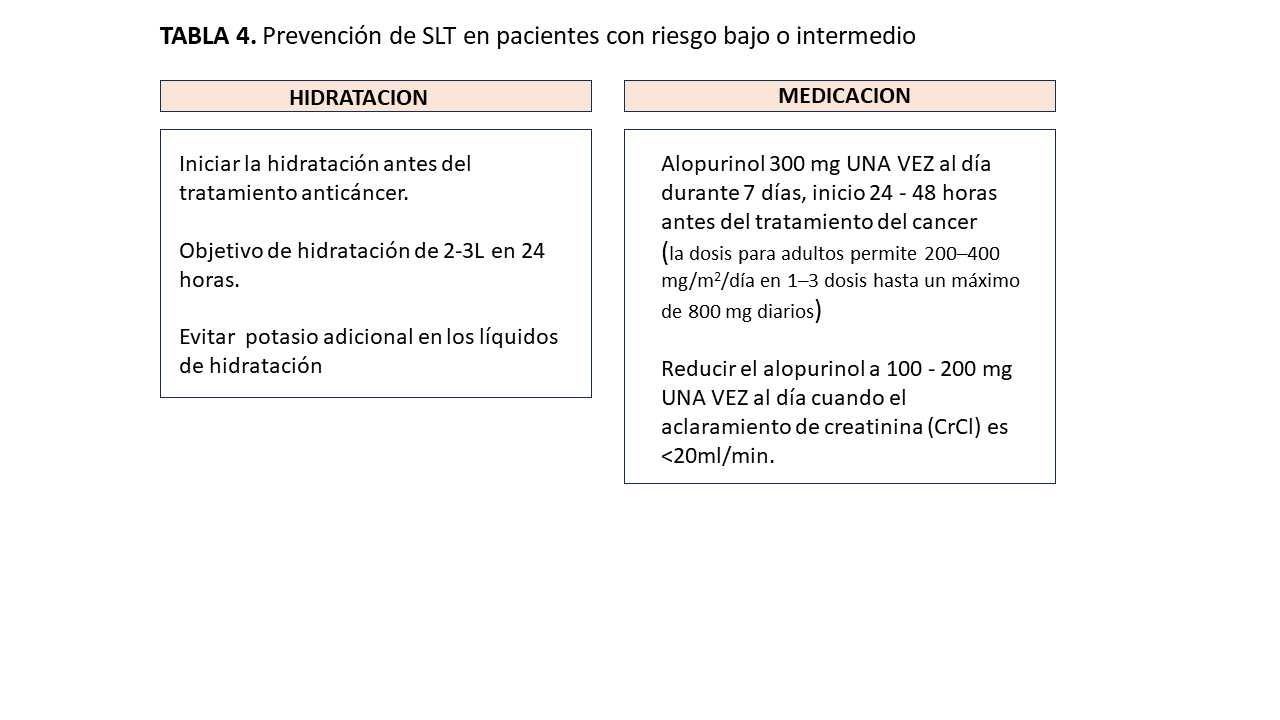
1.- Riesgo bajo o intermedio (prevención) (Tabla 4)
* Observaciones: Peso diario, signos vitales, balance de líquidos, muestreo de sangre (creatinina, urea y electrolitos; incluyendo calcio, fosfato, potasio y magnesio, ácido úrico, LDH) además de los controles habituales relacionados con el tratamiento del cáncer.
* Consideraciones adicionales:
Minimizar el uso de medicamentos nefrotóxicos concurrentes, evitar las tiazidas o los diuréticos ahorradores de potasio.
En algunos pacientes del grupo de riesgo intermedio puede estar justificada la monitorización hospitalaria con hidratación precisa y control de electrolitos.
Los pacientes alérgicos al alopurinol deben ser considerados para tratamiento con rasburicasa
* En el caso de deterioro de los marcadores bioquímicos o clínicos, hay que iniciar precozmente un tratamiento con Rasburicasa. En personas contraindicadas para rasburicasa, las dosis de alopurinol se pueden aumentar hasta un máximo de 800 mg/día (divididas en 2-3 dosis).
2.- Riesgo alto (prevención) (Tabla 5)
* Dosificación profiláctica de Rasburicasa: La dosis autorizada es de 0,2 mg/kg/día IV durante un máximo de 7 días. La Sociedad Británica de Hematología (BSH) recomienda una dosis fija única de 3 mg en la profilaxis [51] que desde entonces ha sido muy aceptada de forma generalizada en pacientes de alto riesgo previo al inicio del tratamiento antitumoral con seguimiento periódico y aplicación de una segunda dosis si se requiere.
* Observaciones: Peso diario, signos vitales, balance de líquidos, análisis de sangre (creatinina, urea y electrolitos; incluyendo calcio, fosfato, potasio y magnesio, ácido úrico, LDH) además del seguimiento habitual del tratamiento contra el cáncer.
* Consideraciones adicionales:
Minimizar el uso de medicamentos nefrotóxicos concurrentes, evitar las tiazidas o los diuréticos ahorradores de potasio.
Existen varias contraindicaciones para el tratamiento con rasburicasa:
Alergia a la rasburicasa o a excipientes
Deficiencia de glucosa 6-fosfato deshidrogenasa (G6PD)
Antecedentes de anemia hemolítica o presencia de otros trastornos celulares que se sabe que causan anemia hemolítica.
Metahemoglobinemia
* Deterioro durante el tratamiento profiláctico: En el caso de deterioro de los marcadores bioquímicos o clínicos, debe escalarse rápidamente al protocolo completo de SLT establecido
PROFILAXIS
La clave en la profilaxis del SLT es mantener un adecuado volumen urinario y disminuir los niveles de ácido úrico, potasio y fosfato en plasma. Estos valores deben monitorizarse cada 4-6 horas después de iniciado el tratamiento antitumoral en pacientes de alto riesgo, cada 8-12 horas en pacientes con riesgo intermedio y diariamente en pacientes de bajo riesgo. Además, se deben evitar fármacos nefrotóxicos (AINES), los contrastes iodados, así como suspender el tratamiento con bloqueantes del sistema renina-angiotensina-aldosterona.
Expansión de volumen
La expansión de volumen debe realizarse con soluciones cristaloides, para aumentar el volumen urinario, así como la excreción de potasio, fosforo y ácido úrico. Además, el aporte de sal al túbulo distal incrementa la secreción de potasio y disminuye la caliemia; y la disminución del producto calcio x fósforo previene la precipitación de cristales.
Se recomienda administrar de 2500-3500 mL/m2/día a los niños (en los que tienen un peso inferior a 10kg, se administrará 200 mL/m2/día) para conseguir un volumen de diuresis sobre 4 mL/kg/hora. En adultos se recomienda administrar unos 3 L/día, iniciando el tratamiento 2 o 3 días previos al inicio de la quimioterapia para obtener un volumen de diuresis superior a 100 ml/m2/hora o de 2500ml al día en adultos y sobre 4 mL/kg/h en niños.
Uso de diuréticos
Los diuréticos no deben usarse rutinariamente debido a que inducen depleción de volumen comprometiendo aún más el flujo hemodinámico renal. Su uso está justificado en casos de hipervolemia sintomática. Son preferidos los diuréticos de asa debido a que aumentan el flujo urinario y la secreción de potasio. El uso de tiazidas está contraindicado debido a su incremento de los niveles sanguíneos de ácido úrico.
Alcalinización de la orina
Un PH urinario alcalino favorece la conversión de ácido úrico a urato y disminuye la precipitación de cristales en los túbulos (el ácido úrico tiene una solubilidad de 0.15 mg/dL cuando el pH= 5, mientras que el urato tiene una solubilidad de 2.2 mg/dL cuando el pH= 7). Sin embargo, la alcalinización de la orina disminuye la solubilidad del producto calcio x fósforo favoreciendo la precipitación de cristales en los túbulos y tejidos blandos y por otro lado aumenta la cantidad de calcio que se une a albúmina pudiendo producir arritmias y tetania. Actualmente, la alcalinización urinaria no está recomendada.
Suplementos de calcio
La administración de calcio no está rutinariamente recomendada debido a que aumenta la precipitación de calcio en los tejidos blandos y esto puede empeorar el FRA. Su administración solo se recomienda en casos de hipocalcemia sintomática (tetania, signo de Chvostek, broncoespasmos, fasciculaciones musculares, laringoespasmo y crisis convulsivas), o cuando existen cambios electrocardiográficos y/o arritmias.
Hiperpotasemia
Cuando existe hiperpotasemia, esta debe ser tratada precozmente para evitar arritmias que puedan amenazar la vida del paciente. Cuando el potasio aumenta más de un 25% su valor basal o cuando es mayor de 6 mmol/L se recomienda la monitorización cardiaca y el tratamiento de la hiperpotasemia con betaadrenergicos, soluciones de glucosa e insulina, diuréticos de asa y resinas que se unen al potasio para aumentar la pérdida digestiva de este catión.
Además de la administración de gluconato cálcico para evitar arritmias. Cuando el potasio plasmático es >7 mmol/L, la diálisis está recomendada.
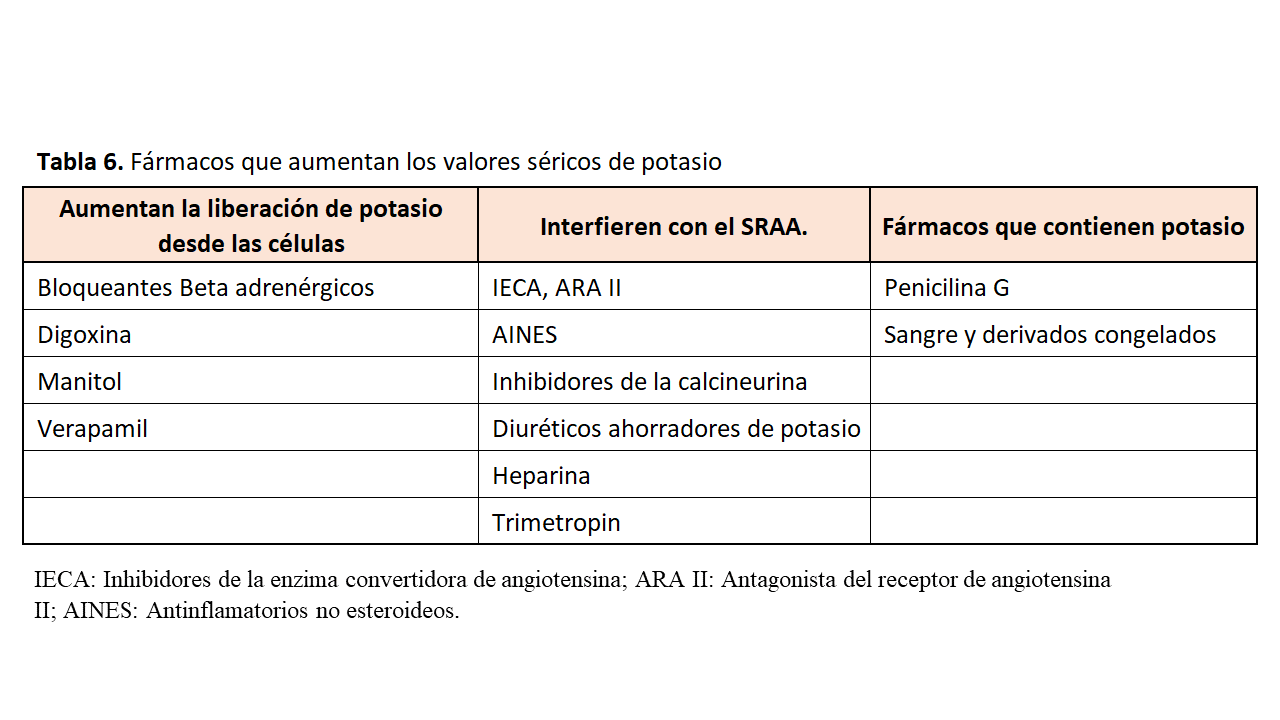
Además, debemos tener en cuenta los fármacos que incrementan los valores séricos de potasio y que se muestran en la (Tabla 6).
Alopurinol
El alopurinol es un análogo de la purina y es el isómero de la hipoxantina. Se metaboliza por la xantina oxidasa a oxipurinol que es su forma activa, la cual es un inhibidor competitivo de la xantina oxidasa. La vida media plasmática del oxipurinol es de 24h y se excreta por vía renal, siendo necesario ajustar dosis en casos de insuficiencia renal. Oxipurinol disminuye la producción de ácido úrico desde la xantina, pero no tiene ningún efecto sobre el ácido úrico que ya ha sido sintetizado [52], lo que ocasiona una respuesta débil al tratamiento en pacientes con SLT e hiperuricemia grave. Además, la concentración sérica de xantina e hipoxantina aumenta después de alopurinol y la xantina puede precipitar en los túbulos renales y provocar un FRA. Por lo tanto, se recomienda utilizar alopurinol como tratamiento profiláctico, pero no se recomienda su uso en el SLT establecido, donde solo puede usarse si el paciente es alérgico a la rasburicasa o tiene un déficit de glucosa-6-fosfato deshidrogenasa (G6PD).
El tratamiento profiláctico con alopurinol debe comenzar al menos 24 horas previo al inicio de la quimioterapia y debe mantenerse por al menos 7 días.
Debemos tener en cuenta las múltiples interacciones que tiene el alopurinol por lo que se recomienda disminuir dosis entre 65-75% cuando se administra alopurinol con azatioprina y 6-mercaptopurina. Además, de los fármacos antes expuestos, se debe ajustar dosis con su uso combinado con las tiazidas, ciclofosfamida, ciclosporina, ampicilina y amoxicilina. Aunque los efectos secundarios descritos son raros, pero pueden poner en peligro la vida produciendo desde el síndrome de Steven-Johnson hasta a necrólisis epidérmica tóxica, hepatitis tóxica aguda, vasculitis de pequeño vaso, aplasia medular y síndrome DRESS (eosinofilia, erupción cutánea, fiebre, linfadenopatía, hepatitis aguda, nefritis intersticial aguda) [53].
- Dosis en adultos: 200-400 mg/m2/día, dividida en 1 a 3 dosis con un máximo de 800 mg/día.
- Dosis en niños: 300-450 mg/m2/día dividido en 3 dosis con un máximo de 400 mg/día [46].
- En pacientes con ERC la dosis recomendada ajustada a filtrado glomerular seria:
20-50 ml/min/1.73 m2: 200–300 mg/día
10-20 ml/min/1.73 m2: 100–200 mg/día
< 10ml/min/1.73 m2: 100 mg/día o cada 48 horas
Febuxostat
Febuxostat es un nuevo inhibidor de la xantina oxidasa y este no induce las reacciones de hipersensibilidad observadas con alopurinol y no requiere ajuste de dosis según eGFR, por lo que es una alternativa al alopurinol en determinados grupos de pacientes.
En el estudio Florence se comprobó la eficacia de febuxostat comparado con alopurinol en pacientes con neoplasias hematologicas malignas y riesgo medio-alto de desarrollar SLT. El estudio demostró que febuxostat en una dosis única diaria de 120 mg/día fue más eficaz para prevenir el SLT [54] [55].
Otro estudio encontró que el febuxostat tenía la misma eficacia que el alopurinol para reducir niveles de ácido úrico sérico y urinario en 45 niños con edades entre 5 y 15 años con neoplasias hematológicas y con riesgo medio-alto de desarrollar un SLT [56]. Sin embargo, la dosis de febuxostat utilizada fue de 10 mg/día, una dosis demasiado pequeña para demostrar mayor eficacia sobre el alopurinol. En un reciente metaanálisis que incluyó seis estudios, y diseñado para evaluar la eficacia y seguridad de febuxostat en comparación con alopurinol como profilaxis del SLT, se observó que ambos fármacos mostraron una incidencia de SLT (OR 1,01, IC 95%: 0,56–1,81) y tasa de respuesta similar (OR 1,01, IC 95%: 0,55–3,51) [57]. A destacar de este estudio, que más de la mitad de los pacientes incluidos provenían del estudio Florence.
Rasburicasa
La rasburicasa es una enzima recombinante urato-oxidasa (UO), derivada de Aspergillus flavus. Es un agente uricolítico que cataliza la oxidación enzimática del ácido úrico a alantoína, dióxido de carbono y peróxido de hidrógeno. La alantoína es un producto hidrosoluble que se excreta fácilmente por vía renal. La acumulación de peróxido de hidrógeno en pacientes con deficiencia de G6PD produce acumulación de metahemoglobina produciendo una anemia hemolítica [58], por lo que antes de iniciar la administración de rasburicasa, los pacientes deben ser evaluados para detectar déficit de G6PD. En casos que no sea posible realizar el test, se puede administrar una dosis inicial de 0,05 mg/kg por vía intravenosa monitorizando al paciente para detectar signos de anemia hemolítica.
La rasburicasa se puede utilizar tanto en la prevención del SLT en pacientes de alto riesgo como tratamiento del SLT ya instaurado. La eficacia y seguridad de la rasburicasa para la prevención y el tratamiento del SLT en pacientes de alto riego se ha evaluado en varios estudios [59] [60] [61] [62] [63] [64] [65] [66] [67] [68].
Cortes et al [68] en un estudio fase III realizado en pacientes con riesgo de desarrollar un SLT evaluó el efecto reductor del ácido úrico con rasburicasa versus rasburicasa seguida de administración de alopurinol, versus alopurinol. Se observó una mejor respuesta en los pacientes tratados exclusivamente con rasburicasa con una reducción de ácido úrico del 87%, frente al 78% de los casos tratados con rasburicasa seguida de alopurinol, y un 66% de los casos tratados exclusivamente con alopurinol.
En otro estudio se comprobó la eficacia de la rasburicasa en el tratamiento de la hiperuricemia en pacientes con neoplasias malignas en 1069 pacientes (adultos y niños) y se observó niveles más bajos de ácido úrico en el 99% de los niños y el 100% de los adultos y solo precisaron tratamiento sustitutivo renal el 2,8% de los casos [69].
El Comité Británico de Estándares en Hematología elaboró un documento para el manejo del SLT en pacientes adultos y pediátricos con neoplasias hematológicas, donde se recomienda administrar rasburicasa como profilaxis en pacientes de alto riesgo en una dosis única de 3 mg para adultos y 0,2 mg/kg para niños. La administración de rasburicasa se puede repetir diariamente durante 5 a 7 días si es necesario (falta de respuesta o aumento del nivel de ácido úrico) [51].
La rasburicasa es un fármaco de acción rápida (reduce el nivel de ácido úrico en 4 h), bien tolerado, con menos interacciones farmacológicas comparado con alopurinol y con escasos efectos secundarios (rara vez puede inducir erupción cutánea, fiebre, cefaleas, náuseas, vómitos o citólisis hepática). Está contraindicado en mujeres embarazadas, lactantes o pacientes con deficiencia de G6PD.
Se recomienda que la muestra de ácido úrico debe ser trasladada al laboratorio en un recipiente con hielo y procesarla en un tiempo menor de 4 horas desde la extracción para evitar valores falsamente disminuidos debido a que la rasburicasa se mantiene activa.
Tratamiento de la hiperfosfatemia
La principal medida terapéutica debe estar centrada en aumentar la fosfaturia por expansión de volumen con soluciones isotónicas. Además, en el tratamiento se debe incluir la restricción del fósforo de la dieta y la administración de quelantes de fósforo orales (por ejemplo, sevelamer). La diálisis está indicada cuando el producto calcio x fosfato supera los 70 mg/dL, a pesar de las medidas terapéuticas y profilácticas.
Futuras perspectivas
Una estrategia en la prevención del SLT puede ser la modulación de la quimioterapia. Al elegir una quimioterapia menos agresiva se puede reducir lentamente el tamaño tumoral, permitiendo un tiempo suficiente para que los mecanismos compensatorios renales puedan eliminar los productos derivados de la lisis tumoral. Por ejemplo, en pacientes con linfoma de Burkitt, existen esquemas que incluyen una primera semana de tratamiento con dosis bajas de vincristina, prednisona y ciclofosfamida, seguidas de dosis completas.
En este sentido, el ensayo clínico NCT05840289 con inicio este año, estudia la incidencia de SLT clínico y bioquímico en pacientes con linfoma de alto grado de células B que reciben tratamiento con dosis fraccionada de rituximab [70].
Otra opción de futuro para mejorar la profilaxis de SLT sería la interferencia en las enfermedades malignas, multiplicación celular y las metástasis. Por ejemplo, es posible disminuir el comportamiento invasivo al apuntar a la expresión de proteínas de unión del desmosoma a través de fármacos que aumentan la expresión de estos desmosomas [71].
Varios estudios han reportado una correlación entre la expresión reducida de desmosomas y la invasividad de los tumores, como el carcinoma de células transicionales de vejiga y carcinoma pulmonar de células no pequeñas, afecciones que pueden estar asociadas con SLT [72] [73] [74].
La terapia de reemplazo enzimático seria otra diana terapéutica debido a la eficacia limitada de los inhibidores de la xantina oxidasa y a los efectos secundarios de la administración intravenosa de rasburicasa. Aunque, los riñones son la principal vía de eliminación del ácido úrico, no debemos olvidar que el intestino también juega un papel importante en el metabolismo de los uratos. Un estudio en modelo animal con ratones deficientes en uricasa con hiperuricemia grave y nefropatía obstructiva cristalina, el tratamiento con urato oxidasa recombinante oral (ALLN-346), que actúa en la degradación intestinal del urato, mostró una reducción significativa de la hiperuricemia en un 44% y normalización de la uricosuria [75].
Otro fármaco, la pegloticasa es una uricasa porcina recombinante que está pegilada para aumentar su vida media de eliminación y disminuir la inmunogenicidad. Al igual que la rasburicasa, esta contraindicado en pacientes con deficiencia de G6PD. Es un tratamiento de tercera línea para el tratamiento de la gota refractaria grave que fue autorizado por la Agencia Europea del Medicamento en 2016 y su administración es por vía intravenosa en infusión cada dos semanas. Actualmente, está en marcha un ensayo clínico en fase IV (NCT04745910), que está en periodo de reclutamiento de pacientes y su objetivo es evaluar la eficacia de la pegloticasa en comparación con rasburicasa para reducir los niveles de ácido úrico en pacientes con hiperuricemia causada por SLT [76].
TRATAMIENTO DEL SÍNDROME DE LISIS TUMORAL ESTABLECIDO
Una vez instaurado el síndrome de lisis tumoral se trata de una urgencia como hemos visto previamente debida a la destrucción masiva de células tumorales con liberación de grandes cantidades de potasio, fosfato y ácidos nucleicos a la circulación sistémica. Por consiguiente, debemos de enfrentarnos al control de la hiperpotasemia, hiperfosfatemia, hiperuricemia e hipocalcemia. La lesión renal aguda por lisis tumoral se ve potenciada por la precipitación de ácido úrico y fosfato cálcico, así como por la vasoconstricción renal. El tratamiento incluye hidratación intravenosa para mantener el flujo de orina, medicamentos dirigidos a la hiperuricemia, incluidos rasburicasa y alopurinol, y en casos graves puede ser necesaria una terapia de reemplazo renal. Todos estos aspectos se resumen en (Tabla 7) (Tabla 8) (Tabla 9) (Tabla 10 ) (Tabla 11) (Tabla 12) (Tabla 13) [30] [46] [51] [77]