Cáncer y Enfermedad Renal Crónica
Epidemiología : Cáncer y Enfermedad Renal Crónica
El cáncer es la segunda causa de muerte y morbilidad en Europa (3.7 millones de nuevos casos cada año). La mediana de edad de los pacientes en el momento del diagnóstico de cáncer es de 65 años. Del 47% de los sobrevivientes de cáncer, casi la mitad tiene 70 años o más [1]. Una población que envejece aumentará la cantidad de pacientes cuyo cáncer se complicará con otras enfermedades agudas (IRAg) o crónicas (ERC).
Por otra parte en el estudio EPIRCE [2] realizado en España por la SEN observamos que el 23% de los pacientes mayores de 65 años presentaban enfermedad renal crónica (ERC) grados 3-5. Por consiguiente y solamente en lo que se refiere a la prevalencia por edad, existe una coincidencia entre cáncer y ERC que explica la gran cantidad de consultas entre Oncología y Nefrología y justifica la creación de este grupo de trabajo.
Conexión Cáncer-Riñón
La ERC y el cáncer están conectados en una doble dirección. El cáncer puede afectar al riñón bien a través de las llamadas nefropatías paraneoplásicas como son las lesiones glomerulares fundamentalmente [3] o como consecuencia de los efectos tóxicos de la medicación o radiación, [4] [5] o tras la reducción de masa renal tras la nefrectomía por cáncer renal [6]. En sentido opuesto, los pacientes que precisan tratamiento sustitutivo de la función renal con diálisis [7] y particularmente con trasplante renal [8] son de alto riesgo para la aparición de cáncer debido a la situación de inmunosupresión que generan estas situaciones.
Consultas de Oncología a Nefrología
Si analizamos los motivos de consultas cada vez más frecuentes de pacientes con cáncer a Nefrología encontraremos una gran cantidad de complicaciones o problemas renales que motivan esta consulta:
- Insuficiencia Renal Aguda por diversos motivos: nefrotoxicidad de la quimioterapia (necrosis tubular, microangiopatía trombótica, nefropatía intersticial aguda), factores hemodinámicos (sepsis), procesos obstructivos, etc.
- Proteinuria en rango nefrótico como consecuencia de determinados cánceres (Enfermedad de Hodgkin, leucemias, Mieloma Múltiple, Cáncer de colon, pulmón ...). asociados a Lesiones Glomerulares mínimas, Hialinosis segmentaria y focal o nefropatía membranosa. Podríamos resumir la patología glomerular asociada al cáncer en lo siguiente [9]:
El tratamiento del cáncer puede conducir a la resolución del proceso glomerular.
La nefropatía membranosa se ha asociado clásicamente con tumores sólidos.
La enfermedad por cambios mínimos se ha descrito comúnmente con neoplasias malignas hematológicas, especialmente linfoma de Hodgkin.
La glomerulonefritis membranoproliferativa es cada vez más reconocida como asociado con neoplasias malignas hematológicas crónicas como la leucemia linfocítica crónica.
- Lesiones relacionadas con el tratamiento quimioterápico con diferentes fármacos: Interferón, Lenalidomida, Pamidronato, Antraciclinas inhibidores mTOR o manifestaciones renales con nuevas terapias cuyo efecto a nivel renal no es aún bien conocido como antiEGFR, anti VEGF, anti PD1 y PDL1 o CAR T Cells, etc y que se desarrollan más adelante:
- Trastornos hidroelectrolíticos como: hiponatremia, hipopotasemia, hipomagnesemia, hipofosfatemia, problemas de alteración acido-base, trastornos del calcio y metabolismo mineral.
- Problemas relacionados con dosis y tiempos de quimioterapia en pacientes con ERC y en diálisis.
- Consenso sobre trasplante renal en paciente con cáncer o donante renal con cáncer.
El paciente oncológico y la lesión renal aguda poscontraste
Lesión renal aguda poscontraste yodado
De especial interés es la Nefropatía inducida por contraste yodado en el paciente con cáncer [10]. Estos pacientes son sometidos con frecuencia a exploraciones que requieren uso de contrastes yodados para control de la progresión de su enfermedad. La dosis acumulativa de contraste yodado con procedimientos repetidos aumenta el riesgo de lesión renal y reduce la supervivencia [11]. En un trabajo publicado por Hong et al, se demostró la asociación entre la necesidad de la realizar un TC con contraste y la lesión renal aguda secundaria a este procedimiento odds ratio (OR) 4.09 (IC 95% 1.34-12.56) [12].De hecho en las guías KDIGO, se recomienda retrasar la exposición repetida durante 48 horas en pacientes sin factores de riesgo para lesión renal aguda inducida por contraste y durante 72 h en aquellos con diabetes mellitus o ERC preexistente. Si se desarrolla una disfunción renal aguda después de la administración de contraste, la exposición repetida preferiblemente debe retrasarse hasta que el nivel de creatinina sérica haya regresado al valor basal [13].
Por otra parte hay un área aún no suficientemente explorada en Nefrología relacionada con la Reserva Funcional Renal (RFR) que puede estar alterándose con agresiones de contraste repetidas sin variación en la función renal. La RFR se estudia con una sobrecarga proteica o perfusión de aminoácidos que eleva el filtrado glomerular en personas sanas. Cuando hay un daño renal, la pérdida del filtrado glomerular se compensa por nefronas intactas y por el uso de la reserva funcional renal de manera que no se eleva la creatinina. Sin embargo, la reparación completa y la vuelta a la condición basal no está garantizada. El daño renal puede destruir un número variable de nefronas y en una persona con una RFR intacta, pueden perderse hasta un 50% de las nefronas sin ningún impacto en el filtrado glomerular basal o en la creatinina sérica. Cuando hay una agresión renal repetida (descompensación de insuficiencia cardiaca, isquemia/reperfusión, uso de contraste yodado o fármacos nefrotóxicos) se pierde la RFR resultando en progresión de la enfermedad renal crónica. Por tanto, en ausencia de elevación de la creatinina sérica no puede descartarse lesión renal aguda y la posibilidad de daño renal subclínico no puede ser descartado en el futuro [14]. Al igual que la troponina cardiaca es válida en el infarto agudo de miocardio sin elevación del ST son precisos marcadores de daño renal estructural en casos de lesión renal aguda sin elevación de la creatinina sérica. Entre estos biomarcadores o troponinas renales hay que señalar marcadores del ciclo celular, como el inhibidor del tejido urinario de la metaloproteinasa 2 (TIMP-2) y la proteína 7 de unión al factor de crecimiento similar a la insulina (IGFBP-7) comercializados unidos en España.
Por consiguiente la Nefrología debe estudiar con más precisión el daño renal tanto funcional como estructural en un paciente con cáncer sometido a agresiones toxicas medicamentosas y a repetidas exploraciones con contraste yodado con la finalidad de prevenir las consecuencias renales.
Cáncer como factor de riesgo de ERC y ERC como factor de riesgo para el cáncer
Otro de los aspectos en los que las sociedades de Nefrología, Oncología y Hematología deben avanzar conjuntamente , es en el estudio de la asociación entre la ERC y el cáncer como factor de riesgo de uno para el otro y viceversa . Debemos explotar las bases de datos existentes en nuestro país con el objetivo de dar una respuesta actualizada a estas preguntas.
Ya disponemos de cierta información acerca de esta situación. El estudio belga BIRMA, mostró una prevalencia de filtrado glomerular estimado (FGe) por MDRD inferior a 60 ml/min/1.73 2 en un 18% de los pacientes con cáncer [15]. En otras series por países, la situación es similar. En Estados Unidos, encontramos un 22 % de disfunción renal crónica en pacientes con cáncer [16], un 25% en Japón [17) y un 15,5% en Austria [18]. En uno de los pocos estudios realizados en España, se analizó a 594 pacientes hospitalizados en Oncología, encontrando que un 18,2% de los pacientes presentaban un FGe por MDRD < 60 ml/min/1.73m2 [19]. En cualquier caso, es evidente que precisamos de estudios epidemiológicos con mayor número de pacientes para conocer la verdadera prevalencia de ERC en pacientes con cáncer.
También es preciso conocer si la ERC es un factor de riesgo para el cáncer. Por un lado, en un meta-análisis de 32.057 participantes no se observó ninguna asociación entre la ERC y el riesgo de cáncer, aunque sí hubo evidencia de una mayor asociación entre los pacientes en diálisis y la presencia de determinados tipos de cáncer, como el de tracto urinario, endocrinos y digestivo [20]. La prevalencia de cáncer en pacientes trasplantados es muy superior [21] y de hecho la SEN ha elaborado un documento de consenso sobre su prevención [22]. En la actualidad, en nuestras unidades de trasplante renal se trasplanta a población cada vez más añosa, por lo que el cáncer constituye una de las complicaciones más importantes, tanto en los pacientes que son candidatos a trasplante renal como en los pacientes que ya lo han recibido. De hecho, los datos del registro ANZDATA (Australia y Nueva Zelanda) muestran que, durante los últimos años, el cáncer se ha convertido en una causa de mortalidad tan frecuente como la de origen cardiovascular en la población trasplantada renal [23].
Incidencia de ERC tras una Nefrectomía
Con frecuencia las unidades de diálisis reciben pacientes que han sido sometidos a nefrectomía por cáncer renal. En un estudio publicado por Kim et al, se demostró que hasta el 22% de los pacientes con tumores renales tenían FGe inferior de 60 mL/min per 1.73 m² antes de la nefrectomía [24]. Las dos opciones quirúrgicas nefrectomía radical o nefrectomía parcial ("nephron-sparing surgery") no se diferencian en términos de evolución oncológica pero sí en la incidencia postoperatoria de ERC y complicaciones cardiovasculares [25]. Es por ello que las sociedades americana y europea de Urología han respaldado la nefrectomía parcial como nuevo estándar de tratamiento para tumores restingidos al órgano ≤ 4 cm (T1a) y sugirieron que se considere una opción viable para pacientes con tumores > 4 pero ≤ 7 cm (T1b) [26] [27].
Para la SEN es muy importante analizar la epidemiología y evolución de aquellos pacientes nefrectomizados (o simplemente que inicien diálisis con un tumor activo) en lo que se refiere a incidencia de inicio de tratamiento renal sustitutorio con este antecedente, tratamientos antineoplásicos y tolerancia así como supervivencia.
Arsenal Terapéutico frente al Cáncer: Agentes diana e Inmunoterapia
Efectos renales adversos de la Inmunoterapia
La evolución del tratamiento del cáncer tiene una rapidez inusitada. Tanto es el ritmo de avances terapéuticos que es difícil para el especialista de Nefrología una actualización constante de sus indicaciones y efectos secundarios. Básicamente, además de la quimioterapia convencional sobre la que ya tenemos experiencia (cisplatino, metotrexate, melfalan, ciclofosfamida, etc) existen otras modernas aproximaciones terapéuticas que se dirigen a una diana concreta (Targeted Therapy). Tal tratamiento se dirige a las moléculas que son esenciales para la supervivencia de las células cancerígenas. La terapia molecular tiene como ventaja más relevante la selectividad de la diana terapéutica que lo diferencia de la quimioterapia y la radioterapia al no afectar al tejido sano circundante. Esto reduce significativamente el riesgo de que se produzcan efectos secundarios.
Hoy, en su mayor parte, todos los pacientes con el mismo tipo de cáncer no son necesariamente tratados con los mismos medicamentos o procedimientos. La terapia molecular dirigida creará un sistema personalizado de terapia en el cual los pacientes son tratados en base a la estructura molecular única de su cáncer específico. Empleando como pilar fundamental las tinciones del tejido, los médicos pueden ver qué moléculas objetivo están presentes en el cáncer del paciente y determinar qué fármacos administrar.
Agentes Diana
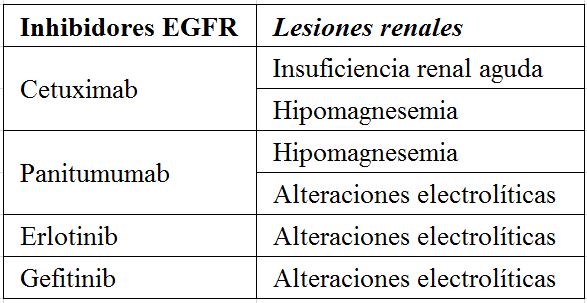
- Agentes diana contra EGFR (Epidermal Grow Factor receptor inhibitors) ligandos: La activación de la familia ErbB (incluyendo EGFR o HER1, HER2, HER3, and HER4) estimula el crecimiento y la progresión del tumor, incluyendo la promoción de la proliferación, la angiogénesis, la invasión, la metástasis y la inhibición de la apoptosis. El enfoque más clínicamente avanzado para la inhibición de EGFR incluye el uso de anticuerpos monoclonales (mAbs) dirigidos contra el dominio extracelular de EGFR (Cetuximab, Panitumumab) o HER2 (trastuzumab) y el uso de inhibidores (TKI) dirigidos contra el dominio intracelular de la tirosina quinasa (Gefitinib, Erlotinib, Lapatinib, Canertinib) [28]. El EGFR unido a su receptor activa el canal renal de magnesio en el tubulo contorneado distal estimulando la absorción de magnesio por lo que estos compuestos antiEGF se asocian a hipomagnesemia y como consecuencia trastornos hidroelectrolíticos secundarios como hipocalcemia e hipopotasemia fundamentalmente.
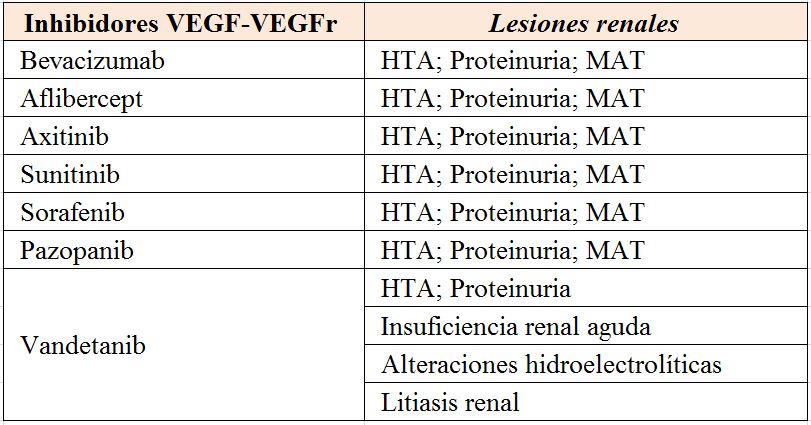
- Agentes diana contra VEGF. Fármacos antiangiogénicos: La angiogénesis, formación de nuevos vasos sanguíneos a partir de los preexistentes, desempeña un papel central en el proceso de crecimiento tumoral y metástasis. La proliferación del endotelio y la formación de nuevos vasos sanguíneos aumentan el tamaño de los tumores sólidos. Se espera que el bloqueo de la angiogénesis sea un enfoque terapéutico eficaz contra muchos tipos de tumores. El sistema de señalización clave que regula la proliferación y migración de células endoteliales es el factor de crecimiento del endotelio vascular (VEGF) y sus receptores (VEGFR-1, -2 y -3).
En la actualidad entre estos fármacos tenemos el inhibidor de la angiogénesis bevacizumab que se dirige al factor de crecimiento endotelial vascular y varios inhibidores de la tirosina cinasa (TKI), como sunitinib, sorafenib, pazopanib y axitinib. El uso de estas terapias dirigidas puede inducir daño tanto glomerular (proteinuria desde leve a severa, microangiopatía trombótica) como tubular (Insuficiencia renal aguda) debido a que el VEGF y otros también se expresan en la nefrona normal manteniendo la barrera de filtración y la integridad endotelial glomerular [29].
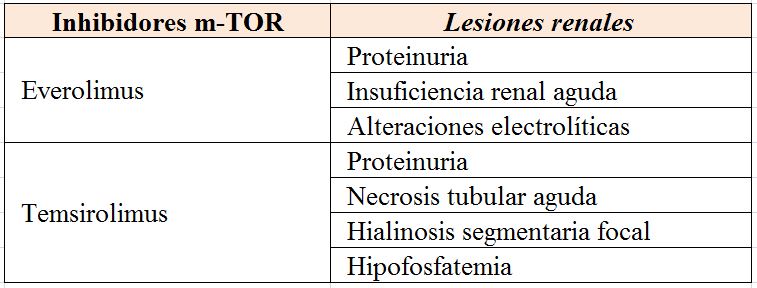
- Agentes contra mTOR (imTOR): Se trata de una proteína que ayuda a controlar varias funciones celulares, incluso la regulación del crecimiento, proliferación y muerte celular. Dado que la actividad de esta proteína está aumentada en algunos tipos de cáncer, se considera como una diana terapéutica y se han estudiado varios fármacos para inactivar su función, entre ellos el Temsirolimus que se emplea en el tratamiento del carcinoma renal. Everolimus y Sirolimus son muy conocidos en Nefrología por su utilización para evitar el rechazo tras el trasplante renal por su capacidad de reducir la respuesta inmunitaria [30].
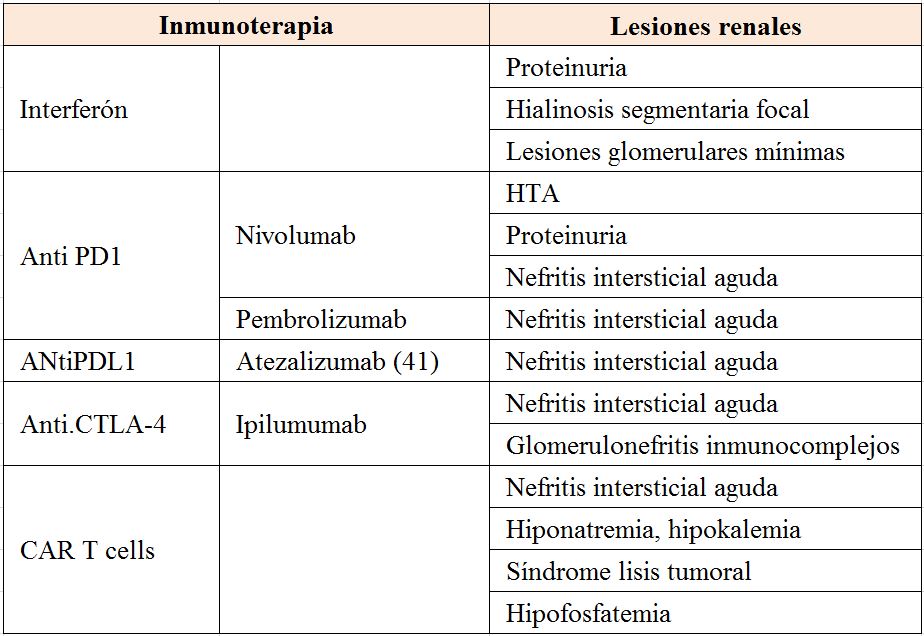
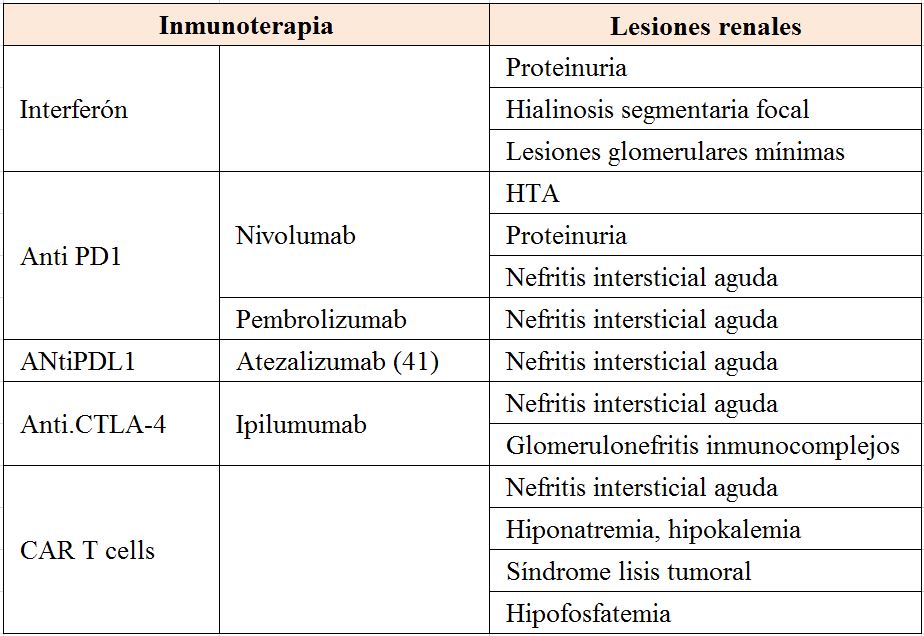
- Agentes contra PD-1, PD-L1 y CTLA-4: Cuando los receptores de los linfocitos T reconocen los antígenos de superficie que identifican a una célula como cancerosa, éstos se activan para eliminarla. Pero cuando una célula T es activada, también es necesaria una señal de stop que asegure que no se producirá una sobreactivación. Una de las vías por las que se regula esta activación de los linfocitos T es mediante receptores de inhibición como el PD-1 (receptor de muerte programada) y el CTLA-4 (cytotoxic T-lymphocyte associated antigen) presentes en la superficie de las células T.
Tras la activación, los linfocitos T aumentan la expresión del receptor PD-1 y CTLA-4 que les permitirá recibir la señal de desactivado. Esta señal se producirá tras la unión de este receptor a su ligando PD-L1 o PD-L2, o B7-1/B72 que normalmente se expresan en la superficie de células dendríticas y macrófagos, y que provocará la reducción de la producción de citoquinas y la supresión de la proliferación de las células T.
Y es precisamente este mecanismo el que han integrado multitud de tumores con el fin de bloquear el reconocimiento de los mismos mediante la expresión en su superficie de las proteínas PD-L1 y PD-L2 o B7 ligandos logrando escapar así de la acción del sistema inmune y continuar proliferando. La ruta PD-1/PD-L1 y CTLA-4 representa, por tanto, un mecanismo de resistencia inmune adaptativa que desarrollan las células tumorales en respuesta a la actividad anti-tumoral endógena.
Explicado de una forma sencilla el linfocito T tiene el receptor PD1 y el tumor tiene el ligando PDL1. Entonces cuando el linfocito T va atacar al tumor y este ligando y receptor se unen, hay una inhibición de la actividad del linfocito y el linfocito no puede destruir al tumor. Básicamente esta interacción entre PD1 del linfocito y el PDL1 del tumor causa que el tumor esté protegido y que el linfocito no lo pueda atacar. Los inhibidores de checkpoint bloquean el receptor del linfocito o bloquean el ligando del tumor, de manera que estos dos no se encuentren y si no se encuentran el linfocito va a destruir el tumor. Por eso es tan importante la inhibición de esta interacción. Gracias a la tecnología, ahora tenemos más de 7 anticuerpos de diferentes casas farmacéuticas que inhiben el PD1 del linfocito o inhiben el PDL1 del tumor y de esa forma el linfocito puede destruir el tumor y causar una regresión del cáncer.
La inhibición de las vías de "checkpoint" inmune ha llevado a la aprobación de varios medicamentos nuevos: ipilimumab (anti-CTLA-4), pembrolizumab (anti-PD-1) y nivolumab (anti-PD-1) [31].
- Agentes contra B-RAF-MEK: BRAF es un protooncogén perteneciente a la familia raf/mil de serina/ treonina proteína quinasa. Es el gen más común asociado con mutaciones en el melanoma maligno , que ocurre en 40% a 50% de los pacientes. La activación resultante de la proteinquinasa activada por mitógeno (MAPK) conduce a la oncogénesis a través de la estimulación del crecimiento celular y la inhibición de la apoptosis. Los ensayos clínicos han demostrado una mediana de supervivencia libre de progresión de aproximadamente 12 meses con la combinación de un inhibidor de BRAF dirigido con un inhibidor de MEK.
En la actualidad han sido aprobados por la FDA para el tratamiento del BRAF-mutated melanoma [32]:
- Inhibidores del BRAF: Vemurafenib, Dabrafenib.
- Inhibidores del MEK: Trametinib, Cobimetinib.
- Agentes inhibidores del PARP (poli (ADP-ribosa) polimerasa): Se trata de una sustancia que bloquea una enzima en las células llamada PARP. PARP ayuda a reparar el ADN cuando se daña. El daño en el ADN puede ser causado por muchas causas, incluida la exposición a la luz ultravioleta, radiación, ciertos medicamentos contra el cáncer u otras sustancias en el medio ambiente. En el tratamiento del cáncer, el bloqueo de PARP puede ayudar a evitar que las células cancerosas reparen su ADN dañado, causando su muerte.
Los inhibidores de PARP, un tipo de terapia dirigida, parecen mejorar la supervivencia libre de progresión en mujeres con cáncer de ovario recurrente sensible al platino, como lo demuestra principalmente la adición de olaparib al tratamiento convencional. Otros fármacos de este grupo son iniparib, rucaparib, veliparib, etc.
Además de su uso en la terapia del cáncer, los inhibidores de PARP se consideran un tratamiento potencial para las enfermedades agudas que amenazan la vida, como el accidente cerebrovascular y el infarto de miocardio, así como para las enfermedades neurodegenerativas a largo plazo [33].
- Agentes inhibidores de las ciclinas: Cuando las células se incorporan y avanzan a lo largo del ciclo celular son controladas por variaciones en los niveles y grado de actividad de las ciclinas. Las ciclinas realizan sus funciones formando complejos con proteínas estructurales denominadas cinasas dependientes de las ciclinas (CDK).
La ciclina B/CDK1 controla el paso de la fase G2 a la fase M2. Cuando la célula entra en fase G2, se sintetiza ciclina B y se une a CDK1, formándose el complejo ciclina B/CDKI, cuya actividad es indispensable para que las células pasen a la fase M. Este complejo se activa por fosforilización y la cinasa activa fosforila a varias proteínas involucradas en mitosis y replicación de DNA.
Los inhibidores de ciclinas son una nueva vía terapéutica hormonal contra el cáncer de mama HR+/HER2-, metastásico o localmente avanzado, que reduce la progresión de la enfermedad mediante la inhibición del ciclo celular, inhibiendo las quinasas dependientes de ciclinas, es decir, la activación o control de la proliferación de las células. Ribociclib, Abemaciclib y Palbociclib van dirigidos a las ciclinas 4 y 6 (CDK4/6) [34].
Inmunoterapia
Efectos renales adversos por inhibidores del check-point (ICP) en pacientes con cáncer. Recomendaciones del grupo de Onconefrología de la Sociedad Española de Nefrología (SEN)
Es una de las más importantes revoluciones en la historia de la Medicina. La inmunoterapia, también denominada terapia biológica, es un tipo de tratamiento para el cáncer que estimula las defensas naturales del cuerpo a fin de combatir el cáncer. Utiliza sustancias producidas por el cuerpo o fabricadas en un laboratorio para mejorar o restaurar la función del sistema inmunitario.
Hay diferentes tipos de Inmunoterapia
a.- Mejorando el sistema inmunológico y haciéndolo más fuerte
a1: Vacuna: Identificando las proteínas mutadas del tumor se crean pequeños neoantígenos que inyectados por vía intravenosa activan a las células T en su lucha contra antígenos específicos tumorales.
a2: Terapia celular adoptiva. CAR-T cell : Se toman muestras de las células T de un paciente y se cultivan en el laboratorio. Este procedimiento aumenta el número de células T capaces de destruir células cancerosas o combatir infecciones. Estas células T se devuelven al paciente para ayudar al sistema inmunitario a combatir las enfermedades.
Una forma de terapia celular adoptiva es la terapia de células T y CAR (receptores de antígeno quimérico Car T cells ). Esta terapia requiere extraer sangre de los pacientes y separar las células T. Después de eso, utilizando un virus desarmado, las células T se modifican genéticamente para producir receptores en sus superficies llamados receptores de antígenos quiméricos. Estos receptores sintéticos permiten que las células T reconozcan y se unan a una proteína específica, en este caso, un antígeno tumoral. Estas células T diseñadas se expanden en cientos de millones en una instalación de fabricación de células. Finalmente, las células CAR-T se infunden en el paciente (precedidas por un régimen de quimioterapia de linfodepleción). Estas células CAR-T pueden atacar selectivamente y matar células que expresan el antígeno tumoral . No está exento este tratamiento de efectos secundarios serios como el síndrome de liberación de citoquinas o el síndrome de lisis tumoral [35]. Una terapia de células T y CAR fue aprobada en agosto de 2017 para el tratamiento de niños con leucemia linfoblástica aguda (LLA). Una segunda terapia será aprobada próximamente para adultos con linfomas avanzados.
a3: Factores estimulantes: Una tercera técnica de "enhancement" es utilizar factores estimulantes como las citoquinas que producen estimulación de las células T que se multiplican y se hacen más fuertes.
a4: Anticuerpos: La terapia basada en anticuerpos para el cáncer se ha establecido durante los últimos 15 años y ahora es una de las estrategias más exitosas e importantes para los pacientes en tratamiento con neoplasias malignas hematológicas y tumores sólidos.
La muerte de células tumorales usando anticuerpos monoclonales (mAb) puede ser el resultado directo de la acción del anticuerpo (a través del bloqueo del receptor, por ejemplo), mecanismos de respuesta inmune de muerte celular, o efectos específicos de un anticuerpo en la vasculatura y estroma tumoral.
Los antígenos tumorales que se han utilizado con éxito incluyen el EGFR, ERBB2, factor de crecimiento endotelial vascular (VEGF), CTLA4, CD20, CD30 y CD52. Las bases de datos serológicas, genómicas, proteómicas y bioinformáticas también se han utilizado para identificar antígenos y receptores que se sobreexpresan en poblaciones de células tumorales o que están vinculados a mutaciones genéticas identificadas como impulsoras de la proliferación de células cancerígenas [36].
Los conjugados de anticuerpo y fármaco (ADC) es un sistema eficaz de administración de fármacos que utiliza la acción dirigida del anticuerpo junto con la muerte celular por un potente agente citotóxico, unidos entre sí por una molécula enlazadora y ayuda a reducir la toxicidad de las células no diana, garantizar una ventana terapéutica amplia y superar la resistencia a múltiples fármacos [37).
b.- Mediante el uso de medicamentos que ayudan a inhibir el entorno inmunosupresor de los tumores.
Otra estrategia es disminuir las defensas de la célula tumoral frente al linfocito T. Por ejemplo, neutralizando con anticuerpos los factores inhibitorios y citoquinas como Anti IL10 y anti TGF beta.
Otra posible estrategia, ya comentada, es disminuir las defensas de la célula tumoral frente al linfocito T con inhibidores del "checkpoint" como anticuerpos anti PDL1 y anti CTLA 4 aprobados por la FDA.
Toxicidad Renal del tratamiento del cáncer
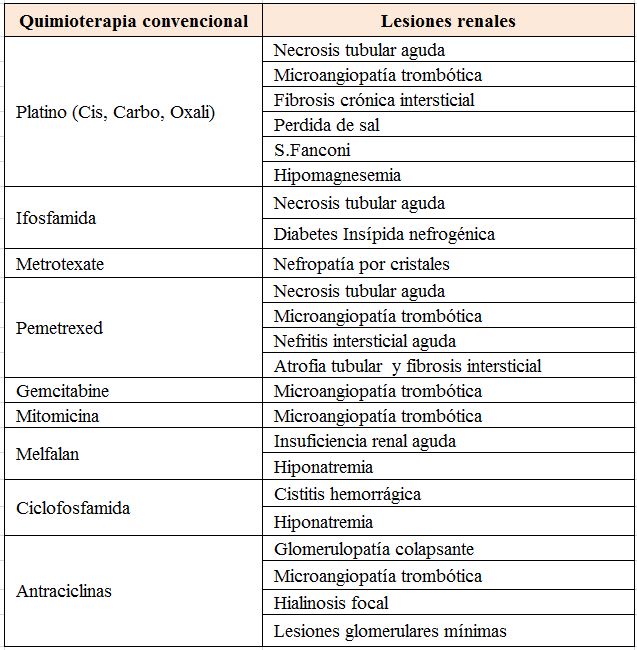
La nefrotoxicidad relacionada con la quimioterapia convencional es conocida desde hace tiempo por oncólogos y nefrólogos. Sin embargo, el enorme crecimiento de tratamientos diana y la moderna inmunoterapia como acabamos de ver, pueden conducir a complicaciones renales agudas o crónicas y trastornos hidroelectrolíticos y ácido-base. Estas complicaciones deben ser conocidas por nefrólogos y oncólogos, no solamente en lo que respecta a la prevención del daño renal y su tratamiento sino también en los aspectos epidemiológicos y farmacoterápicos.
En las (Tabla 1) (Tabla 2) (Tabla 3) (Tabla 4) (Tabla 5) (Tabla 6) expresamos las alteraciones renales más frecuentes asociadas con los diferentes tratamientos frente al cáncer [38] [39].
Los datos epidemiológicos han alumbrado la posibilidad de una consulta específica onconefrológica atendida inicialmente por un equipo multidisciplinar de oncólogos, hematólogos y nefrólogos en hospitales de primer nivel con atención al menos a medio millón de habitantes acompañados en ocasiones de otros especialistas como urólogos, radioterapeutas, patólogos, radiólogos, paliativistas, etc. Se trata de avanzar en la masa critica que atienta a estos pacientes con protocolos de actuación y actividades educativas [40].