Daño renal agudo y crónico en el trasplante de progenitores hematopoyéticos
Palabras clave
Síndrome de lisis tumoral, Síndrome de infusión medular, Trasplantes ABO incompatibles, Efermedad injerto contra huésped, Enfermedad venooclusiva hepática, Microangiopatía trombótica
Introducción
Cada año, unos 50.000 pacientes de todo el mundo se someten a un trasplante de progenitores hematopoyéticos (TPH). El término TPH se usará a lo largo de esta revisión como un término general que incluye el trasplante de células progenitoras de cualquier fuente (médula ósea, sangre periférica, sangre del cordón umbilical) [1]. Los TPH constituyen hoy en día una opción terapéutica para una gran variedad de enfermedades congénitas y adquiridas que afectan a la médula ósea, y además de las clásicas enfermedades hematológicas, también incluye otros trastornos autoinmunes e inflamatorios que son refractarios a las terapias convencionales [2]. Por ello, el número de TPH sigue incrementándose hasta un 20% cada año. En los últimos años, los avances terapéuticos han reducido la mortalidad y han mejorado los resultados tras el trasplante de forma notable [3]. Sin embargo, como cualquier otro tipo de trasplante no está exento de sufrir diversas complicaciones. En esta revisión nos centraremos en el daño renal [4].
Aunque la prevalencia del fracaso renal agudo (FRA) y de la enfermedad renal crónica (ERC) tras un TPH ha disminuido en los últimos años, la lesión renal sigue siendo una complicación que afecta a la calidad de vida y a la mortalidad de los pacientes trasplantados [5]. Aunque la necesidad de diálisis tras el TPH es relativamente infrecuente (entre el 2-5%), generalmente se asocia a un pronóstico sombrío. Las lesiones renales asociadas al TPH incluyen una amplia gama de anomalías estructurales y funcionales, que pueden ser de tipo vascular (hipertensión arterial, microangiopatía trombótica), glomerular (albuminuria, glomerulopatías), y/o tubulointersticial. Las causas de la lesión renal son multifactoriales entre las que se incluyen: el régimen de acondicionamiento quimioterápico, la radiación, la sepsis, la nefrotoxicidad, el síndrome de infusión medular, el síndrome obstructivo sinusoidal hepático, la microangiopatía trombótica (MAT), las infecciones y la enfermedad del injerto contra huésped (EICH) [6]. La frecuencia de este tipo de lesiones, la cronología y los factores de riesgo varían dependiendo de las características del paciente y el tipo de trasplante realizado.
Por lo tanto, la prevención, el diagnóstico precoz y el tratamiento del tipo de lesión renal son esenciales para una rápida respuesta renal y una mejor supervivencia de los pacientes después del TPH, y aprovechar todo el potencial de esta terapia.
Tipos de trasplantes de progenitores hematopoyéticos
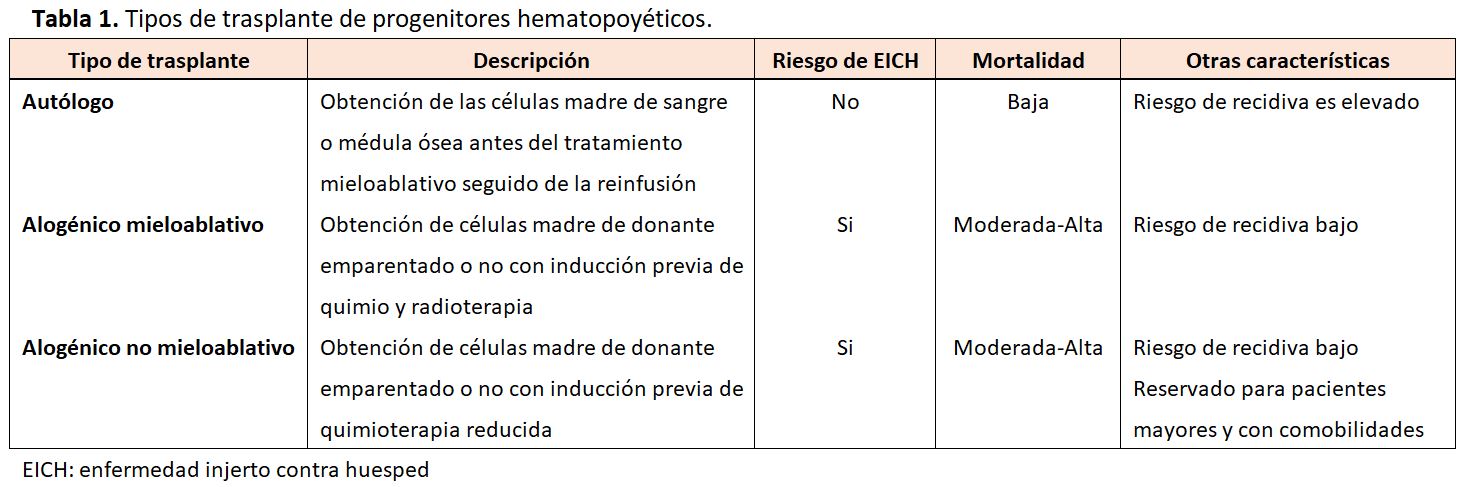
La epidemiología y los factores de riesgo de la lesión renal dependerán de las características del paciente, del tipo de TPH, de los fármacos empleados para su acondicionamiento o de la profilaxis empleada para evitar la enfermedad injerto contra huésped (EICH). Los diferentes tipos de TPH son (Tabla 1):
* El TPH alógenico y el autólogo mieloablativo utilizan regímenes de acondicionamiento con dosis elevadas de fármacos quimioterápicos (ciclofosfamida, busulfán, citarabina) frecuentemente en combinación con dosis elevadas de radioterapia.
* Una forma alternativa es el TPH alogénico no mieloablativo o de intensidad reducida, se usa generalmente para pacientes mayores de 60 años o pacientes con gran comorbilidad. Este procedimiento implica una dosis más baja de quimio-radioterapia.
Es importante resaltar que tanto los trasplantes mieloablativos alogénicos como el alogénico no mieloablativo requieren el uso de inmunosupresión tras el trasplante, a menudo con un inhibidor de la calcineurina (ICN), para prevenir la EICH. El trasplante autólogo no requiere profilaxis de la EICH [7].
Fracaso renal agudo en el trasplante de progenitores hematopoyéticos
Epidemiología
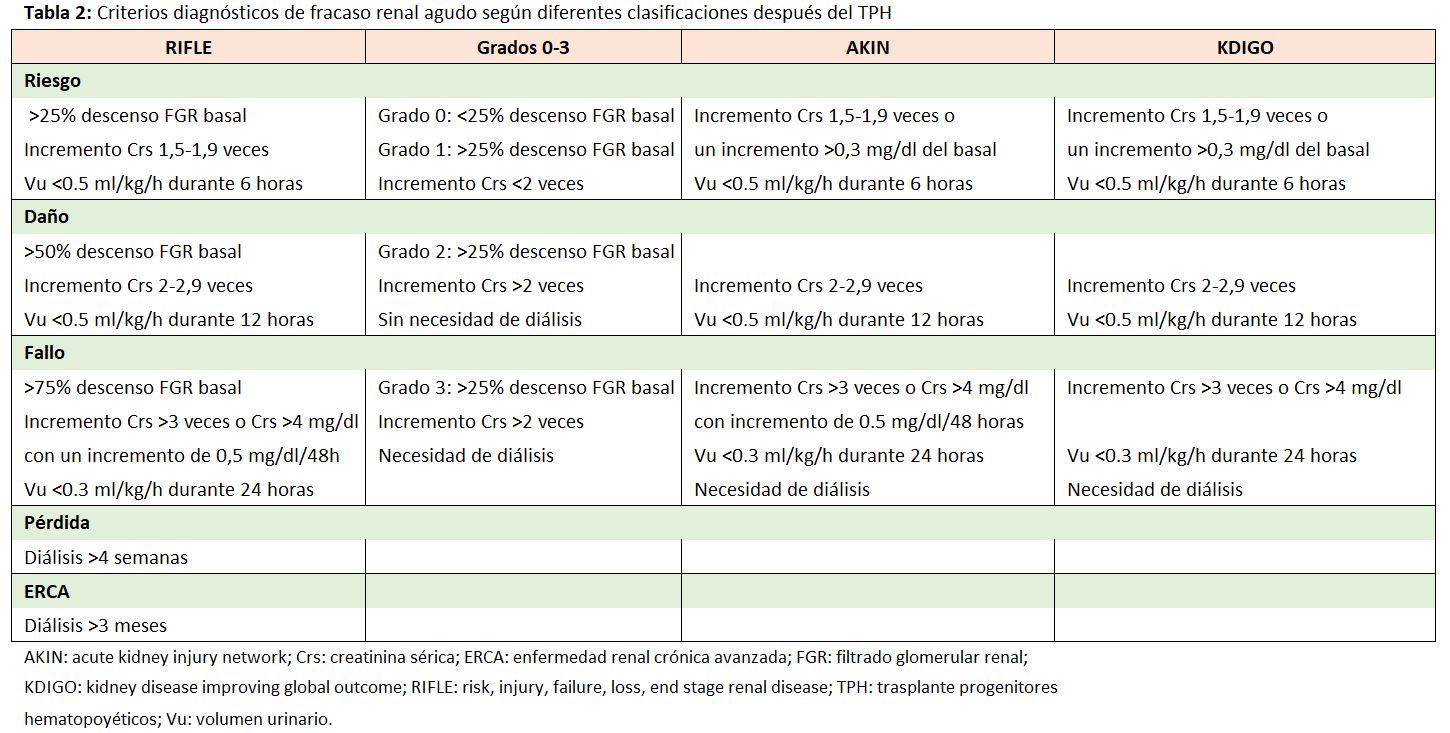
El FRA es una complicación frecuente tras el TPH, con incidencias variables dependiendo de la definición de FRA (incremento de la creatinina sérica, duplicación de la creatinina, descenso del filtrado glomerular renal o el uso de clasificaciones como RIFLE, AKIN, KDIGO) (Tabla 2), el régimen de acondicionamiento quimioterápico (mieloablativo o no mieloablativo) y el tipo de trasplante (alogénico frente a autólogo).
En general, la incidencia del FRA definida por la duplicación de la creatinina sérica (Crs) y/o disminución del 50% del filtrado glomerular renal (FGR) en los primeros 100 días del trasplante, es relativamente común oscilando entre un 50-60%. Algunos autores sitúan la mayor incidencia en las primeras tres semanas del postrasplante [8]. Sin embargo, la incidencia del FRA tras el TPH puede estar disminuyendo. En una revisión retrospectiva de más de 2.500 receptores de TPH del mismo centro, la incidencia de duplicación de la Crs fue significativamente menor durante el período comprendido entre los años 2003 y 2007 en comparación con el período entre 1993 y 1997 (33 vs 50%) [9].
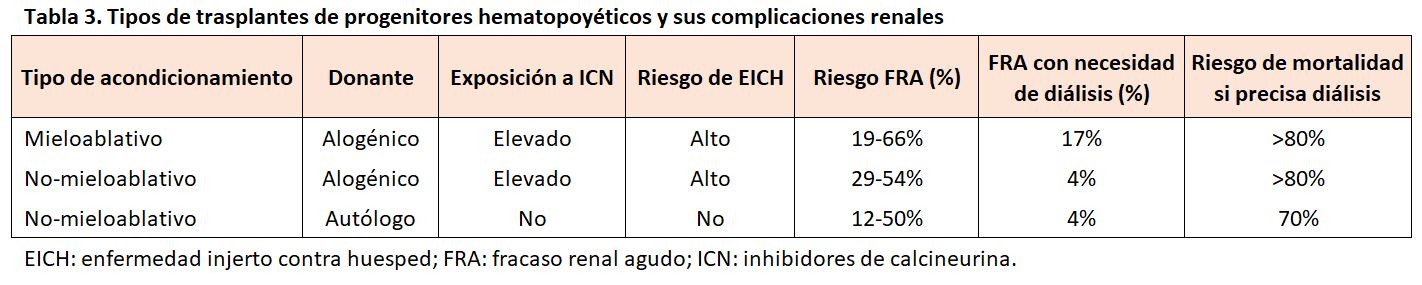
El riesgo de FRA dependerá del tipo de trasplante, los TPH mieloablativos presentan una mayor incidencia de FRA que los no mieloablativos y los TPH alogénicos presentan un mayor riesgo de FRA que los autólogos (Tabla 3). Según estas premisas, revisiones sistemáticas describen una incidencia promedio de FRA grave (definido como una reducción > 50% del FGR y/o duplicación de la Crs sérica o requerimiento de diálisis) del 76% en el TPH alogénico mieloablativo, un 43% en el TPH alogénico no mieloablativo y un 23% en el TPH autólogo. El riesgo de FRA en el TPH mieloablativo fue casi cinco veces mayor que el riesgo con un TPH no mieloablativo después de tener en cuenta la edad y la comorbilidad [7]. En la actualidad, disponemos de una herramienta útil para la predicción del FRA en el TPH, es el denominado índice de comorbilidad del TPH (IC-TPH). Valores de este índice entre 1-2 se asoció con un riesgo 2,4 veces mayor de desarrollar un FRA, mientras que un índice > 3 incrementó el riesgo hasta cinco veces [10].
La gravedad del FRA como la aparición temprana de la lesión renal (dentro de los primeros 30 días después del trasplante) se asocian a un incremento del riesgo de muerte y una disminución de la supervivencia global [11]. Al igual que con la incidencia del FRA, el riesgo de requerir diálisis después del trasplante es muy amplio, con series publicadas que van desde el 0% (TPH autólogo) al 33% (TPH alogénico mieloablativo). Los pacientes con FRA que requieren diálisis en el periodo peritrasplante tiene un peor pronóstico debido a su asociación con coexistencia de fracasos de otros órganos [12]. En un estudio de 88 pacientes sometidos a un TPH alogénico, la necesidad de diálisis se asoció con una mortalidad superior al 80% en los dos primeros meses postrasplante [13]. Sin embargo, la mayoría de los pacientes que presentan un FRA y no requieren diálisis acaban recuperando su función renal previa. Las tasas de mortalidad asociadas al FRA varían según el tipo de TPH, pudiendo alcanzar cifras del 54, 48 y 11% a los 100 días después del TCH autólogo, alogénico mieloablativo y alogénico no mieloablativo, respectivamente [11].
Factores de riesgo
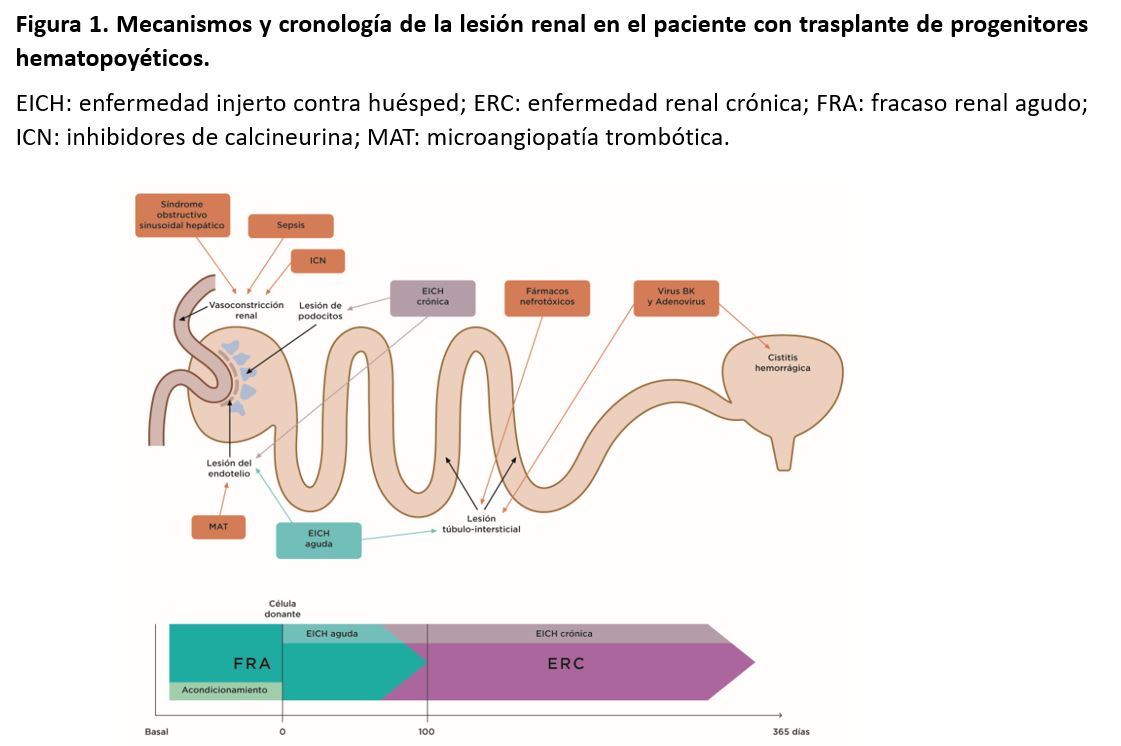
El FRA suele producirse en el primer mes después del trasplante mieloablativo [14]. Durante este primer período postrasplante, los pacientes son más susceptibles de padecer FRA debido a las toxicidades de los fármacos empleado en el acondicionamiento medular, la sepsis, el síndrome obstructivo sinusoidal hepático (SOSH) y otro tipo de nefrotoxicidades (fármacos, contrastes) [1]. Se ha sugerido que la EICH que se produce en los primeros 30 días tras el trasplante también está asociada al FRA [15]. Este síndrome es más frecuente después del trasplante autólogo, pero también puede ocurrir después de un trasplante alogénico mieloablativo y no mieloablativo (Figura 1) [16].
Los factores de riesgo para el desarrollo del FRA tras el trasplante alogénico no mieloablativo son: la diabetes mellitus, el haber recibido más de tres ciclos previos de quimioterapia y el uso de metotrexato para la profilaxis de la EICH [14]. La EICH es un factor de riesgo para el desarrollo del FRA, pero sólo después del día 100. El uso de ciclosporina en pacientes diabéticos incrementa el riesgo de desarrollar un FRA, especialmente en los primeros 100 días postrasplante [17].
Etiología del FRA
Los pacientes que van a recibir un TPH pueden tener patología renal previa debida a diferentes glomerulopatías o diversas comorbilidades o a ambas. La patología glomerular puede aparecer en el contexto de diversas neoplasias hematológicas con una evolución paralela a la remisión de la enfermedad subyacente. Las comorbilidades como la diabetes mellitus y la hipertensión arterial también pueden contribuir al desarrollo de la enfermedad renal [5].
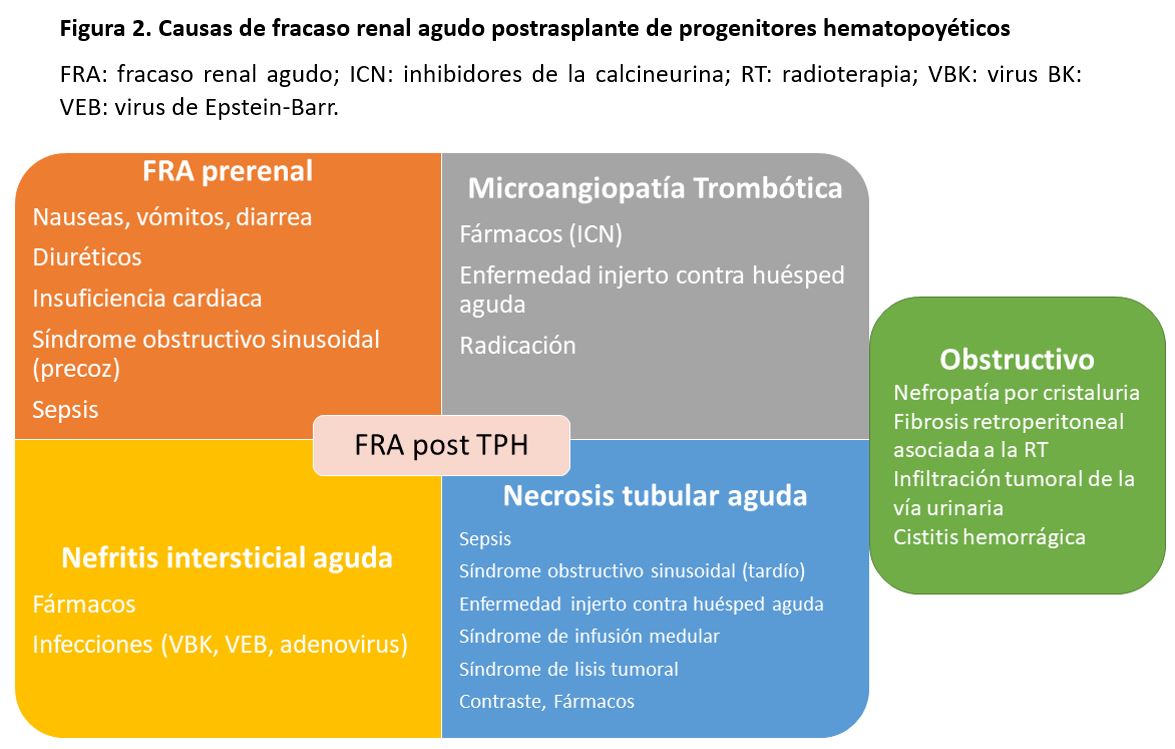
Son múltiples los factores que pueden originar un FRA después del TPH, pero las causas más comunes son la necrosis tubular aguda en el contexto de una sepsis, la administración de fármacos nefrotóxicos, el síndrome de infusión medular, el síndrome de lisis tumoral, y el SOSH o enfermedad venooclusiva (Figura 2) [18].
Sepsis
Los receptores del TPH inmunodeprimidos pueden presentar infecciones que acaben desarrollando una sepsis complicada con FRA [19]. El FRA inducido por la sepsis se produce como consecuencia de la vasodilatación sistémica con hipotensión e hipoperfusión renal, lesión tubulointersticial y la disfunción endotelial intrarrenal con trombosis capilar [20]. Los fármacos nefrotóxicos, como los aminoglucósidos y la vancomicina (a menudo en combinación con piperacilina-tazobactam), pueden contribuir al FRA relacionado con la sepsis. El 75% de los pacientes trasplantados que precisan ingresar en una unidad de cuidados intensivos acaban desarrollando un FRA y la tasa de mortalidad en los que requieren tratamiento renal sustitutivo alcanza el 95% [21]. Por lo tanto, el diagnóstico y el tratamiento precoz de las infecciones son cruciales para la prevención del FRA.
Fármacos nefrotóxicos
Varios agentes antimicrobianos son causas bien conocidas de FRA; los mecanismos incluyen la lesión renal directa y las respuestas alérgicas idiosincrásicas que conducen a una nefritis intersticial aguda. Algunos ejemplos de la toxicidad farmacológica lo encontramos con los aminoglucósidos, las sulfamidas, el ciprofloxacino, el aciclovir, la anfotericina B y los ICN como la ciclosporina o el tacrolimus [6]. La nefrotoxicidad de los ICN es similar a la que encontramos en otro tipo de trasplantes de órganos. Por este motivo, es fundamental la monitorización de los niveles de los ICN y de la función renal para la detección precoz del FRA. La vasoconstricción renal temprana inducida por estos agentes se ve notablemente potenciada por la terapia concurrente con otros fármacos como la anfotericina B, y puede estar indicada una reducción temporal de la dosis o la suspensión del tratamiento si se produce un FRA. En los casos de administraciones prolongadas de los ICN deberíamos pensar en la nefrotoxicidad crónica de estos fármacos [22].
Síndrome de lisis tumoral
Se trata de una complicación poco frecuente después del TPH, ya que la neoplasia suele eliminarse en el momento del trasplante. Cuando se produce, el FRA es el resultado del daño renal relacionado con las citoquinas, la lesión tubular inducida por cristales (hiperuricemia/hiperfosfatemia), o la nefrotoxicidad relacionada con el ácido úrico [23]. En los pacientes de alto riesgo están indicadas las estrategias preventivas, como la administración de sueroterapia, la alcalinización y el tratamiento farmacológico con alopurinol o rasburicasa (0.2 mg/kg/día) [24]. El tratamiento renal sustitutivo (TRS) está indicado sólo como último recurso en los trastornos electrolíticos graves.
Síndrome de infusión medular
El proceso de preservación de las células madre incluye la exposición a diversos crioprotectores, como el dimetil sulfóxido que puede provocar la lisis de los granulocitos y los glóbulos rojos. La infusión posterior de glóbulos rojos lisados durante el trasplante puede originar fiebre, vómitos y tendencia a la hipotensión dentro de las primeras 24-48 horas siguientes al trasplante. El FRA es el resultado de la vasoconstricción renal, la citotoxicidad directa de la hemoglobina con la formación de cilindros intratubulares [25].
Trasplantes ABO incompatibles
Los pacientes que reciben un TPH de un donante con una incompatibilidad ABO corren el riesgo de sufrir hemólisis y un FRA debido a la hemoglobinuria [26]. No obstante, estos tipos de trasplantes son generalmente seguros si se presta una atención cuidadosa para minimizar el riesgo de hemólisis.
La enfermedad injerto contra huésped (EICH)
La relación entre la EICH y el daño renal sigue siendo controvertida debido a que existe poca información disponible en la literatura de los hallazgos histológicos renales encontrados en esta entidad. El mecanismo etiopatogénico de la lesión renal está relacionado con la lesión endotelial provocada por el exceso de la liberación de citoquinas proinflamatorias como el factor de necrosis tumoral, la interleucina 6 y TGF-beta [27]. La hipótesis de la lesión inflamatoria está respaldada por la determinación de citoquinas urinarias y de la elafina urinaria, un inhibidor de la serina proteasa endógena producida por las células epiteliales y los macrófagos en respuesta a la inflamación de los tejidos [28]. Los niveles elevados de elafina en la orina se asocian a la presencia de daño renal agudo y crónico. La presencia de elafina en los túbulos distales y colectores, pero no en los glomérulos en los receptores de TPH puede indicar una respuesta local a la lesión del túbulo distal, más que a la filtración de la elafina circulante en el riñón [29].
Los niveles urinarios elevados de interleucina 6, interleucina 15 y la proteína quimioatrayente de monocitos 1 (MCP-1) se asocian al desarrollo de albuminuria y proteinuria a partir del día 100 postrasplante; este hallazgo sugiere la presencia de una inflamación intrarrenal. [30]. Por otro lado, en modelos animales de TPH alogénicos identificaron a partir del día 28 en el riñón, la infiltración de leucocitos del donante, así como de células T CD3+, CD8+, CD4+ y macrófagos CD68+ en el intersticio peritubular. Esta infiltración celular tuvo una expresión histológica en forma de capilaritis peritubular, tubulitis, glomerulitis aguda, y una endarteritis con el correspondiente FRA [3].
El síndrome obstructivo sinusoidal hepático (SOSH) o enfermedad venooclusiva hepática
Es una causa frecuente de FRA en el paciente con TPH. El SOSH se asocia más comúnmente con el TPH alogénico mieloablativo que con el TPH autólogo [31]. Los criterios diagnósticos del SOSH (Seattle o Baltimore) incluyen hepatomegalia dolorosa, hiperbilirrubinemia y ganancia de peso y/o ascitis. Su incidencia oscila entre el 2-31% y suele aparecer dentro de los primeros 30 días postrasplante. El deterioro de la función renal comienza después del inicio de la enfermedad hepática. Los pacientes con una concentración de bilirrubina plasmática > 7 mg/dL tienen un mayor riesgo de necesitar posteriormente diálisis [25]. Los factores de riesgo son la edad, la enfermedad hepática previa, la seropositividad para el citomegalovirus y el uso de ciertos fármacos (anfotericina, metotrexato y ciclofosfamida) [32].
La etiopatogenia del FRA en el SOSH continúa siendo incierta, la falta de depuración de las toxinas intestinales y la lesión inducida por la quimio-radiación en las células epiteliales sinusoidales pueden jugar un papel en la génesis de la hipertensión portal, la dilatación vascular esplácnica y la retención de sodio y agua, un cuadro clínico que simula al síndrome hepatorrenal [33]. En el análisis de orina pueden encontrarse cilindros granulosos de color marrón turbio; sin embargo, esta anomalía parece estar inducida por la toxicidad de la bilirrubina más que reflejar la presencia de una necrosis tubular. Los pacientes con SOSH son a menudo resistentes al tratamiento diurético y la recuperación espontánea es probablemente infrecuente. La mortalidad es muy elevada alcanzando el 80% en los pacientes que requieren diálisis [34].
Infecciones
El virus BK y el adenovirus merecen especial atención en el contexto de los pacientes con TPH y lesión renal. Ambos virus se encuentran en portadores asintomáticos y la inmunosupresión puede causar su reactivación en los receptores de TPH, lo que provoca una cistitis hemorrágica, y con menor frecuencia una nefritis intersticial [35].
Microangiopatía trombótica aguda (MAT)
La MAT después del TPH es una complicación con una mortalidad elevada (hasta el 90% en pacientes graves) y con riesgo de desarrollar una ERC en los menos graves. Se ha estimado que la MAT ocurre entre el 10 y el 35% de los pacientes con TPH, especialmente después del trasplante alogénico. La etiopatogenia de la MAT se debe probablemente a la combinación de múltiples factores como la EICH, la radioterapia y los ICN para la profilaxis de la EICH, que causan directamente una lesión endotelial, activan el complemento y alteran la actividad de ADAMTS13. El término MAT define una lesión histológica de arteriolas y capilares que se caracteriza por engrosamiento e inflamación de la pared vascular, desprendimiento de células endoteliales, ensanchamiento subendotelial por acúmulos de proteínas y material de lisis celular, y la presencia de trombos plaquetarios ocluyendo las luces vasculares [36]. El examen histológico del riñón revela una mesangiolisis con lesiones arteriolares y glomerulares necrotizantes y trombos intraglomerulares y arteriolares renales. El riñón es el principal órgano afectado en la MAT, ya que los estudios de autopsia en pacientes con TPH no han identificado trombos sistémicos [37]. El cuadro se caracteriza por la tríada de anemia hemolítica microangiopática no inmune, trombocitopenia y fracaso renal agudo. Los niveles elevados de lactato deshidrogenasa, los valores indetectables de haptoglobina y la presencia de esquistocitos confirman la presencia de hemólisis intravascular. Se observa hematuria, proteinuria y/o fracaso renal agudo (con o sin oligoanuria). La presencia de hipertensión arterial, por sobrecarga de volumen o por lesión vascular, es relativamente frecuente [38].
Entre las posibles etiologías de la MAT, estudios recientes apoyan la posibilidad de que el TPH pueda desenmascarar variantes patogénicas del complemento no diagnosticadas previamente. Estas anomalías de la vía alternativa del complemento pueden predisponer a los pacientes a desarrollar MAT asociadas al TPH (MAT-TPH). Esta afirmación ha sido fruto, de los trabajos de Jodele et al, un estudio con 6 niños con FRA y MAT-TPH, la mayoría presentaban deleción de genes de proteínas relacionadas con el factor H (CFHR3 y CFHR1), 3 de ellos con anticuerpos frente al FH. La respuesta al recambio plasmático fue mala por lo que se inició tratamiento con eculizumab. De los 6 pacientes, 4 alcanzaron niveles plasmáticos terapéuticos de eculizumab y su correspondiente respuesta clínica [39].
La MAT también puede ser una consecuencia de la EICH [40]. Cuando se asocia a la EICH, los pacientes tienden a ser refractarios o resistentes a los esteroides y pueden tener una activación de la vía alternativa del complemento y, por lo tanto, ser susceptibles de ser tratados con los bloqueantes del complemento [41]. El cuadro clásico de microangiopatía trombótica inducida por los ICN es una complicación relativamente rara que se produce poco después del TPH [42]. Por último, debemos recordar que podemos encontrar pacientes con una MAT subaguda o crónica que se manifiesta a los 20 y 100 días después del TPH respectivamente [43]. Estos pacientes presentan una forma más gradual de anemia hemolítica microangiopática junto con trombocitopenia, un análisis de orina que puede ser relativamente normal o mostrar proteinuria y/o hematuria leve, y una elevación moderada de la concentración de Crs.
Procesos glomerulares
Suelen ser una complicación rara del TPH alogénico no mieloablativo. Las lesiones glomerulares se asocian con la reducción o suspensión de la terapia inmunosupresora y puede representar una manifestación humoral de la EICH crónica (> 100 días después del trasplante) en > 80% de los casos [44]. El síndrome nefrótico después del trasplante es muy poco frecuente (con una incidencia de alrededor del 1% aunque puede ser superior con la terapia no mieloablativa) [45]. Por lo general, este síndrome se desarrolla 6 meses después del trasplante y se cree que está relacionado con alteración de la inmunosupresión y con la EICH crónica [44]. Los procesos glomerulares más frecuentes son: la nefropatía membranosa (70% de los casos) y la nefropatía por cambios mínimos (20%) [46]. Mientras que el 90% de los pacientes con nefropatía por cambios mínimos logran una remisión completa, sólo entre el 27 y el 63 % con una nefropatía membranosa muestran una remisión parcial o completa [44]. Entre las posibles opciones de tratamiento, incluyen los esteroides, los ICN, la ciclofosfamida, el micofenolato mofetil y el rituximab [47].
Biomarcadores para el diagnóstico del FRA
La Crs es un marcador tardío de la lesión renal, por este motivo el diagnóstico del FRA asociado al TPH también lo es. Estudios recientes han analizado el papel de los nuevos biomarcadores que permiten predecir el FRA en este grupo de pacientes con TPH (elafina, urinary liver-type fatty acid binding protein (L-FABP), urinary alpha 1M). De todos ellos, la elafina es una proteína producida por las células epiteliales que juega un papel en la inmunomodulación y regulación de la proliferación celular. Es un marcador conocido de la EICH de la piel, los niveles elevados de elafina urinaria están asociados con el posterior desarrollo de albuminuria, FRA y progresión de la ERC en los receptores de un TPH [29].
Evaluación de la disfunción renal en el paciente con TPH
La evaluación inicial de un paciente con TPH y disfunción renal (elevación de la Crs) debe estar enfocado en la búsqueda de la causa subyacente. Es importante disponer de un análisis de orina, una relación albúmina-creatinina, un recuento sanguíneo completo con evaluación del frotis sanguíneo, y niveles de lactato deshidrogenasa sérica, haptoglobina y de los ICN. También es importante determinar la carga viral del BK y del adenovirus. Por último, debemos disponer de una prueba de imagen mediante la ecografía renal y finalmente valorar la realización de una biopsia renal si las circunstancias clínicas del paciente lo permiten [1].
La albuminuria es un marcador de disfunción endotelial y de inflamación. En los pacientes que han recibido un TPH la presencia de albuminuria en los primeros 100 días después del trasplante está asociada a un incremento del riesgo de muerte en el primer año postrasplante. La albuminuria y la hipertensión arterial también se han identificado como marcadores tempranos de microangiopatía trombótica en estos pacientes [30].
Prevención y tratamiento del FRA
Después de todo lo expuesto, está claro que nuestros esfuerzos deben ir encaminados a la prevención del daño renal con un control estricto del balance hídrico y de la presión arterial. Por otro lado, debemos individualizar la dosificación de los fármacos que se empleen con un ajuste según superficie corporal, función renal y niveles plasmáticos de fármacos.
Medidas generales
Un balance hídrico equilibrado es fundamental para la prevención del FRA postrasplante, por lo que el peso, la presión arterial y la diuresis deben controlarse regularmente en todos los pacientes. Los medicamentos nefrotóxicos y los contrates deben utilizarse con precaución, aunque lo mejor es evitarlos (Tabla 4).
Recientes avances en el mundo del TPH han permitido reducir el riesgo de FRA debido al uso de estrategias terapéuticas sin ICN como profilaxis de la EICH; y el uso de fármacos más personalizados que se sustentan en las características específicas del paciente, los niveles del fármaco y la determinación de polimorfismos implicados en el metabolismo de este [48].
El TRS debe iniciarse en los casos de sobrecarga de líquidos refractaria al tratamiento diurético o en los casos de alteraciones graves de electrolitos. Hay evidencias científicas que sugieren que las técnicas convectivas continuas son preferibles en este en este tipo de pacientes [49].
Medidas específicas
Síndrome de infusión medular
Entre las medidas preventivas de la nefropatía por la hemoglobinuria del síndrome de infusión medular se incluyen la alcalinización urinaria y la diuresis inducida por manitol [50]. El síndrome de infusión medular puede tratarse con éxito con la administración temprana de esteroides [51].
Síndrome de obstrucción sinusoidal hepática.
Además de restricción de líquidos y sodio, la administración de albúmina junto con terlipresina o el tratamiento precoz con defibrotide, un agente antitrombótico y fibrinolítico, son en la actualidad las opciones terapéuticas que podemos emplear en este síndrome [52].
MAT aguda.
El tratamiento inicial consiste en la retirada de agentes potencialmente desencadenantes (ICN), control de complicaciones asociadas (infecciones, EICH) y una adecuada terapia antihipertensiva. No hay datos convincentes que apoyen la eficacia del recambio plasmático en los pacientes que desarrollan MAT tras el TPH [53]. Otras intervenciones, como la administración de rituximab, trombomodulina recombinante, defibrotide y la pravastatina en combinación con el limaprost han demostrado resultados favorables, sin embargo, se desconoce el mecanismo de actuación de este tipo de terapias [54][55]. La implicación del complemento en la patogénesis de la MAT asociada al trasplante ha permitido el uso de eculizumab con resultados claramente beneficiosos [56]. Es importante señalar que la dosis necesaria para lograr el bloqueo del complemento es mayor que la utilizada en el síndrome hemolítico urémico atípico.
Enfermedad renal crónica en el trasplante de progenitores hematopoyéticos
Epidemiología
Existe un amplio rango en la incidencia de la ERC después de un TPH, del 7 al 48%; esta variabilidad depende de la definición utilizada para la misma, la duración del seguimiento y el tipo de TPH [57]. En este sentido, diversos estudios describen una incidencia de ERC del 4.5% a los 5 años postrasplante, el 7% de los cuales desarrollaron una ERCA y requirieron diálisis. La frecuencia de la ERC aumenta con el tiempo después del TPH y difiere sustancialmente entre los receptores de trasplantes alogénicos (14%) y autólogos (4%) [58]. Hingorani et al. evaluaron recientemente una cohorte prospectiva de 434 adultos a los que se hizo un seguimiento desde el periodo previo al trasplante hasta una mediana de seguimiento de 5 años. Los mayores descensos del FGR se identificaron en el primer año tras el trasplante, con un descenso del FGR desde 98 ml/min/1,73 m2 al inicio del trasplante a 78 ml/min por 1,73 m2 al año. Los investigadores observaron que los pacientes con un FGR < 60 ml/min por 1,73 m2, se asoció un incremento de la mortalidad [17].
La enfermedad renal crónica preexistente
La ERC es una complicación común después del trasplante asociada a una mayor morbilidad y mortalidad [59]. Por otra parte, la presencia de ERC es a menudo un motivo de exclusión en la selección de pacientes que van a recibir un TPH, especialmente en los que van a precisar profilaxis con un ICN para la EICH.
El síndrome mielodisplásico, la leucemia mieloide aguda y el linfoma no Hodgkin son enfermedades de pacientes de edad avanzada con una mayor prevalencia de ERC que en pacientes más jóvenes. La función renal en estos pacientes suele empeorar con la quimioterapia previa y la exposición a fármacos nefrotóxicos. Los regímenes de acondicionamiento no mieloablativo se desarrollaron como modalidades de tratamiento menos tóxicas para pacientes de edad avanzada y con comorbilidades graves, incluida la ERC [6].
Factores de riesgo
La ERC es una complicación a largo plazo del TPH asociada a un amplio abanico de factores como el FRA previo, la edad, un menor FGR pretratamiento, el sexo femenino, el tratamiento del acondicionamiento con fludarabina, la EICH, la exposición a ICN, la MAT, procesos glomerulares, y una amplia variedad de otros factores (Figura 2) [60]. La radioterapia se ha implicado en el desarrollo de la ERC postrasplante como agente causal de una MAT subaguda o crónica [61]. La hipertensión arterial ha sido reconocida como una complicación tardía del TPH, cuya incidencia está relacionada con el desarrollo de la ERC [62]. La albuminuria se ha asociado a la progresión de la ERC y a la disminución de la supervivencia tras el trasplante [63].
Pronóstico
La mortalidad de los pacientes que precisaron diálisis en el contexto de un fracaso multiorgánico fue muy elevada, próxima al 100%. Sin embargo, otro escenario distinto es el de los pacientes que desarrollaron una enfermedad renal crónica avanzada tiempo después del TPH. Estos pacientes tienen una aceptable supervivencia en diálisis y permiten plantearse la opción de recibir un trasplante renal. Existen casos descritos en la literatura en el que el trasplante renal aislado o combinado con un TPH origina un fenómeno de "tolerancia inmunológica" y permite la suspensión del tratamiento inmunosupresor de mantenimiento [64].
Mensajes clave de la afectación renal en los pacientes con TPH
* El FRA se produce en aproximadamente el 50% de los pacientes tras un TPH. La tasa de incidencia es mayor en los pacientes con un TPH alogénico mieloablativo y menor en el autólogo. Aunque el daño renal suele ser leve y transitorio, el FRA puede requerir diálisis y es un factor de riesgo de mal pronóstico.
* El FRA después de un TPH se debe con mayor frecuencia a la necrosis tubular aguda, a la nefrotoxicidad o al SOSH.
* La ERC puede producirse tras un TPH y suele deberse a una forma subaguda o crónica de MAT relacionada con los ICN, la quimioterapia, la EICH o la radiación corporal total.
* El síndrome nefrótico después del TPH es infrecuente. Los tipos histológicos más frecuentes son la nefropatía membranosa o la nefropatía por cambios mínimos y parece estar relacionado con la EICH.
* Los pacientes que requieren diálisis después de un tiempo de evolución del TPH presentan una aceptable supervivencia y pueden beneficiarse de recibir un trasplante renal.