Enfermedad renal en leucemias y linfomas
Las neoplasias de tejidos hematopoyéticos constituyen un amplio grupo heterogéneo de patologías que incluyen los linfomas, las leucemias, las neoplasias linfoproliferativas, las neoplasias de células mastoideas, las neoplasias de células plasmáticas, los tumores histiocíticos y las neoplasias de células dendríticas.
La clasificación más actual es la de la Organización Mundial de la Salud [1][2] revisada en 2016, que clasifica las neoplasias en función de las características clínicas, morfológicas, genéticas e inmunofenotípicas. De forma global, pueden dividirse en neoplasias mieloides (que derivan de células progenitoras de médula ósea), neoplasias linfoides (que derivan de células B y células progenitoras de células B, linfocitos B maduros y linfocitos T maduros) y neoplasias histiocíticas/dendríticas (que derivan de células presentadoras de antígeno o de macrófagos tisulares).
EPIDEMIOLOGÍA DE LOS TUMORES HEMATOLÓGICOS
Los tumores hematológicos, en su conjunto, ocupan el tercer puesto en la clasificación general del cáncer, por detrás de las neoplasias de pulmón y mama [3]. Los linfomas, las leucemias y los mielomas son los más frecuentes, con una incidencia anual en España de 10.000, 6.000 y 3.000 casos respectivamente [4].
Los linfomas ocupan el 5º lugar de los tumores malignos más frecuentes [5]. El linfoma de Hodgkin (LH) constituye el 15% de todos los linfomas, con una incidencia anual en Europa de 2,2/100.000 habitantes [6] y tiene una presentación bimodal, con un pico en jóvenes adultos y otro pico alrededor de los 65 años. El linfoma no Hodgkin (LNH) representa el 85% de todos los linfomas, con una incidencia anual de 5-6/100.000 habitantes y se presenta fundamentalmente entre los 60-70 años. Existe una forma de presentación agresiva y una presentación indolente o de bajo grado.
La leucemia linfocítica crónica (LLC) representa el 30% de todas las leucemias, con una incidencia de 4-5 casos por 100.000 habitantes y año, y la edad media en el momento del diagnóstico es de 60 años. Por otro lado, la leucemia mieloblástica aguda (LMA) constituye el 40% de todas las leucemias y tiene una incidencia de 3.5 casos por 100.000 habitantes y año, y también es más frecuente entre los 60-75 años. Sin embargo, la leucemia linfoblástica aguda (LLA) tiene una incidencia de 1.6 casos por 100.000 habitantes y año, y es más frecuente en niños.
En algunas poblaciones específicas con inmunodeficiencia, como VIH y trasplantados, la tasa de tumores hematológicos es más elevada, especialmente el LNH. En pacientes trasplantados renales pediátricos, el riesgo es 29 veces superior y en adultos 8 veces superior a la población general [7]. En torno al 50% de los síndromes linfoproliferativos postrasplante está en relación con la infección por virus Epstein Barr [8].
AFECTACIÓN RENAL EN NEOPLASIAS HEMATOLÓGICAS
La afectación renal en las neoplasias hematológicas es frecuente. El fracaso renal agudo (FRA) ocurre hasta en el 60% de los pacientes y la etiología es variada. Por otro lado, el desarrollo de enfermedad renal crónica (ERC) es multifactorial y condiciona el pronóstico de la enfermedad. Además, la mejoría de la supervivencia con la aparición de las nuevas terapias oncológicas, aumenta la prevalencia de pacientes con ERC.
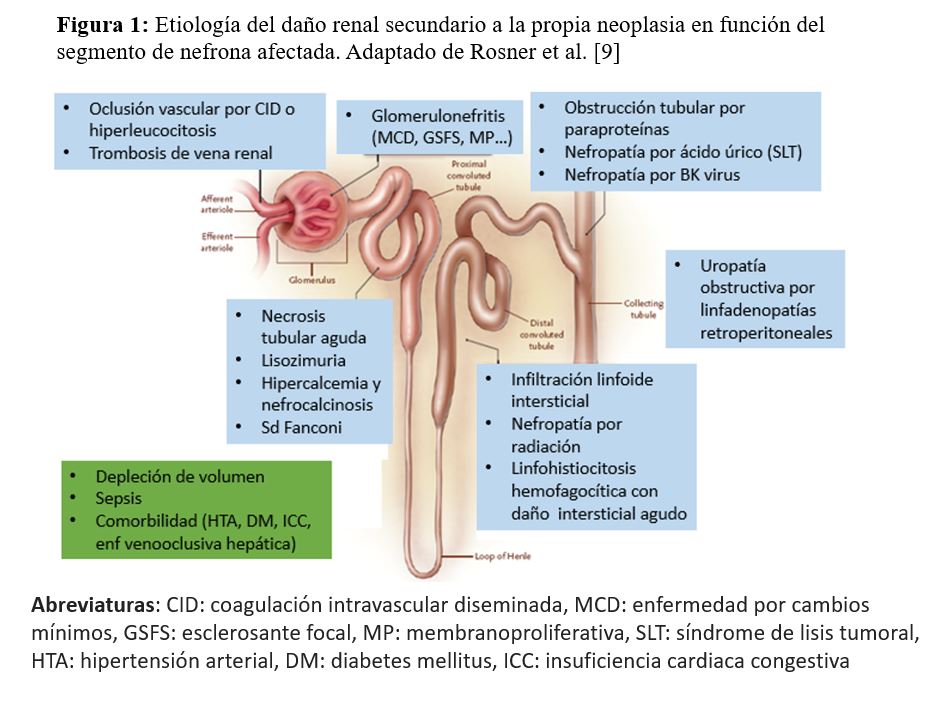
El daño renal en las neoplasias hematológicas puede ser debido a la propia neoplasia o a los tratamientos oncológicos y las lesiones pueden afectar a cualquier compartimento renal. La etiología del daño renal secundario a la propia neoplasia es diversa y puede clasificarse según el segmento de nefrona afectada [9] (Figura 1).
- Lesiones vasculares: por una oclusión vascular por una coagulación intravascular diseminada o una hiperleucocitosis, o una trombosis de la vena renal.
- Lesiones glomerulares: el glomérulo se puede afectar por la aparición de varias formas de glomerulonefritis, como por ejemplo, la glomerulonefritis de cambios mínimos (más frecuente en el LH) [10], la glomeruloesclerosis focal y segmentaria o la glomerulonefritis membranoproliferativa [11].
- Lesiones en el túbulo proximal: es muy frecuente la necrosis tubular aguda, la lisozimuria, la hipercalcemia y nefrocalcinosis, o el síndrome de Fanconi.
- Lesiones tubulointersticiales: es frecuente en la infiltración linfoide intersticial, la nefropatía por radiación, y la linfohistiocitosis hemofagocítica con daño intersticial agudo.
- Lesiones en los túbulos colectores: como en la obstrucción tubular por paraproteínas como en el mieloma múltiple, en la nefropatía por ácido úrico (asociado generalmente a un síndrome de lisis tumoral), o en la nefropatía por virus BK.
- Uropatía obstructiva por adenopatías retroperitoneales.
Además, en estos pacientes existen situaciones de riesgo de FRA, como la depleción de volumen, sepsis, y otras comorbilidades especialmente en pacientes añosos, como hipertensión arterial, diabetes mellitus, insuficiencia cardíaca congestiva, etc.
De entre las causas anteriores, la infiltración renal por células neoplásicas es frecuente en las neoplasias hematológicas, y la presentación clínica puede variar desde asintomática hasta FRA. El FRA por infiltración renal ocurre sólo en 1% de leucemias agudas y < 1% de linfomas o leucemias crónicas [12]. Sin embargo, en estudios antiguos donde se analizaron autopsias de pacientes con linfoma, se observó que la infiltración renal por linfoma aparecía hasta en el 33% de las autopsias [13]. Por otro lado, en estudios que usaban técnicas de imagen, esta patología aparecía en < 10% de pacientes con linfoma [14].
Debido al escaso tejido linfoide en el parénquima renal, el linfoma primario renal es muy poco frecuente (< 1% de linfomas extranodales) y se observa más frecuentemente en LNH [14]. La infiltración linfocítica aumenta la presión en el parénquima, produciendo una compresión de los túbulos y una alteración de la estructura microvascular con liberación de citoquinas [12]. Puede ser asintomático, o causar síntomas como dolor en flanco, hematuria, HTA, alteraciones tubulares o FRA. El diagnóstico de sospecha se establece fundamentalmente por técnicas de imagen, observándose en ecografía riñones aumentados de tamaño. Sin embargo, en el 10-25% de los linfomas con afectación renal, se puede presentar como una masa solitaria, que puede ser indistinguible de un carcinoma de células renales. En el TAC con contraste, se observan riñones aumentados de tamaño con presencia de masas hipocaptantes respecto al parénquima. El diagnóstico por PET-TAC puede ser dudoso, pues el acúmulo y eliminación fisiológica de la fluorodesoxiglucosa por el parénquima renal puede dificultar la identificación de las lesiones [14].
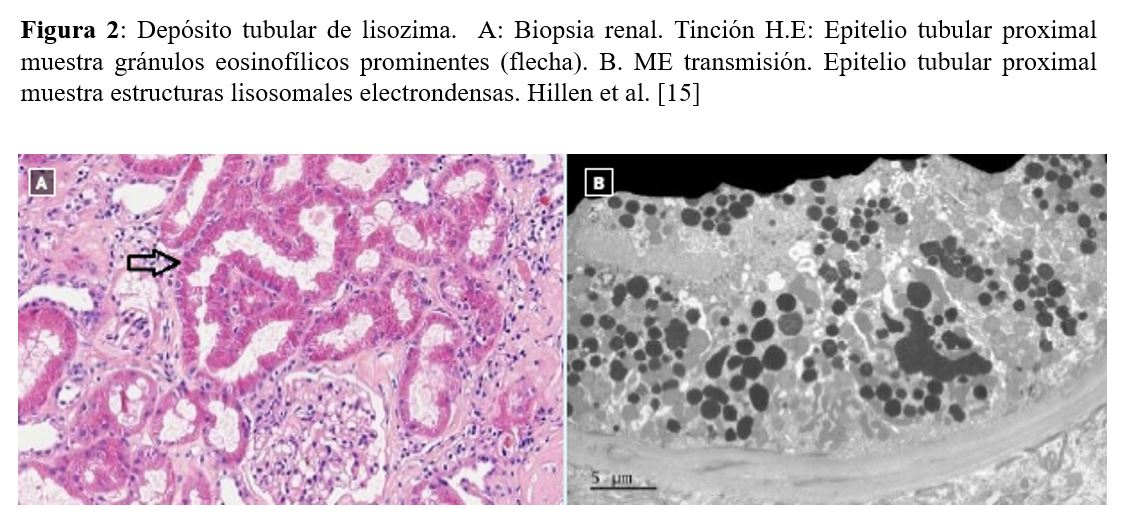
Otra forma de presentación de daño renal en estas entidades es la aparición de lisozimuria, o aparición de lisozima en orina, que puede observarse en las neoplasias hematológicas y en carcinomatosis. La lisozima es una proteína producida por monocitos y macrófagos, que forma parte del sistema inmune innato y contribuye a la hidrólisis de la pared celular de bacterias Gram positiva. En condiciones normales, la lisozima es filtrada por el glomérulo y reabsorbida a nivel del túbulo proximal. En algunas neoplasias puede producirse una liberación masiva de lisozima desde las células neoplásicas a la sangre, excediéndose la capacidad reabsortiva del túbulo proximal y por tanto, apareciendo lisozima en orina y pudiendo causar daño tubular o amiloidosis por lisozima (Figura 2) [15].
Por otro lado, el daño renal secundario a los tratamientos oncológicos es muy frecuente. El manejo clínico de estas entidades es muy variable. En algunas patologías como la LLA o el LNH agresivo, el curso clínico es agudo y requiere un tratamiento oncológico intensivo, pero en otros casos, como la LLC o la macroglobulinemia de Waldeström, la enfermedad se presenta de forma crónica y el tratamiento se plantea tras un curso clínico prolongado, cuando aparecen síntomas o riesgo de complicaciones.
De forma general, el tratamiento oncológico está orientado hacia una terapia múltiple que consiga minimizar la toxicidad asociada al tratamiento (tanto de forma aguda como de forma residual), manteniendo altos niveles de eficacia. En algunos casos, como el LNH la radioterapia es un arma terapéutica importante, pero en la mayoría de neoplasias hematológicas se requieren tratamientos quimioterápicos a altas dosis, en muchos casos seguidos de trasplante autólogo de progenitores hematopoyéticos. Sin embargo, en los últimos años, la llegada de nuevos agentes antineoplásicos está proporcionando una mayor eficacia antitumoral con una toxicidad más reducida, que está incrementando las tasas de supervivencia de muchas neoplasias hematológicas, por lo que el número de pacientes que reciben estas terapias se incrementará progresivamente.
Las nuevas terapias oncológicas se dividen en:
Terapia de precisión dirigida a dianas moleculares (dianas específicas de células tumorales) (como inhibidores de tirosin quinasa y de NFκ-β), aisladas o en combinación con quimioterapia tradicional.
Inmunoterapia: este término hace referencia a cualquier tratamiento que regule el sistema inmunitario para luchar contra las células neoplásicas. Las dianas moleculares en la inmunoterapia se encuentran en las células del sistema inmunológico. En este grupo se incluyen los anticuerpos monoclonales (inhibidores de la inmunotolerancia al tumor, como los inhibidores del checkpoint) y terapia celular con células NK y T (células T CAR). La terapia celular con células T CAR (Chimeric Antigen Receptor) es una nueva estrategia terapéutica, que se basa en la modificación de células T del paciente para que se unan a receptores específicos de las células tumorales y causen la lisis celular [16]. Los resultados con células T CAR son espectaculares sobre todo en niños y jóvenes con LLA.
El daño renal secundario a los tratamientos en los pacientes con neoplasias hematológicas es muy frecuente. Los agentes quimioterápicos clásicos se asocian con distintos grados de toxicidad, y la toxicidad renal es frecuente. Sin embargo, los nuevos agentes terapéuticos, aunque menos tóxicos, también se han asociado con múltiples alteraciones a nivel renal, que se han ido describiendo en los últimos años.
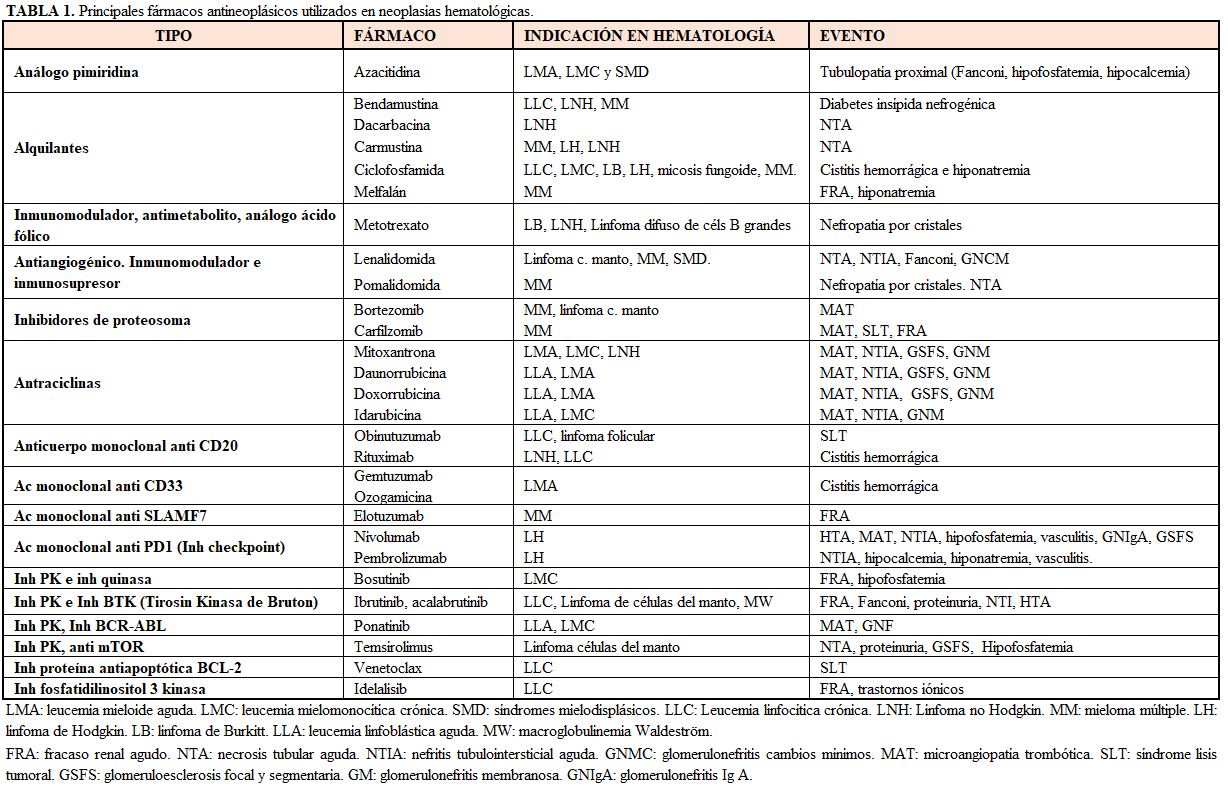
La etiología del daño renal secundario a los tratamientos es diversa y puede clasificarse según el segmento de nefrona afectada [9]. A grandes rasgos, los nuevos fármacos antiangiogénicos (anti-VEGF) muy utilizados en neoplasias de órgano sólido, se han relacionado con lesiones vasculares de microangiopatía trombótica (MAT) o lesiones glomerulares. Por otro lado, los inhibidores de la tirosin quinasa y los inhibidores BRAF se han relacionado con el desarrollo de nefritis tubulointersticial, así como los inhibidores de checkpoint (Tabla 1).
Por otro lado, el uso de células T CAR puede ocasionar algunas patologías graves con daño renal secundario como síndrome de lisis tumoral, síndrome de activación macrofágica o síndrome de liberación de citoquinas [16].
También otros fármacos ampliamente usados en estos pacientes, como pamidronato, zoledrónico o aciclovir se han relacionado con lesiones tubulares. Además, otros fármacos nefrotóxicos son usados frecuentemente en estos pacientes, como los contrastes yodados, los AINES, los IECAS/ARA-2, antibióticos como la vancomicina, aminoglucósidos, quinolonas, cotrimoxazol, antifúngicos como la anfotericina B liposomal, o antivíricos como el aciclovir, el ganciclovir, el foscarnet o el cidofovir.
Por último, el trasplante autólogo de progenitores hematopoyéticos (TASPE) ampliamente utilizado en estas patologías está relacionado con daño renal. El FRA es una complicación frecuente tras el TASPE con una incidencia de hasta el 55% y de FRA severo en 8%, siendo más frecuente en el trasplante alogénico que en el autólogo, y más frecuente en el tipo mieloablativo que en el no-mieloablativo [17]. Son muchos los factores de riesgo de FRA tras el TASPE, como depleción de volumen, sepsis, inhibidores de calcineurina, irradiación corporal total y enfermedad de injerto contra huésped. Las causas más frecuentes son la NTA, toxicidad farmacológica, síndrome de obstrucción sinusoidal hepática, MAT e infecciones virales (virus BK, adenovirus y citomegalovirus). El síndrome de obstrucción sinusoidal hepática (previamente conocido como enfermedad hepática venooclusiva) es una complicación de riesgo vital que desarrollan hasta el 15% de pacientes tras un TASPE [18], debido a daño las células endoteliales sinusoidales secundario a la quimio y radioterapia. Clínicamente se presenta con hepatomegalia, retención hídrica, ictericia e hiperbilirrubinemia, con desarrollo de FRA en la mitad de los pacientes y clínicamente es indistinguible de un síndrome hepatorrenal. La MAT también puede aparecer tras el TASPE, en los primeros 100 días, con una incidencia variable según los regímenes empleados, y se relaciona con FRA pero también con desarrollo de ERC. Se presenta habitualmente como una anemia hemolítica microangiopática con trombocitopenia, LDH elevada y presencia de esquistocitos. Las manifestaciones renales muestran elevación de la creatinina sérica con proteinuria variable y/o hematuria, con HTA en ocasiones presente. Algunos pacientes evolucionan a ERC. Otros evolucionan a fallo multiorgánico con hipertensión pulmonar, poliserositis y síntomas gastrointestinales con afectación del SNC.
MANEJO DEL DAÑO RENAL ASOCIADO A NEOPLASIAS HEMATOLÓGICAS
Evitar los factores de riesgo asociados al desarrollo de FRA continúa siendo un pilar fundamental para el manejo de estos pacientes, como individualizar los regímenes terapéuticos, monitorizar los fármacos nefrotóxicos, identificación y manejo precoz de la sepsis, optimización de diuresis y volemia y valoración por nefrólogos durante la evolución [9]. Por otro lado, un adecuado manejo de la ERC y las comorbilidades puede mejorar la evolución de estos pacientes, como la prevención y manejo de la HTA, la anemia, la malnutrición, ajuste de dosis de fármacos y detección de interacciones farmacológicas.
La presentación clínica del daño renal y el manejo clínico de la patología renal dependerá del tipo de lesión renal. Puede cursar en forma de FRA, ERC, síndrome nefrótico o nefrítico, HTA, alteraciones hidroelectrolíticas o del equilibrio ácido base, etc. Para ello es fundamental una valoración global del paciente, con una historia clínica completa que recoja el estado actual del tumor, registro de fármacos recibidos (incluídos contrastes yodados) y comorbilidades como HTA o ICC. En la exploración física es fundamental, recoger la presencia de HTA y el estado de hidratación. Además, es necesario un completo análisis de sangre y orina para detectar alteraciones de la función renal, proteinuria, alteraciones del sedimento urinario o trastornos hidroelectrolíticos y del equilibrio ácido base. En muchas ocasiones, especialmente cuando se presenta con síndrome nefrótico o nefrítico, o se sospecha una nefritis tubulointersticial es fundamental la realización de una biopsia renal.
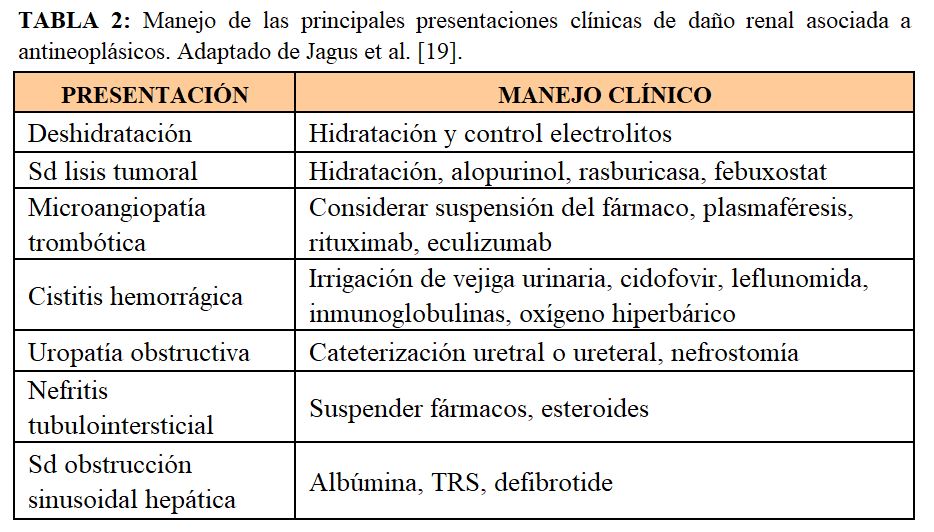
El manejo clínico dependerá del tipo de lesión renal (Tabla 2).
En caso de glomerulonefritis asociadas a neoplasias, el tratamiento oncológico mejora el curso de la glomerulonefritis [20].
En el caso de toxicidad renal por quimioterápicos, puede requerirse el ajuste de dosis del fármaco o incluso su retirada. En el caso de desarrollo de proteinuria o MAT inducida por fármacos, se puede requerir también de ajuste de dosis o incluso suspender el fármaco, así como potenciar el tratamiento antihipertensivo. También en el caso de nefritis tubulointersticial puede requerirse la suspensión del fármaco, así como esteroides [21]. El síndrome de liberación de citoquinas requiere una reposición volumétrica intensa, vasopresores y en situación severa puede requerirse el uso de esteroides y tocilizumab, un potente anticuerpo monoclonal anti IL-6 [22]. En caso de síndromes linfoproliferativos postrasplante, es crucial la reducción de la dosis de inmunosupresión en estos pacientes [8].
Por último, en pacientes con ERC en programa de hemodiálisis es necesaria una valoración multidisciplinar del paciente con ajuste de fármacos a la función renal, así como manejo de volumen y planificación del esquema oncológico en función del tratamiento sustitutivo renal.