Evaluación de la Función Renal en el Paciente Oncológico
Angel L Martin de Francisco1, Clara García Carro2, Manuel Macía Heras3, Fabiola Alonso4, Eduardo Gutiérrez Martínez5, Luis F. Quintana6, Borja Quiroga7, Isidro Torregrosa8, Pilar Auñón9 María José Soler10. Grupo Onconefrología Sociedad Española de Nefrología
1 Angel L Martin de Francisco Catedrático de Medicina, Universidad de Cantabria. Servicio de Nefrología. H.U Marqués de Valdecilla. Santander.
2 Clara García Carro. Servicio de Nefrología. Hospital Clínico San Carlos, Madrid, España.
3 Manuel Macía Heras. Servicio de Nefrología, HUNS Candelaria, Tenerife.
4 Fabiola Alonso. Servicio de Nefrología HU Virgen Macarena. Sevilla.
5 Eduardo Gutiérrez Martínez. Servicio de Nefrología. HU 12 de Octubre. Madrid.
6 Luis F. Quintana. Servicio de Nefrología Hospital Clínic de Barcelona ,Universidad de Barcelona, IDIBAPS, Barcelona.
7 Borja Quiroga. Servicio de Nefrología, HU de La Princesa. Madrid.
8 Isidro Torregrosa. Servicio de Nefrología Hospital Clínico Universitario. Valencia.
9 Pilar Auñón Servicio de Nefrología HU Doce de Octubre, Madrid.
10 María José Soler Servicio de Nefrología HU Vall d’Hebron, Barcelona.
Introducción
La evaluación de la tasa de filtrado glomerular (TFG) es fundamental en la práctica clínica para identificar síntomas, signos y alteraciones de laboratorio relacionados con enfermedades renales, ajustar dosis de medicamentos y predecir el pronóstico de la enfermedad renal crónica (ERC). Una TFG inferior a 60 ml/min/1,73 m² durante 3 meses o más es un criterio diagnóstico de ERC y se asocia con un mayor riesgo de resultados adversos incluidos insuficiencia renal aguda y mortalidad [1]. En la práctica clínica rutinaria, la TFG se estima a partir de marcadores endógenos como la creatinina sérica, pero desde hace años se han desarrollado ecuaciones como MDRD [2] y CKD-EPI [3] para estimar la TFG a partir de la creatinina sérica que han mejorado la precisión y son ampliamente aceptadas como pruebas iniciales para evaluar la TFG. En el paciente oncológico se dan una serie de circunstancias especiales, como la sarcopenia o el uso de determinados fármacos, que condicionan tanto la importancia como los métodos de estudio de la función renal.
Importancia de la medida del filtrado glomerular en el paciente oncológico
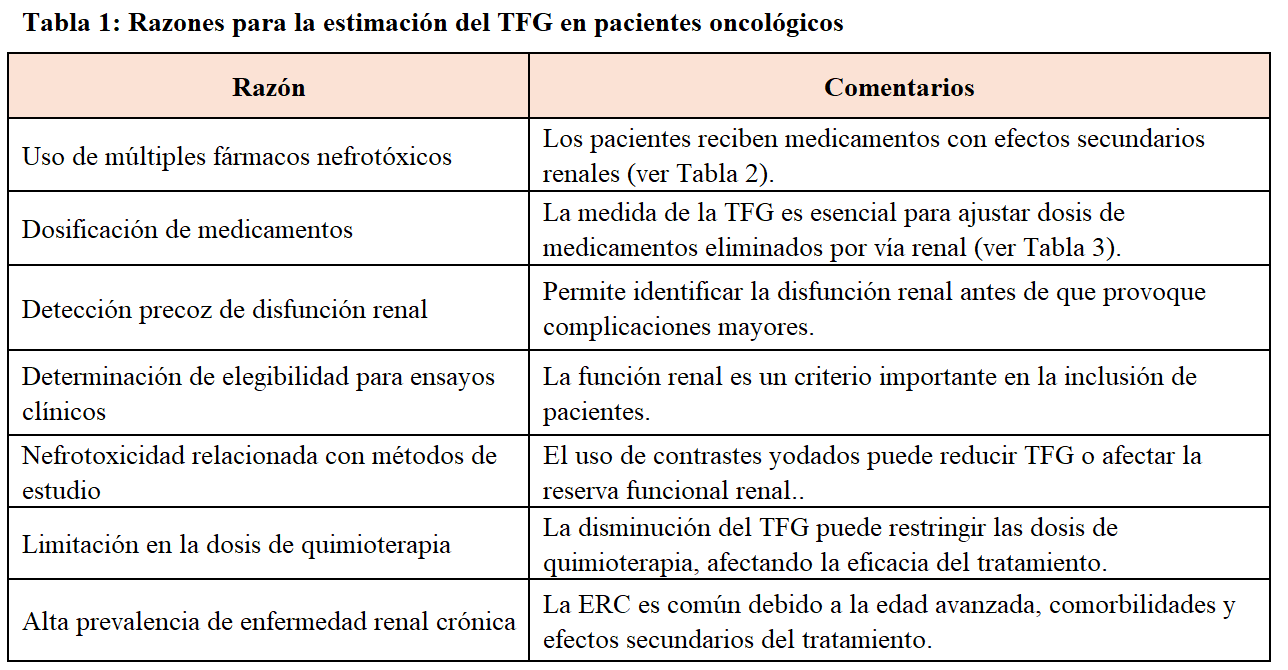
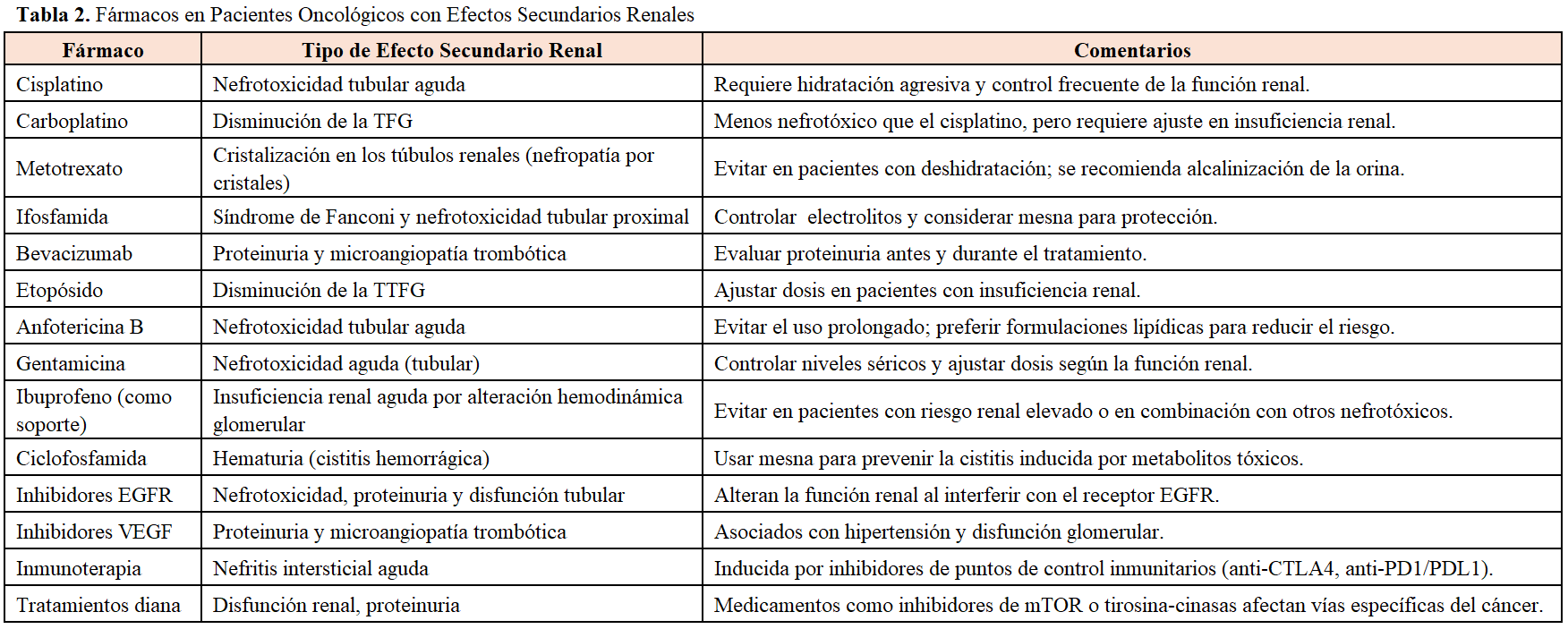
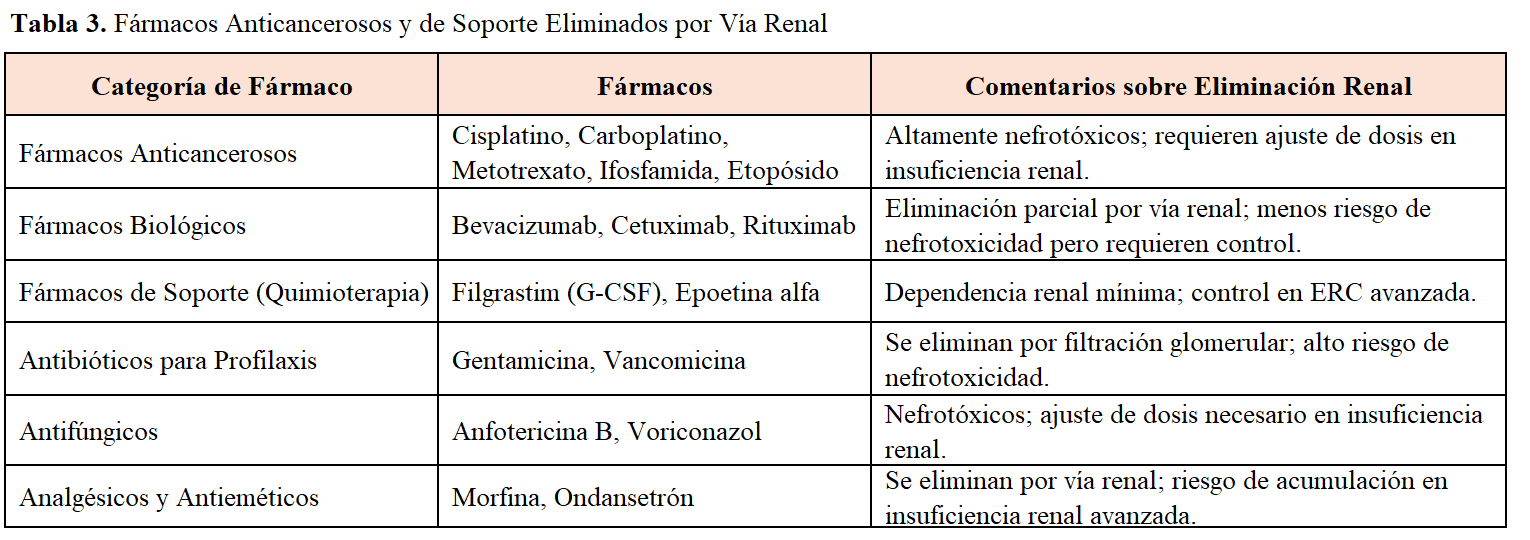
En el paciente oncológico, el disponer de métodos de medida de la TFG fáciles de utilizar y precisos es fundamental por múltiples razones, que se resumen en la (Tabla 1). Uno de los motivos principales, es el uso de diversos fármacos, muchos de ellos con efectos secundarios renales (Tabla 2) [4] [5] [6]. Los efectos adversos renales inducidos por los tratamientos oncológicos pueden reducir significativamente la TFG debido a daño glomerular o tubular, siendo la necrosis tubular aguda un efecto común y potencialmente reversible. Además, la estimación de la TFG es esencial para dosificar medicamentos que se eliminan por vía renal (Tabla 3), detectar precozmente las alteraciones de la función renal y para la inclusión de pacientes en ensayos clínicos. Asimismo, la disminución de la TFG puede limitar el uso de determinados fármacos oncoespecíficos o las dosis administradas de determinados agentes, afectando la eficacia del tratamiento. De esta manera, el control frecuente de la función renal en el paciente oncológico es fundamental para detectar y manejar los efectos adversos renales y prevenir la evolución a enfermedad renal crónica.
En los pacientes con neoplasias, la medida de la TFG es de elevada importancia ya que, aunque la reducción del filtrado glomerular provoca lógicamente un aumento de la creatinina sérica, la creatinina sérica en esta población puede subestimar la lesión renal aguda (generalmente, son pacientes con sarcopenia y escasa ingesta proteica, por lo que las elevaciones de creatina sérica, al igual que la creatinina sérica basal, son inferiores que en la población general). Por este motivo, las ecuaciones basadas en creatinina pueden no ser lo suficientemente precisas en este perfil de enfermos, siendo necesario utilizar otras fórmulas basadas en otros marcadores, como las basadas en cistatina C y/o mediciones más precisas de la TFG.
En la población con cáncer se observa una alta prevalencia de ERC, que se ha atribuido en parte a su edad avanzada, comorbilidades (diabetes, insuficiencia cardíaca, cirrosis), desnutrición, sarcopenia, así como a los efectos secundarios de los tratamientos oncológicos. En un estudio sobre 14.658 pacientes adultos hospitalizados en 10 centros en España un 18,2% de 594 pacientes oncológicos presentaron un TFG <60ml/min/1.73m2 [7]. En otros estudios la presencia de ERC en pacientes oncológicos oscila entre el 15 y el 25% [8] [9] [10] [11].
Finalmente, un factor importante a considerar en el paciente oncológico es el riesgo de la complicación de deterioro de la función renal asociada a la administración de contraste intravenoso [12]. El uso de contraste yodado resultó un factor de riesgo para el desarrollo de alteración de la función renal en pacientes oncológicos, así como la presencia de diabetes mellitus, la hiponatremia, el tratamiento quimioterápico y el uso de antibióticos en un estudio realizado en 3.558 enfermos con cáncer. El seguimiento oncológico requiere de la realización de estudios con contraste yodado con mucha frecuencia. [14] [15]. Además, es importante tener en cuenta que tras una lesión renal repetida (descompensación de insuficiencia cardiaca, isquemia/reperfusión, uso repetido de contraste yodado o fármacos nefrotóxicos) se deteriora la reserva funcional renal, ya que los pacientes oncológicos presentan de manera intercurrente a su enfermedad neoplásica muchas de estas agresiones renales, por lo que la afectación de la reserva funcional renal y el daño renal subclínico no es infrecuente en esta población [16].
Problemas relacionados con la determinación del filtrado glomerular en pacientes oncológicos
La medición de la TFG mediante ecuaciones tradicionales, como MDRD [2] y CKD-EPI [3] presenta varias limitaciones que pueden afectar su precisión en ciertas poblaciones y situaciones clínicas, como sucede en los pacientes oncológicos [17].
Ecuaciones basadas en la Creatinina
La creatinina sérica está influenciada por múltiples factores no relacionados con la función renal, tal y como se muestra en la (Tabla 4). Las ecuaciones que se basan en este marcador pueden ser imprecisas en múltiples situaciones [18].
La creatinina sérica, influida por la masa muscular, puede generar imprecisiones en la evaluación de la función renal, especialmente en pacientes con sarcopenia (como ancianos o personas con enfermedades crónicas). Una menor masa muscular reduce la creatinina sérica sin reflejar una disminución real de la función renal, lo que puede llevar a sobreestimar la TFG. Además, factores dietéticos (ingesta alta o baja de proteínas), sexo, etnia y condiciones clínicas como daño renal agudo también afectan la precisión de las ecuaciones basadas en creatinina, que requieren un equilibrio estable para resultados confiables.
Otra dificultad en las ecuaciones basadas en la creatinina es que, en pacientes con TFG por encima de 60 ml/min/1,73 m², estas ecuaciones también pierden precisión, lo que limita su utilidad para identificar daños en la función renal en estadios precoces. La variabilidad en los resultados que miden la creatinina es muy dependiente de los métodos de laboratorio que exigen estandarización lo que puede influir en las estimaciones del TFG al utilizar ecuaciones tradicionales [19].
En pacientes oncológicos en particular, las ecuaciones tradicionales para estimar la TFG son menos fiables debido a la sarcopenia, las alteraciones metabólicas inducidas por el cáncer, los efectos de los tratamientos nefrotóxicos y el envejecimiento. Esto subraya la necesidad de utilizar herramientas adicionales, como la Cistatina C o métodos directos de medición de la TFG, para garantizar un manejo renal seguro y preciso en esta población.
Ecuaciones basadas en la Cistatina
En respuesta a estas limitaciones de las ecuaciones basadas en creatinina, se han desarrollado ecuaciones alternativas basadas en Cistatina C, una proteína que se filtra libremente en los glomérulos y que no depende de la masa muscular. Aunque estas ecuaciones mejoran la precisión en ciertos grupos de pacientes, su uso no está tan extendido como las ecuaciones basadas en creatinina, principalmente debido a su costo y menor disponibilidad.
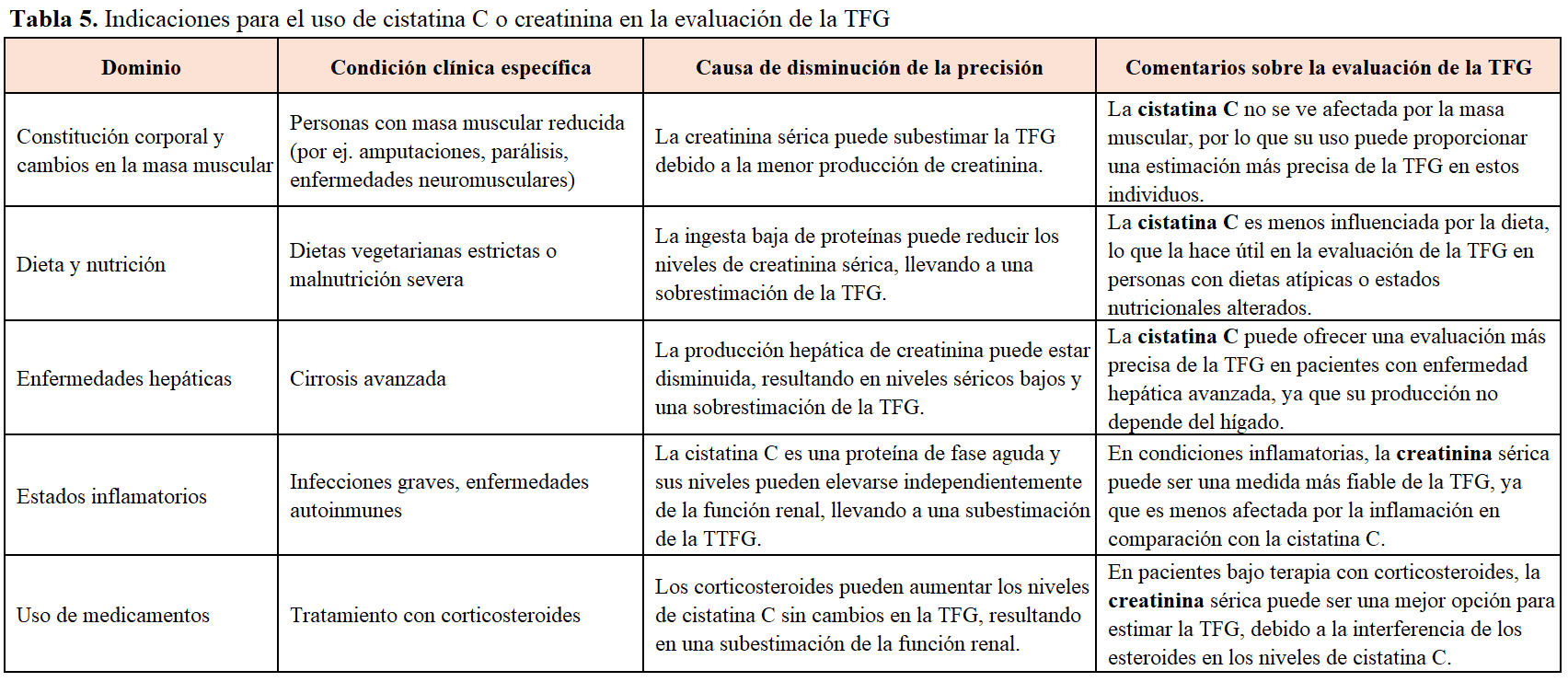
La cistatina C es una proteína producida por todas las células nucleadas del organismo y liberada constantemente a la sangre y a otros fluidos corporales. Debido a su bajo peso molecular es filtrada sin restricción en el glomérulo de manera que su concentración está influenciada principalmente por la filtración glomerular. A diferencia de la creatinina, la cistatina C no depende de la masa muscular ni de la dieta, lo que la convierte en una opción más precisa en ciertos pacientes con cáncer, especialmente aquellos con pérdida de masa muscular severa o malnutrición. En la (Tabla 5) se muestran las indicaciones para el uso de la cistatina C o de la creatinina en la evaluación de la TFG [1].
No obstante, los determinantes no relacionados con la TFG para la cistatina C han sido menos estudiados, y es incorrecto asumir que la estimación de la TFG basada en cistatina C (eTFGcys) es más precisa en todas las circunstancias. Aunque la cistatina C es un marcador valioso y menos dependiente de la masa muscular, especialmente en pacientes donde la creatinina es poco fiable (como aquellos con sarcopenia o caquexia), su uso presenta también problemas (Tabla 6).
La cistatina, al ser también un reactante de fase aguda, puede aumentar en presencia de inflamación sistémica, como en procesos infecciosos, enfermedades autoinmunes y también en pacientes con cáncer, sin que ello signifique necesariamente un cambio en la función renal. Algunos fármacos, como los glucocorticoides, pueden aumentar los niveles de cistatina C también independientemente de la función renal. Esto es particularmente relevante en pacientes oncológicos que reciben tratamientos inmunosupresores o corticosteroides como parte de su manejo. Otros problemas se relacionan con la variabilidad en las mediciones y precisión en rangos extremos de TFG. Por ello, su implementación debe ser cuidadosamente considerada, y, en muchos casos, es mejor utilizarla como complemento de la creatinina en lugar de como un marcador único de la función renal [21].
Por lo tanto, se recomienda limitar el uso de esta estrategia a contextos clínicos específicos, especialmente en personas saludables con circunstancias conocidas en los determinantes no relacionados con la TFG de la creatinina. Un ejemplo sería un estudio que comparó la TFG basada en creatinina sérica (eTFGcr) y la basada en cistatina (eTFGcys) antes y después de una amputación en veteranos militares saludables. En él se observó un cambio significativo en la eTFGcr, como era esperado por la pérdida de una extremidad y la movilidad, con la consecuente pérdida de masa muscular, pero no hubo cambio en la eTFGcys [22]. El uso de ambas mediciones también podría ser relevante en casos donde se utilizan medicamentos que inhiben la secreción tubular de creatinina, aunque no existen estudios que proporcionen evidencia suficiente para guiar recomendaciones en estas situaciones.
Otras medidas posibles del filtrado glomerular y su aplicación en el paciente oncológico
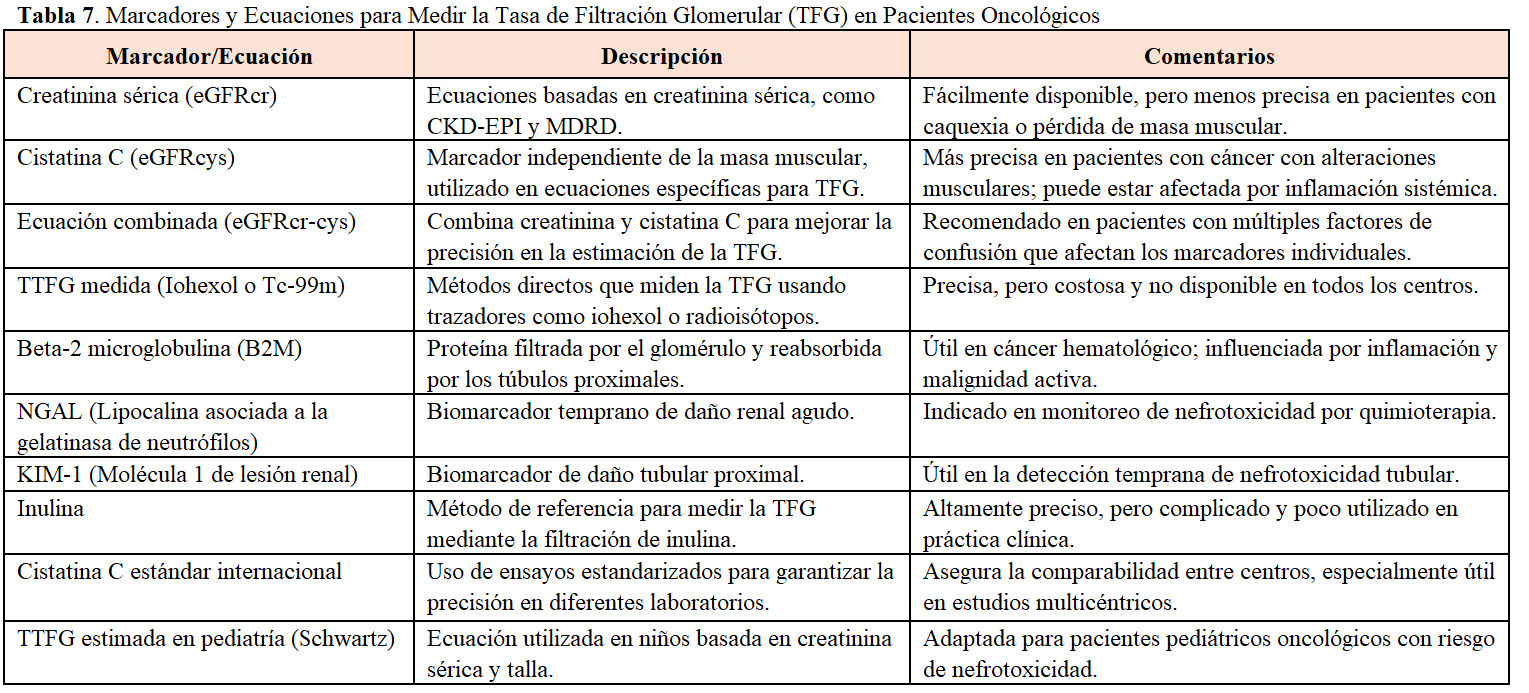
Junto a las técnicas ya comentadas basadas en creatinina y cistatina, en la (Tabla 7) pueden verse otros métodos de estudio de la TFG.
Los métodos de medición directa con trazadores (Iohexol o Tc-99m), son considerados el estándar de referencia debido a su alta precisión. Sin embargo, debido a su coste y ausencia de disponibilidad en muchos centros, está restringido a casos específicos o protocolos de investigación [23] [24].
La beta-2 microglobulina (B2M) [25] es filtrada por el glomérulo renal y casi completamente reabsorbida en los túbulos proximales. Por lo tanto, su acumulación en sangre puede indicar una reducción en la TFG o daño tubular proximal. Esto la convierte en un marcador indirecto de la función renal. No obstante, en determinadas enfermedades hematológicas como el mieloma múltiple, el linfoma no Hodgkin y la leucemia linfocítica crónica, los niveles elevados de B2M en sangre se asocian con una mayor carga tumoral y actividad proliferativa. Se debe a que las células malignas producen grandes cantidades de B2M, lo que incrementa sus niveles séricos sin que esto traduzca cambios en la función renal.
Los biomarcadores de daño renal temprano, como NGAL (Lipocalina asociada a la gelatinasa de neutrófilos) se han utilizado para controlar la nefrotoxicidad por quimioterapia. NGAL permite detectar daño renal agudo antes de que ocurra una disminución significativa de la TFG [26].
Por otro lado, KIM-1 (Molécula 1 de lesión renal) es útil para identificar daño tubular proximal, especialmente en casos de nefrotoxicidad tubular inducida por tratamientos oncológicos. Sin embargo, el uso de estos marcadores requiere más estudios y no se utilizan de manera rutinaria en la práctica clínica [27].
La inulina es el método de referencia para medir la TFG debido a su alta precisión, aunque su uso tampoco es habitual en práctica clínica debido a la complejidad técnica que entraña y la falta de disponibilidad en la mayoría de los centros [23].
El desarrollo y conocimiento de estos marcadores y ecuaciones, así como la investigación en nuevas fórmulas de estimación de la función renal en poblaciones con cáncer son esenciales para una evaluación precisa y personalizada de la función renal en pacientes oncológicos, permitiendo ajustar tratamientos, detectar daño renal temprano y prevenir complicaciones mayores.
Medida del filtrado glomerular KDIGO CKD 2024
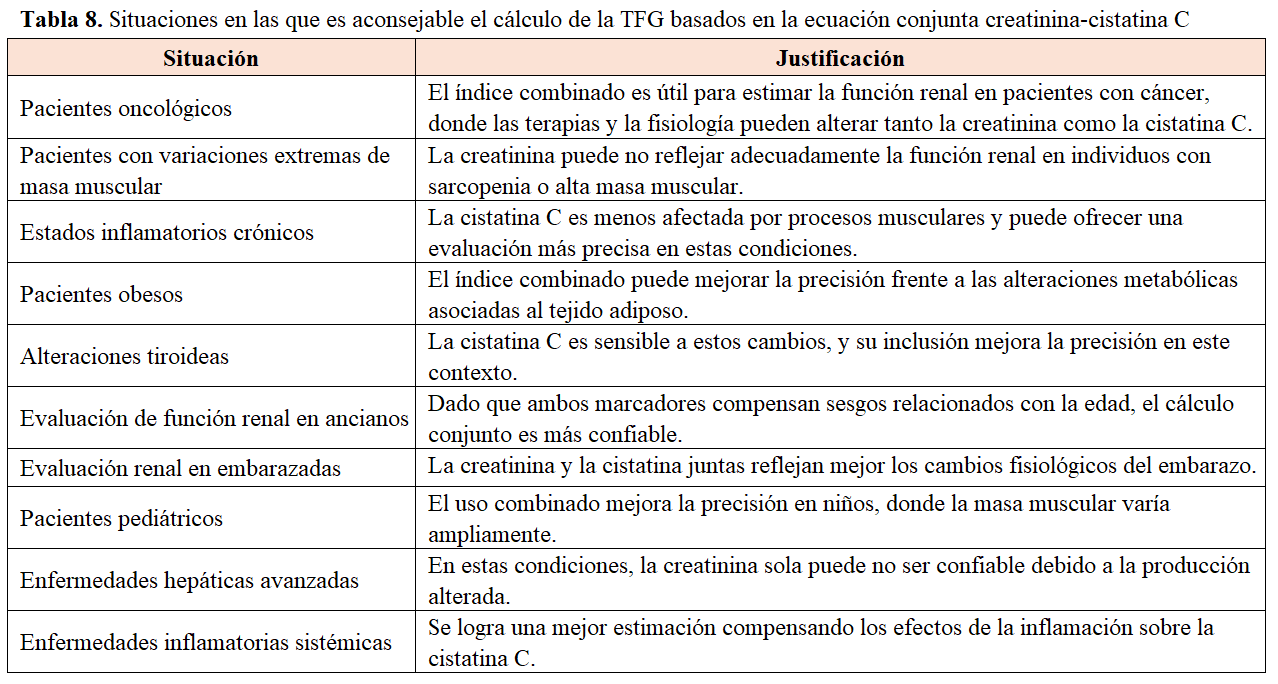
Respecto a la evaluación de la tasa de filtración glomerular, la guía KDIGO 2024 [1] recomienda utilizar una ecuación validada de estimación de la TFG (por ej CKD EPI 2021) [30] para derivar la TFG a partir de los marcadores de filtración sérica (TFGe) en lugar de basarse únicamente en los marcadores de filtración sérica (1D). En determinadas situaciones clínicas se recomienda utilizar la ecuación estimada de la formula conjunta eGFRcr-Cys [31] [32] en las que la ecuación de la TFG basado en la creatinina sea menos precisa y la medida exacta de la TFG afecte a la toma de decisiones clínicas (1C) como trasplante de riñón simultáneo a otro trasplante de órgano sólido, candidato de un donante de riñón, dosificación de fármacos o en circunstancias como la limitación de los biomarcadores especialmente en la creatinina como malnutrición, cáncer, amputación importante..etc (Tabla 8).
La combinación de eTFGcr y eTFGcys juntos es más precisa que el eTFGcr o el eTFGcys por separado. La mayor precisión se debe a que la combinación de creatinina sérica y cistatina C (eTFGcr-cys) puede mejorar la precisión de la estimación de la TFG. Este enfoque compensa las limitaciones individuales de cada marcador y es particularmente útil en pacientes con cáncer, donde las condiciones inflamatorias o alteraciones musculares pueden afectar uno u otro marcador, tal y como se ha mencionado previamente [31] [33].
Se recomienda estimar la TFG y no medirla (salvo en condiciones muy especiales y siempre con marcadores exógenos como inulina, iohexol, EDTA) pues la estimación es la que se ha utilizado en todos los estudios clínicos que analizan complicaciones y evolución. La guía recomienda la ecuación CKD EPI Creatinina /cistatina que excluye la raza, ya que ésta es un factor no binario y existe diversidad dentro de cada raza [34].
Pseudo AKI inducida por fármacos oncológicos
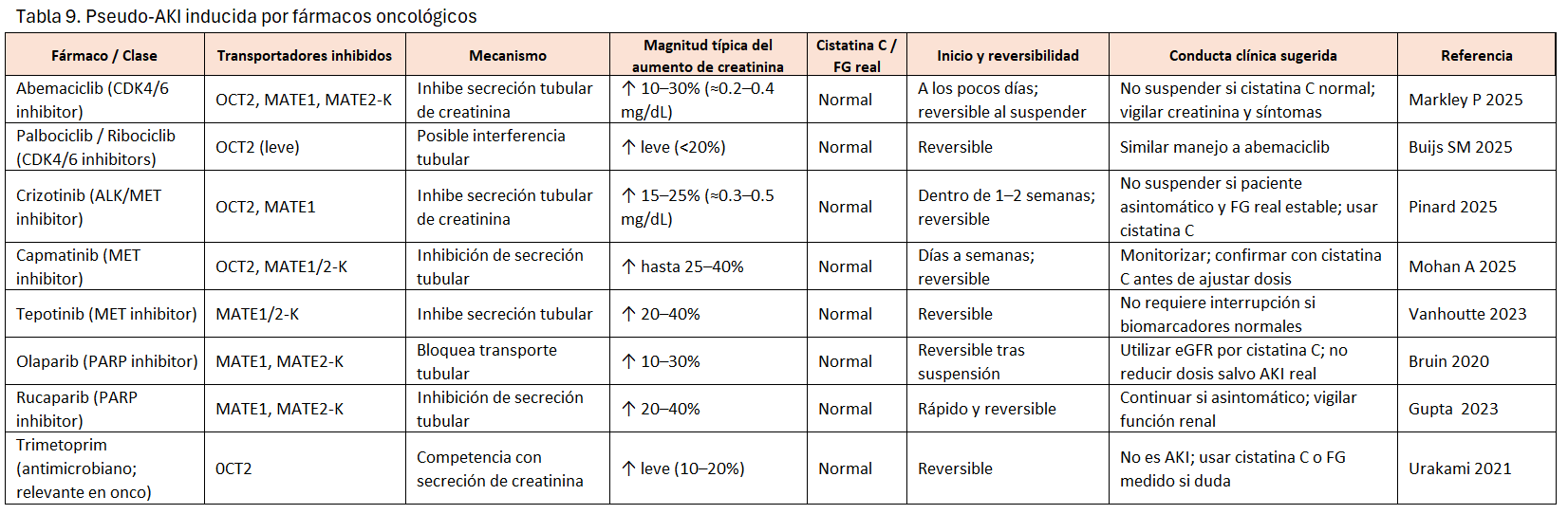
En oncología es frecuente observar elevaciones de creatinina sérica al iniciar terapias dirigidas o inhibidores de quinasas, sin que exista un daño renal estructural. Este fenómeno, conocido como pseudo-AKI se produce por interferencia farmacológica con la secreción tubular de creatinina y no por una reducción real del filtrado glomerular (FG). Reconocerlo evita suspensiones innecesarias del tratamiento antineoplásico, cambios de dosis inadecuados y procedimientos invasivos (biopsia en algunos casos).
Un 10-40% del aclaramiento de creatinina es debido a la secreción tubular activa en el túbulo proximal mediada principalmente por OCT2 (SLC22A2) en la membrana basolateral y por MATE1 (SLC47A1) y MATE2-K (SLC47A2) en la membrana apical. OAT2 también puede contribuir. El problema de interpretación de la función renal en oncología es que muchos antineoplásicos inhiben estos transportadores, elevando la creatinina sérica y aparentando un descenso del eGFR basado en creatinina, mientras que cistatina C, el FG medido u otros biomarcadores permanecen normales, como la urea o la albuminuria[35][36].
La (Tabla 9) incluye un listado de Pseudo AKI inducida por fármacos oncológicos [35][37][38][39][40][41][42][43][44].
Algoritmo de manejo práctico ante una elevación de la creatinina sérica en pacientes que reciben fármacos oncologicos
1. Antes de iniciar (crizotinib, capmatinib, abemaciclib, olaparib/rucaparib, etc.): Registrar creatinina y cistatina C basales (si disponible). Documentar eGFR-creatinina y eGFR-cistatina C. Educar al equipo sobre la posibilidad de pseudo-AKI
2. Si la creatinina sube tras iniciar el antineoplásico:
o Valorar síntomas, volemia, sedimento, orina, fármacos concomitantes.
o Solicitar cistatina C y calcular eGFR-cistatina C; si normal y el paciente estable, continuar el antineoplásico y vigilar
o Evitar reducciones o suspensiones precipitadas cuando solo se altera la creatinina (sin otros datos de daño renal)
3. Cuando intensificar el estudio
o Incrementos >0,5–1,0 mg/dL con elevación de cistatina C y urea y/o con otras alteraciones asociadas : proteinuria/hematuria significativa, hiperpotasemia, oliguria o combinación con ICI → considerar si procede, biopsia
4. Interacciones y comedicación
o Minimizar co-inhibidores de OCT2/MATE y otros nefrotóxicos (p. ej., ajustar antiinfecciosos) para no amplificar la subida “falsa” de creatinina
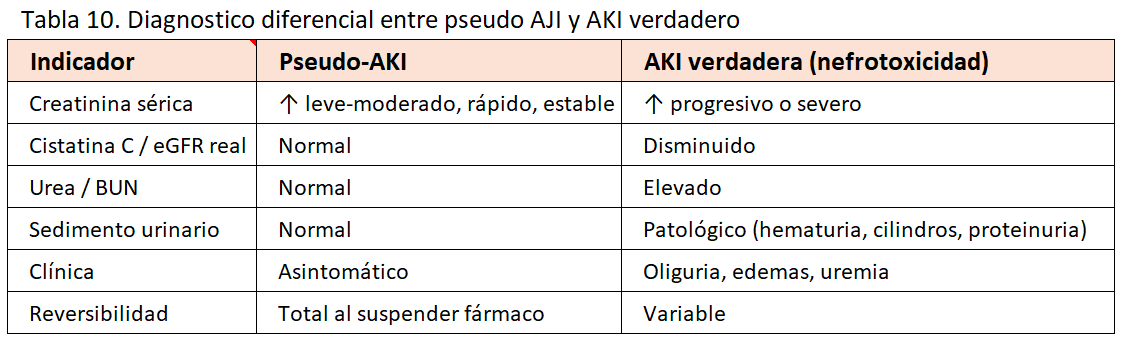
Diagnostico diferencial entre Pseudo AKI y AKI verdadero (nefrotoxicidad)
En la (Tabla 10) se incluyen los datos para un diagnostico diferencial en los que se valoran creatinina sérica, Cistatina C / eGFR real, Urea /BUN, sedimento urinario, clinica y reversibilidad al suspender el fármaco.
Valores de Cistatina en pacientes en tratamiento con inhibidores de la Tirosin Kinasa
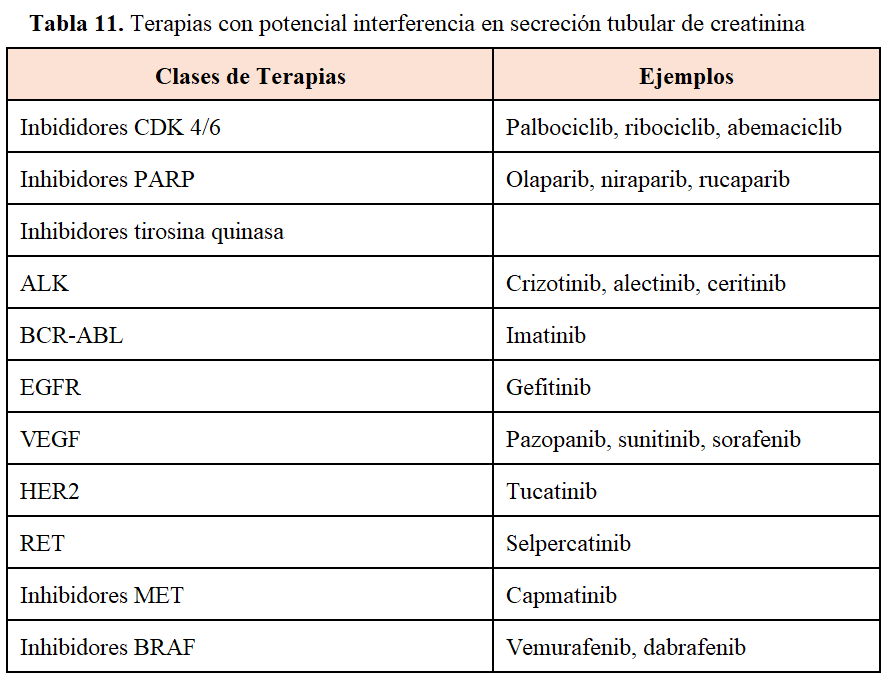
Por otro lado, en algún estudio se ha reportado que las concentraciones séricas de cistatina C disminuyen durante el tratamiento con agentes dirigidos debido a la proteólisis de la cistatina C mediada por la catepsina D, que es liberada por el tumor durante la terapia dirigida. Este efecto se observó principalmente en pacientes tratados con TKIs. Debido a esta interacción biológica entre la cistatina C y la catepsina D, no se recomienda el uso de la eTFG basada en cistatina C como un marcador adecuado de la función renal en pacientes con cáncer tratados con fármacos antiangiogénicos. Es pues necesario evaluar cuidadosamente los resultados de laboratorio en pacientes que reciben TKIs y considerar la posibilidad de interferencias farmacológicas [45]. En la (Tabla 11) se adjuntan las terapias con potencial interferencia en secreción tubular de creatinina.
Ojo a la ficha técnica del medicamento y su cálculo de la función renal
Otro desafío importante en el manejo de la función renal en pacientes oncológicos radica en las discrepancias entre las fichas técnicas de los medicamentos. Algunas utilizan el aclaramiento de creatinina estimado (eCrCl) calculado mediante la fórmula de Cockroft-Gault, mientras que otras se basan en la estimación de la TFG a partir de ecuaciones como MDRD o CKD-EPI, ajustadas a la superficie corporal. Estas diferencias pueden llevar a ajustes incorrectos de las dosis si no se presta atención al método utilizado en cada caso. Es pues importante verificar siempre qué método de cálculo se ha utilizado y lo adapten a la fórmula correspondiente en la práctica clínica.
Guías para la dosificación de medicamentos en disfunción renal
Para facilitar el manejo de la dosificación de fármacos oncológicos en pacientes con disfunción renal, se puede consultar :
• Guía Anticancer Drug Dosing in Kidney Dysfunction (ADDIKD) [46]
• Diccionario de quimioterápicos y nefrotoxicidad Nefrología al día [47]
Estas herramientas proporcionan recomendaciones prácticas para ajustar las dosis según el grado de afectación renal, mejorando la seguridad y eficacia de los tratamientos.
En Resumen: Circunstancias en las que el cálculo de la TFG en pacientes oncológicos debe basarse en la ecuación conjunta Creatinina/ Cistatina C
En pacientes oncológicos, existen diversas situaciones clínicas en las que el cálculo de la TFG utilizando la ecuación conjunta creatinina-cistatina C es especialmente recomendable debido a su capacidad para ofrecer una evaluación más precisa de la función renal [31] (Tabla 8).
Los ejemplos de indicación de esta ecuación conjunta en el paciente oncológico son claros:
• En pacientes que reciben tratamientos oncológicos con potenciales efectos adversos renales, el uso del índice combinado es fundamental para evaluar el riesgo de daño renal y ajustar las dosis de los medicamentos de forma segura.
• Por otro lado, en aquellos que sufren de caquexia o pérdida significativa de masa muscular, la creatinina sérica puede no reflejar con precisión la función renal, ya que su producción está directamente ligada a la cantidad de masa muscular. En estos casos, incluir la cistatina C en la evaluación mejora notablemente la precisión del cálculo de la TFG.
• Antes de iniciar un tratamiento onco-específico, ya que permite ajustar las dosis de los medicamentos para evitar toxicidad o una dosificación insuficiente.
• Los pacientes con tumores sólidos avanzados también se benefician de esta combinación de biomarcadores. Las alteraciones metabólicas propias de su enfermedad pueden influir tanto en la creatinina como en la cistatina C, y al analizarlos juntos, se obtiene una valoración renal más confiable.
• De manera similar, en aquellos sometidos a trasplante de médula ósea, donde la función renal puede verse afectada por varios factores, como medicamentos o inflamaciones, la ecuación que combina creatinina y cistatina C es una herramienta clave para un control más efectivo.
• En pacientes con metástasis óseas, el daño al tejido óseo puede liberar sustancias que interfieren con los niveles de creatinina. En estos casos, la cistatina C se convierte en un aliado indispensable para calcular de forma precisa la TTFG.
• Finalmente, en pacientes pediátricos con cáncer, las variaciones en el desarrollo muscular y metabólico dificultan confiar únicamente en la creatinina para evaluar la función renal. Aquí, el uso del cálculo combinado proporciona una valoración más fiable, adaptada a las particularidades de este grupo tan vulnerable.
En resumen, la ecuación que integra creatinina y cistatina C permite una estimación más precisa y personalizada de la función renal en pacientes oncológicos, lo que se traduce en un mejor manejo clínico y terapéutico.