Vitamina D en la Enfermedad Renal Crónica
Introducción
El mantenimiento de unos niveles adecuados de vitamina D es esencial para asegurar el correcto funcionamiento de la actividad endocrina que regula el metabolismo mineral y de la actividad autocrina o pleiotrópica que, actualmente, se relaciona con diversas entidades patológicas como la enfermedad cardiovascular, la progresión de la enfermedad renal crónica (ERC), la resistencia a la insulina y/o la inflamación; es más, si consideramos la múltiple interacción de la vitamina D con el genoma, podemos asumir que esta lista se alargará en el futuro.
En el pasado, las cosas estaban muy claras y la deficiencia de vitamina D se identificaba por la presencia de enfermedad ósea: raquitismo u osteomalacia. Estas enfermedades tuvieron su auge en el siglo XIX como consecuencia del movimiento migratorio desde el campo a la ciudad durante la explotación industrial, especialmente en Inglaterra; y no solo afectaron a las clases sociales más desfavorecidas sino que también fueron muy prevalentes en la aristocracia al asimilarse el bronceado de la piel con la actividad laboral al aire libre. Así se generó un verdadero problema de salud pública que dio lugar a la aparición de las primeras políticas sanitarias. Entre los años 20 y los 30 comienza a enriquecerse la leche con vitamina D en EEUU y al mismo tiempo se recomienda la exposición solar, popularizándose el aspecto bronceado de la piel. Sin embargo, a mediados de siglo, cuando se demostró que el sol era un arma de doble filo por sus efectos nocivos como la formación de radicales libres, la degradación de folatos y el daño estructural en el DNA, los dermatólogos modificaron los hábitos solares y, para evitar el exceso de exposición solar, la población se protegió del sol y comenzó a utilizar filtros solares. Es más, el estudio OPTIFORD, que recoge el status de vitamina D en mujeres de Europa, destaca en sus resultados los hábitos solares de la mujer adulta española, mucho más preocupada que el resto de mujeres europeas por protegerse del sol [1]. A pesar de ello, al no diagnosticarse situaciones de raquitismo y osteomalacia, la vitamina D dejó de constituir un problema.
Actualmente sabemos que para que se desarrollen esas situaciones patológicas los niveles circulantes de calcidiol sérico deben ser inferiores a 4 ng/mL (10nmoles/L), valores francamente deficientes [2], y que existe una elevada prevalencia de hipovitaminosis D subclínica, no diagnosticada, con importantes repercusiones sobre la salud [3]. Curiosamente, cuando se evalúan los niveles circulantes de calcidiol se observa que los países mediterráneos, privilegiados de sol, presentan menos reservas de vitamina D que los países nórdicos [4]. Esto se explica porque en latitudes altas son conscientes de que las fuentes solares son insuficientes y suplen sus necesidades de vitamina D con una elevada ingesta de pescados ricos en grasa y mamíferos marinos y con la adopción de políticas sanitarias de suplementación y enriquecimiento de los alimentos; por ello muestran valores “suficientes” y similares durante todas las estaciones. Los países mediterráneos, al confiar en sus fuentes solares, malinterpretan que es innecesario suplementar sin considerar que las fuentes solares en invierno son insuficientes para mantener un status adecuado de vitamina D y que las reservas estivales de calcidiol, con una vida media de 3 semanas, se habrán agotado.
Existe controversia sobre los datos de prevalencia de hipovitaminosis D; es más, informes del Institute of Medicine (IOM) insisten en que la mayoría de la población americana no es deficiente en vitamina D. El problema que se plantea es dónde situar los puntos de corte para definir la deficiencia; el IOM considera suficiente una concentración de 20 ng/mL (50 mmol/L) para el mantenimiento de la salud ósea [5]. Sin embargo este punto de corte está muy debatido y diversos autores arguyen que ni siquiera es suficiente para mantener los beneficios sobre la salud ósea, dejando al margen los beneficios potenciales de la vitamina D sobre otras enfermedades extra-óseas como la enfermedad cardiovascular o el cáncer [6]. Existen pocos ensayos randomizados y controlados que estudien el efecto preventivo y terapéutico de la vitamina D sobre estas enfermedades crónicas ya que la mayoría de los estudios se enfocaron hacia los beneficios sobre la salud ósea y musculo-esquelética: además, las compañías farmacéuticas con poco interés por una molécula pequeña no patentable se volcaron en los análogos de la vitamina D. Futuros estudios situarán a la vitamina D en el lugar que le corresponde.
Síntesis y metabolismo de la vitamina D
El 90% de la vitamina D de nuestro organismo procede de fuentes solares, por la fotolisis del 7-dehidrocolesterol a nivel cutáneo a través de la acción de los UVB (rayos ultravioleta con longitud de onda entre 320 nm y 280 nm). Es además una fuente segura, ya que ante un exceso de irradiación solar, la vitamina D (colecalciferol) sintetizada se degrada a productos inactivos (lumisterol y taquisterol), de forma que la intoxicación a partir de fuentes solares es prácticamente imposible. La melanina constituye una eficaz pantalla solar que reduce la eficiencia de la fotosíntesis cutánea de vitamina D [7] y esto explica el por qué la población negra que vive en latitudes más al norte, presenta menores niveles de 25-hidroxivitamina D circulante y es más propensa a desarrollar deficiencia de vitamina D, ya que necesita exponerse al sol de 5 a 10 veces más que la población blanca. También se obtiene vitamina D a partir de los alimentos (sobretodo pescados ricos en grasas) y por suplementos dietéticos; cuando procede de fuentes vegetales, la vitamina D que se incorpora al organismo lo hace como vitamina D2 o ergocalciferol. En ausencia de exposición solar, se precisarían por lo menos 1000 UI (preferiblemente 2000 UI) de vitamina D/día para satisfacer las necesidades de un adulto [8].
Dado su carácter lipofílico, cuando la vitamina D alcanza el espacio extracelular se une a su proteína transportadora vitamin D Binding Protein (VDBP) para circular en sangre y alcanzar el hígado donde sufre un primer proceso de hidroxilación transformándose en 25-hidroxivitamina D (calcidiol). Esta hidroxilación en posición C25 está controlada por el enzima microsomal CYP2R1 citocromo p450-dependiente [9] y no está hormonalmente regulada, de modo que depende exclusivamente de la disponibilidad de sustrato (ergocalciferol y colecalciferol). Únicamente están sujetas a control hormonal las dos hidroxilaciones que se producen a nivel renal: la primera de ellas en C1 para formar el 1,25(OH)2D (calcitriol), que constituye la forma eminentemente activa de la vitamina D, y la segunda en C24 para iniciar su catabolismo a ácido calcitróico, su forma soluble que se eliminará por la bilis.
Regulación renal del metabolismo de la vitamina D (Figura 1)
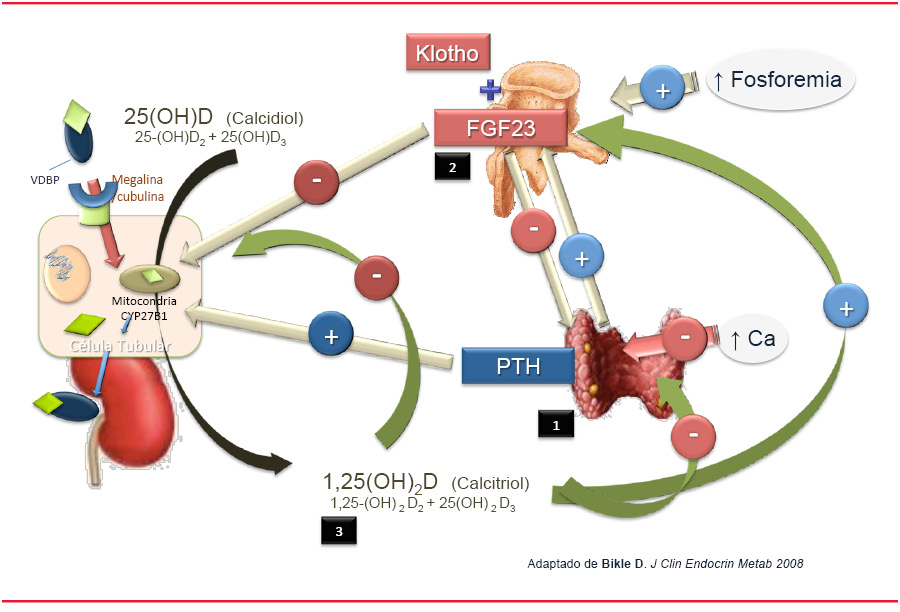
El calcidiol circulante, unido a su proteína transportadora (VDBP), sufre un proceso de filtración glomerular y captación por las células del túbulo proximal mediante un mecanismo de endocitosis mediado por una proteína: megalina [10]. Tras alcanzar la mitocondria, se hidroxila en C1 por la enzima CYP27B1 (citocromo p450) [11]. En base a esto, la cantidad de vitamina D que se sintetizará dependerá tanto de la cantidad de sustrato (calcidiol) que acceda a la célula tubular como, mas importante aun, del grado de expresión de la alfa1- hidroxilasa. Tres hormonas influyen principalmente sobre esta enzima: la hormona paratiroidea (PTH) como señal del estatus de calcio, el factor fibroblastico 23 (FGF23) como señal de la homeóstasis del fosfato y el feedback negativo de la propia 1,25-dihidroxivitamina D.
La PTH es el principal inductor de la expresión renal de esta hidroxilasa CYP27B1 al aumentar la actividad transcripcional por la demetilacion de ADN [12], estimulando la síntesis de 1,25-dihidroxivitamina D. Simultáneamente, inhibe el proceso catabólico de la vitamina D al disminuir la expresión de CYP24A1 y con ello la hidroxilación en posición C24. Para evitar cantidades excesivas de hormona, el calcitriol va a frenar a la glándula paratiroidea, inhibiendo tanto la síntesis como la secreción de PTH directamente a través de un mecanismo transcripcional e indirectamente al incrementar la concentración sérica de calcio.
Además de su acción inhibitoria sobre la PTH, el 1,25-dihidroxivitamina D constituye el principal estímulo, junto con la hiperfosfatemia, de la síntesis ósea del factor fibroblástico 23(FGF23), una fosfatonina que actúa a nivel renal en interacción con el klotho (una proteína de origen renal) que, aunque comparte el efecto fosfatúrico de la PTH al internalizar el cotransportador Na/P en el túbulo renal, presenta una acción antagónica con respecto a la vitamina D inhibiendo al CYP27B1 e induciendo la 24-hidroxilasa (CYP24A1) [13]; de esta forma disminuye su síntesis y promueve su degradación. Complicando aún más esta regulación, el binomio FGF23/klotho, mediante su acción inhibidora sobre la síntesis y liberación de la PTH (eje hueso-paratiroides), disminuye también indirectamente los niveles circulantes de calcitriol.
Finalmente, el propio calcitriol a través del VDR (Vitamin D Receptor) ejerce un efecto feedback negativo sobre la alfa 1-hidroxilasa [14] y aumenta la expresión de 24-hidroxilasa, regulando de esta forma su propia producción.
El calcitriol que se ha sintetizado en el riñón circula unido a su proteína transportadora (VBDP) comportándose como una hormona calciotrópica para regular los niveles circulantes de calcio. Hasta no hace mucho tiempo, se pensaba que el riñón era el único sitio donde se producía 1,25-dihidroxivitamina D, de hecho tras la nefrectomía los niveles séricos de calcitriol se vuelven indetectables. Actualmente sabemos que muchos otros tejidos expresan CYP27B1 y que tienen capacidad para transformar el calcidiol a calcitriol. Esta actividad alfa1 hidroxilasa extra-renal no parece estar regulada por la PTH. Por el contrario, si se ha identificado el receptor FGFR1 en monocitos de sangre periférica, lo que indica que el FGF23 podría también inhibir la expresión extrarrenal de 1-alfa-hidroxilasa y las subsecuentes respuestas intracrinas de la vitamina D [15]. Al margen del posible papel adicional del FGF23 sobre esta activación autocrina de la vitamina D, la actividad 1-hidroxilasa extra-renal está sujeta a factores tisulares específicos, entre los que se incluyen diversas citoquinas, factores de crecimiento, y otros factores inmunomoduladores a los que se expone la célula [16], de modo que la vitamina D establece esa conexión entre el estímulo extracelular y la respuesta genómica [17].
Acciones de la vitamina D
La forma activa de la vitamina D ejerce su acción (Figura 2) mediante la activación de su receptor (VDR), un receptor de la familia de los receptores nucleares, localizado dentro del citoplasma de la célula [18]. El VDR activado se transloca al núcleo donde forma un heterodímero con el receptor del Retinoide X (RXR). Este complejo heterodímero interacciona con unas secuencias específicas del ADN (Vitamin D Responsive Elements), generalmente dentro de la región promotora del gen, con la finalidad de desestabilizar la histona y permitir la transcripción o represión de un gen a través de la RNA polimerasa.
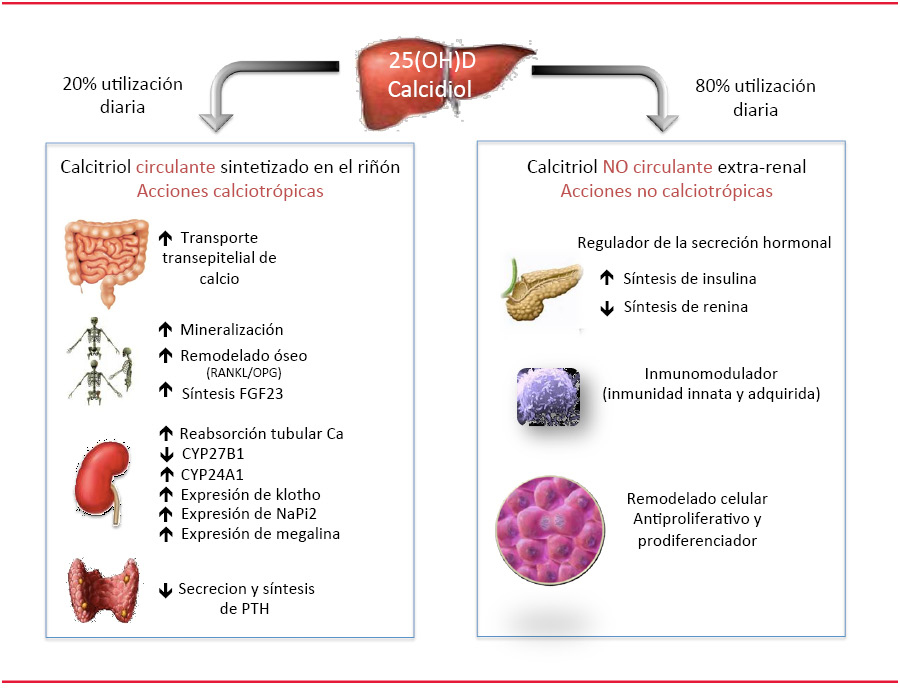
Acciones endocrinas. Mediante su unión al VDR, el calcitriol circulante que se ha sintetizado en el riñón regula la homeostasis mineral [19]. Esta actividad se consigue a través de acciones directas finamente orquestadas sobre intestino, riñón y hueso, y a través de la inhibición de la PTH en la paratiroides y de la inducción del FGF23 en las células óseas para controlar respectivamente los niveles sanguíneos de calcio y fosfato. En intestino y riñón, incrementa el transporte trans-epitelial de calcio al estimular la expresión de los canales de calcio epiteliales (TPRV6) en la membrana luminal y de calbindina D9K y D28K en el citosol. Sin vitamina D solamente se absorbería a nivel intestinal un 10-15% del calcio y un 60% del fósforo de la dieta. A nivel óseo, la acciones del 1,25-dihidroxivitamina D son extensas y complejas. En el osteoblasto participa tanto en la formación de las matriz osteoide como en la mineralización; también regula la producción de RANL y osteoprotegerina (OPG) [20] y de este modo, la vitamina D juega un papel significativo en el remodelado óseo. El calcitriol presenta también acciones sobre el osteocito donde induce la síntesis de FGF23 y sobre las células del periostio. Sobre el riñón, las acciones del complejo calcitriol/VDR van más allá de la inducción de la reabsorción transepitelial activa de calcio en la nefrona distal y de la supresión del CYP27B1 e inducción del CYP24a1 en la nefrona proximal; también induce la expresión renal del klotho y del cotransportador de sodio-fosfato (NaPi2), ambos críticos para los efectos fosfatúricos del FGF23 [21].
Acciones autocrinas. Desde no hace mucho tiempo, se sabe que numerosos tejidos, en particular las células del sistema inmune y diversos epitelios (próstata, mama, colon, cerebro), tienen capacidad para expresar CYP27B1 y que al margen de las acciones endocrinas calciotrópicas dependientes del calcitriol circulante sintetizado en el riñón, la vitamina D también actúa sobre el organismo a través de un mecanismo autocrino mediante el cual estas células captan el calcidiol circulante, lo hidroxilan a calcitriol, lo utilizan y lo degradan; todo ello a nivel “intracelular”, de forma que este calcitriol no circula en sangre en condiciones fisiológicas. Para permitir esta señalización autocrina, el VDR se expresa en numerosos tejidos no relacionados con el metabolismo mineral, como macrófagos, células de músculo liso vascular, endotelio, miocardio, páncreas, próstata o colon [22].
Más del 80% de la utilización diaria de vitamina D corresponde a estas acciones autocrinas que, desde el punto de vista didáctico, pueden clasificarse en 3 categorías: a) regulación de la función inmune, tanto innata como adaptativa o autoinmune [16]; b) regulación de la secreción hormonal, como la síntesis de insulina que está inducida por la vitamina D o la de renina que por el contrario se ve inhibida [23] y c) regulación de la proliferación y diferenciación celular en los epitelios [24].
A diferencia de la actividad endocrina de la vitamina D donde el calcitriol circulante produce una activación universal del VDR, la señalización autocrina permite la activación específica del VDR de cada tejido. Hasta hace muy poco pensábamos que estas células extra-renales carecían de receptores para la PTH o el FGF23, por lo que este mecanismo autocrino solo dependía de la disponibilidad de su precursor (calcidiol) y, de esta forma, la concentración sérica de calcidiol era crítica para asegurar la funcionalidad óptima de diversos sistemas que requieren vitamina D como parte de su aparato de señalización. Actualmente sabemos que, al menos, los monocitos de sangre periférica expresan receptor para el FGF23 y klotho [15] y por ello, aunque pudiera no ser un importante regulador de la actividad alfa-1-hidroxilasa extra-renal en condiciones fisiológicas, los niveles patológicamente aumentados de FGF23 podrían afectar a estas acciones autocrinas de la vitamina D.
Alteraciones de la vitamina D en la enfermedad renal crónica
En la Figura 3 se describen las alteraciones de la vitamina D en la enfermedad renal crónica.
Alteraciones endocrinas
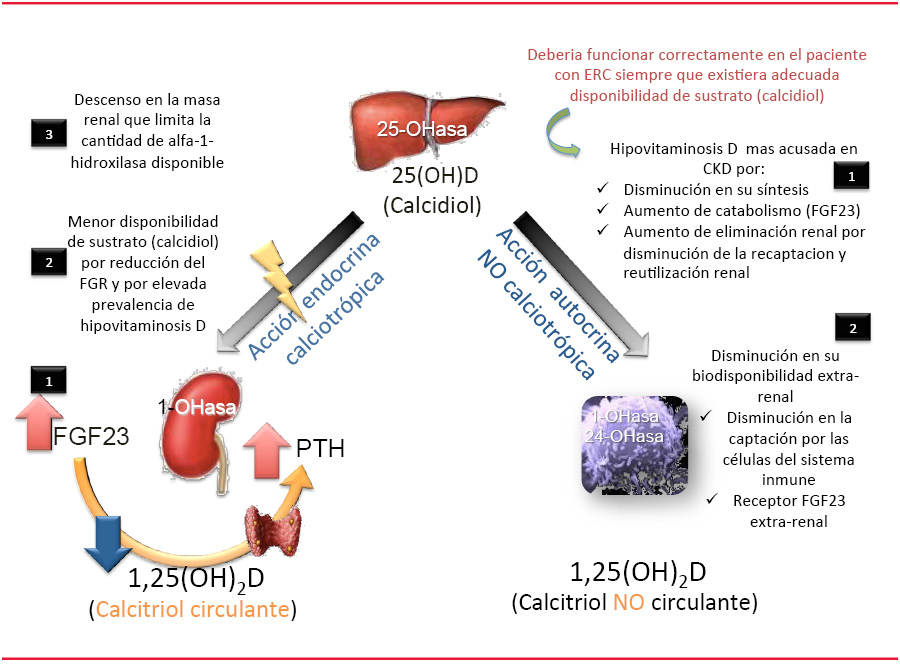
Conforme se altera la función renal disminuye la expresión de klotho. El klotho no es solamente una simple proteína de paso de membrana que actúa como co-receptor del FGF23, sino que existe otra forma soluble que actúa como una hormona fosfatúrica paracrina a nivel del túbulo proximal independiente del FGF23, e incrementa la reabsorción de calcio en el túbulo distal. La disminución de klotho en orina es detectable por Western blot desde el estadio 1 de ERC [25] y de esta forma, los grandes incrementos de FGF23 que se producen en la ERC representan el esfuerzo para mantener la normofosfatemia sobre un “riñon resistente”: cada vez con menos nefronas funcionantes, cada una de las cuales expresa menos klotho [26]. La elevación del FGF23 ejerce un doble efecto sobre el riñón: activa los mecanismos fosfatúricos para desembarazarse del exceso de fosfato y disminuye los niveles circulantes de calcitriol para evitar nueva entrada de fósfato al organismo desde el intestino o el hueso [27], observándose esta disminución de 1,25-dihidroxivitamina D incluso con aceptables grados de filtrado glomerular.
Además del efecto del FGF23, otros factores contribuyen en la disminución del calcitriol [28]. El propio descenso del filtrado glomerular limita el acceso de calcidiol a la célula tubular, comprometiendo la capacidad del riñón para producir 1,25dihidroxivitamina D; situación que se ve agravada si existe una situación previa de hipovitaminosis D, tan prevalente en estos pacientes. Este mecanismo de captación tubular de 25-hidroxivitamina D esta mediado por la megalina [29],un recetor multiligando inducido por el propio calcitriol; de este modo la disminución de 1,25-dihidroxivitamina D condiciona un descenso en la expresión de megalina [30] y con ello, una disminución en la biodisponibilidad del calcidiol por la célula tubular. Finalmente, en estadios más avanzados, el descenso en la masa renal limita la disponibilidad de alfa1-hidroxilasa. Adicionalmente a estos factores, para algunos autores, la potencial acción supresora de la PTH ¿no? 1-84 (acumulada en la ERC) sobre la 1-alfa hidroxilasa contribuiría al descenso en los valores circulantes de calcitriol.
La consecuencia de este descenso en los niveles circulantes de 1,25-dihidroxivitamina D y de la correspondiente hipocalcemia es el desarrollo de un hiperparatiroidismo secundario, ya que la vitamina D no podría frenar la expresión génica de la PTH a través del efecto supresor del VDR. A esto debemos añadir el resto de alteraciones del metabolismo mineral, como la disminución de klotho que dificulta el efecto inhibidor del FGF23 sobre la paratiroides al no interaccionar con su receptor y el incremento en la fosfatemia que estimularía la liberación y síntesis de PTH a través de un sensor especifico en la glándula. La persistencia de estas alteraciones provoca que la glándula paratiroidea se vuelva hiperplásica y nodular, pierda la expresión del sensor de calcio y de VDR, y se vuelva resistente al tratamiento [31].
Alteraciones autocrinas
La adecuada disponibilidad de sustrato (25-hidroxivitamina D) es crítica para el correcto funcionamiento de las acciones autocrinas de la vitamina D. Por ello, la primera cuestión que se suscita es si la disponibilidad de calcidiol está comprometida en el enfermo renal. Aunque España es un país soleado, existe una elevada prevalencia de hipovitaminosis D subclínica en la población general [32] [33] [34] y por tanto también en el paciente renal. Complicando aún más esta situación, se observa que conforme desciende el filtrado glomerular, no solo decrecen los niveles circulantes de calcitriol, como cabria esperar, sino que también se produce una disminución del calcidiol sérico [35]. De hecho, cuando se comparan las prevalencias de deficiencia de vitamina D (definida por calcidiol sérico < 20 ng/mL) entre población sana y población con ERC en hemodiálisis (HD) la disponibilidad de calcidiol, la hipovitaminosis D se acentúa en esta última población (30-44% vs 69-78% respectivamente). ¿Qué mecanismos justifican esta observación? En primer lugar, la existencia de diversos factores que dificultan su síntesis en el paciente renal, como son una forma de vida que dificulta la exposición solar, unida a las restricciones dietéticas y a la presencia de malabsorción intestinal por insuficiencia biliar y pancreática. En segundo lugar, el aumento en su catabolismo que se produce en el transcurso de la ERC condicionado por el incremento de FGF23, ya que el aumento de la expresión de 24-hidroxilasa induce el catabolismo tanto del calcitriol como del “calcidiol”; no obstante, estudios recientes ponen de manifiesto que los niveles de 24,25-dihidroxivitamina D (reflejo de la actividad CYP24A1) en el paciente renal son mucho más bajos de lo que correspondería a los valores elevados de FGF23 [36]. En tercer lugar, su mayor aclaramiento renal a pesar del descenso en el filtrado, por la disminución de megalina, cuya expresión esta inducida por el calcitriol. Además de mediar la captación de 25-hidroxivitamina D en la célula tubular, la megalina captura el calcidiol no hidroxilado a 1,25-dihidroxivitamina D en la mitocondria y lo devuelve a la circulación para reutilizarlo [37]; de hecho los ratones KO para megalina presentan una severa deficiencia de vitamina D al disminuir la captación del calcidiol filtrado por la célula tubular y la reutilización del calcidiol captado y no hidroxilado. Paralelamente a esta disminución de los niveles circulantes de 25-hidroxivitamina D que se produce en la ERC, también se observa un compromiso en su biodisponibilidad. Al igual que la disminución de megalina (inducida por el calcitriol) afecta a la captación de calcidiol por la célula tubular, se ha demostrado que también está alterada en las células del sistema inmune. La disminución de calcitriol compromete la disponibilidad del calcidiol en los monocitos [38] y la administración de 1,25 dihidroxivitaminaD corrige esta alteración.
La disminución de los niveles de calcidiol sérico y/o en su biodisponibilidad por parte de la célula no es el único factor que compromete la activación autocrina del VDR. El reciente hallazgo de la expresión del receptor FGFR1 y klotho en monocitos humanos [15] induce a pensar que los grandes incrementos de FGF23 que se producen en el transcurso de la ERC inhibirían la CYP27B1 y, con ello, la síntesis extra-renal de 1,25-dihidroxivitamina D; es más tal vez también promuevan su catabolismo a través de la inducción de 24-hidroxilasa en esas mismas células.
Existen pues diversos factores en el contexto de la ERC que justifican el compromiso en la activación autocrina de la vitamina D y, como consecuencia de ello, la funcionalidad de diversos sistemas que utilizan la vitamina D como parte de su aparato de señalización, particularmente la integridad de la célula renal y del sistema cardiovascular. La vitamina D es un potente supresor de la síntesis de renina, un conocido marcador que se asocia con la proteinuria y la progresión de la enfermedad renal; los ratones null para VDR presentan un incremento de renina y angiotensina II, lo que ocasiona hipertensión arterial, hipertrofia cardiaca y aumento en la ingesta de agua [39]. Además, por su acción antiproliferativa y prodiferenciadora, la vitamina D reduce el crecimiento glomerular y la hipertrofia de podocitos [24], y a través de una acción inmunomoduladora, actuaría sobre los mecanismos de la inflamación disminuyendo la expresión de TGF-beta y de MCP-1 y el reclutamiento de células macrófago like así como de linfocitos T efectores [40] [41]. Al mismo tiempo, la vitamina D también influye directamente sobre el miocardio y juega un papel en la regulación de la hipertrofia ventricular izquierda, como se demuestra en modelos animales de experimentación [42]. De hecho, los niveles bajos de calcidiol sérico constituyen un marcador de riesgo cardiovascular en pacientes con ERC en HD, asociándose independientemente con el aumento de pro-BNP, la presión de pulso y el score de calcificación vascular [43]. La inhibición por la vitamina D de la activación renal de la enzima conversora del TNF-alfa (TACE) contribuye a esta protección renal y cardiovascular [44].
Todas estas acciones autocrinas justifican que los valores de calcidiol en rango de deficiencia constituyan un predictor independiente de progresión de la enfermedad renal y de riesgo de muerte en los enfermos renales con estadios 2-5 [35] [45].
Evaluación del estatus de vitamina D
El mantenimiento de unos niveles óptimos de vitamina D asegura el correcto funcionamiento de sus acciones endocrinas y autocrinas en la población con función renal normal.
La evaluación del estatus de vitamina D es con frecuencia motivo de controversia ya que genera numerosas cuestiones, entre ellas ¿qué metabolito debemos medir? y ¿qué punto de corte debemos utilizar para definir la hipovitaminosis D?, así como otros aspectos metodológicos que conciernen a su cuantificación.
¿Qué metabolito de la vitamina D y cuándo debemos medirlo?
A 40º de latitud, donde se sitúa la mayor parte de nuestro país, no se produce síntesis de vitamina D durante los meses de invierno y la fotobiosíntesis cutánea es insuficiente para compensar las necesidades en el periodo de mínima irradiación solar. Esta variabilidad estacional de la vitamina D implica que la evaluación del estatus de vitamina D debe realizarse durante el periodo de mínima irradiación solar (de octubre a mayo en nuestro país), ya que las reservas repleccionadas de vitamina D durante el periodo estival pueden dar lugar a interpretaciones erróneas.
El calcidiol es la forma circulante más abundante y más fácilmente dosificable. Constituye el mejor índice para evaluar la reserva de vitamina D del organismo porque: 1) tiene una vida media elevada (alrededor de 3 semanas), muy superior a la del colecalciferol (24 horas aproximadamente) y a la del calcitriol (4-6 horas); 2) porque su síntesis no está regulada hormonalmente y depende exclusivamente de la biodisponibilidad de sustrato (colecalciferol y/o ergocalciferol); y finalmente 3) porque evalúa tanto la acción autocrina como la endocrina de la vitamina D. Estas mismas razones que hacen del calcidiol sérico un buen marcador de reserva de vitamina D, al menos en sujetos con función renal normal, descalifican la cuantificación de calcitriol (1,25(OH)2D) para diagnosticar la deficiencia de vitamina D: su corta vida media unida al estrecho control hormonal favorece errores diagnósticos, ya que sus niveles circulantes pueden encontrarse dentro de la normalidad o incluso aumentados como resultado de un hiperparatiroidismo secundario condicionado incluso por la propia hipovitaminosis D.
Sin embargo, al cuantificar el calcidiol estamos evaluando un marcador de “reserva” y no de “función” (al menos endocrina) y uno se plantea si estaría indicada la cuantificación adicional de 1,25-dihidroxivitamina D en el paciente renal. Las propias guías KDIGO (46) dejan en entredicho la utilidad de la monitorización del 1,25(OHO)2D incluso en el manejo de las alteraciones de la vía endocrina del paciente renal, ya que lo que interesa es diagnosticar cuanto antes la situación de hiperparatiroidimo secundario y para eso es preferible cuantificar directamente los niveles circulantes de PTH. Además, la determinación de 1,25 dihidroxivitamina D no está bien estandarizada, es laboriosa y el tratamiento con calcitriol o activadores del receptor de la vitamina D produce interferencias en los resultados. Todos estos argumentos desaconsejan la utilización clínica de la determinación de los niveles circulantes de calcitriol, relegando únicamente su cuantificación a los estudios de investigación.
¿Qué punto de corte define la situación de hipovitaminosis D?
Actualmente, definimos la deficiencia de vitamina D por “criterios bioquímicos”, es decir, como aquella disminución en la concentración sérica de 25(OH)D que se asocia con un incremento variable en la PTH para mantener los niveles de calcitriol en rango normal o incluso por encima de lo normal. En base al nivel de influencia sobre la PTH, la mayoría de los expertos sitúan los niveles de deficiencia por debajo de los 20 ng/mL (50 mmoles/L) y óptimos entre los 30-40 ng/mL (75-100 mmoles/L) [47]. El inconveniente es que este rango es muy variable porque muchos pacientes presentan valores muy bajos de 25 hidroxivitamina D sin elevación de PTH y otros continúan estimulando a la paratiroides con valores de calcidiol superiores a 30 ng/mL (75 mmoles/L). Por este motivo, también se ha utilizado como indicador los niveles de vitamina D que dan lugar a la “máxima absorción intestinal de calcio”: el transporte intestinal de calcio se incrementa de 45% a 65% cuando los valores de calcidiol sérico aumentan de 20 a 32 ng/ml (50-80 mmoles/L) o incluso algo más [48].
Más recientemente, para establecer los niveles óptimos de calcidiol sérico se utilizan otros posibles marcadores, basados en ensayos clínicos randomizados que relacionan los valores de calcidiol sérico con otros beneficios sobre la salud ósea: mayor densidad mineral ósea (30-40 ng/mL) [49], disminución en el riesgo de caídas (>24 ng/mL) [50], y reducción en la incidencia de fracturas (> 29,6 ng/mL) [51]. Finalmente, ha surgido interés en conocer su relación sobre otros beneficios potenciales que van más allá del hueso, como la prevención de la enfermedad cardiovascular, el cáncer, la diabetes mellitus y la disfunción inmune, y algunos estudios apuntan requerimientos aun mayores, entre 36 y 48 ng/mL [52].
Considerando todos esos aspectos, suelen aceptarse los siguientes puntos de corte: calcidiol sérico < 20 ng/mL para definir la deficiencia de vitamina D; 21-30 ng/mL como niveles subóptimos de vitamina D; y > 31 ng/mL como valores suficientes. En enfermos renales, la Sociedad Española de Nefrología (SEN) establece unos rangos deseables iguales o superiores a 30 ng/mL para todos los estadios de ERC [53].
Otras consideraciones metodológicas concernientes a la cuantificación de calcidiol sérico
La mayoría de los ensayos comerciales para cuantificar 25-hidroxivitamina D son buenos para detectar deficiencias de vitamina D. El método de referencia clásico es la cromatografía de gases asociada a la espectrometría de masas. También se utilizan otros métodos de detección directa como es la cromatografía líquida de alta resolución (HPLC) o el tándem cromatografía liquida-espectrometría de masas [54]. Ofrecen la ventaja de separar y cuantificar independientemente el 25(OH)D2 (ergoferol) y el 25(OH)D3 (calcidiol), aunque tal vez esto no tenga excesiva relevancia a nivel clínico. Como contrapartida, estos métodos requieren equipos caros y son laboriosos, limitando el procesamiento de las muestras, por lo que su uso es inviable en el laboratorio clínico. Los métodos para evaluar los niveles de 25-hidroxivitamina D utilizados a nivel clínico se basan en inmunoensayos, y han evolucionado desde los primeros ensayos protein-binding competitivos que utilizaban tritio (CPBA), pasando por los radioinmunoanálisis (RIA) que utilizan I125 o los escasamente aceptados ELISAs, hasta los actuales métodos quimioluminiscentes automatizados.
La cuantificación de 25-hidroxivitamina D plantea, especialmente con los inmunoensayos, dos problemas. El primero de ellos es consecuencia de su carácter hidrofóbico. La naturaleza lipofílica de la vitamina D le hace especialmente vulnerable al efecto de matriz; de este modo, la presencia de lípidos o determinados componentes del suero o plasma pueden modificar la afinidad por la unión a anticuerpo o proteina, reduciendo considerablemente la validez del ensayo [55], situación que se acentúa en los métodos protein-binding. El segundo problema se produce por la presencia de sus dos formas circulantes: 25(OH)D2 y 25(OH)D3, ya que la afinidad del anticuerpo por ellas es variable, infraestimando por lo general el 25(OH)D2, lo que plantea un problema para establecer el estatus de vitamina D en los pacientes tratados con ergoferol; esto, en España no supone mucho problema ya que la suplementación se realiza fundamentalmente mediante preparados de vitamina D3 pero sí lo es en EEUU donde el ergocalciferol es el único preparado de choque o en Australia donde solo se suplementa con D2.
Finalmente, casi todos los estudios clínicos para definir el rango de referencia de la vitamina D se realizaron utilizando el primer método de radioinmunoanálisis (RIA) que se desarrolló y que aprobó la FDA: el de DiaSorin. Con este método se han generado también todos los datos sobre calcidiol que se registran en grandes estudios poblacionales como el NHANES [56] [57] incluyendo a pacientes renales [58]. Por eso, podemos considerar el RIA de DiaSorin (Stillwater, MN) como estándar de oro para la evaluación clínica del estatus de vitamina D.
Corrección de la deficiencia nutricional de vitamina D
Tal y como recomiendan las guías KDIGO [46], en los pacientes con ERC estadios 3-5D, se sugiere cuantificar los niveles de calcidiol sérico y corregir la deficiencia o insuficiencia de vitamina D utilizando las mismas estrategias terapéuticas aceptadas para la población general, es decir, suplementando con vitamina D nativa. Recientes estudios en población general sitúan en 20 μg/día de vitamina D la dosis que asegura un estatus apropiado de vitamina D en el adulto [59]. La SEN recomienda valores de calcidiol sérico de 30 ng/mL (75 mmol/L) para el manejo de las alteraciones del metabolismo óseo y mineral en todos los estadios de ERC [53].
Podemos suplementar con vitamina D nativa: colecalciferol o ergocalciferol, o con calcidiol directamente, pero al elegir una u otra forma debemos considerar varios aspectos. En el caso de la vitamina D, y aunque las guías KDOQI recomienden corregir con bolos de 500.000 UI semanalmente [46], es preferible la dosificación diaria por diversos motivos: 1) aunque en España la suplementación se realiza a base de vitamina D3, el ergocalciferol no es equivalente al colecalciferol, porque la vida media del ergocalcidiol es menor; por ello se pueden dar dosis equivalentes si se da una pauta diaria, pero no conviene utilizar el ergocalciferol en bolos semanales (como recomiendan las KDOQI) porque es menos eficaz [60]; además, 2) si se administran dosis muy elevadas de colecalciferol, se almacenan en el tejido adiposo y la conversión a calcidiol es más lenta; de hecho el paciente con un elevado índice de masa corporal responde peor. Y finalmente, 3) los sujetos deficientes responden mejor que los insuficientes.
La suplementación con calcidiol presenta la ventaja de reponer directamente los niveles insuficientes y es el tratamiento de elección en los hepatópatas al no requerir la hidroxilación hepática. Su vida media más larga (2-3 semanas) obliga a espaciar su dosificación para no intoxicar. En general, exige un manejo más cuidadoso porque el calcidiol tiene más avidez por la proteína transportadora (VDBP) que el calcitriol, y al administrarlo desplaza a este último, incrementando la proporción de calcitriol libre y favoreciendo de este modo la toxicidad.
La corrección de la deficiencia nutricional es la forma más fisiológica y económica para asegurar el funcionamiento del mecanismo autocrino de la vitamina D. Al mismo tiempo, aunque de forma limitada, también estaríamos actuando a nivel endocrino al tratar el hiperparatiroidismo secundario a hipovitaminosis D. Es más, el mantenimiento de unos adecuados niveles de calcidiol sérico podría retrasar la aparición de hiperparatiroidismo secundario en los estadios iniciales de la ERC, al no limitar la cantidad de sustrato que accede a la célula tubular para hidroxilarse a calcitriol. No obstante, la corrección del hiperparatiroidismo secundario necesita algo más que vitamina D nativa y es necesario el tratamiento combinado con vitamina D (suplementación con vitamina D nutricional: colecalciferol o calcidiol, asociada a un activador del VDR). La administración de un activador del VDR también supone beneficios adicionales sobre la activación autocrina, al inducir la expresión de megalina y con ello mejorar la biodisponibilidad del calcidiol, al inducir la expresión de VDR en la célula y más aun, ante grandes elevaciones del FGF23 que tal vez también estarían inhibiendo la alfa1-hidroxilasa extra-renal.
La experiencia científica sobre la suplementación con vitamina D no es mucha y existe muy poca bibliografía sobre el tratamiento combinado con vitamina D. Vondracek y col [61] reúne en una revisión sobre tratamiento combinado los resultados obtenidos en 3 estudios observacionales prospectivos [62] [63] [64], un estudio prospectivo de cohorte [65] y un estudio retrospectivo [66]. Entre ellos, cabe destacar el estudio de Jean [64] que compara los datos registrados prospectivamente en pacientes incidentes y prevalentes en HD durante 3 periodos de tiempo: 2004-2005, 2006-2007 y 2008-2009. En el transcurso de este tiempo, el porcentaje de pacientes incidentes en diálisis tratados con vitamina D nativa se incrementó de 11% a 58%, disminuyendo el porcentaje de hiperparatiroidismo secundario desde un 40% a un 12%, manteniendo igual el tratamiento con activador del VDR; en el grupo de pacientes prevalentes en diálisis, al incrementar el número de pacientes suplementados con vitamina D nativa de un 55% a un 91% se consiguió una reducción de hasta un 13% del hiperparatiroidismo secundario, asociada a una disminución muy significativa del tratamiento con activador del VDR. En el estudio prospectivo de cohorte [65], además de plantear el efecto de la suplementación con colecalciferol en 158 pacientes con ERC-5D sobre los niveles de PTH (que se reducen significativamente) evalúan otros efectos como beneficios sobre la inflamación (reducción significativa de la PCR ultrasensible), sobre el sistema cardiovascular (disminución significativa del proBNP y de la HVI) y sobre el tratamiento (reducción significativa de las dosis del activador de VDR). La conclusión es que la suplementación con vitamina D nativa para mantener los valores de calcidiol sérico entre 20 y 30 ng/mL, con o sin tratamiento con activador, es barata, parece segura y puede proporcionar beneficios adicionales para la salud de los pacientes con ERC 5; si bien se necesitan estudio randomizados controlados para determinar la eficacia y seguridad del tratamiento combinado de vitamina D nativa y activador del VDR en estos pacientes.
A nivel práctico, la cuestión es hasta qué punto debemos empeñarnos en conseguir estos valores. Solo hay una respuesta: individualizar. Tal y como hemos visto, existen numerosos factores (raza, grasa, insuficiencia biliar y pancreática, variabilidad estacional….) que explican la gran variabilidad intraindividual en la respuesta al tratamiento. Lo más importante es controlar el tratamiento y garantizar el mantenimiento de un perfil adecuado de calcio y fósforo en sangre; no debemos olvidar que la curva dosis-respuesta para la vitamina D es bifásica y que sus consecuencias, tanto por defecto como por exceso, son deletéreas. Si bien las dosis bajas de vitamina D (en rango fisiológico) ejercen acciones protectoras sobre la calcificación vascular en el contexto de la ERC, las dosis farmacológicas elevadas podrían promover la mineralización vascular.