Complicaciones por Órganos y Aparatos
Palabras clave
Síndrome desequilibrio, síndrome piernas inquietas, Disfunción eréctil, prurito urémico, fibrosis nefrogénica, tunel carpiano, calambres, cefaleas, pulmon urémico, apnea del sueño
Este capítulo revisará patologías, por órganos y aparatos, que se presentan específicamente en el enfermo urémico, o que requieran un enfoque diagnóstico o terapéutico especial en el contexto de la enfermedad renal crónica (ERC).
APARATO DIGESTIVO
Síntomas más frecuentes:
Anorexia
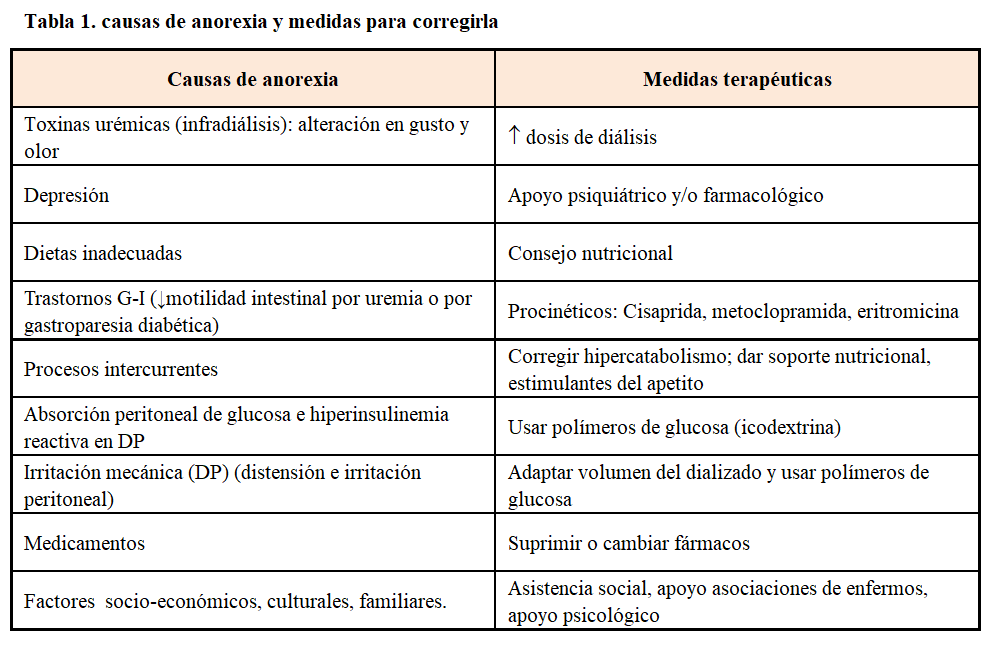
• Complicación frecuente que puede acarrear graves problemas nutricionales, de ahí la importancia de su detección y corrección precoz. Las causas más comunes y las posibles medidas para corregirla aparecen en la (Tabla 1). La anorexia latente o manifiesta es un factor importante en la génesis de la desnutrición proteica observada en la ERC. Ésta puede desarrollarse como resultado de aumento en las hormonas anorexigénicas [1] y la activación de citocinas proinflamatorias y conducir a la insuficiencia de la ingesta de proteínas y energía. El soporte nutricional y estimulantes del apetito son medidas prioritarias para prevenir o tratar el hipercatabolismo [2]. Hay estudios que consideran que la solución oral de acetato de megestrol (AM), a la mitad de su dosis habitual, es segura y que mejora el estado nutricional, la inflamación y la anorexia en pacientes en diálisis; la evidencia actual para el tratamiento con AM en pacientes en diálisis es escasa, con pocos ensayos de alta calidad [3]. Se desconoce la seguridad de usar AM más allá de las 24 semanas, pues se ha asociado a eventos adversos significativos, como sobrehidratación, aumento excesivo de líquidos, diarrea, hiperglucemia, aumento de peso excesivo, niveles de cortisol suprimidos, tromboflebitis, náuseas, vómitos, confusión, alucinaciones, sangrado vaginal, cefalea / mareo y elevación de lactato deshidrogenasa. En este momento, el AM oral debe utilizarse con precaución, y sólo cuando otras opciones de tratamiento no están disponibles [4].
Náuseas y vómitos
• La mayor parte de las causas de anorexia también pueden provocar náuseas y vómitos. La más frecuente es la dosis insuficiente de diálisis (síndrome del fin de semana). Los fármacos de uso común, potencialmente responsables, son los quelantes del fósforo y los calcimiméticos. La sobrecarga de volumen con estasis hepático (malestar en hipocondrio derecho) también puede provocar vómitos.
• Durante la diálisis, las náuseas y vómitos son más frecuentes en enfermos con gastroparesia o flatulencias, en aquellos que realizan ingestas copiosas, y en conjunción con hipotensiones por elevada ultrafiltración.
• El tránsito gastroduodenal o el test de “vaciamiento gástrico”, pueden aportar información diagnóstica importante.
Dispepsia
• La prevalencia en pacientes en hemodiálisis varía entre el 48 y el 73%. El origen funcional de la dispepsia es el más frecuente entre los pacientes con ERC [5]. La dispepsia se asocia una menor ingesta calórica y proteica [6]. En diálisis, considerar como posibles causas ciertos fármacos (quelantes, hierro) o gastroparesia. La hipervolemia se asocia con dispepsia entre los pacientes en HD [7]. En dialisis peritoneal la dispepsia es causada por reflujo gastroesofágico o por retraso del vaciamiento gástrico.
Estreñimiento
• Su prevalencia es del 63% en pacientes en hemodiálisis y del 29% en pacientes en diálisis peritoneal. La prevalencia en la población general es del 10-20% [8].
• Las causas más frecuentes son el sedentarismo, la dieta pobre en fibra y líquidos, el uso de antiácidos que contienen aluminio, el tratamiento analgésico, y los quelantes del fósforo, especialmente sevelamer [9]. La corrección de estos factores y el apoyo terapéutico con laxantes y enemas pueden ayudar a corregirlo.
• En pacientes añosos, arterioscleróticos y de largo tiempo en diálisis, el estreñimiento puede facilitar las perforaciones intestinales.
• Evitar uso de enemas que contengan magnesio y fosfato para prevenir el desarrollo de hipermagnesemia e hiperfosfatemia.
Diarrea
• La causa más frecuente son los quelantes cálcicos. En pacientes arterioescleróticos descartar siempre isquemia intestinal (puede o no cursar con diarrea sanguinolenta). En los diabéticos considerar la neuropatía autonómica. Descartados estos factores hacer diagnóstico diferencial de diarrea como en la población general.
• Puede tratarse con loperamida según pauta habitual. La clonidina puede ser útil cuando se debe a neuropatía autonómica.
Dolor abdominal
• Puede aparecer como consecuencia de diversas patologías, algunas de las cuales son propias del paciente con ERC, o bien le afectan con mayor frecuencia que a la población general.
Hipo
Secundario a irritación diafragmática. Suele desaparecer con el tratamiento sustitutivo renal. En caso de que no se corrija, suele responder de forma adecuada a la clorpromazina o a la metoclopramida. Si no mejorase, hacer diagnóstico diferencial del hipo [10].
Problemas digestivos más frecuentes asociados a la uremia
Casi el 80% de los pacientes de diálisis presentan síntomas gastrointestinales
Hernia de hiato
Más frecuente que en la población general (diagnóstico por endoscopia). Cursa con menos lesiones de esofagitis, probablemente por el uso habitual de antiácidos.
Gastritis, duodenitis, ulcera péptica
La gastritis y la duodenitis [11] son más frecuentes en pacientes con ERC que en la población general y cursan con los síntomas clásicos. La incidencia de gastritis parece disminuir con el aumento de la dosis de diálisis. Su tratamiento no difiere del de la población general, excepto por el uso de algunos fármacos como las sales de bismuto, que hay que evitar. La enfermedad ulcerosa es 10 veces más frecuente entre la población en diálisis que en la población general [12]. Los pacientes en diálisis tienen mayor riesgo de sangrado de la úlcera [13].
La patogenia de las lesiones del tracto superior del tubo digestivo no está del todo aclarada. Algunos autores especulan que la hipergastrinemia provoca un aumento de la secreción ácida y por tanto la aparición de las lesiones gastrointestinales [14]. Aunque algunos estudios muestran que la prevalencia de infección por Helicobacter pylori es mayor en la ERC, otros muestran que es similar a la de la población general, e incluso menor (prevalencia del 44% en ERC terminal), considerando que la ERC podría ser un factor protector frente al H. pylori [15]. En pacientes con ERC no existe una asociación clara entre dispepsia e infección por Helicobacter pylori lo que limita el valor del screening en este tipo de pacientes; de hecho, los tests no invasivos (serología, test del aliento) son menos sensibles y específicos en la ERC [16].
La Asociación Americana de Gastroenterología ha adoptado una estrategia prudente a la hora de realizar una gastroduodenoscopia para identificar al Helicobacter pylori en población con ERC, que consiste en realizar la gastroduodenoscopia a aquellos pacientes con dispepsia de reciente aparición que no tengan evidencia de reflujo gastroesofágico ni hayan tomado AINEs. Si la sospecha de infección por Helicobacter es baja se recomienda probar con un ciclo de tratamiento con inhibidores de la bomba de protones durante 1-2 meses antes de proceder a la realización de gastroduodenoscopia [17]. El abordaje terapéutico de la infección por Helicobacter pylori es el mismo que en la población general: se recomienda una combinación de amoxicilina, claritromicina y un inhibidor de la bomba de protones durante una semana. En caso de alergia a la penicilina se recomienda sustituirla por metronidazol.
Hemorragia digestiva alta
Los pacientes en diálisis presentan un riesgo aumentado de sangrado por la disfunción plaquetaria inducida por la uremia, la toma en ocasiones de antiagregantes plaquetarios y el uso intermitente de heparina durante la hemodiálisis. El lugar más frecuente de sangrado es el duodeno (existen lesiones duodenales en el 61% de los pacientes en diálisis con test de sangre oculta en heces positivo). La causa más frecuente son las lesiones agudas de la mucosa gástrica tras ingesta de AINEs. En segundo término, está la angiodisplasia gástrica. Las angiodisplasias, tanto del tracto superior como inferior, son más frecuentes en la ERC, y su riesgo de sangrado y resangrado es mayor.
Ante una hemorragia digestiva aguda, el primer paso diagnóstico es la endoscopia; el tratamiento es igual en pacientes urémicos y no urémicos. Existen numerosos estudios acerca del tratamiento de angiodisplasias con estrógenos con resultados dispares. Dado el alto riesgo de la terapia estrogénica (metrorragia, ginecomastia, retención hídrica, trombosis, ictus, neoplasia de mama y endometrio) se necesitan estudios prospectivos y aleatorizados para demostrar su utilidad y seguridad en pacientes con ERC. Hasta entonces el tratamiento de las angiodisplasias con estrógenos debería reservarse para casos de sangrado refractario a tratamiento convencional.
Colelitiasis, colecistitis
Su prevalencia no difiere a la de la de la población general. Su tratamiento es la cirugía convencional o endoscópica.
Diverticulosis
La prevalencia de diverticulosis no es mayor en pacientes con ERC (32%), excepto en aquellos con riñones poliquísticos, en los que sí que aumenta la prevalencia. El riesgo de diverticulitis aguda y perforación está incrementado en pacientes con ERC terminal. La presentación clínica, el diagnóstico y el tratamiento de la diverticulitis aguda es similar al de la población general. Sin embargo, la resección quirúrgica en la diverticulitis se asocia a mayor mortalidad en pacientes añosos con ERC terminal. Las diverticulitis recurrentes son una contraindicación relativa para la realización de diálisis peritoneal (habrá que valorar riesgo/beneficio) [18]. Debe hacerse el diagnóstico diferencial con quistes renales complicados (urocultivo y prueba de imagen: ecografía y TAC abdominal o uroresonancia magnética).
Hemorragia digestiva baja
El lugar más frecuente de la hemorragia es el colon proximal [19]. Las causas más frecuentes son la neoplasia de colon y las angiodisplasias. Además de las causas habituales (diverticulosis, pólipos, enfermedad inflamatoria intestinal, colitis isquémica, hemorroides, fisura anal y tumores), pensar siempre en angiodisplasia o úlceras de colon de etiología no aclarada.
El hallazgo casual de una angiodisplasia durante una colonoscopia no debería ser tratado. La angiodisplasia sangrante o la detección de una angiodisplasia en el contexto de un paciente con sospecha de sangrado digestivo sí que debe ser tratada. Puede aplicarse alguna modalidad de tratamiento endoscópico en función de la experiencia del endoscopista, y eventualmente la cirugía. La eficacia del Octeotride (50-100 mcg dos veces al día) no está contrastada, pudiendo intentarse en casos resistentes e individualizados.
Abdomen agudo
Deben extremarse las precauciones, dado que con frecuencia los casos graves son poco sintomáticos. Se deben tener en cuenta las siguientes consideraciones:
• Oclusión intestinal: Considerarla en pacientes que puedan tener bridas, entre ellos los que han estado en DP.
• Isquemia-necrosis mesentérica: en el 14% de los pacientes de hemodiálisis se ha encontrado evidencia histológica de isquemia mesentérica en autopsias [20]. Esta alta frecuencia se asocia principalmente a inestabilidad hemodinámica e hipotensión arterial intradialítica en pacientes mayores y con arterioesclerosis. El cuadro es más grave en pacientes en diálisis respecto a la población general, y es más frecuente en colon ascendente. En pacientes en diálisis peritoneal, los síntomas son similares a los de una peritonitis, lo que puede retrasar el diagnóstico correcto, con el consecuente aumento del riesgo de mortalidad [21].
• Necrosis y/o perforación de colon ascendente o región ileocecal: diagnóstico diferencial con apendicitis aguda (misma clínica). Debe diferenciarse de la enfermedad isquémica intestinal que afecta a colon descendente.
• Perforación espontánea de colon: Puede ocurrir por impactación fecal, sin divertículos ni ulceración. En pacientes con muchos años en diálisis pensar en infarto intestinal por depósitos amiloides (tipo ?-2 microglobulina). Otros factores a los que se ha asociado son: antiácidos con base de aluminio, contrastes baritados, deshidratación.
• Peritonitis en pacientes en diálisis peritoneal
Pancreatitis
La etiología es la misma que en población general, sin embargo, algunos factores de riesgo son más prevalentes en pacientes en diálisis (enfermedad vascular, poliquistosis renal, fármacos e hiperparatiroidismo). La incidencia de pancreatitis es mayor en pacientes en diálisis, especialmente en los tratados con DP, con clínica que puede confundirse con una peritonitis. La razón de este aumento de incidencia en la DP no está del todo aclarada. Algunos autores sugieren que las características del líquido de la DP (acidez, hipertonicidad, concentración de glucosa) pueden tener efectos tóxicos sobre el páncreas, al igual que los antibióticos intraperitoneales usados para el tratamiento de la peritonitis. El tratamiento es similar al de la población general. El uso de heparina en hemodiálisis debe reducirse para disminuir el riesgo de hemorragia pancreática. Hay que tener en cuenta que los niveles de amilasa y lipasa generalmente están aumentados en pacientes con ERC terminal en ausencia de pancreatitis aguda. El pronóstico es peor entre la población en diálisis.
Ascitis de diálisis
Su diagnóstico es de exclusión: deben considerarse los cuadros descritos en la (Tabla 2). Las características del líquido peritoneal incluyen: color pajizo, proteínas elevadas (de 3-6 g/dl), leucocitos entre 25 a 1600/mm3. Presenta mal pronóstico con una mortalidad del 45% a los 15 meses del diagnóstico.
Existe una entidad, la “ascitis asociada a la hemodiálisis”, en la que se desarrolla ascitis en pacientes en hemodiálisis en ausencia de una causa clara que la provoque. La etiopatogenia se desconoce, aunque se han implicado varios mecanismos: sobrecarga crónica de volumen con congestión hepática, cambios en la permeabilidad de la membrana peritoneal en pacientes previamente tratados con diálisis peritoneal, alteración linfática peritoneal. El tratamiento inicial consiste en la restricción hídrica con disminución de la ingesta de sal, ultrafiltraciones importantes en cada sesión de diálisis, paracentesis intermitentes y mejora del soporte nutricional. Si estas medidas fracasan, se puede plantear la transferencia a diálisis peritoneal. El pronóstico también es muy malo, siendo el trasplante renal el único tratamiento definitivo [22].
Peritonitis encapsulada esclerosante
Es un proceso inflamatorio que transforma la membrana peritoneal en un tejido fibroso que rodea y comprime las asas intestinales conduciendo a cuadros de obstrucción intestinal y muy frecuentemente a la muerte del paciente (mortalidad de hasta el 51%) [23]. Ocurre entre el 0-0.4% de pacientes en diálisis peritoneal, aumentando su incidencia conforme aumenta la estancia en DP (15% en los que llevan más de 15 años) [24].
Consecuencias de la cirugía bariátrica
La ‘epidemia’ de obesidad que estamos experimentando en los últimos años ha provocado un aumento importante en la realización de cirugía bariátrica. Cuando se comenzó a realizar el bypass yeyunoileal aparecieron múltiples casos de fracaso renal agudo y de progresión de ERC previamente conocida, lo cual se achacó a la hiperoxaluria secundaria a la cirugía y a nefropatía por oxalato. Con las nuevas técnicas de la cirugía bariátrica (Y de Roux) la incidencia de estas complicaciones ha disminuido de forma notable aunque aún sigue habiendo casos de hiperoxaluria, nefrolitiasis y nefropatía por oxalato. Por lo tanto, es conveniente vigilar la evolución de la función renal en pacientes con ERC que se sometan a cirugía bariátrica [25].
Síndrome del intestino irritable
Es más frecuente en pacientes en diálisis que en la población general (prevalencia del 11-44% en hemodiálisis), generalmente infradiagnosticado. Aunque la patogenia del síndrome del intestino irritable no es conocida, se cree que juega un papel importante en pacientes en hemodiálisis la alteración en la secreción y motilidad intestinal, la hipersensibilidad visceral y la disregulación del eje cerebro-intestino [26], y la alta prevalencia de ansiedad y depresión (20-30%) [27].
APARATO RESPIRATORIO
Edema pulmonar
Es una de las causas más frecuente de urgencia dialítica. Puede deberse a sobrecarga de volumen y/o fallo cardiaco. Las manifestaciones precoces pueden ser anodinas, como dificultad para conciliar el sueño, malestar, tos irritativa y aumento del trabajo respiratorio, con ausencia de estertores crepitantes o edemas. El interrogatorio revela que estas molestias son menores en la noche que sigue a una sesión de diálisis. Suele acompañarse de incremento de la tensión arterial.
Los pacientes que tienen patología pulmonar asociada pueden presentar disnea con clínica de broncoespasmo como consecuencia de una situación de pre-edema pulmonar por sobrepeso o de reagudización de su problema pulmonar de fondo. Ante la duda, lo primero es ultrafiltrar al paciente y a continuación reevaluar el cuadro pulmonar.
Por lo dicho anteriormente, se deduce que la estimación del estado hídrico del paciente en hemodiálisis es un reto. Una técnica a la que se le está prestando cada vez más atención para la estimación del estado hídrico del paciente es la ecografía pulmonar, la cual se está mostrando como una técnica altamente sensible, con aceptable reproducibilidad intra e interoperador, fácil de usar y sin efectos secundarios [28].
Derrame pleural
El derrame pleural que aparece en pacientes con síndrome nefrótico es consecuencia directa de la hipoproteinemia, siendo generalmente un derrame bilateral. El aspirado repetido del trasudado no es recomendable ya que puede reducir aún más los niveles de proteínas. Si tras el correcto tratamiento de la patología que provoca el síndrome nefrótico y la realización de toracocentesis, el derrame pleural vuelve a aparecer y es lo suficientemente grande como para provocar síntomas, se recomienda la realización de pleurodesis [29].
La incidencia de derrames pleurales en pacientes en hemodiálisis hospitalizados de larga estancia llega a ser de alrededor del 20%, resultado de la hipervolemia secundaria a la pérdida de peso seco que puede pasar desapercibida durante el ingreso.
Si existen datos clínicos y radiológicos de sobrecarga de volumen o de insuficiencia cardiaca congestiva se debe realizar ultrafiltración para corregirlas y llevar al paciente a su peso seco real. A veces, se requieren varias UF cortas y frecuentes para mejorar la tolerancia a la extracción de líquido, especialmente en pacientes con hipoalbuminemia por desnutrición. Es frecuente que estos enfermos estén infradializados, por lo que la diálisis intensiva suele ser beneficiosa.
Excluida la sobrecarga hidrosalina, el estudio del derrame es igual que en pacientes no urémicos y habría que considerar la punción diagnóstica. En los pacientes en diálisis hay que establecer de forma individual la indicación de la punción diagnóstica, ya que esta técnica presenta más riesgos en estos pacientes con respecto a la población general [30]. En estos pacientes, los derrames por sobrecarga de volumen frecuentemente son trasudados. Por otra parte, los pacientes con ERC tienen una susceptibilidad aumentada a derrames pleurales exudativos como consecuencia de su estado inflamatorio, es lo que se conoce como pleuritis urémica [31]. Su histología es la de una pleuritis fibrinosa crónica con exudado estéril con necrosis fibrinoide. Se relaciona con filtración a través de capilares subpleurales y una absorción linfática alterada en los pacientes de diálisis. Estos derrames suelen ser grandes, bilaterales y en ocasiones hemorrágicos. La mayoría de los pacientes están asintomáticos. La disnea suele ser el síntoma más frecuente aunque también puede encontrarse fiebre, dolor torácico de características pleuríticas y roce pleural. Se trata con toracocentesis y diálisis intensiva. Una posible complicación es el fibrotórax, el cual precisa decorticación quirúrgica.
En pacientes en diálisis peritoneal, la aparición de un derrame pleural masivo derecho debe hacernos pensar en un hidrotórax por paso de líquido de diálisis a través del diafragma [32].
En pacientes trasplantados renales las causas de aparición de derrame pleural son múltiples, pero tener en cuenta que pueda ser consecuencia del tratamiento inmunosupresor (sirolimus…) [33].
Una vez descartadas las causas de derrame pleural descritas debemos pensar en otras causas que aparecen en la población general (procesos infecciosos o neoplásicos, etc).
Embolismo pulmonar
Aunque la enfermedad renal se ha asociado clásicamente a una tendencia al sangrado, los eventos trombóticos son frecuentes entre los pacientes en estadios finales de la ERC. Una gran variedad de alteraciones hematológicas protrombóticas se han descrito en estos pacientes (aumento de fibrinógeno, trombocitosis, hemoconcentración, pérdidas urinarias de antitrombina III y proteínas C y S…). Además, también se han descrito factores de riesgo protrombóticos no tradicionales como la hiperhomocisteinemia, disfunción endotelial, inflamación, desnutrición, uso de eritropoyetina, uso de inhibidores de la calcineurina en trasplantados renales [34]. La presencia de síndrome nefrótico también predispone a eventos trombóticos, siendo éstos más frecuentes conforme más marcada sea la hipoproteinemia. Todos los elementos nombrados anteriormente justifican un aumento de la incidencia de tromboembolismo pulmonar en estos pacientes. También se ha visto que el riesgo de recurrencia del tromboembolismo es mayor en pacientes con ERC (incluso con deterioros ligeros de la función renal) [35].
En ocasiones los embolismos pulmonares aparecen tras las maniobras externas para destrombosar una FAV.
Calcificaciones pulmonares
Son frecuentes en pacientes de mucho tiempo en diálisis y con hiperparatiroidismo severo. Es difícil de diagnosticar por radiología convencional, suele ser un hallazgo gammagráfico. Las calcificaciones se pueden caracterizar mediante TAC y RM. Cuando son visibles en la radiografía simple de tórax, la calcificación pulmonar suele producir pequeñas opacidades nodulares que pueden coalescer y formar grandes infiltrados. Es una entidad infradiagnosticada ya que la mayoría cursan de forma asintomática. Pueden provocar un patrón restrictivo y alteración de la difusión pulmonar. En ocasiones evolucionan a hipertensión pulmonar.
Pulmón urémico
Muy raro en la actualidad cuando el inicio de diálisis es precoz y programado. Es un cuadro de edema pulmonar intersticial por aumento de la permeabilidad alveolo-capilar, sin que exista gran sobrecarga de volumen, junto con acidosis metabólica severa, lo que provoca mayor trabajo respiratorio por la hiperventilación compensatoria.
Tuberculosis
Los pacientes con ERC y, en particular aquellos que están en diálisis, tienen un mayor riesgo de desarrollar enfermedad por tuberculosis debido a su condición de inmunodeprimidos. La presentación clínica suele ser insidiosa e inespecífica. El diagnóstico es difícil de establecer usando los tests tradicionales (la prueba de la tuberculina suele ser negativa) por lo que se precisa un alto índice de sospecha. La hemodiálisis complica el tratamiento ya que muchos tuberculostáticos se dializan. Es preciso el ajuste de dosis en la ERC [36].
Urinotórax
Es el acúmulo de orina en el espacio pleural. Es una rara complicación de la uropatía obstructiva, la cual puede provocar un acúmulo de orina en la cavidad abdominal (urinoma) que, en ocasiones, pasa al espacio pleural [37].
Hipertensión pulmonar (HTP)
Los pacientes en diálisis tienen una alta prevalencia de HTP (afecta a más de un tercio de los pacientes). Los principales determinantes de la presión arterial pulmonar son el gasto cardiaco, la resistencia vascular pulmonar y la presión de enclavamiento capilar pulmonar que equivale a la presión en la aurícula izquierda. Todas estas variables se encuentran alteradas en mayor o menor medida en pacientes con ERC, y muy especialmente en diálisis. Así, el estado hiperdinámico que condiciona la fístula arteriovenosa, la anemia o la propia sobrecarga de volumen, frecuente en estos pacientes, aumentan el gasto cardiaco, contribuyendo a un aumento de la HTP. Otros factores que contribuyen al aumento de HTP en el paciente urémico son: el aumento de la resistencia vascular pulmonar secundario a disfunción endotelial y a la producción de diferentes moléculas vasoactivas por parte del endotelio en estado urémico (endotelina-1, dimetilarginina...), las calcificaciones pulmonares metastásicas, las complicaciones trombóticas del acceso vascular y su tratamiento (pueden producir microembolismos subclínicos en la vascularización pulmonar y aumentar la HTP).La ecocardiografía es una técnica no invasiva y útil para la detección de HTP, y debería hacerse de manera rutinaria [38] [39].
Síndrome de apnea obstructiva del sueño
La prevalencia entre los pacientes en diálisis es alta debido al mal control de la ventilación (quimiorreceptores centrales y periféricos alterados), la frecuente sobrecarga de líquido y la disminución del tono de los músculos de la vía respiratoria superior. A estas condiciones hay que añadir los factores de riesgo habituales de la población general (edad avanzada, varón, tabaquismo, diabetes, aumento de la circunferencia del cuello…) [40].
PROBLEMAS SEXUALES Y REPRODUCTIVOS
Disfunción eréctil
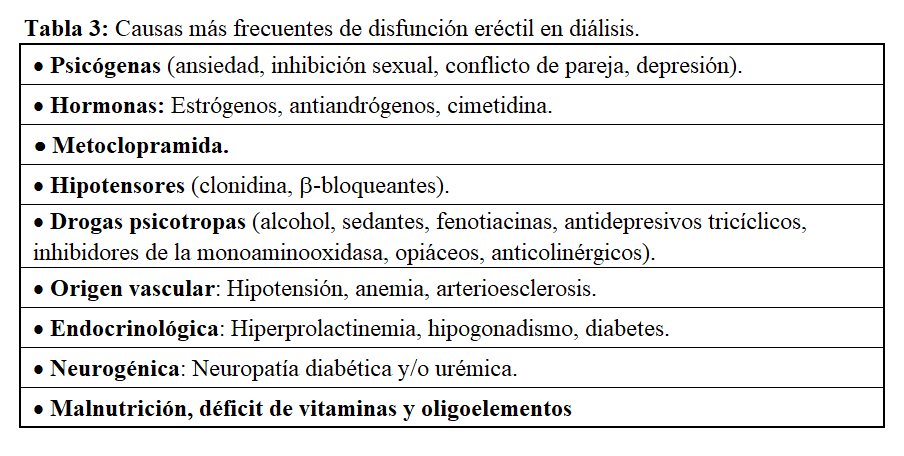
• Tienen su origen en los trastornos endocrinológicos, vasculares, neurológicos y en la alteración psicológica provocada por la situación de uremia. Alguno de los fármacos incluidos en el tratamiento de los pacientes también pueden contribuir a la disfunción eréctil. El 50% de los varones con ERC tienen disfunción eréctil y casi la totalidad de hombres y mujeres tienen disminución de la libido. En un estudio reciente se encontró que la prevalencia de disfunción sexual en pacientes en prediálisis era del 9%, mientras que en aquellos en diálisis era del 70-80% [41].
• Las causas más comunes en diálisis se describen en la (Tabla 3)
• Gran parte de la responsabilidad de la disfunción eréctil la tiene la situación de hipogonadismo hipergonadotrópico que experimenta el paciente urémico. Éste se caracteriza por disminución de la testosterona sérica, elevación de gonadotropinas (FSH y LH), hiperprolactinemia y alteración de la secreción de GnRH por el hipotálamo [42]. La espermatogénesis también está alterada en la ERC. El análisis del semen muestra un volumen de eyaculado disminuido con oligoespermia o azoospermia. Tampoco es infrecuente encontrar ginecomastia en pacientes en hemodiálisis (en el 30% de los hombres). Suele desarrollarse en los primeros meses tras la inclusión en programa de diálisis, normalizándose posteriormente. Su etiopatogenia permanece desconocida.
• Para el diagnóstico del hipogonadismo urémico se precisan determinaciones hormonales de LH, FSH, prolactina y testosterona. Hay que tener en cuenta que la medición de testosterona se debe hacer en 2 muestras de sangre consecutivas, en ayunas y entre las 7 y 9 de la mañana para evitar la variación circadiana [43]. Para el screening del estado androgénico del paciente en diálisis se puede medir la testosterona en muestra de saliva de la mañana [44].
Tratamiento
Medidas generales
Suspender fármacos innecesarios; consejo-apoyo psicológico; evitar hábitos insanos; optimizar la dosis de diálisis; mejorar el estado nutricional. La corrección de la anemia y del hiperparatiroidismo tienen efecto beneficioso.
Farmacológico
Actualmente los principales fármacos son:
• Inhibidores de la fosfodiesterasa: el Sildenafilo es un tratamiento efectivo para la disfunción eréctil en pacientes en hemodiálisis, diálisis peritoneal y en trasplantados renales. Actúa sobre el músculo liso peneano. Está indicado en casos de disfunción eréctil de origen psicógeno, vascular y neurogénico. Los estudios muestran que es efectivo y bien tolerado. Está contraindicado en pacientes tratados con nitritos, se debe utilizar con precaución en aquellos con enfermedad coronaria conocida. Para limitar la posibilidad de hipotensión arterial en los pacientes en hemodiálisis tratados con Sildenafilo, algunos especialistas recomiendan usarlo solamente los días de no diálisis. También se pueden emplear otros inhibidores de la fosfodiesterasa (Tadalafilo, Vardenafilo) pero aún no hay mucha experiencia en pacientes con tratamiento renal sustitutivo [45].
• Prostaglandina E1: su administración intrauretral provoca la liberación de prostaglandinas al cuerpo cavernoso, provocando la erección. La prostaglandina E1 también puede inyectarse directamente en el cuerpo cavernoso, lo que provoca vasodilatación e inhibición de la agregación plaquetaria. Dado que en la ERC la propia uremia provoca disfunción plaquetaria, la inyección intracavernosa de prostaglandina E1 debe usarse con precaución en nuestros pacientes [45].
• Agonistas dopaminérgicos: la bromocriptina es un agonista dopaminérgico empleado en casos de hiperprolactinemia. Empezar con 1,25 mg al acostarse, pudiendo aumentar gradualmente hasta 2,5 mg/12 horas. Se normalizan los niveles de prolactina sin que haya cambios en los de LH y FSH, aumentando los niveles de testosterona. A pesar de su eficacia, su utilidad está bastante limitada por la alta frecuencia de efectos secundarios. La cabergolina tiene menos efectos secundarios y es al menos tan eficaz como la bromocriptina para tratar la hiperprolactinemia, por lo que debería intentarse antes el tratamiento con cabergolina [45].
• Enanatato o depo-tetosterona: la administración de testosterona a pacientes con ERC generalmente no tiene éxito a la hora de restaurar la función sexual y la libido, a pesar de normalizar los niveles de testosterona sérica y reducir los niveles de LH y FSH. Sin embargo, se puede intentar el tratamiento con testosterona en pacientes que tengan sus niveles bajos en sangre [46].
• Clomifeno: droga antiestrogénica que puede emplearse si hay aumento de LH y FSH. La dosis es de 100 mg al día y se ha empleado en ciclos de tratamiento tanto de corta como de larga duración.
• Suplementos de Zinc: el déficit de zinc se encuentra con frecuencia en pacientes con ERC. La corrección de este déficit con suplementos orales aumenta los niveles de testosterona mejorando la libido y la disfunción eréctil. Esta mejoría no se ha conseguido demostrar en todos los estudios.
• Gonadotropina coriónica humana: la administración prolongada de HCG normaliza los niveles de testosterona, pero éstos vuelven a disminuir rápidamente tras la finalización el tratamiento.
Dispositivos de vacío
Es una opción muy efectiva en pacientes con ERC que no han respondido al tratamiento médico [47].
Tratamiento quirúrgico
1. Revascularización: no es efectiva. Prácticamente no se emplea.
2. Prótesis de pene: resultados aceptables si la indicación es correcta. Problema técnico quirúrgico para futuro trasplante renal por ocupación del espacio latero vesical con el reservorio de prótesis, sin embargo hay prótesis sin reservorio paravesical.
3. Trasplante renal: la hemodiálisis o la diálisis peritoneal raramente mejoran la disfunción eréctil, sin embargo el trasplante renal se ha mostrado como la medida más eficaz para restaurar la normalidad de la función sexual, especialmente en los pacientes más jóvenes [48]. Aunque los niveles de testosterona habitualmente mejoran en los 6-12 meses post-trasplante, un 25% de varones permanece con el hipogonadismo uno o dos años tras el trasplante renal.
Anomalías de la menstruación
• La ERC en mujeres se acompaña frecuentemente de disregulaciones endocrinas que provocan alteraciones en la menstruación y en la fertilidad. Existe un defecto en la secreción hipotalámica de gonadotropinas lo que resulta en picos menores de estradiol, ratios FSH/LH disminuidos y un aumento en la concentración de prolactina sérica. Todas estas alteraciones provocarán ciclos anovulatorios y amenorrea persistente. Al mismo tiempo la hiperprolactinemia se ha asociado a disminución del deseo sexual, infertilidad, vaginitis atrófica, disminución del vello púbico y prurito [49].
• Las mujeres con ERC deben seguir controles estrictos por su ginecólogo ya que se desconoce si los ciclos anovulatorios pueden favorecer la hiperplasia endometrial y un posible carcinoma.
• La amenorrea ocurre aproximadamente en el 50% de mujeres con ERC. Algunas mejoran al comenzar diálisis y al corregirse la anemia. Las que mejoran vuelven a tener sus reglas normales, pero la mayoría de los ciclos son anovulatorios. Otras pacientes sufren hipermenorrea y polimenorrea. La coagulopatía urémica y el uso de heparina durante la hemodiálisis pueden empeorar el sangrado [50].
Tratamiento de la hipermenorrea o polimenorrea:
1.- Si quieren tener reglas utilizar la combinación de estrógenos/progestágenos de baja dosis (micropíldora) para evitar problemas de tensión arterial. Si se detecta hiperprolactinemia se puede utilizar bromocriptina.
2.- Si tienen hemorragias uterinas disfuncionales con déficit de progesterona por fallo en la luteinización del folículo se puede tratar con progesterona (4 mg de medroxiprogesterona diario) entre los días 14 y 25 del ciclo lo cual conduce a la transformación endometrial y a una regla normal.
3.- Ante metrorragias tratar con dosis altas de progesterona (50-100 mg IM de medroxiprogesterona) durante 1-2 días. Utilizar AINEs sólo en pacientes que ovulan y que tienen ocasionalmente metrorragias por sus efectos secundarios.
4.- Si metrorragias repetidas o si se quiere evitar la regla por su efecto anemizador, se puede provocar atrofia endometrial mediante las siguientes medidas:
- Acetato de medroxiprogesterona 0,5-1 gr IM cada 2-3 meses.
- Legrado profundo o con laser
- Histerectomía: procedimiento de elección en mujeres post o peri-menopaúsicas.
Embarazo en la ERC leve-moderada
La ERC se asocia a una mayor tasa de eventos adversos tanto maternos como fetales. Estas complicaciones serán más frecuentes conforme avance el deterioro de la función renal [51].
Los eventos adversos maternos descritos son: hipertensión arterial gestacional, preeclampsia (en la ERC puede aparecer preeclampsia en el segundo trimestre del embarazo), eclampsia, mortalidad materna.
Los eventos adversos fetales descritos son: crecimiento intrauterino retardado, tamaño disminuido para la edad gestacional, parto pretérmino, muerte fetal [52].
Es importante discontinuar el tratamiento de posibles medicaciones teratógenas que tome la paciente (IECA, ARA-II, algunos inmunosupresores…) tan pronto como se diagnostique el embarazo.
Embarazo en la mujer en diálisis
• La mayoría de las mujeres en hemodiálisis tienen la fertilidad disminuida por varios motivos: anemia, hiperprolactinemia, tratamiento con múltiples fármacos, depresión, disminución del apetito sexual, y disfunción hipotálamo-hipofisaria que provoca disfunción ovárica y ciclos anovulatorios [53]. En algunas mujeres la función reproductora se normaliza haciendo posible el embarazo. Se cree, aunque no está documentado, que la frecuencia de embarazos de mujeres en hemodiálisis está aumentando desde un 1% a un 7% según las publicaciones más recientes, siendo diferente entre distintos países [54]. En diálisis peritoneal la frecuencia es menor, siendo de hasta la mitad que en hemodiálisis. La frecuencia verdadera es desconocida ya que muchos embarazos terminan con aborto precoz espontáneo. La concepción es más frecuente en mujeres que mantienen diuresis residual.
A pesar de que la mortalidad fetal todavía es alta y que la prematuridad y el bajo peso al nacer son la regla general, el número de embarazos con éxito en pacientes en hemodiálisis ha aumentado con el paso de los años, con una supervivencia fetal final del 90% en los últimos años (en la década de 1980 era del 23%) [55].
Las posibles complicaciones maternas son: aborto espontáneo, desprendimiento placentario, anemia, infección, ruptura prematura de membranas, polihidramnios, parto pretérmino, descontrol de hipertensión arterial, preeclampsia, eclampsia, hemorragia, necesidad de practicar cesárea y muerte materna [56].
Las posibles complicaciones fetales son: restricción del crecimiento intrauterino, sufrimiento fetal agudo y crónico, prematuridad, dificultad respiratoria del recién nacido, crecimiento en una unidad de cuidados intensivos neonatales y muerte en útero o neonatal.
Pero si la mujer insiste en intentarlo debemos prestar atención a las siguientes consideraciones:
• Diagnóstico: las reglas anómalas y los frecuentes dolores abdominales de las pacientes en hemodiálisis retrasan el diagnóstico del embarazo. Un empeoramiento de la anemia, la resistencia a eritropoyetina y episodios de hipotensión arterial inexplicados en pacientes premenopáusicas debe hacernos pensar en la posibilidad de que la paciente esté embarazada. Los test de embarazo de orina no son útiles, aun cuando la paciente presente diuresis residual. La medida de gonadotropina coriónica humana es inexacta, ya que ésta es producida por células somáticas y eliminada por el riñón, por lo que la ecografía es la única medida valorable para calcular la edad gestacional.
• Trabajo conjunto y coordinado del ginecólogo, nefrólogo, enfermería de hemodiálisis y nutricionista.
• Estrategia de diálisis: aumentar el tiempo de diálisis favorece una gestación más prolongada y consecuentemente un mayor peso de los niños al nacer y una disminución de las complicaciones a largo plazo. Se aconseja aumentar la dosis de diálisis para mantener niveles de BUN prediálisis < 50 mg/dl. El tiempo total de diálisis que se debería administrar semanalmente varía en los diferentes estudios, pero ya existen publicaciones en las que se recomienda un mínimo de 36 horas semanales en pacientes que no tienen función renal residual [57]. En el caso de que tenga función renal residual, el número de horas necesarias será menor. Independientemente del criterio que se siga, la prescripción de la hemodiálisis debe ser suficiente para mantener estables las condiciones maternas en relación con la volemia, presión sanguínea y ganancia de peso entre las sesiones. Heparinización mínima (no teratogenicidad de heparina).
• Control de la tensión arterial: Evitar diuréticos, IECA y ARA II. Usar preferiblemente la alfa metildopa. Mantener tensiones diastólicas por debajo de 90 mmHg y no menores de 80 mmHg. Evitar hipotensores y contracción de volumen.
• Evitar ganancias de peso interdiálisis superiores a 1 kg.
• Usar filtros de alta biocompatibilidad y evitar esterilización con óxido de etileno.
• Prevenir hipercalcemias, hipocalcemias e hipofosfatemias. El baño más frecuentemente usado tiene un cálcio de 1.5 mmol/l, com potasio de 3 mmol/l [58]. Dado que hay una isoenzima placentaria de la fosfatasa alcalina, es posible encontrar niveles elevados de esta durante el último trimestre. No confundir con la fosfatasa alcalina de origen óseo.
• Prevenir alcalosis y acidosis metabólica.
• El objetivo de Hemoglobina será de 10-11 g/dl [58]. Evitar analíticas innecesarias. No se ha documentado teratogenicidad con el uso de eritropoyetina. Usar ferroterapia si precisa.
• Control riguroso de la TA. La normotensión antes del embarazo es un indicador de buen pronóstico.
• El peso seco materno y la ganancia de peso deben ser reevaluados regularmente y ajustados según el peso estimado del feto.
• Nutrición: Ingesta proteica 1-1,2 g/kg/peso pregestacional/día + 10-20 g/día. Ingesta calórica: 35 kcal/kg peso gestacional/día + 300 kcal/día. Suplementos vitamínicos hidrosolubles diarios (complejo B, C y ácido fólico).
• Control ecográfico: ayuda a detectar retardo en el crecimiento intrauterino, situación en que debe aumentarse la dosis de diálisis. Los índices de crecimiento normales alientan sobre la consecución con éxito del embarazo. El polihidramnios es una complicación frecuente.
• Se desaconseja la lactancia materna.
Embarazo en la mujer trasplantada renal
La fertilidad mejora de manera muy importante tras el trasplante renal. Sin embargo, las tasas de embarazo son menores que en la población general (la causa exacta se desconoce).
El embarazo tiene poco o ningún efecto sobre la función renal en la paciente trasplantada. Es aconsejable que la mujer espere a quedarse embarazada al menos un año después del trasplante de donante vivo, y dos años después del trasplante de donante cadáver, para evitar complicaciones derivadas del tratamiento inmunosupresor. La creatinina sérica debería ser menor de 1,5 mg/dl y la proteinuria menor de 500 mg/día.
Es posible que las pautas de tratamiento inmunosupresor deban ser reajustadas antes de intentar la concepción. El micofenolato y el sirolimus están contraindicados en el embarazo. Debería cambiarse de micofenolato a azatioprina, y de sirolimus a tacrolimus o ciclosporina, si no hubiera contraindicaciones.
En principio, el trasplante renal no supone un impedimento para el parto por vía vaginal, aunque el ginecólogo tendrá la última palabra [59] [60].
ALTERACIONES ENDOCRINOLÓGICAS
Hormonas pancreáticas
Insulina: En la uremia se produce resistencia a la insulina. También existe déficit de secreción y aclaramiento de la misma (con FG < 40 ml/min). La resistencia periférica a la insulina comienza en estadios tempranos de la ERC, y se va agravando conforme avanza el deterioro de la función renal. Tras el inicio de la terapia renal sustitutiva, la resistencia a la insulina mejora de forma importante tras varias semanas de tratamiento [61]. La fisiopatología de la resistencia a la insulina en la uremia es compleja, siendo el principal mecanismo una alteración post-receptor en el músculo esquelético. Otros mecanismos que participan son: la inflamación crónica, el exceso de grasa abdominal, disregulación y acumulación de adipokinas, acidosis metabólica, estrés oxidativo, déficit de vitamina D, anemia, descenso de actividad física y acumulación de toxinas urémicas [62].
Las consecuencias clínicas son: curva diabética de tolerancia a la glucosa, hiperglucemia discreta en ayunas, aumento de síntesis de VLDL, peor actividad de la lipoprotein lipasa con hipertrigliceridemia, hipertensión arterial y aumento del riesgo cardiovascular [63].
A pesar de las alteraciones en el metabolismo de la insulina, la mayoría de pacientes no diabéticos con ERC (incluso en estadios avanzados) no desarrollarán hiperglucemia persistente, a no ser que tengan una predisposición genética para la diabetes.
Entre los pacientes con diabetes y ERC, los requerimientos de insulina tienen un curso bifásico. El control de la glucemia se deteriora conforme la ERC avanza (aumenta progresivamente la resistencia periférica a la insulina). Pero se llega a un punto, en estadios avanzados de la ERC, en el que el aclaramiento renal de la insulina es tan bajo, que los requerimientos de insulina exógena disminuyen, posibilitando incluso el cese de tratamiento con insulina y el inicio de antidiabéticos orales [64].
Glucagón: Hormona catabólica que aumenta por disminución de su degradación. Consecuencias clínicas: gluconeogénesis, aumento del catabolismo proteico.
Eje Hipotálamo-Hipófisis-Tiroides:
La ERC provoca alteraciones tanto en la función de la glándula tiroidea como en su estructura (aumento de su volumen). La uremia afecta al eje hipotálamo-hipófisis-tiroides, así como al metabolismo periférico de las hormonas tiroideas [65]. Esto se traduce en que en la ERC se detectan, habitualmente, niveles de TSH normales, con niveles de T4 normales y de T3 normales o reducidos [66]. Tras la administración exógena de TRH ocurre una respuesta frenada de TSH, y cuando se administra TSH aumenta la T3 pero no la T4.
La disminución de los niveles de T3 se debe a una alteración de la conversión de T4 a T3 provocada por la acidosis metabólica y la malnutrición.
Los niveles de TSH suelen ser normales pero sus picos de secreción están alterados con respecto a la población general [66].
El tratamiento con EPO mejora la respuesta anómala de la hipófisis a los niveles bajos de hormonas tiroideas pero no mejora la respuesta de la glándula tiroides a la acción de la TSH.
La frecuencia de bocio, nódulos tiroideos solitarios e hipotiroidismo es mayor en diálisis que en la población general. Se recomienda realizar control de hormonas tiroideas en todos los pacientes de diálisis. El enfoque diagnóstico del bocio y de los nódulos solitarios es igual que en pacientes no urémicos, sin embargo en los pacientes con ERC avanzada a veces resulta difícil realizar un diagnóstico clínico de hipotiroidismo ya que los síntomas se pueden confundir con los de la uremia. El diagnóstico de hipotiroidismo requiere documentar niveles séricos bajos de T3 y T4 junto a niveles elevados de TSH. Debe tratarse con L-tiroxina.
La prevalencia de hipertiroidismo en la ERC es similar a la de la población general [61].
En pacientes en hemodiálisis, en ocasiones, se observa una elevación transitoria de los niveles de T4, causada por el uso de heparina para anticoagulación del circuito de diálisis [61].
Se ha encontrado asociación entre diferentes tipos de glomerulopatías y alteraciones funcionales tiroideas. Aunque menos frecuente, también hay alteración de la función tiroidea en trastornos tubulointersticiales. En el síndrome nefrótico los cambios en los niveles de hormonas tiroideas se deben principalmente a la pérdida de proteínas por la orina. Algunos autores han encontrado asociaciones entre algunos tipos de cáncer tiroideo y tumores renales [67].
Eje Hipotálamo-Hipófisis-Suprarrenal:
Hay resultados discordantes en relación a los niveles de cortisol en la uremia, dependiendo en parte de problemas metodológicos. Los últimos datos disponibles hablan de niveles disminuidos de cortisol en presencia de ACTH normal lo que indica una resistencia de la glándula suprarrenal a la ACTH y una incapacidad de la hipófisis para incrementar la secreción de ACTH en respuesta a los niveles bajos de cortisol.
Consecuencias clínicas: No existe una repercusión clínica evidente de este supuesto estado de hipofunción suprarrenal. Así mismo, los pacientes en diálisis tampoco presentan normalmente signos ni síntomas cushingoides.
Eje Hipotálamo-Hipófisis-Gonadal:
En varones: FSH elevada o en el límite alto de la normalidad, LH elevada, estradiol normal, testosterona disminuida. La elevación de la FSH provoca alteraciones de la espermatogénesis. La disminución de andrógenos provoca un aumento de la cantidad total de grasa en el cuerpo, contribuye a la enfermedad mineral-ósea de la ERC, anemia, disminución de la libido, disfunción eréctil y depresión [68].
En mujeres: FSH normal, LH elevada, estradiol bajo, progesterona baja. Las consecuencias de estas alteraciones son: alteraciones menstruales, infertilidad, disminución de la densidad mineral ósea [69]. Los niveles de ambas gonadotropinas aumentan adecuadamente tras la administración de hormona liberadora de las gonadotrofinas o clomifeno, lo que sugiere que la función pituitaria se conserva en la uremia.
Eje Hipotálamo-Hipófisis-Prolactina:
Aproximadamente el 30% de los pacientes tienen niveles de prolactina entre 3 y 6 veces más elevados que la población normal, sin respuesta a la TRH. Niveles de prolactina superiores a 100 ng/ml deben ser investigados. Además, también está alterado el ritmo normal de secreción diaria de prolactina. A nivel clínico esta hiperprolactinemia es causa de ginecomastia con galactorrea, hipogonadismo, disfunción eréctil y trastornos menstruales (amenorrea, oligomenorrea…).
El tratamiento con EPO normaliza los niveles de prolactina, mejora la función sexual en los varones y normaliza las reglas en la mujer. También el tratamiento con bromocriptina corrige la hiperprolactinemia.
Hormona de crecimiento (GH):
Las alteraciones del eje de la GH han sido descritas tanto en niños como en adultos, y pueden tener consecuencias clínicas importantes. En niños, la más grave es el retraso del crecimiento con una altura final en edad adulta disminuida (un 40 % de ellos no alcanza la altura estimada para su edad). Otros mecanismos que influyen en este retraso son el tipo de nefropatía, los trastornos metabólicos de la ERC, el tratamiento con corticoides y otros trastornos endocrinológicos [70]. Los niveles de GH pueden ser normales, aunque generalmente están elevados (dependiendo del grado de daño renal) debido a una disminución de la eliminación renal de GH [71].
La mejoría de la anemia con EPO corrige parcialmente estas alteraciones. El fallo renal provoca una situación de resistencia a la GH, con niveles generalmente elevados de la hormona. Los mecanismos de resistencia a la GH son: reducción de la densidad de receptores de GH en los órganos diana, alteración en señales de transducción y transcripción, niveles reducidos de IGF1 libre.
El tratamiento con GH recombinante humana en niños con retraso del crecimiento se ha mostrado seguro y eficaz, consiguiéndose una altura final en la edad adulta casi normal en el 65% de los niños tratados. Existe una mejor respuesta al tratamiento en pacientes en estadios prediálisis, probablemente por una menor resistencia a la GH. El tratamiento también es eficaz en niños después del trasplante renal [72]. Los niños que más se benefician del trasplante renal son aquellos menores de 6 años [73]. El tratamiento con GH recombinante en adultos con ERC puede tener beneficios (ganancia de masa muscular, disminución del desgaste proteico) pero también tienen riesgos, por lo que aún hacen falta más estudios para poder recomendarlo en adultos.
Eritropoyetina:
Los riñones son los responsables de la síntesis del 85-90% de EPO circulante (el resto es sintetizado en el hígado). Conforme se deteriora la función renal, la síntesis de EPO por parte del riñón disminuye y la resistencia periférica a la EPO aumenta. La consecuencia clínica directa es la presencia de anemia [61].
Hormonas del tejido adiposo:
El tejido adiposo ya se considera un órgano endocrino, ya que produce una amplia variedad de sustancias biológicamente activas, las adipokinas.
En la ERC, la concentración plasmática de diferentes adipokinas está aumentada. Las más importantes son las siguientes:
- Leptina: el aumento de su concentración plasmática estimula la actividad del sistema nervioso simpático, lo que se relaciona con progresión de la ERC, hipertensión arterial y aumento del riesgo cardiovascular.
- Adiponectina: aún no están claras las consecuencias clínicas de su aumento en la ERC.
- Resistina: su aumento provoca inhibición de la actividad de los neutrófilos, y por lo tanto una mayor prevalencia de infecciones.
- Visfatina: su aumento se relaciona con disfunción endotelial y malnutrición [74].
ALTERACIONES DE LA PIEL
Prurito
Definición y diagnóstico
Los estudios sugieren que la prevalencia del prurito urémico está decreciendo en los últimos años gracias a una diálisis más efectiva. En los años 80 la prevalencia era del 80%, y en estudios recientes la prevalencia en hemodiálisis era del 42% [75].
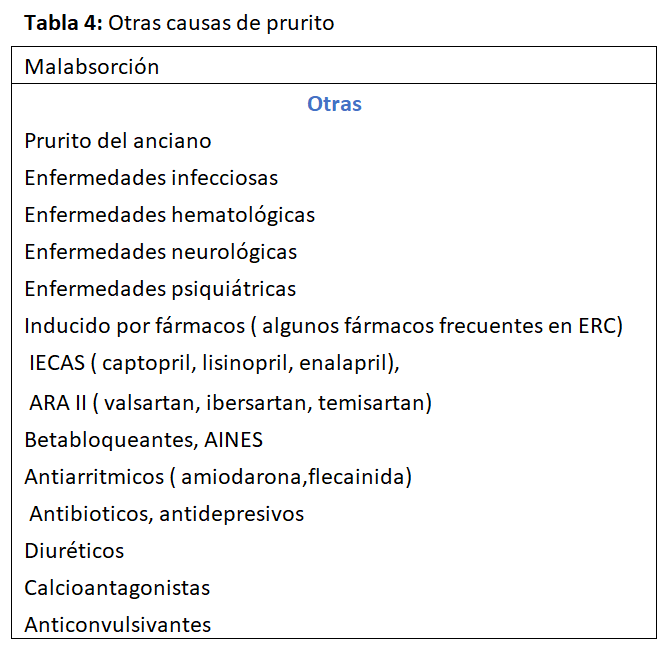
El prurito crónico se define como una sensación desagradable de piel que provoca urgencia de rascarse con síntomas presentes durante > 6 semanas según la reciente definición del Forum Internacional para el estudio del Prurito IFSI) [76]. Para denominarlo prurito urémico se deben excluir otras causas de prurito (Tabla 4), realizar una buena historia clínica y solicitar una serie de pruebas (Tabla 5) [77]. El diagnóstico de prurito urémico es un diagnóstico de exclusión.
Características del prurito urémico
Suele tener una localización generalizada (31-61%) y si es localizado predomina en extremidades inferiores y se asocia con frecuencia a Xerosis (sequedad de la piel) hasta en casi un 90% [78].
En un 43 % pueden no existir lesiones cutáneas [78]. En el resto, las lesiones son secundarias a la intensa actividad de rascado: Excoriaciones (con y sin impétigo), costras lineales, pápulas, ulceraciones , prurigo nodularis (con menos frecuencia) y/o liquenificación (liquen simple crónico) que es la reacción secundaria al rascado más frecuente en los enfermos dializados [78] [79].
Se debe descartar la dermatosis perforante adquirida o enfermedad de kryle [80] que produce prurito intenso y se debe a la eliminación transepidérmica de bandas alteradas de colágeno. Se manifiesta por múltiples pápulas umbilicadas hiperpigmentadas y nódulos con un tapón central queratósico y se localiza frecuentemente en las extremidades, especialmente en las piernas, tronco y cuello. Se caracteriza por el Fenómeno de Koebner, que consiste en la reproducción de las lesiones al realizar una injuria de la piel. Predomina en adultos del sexo femenino principalmente con diabetes mellitus descompensada e insuficiencia renal crónica en hemodiálisis, de causa aún desconocida. Otras patologías sistémicas asociadas son hipotiroidismo, cardiopatía hipertensiva e hipertensión arterial.
El momento de inicio es variable antes de entrar en hemodiálisis (HD) o años después, suele ser persistente. No tiene un claro predominio estacional, aunque entre 10 y 20% empeora en verano. Mas frecuente cuanto más tiempo en HD (microangiopatía dérmica con el engrosamiento progresivo de la membrana basal). El prurito urémico se relaciona con la diálisis hasta en un 40% de los casos (aparece o empeora durante o inmediatamente después) [81], lo que puede deberse a la disminución del umbral sensitivo para los estímulos nociceptivos durante la sesión. La incidencia es significativamente mayor entre los pacientes con diuresis residual menor de 500 ml/día y en mayores de 65 años, en sesiones vespertinas y en hemodiálisis más de 15 años [82]. Se ha descrito una mayor prevalencia de prurito urémico en pacientes en diálisis peritoneal comparado con hemodiálisis [83].
Etiopatogenia del prurito urémico
Es bastante desconocida. Las diferentes hipótesis implican: mecanismos inmunológicos, mecanismos del sistema opioide, otros mecanismos [84].
- Hipótesis inmunológica: propone que el prurito es el resultado de una inflamación sistémica más que un trastorno local de la piel. En estudios se ha visto un papel directo de células T proinflamatorias y citocinas. Otros marcadores que también se han asociado al prurito en algunos estudios son: albúmina baja y ferritina alta.
- Hipótesis opioide: la alteración en la expresión de los receptores opioides mu y kappa provoca prurito.
- Otros mecanismos: liberación de histamina por mastocitos, xerosis.
Factores de riesgo:
No se ha identificado una sola causa que provoque el prurito urémico, sino que múltiples factores se han asociado al mismo: diálisis inadecuada, hiperparatiroidismo, producto calcio-fósforo elevado, xerosis (piel seca provocada por atrofia de glándulas sudoríparas), elevación de magnesio y aluminio en sangre, algunos fármacos, comorbilidades asociadas como diabetes o hepatopatías, neuropatía periférica, estrés, conflitos emocionales, estado proinflamatorio con aumento de citoquinas, anemia, uso de altas dosis de eritropoyetina y hierro, hipotiroidismo.
Prevalencia del prurito urémico
El 36% de los pacientes en hemodiálisis en España sufre prurito moderado o severo según resultados del DOPPS [80]. Uno de los problemas es el infradiagnóstico y los nefrólogos no han prestado suficiente atención a este síntoma. En la Guía de práctica clínica KDIGO 2012 para la evaluación y el tratamiento de la ERC, el prurito no se analiza como una complicación de la ERC [85].
En la actualización de 2015 de la guía KDOQI para la adecuación de la hemodiálisis, el prurito se considera uno de los varios síntomas que comprenden el “síndrome residual” en pacientes sometidos a hemodiálisis [86].
El 17% de los pacientes con prurito habitual no informan sus síntomas y se estima que el 65% de los responsables de las unidades de HD creen tener una prevalencia de prurito menor del 5% entre sus pacientes, cuando en realidad oscila entre el 21-50% [81].
Como se mide el prurito
El Prurito es un síntoma complejo y subjetivo en el que hay que evaluar diferentes aspectos : intensidad, gravedad, duración y su repercusión sobre sueño, calidad de vida, etc. Es por ello que para su medición probablemente tengamos que combinar diferentes escalas [81] [87]: La escala visual analógica del prurito mide intensidad, la escala modificada de Pauli-Magnus mide la distribución e impacto en el sueño, la escala 5-D itching scale mide el impacto en la calidad de vida y la de Skindex-10 el impacto emocional, social y laboral del prurito en la vida de los pacientes.
Consecuencias del prurito urémico
El prurito moderado- severo tiene consecuencias negativas sobre el estado de ánimo (depresión) [81], calidad del sueño [75] y calidad de vida [88] . Se asocia a un mayor riesgo de infecciones (bacteriemia, uso de antibióticos) con el consiguiente aumento en el uso de recursos económicos [89]. El prurito severo es un factor predictivo independiente para mortalidad, incluso después de ajustar para otros factores (HR=1.595; p=0.0084) [90]. Se ha descrito un mayor uso de eritropoyetina en pacientes con prurito moderado-severo. Los pacientes que informan picazón pueden tener una tasa un 7% más alta de sesiones de diálisis perdidas como consecuencia de su malestar por el prurito urémico [89].
Tratamiento
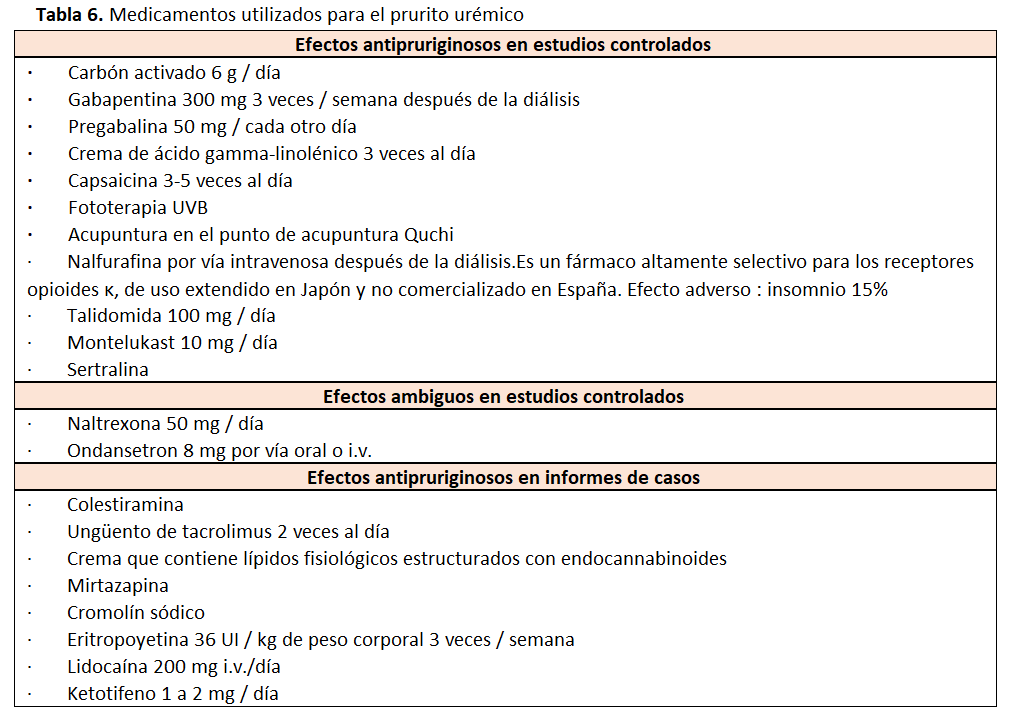
En general, la falta de conocimiento sobre la patogénesis del prurito urémico hace que no haya tratamientos plenamente útiles. Las pautas actuales recomiendan el uso de una amplia gama de medicamentos, en su mayoría fuera de etiqueta, con diferentes mecanismos de actuación (Tabla 6). Una reciente revisión sistemática [91] que incluye 44 estudios con 39 fármacos diferentes concluye que la evidencia actual para los tratamientos antipruriginosos frente la prurito urémico es débil por que los estudios disponibles tienen un alto riesgo de sesgo y son muy heterogéneos.
Tratamiento general del prurito
Para el tratamiento del prurito urémico se deben utilizar, como primera línea o asociada a otras, las medidas generales utilizadas para cualquier tipo de prurito que se exponen en la (Tabla 7).
Tratamientos tópicos y emolientes.
Es uno de los tratamientos fundamentales del prurito urémico. Las alteraciones en la vascularización cutánea y la disminución de las glándulas sebáceas y sudoríparas de los pacientes con ERC favorecen la sequedad de la piel. Se sugiere usar un emoliente con alto contenido en agua. Las pomadas de tacrolimus se han mostrado eficaces en una cohorte pequeña de pacientes con reducción del prurito de hasta un 80% pero su eficacia se pierde a las pocas semanas de retirarlo [92].
Antihistamínicos.
Aunque la mayoría de nefrólogos utilizan antihistamínicos orales como tratamiento de primera línea del prurito (DOPPS) su eficacia es débil o nula [93]. Algunos pacientes responden a altas dosis ( x 4 veces ). Hidroxicina y clorfenamina muestran un efecto parcial o no efecto. Peligro: efecto sedante en población anciana y frágil; riesgo de caídas y fracturas Los antihistamínicos están indicados para el prurito pero no son efectivos en el prurito urémico
Gabapentina
En un ensayo clínico doble ciego de 25 pacientes, la gabapentina a dosis de 300 mg/3 veces por semana, demostró disminuir el prurito en la escala visual analógica hasta 7 puntos sin grandes efectos adversos, aunque hay que destacar que la duración del tratamiento fue de tan solo 4 semanas [94]. En otro estudio se consiguieron disminuciones de más de 7 puntos administrando dosis posdiálisis menores de gabapentina (100 mg 3 veces por semana) [95].
Hasta un 37% de los pacientes abandonan el tratamiento por efectos adversos. Una revisión sistemática sobre el tratamiento del prurito concluye que el único fármaco con efecto probado sobre el prurito urémico sería la gabapentina [91]. Si la gabapentina no funciona, la pregabalina puede ser efectiva.Vigilar estrechamente los efectos secundarios neurológicos de estos medicamentos [96].
Montelukast
Utilizado sobre todo en el asma infantil, tiene acción antiinflamatoria por medio de la inhibición de los leucotrienos. Dosis diarias de 10 mg consiguió una disminución en la escala visual analógica del prurito de 3,7 puntos. También disminuyó de manera significativa los niveles de proteína C reactiva, por lo que sus efectos podrían deberse a su acción antiinflamatoria. Fármaco muy seguro con pocos efectos adversos y con pocas interacciones con otros medicamentos sobre el que se va a realizar una revisión sistemática [97] [98].
Difelikefalin
Acción agonista selectiva en los receptores K de las neuronas periféricas. En un ensayo clínico (fase 3) [99] en el que se administraba por vía intravenosa durante las sesiones de HD, demostró ser eficaz desde la primera semana. El 51,9% de los pacientes tratados con difelikefalin consiguieron una reducción del prurito de al menos 3 puntos en la escala visual analógica del picor, mientras que en el brazo de placebo solo lo consiguieron un 30,9% Los efectos adversos descritos con más frecuencia fueron diarrea, vómitos y mareo. Aun no comercializado, se espera para el 2023.
Filtros de polimetil metacrilato (PMMA)
Estos filtros han mostrado disminuciones de 1-2 puntos en la escala visual analógica del prurito. Tienen capacidad adsortiva de partículas de mediano y alto peso molecular [100] y disminución de TNF-aunque un estudio los dializadores de PMMA demostraron disminuir el prurito de manera independiente a las concentraciones de TNF-α [101].
Sertralina
Los antidepresivos como la sertralina también se han usado en el tratamiento del prurito, ya sea urémico o no urémico [91].
En el momento actual, con los fármacos actualmente disponibles y más aceptados para el esquema terapéutico del prurito urémico sería:
1.- Tratamiento tópico con emolientes, ajuste de dosis de diálisis, control de calcio y fósforo
2.- Gabapentina / Pregabalina
3.- si alta comorbilidad: Montelukast
4.- otros: Mirtazapina, Sertralina, naltrexona…
Fototerapia con ultravioleta B
Se ha visto que es efectiva en el tratamiento del prurito urémico. Se debe a que disminuye los niveles de citocinas proinflamatorias y la inducción de la apoptosis de mastocitos. Tener cuidado ya que este tratamiento se ha asociado con un aumento del riesgo de cáncer de piel y no debe ser usado en pacientes inmunosuprimidos. El potencial cancerígeno de este tratamiento es un tema que debe ser discutido con todos los pacientes que vayan empezar este tratamiento. No usar la fototerapia en pacientes con lupus [91].
Trasplante renal:
Es el tratamiento definitivo para el prurito urémico.
Otros tratamientos propuestos con escasa evidencia
Ketotifeno (estabilizador de células mastocitarias). Antagonistas opioides en pacientes con enfermedad severa: naltrexona, butorfanol intranasal o nalfurafina iv. Nicergolina (derivado ergotamínico). Carbón activado oral. Resincolestiramina (resina de intercambio aniónico no reabsorbible que capta los ácidos orgánicos). Talidomina. Ondansetrón.
En conclusión:
• Carecemos de guías específicas en nefrología para el tratamiento del prurito urémico
• A pesar de la reconocida importancia del prurito urémico para los pacientes (más del 50% de los pacientes en HD tiene prurito moderado –severo) , en la actualidad esta infradiagnosticado e infatratado. Los nefrólogos no lo preguntamos ni abordamos activamente este problema.
• El primer paso en el abordaje del prurito urémico es descartar otras causas, hidratar la piel y asegurar una dosis adecuada de diálisis.
• Los antihistamínicos, ampliamente usados por los nefrólogos, no son útiles en el tratamiento del prurito urémico y tienen efectos secundarios indeseables (como sedación).
Fibrosis nefrogénica
Entidad conocida desde 1997 y descrita en pacientes con filtrado glomerular inferior a 30 ml/min (agudos o crónicos) sometidos a RMN utilizando contraste que contiene GADOLINIO (aunque el 5% de los casos no presentan este antecedente). La enfermedad no tiene predisposición racial ni por sexo, afectando por igual a hombres y mujeres. La incidencia aumenta en presencia de procesos pro-inflamatorios previos (trombosis, cirugía, infección, cáncer etc), hiperfosfatemia, hipotiroidismo, el uso de altas dosis de eritropoyetina y hierro. Se caracteriza por un engrosamiento y endurecimiento de la piel en extremidades y tronco, con marcada fibrosis en dermis. Los pacientes en DP o con ERC avanzada (FG<15ml/min sin diálisis) parecen tener mayor riesgo. El lapso de aparición desde la exposición al gadolinio varía desde días hasta meses. Las lesiones típicas se desarrollan de forma progresiva, presentando en extremidades edema, eritema, placas eritematosas de color café, pápulas y nódulos acompañados de prurito, dolor y rubor. La presentación es simétrica, distal y posteriormente proximal con invasión de nalgas y tórax en algunos casos. Puede acompañarse de fibrosis en músculos, vasos y órganos internos, como pulmón, diafragma, miocardio, pericardio y pleura, así como en la duramadre. Tiende a tener un curso crónico, alcanzándose la remisión en pocos casos, dejando lesiones residuales hipopigmentadas y atróficas. El 5% de los pacientes experimentan un curso rápido y fulminante en dos semanas, con afectación de múltiples órganos. Su diagnóstico es anatomopatológico, junto con el antecedente de exposición al gadolinio. El diagnóstico diferencial incluye la esclerosis sistémica, escleromixedema, síndrome mialgia eosinofilia, fascitis eosinofílica, síndrome del aceite tóxico.
En cuanto al tratamiento, la prevención es la mejor opción dado que en la actualidad no hay un tratamiento establecido para este grave trastorno. Se sugiere realizar una medición de la función renal en pacientes con riesgo de tener ERC antes de usar contraste con gadolinio. El gadolinio debe evitarse en pacientes con un filtrado glomerular menor de 30 ml/min. En estos pacientes deberá considerarse el uso de métodos de diagnóstico por imagen alternativos. En el caso de que sea estrictamente necesario el uso de gadolinio deberá usarse la menor dosis posible (el gadoteridol es la opción más segura). Se recomienda la realización de una sesión de hemodiálisis en menos de dos horas tras la exposición al gadolinio (es efectiva en eliminar el 73.8% del gadolinio tras una sesión y el 93% tras dos sesiones). El gadolinio no es correctamente eliminado en diálisis peritoneal. También se sugiere que el tratamiento con hierro sea retirado una semana antes de la RM con gadolinio, así como el tratamiento con eritropoyetina.
Se han ensayado otros tratamientos, pero han demostrado tener escasa eficacia (corticoides, inmunosupresores, plasmaféresis). La fotoféresis extracorpórea está obteniendo buenos resultados, así como el tratamiento con fototerapia sobre las lesiones de la piel.
El trasplante renal proporciona una mejoría en el 54% de los pacientes, y en algunos casos se ha conseguido la remisión completa [102].
Se recomienda rehabilitación intensiva para evitar o retrasar contracturas y deformidades articulares.
Otros trastornos cutáneos
1. Hiperpigmentación difusa: más frecuente en pacientes con diálisis de larga evolución. Su aparición se atribuye al acúmulo de moléculas medias, como pigmentos urocromos, carotenoides y hormona melanocito-estimulante a y ß. Cursa de forma asintomática y puede mejorar con técnicas de diálisis de alta eficacia incluyendo convección [103]. Otro factor que puede oscurecer la piel en estos pacientes es la hemosiderosis secundaria a politransfusiones; puede mejorar tras el tratamiento prolongado con EPO.
2. Xerosis: es la manifestación cutánea más frecuente en la ERC, afectando hasta un 80% de los pacientes. Los mecanismos etiopatogénicos incluyen: hidratación disminuida del estrato córneo, disminución de glándulas sudoríparas y sebáceas, el uso de diuréticos. El tratamiento se basa en la hidratación de la piel y el control del prurito. El baño repetido debe ser evitado y es preferible usar jabones con pH neutro [102].
3. Calcificaciones cutáneas y subcutáneas: pápulas blanquecinas muy pruriginosas por depósitos de sales de calcio. Aparecen en casos de hiperfosforemia o hiperparatiroidismo secundario grave. El tratamiento va dirigido a corregir la alteración metabólica. Puede ser indicación de paratiroidectomía
4. Porfiria cutánea tarda: ocurre en el 1.2-18% de pacientes con ERC, más frecuente en hemodiálisis. Es una dermatosis bullosa causada por fototoxicidad en pacientes con niveles elevados de uroporfirina e isocoproporfirina. En la ERC se acumulan estas dos moléculas por excreción disminuida de las mismas. Las uroporfirinas no se eliminan por completo en la hemodiálisis, pero las membranas de alto flujo mejoran su aclaramiento. Clínicamente aparecen ampollas y erosiones en zonas expuestas a la luz solar (dorso de manos, antebrazo, cara y pies). Estas lesiones dejan cicatriz cuando desaparecen y pueden acompañarse de hipertricosis e hiperpigmentación. El tratamiento consiste en evitar la exposición solar y el uso de protectores solares (con base de zinc y titanio). Es importante el uso de membranas de alto flujo para optimizar la eliminación de las uroporfirinas. También es recomendable disminuir los depósitos de hierro, realizándose flebotomías en diálisis, e incluso tratando con deferoxamina. en casos refractarios a tratamiento. La plasmaféresis es una opción. El trasplante renal es el tratamiento definitivo [102].
5. Pseudoporfiria cutánea: es una dermatosis bullosa inducida por fototoxicidad con unas manifestaciones clínicas y anatomopatológicas parecidas a la porfiria cutánea tarda, pero los niveles de uroporfirinas son normales. Esta enfermedad se asocia con el uso de fármacos fototóxicos (tetraciclina, furosemida, naproxeno, amiodarona, ácido nalidíxico, isotretinoina). El tratamiento se basa en la administración de N-acetilcisteína (precursor del glutatión) y el uso de protección solar, especialmente frente a rayos UVA. Es importante evitar los fármacos que desencadenen esta enfermedad [102].
6. Trastornos ungueales: frecuentes en los pacientes en diálisis (alrededor del 60%). Los más comunes son la ausencia de lúnula y las uñas mitad-y-mitad (prevalencia variable entre el 15-50%, siendo muy específica de pacientes renales). No mejoran al aumentar la eficacia de la diálisis [104].
7. Dermatosis perforante adquirida: La dermatosis perforante adquirida es un trastorno perforante cutáneo poco común. Se caracteriza por la presencia de pápulas y nódulos hiperqueratósicos, e histológicamente por eliminación transepidérmica de varias sustancias tales como queratina, colágeno y fibras elásticas. La etiopatogenia de la dermatosis perforante adquirida es desconocida, presentando una fuerte asociación con traumatismos leves, insuficiencia renal crónica y diabetes mellitus y, con menor frecuencia, con endocrinopatías, enfermedades infectocontagiosas y neoplasias, entre otras. Se trata de una patología relativamente frecuente en las unidades de diálisis (la prevalencia oscila entre 4-10 %). No siempre es diagnosticada y en ocasiones es invalidante por el prurito que produce. Para el tratamiento se usan corticoides (tópicos u orales) y retinoides (tópicos u orales). También se ha empleado con éxito el tratamiento con alopurinol y la fototerapia [102].
8. Calcifilaxis: Véase Calcifilaxis
Es una enfermedad poco frecuente y muy peligrosa, que se presenta con isquemia de la piel y necrosis, y se caracteriza histológicamente por calcificación de las arteriolas dérmicas. La calcifilaxis ocurre con más frecuencia en pacientes con ERC terminal que están en diálisis o que han recibido recientemente un trasplante renal, pero también puede darse en pacientes sin ERC terminal. El término “calcifilaxis” es erróneo, puesto que implica una reacción anafiláctica sistémica. Un nombre más adecuado es arteriolopatía calcificante urémica, que es un término más descriptivo. La calcifilaxis será tratada en otro tema de este libro.
9. Infecciones de la piel: más frecuentes en pacientes con ERC por su alteración en la inmunidad humoral y celular. Son más frecuentes en pacientes diabéticos. La infección fúngica más frecuente es la onicomicosis. Las infecciones virales más frecuentes son el herpes simplex y el herpes zoster [102].
10. Escarcha urémica: actualmente es una manifestación muy infrecuente. Se observa en pacientes con urea mayor de 300 mg/dl. Se debe a la acumulación de urea en el sudor, el cual cuando se evapora, forma depósitos de cristales sobre la piel [102].
11. Trastornos del pelo: la alopecia difusa es la manifestación más frecuente y suele estar provocada por el efluvio telógeno. La decoloración y sequedad del cabello se deben a una disminución en la producción de sebo [102].
12. Alteraciones mucosas: la xerostomía es la manifestación más frecuente. La estomatitis ulcerativa aparece en pacientes con niveles de urea elevados y con poca higiene oral. El aliento urémico se encuentra en pacientes con niveles de urea mayores de 200 mg/dl [102].
PROBLEMAS NEUROLÓGICOS Y PSIQUIÁTRICOS:
Polineuropatía urémica
Es la complicación neurológica más frecuente en los pacientes con ERC. Afecta alrededor del 90% de los pacientes en diálisis (aunque solamente un pequeño porcentaje de éstos es sintomático) y a un 65% de pacientes con ERC avanzada que no están en diálisis [45]. Es más frecuente en HD que en DP, y más en hombres que en mujeres [105] [106].
La causa de la polineuropatía urémica es desconocida. Aunque inicialmente se atribuyó a una insuficiente depuración de moléculas (urea, creatinina, guanidina, ácido oxálico, fenoles, ácidos aromáticos, PTH, beta 2 microglobulina etc), nunca se ha podido establecer una relación de causalidad [105] [106]. Recientemente se ha demostrado que la hiperpotasemia podría tener un papel muy importante en la génesis de la neuropatía urémica [107].
Es una complicación típica, que se manifiesta con afectación nerviosa distal, simétrica, sensitivo-motora y, en ocasiones, disfunción autonómica, con manifestaciones en la piel, estreñimiento o diarrea, y disminución de la sudoración. Se debe a una desmielinización y degeneración axonal. El daño se relaciona directamente con la longitud del axón, de modo que los más largos se afectan antes, por lo que los síntomas se inician en las extremidades inferiores.
Síntomas
Los pacientes con polineuropatía urémica inicialmente presentan alteraciones sensitivas (parestesias, hormigueo, picazón) que afectan a zona distal de miembros inferiores. Aparecerá dolor urente conforme la neuropatía se haga más severa. Los reflejos tendinosos profundos disminuyen, empezando por el aquíleo. Los síntomas progresan proximalmente, y una vez que las alteraciones sensoriales progresan por encima de las rodillas los pacientes pueden desarrollar síntomas en las manos. Los pacientes con daño neurológico más avanzado desarrollarán alteraciones motoras, que incluyen debilidad de músculos distales, mioclonías, atrofia muscular e incluso parálisis. La neuropatía autonómica puede asociarse con cuadros más severos de hipotensión arterial durante las sesiones de hemodiálisis. Otra manifestación de la neuropatía urémica es la sensación paradójica de calor ante estímulos fríos.
Diagnóstico
Puede ser difícil de distinguir de la polineuropatía debida a otras enfermedades causantes de la ERC como la diabetes mellitus, LES, mieloma múltiple y amiloidosis. En estos casos el daño puede ser aditivo. La sospecha diagnóstica la dará la presentación clínica, y el diagnóstico será confirmado por estudios electrofisiológicos. La velocidad de conducción nerviosa en el nervio peroneal es el parámetro más usado para establecer la función motora. La velocidad de conducción nerviosa del nervio sural es incluso más sensible para detectar alteraciones tempranas, pero su medición no está tan extendida.
Los nervios de la extremidad que tenga una fístula arteriovenosa no deberían ser usados para los estudios electrofisiológicos, puesto que los resultados estarán artefactados por la fístula [108].
Tratamiento
En los pacientes con ERC que aún no están en diálisis, la aparición de polineuropatía urémica es una indicación para el tratamiento renal sustitutivo (diálisis o trasplante). Tanto la diálisis como el trasplante han demostrado eficacia en la mejora de los síntomas de la polineuropatía, aunque el trasplante es más efectivo. La hemodiálisis y la diálisis peritoneal presentan la misma eficacia en la reducción de síntomas [109].
En los pacientes que ya están en diálisis y que tienen síntomas de neuropatía urémica, se debe determinar si la prescripción de la diálisis es la adecuada y, generalmente se incrementará la dosis de diálisis, incluso si el objetivo mínimo de Kt/V ya se había alcanzado previamente. Hay evidencia de que la hemodiafiltración puede mejorar la función neurológica [110]. El mantenimiento de niveles normales de potasio en sangre en pacientes con ERC puede prevenir y tratar la polineuropatía urémica [107].
Algunos pacientes siguen teniendo síntomas de neuropatía a pesar del incremento de la dosis de diálisis. En estos pacientes el trasplante renal puede revertir los síntomas [111]. Mientras el paciente espera el trasplante o en pacientes excluidos de la lista de espera de trasplante, el tratamiento farmacológico puede ser efectivo. Tanto la gabapentina como la pregabalina han demostrado eficacia. También se han empleado con éxito los antidepresivos tricíclicos (amitriptilina, desipramina) [112].
El ejercicio físico puede prevenir la pérdida de masa muscular. Como en otros tipos de neuropatía, el uso apropiado de ortesis plantares puede mejorar la calidad de vida [101].
Prestar especial atención a la aparición de úlceras en pies, ya que el riesgo está aumentado. El adecuado cuidado de los pies y las uñas es de especial importancia en estos pacientes.
Síndrome de piernas inquietas (SPI)
Es frecuente y a menudo pasa desapercibido para el clínico. La prevalencia en los pacientes en hemodiálisis es del 14-57% [113] [114], y en los trasplantados renales es del 5% (similar a la de la población general) [115]. El aspecto más distintivo o poco usual es que los síntomas se inician al acostarse, por lo que aparece predominantemente por la noche o durante la sesión de diálisis; como resultado, la mayoría de las personas con este síndrome tienen dificultad para conciliar y mantener el sueño.
Aunque a menudo los pacientes urémicos presentan a la vez polineuropatía y SPI, ambos cuadros no tienen la misma etiopatogenia. La etiopatogenia del SPI no está aclarada, pero hay consenso en atribuir su presencia a un trastorno del sistema nervioso central (SNC) de tipo funcional y que involucra a la transmisión dopaminérgica y opioide a nivel subcortical y especialmente medular. Otros factores que se han asociado al SPI son: anemia, déficit de hierro, elevación del calcio sérico, niveles bajos de PTH. El exceso de cafeína, alcohol y nicotina puede exacerbar los síntomas, como también lo hacen algunas medicaciones (antidepresivos tricíclicos, inhibidores de la recaptación de serotonina, agonistas dopaminérgicos) [116].
Síntomas
El SPI se caracteriza por sensaciones desagradables en las piernas (y ocasionalmente en los brazos) asociado a un impulso incontrolable de moverse cuando se está descansando, en un esfuerzo para aliviar estas sensaciones. Las personas a menudo describen las parestesias o disestesias como quemantes, como si algo les tirara o se deslizara por dentro, o como si insectos treparan por el interior de sus piernas. Las sensaciones varían en intensidad entre desagradables e irritantes hasta dolorosas. También se puede manifestar como hinchazón, pérdida de sensibilidad en calcetín y, en casos severos, puede aparecer afectación motora con debilidad muscular [117]. La dificultad para conciliar el sueño y la poca calidad del sueño pueden tener un importante impacto en la calidad de vida, por lo que el SPI se ha asociado a una mayor prevalencia de depresión [118].
Diagnóstico
El diagnóstico es básicamente clínico, basado en la sospecha y la confirmación mediante entrevista con el paciente, a menudo con ayuda de un cuestionario apropiado. La polisomnografía puede ser útil para determinar la presencia y evaluar la severidad de movimientos involuntarios de extremidades presentes en el sueño que se observan en cerca del 80% de los pacientes con SPI.
Tratamiento
El tratamiento del SPI en los pacientes con ERC es similar al de la población general: medidas higienodietéticas (evitar cafeína y determinados fármacos, masaje de piernas, calor local), tratamiento farmacológico con agonistas dopaminérgicos (pramipexol, ropinirol, rotigotina), ligandos alpha 2-Delta (gabapentina, pregabalina), benzodiacepinas, opioides. En caso de plantearse su uso en pacientes con deterioro de función renal las dosis se deben ajustar al filtrado glomerular.
En cuanto a medidas más específicas para pacientes con ERC, se han asociado con mejoría del SPI: la corrección del déficit de hierro, el trasplante renal, el ejercicio moderado y regular, la hemodiálisis corta diaria [119], [120].
Mononeuropatía urémica
La mononeuropatía urémica es frecuente en pacientes con ERC terminal. El nervio afectado con mayor frecuencia es el mediano (síndrome del túnel del carpo). Su incidencia es similar en pacientes en hemodiálisis y en diálisis peritoneal. La patogenia es múltiple, incluyendo compresión directa, isquemia e infiltración por amiloide (Beta-2-microglobulina).
Síndrome del túnel del carpo
Es la mononeuropatía más frecuente en pacientes en diálisis, con una prevalencia del 6-31% [121]. Su principal causa es la amiloidosis por depósito de Beta-2-microglobulina. Pero también influyen otras causas derivadas de la fístula arteriovenosa, ya que se ha visto en estudios que el síndrome del túnel del carpo es más frecuente en el brazo del acceso vascular. Los mecanismos por los que el acceso vascular influye son variados: aumento de presión venosa durante la diálisis con extravasación de fluido y compresión extrínseca del nervio mediano, sangrado del acceso y compresión del nervio, daño isquémico neural por fenómeno de robo vascular [122]. Clínicamente los pacientes presentan parestesias o disestesias con sensación de quemazón en la zona de distribución del nervio en la mano, progresando posteriormente a dolor. Las parestesias también pueden afectar a territorios más proximales como el antebrazo. Los síntomas tienden a empeorar durante la hemodiálisis. En los casos más avanzados aparece atrofia muscular en la mano. A la exploración son característicos los signos de Tinel y Phalen. Se diagnostica mediante la clínica y la EMG, y el tratamiento es quirúrgico, aunque puede recidivar. En los casos no subsidiarios de cirugía la infiltración local con esteroides consigue controlar a corto plazo los síntomas, así como un ciclo corto de corticoides orales. La inmovilización nocturna mediante férulas también puede mejorar la sintomatología.
Neuropatía cubital
Su principal causa es la compresión del nervio cubital por mala posición del brazo durante la sesión de hemodiálisis, pero también puede deberse a calcinosis tumoral en la muñeca o por isquemia neural. Los pacientes presentan síntomas motores, como debilidad de los músculos de la mano, o sensoriales afectándose la eminencia hipotenar. El diagnóstico se hará por EMG, y con pruebas de imagen (RM, ecografía). El tratamiento puede ser tanto conservador como quirúrgico. Si se presenta de forma aguda tras la realización de la fístula, generalmente se opta por el tratamiento quirúrgico (banding o cierre de la fístula).
Neuropatía femoral
Es una complicación de la cateterización de la vena femoral. También está descrita en trasplantados renales por presión local durante la cirugía [123]. La mayoría de pacientes tienen una recuperación completa sin necesidad de intervención quirúrgica.
Neuropatía radial
Puede suceder tras canulación dificultosa de la fístula arteriovenosa. También puede presentarse de forma aguda tras la realización de la fístula, lo que usualmente es una indicación para tratamiento quirúrgico (banding o cierre de la fístula).
Neuropatía de pares craneales
Afectación de los pares craneales VII (facial) y VIII (auditivo). La afectación puede ser directa por fármacos (p. ej. la ototoxicidad descrita con aminoglucósidos, eritromicina, vancomicina y diuréticos de asa); o estar asociada a nefritis hereditaria.
Neuropatía óptica
Los factores de riesgo para desarrollar neuropatía óptica en pacientes con ERC incluyen: la isquemia recurrente debida a hipotensiones frecuentes durante la diálisis, la anemia y la ateroesclerosis generalizada.
Neuropatía isquémica monomiélica
Es un tipo de neuropatía que afecta al antebrazo inmediatamente después de la realización de una fístula arteriovenosa para diálisis. Se debe a un importante descenso en la perfusión de los nervios radial, cubital y mediano, lo que provoca pérdida axonal. Las manifestaciones clínicas generalmente incluyen tanto alteraciones motoras como sensoriales. El diagnóstico se hace mediante EMG. El tratamiento suele ser quirúrgico (banding o incluso cierre de la fístula) [124].
Calambres musculares
Muy frecuentes en pacientes en hemodiálisis. Con frecuencia conllevan una temprana finalización de la sesión y por lo tanto son una causa significativa de infradiálisis.
La etiología exacta de los calambres en hemodiálisis es desconocida. Se sabe que el origen del calambre es neural, no muscular. En la etiología se han asociado uno o más de los siguientes factores: disminución del volumen plasmático, hiponatremia, hipoxia tisular, hipomagnesemia, déficit de carnitina, niveles séricos de leptina elevados.
El tratamiento para reducir la frecuencia de los calambres consiste en: minimizar la ganancia de volumen interdíalítica, prevenir la hipotensión durante la sesión de diálisis (pautas secuenciales de ultrafiltración/diálisis, perfiles de sodio), suplementación de carnitina (intravenosa u oral), administración de vitamina E. Otras medidas que se pueden emplear son: el uso de bicicleta estática durante unos minutos antes de acostarse (en pacientes con calambres nocturnos frecuentes), o estiramientos musculares a lo largo del día (aguantar 15-20 segundos, 4 ó 5 veces al día).
El tratamiento de los calambres durante la sesión de hemodiálisis es el siguiente: corregir la posible hipotensión arterial, suero salino hipertónico o dextrosa hipertónica (generalmente se prefiere la dextrosa hipertónica en los pacientes no diabéticos ya que no aumentará la sed tanto como el suero salino hipertónico, en diabéticos mejor usar el salino hipertónico), masaje local del músculo afectado, aplicación de calor húmedo local [125].
Cefalea intra o posthemodiálisis (entre 3-7 horas del comienzo de diálisis)
Es una manifestación del síndrome de desequilibrio, que ocurre en pacientes incidentes en hemodiálisis, sobre todo si parten de cifras de urea muy elevadas. Se caracteriza por síntomas neurológicos causados por la retirada rápida de urea durante la hemodiálisis, lo que condiciona un gradiente osmótico que induce edema cerebral con síntomas neurológicos como cefalea, náuseas, calambres musculares, deterioro del nivel de conciencia, y convulsiones [126].
Es una cefalea secundaria según la clasificación de la Sociedad Internacional de Cefalea (ICHD-3) y es el síntoma neurológico más frecuente en HD [127]. El dolor se manifiesta durante la sesión de hemodiálisis, a partir de la tercera hora y remite dentro de las 72 horas siguientes. Los episodios cesan tras un trasplante renal exitoso con la consecuente finalización de la hemodiálisis. El tipo de dolor, la localización, la intensidad y los síntomas asociados son variables y habitualmente no responden a los analgésicos. La prevalencia es elevada, entre el 30 % y el 57.5 % según estudios publicados [128] [129] [130].
Los antecedentes médicos que más influyen son la HTA la DM y las cefaleas previas. La fisiopatología se explica con la disminución importante de las cifras tensionales, de las concentraciones de urea y sodio con la hemodiálisis que causan un gradiente osmótico con paso de agua a través de la barrera hematoencefálica con edema cerebral secundario; además se produce un síndrome de desequilibrio [128] [129] [131] [132]. Los niveles bajos de Mg sérico bajo tanto pre como post HD [128] también influyen porque causan disminución de la energía liberada a partir de la hidrólisis del ATP, aumento de la liberación de sustancia P, TNF-α, IL-1, IL-6, radicales libres y modificación de la transmisión nociceptiva mediada por receptores de glutamato. Por lo tanto, se recomienda evitar grandes variaciones del volumen plasmático, control estricto de la tensión arterial, disminución lenta de electrolitos, aumentar la conductividad del sodio en hemodiálisis y evitar la alcalosis post sesión. Sesiones más cortas y frecuentes teniendo en cuenta que el dolor inicia generalmente después de la segunda hora de hemodiálisis. Los fármacos que se pueden usar de manera profiláctica son: Nortriptilina, Amitriptilina, Fluoxetina, Gabapentina, Carbamazepina, Benzodiacepinas [133]. Otras terapias publicadas incluyen: Manitol IV durante la sesión [134], infiltración o estimulación de nervios occipitales.
Crisis comiciales
Más frecuentes en enfermos en diálisis que en la población general. Suelen guardar relación con la sesión de diálisis, ya que la hipoxia, la hipotensión, las alteraciones electrolíticas y los cambios osmóticos las favorecen al bajar el umbral para su aparición [135]. Las causas más habituales, además de las propias de la población general, se describen en la (Tabla 8).
Las más frecuentes son las causadas por encefalopatía hipertensiva. En segundo lugar, las debidas a lesión cerebral por isquemia multiinfarto en pacientes con arterioesclerosis severa; suelen coincidir a veces con hipotensiones intra o postdiálisis. La encefalopatía urémica sólo provoca crisis en casos de uremia avanzada y no tratada [136], por lo que actualmente es muy rara en nuestro medio. También hay que considerar como posibles factores desencadenantes la hipocalcemia, sobre todo coincidiendo con la corrección brusca de la acidosis que ocurre durante la diálisis con bicarbonato, o la hipoglucemia intradiálisis, especialmente cuando se usan líquidos de diálisis sin glucosa. En pacientes con poliquistosis renal debe tenerse en cuenta la posible ruptura de un aneurisma. Entre las infecciones que pueden afectar al sistema nervioso central, en los pacientes con catéteres centrales hay considerar la posibilidad de que desarrollen abscesos cerebrales.
El tratamiento dependerá en gran medida de la etiología. Hay que descartar lesión estructural siempre que exista clínica o electroencefalograma de lesión focal. Se prefiere el uso de los nuevos fármacos antiepilépticos (levetiracetam, lacosamida…) por presentar menos efectos secundarios e interacciones que los fármacos clásicos (fenitoína, ácido valproico). Muchos requieren ajuste de dosis en pacientes con ERC, y una colaboración estrecha con Neurología de cara a la elección del fármaco y la dosis e intervalo a administrar. Los pacientes tratados pueden necesitar dosis suplementarias prediálisis o postdiálisis para evitar la aparición de crisis intradiálisis o postdiálisis respectivamente [137]. Es importante considerar las interacciones medicamentosas de los fármacos antiepilépticos, especialmente en candidatos a trasplante renal, ya que las interacciones con los inmunosupresores pueden ser importantes, como es el caso de la fenitoína o el ácido valproico.
La prevención es muy importante. Los trastornos electrolíticos deben ser corregidos, y el síndrome de desequilibrio evitado, iniciando las diálisis de forma suave para evitar cambios eletrolíticos y osmóticos demasiado rápidos o muy intensos.
Demencia
La mejora de las técnicas y de la calidad de diálisis ha prolongado la supervivencia de pacientes añosos y arterioscleróticos, favoreciendo la aparición de demencia [138], especialmente en personas de edad avanzada. Su etiología es multifactorial. La demencia en estos pacientes puede estar precedida por un deterioro cognitivo leve, predominantemente no amnésico, que se relaciona con una potencial etiología vascular [139].
Los síntomas iniciales son sutiles: disminución del estado de alerta y de la capacidad de concentración, pérdida de memoria, letargia, lentitud, cambios de personalidad y trastornos del sueño. Puede haber disminución progresiva del nivel de consciencia hasta llegar al coma. Los síntomas pueden mostrar fluctuaciones temporales.
Siempre hay que descartar causas potencialmente reversibles tales como la intoxicación por aluminio, poco frecuente hoy en día con la mejora de la calidad de las plantas de agua para hemodiálisis, el déficit de tiamina, que provoca la encefalopatía de Wernicke, a menudo asociada con polineuropatía axonal, y el déficit de biotina (vitamina H), que produce un cuadro de neuropatía con o sin encefalopatía, caracterizada por mioclonías, asterixis y amnesia. También es necesario descartar alteraciones iónicas o metabólicas que puedan desencadenar demencia (hiponatremia, hipocalcemia, hipercalcemia, hipoglucemia).
En el escáner se detecta atrofia córtico-subcortical progresiva conforme aumenta el tiempo en diálisis. Se ha visto que la leucoaraiosis en imágenes de resonancia magnética es más prevalente en pacientes con ERC [140].
El MINI-MENTAL es un test rápido y sencillo de 13 apartados que evalúa la función cognitiva. Se puede obtener una valoración aproximada de la gravedad del deterioro cognitivo inicial mediante una puntuación (puntuación patológica < 24) y seguir su progresión en el tiempo. En una población añosa en diálisis con alta comorbilidad cardiovascular el estado cognitivo patológico es un importante marcador pronóstico de mortalidad. El deterioro cognitivo de los pacientes mayores en diálisis es progresivo.
El tratamiento de la demencia será el de la causa, en el caso de que exista una (alteraciones electrolíticas, fármacos que contribuyan a la alteración del estado mental, deferoxamina en el caso de toxicidad por aluminio). En el resto de casos se puede tratar con inhibidores de la colinesterasa, aunque aún existe falta de información sobre la eficacia en pacientes con ERC.
Depresión
Es la patología psiquiátrica más común en los pacientes con insuficiencia renal, con una prevalencia descrita del 20-30% [141]. El suicidio es más común que en la población general. Se asocia con una mayor tasa de hospitalización, de estancia hospitalaria [142] y con un aumento de 40% del riesgo de mortalidad por todas las causas [143]. Para su correcto diagnóstico es necesario optimizar la dosis de diálisis para mejorar la sintomatología del paciente y así aliviar su sufrimiento psicológico.
Requiere un abordaje especializado. Los antidepresivos en la ERC son efectivos en un 75% de pacientes, y generalmente necesitan de 4 a 6 semanas en hacer efecto. La mayoría de antidepresivos se metaboliza en el hígado por lo que no se necesita ajuste de dosis en muchos casos (hay excepciones como la paroxetina o la venlafaxina). Los inhibidores selectivos de la recaptación de serotonina se toleran mejor que los antidepresivos tricíclicos, sin embargo, el uso de estos últimos puede ser beneficioso para el tratamiento del dolor neuropático en los pacientes que lo necesiten [144].
Insomnio
Su prevalencia en diálisis varía desde el 19 al 71%. En su etiopatogenia contribuyen diferentes factores: síndrome de piernas inquietas, apnea del sueño, factores metabólicos (uremia, anemia, hipercalcemia), dolores óseos, prurito, alteraciones de los ritmos circadianos (el ritmo diurno de melatonina está alterado en pacientes con ERC), niveles elevados de orexina, ansiedad, depresión, falta de higiene del sueño (incluyendo siestas frecuentes durante sesiones de diálisis).
Existen muchos condicionantes que hacen difícil su manejo, como el cambio del ritmo del sueño y la vida poco activa o sedentaria, la insatisfacción o la frustración; y los problemas familiares o sociales derivados de la enfermedad (disminución del poder adquisitivo, carga familiar, pérdida de trabajo, disfunción eréctil), por lo que siempre se debe interrogar al paciente sobre un posible componente psicosocial.
El tratamiento debe ser mixto: farmacológico y con medidas no farmacológicas, adaptadas a la problemática personal del paciente [145]. A veces la analgesia puede ayudar. En lo posible se deben evitar los hipnóticos; en general, mejora con ansiolíticos o antidepresivos. También se recomienda optimizar la dosis de diálisis en pacientes con insomnio. El trasplante renal mejora el insomnio y la calidad del sueño [146].
Excesiva somnolencia diurna
La sensación subjetiva de excesiva somnolencia diurna es muy frecuente en pacientes tratados con diálisis. Los pacientes la describen tanto en situaciones pasivas (leer, ver la televisión) como en activas (conducir, conversar), lo que acarrea disminución de la productividad en el trabajo y un riesgo aumentado de accidentes de tráfico.
Múltiples factores contribuyen a la somnolencia: uremia, síndrome de piernas inquietas, apnea obstructiva del sueño, encefalopatía urémica subclínica, deficiencia de hormonas tiroideas, liberación de citokinas inductoras del sueño durante la diálisis, persistencia de melatonina durante el día, alteración de la termorregulación corporal.
El tratamiento es similar al de la población general. Se ha observado que la hemodiálisis nocturna puede mejorar la somnolencia diurna [147].
Apnea del sueño
La apnea del sueño (tanto la de origen central como la obstructiva) es más frecuente en pacientes con ERC terminal, siendo la prevalencia de hasta el 50% [148]. Esta prevalencia es similar tanto en hemodiálisis como en diálisis peritoneal. La apnea del sueño no diagnosticada y no tratada puede tener importantes consecuencias clínicas como excesiva somnolencia diurna, deterioro de la función neurocognitiva e incremento de complicaciones cardiovasculares.
La clínica típica que se observa en la población general con apnea del sueño puede estar ausente en los pacientes con ERC, siendo menos frecuentes los ronquidos y los episodios de apnea objetivados por el acompañante. Además, otros síntomas frecuentes como fatiga y somnolencia, son frecuentemente atribuidos a la propia enfermedad renal. Por lo tanto, se requiere un alto índice de sospecha para diagnosticar la apnea del sueño en esta población.
El tratamiento es similar al de la población general. Se ha visto que la hemodiálisis nocturna mejora la apnea del sueño [149]. La diálisis peritoneal automatizada tiene una prevalencia menor de apnea del sueño comparada con la diálisis peritoneal continua ambulatoria [150]. Aún no queda claro si el trasplante renal mejora la apnea del sueño.
NIVELES ENZIMÁTICOS Y MARCADORES TUMORALES
La concentración de ciertas enzimas séricas de utilidad diagnóstica, puede aparecer alterada en la insuficiencia renal, debido a ausencia de excreción renal y condiciones co-mórbidas asociadas.
Enzimas cardíacas
El patrón enzimático de los pacientes en HD que sufren un infarto agudo de miocardio (IAM) se asume que es el mismo que en pacientes no urémicos.
Creatinkinasa (CK) total
Los niveles basales aparecen elevados hasta 3 veces el rango alto de la normalidad (se han descrito hasta 10 veces) entre un 30-70% de los pacientes, siendo mayores en HD que en DP. La causa es multifactorial. Se normalizan tras el trasplante.
Circunstancias a tener en cuenta ante una elevación de CK total: Inyecciones intramusculares, miopatías, hipotiroidismo, déficit de vitamina D, empleo de esteroides anabolizantes.
La isoenzima CK-MB (representa el 5% de la CK total en condiciones normales): puede aumentar ligeramente en pacientes en diálisis sin lesión miocárdica [151].
Lactato deshidrogenasa (LDH)
Concentración plasmática elevada hasta 3 veces el límite superior de la normalidad. Las muestras deben extraerse prediálisis, dado que aumentan durante la sesión de diálisis por hemoconcentración y liberación leucocitaria.
Troponinas
Proteínas implicadas en la contracción muscular (cardíaca y esquelética). Está formada por tres subunidades (C, T, I). Las subunidades T e I de la troponina cardíaca (cTnT y cTnI) aparecen elevadas en el suero de pacientes con daño miocárdico.
En la población general se consideran biomarcadores de daño miocárdico altamente cardioespecíficos: permiten un diagnóstico rápido y preciso de la isquemia coronaria, establecen precozmente grupos de riesgo y tienen implicaciones pronósticas.
En pacientes en diálisis el diagnóstico de IAM puede ser difícil (clínica atípica, EKGs poco sugestivos o alterados basalmente, baja especificidad de la CK-MB). El valor de las cardiotroponinas en esta población es controvertido, dado que hasta un 20% puede presentarlas elevadas, especialmente la cTnT [152]. Para explicar esta elevación se ha propuesto la presencia de daño miocárdico subclínico (existe relación entre los niveles de cTnI y el grado de hipertrofia ventricular izquierda, edad y diabetes mellitus) o una disminución en el aclaramiento renal de la cTnT [153] [154].
Desde un punto de vista práctico, en pacientes en diálisis con sospecha de IAM se recomiendan determinaciones seriadas de cardiotroponinas, preferiblemente cTnI (de acuerdo a los valores de referencia de cada laboratorio) [155] ya que se considera el marcador más específico de daño miocárdico en pacientes con IRCT. Inicia su ascenso a las 3-12h, alcanzan un pico a las 24-48h y puede permanecer elevada más allá de 10 días del evento.
Peptido natriurético cerebral (NT-PRO-BNP)
Es un buen predictor de mortalidad en pacientes de diálisis. Se usa como marcador de sobrecarga de volumen, insuficiencia cardíaca e hipertrofia de ventrículo izquierdo (HVI). Pertenece a la familia de los péptidos producidos por los cardiomiocitos en respuesta a estímulos como sobrecarga de volumen y elevación de presión arterial. El NT-proBNP es un fragmento de aminoácidos que se desglosa ante ciertos estímulos. Su vida media es larga con gran estabilidad plasmática.
En ERC los niveles de NT-proBNP son más elevados que en la población general [156]. Las causas son múltiples: por un lado es una molécula de gran tamaño que se acumula en IRCT; por otro, los pacientes en diálisis suelen tener sobrecarga de volumen que estimula la secreción de BNP por estrés o por HVI [157]. De hecho, es un excelente marcador de HVI en la práctica clínica [158].
Enzimas Hepáticas
Aminotransferasas (GOT [AST] y GPT [ALT])
Presentan niveles séricos habitualmente disminuidos en la uremia (déficit de piridoxina -cofactor de aminotransferasas- y/o inhibición por tóxinas urémicas). Incluso niveles considerados en el límite alto de la normalidad (a partir de GOT 24 U/L y GPT 17 U/L) deben alertar sobre una hepatopatía [159].
Gammaglutamil transpeptidasa (GGT)
Elevación inexplicada en el 10% de los pacientes en HD (2 ó 3 veces el límite superior normal). Posible elevación secundaria a fármacos que inducen enzimas hepáticas microsomales.
Fosfatasa Alcalina total
Su elevación puede tener un origen óseo o hepático. Para considerar origen hepático (enfermedad biliar obstructiva, fármacos), se debe valorar de forma concomitante con otras enzimas hepáticas y niveles de PTH.
Enzimas pancreáticas
Amilasa
En pacientes con ERC (FG < 50 ml/min), dado el déficit de excreción renal, se pueden observar elevaciones de hasta 3 veces el rango alto de la normalidad, en ausencia de pancreatitis. También hay que considerar la existencia de pancreatitis subclínicas (primarias, fármacos). En DP, niveles de amilasa en líquido peritoneal superiores a 100U/l se consideran sugestivos de pancreatitis. La amilasa puede estar falsamente disminuida en pacientes en DP que utilizan icodextrina por un mecanismo competitivo: en estos casos valorar lipasa [160].
Lipasa
Elevación en pacientes en hemodiálisis hasta 2 veces el límite superior debido a déficit de aclaramiento. Elevación postdiálisis inducida por la actividad lipolítica de la heparina.
Marcadores tumorales
Los marcadores tumorales que tienen metabolismo o eliminación renal (antígeno carcinogeno embrionario o CEA) dan falsos positivos en pacientes con ERC y tienen poco valor para screening de pacientes con cáncer.
La alfafetoproteína sérica (AFP) tiene una especificidad alta y permite valorar la respuesta al tratamiento en pacientes con cáncer hepatocelular y en ciertos tipos de tumores de células germinales.
En la determinación del antígeno específico prostático (PSA) en pacientes con ERC hay que tener en cuenta el estadio de enfermedad renal en el que se encuentran. En pacientes con ERC moderada ya se observa un aumento significativo del PSA libre, permaneciendo los niveles de PSA total estables en comparación con los de la población general (aunque hay estudios contradictorios), por lo que se recomienda la evaluación del PSA total, ignorando los niveles de PSA libre. En pacientes en diálisis los niveles de PSA libre también están aumentados, por lo que se recomienda la medición de PSA total, preferiblemente antes de la sesión de diálisis (solamente las membranas de baja permeabilidad no afectan a los niveles de PSA libre). En pacientes trasplantados renales los niveles de PSA libre están disminuidos, pero los niveles de PSA total permanecen sin cambios, por lo que pueden ser usados para la evaluación del cáncer de próstata [161] [162].
La eficacia de antígenos carbohidratos (CA 19-9, CA 50, CA 125, CA 15,3) como marcadores tumorales en pacientes con ERC no está clara. Aunque la mayoría de los investigadores han encontrado altas tasas de falsos positivos, especialmente CA 50 y CA19-9, otros han observado su utilidad (cáncer de mama y cáncer exocrino pancreático, respectivamente). Los valores de CYFRA 21.1, enolasa neuroespecífica (NSE) y Antígeno de carcinoma de células escamosas (SCC-Ag) tampoco se pueden considerar específicos para el diagnóstico de tumores en pacientes con ERC.
La concentración sérica de CA 125 se utiliza en el diagnóstico de cáncer de ovario. En mujeres en DP no es un marcador agudo de enfermedad debido a que los niveles séricos pueden aumentar como consecuencia de irritación peritoneal inespecífica o peritonitis. En paciente en HD debe ser interpretado con precaución si existe serositis (derrame pericárdico, pleural o ascitis).
En resumen, los valores de los marcadores tumorales en la ERC se deben interpretar con cautela y dentro del contexto clínico de cada paciente.
En la (Tabla 9) se exponen los cambios de los niveles de marcadores tumorales según estadio de la ERC [163].