Inflamación en Diálisis
Palabras clave
Palabras clave: inflamación, proteína C reactiva, interleukina, adipocitoquina, diálisis, infecciones, catéter, hemodiálisis, diálisis peritoneal, función endotelial, calcificación vascular depresión, anorexia, síndrome malnutrición inflamación, monitorización, mortalidad, testosterona, hormonas tiroideas, disfunciones endocrinas, acceso vascular, tratamiento, terapia, hábitos de vida, nutrición, malnutrición, obesidad, clínica.
INTRODUCCIÓN
El proceso inflamatorio debe entenderse como una respuesta sistémica compleja a agentes perniciosos. La inflamación es un mecanismo de defensa del organismo, que intenta eliminar o combatir dicho agente/estímulo e iniciar el proceso curativo. Así, aunque inicialmente la producción de citoquinas pro-inflamatorias tiene un efecto beneficioso para el organismo, su elevación crónica y sostenida se traduce en efectos perjudiciales, y este es el cuadro que parece estar presente en la enfermedad renal crónica (ERC).
La inflamación crónica se caracteriza por la presencia persistente de estímulos pro-inflamatorios, lo que termina produciendo destrucción celular y tisular, con los consiguientes efectos deletéreos en el organismo. En el caso de la insuficiencia renal crónica y sobre todo en estadios avanzados y durante la diálisis, las concentraciones sistémicas tanto de citoquinas proinflamatorias como antiinflamatorias se encuentran aumentadas. Las razones de esta elevación se deben tanto a la retención por descenso de la función renal como al aumento de su producción. En esta revisión, estudiaremos las causas y consecuencias de la inflamación en la diálisis, las razones para su monitorización en la clínica y opciones terapéuticas disponibles para disminuir las concentraciones séricas de marcadores inflamatorios en enfermos renales.
CAUSAS DE INFLAMACIÓN EN LA ENFERMEDAD RENAL CRÓNICA
Aunque las causas relacionadas con la inflamación urémica no han sido totalmente dilucidadas, son abundantes y variados los factores que se han relacionado con un aumento en la inflamación sistémica de estos pacientes. En primer lugar, no es de extrañar que las infecciones intercurrentes sean una de las principales causas de elevación de la proteína C reactiva (PCR) en los enfermos de diálisis [1]. Los agentes infecciosos estimulan la cascada de reacciones bioquímicas y biológicas que dan lugar a la respuesta inflamatoria. En concreto, microorganismos como Chlamydia pneumoniae, se han asociado con el estatus inflamatorio y la progresión de aterosclerosis en enfermos renales [2][3][4][5]. Igualmente, episodios de infección dental como la periodontitis también se han asociado con la elevación de los marcadores de inflamación sistémica de los pacientes en hemodiálisis [6] [7]. No es desaventurado postular que la cavidad bucal constituye un potencial foco inflamatorio en la uremia. Además, las restricciones dietéticas en la ERC, como la dieta baja en potasio y fosforo, pueden alterar la flora intestinal, favoreciendo la disbiosis intestinal (sobrecrecimiento bacteriano en el intestino) [8].
La propia disminución de la función renal parece estar asociada con la inflamación, e incluso cambios mínimos en la función renal residual (FRR) parecen influir en dicha “inflamación urémica”. De hecho, se ha demostrado que existe una fuerte relación entre la FRR, la inflamación sistémica y la hipertrofia de ventrículo izquierdo (HVI) en pacientes de diálisis [9]. La retención de citoquinas [10], toxinas urémicas [11], de productos avanzados de glicosilación (AGEs) [12] y de la oxidación proteica (AOPPs) [13] y otras moléculas pro-oxidantes [14] contribuyen, en un círculo vicioso, a facilitar un entorno pro-inflamatorio a medida que la tasa de filtración glomerular disminuye. Otros factores que parecen contribuir a este círculo vicioso son la hiperactividad simpática y/o la hipotonía del nervio vago [15].
Existen numerosos estudios relacionando la técnica de diálisis con la inflamación. La interacción de los monocitos circulantes con las membranas no biocompatibles [16], el contacto de la sangre circulante con soluciones de diálisis no estériles [16], el uso de agua no ultrapura [17] [17 [19], el exceso de transporte convectivo, y la frecuencia y duración de la diálisis [20][21], son factores contribuyentes al proceso inflamatorio. Sin embargo, no deben ser factores fundamentales en la iniciación de esta respuesta inflamatoria dado que los pacientes con ERC estadio 5 que aún no han iniciado tratamiento renal sustitutivo, ya presentan niveles muy elevados [22][23] [24]. La sobrehidratación, una complicación muy frecuente en la ERC, es otro causante del estado pro-inflamatorio, al facilitar la translocación bacteriana en pacientes con edema intestinal severo [25]. Otra causa importante de inflamación en la población en diálisis son los pacientes portadores de injertos renales no funcionantes, que no han sido sometidos a trasplantectomía tras su retorno a hemodiálisis [26].
En la población general, la obesidad se asocia a un aumento de la actividad inflamatoria, existiendo una estrecha relación entre las adipocitoquinas y las citoquinas pro-inflamatorias, así como entre la grasa y el tejido muscular. De igual manera, tanto el depósito de grasa troncular [27], como al abdominal [28], se han asociado con un incremento de la inflamación sistémica en los pacientes en diálisis, debido en parte a la capacidad de los adipocitos (y de los macrófagos que se infiltran la grasa), de secretar interleucina-6 (IL-6) o Factor de Necrosis Tumoral alfa (TNF-α) a la circulación sistémica [29][30]. Mientras que la mayoría de las adipocitoquinas (como la leptina o visfatina) pueden tener efectos pro-inflamatorios, a la adiponectina se la han descrito propiedades antinflamatorias y sensibilizantes a la insulina [31][32][33][34][35]. Dado el impacto que la pérdida de función renal tiene sobre el aclaramiento de las adipoquinas, las consecuencias fisiopatológicas del desequilibrio de estas en ERC pueden ser mayores que en la población general.
CONSECUENCIAS DE LA INFLAMACIÓN EN LA ENFERMEDAD RENAL CRÓNICA.
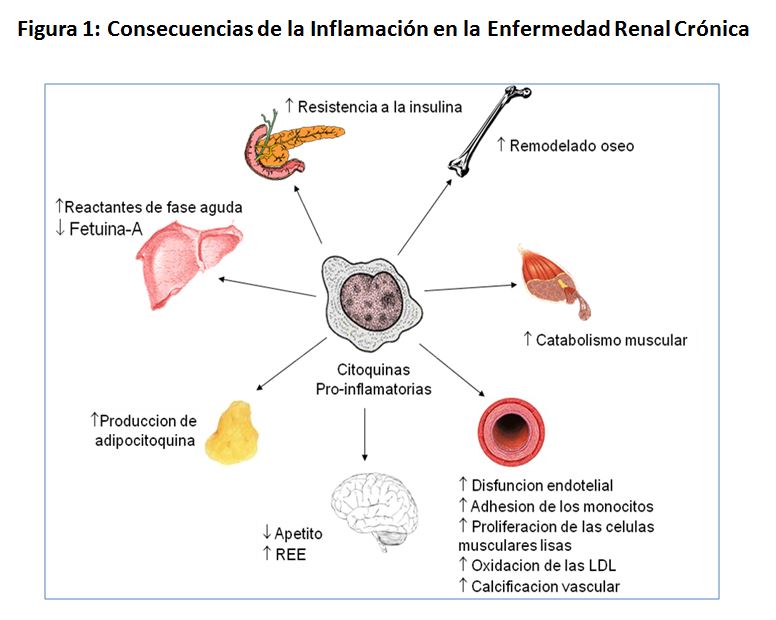
La naturaleza pleiotrópica de las citoquinas proinflamatorias afecta al desarrollo de diversas complicaciones concurrentes en la ERC, como el síndrome malnutrición-inflamación, la calcificación vascular o las alteraciones en el sistema endocrino (Figura 1).
El síndrome de desgaste proteico-energético (DPE) es un complejo síndrome metabólico de carácter multifactorial, tanto en sus causas como en sus consecuencias. El DPE se caracteriza por la presencia concurrente de pérdida de masa muscular (asociada o no a anorexia), pérdida de peso y/o masa grasa [36][37][38][39]. Este síndrome no es exclusivo de la ERC, sino que está presente en un amplio espectro de enfermedades en las que la inflamación crónica constituye un común denominador, como el VIH, la tuberculosis, la insuficiencia cardiaca, enfermedad pulmonar obstructiva crónica, el cáncer o la sepsis. La presencia de sobrepeso no excluye la ocurrencia del DPE en la ERC, que puede estar presente no solo en pacientes con índice de masa corporal (IMC) reducido (25 kg/m2) [40]. Entre los múltiples factores que pueden fomentar el DPE, la inflamación juega un papel fundamental: a medida que los niveles de IL-6 y TNF-α aumentan en los enfermos de diálisis, el apetito empeora [41][42]. La masa muscular esta inversamente correlacionada tanto con la IL-6 como con la PCR en los pacientes en HD, incluso tras corregir por edad y sexo [41]. La activación de citoquinas durante la diálisis también se ha asociado con un aumento en el catabolismo proteico del músculo [43][44]. Además, la visfatina se ha asociado al desarrollo de anorexia en estos pacientes [45]. Otros mecanismos adicionales por los que la inflamación puede inducir pérdida de masa muscular en los pacientes con ERC son (Figura 1): el aumento de resistencia a la insulina, la activación de la vía de la ATP-ubiquitina proteolítica, el aumento del gasto calórico y la anorexia [37][46].
La calcificación vascular puede también interpretarse, al menos en parte, como una consecuencia de la inflamación sistémica. De hecho, el TNF-α induce la mineralización de las células vasculares, y en estudios in vitro de co-cultivos de células vasculares con monocitos y/o macrófagos (fuente de la mayor parte de las citoquinas), se ha observado cómo dicha mineralización se ve acelerada [47]. Mediadores de la calcificación ósea y vascular como la osteoprotegerina y fetuina-A se asocian al estado inflamatorio de los enfermos en diálisis y predicen el riesgo de mortalidad únicamente en presencia de una inflamación sistémica de base [47][48][49][50][51]. La osteoprotegerina aumenta la síntesis de moléculas de adhesión en el endotelio [52] y las citoquinas pro-inflamatorias inhiben los niveles circulantes de fetuina-A en ERC [53][54]. El depósito de cristales de fosfato cálcico en la íntima arterial (proceso sine qua non de la calcificación) interactúa con los macrófagos activados, induciendo un estado pro-inflamatorio mediante la vía de la proteína C-quinasa y la MAP-quinasa [55]. Todo esto puede implicar que la inflamación sea causa y a la vez consecuencia de la calcificación vascular en un círculo vicioso.
La enfermedad cardiovascular constituye otra importante consecuencia de la inflamación existente en los pacientes en diálisis, aumentando el riesgo existente en estos pacientes debido a la sobrecarga de líquidos debido a la enfermedad renal preexistente, así como los cambios fisiopatológicos que ocurren en la vasculatura de pacientes con ERC [56]. La inflamación actúa como un catalizador para el desarrollo de insuficiencia cardíaca y acelera la progresión de la enfermedad arterial central y periférica, especialmente el inicio y la progresión de la aterosclerosis [57]. Además, la fibrosis miocárdica y la reducción de la compliance del ventrículo izquierdo pueden hacer que los pacientes en diálisis (sobre todo en hemodiálisis) sean más susceptibles a la hipotensión y al edema pulmonar agudo. La alteración de la autorregulación y la deposición de sustancias anormales en las paredes vasculares contribuyen a una mayor rigidez arterial, lo que agrava aún más la carga cardíaca y aumenta el riesgo de eventos cardiovasculares adversos. En el contexto de la hemodiálisis, la fluctuación de líquidos y electrolitos durante las sesiones de diálisis puede exacerbar la inestabilidad cardiovascular. La hipotensión intradiálisis, por ejemplo, puede desencadenar episodios de isquemia miocárdica y empeorar el daño cardíaco existente.
El riñón es uno de los principales moduladores de la función endocrina y una importante diana para numerosas hormonas. Por ello, el estado urémico se asocia con alteraciones en la síntesis o funcionamiento de diversos sistemas hormonales. Este desequilibrio hormonal puede verse agravado por un estado de inflamación persistente. En la ERC existe una resistencia a la acción anabólica de la hormona de crecimiento (GH), afectando al desarrollo corporal en niños y a la pérdida de fuerza y masa muscular en adultos. Se ha demostrado que la resistencia a dosis farmacológicas de GH en enfermos en HD se debe al estado inflamatorio más que a la uremia de por sí [58]. La inflamación persistente podría ser también una de las causas de síndrome de la trioodotironina (T3) baja y del hipotiroidismo subclínico, ambos cuadros cínicos tan frecuentes en los pacientes con ERC [59][60]. Los niveles reducidos de T3 están fuertemente relacionados con marcadores sistémicos de inflamación y constituyen un predictor independiente de mortalidad, tanto en pacientes con ERC estadio 5 [60] como en pacientes en diálisis [61]. Por último, aproximadamente el 50% de los varones con ERCA presentan deficiencia de testosterona, que se encuentra íntimamente relacionada con la inflamación sistémica y se asocia a un aumento del riesgo de mortalidad [62].
INFLAMACIÓN Y MORTALIDAD
Estudios prospectivos en HD [24][63][64][65][66][67], DP [68][69][70] y en pacientes trasplantados de riñón [71] demuestran que una simple medición de mediadores inflamatorios es capaz de predecir, de manera independiente, la mortalidad de los pacientes. Igualmente, resultados americanos de la base de datos MDRD sugieren que una PCR=3 mg/L en presencia de hipoalbuminemia también es un importante predictor de mortalidad en estadios iniciales de la ERC [72]. La inflamación sistémica es también un importante factor predictor de la muerte súbita en la ERCA [73]. Sin embargo, complicando este escenario aún más, debemos reconocer que existe una alta variabilidad intra e inter-individuo de los mediadores inflamatorios, sobre todo de los inespecíficos como es la PCR [74][75]. Esta variabilidad parece aún mayor en los pacientes con ERC, debido a que factores urémicos y el estímulo intermitente de la diálisis influyen tanto en su producción como en su aclaramiento [76][77][78]. Mientras que la disminución de la función renal, la existencia de comorbilidades, el DPE y el propio entorno urémico (estrés oxidativo, acumulación de productos finales de la glucosilacion avanzada, etc.) afectan a la variabilidad inter-individual [78], la variación intra-individual se ve más influida por los diferentes eventos concurrentes (infecciones, complicaciones agudas, cirugías, etc.), el tipo de acceso vascular, las membranas bio-incompatibles, la retrofiltración con agua no ultrapura, las endotoxinas y la diálisis intermitente [22][79][80][81]. El estado de hidratación, influido por las diálisis intermitentes, la ingesta de líquidos y la FRR, también se asocia a este fenómeno [82]. Diversos estudios longitudinales (incluyendo varias medidas de marcadores inflamatorios en el tiempo) han demostrado que la mediana (y media) de los niveles de PCR en los pacientes de HD es mejor marcador pronóstico que un valor de PCR puntual [79][83]. Esto sugiere que la monitorización frecuente de la respuesta inflamatoria en la clínica puede ser de utilidad para el seguimiento del paciente. Los pacientes con una elevación persistente de la PCR en un corto periodo de tiempo (3 meses) tienen un peor pronóstico, que aquellos que presentan valores persistentemente bajos o elevaciones puntuales [84].
MONITORIZACIÓN DE LA INFLAMACIÓN EN PACIENTES CON ERC
A la hora de recomendar la monitorización de los niveles inflamatorios en enfermos de diálisis debemos reflexionar sobre por qué es necesario medir marcadores de inflamación a nivel clínico y si estas mediciones pueden mejorar el diagnóstico y pronóstico de nuestros pacientes. Dado que hasta la fecha no existen estudios randomizados con marcadores de inflamación como principal objetivo ni tampoco análisis de coste-efectividad, las siguientes recomendaciones para la monitorización de la inflamación en la ERC no están basadas en la evidencia y constituyen la opinión profesional de los autores.
Medidas de PCR y valores de referencia en la ERC.
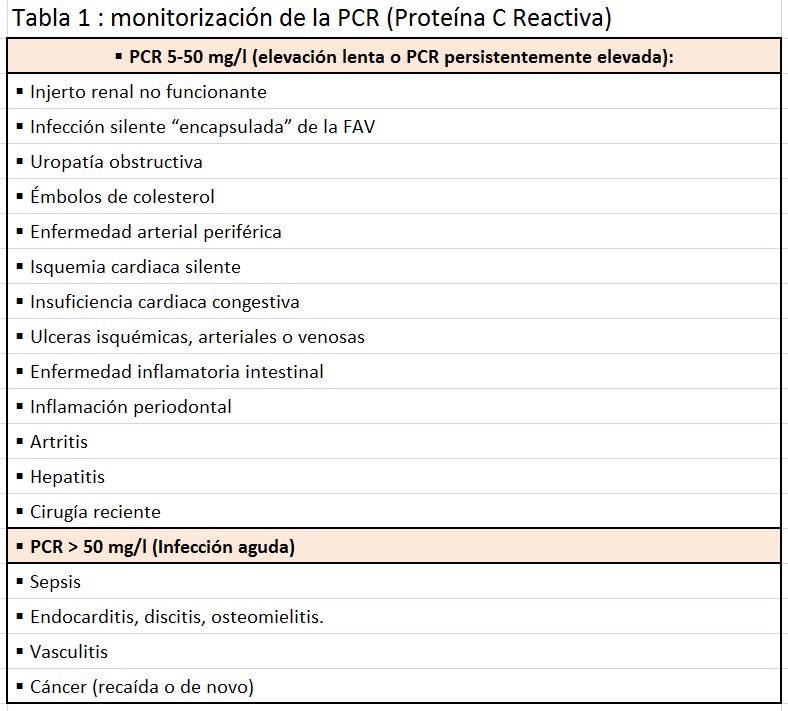
De todos los reactantes de fase aguda y marcadores de inflamación vascular del plasma, la PCR es el marcador de riesgo cardiovascular más utilizado, gracias a su reproducibilidad, bajo coste y disponibilidad en la clínica. La PCR es un subproducto bioquímico inespecífico, producido por los hepatocitos como respuesta a niveles elevados de IL-6, que aumenta rápidamente tras un estímulo inflamatorio. Aunque hasta la fecha carecemos de valores de referencia para la PCR en pacientes con ERC, sí parece claro que los niveles de PCR suelen, por lo general, estar por debajo del límite de 3 mg/l de la población general. Los pacientes en diálisis en Europa suelen tener una PCR media de 7–8 mg/L y una mediana de 4–5 mg/L, algo menor que en EE. UU. [9][85][86][87][88][89]. Hallazgos similares se han observado en pacientes con ERC en estadios 3-5. Según el estudio NHANES, alrededor del 50% de los pacientes con un aclaramiento renal entre 15-60 ml/min tienen unos niveles de PCR >2,1 mg/L. Los pacientes diabéticos generalmente tienen unas concentraciones séricas de PCR ligeramente mayores (media 10 mg/L) que los no diabéticos [90]. Con base en esta literatura precedente, diversos autores han sugerido un punto de corte pragmático para los niveles de PCR en los pacientes en diálisis en torno a los 5 mg/L. Sin embargo, este punto de corte no está consensuado por ninguna guía clínica y dadas las diferencias étnicas y culturales de muchos países, no es extrapolable a todas las poblaciones de diálisis (Tabla 1)
Razones para medir PCR en la clínica
A nivel de la unidad de diálisis (monitorización de la inflamación a largo plazo), la monitorización mensual de PCR en los pacientes puede ayudar a controlar la presencia de contaminaciones en el agua o líquido de diálisis, control del estado del acceso vascular, y optimización de los protocolos y dosis de diálisis. Desde un punto de vista preventivo, sin embargo, la monitorización de PCR no debe ser una alternativa sino un complemento más en el juicio clínico. Razones adicionales para medir la PCR pueden ser la motivación del paciente para mejorar su estilo de vida o el cumplimiento de sus prescripciones médicas.
A nivel individual, la monitorización frecuente de la inflamación (monitorización a corto plazo) puede contribuir a identificar complicaciones subyacentes que requieran rápido tratamiento. En esta monitorización a corto plazo, los pacientes más interesantes son quizás aquellos que presentan una persistente elevación de los niveles de PCR entre 5-50 mg/L. A estos pacientes, debería realizárseles un estudio clínico exhaustivo, independientemente de la existencia o no de sintomatología, para valorar las posibles causas de dicha inflamación. Asimismo, es recomendable una segunda determinación de la PCR dos semanas después del primer resultado para descartar procesos transitorios y reducir la variabilidad biológica de la PCR. Aquellos pacientes que presentan una rápida elevación de la PCR a valores > 50 mg/L deberían ser estudiados en profundidad para detectar la existencia de quizás una infección activa o de procesos clínicos similares (cáncer o vasculitis).
Índice Neutrófilo-Linfocitos
Los neutrófilos y los monocitos son las células más importantes en la respuesta inmunológica innata que se activan en respuesta al contacto prolongado con membranas biológicamente incompatibles y coordinan la respuesta inmunológica a través de la producción de citocinas y quimiocinas al reconocer patógenos o tejidos dañados junto con las células natural killer (NK) [91]. Por lo tanto, los cambios en el número de neutrófilos y células NK pueden indicar anomalías en el sistema inmunológico del cuerpo, relacionadas con el tipo de membrana biológicamente incompatible y el método de diálisis [92]. Pacientes en diálisis con inflamación crónica también presentan disfunción de los linfocitos T, con existencia frecuentemente de linfopenia y/o una activación mantenida de los linfocitos restantes con aumento de la fabricación de citoquinas pro-inflamatorias [93][94].
El índice neutrófilo-linfocito (NLR, por sus siglas en inglés) es uno de los biomarcadores más sensible y específico del estado inflamatorio en pacientes con ERC [95]. Dos estudios clínicos publicados en 2020 demostraron que el NLR es un predictor de mortalidad por todas las causas y de mortalidad cardiovascular en pacientes con ERC, y que un NLR más alto indica un riesgo aumentado de mortalidad [96][97].
OPCIONES TERAPÉUTICAS PARA DISMINUIR LA INFLAMACIÓN EN LA ERC
Dado que hasta la fecha no existen estudios clínicos de intervención sobre el impacto que el descenso de la inflamación tiene sobre el pronóstico de los pacientes, las recomendaciones que sugerimos a continuación son específicas de cada paciente y principalmente tratan de la identificación y tratamiento de las causas que desencadenan la elevación de la respuesta inflamatoria.
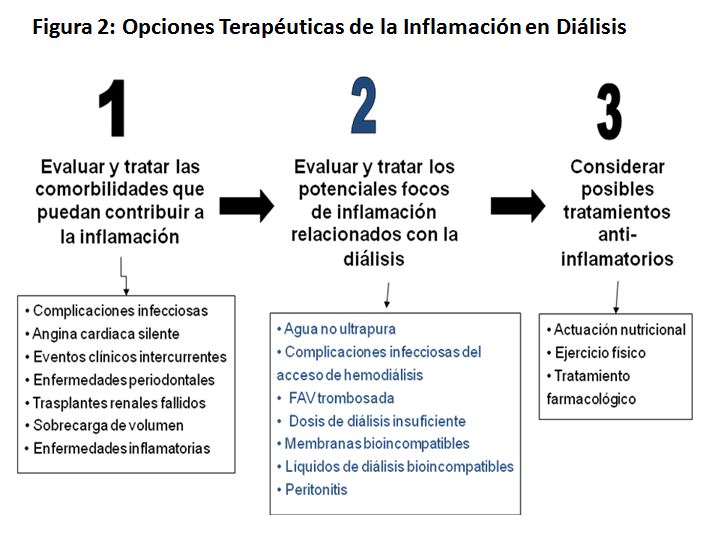
Las opciones terapéuticas que actualmente existen para los enfermos de diálisis pueden clasificarse en 4 categorías (Figura 2): 1) Tratamiento de las comorbilidades preexistentes; 2) Evaluación de posibles causas proinflamatorias relacionadas con la diálisis; 3) Intervención nutricional y modificación de hábitos de vida y 4) Tratamiento farmacológico.
Evaluación de las comorbilidades existentes y de la técnica de diálisis.
Antes de iniciar cualquier tratamiento farmacológico, es fundamental evaluar y tratar patologías concurrentes, incluidas las posibles complicaciones infecciosas, que pudiesen contribuir a la inflamación, alguna de las cuales hemos discutido con más detalle anteriormente. Por ejemplo, la sobrecarga de volumen puede producir una translocación bacteriana o de endotoxinas que active el sistema inmune y aumente la producción de citoquinas [98]. También es necesario considerar a la técnica de diálisis como un potencial foco de inflamación. Por ejemplo, los catéteres de diálisis pueden contribuir a incrementar la inflamación, independientemente que estén infectados o no [99], por lo que se debe evitar su uso siempre que sea posible. Aunque el supuesto potencial pro-inflamatorio de la HD y la DP nunca ha sido estudiado en un ensayo clínico aleatorizado, estudios observacionales han mostrado que, en comparación con la DP, un año de terapia de HD se asocia con una menor inflamación [100]. Además, los altos transportadores de diálisis peritoneal parecen estar más inflamados que los bajos transportadores [100][101]. La heparina posee propiedades anti-inflamatorias y dado que un estudio sugirió que el uso intraperitoneal de la misma disminuye los niveles de PCR en los pacientes de DP [102], el potencial antiinflamatorio de este tratamiento debería ser estudiado en más profundidad. La hemodiafiltración on-line disminuye los niveles de IL-6 más que la diálisis convencional, por lo que la modalidad de diálisis es también importante [103] [104]. Por último, la diálisis corta diaria, comparada con la HD convencional, se asocia no solo a un mejor manejo del estado hídrico corporal y a una disminución de la HVI, sino también de los factores inflamatorios.
Intervención nutricional y de hábitos de vida
Mediante estas medidas inespecíficas podemos mejorar el estado nutricional e inflamatorio de los pacientes. Por ejemplo, la dieta mediterránea, ajustada a las necesidades especiales de los pacientes renales, parece asociarse a una disminución de la inflamación y a un descenso del riesgo cardiovascular y de la morbi-mortalidad [106] [107].
El ejercicio físico redujo la inflamación y mejoró el estado nutricional en pacientes con ERC estadio 3-4 [109][110]. Diversos estudios también sugieren que los ácidos grasos omega-3 (conocidos como aceite de pescado) tienen un efecto beneficioso sobre la respuesta inflamatoria en HD [111]. Un estudio caso-control, randomizado, realizado en 70 pacientes en HD [112] mostró que la suplementación con gamma-tocoferol y ácido decosahexaenoico disminuía la inflamación en estos pacientes. Otras posibilidades incluyen la suplementación nutricional con genisteína [113] (una isoflavona de la soja) y antocianinas [114].
Tratamiento farmacológico
Fármacos inespecíficos:
Existen varios fármacos que poseen, además de su acción principal, propiedades inmunomoduladoras (efectos pleiotrópicos). Las estatinas y fibratos, por ejemplo, han atraído considerable interés en los últimos años [115]. En el estudio 4D, se observó un menor aumento de los niveles de PCR en los pacientes diabéticos en tratamiento con atorvastatina respecto al grupo tratado con placebo [116]. En el estudio AURORA, se observó un descenso, estadísticamente significativo en los niveles de PCR en el grupo de pacientes tratados con rosuvastatina [116]. El tratamiento con colecalciferol fue capaz de reducir los niveles de citoquinas circulantes, incluidas la IL-8, IL-6 y el TNF-α [117]. En un estudio prospectivo con 158 pacientes en HD, se demostró que la suplementación con colecalciferol no solo aumentaba los niveles séricos de 25(OH)D y 1,25(OH)2D, sino que también reducía los niveles de PCR [118]. El Sevelamer se asocia con un efecto pleiotrópico antinflamatorio: En un estudio controlado de 8 semanas se observó un aumento de la concentración sérica de fetuina-A, mejorando la disfunción endotelial y reduciendo los niveles de PCR en los pacientes con ERC estadio 4 [119]. La pentoxifilina, un inhibidor no específico de la fosfodiesterasa con propiedades antinflamatorias, no solo parece reducir la proteinuria sino también reducir la progresión de la insuficiencia renal [120]. Debido a la ausencia de métodos de diálisis efectivos para eliminar las toxinas urémicas unidas a proteínas, se están investigando diversas estrategias dietéticas para abordar la generación intestinal de estos compuestos dañinos, basados en la idea de que modificar tanto el contenido como la frecuencia de las comidas, junto con la selección de fuentes específicas de proteínas, que pueden desempeñar un papel importante en la reducción de la inflamación. Actualmente, la metformina es un fármaco oral en estudio como tratamiento para la inflamación, independientemente de sus efectos sobre el metabolismo de la glucosa [121][122].
Fármacos específicos:
El uso de terapias anti-inflamatorias específicas (estrategias anti-citoquinas) está ganando mucho interés en el campo de enfermedades inflamatorias crónicas como la artritis reumatoide. Sin embargo, se ha especulado sobre posibles riesgos asociados a este tipo de terapias, ya que se basan en el bloqueo de sistemas fisiológicos que se supone son piezas claves en el sistema inmune. Así, por ejemplo, algunos estudios en enfermos no-renales han asociado uso de este tipo de terapias a un aumento de la incidencia de infecciones [123]. En los pacientes en HD, la seguridad y eficacia de los anti-TNF (en concreto, del etanercept) ha sido estudiada en dos trabajos. En el primero, tras tratar durante 3 meses a 6 pacientes en HD (con niveles normales de albumina y PCR) con 25 mg de etanercept subcutáneo 2 veces por semana durante tres meses, no se registraron efectos secundarios durante el seguimiento inicial, ni tampoco durante los 6 meses posteriores [124]. Además, se observó que la farmacocinética del fármaco era similar a la de los pacientes con función renal normal [124]. En el segundo trabajo, 10 pacientes en HD (con niveles elevados de albumina y PCR) fueron randomizados a tratamiento con etanercept o placebo durante más de 7 meses, tampoco registrándose efectos adversos [125]. Otro estudio, también de diseño randomizado y controlado probó la eficacia de la administración de un antagonista recombinante del receptor de la IL-1 (anakinra) en la reducción de parámetros inflamatorios y mejora del estatus nutricional [126]. Un total de 14 pacientes (randomizados a placebo o anakinra durante 4 semanas) completaron el estudio, observando una reducción significativa de los niveles de PCR e IL-6 en el grupo tratado con anakinra. Fue interesante observar que los niveles de pre-albumina también mejoraron considerablemente en el grupo tratado [127]. El estudio ACTION fue un ensayo piloto, randomizado, multicéntrico con 80 pacientes en HD randomizados 1:1 a recibir placebo frente anakinra 100 mg durante 24 semanas, con un periodo de seguimiento posterior de 2 años, en el que se objetivó una mejoría de la inflamación (medida mediante PCR) con menor incidencia de eventos adversos (incluidos infecciones y linfopenias) en el grupo de tratamiento frente al placebo [128]. En conclusión, aunque la evidencia presente muestra efectos positivos a corto plazo, aún queda por estudiar la seguridad de estos tratamientos a más largo plazo y su posible impacto en mejorar el pronóstico y supervivencia de los pacientes.
CONCLUSIONES
La inflamación sistémica es una característica clínica habitual en los pacientes en diálisis. Esta inflamación es multifactorial en su origen, relacionándose entre otros con la pérdida de la función renal, las comorbilidades o el procedimiento de la diálisis. Las consecuencias de la inflamación tocan a un amplio abanico de procesos fisiopatológicos, como el síndrome malnutrición-inflamación, la calcificación vascular y disfunción endotelial, la resistencia a la insulina o la depresión. La PCR y el índice neutrófilo-linfocito son los marcadores inflamatorios más habitualmente utilizados a nivel clínico, y su monitorización frecuente puede ser un complemento importante en el seguimiento de los pacientes para el diagnóstico y tratamiento de cuadros patológicos subyacentes (como infecciones, uropatías, alteraciones cardiovasculares) o problemas con la técnica de diálisis (como contaminaciones de catéteres o de agua de dializado). Los primeros pequeños estudios randomizados controlados a corto plazo con terapias farmacológicas, como la metformina o anticitoquina-específicas demuestran, hasta la fecha, la ausencia de efectos adversos y cierta efectividad en la reducción de la inflamación en los enfermos de diálisis.