Calcifilaxis
1. Introducción:
La calcifilaxis, también denominada arteriolopatía urémica calcificante (CUA) cuando afecta a pacientes con enfermedad renal crónica (ERC), es un síndrome clínico caracterizado por ulceración necrótica de la piel debida a calcificación de la media más fibrosis de la íntima arteriolar y posterior isquemia cutánea por trombosis [1].
Suele manifestarse en pacientes en terapia sustitutiva renal, tanto en diálisis como trasplante renal, así como pacientes con filtrado glomerular bajo. Y sobre todo con la edad y la severidad de la patología vascular.
2. Incidencia / prevalencia:
La calcifilaxis es una enfermedad rara (ORPHA: 280062), cuya incidencia es desconocida.
Ello se debe a la falta de criterios diagnósticos unívocos, a la escasez de registros nacionales e internacionales y al gran número de casos no diagnosticados.
Cuando se habla de enfermedades raras, como en el caso de la calcifilaxis, los datos de registros resultan esenciales a la hora de poder determinar incidencia, las formas de presentación, los factores de riesgo y alternativas de prevención y tratamiento futuras.
De hecho, la mayoría de los datos existentes sobre la calcifilaxis proceden de los datos de los registros americano y alemán.
Un proyecto actualmente en marcha en Europa es la creación del Registro Europeo de Calcifilaxis (www.calciphylaxis.net) patrocinado por la sociedad europea de nefrología, diálisis y trasplante (ERA-EDTA) y que sigue la experiencia del registro alemán. En este registro multinacional, ya están implicados países como España, Italia, Portugal, Alemania, Bélgica y Holanda.
La Sociedad Española de Nefrología ha desarrollado su propio registro y se invita a cualquier médico conocedor de algún caso de calcifilaxis a ponerse en contacto con los gestores para comunicarlo y que sea incluido en el registro de calcifilaxis (calcifilaxis&senefro.org).
Como se ha dicho, los datos más representativos proceden del registro americano de pacientes con ERC (USRDS) y del registro alemán dedicado especificadamente a esta enfermedad [2] [3]. Según los datos americanos, se ha estimado una incidencia anual entre 3,7 y 5,7 casos por 10.000 pacientes en hemodiálisis. Este registro presenta el inconveniente de que excluye los pacientes en diálisis peritoneal o con ERC sin tratamiento sustitutivo.
En el registro alemán de calcifilaxis, se ha reportado una incidencia anual de 4,2 casos por 10.000 pacientes, que extrapolando a España, implicaría una incidencia de 10-15 pacientes año.
Cabe destacar que según los datos del USRDS la incidencia, en pacientes en hemodiálisis, ha aumentado significativamente en un periodo temporal de 10 años, desde 1,1 casos del 2002 hasta 5,7 casos por 10.000 pacientes en la actualidad. Esto podría reflejar la mayor complejidad de los pacientes incidentes en hemodiálisis o simplemente, una mejor conciencia de la existencia de la enfermedad por parte de los nefrólogos.
Tradicionalmente se han reportado más casos en pacientes en hemodiálisis y todo parece indicar que es el colectivo con mayor frecuencia [2].
De hecho, la mayoría de los datos presentes en la literatura hacen referencia a esta modalidad de tratamiento sustitutivo renal. Según el registro alemán, el 75% de los casos pertenecían a pacientes en hemodiálisis y el 10% a pacientes en diálisis peritoneal [4]. A este respecto, hay que tener en cuenta que el porcentaje de pacientes incluidos en programa de diálisis peritoneal es significativamente inferior a los incluidos en programa de hemodiálisis, por lo cabe esperar un menor número de casos de calcifilaxis. Por el contrario, hay un estudio reciente que muestra una mayor incidencia de calcifilaxis en pacientes de diálisis peritoneal, aunque también es cierto que un 71% de estos pacientes se había sometido a hemodiálisis anteriormente.
Por otro lado, en el registro alemán se comunican un 10% de pacientes que se encontraban en diferentes estadios de ERC, incluso presentaban solo una leve afectación de la función renal y un 4% de casos de pacientes con trasplante renal funcionante [5]. En prácticamente la mitad de los casos, la calcifilaxis aparece durante el primer año post-trasplante.
3. Fisiopatología:
La calcifilaxis se produce por la calcificación progresiva de la túnica media de las arteriolas cutáneas de pequeño calibre y la posterior trombosis de la luz residual del vaso. Mientras el proceso de calcificación es crónico y se produce a lo largo del tiempo debido a los efecto pro-calcificantes de los factores de riesgo, la trombosis suele aparecer de forma súbita y, en ocasiones, los pacientes refieren un evento desencadenante.
Estas fases son cronológicamente, clínicamente y tal vez etiológicamente distintas [6].
4. Manifestaciones clínicas:
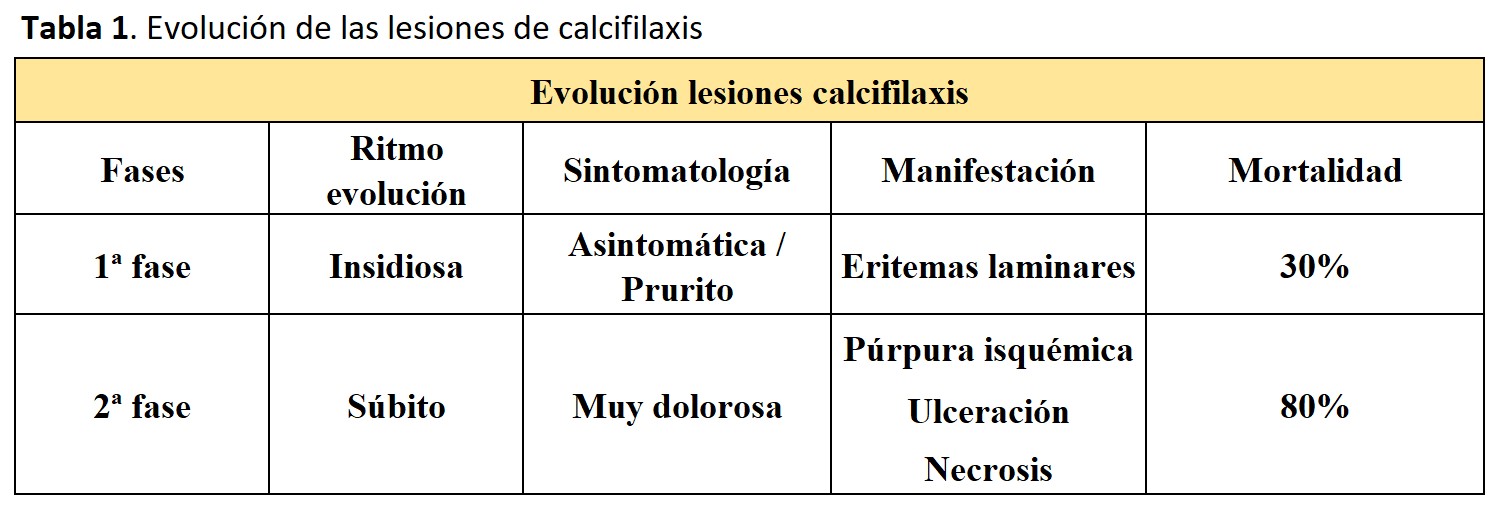
Generalmente, la CUA suele mostrar dos tipos de manifestación:
Una primera fase insidiosa y normalmente asintomática, aunque a veces aparece prurito, y que se presenta con eritemas laminares cutáneos.
Una segunda fase de rápida evolución, con púrpura isquémica muy dolorosa (dolor desproporcionado respecto a la lesión cutánea) que posteriormente puede evolucionar a ulceración y necrosis cutánea.
Ambos tipos de lesiones pueden presentarse simultáneamente.
Mientras que el primer tipo de lesión se asocia a una mortalidad del 30%, el segundo conlleva una mortalidad mucho más alta, aproximadamente del 80% [7] (Tabla 1).
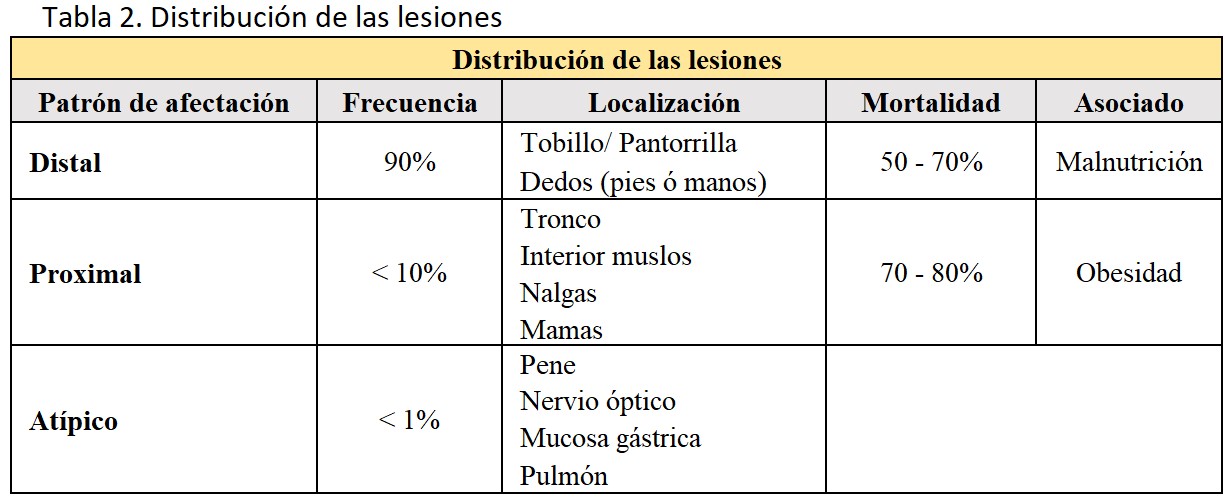
La distribución de las lesiones cutáneas tampoco es homogénea, pudiéndose distinguir dos patrones típicos [8]:
Patrón de afectación distal, que se presenta en aproximadamente el 90% de los casos y en el que las lesiones aparecen en las extremidades inferiores, especialmente entre tobillo y pantorrilla, aunque también se han descrito casos en dedos, manos e incluso genitales.
Patrón de afectación proximal, que es menos frecuente y afecta áreas con mayor tejido adiposo como el tronco, interior de los muslos, nalgas y, en alguna ocasión las mamas.
También en este caso ambos patrones de afectación pueden coexistir en el mismo paciente.
La distribución de las lesiones se refleja en la (Tabla 2). En general, se considera que el patrón proximal tiene un peor pronóstico que el patrón distal, aunque hay series que reportan tasas de mortalidad similares (distal 70%, proximal 76%) [9].
Aunque en la mayoría de los casos la calcifilaxis se presenta con lesiones cutáneas, eso no significa que es una enfermedad exclusiva de la piel.
De hecho, la calcificación y posterior trombosis de las arteriolas de pequeño calibre puede desarrollarse en cualquier órgano del cuerpo, pudiendo desencadenarse lesiones isquémicas de calcifilaxis en la mucosa de diferentes órganos, dependiendo de las arteriolas afectadas. Por ejemplo, se han observado casos de hemorragia digestiva alta debida a ulceración necrótica de la mucosa gástrica [10].
Se han descrito también lesiones de calcifilaxis en pene, debidas a trombosis de arteriolas del cuerpo cavernoso que han llegado a requerir en algún caso de posterior amputación del pene [11][12].
También se han reportado casos de calcifilaxis pulmonar [13] y calcifilaxis del nervio óptico, incluso bilateral, que pueden ser causa de ceguera irreversible [14][15].
Así pues y dada la posibilidad de un patrón atípico de manifestaciones, es muy importante la sospecha diagnóstica, sobre todo en pacientes con múltiples factores de riesgo.
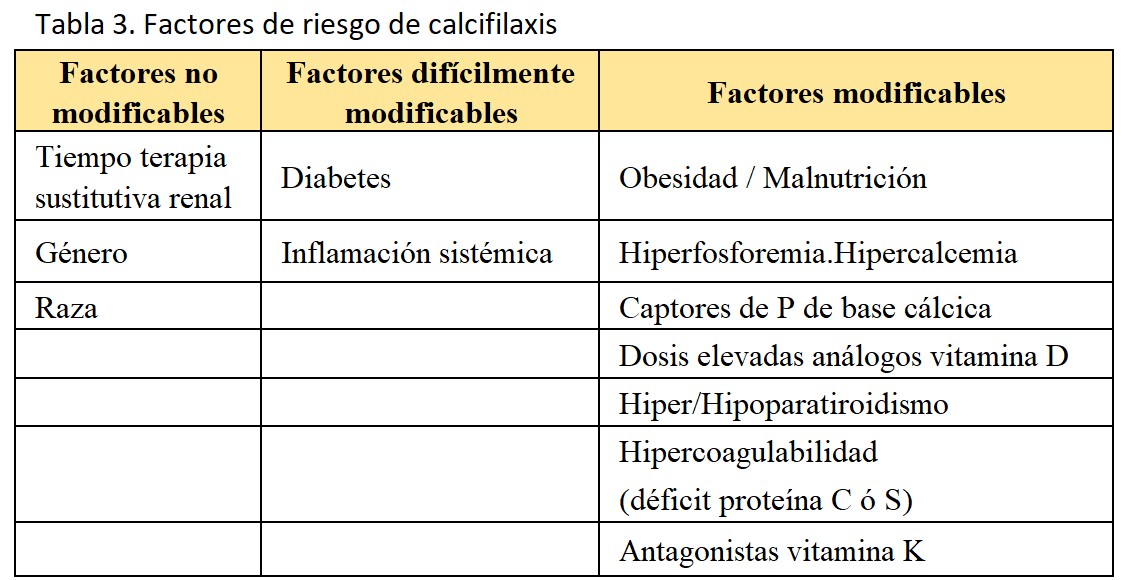
5. Factores de riesgo:
Podríamos agruparlos como factores no modificables, difícilmente modificables y modificables (Tabla 3).
Entre los factores no modificables se incluyen el tiempo en terapia sustitutiva renal, el sexo femenino (postmenopausia) y la raza caucásica. Los factores difícilmente modificables incluyen la diabetes y la inflamación sistémica. Entre los factores modificables más relevantes cabe incluir: obesidad, malnutrición, hiperfosforemia con elevado producto calcio-fósforo, uso de dosis elevadas de captores de fósforo de base cálcica, el tratamiento con metabolitos activos de la vitamina D, el hiperparatiroidismo o el hipoparatiroidismo, la anticoagulación con antagonistas de la vitamina K y los estados de hipercoagulabilidad [6].
a) Género
El sexo femenino, está considerado como un factor de riesgo. Se ha sugerido que las mujeres, sobre todo post-menopausia, ya sea por razones genéticas u hormonales (déficit de estrógenos), presentan una cierta predisposición a un patrón de calcificación ectópica que involucra los vasos más pequeños.
La disminución de los valores séricos de estrógenos se asocia a una expresión disminuida de osteoprotegerina (OPG) [16]. La OPG es una proteína soluble segregada por los osteoblastos que actúa como receptor señuelo del RANKL (ligando del receptor activador del factor nuclear kappa beta), con lo que, al unirse al RANKL lo neutraliza e impide la unión del RANKL a su receptor el RANK (receptor activador del factor nuclear kappa beta). Al impedir la unión RANKL/RANK evita la activación de la vía de señalización intracelular NF-κB (factor nuclear kappa beta), un factor de transcripción fundamental para el desarrollo y el recambio fisiológico del tejido óseo y de alta relevancia en la calcificación vascular.
De hecho, en modelos animales con déficit de OPG, se observa extensiva calcificación vascular por la hiperactividad del eje RANKL-RANK-NF-kB [17]. Esto quizá podría explicar por qué en las mujeres en menopausia se observa una mayor incidencia de calcifilaxis.
b) Inflamación
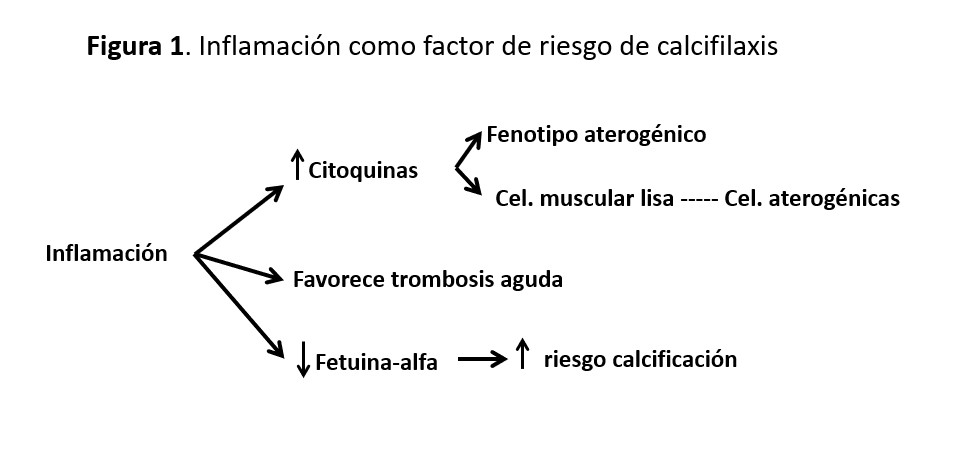
La inflamación sistémica se asocia al desarrollo de calcificaciones vasculares [18], que se ve agravada por factores como el deterioro de función renal, las técnicas de depuración extracorpórea, las infecciones crónicas o las comorbilidades (ej. diabetes, enfermedades autoinmunes) (Figura 1). De hecho, se han descrito casos de calcifilaxis en pacientes con función renal normal y enfermedades inflamatorias de larga duración [19].
Las citoquinas proinflamatorias son capaces de activar de forma endocrina el endotelio vascular, favoreciendo un fenotipo aterogénico y la transdiferenciación de las células musculares lisas de la pared vascular en células de estirpe osteoblástica [20]. Además, los estados inflamatorios son protrombóticos, pudiendo favorecer la trombosis aguda de las arteriolas calcificadas, que desencadenaría el cuadro clínico.
En los estados proinflamatorios disminuye la concentración de la fetuina-alfa, que es un potente inhibidor de la calcificación ectópica [21]. Se ha visto en pacientes con largo tiempo en diálisis y bajas concentraciones de la fetuina A, una mayor precipitación vascular de calcio y fósforo [22].
Todos estos cambios favorecen por tanto la calcificación crónica de las arterias de pequeño calibre y su posterior trombosis, dos eventos claves en la patogénesis de la calcifilaxis.
Por tanto, en pacientes con calcifilaxis activa, es oportuno averiguar si existen causas de inflamación modificables, como infecciones crónicas u ocultas (incluso de prótesis vasculares) y tratarlas.
c) Obesidad
La obesidad e incluso un índice de masa corporal superior al normal se asocia al desarrollo de calcifilaxis. Esto podría simplemente reflejar la asociación de la obesidad con la patología vascular, compartiendo las dos entidades muchos factores de riesgo, como la diabetes, la hipertensión, la inflamación sistémica etc.
En los pacientes con obesidad, las lesiones de calcifilaxis suelen ser mayoritariamente proximales. Esta observación clínica podría sugerir un papel activo de la obesidad en la patogénesis de este patrón de lesiones. Se ha propuesto en tal sentido que la obesidad ejerce una tensión crónica en los septos del tejido adiposos y esto puede afectar el flujo sanguíneo de las arteriolas allí presentes que a su vez precipitaría una isquemia del tejido adiposo subcutáneo [23).
d) Déficit nutricional
En pacientes con déficit nutricional se ha observado el desarrollo de calcifilaxis, especialmente con patrón distal, al contrario de los pacientes con obesidad. Además, recientemente la mayoría de las series de casos publicados subrayan la significativa asociación de la calcifilaxis con la hipoalbuminemia [3].
Sin embargo, no queda claro si la malnutrición per se tiene un nexo causal con la patogénesis de la calcifilaxis, ya que la malnutrición se asocia inevitablemente a la inflamación sistémica que si está asociada al desarrollo de calcificaciones vasculares.
Si parece evidente que en el momento en el que se producen las lesiones cutáneas de calcifilaxis, la malnutrición es un factor pronóstico adverso, retrasando la recuperación de las heridas y afectando la respuesta inmune a las sobreinfecciones.
e) Hipercalcemia y/o hiperfosfatemia
La hipercalcemia y la hiperfosfatemia son tradicionalmente factores asociados a la aparición de calcifilaxis.
En gran número de casos publicados se observa una correlación entre la elevación del producto CaxP y la aparición de calcifilaxis. Ahora bien, en algunos se halla correlación solo con la hipercalcemia y en otros con la hiperfosfatemia.
Por otro lado, en la mayoría de las publicaciones más recientes, si bien tanto la hipercalcemia como la hiperfosfatemia siguen considerándose factores asociados con la calcifilaxis, presentan cada vez menor entidad frente a otros de mayor relevancia como pueden ser la obesidad, la inflamación, la hipoalbuminemia (malnutrición) o el tratamiento con antagonistas de la vitamina K [24].
f) Valores séricos de PTH
Tradicionalmente el hiperparatiroidismo secundario/terciario se ha considerado como un importante factor de riesgo de calcifilaxis y por otro lado, el hipoparatiroidismo se ha asociado más recientemente al desarrollo de calcifilaxis. No obstante, la relación de los valores séricos elevados de PTH con la fisiopatología de la calcifilaxis está aún por establecer.
En el registro alemán de calcifilaxis, el 47% de los pacientes reportados tenían valores séricos de PTH inferiores al rango aconsejado por las guías KDIGO [3]. Y también no hay que olvidar que la enfermedad de hueso adinámico se ha relacionado a mayor severidad a calcificaciones vasculares.
Probablemente lo más aconsejable para disminuir el riesgo de calcifilaxis sea intentar mantener los valores de PTH sugeridos por las Recomendaciones de la Sociedad Española de Nefrología [25] que para el paciente en diálisis contempla valores de PTHi entre 150-300 pg/ml siendo aceptable hasta 500 pg/ml.
g) Tratamiento con metabolitos activos de vitamina D
Los metabolitos activos de vitamina D, a dosis elevadas, pueden acelerar la calcificación vascular, por un lado, al facilitar la diferenciación osteogénica de las células musculares lisas vasculares, pero fundamentalmente por la elevación de la fosfatemia y calcemia que provocan [26].
Análogos de la vitamina D como el paricalcitol parecen ser menos inductores de calcificación y podrían provocar menos riesgo de calcifilaxis, aunque a día de hoy, no hay ningún estudio que lo demuestre.
h) Antagonistas de la vitamina K
Los antagonistas de la vitamina K, tales como los anticoagulantes orales (acenocumarol, warfarina), favorecen la calcificación ectópica y constituyen uno de los más conocidos factores de riesgo de calcifilaxis [3] [27] [28].
La proteína de matriz Gla (MGP), proteína producida por las células musculares lisas de la pared vascular, previene la transdiferenciación de las célula muscular lisa en células de estirpe osteoblástica y además interactúa con los cristales de hidroxiapatita previniendo la calcificación. Esta proteína se activa con un mecanismo de carboxilación (gamma-glutamil carboxilasa) dependiente de la vitamina K.
La vitamina K previene la calcificación vascular al servir como cofactor de la carboxilación de la proteína MGP, un proceso que convierte la MGP descarboxilada (ucMGP) en MGP carboxilada (cMGP). Esto explica por qué los antagonistas de la vitamina K, tales como los anticoagulantes orales, pueden favorecer la calcificación ectópica.
i) Alteraciones de la coagulación (déficit proteína C ó S)
La deficiencia de proteína C ó S provoca un estado de hipercoagulabilidad que podría ser responsable de algunos casos de calcifilaxis [29].
La proteína S, factor de la coagulación dependiente de la vitamina K, interviene en la regulación de la actividad anticoagulante de la proteína C activada, formando con ésta un complejo que inactiva rápidamente a los factores Va y VIIIa. Su déficit predispone a padecer fenómenos tromboembólicos.
El tratamiento con eritropoyetina recombinante también se ha asociado a un incremento de tendencia trombótica por diversos mecanismos, entre ellos un descenso de los valores de proteínas C y S [30] [31].
Se ha descrito, en pacientes en hemodiálisis, un discreto, aunque significativo descenso de proteína S libre junto a un aumento de proteína S total [32].
6. Criterios clínicos diagnósticos:
Recientemente se han propuesto unos criterios diagnósticos, que en nuestra opinión presenta muchas limitaciones. Según éstos, el diagnóstico de calcifilaxis puede hacerse si se cumplen los tres criterios clínicos de a) paciente en hemodiálisis o con filtrado glomerular < 15 ml/min/1,73 m2), b) más de dos úlceras dolorosas y no curables con púrpura dolorosa asociada y c) presentes en el tronco, extremidades o pene. En caso de que haya solamente dos de los criterios anteriormente mencionados, el diagnóstico hay que confirmarlo mediante biopsia cutánea [33].
7. Exploraciones complementarias:
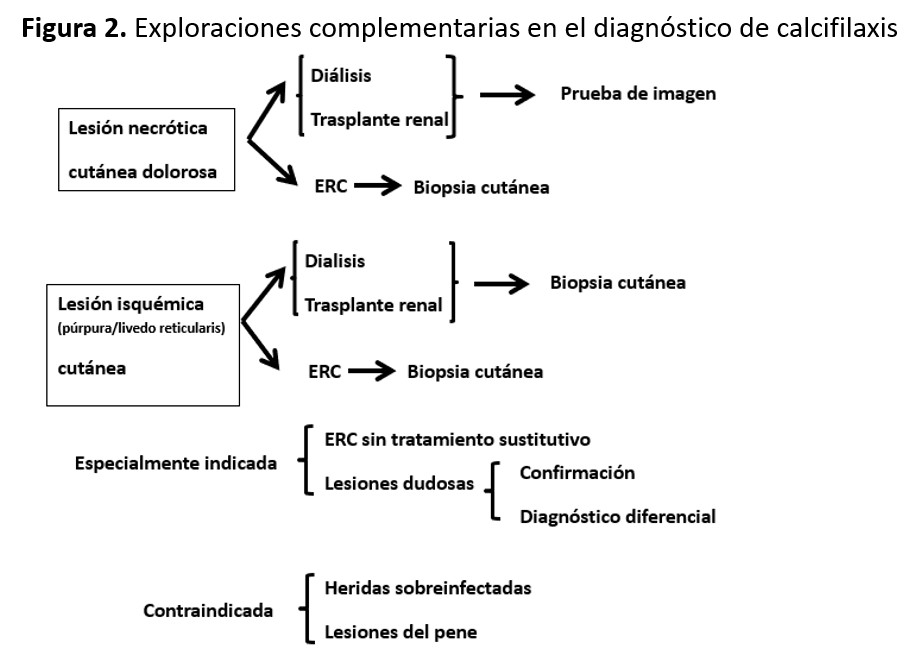
En la práctica clínica habitual, nosotros aconsejamos complementar la sospecha clínica con una prueba diagnóstica, que será una biopsia o una prueba de imagen dependiendo del contexto clínico (Figura 2):
- En los pacientes en diálisis que tienen una o más lesiones necróticas dolorosas cutáneas, se podrá confirmar el diagnóstico con una prueba de imagen (especialmente la radiografía con técnica de mamografía, aunque también puede ser útil la radiografía simple, Ecografía cutánea o la gammagrafía ósea y en menor medida la radiografía simple)
- En los pacientes con ERC o trasplantados renales con lesiones cutáneas o no cutáneas en cualquier fase y en los pacientes en diálisis con lesiones aún isquémicas (púrpura, livedo reticularis) o lesiones no-cutáneas, se debería confirmar el diagnóstico con la biopsia cutánea.
a) Biopsia cutánea
La biopsia cutánea nos ayudará a confirmar el diagnóstico de calcifilaxis. Tiene mayor interés especialmente en pacientes con ERC de cualquier estadio sin tratamiento sustitutivo.
Además, puede revelarse una útil herramienta diagnóstica en los casos donde quepan dudas y sea importante en diagnóstico diferencial con otras patologías [6].
Sin embargo, siempre hay que tener en cuenta que la biopsia cutánea puede complicarse con nuevas úlceras y la sobreinfección de antiguas.
Se debería evitar en lesiones sobre-infectadas y en las lesiones del pene.
La muestra debería tomarse en los bordes de la lesión para evitar que presente tejido necrótico, ya que esto perjudicaría el diagnóstico, pero por otro lado tampoco muy alejado pues en este caso nos podría dar falsos negativos.
Cuando se realiza la biopsia, es importante tomar la muestra con una profundidad de al menos 4-5 mm para incluir también la grasa subcutánea en el análisis, de este modo se incluirán más fácilmente las arteriolas afectadas para hacer el diagnóstico.
Se ha descrito que, en ocasiones, la biopsia cutánea puede complicarse con sobreinfección o aumento de la zona de necrosis, por tanto, los riesgos y los beneficios de realizarla han de valorarse en cada paciente, especialmente en los que tienen un cuadro clínico muy evidente que pueda hacerla innecesaria [33].
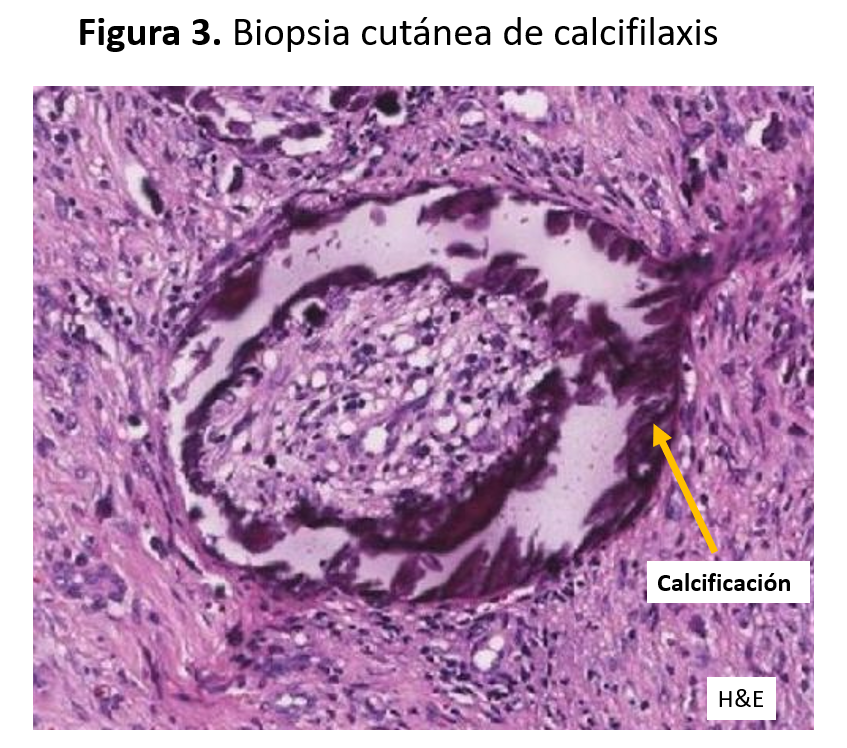
El patrón anatomopatológico clásico consiste en la calcificación de la túnica media de las arteriolas cutáneas o de la grasa subcutánea, asociada a un importante engrosamiento fibro-intimal que disminuye la luz del vaso, objetivándose en algunos vasos la trombosis de la luz residual.
La calcificación de la túnica se puede demostrar con la tinción de van Kossa en inmunohistoquímica y también puede mostrar un patrón violeta en la coloración con hematoxilina y eosina [1] (Figura 3).
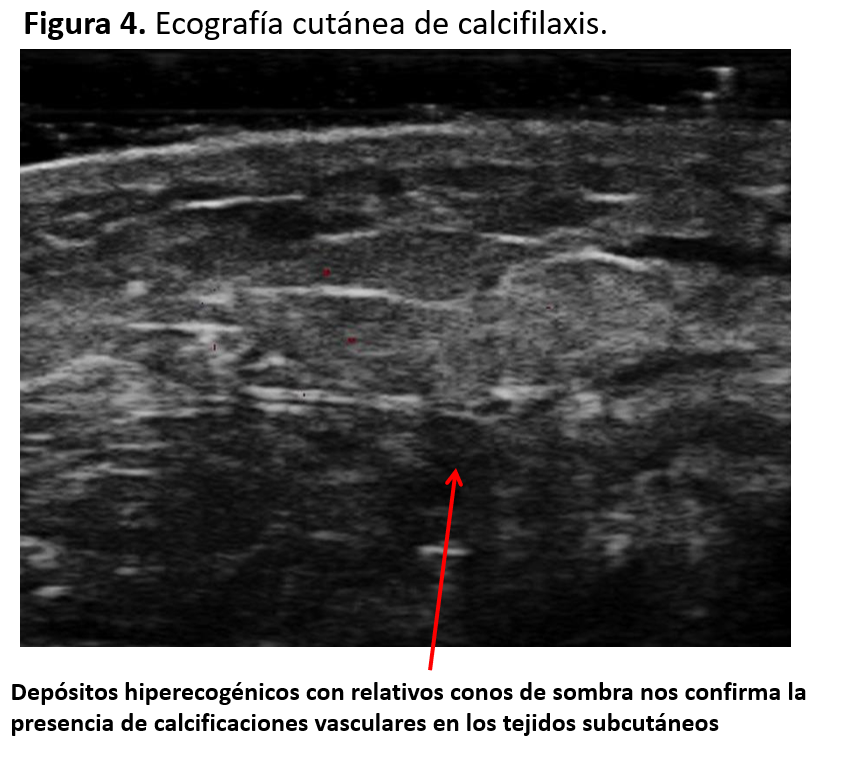
b) Ecografía cutánea
La ecografía, dada su sencillez y su amplia disponibilidad, puede ser una herramienta valiosa para confirmar el diagnóstico.
Especialmente en los pacientes con alta sospecha de calcifilaxis, el hallazgo ecográfico de depósitos hiperecogénicos con relativos conos de sombra nos confirma la presencia de calcificaciones vasculares en los tejidos subcutáneos [34] (Figura 4).
c) Radiología simple
Una radiografía simple de la zona afectada puede demostrar la presencia de calcificaciones de los vasos de medio-pequeño calibre. En un estudio multicéntrico retrospectivo sobre 29 pacientes, la presencia de calcificaciones en forma de red (“net-like pattern”) en los tejidos blandos presentó una especificidad muy elevada, alrededor del 90% [35].
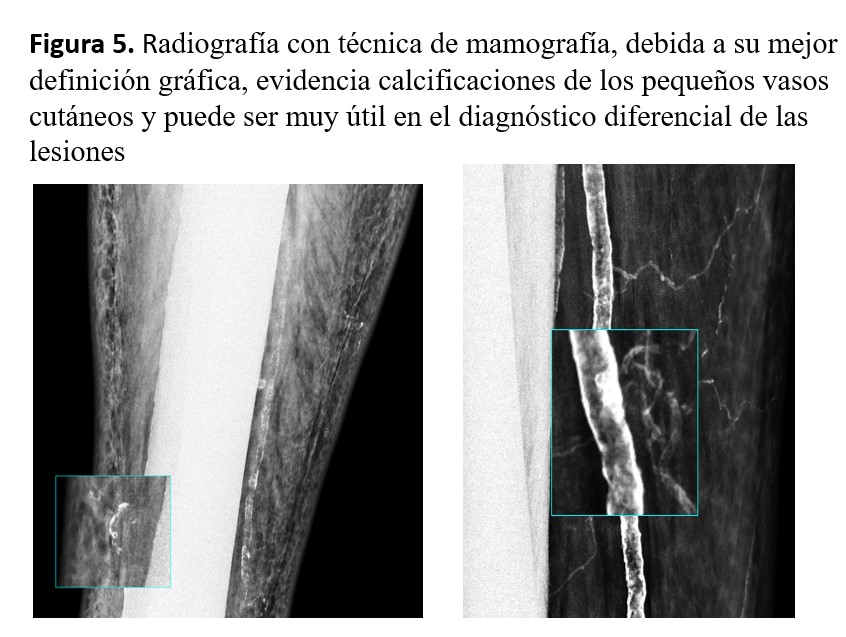
d) Radiología con técnica de mamografía
Una radiografía con técnica de mamografía, debida a su mejor definición gráfica, puede evidenciar calcificaciones de los pequeños vasos cutáneos y puede ser muy útil en el diagnóstico diferencial de las lesiones [6][36]. En nuestra experiencia es la prueba con mayor sensibilidad (Figura 5).
e) Gammagrafía ósea
La gammagrafía ósea también se ha mostrado cierta utilidad, acumulándose el trazador de forma difusa en las áreas correspondientes a los hallazgos clínicos.
La gammagrafía ósea también se podría aprovechar para monitorizar el efecto del tratamiento [37].
En este caso, en nuestra experiencia es poco concluyente y se observan gran número de falsos negativos.
f) Tomografía computarizada
Se ha demostrado, en algunos casos, que la tomografía computarizada de alta resolución puede revelar la presencia de vasos calcificados de pequeño y medio calibre.
Sin embargo, considerando el riesgo para el paciente, el coste y la mayor sensibilidad de la radiografía simple o con técnica de mamografía, no se puede aconsejar su uso rutinario [38].
8. Diagnóstico diferencial
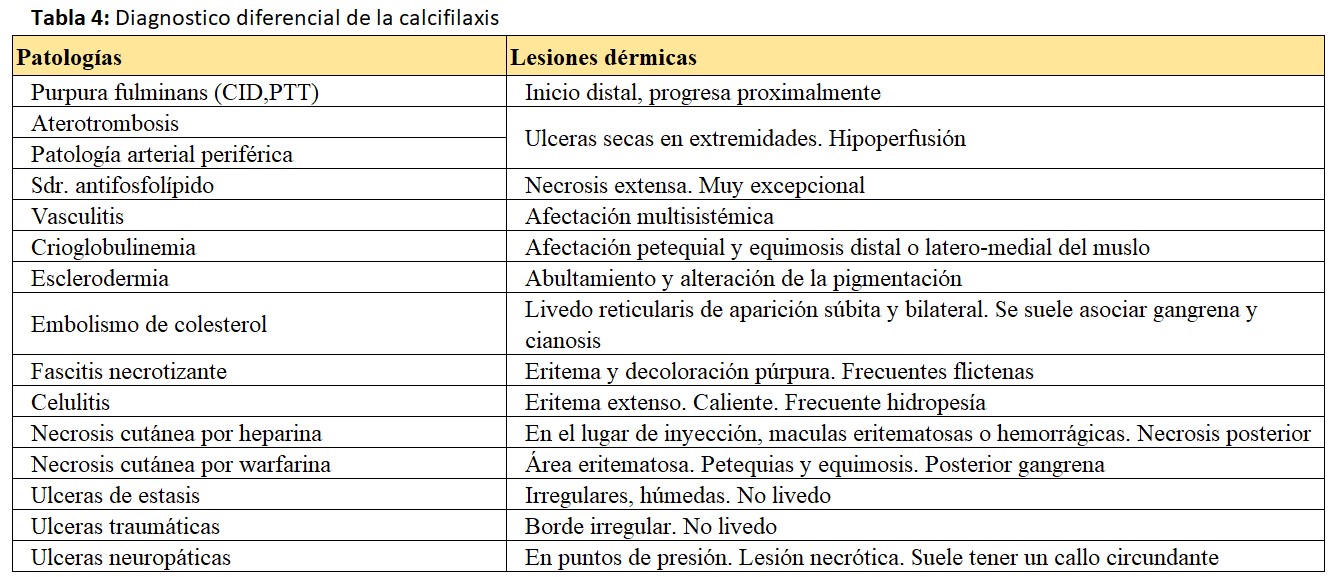
En el diagnóstico diferencial hay que tener en cuenta las patologías que pueden presentarse con un cuadro cutáneo similar.
Aunque la mayoría de ellas se podrán descartar por las diferencias en cuanto a los antecedentes, la historia clínica, el patrón biológico sanguíneo, las imágenes complementarias y en última instancia la histología.
Agrupamos posibles causas de confusión en la (Tabla 4) [6]
9. Manejo terapéutico
Por su naturaleza rápidamente evolutiva y la alta mortalidad es muy importante el diagnóstico lo más precoz posible.
Nosotros aconsejamos iniciar el tratamiento tan pronto se sospeche una lesión de calcifilaxis y en el caso de no confirmarse ya se suspenderá.
Conviene recordar que la mayoría de los pacientes con calcifilaxis fallecen por complicaciones infecciosas o isquémicas.
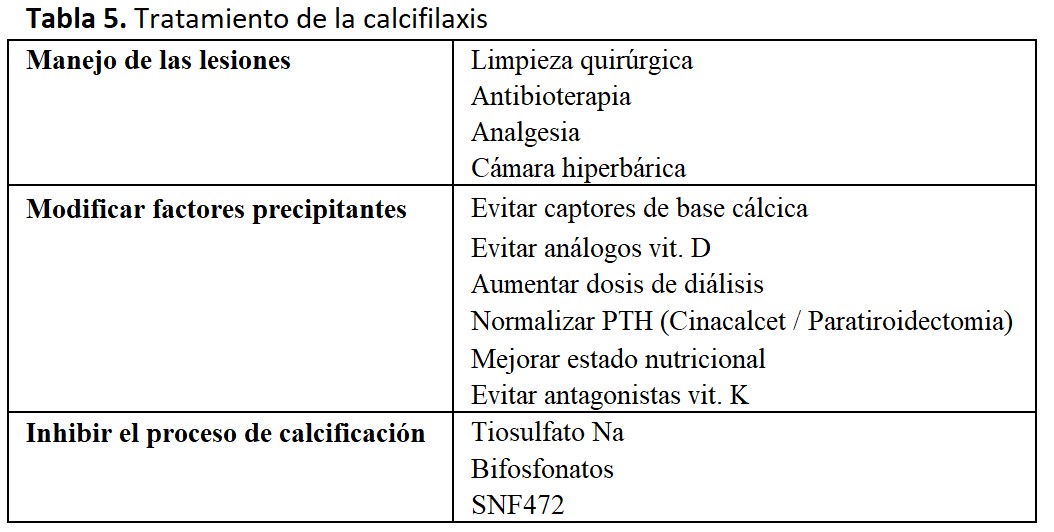
El tratamiento de la calcifilaxis deberíamos articularlo en tres niveles complementarios [6].
El primero sería el manejo de las lesiones desde el punto de vista médico-quirúrgico, el segundo modificar todos los posibles factores precipitantes de la calcificación ectópica, y el tercero en emplear todas aquellas herramientas que inhiben activamente el proceso de calcificación cutánea. En la (Tabla 5) se resumen las pautas de tratamiento.
a) Manejo médico-quirúrgico
Limpieza quirúrgica. La limpieza quirúrgica de la herida puede ser el primer paso en el manejo de las lesiones. En estudios retrospectivos se ha descrito que la supervivencia al año de los pacientes que se sometían a desbridamiento era significativamente superior que la de los pacientes que no lo realizaban [39].
Antibioterapia. Es razonable intentar obtener un aislamiento microbiológico para pautar una terapia antibiótica específica o, si no es posible, se debería emplear una terapia de amplio espectro con cobertura para los Gram positivos y los anaerobios [39].
Analgesia. El dolor es muy severo y se cree que es debido tanto a la isquemia como al dolor neuropático secundario a la sensibilización nerviosa. Un régimen de analgesia que incluya opioides, ketamina, adyuvantes no opioides (por ejemplo, gabapentina) u otros moduladores centrales del dolor (ej. antidepresivos tricíclicos o inhibidores de la recaptación de serotonina y noradrenalina como la duloxetina) puede ser eficaz [40]. Ahora bien, la necesidad de una analgesia potente y sin toxicidad requiere drogas que no dependan del funcionalismo renal ni que sean fácilmente dializables, de ahí que, el fentanilo, la buprenorfina y la metadona podrían estar más recomendados que los opioides ya que, en pacientes con ERC, se asocian a menor toxicidad. El uso de lidocaína tópica u opiáceos tópicos, como los geles con infusión de morfina, puede ofrecer razonable control local del dolor, con efectos secundarios potencialmente menos sistémicos, pero esto aún está muy poco estudiado y habría que evitarlo en áreas de infección activa. Por último, la aplicación de frio puede mejorar el dolor urente agudo.
Cámara hiperbárica. Se ha reportado que el uso de la cámara hiperbárica puede favorecer la recuperación de las lesiones necróticas, así como suele pasar en los grandes quemados, también favoreciendo la proliferación de fibroblastos, de colágeno y la angiogénesis [42]. Así pues, si se tiene la posibilidad de emplearla, puede sernos de utilidad.
b) Modificar factores precipitantes
Evitar captores de fósforo de base cálcica. Para el control de la hiperfosforemia se deberían evitar a toda costa los captores de fósforo de componente cálcico. Se aconseja el empleo de captores no cálcicos como el sevelamero, carbonato de lantano o el oxihidróxido sucroférrico.
Evitar los metabolitos activos de vitamina D. Los metabolitos activos de la vitamina D se deberían eliminar ante todo paciente con lesiones de calcifilaxis. Los metabolitos activos de vitamina D, a dosis elevadas, pueden acelerar la calcificación vascular, por un lado al facilitar la diferenciación osteogénica de las células musculares lisas vasculares pero, fundamentalmente, por la elevación de la fosfatemia y calcemia que provocan [26]. Metabolitos activos como el paricalcitol o el maxicalcitol parecen ser menos inductores de calcificación, pero tampoco están exentos.
Intensificación de la diálisis. En el caso de pacientes en programa de diálisis, el aumento de la dosis de diálisis es también importante para aumentar el aclaramiento del fosforo y de las toxinas urémicas, factores ambos precipitantes de calcificación vascular.
Controlar el hiperparatiroidismo secundario. En caso de hiperparatiroidismo secundario/terciario con PTH elevada por encima de rango, además de tratar la hipocalcemia y la hiperfosforemia, se debería manejar con Cinacalcet y ante la falta de respuesta rápida plantearse la paratiroidectomía. Se ha mostrado que, en pacientes con hiperparatiroidismo secundario severo, la paratiroidectomia subtotal mejora significativamente la supervivencia [43].
En el caso de pacientes con hipoparatiroidismo, se debería evitar a toda costa la hipercalcemia y la hiperfosforemia.
Control nutricional. En estos pacientes es fundamental evitar la desnutrición con los aportes calóricos necesario y eventualmente, en los casos más graves con afectación del estado general, incluso dar un soporte calórico a través de nutrición parenteral. Como ya se ha descrito, la malnutrición es un factor pronóstico adverso, que retrasa la recuperación de las heridas y facilita la sobreinfección [3].
Interrumpir el tratamiento con antagonistas de la vitamina K. En los pacientes bajo tratamiento con antagonistas de la vitamina K (acenocumarol / warfarina) se debería intentar a toda costa su suspensión y en caso de que sea imprescindible la anticoagulación, valorar la conversión a heparina subcutánea o a anticoagulantes orales no antagonistas de la vitamina K. Estos últimos presentan el problema de la dificultad en su ajuste de dosis en el caso de pacientes con deterioro de función renal o en diálisis.
Recientemente se han reportado casos de conversión eficaz a anticoagulantes orales sin efectos colaterales graves [44].
c) Inhibir el proceso de calcificación
Como es primordial en la patogénesis de la calcifilaxis la calcificación de la túnica media de las arteriolas cutáneas, el uso de inhibidores de la calcificación es una herramienta válida para detener la evolución de las lesiones.
A pesar de que las arterias ya calcificadas son irrecuperables, el poder detener el proceso activo de calcificación ectópica nos permitirá evitar la ampliación de las lesiones ya existente y el desarrollo de nuevas.
Los agentes inhibidores de la calcificación ectópica más conocidos son los bifosfonatos, el tiosulfato sódico y actualmente se encuentra en fase de desarrollo el SNF472.
Tiosulfato sódico. La administración de tiosulfato sódico es probablemente la medida off-label más común para tratar la calcifilaxis. Su mecanismo de acción se basa en la capacidad de formar complejos solubles con muchos metales y minerales, además de un posible efecto vasodilatador, antioxidante y directamente inhibidor del proceso de calcificación [45]. En el estudio retrospectivo más amplío en pacientes en hemodiálisis con diagnóstico de calcifilaxis, se ha observado una recuperación total o mejoría en un 70% de los pacientes tratados [46]. La dosificación más ampliamente aceptada es la de 25 g (100 mL de solución al 25%) endovenosos 3 veces por semana (después de cada sesión de hemodiálisis).
Bisfosfonatos. Los bifosfonatos poseen acción inhibidora de la calcificación a través de su enlace a los cristales de hidroxiapatita y pueden ser de gran utilidad.
Se han descrito casos aislados, así como un estudio retrospectivo que muestran una muy buena respuesta con una restitutio ad integrum en la mayoría de los casos [47].
Por supuesto, hay que sopesar la eficacia de este tratamiento frente al riesgo de inducir una enfermedad de hueso adinámico, sin embargo, teniendo en cuenta la alta morbi-mortalidad asociada a la calcifilaxis, la relación riesgo/beneficio juega sin duda a favor del uso de bifosfonatos.
Nuestro esquema de tratamiento actual es de administración de 60 mg de Pamidronato endovenoso (en 100 mL de suero fisiológico a pasar durante una hora, que en el caso de pacientes en hemodiálisis sería durante la última hora de la sesión), dosis que se repite a los 15 días y al mes. En caso de no completa resolución de las lesiones proponemos una nueva dosis de 60 mg a los tres meses.
SNF472. Actualmente SNF472 se encuentra en fase de desarrollo clínico, como alternativa de tratamiento para la calcifilaxis en pacientes en hemodiálisis. El SNF472 que es una formulación intravenosa de mio-inositol hexafosfato (IP6). De momento, es el único fármaco que está siendo estudiado para esta enfermedad.
El SNF472 inhibe selectivamente la formación y crecimiento de los cristales de hidroxiapatita y por tanto la calcificación vascular. En el ensayo fase 2 en pacientes de CUA, tras 3 meses de tratamiento, se ha mostrado eficaz en revertir las lesiones de calcifilaxis así como en disminuir el dolor [48]. En diciembre de 2018, se ha iniciado un estudio de Fase 3 con este fármaco [49].
10. Pronóstico
La calcifilaxis se asocia a una morbi-mortalidad muy elevada.
La morbilidad se debe sobre todo al intenso dolor que provocan las lesiones y los requerimientos de hospitalización.
La mortalidad se encuentra entre el 30% y el 80% dependiendo de las comorbilidades y del patrón de afectación cutáneo. En los últimos años parece haber mejorado la mortalidad, sobre todo desde que se conoce mejor la patología, se actúa más rápidamente y se dispone de algunas alternativas de tratamiento. Un reciente estudio muestra una mortalidad a los 6 meses del 50% y al año del 58%, siendo la septicemia la primera causa de ella [24].
Hay que tener en cuenta que en la mayoría de las series publicadas los pacientes fallecen dentro del primer año por complicaciones infecciosas de las úlceras cutáneas y por otro lado suelen ser pacientes con una severa patología vascular que también condiciona su supervivencia.
Aunque la recidiva no suele ser habitual, los datos en la literatura son discordantes. Ahora bien, después de un diagnóstico de calcifilaxis, se deberían extremar las medidas de prevención con el objetivo de evitar la recidiva [50].
PUNTOS CLAVE
La calcifilaxis es una enfermedad rara que afecta sobre todo a los pacientes con ERC en diálisis y es debida a la calcificación progresiva y crónica de los vasos de pequeño calibre seguida por trombosis súbita de la luz residual.
Puede manifestarse como eritemas laminares cutáneos pruriginosos y posteriormente púrpura isquémica y necrosis cutánea muy dolorosa.
Las lesiones cutáneas pueden ser distales (mejor pronóstico) o proximales (peor pronóstico), aunque también puede manifestarse en otras áreas no cutáneas.
Los factores de riesgo más relevantes en pacientes con ERC son; sexo femenino, diabetes, obesidad, malnutrición, alteraciones del metabolismo óseo-mineral y la anticoagulación con antagonistas de la vitamina K.
El diagnóstico es clínico, puede complementarse con prueba de imagen y confirmarse con biopsia cutánea en caso de duda.
El inicio de un rápido tratamiento es fundamental para prevenir la progresión de las lesiones y su sobreinfección.
La limpieza quirúrgica de las heridas, la antibioterapia, la eliminación de los factores precipitantes de la calcificación ectópica y la administración de fármacos inhibidores de la calcificación, son las mejores opciones terapéuticas actuales para su manejo.