Anemia en la Enfermedad Renal Crónica
Palabras clave
Anemia en Hemodiálisis, Anemia en enfermedad renal crónica, Anemia en Diálisis Peritoneal, Déficit de hierro, Eritropoyetina, Anemia ferropénica, Vadadustat, darbepoetina, roxadustat, daprodustat, molidustat, inhibidores de prolil-hidroxilasas, factor inducible por hipoxia, PHI-HIF
INTRODUCCIÓN
La anemia es una complicación frecuente en pacientes con enfermedad renal crónica (ERC). Se presenta de manera progresiva a medida que disminuye el filtrado glomerular estimado. Los datos más recientes muestran que la prevalencia aumenta con el deterioro de función renal, aconteciendo en más del 50% de los pacientes con grado 4 y más del 90% en los de grado 5 que precisan diálisis [1].
En cuanto a la etiología, la anemia puede ser secundaria a múltiples causas, siendo el déficit de eritropoyetina la causa más frecuente, seguido de la ferropenia [1] [2] (Tabla 1). La eritropoyetina es una glicoproteína de 30.400 Daltons que se produce en los capilares peritubulares de la vasa recta como respuesta a una baja presión parcial de oxígeno. Recientemente se ha realizado un hallazgo de enorme trascendencia, y es descubrimiento concreto de las células renales productoras de eritropoyetina: las células Norn [3].
Más allá de la disminución en la producción de eritropoyetina, la ferropenia es una causa tratable y frecuente de anemia en la enfermedad renal. Las causas principales que condicionan ferropenia incluyen las pérdidas sanguíneas (extracciones, hemodiálisis…), la absorción intestinal disminuida, la disminución de la liberación desde los tejidos (mediada por la inflamación) y el sobretratamiento con agentes estimulantes de la eritropoyesis (AEE) [4]. Desde un punto de vista etiopatogénico, podemos dividir la anemia ferropénica en dos tipos [5]:
1. Ferropenia absoluta. Consiste en la depleción de los depósitos totales de hierro y se define como ferritina inferior a 100 ng/mL y un índice de saturación de transferrina (IST) inferior a 20%.
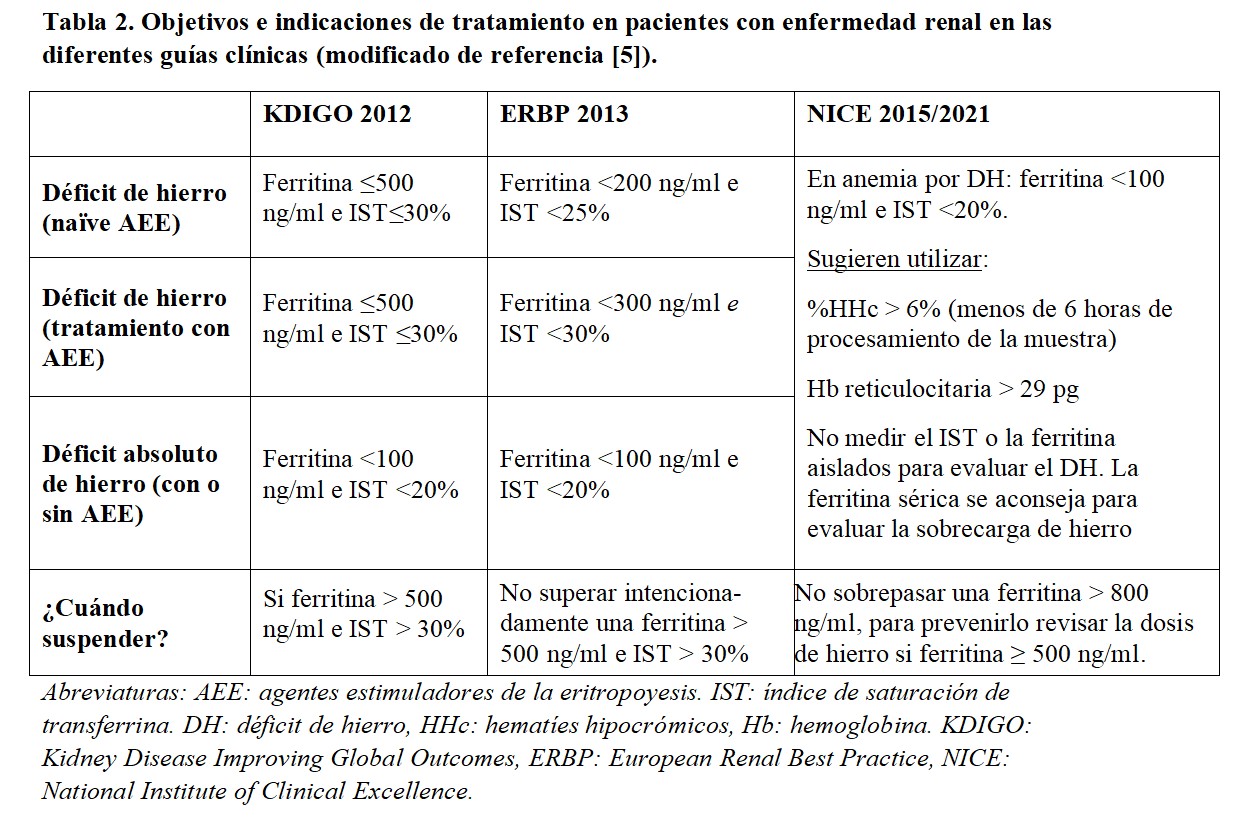
2. Ferropenia relativa o funcional. Es propia de los pacientes con cierto grado de inflamación y consiste en la presencia de depósitos adecuados (o elevados) de hierro pero que no pueden ser movilizados para la eritrocitosis. La hepcidina es una proteína sintetizada por el hígado que regula la absorción intestinal de hierro y su disponibilidad. Junto con su diana, la ferroportina forma un complejo que tiene como función la extracción de hierro. La estimulación del eje ferroportina-hepcidina secundaria a la inflamación limita la absorción de hierro intestinal y la liberación desde los tejidos donde se almacena (hígado, bazo y retículo endoplásmico) hasta los órganos donde se utiliza (músculo y médula ósea). Aunque no existen unos criterios diagnósticos homogéneos en las guías de actuación clínica, podríamos definir la ferropenia relativa como ferritina entre 200 y 500 mg/ml y un IST entre 20 y 30% [6] [7] [8] (Tabla 2).
Las consecuencias de la anemia en la ERC son muy relevantes desde el punto de vista clínico e incluyen progresión de la enfermedad, aumento en la incidencia de eventos cardiovasculares y reducción de la supervivencia. Desde el punto de vista sintomático, la anemia se asocia a debilidad, fatiga, letargia, alteraciones del sueño, anorexia y disminución de la capacidad cognitiva, junto con una peor percepción de la calidad de vida. Por ello, un adecuado estudio y conocimiento de la misma es un requisito imprescindible para su manejo [6] [9] [10].
MANEJO DE LA FERROPENIA
La prescripción de hierro, junto con los AEE y los inhibidores de las prolil-hidroxilasas del factor inducible por hipoxia (PHI-HIF) (estabilizadores del HIF), forma parte de los tres pilares básicos del manejo de la anemia en la enfermedad renal. Un correcto abordaje de la anemia debe estar encaminado a limitar al máximo las necesidades transfusionales de los pacientes. Las indicaciones de hierro se resumen en la (Tabla 2).
Ventajas e inconvenientes del hierro oral e intravenoso
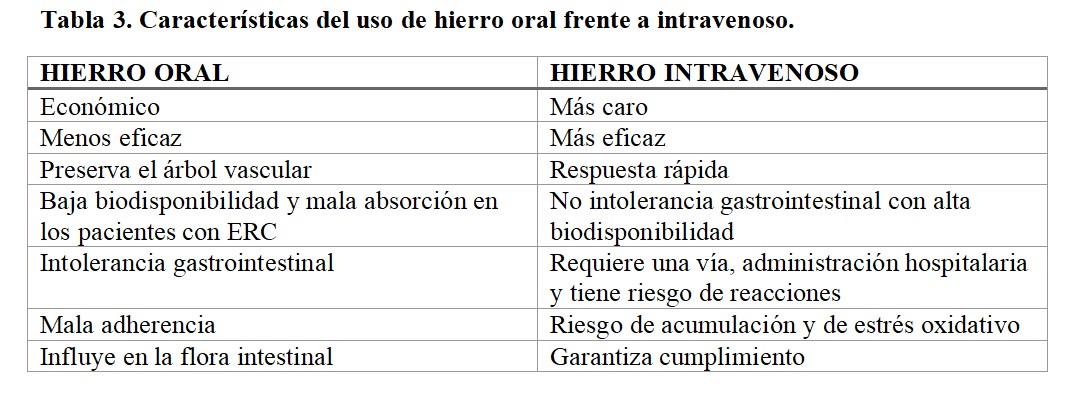
Dentro de los agentes disponibles, la primera decisión debe ser individualizar la vía de administración (Tabla 3). En términos generales, las guías abogan por la vía intravenosa en pacientes en programa de diálisis o aquellos con respuesta subóptima a las formulaciones orales. Únicamente, y con el fin de evitar visitas repetidas al hospital y preservar el árbol vascular, las guías (especialmente las NICE) sugieren intentar una prueba con formulación oral durante tres meses.
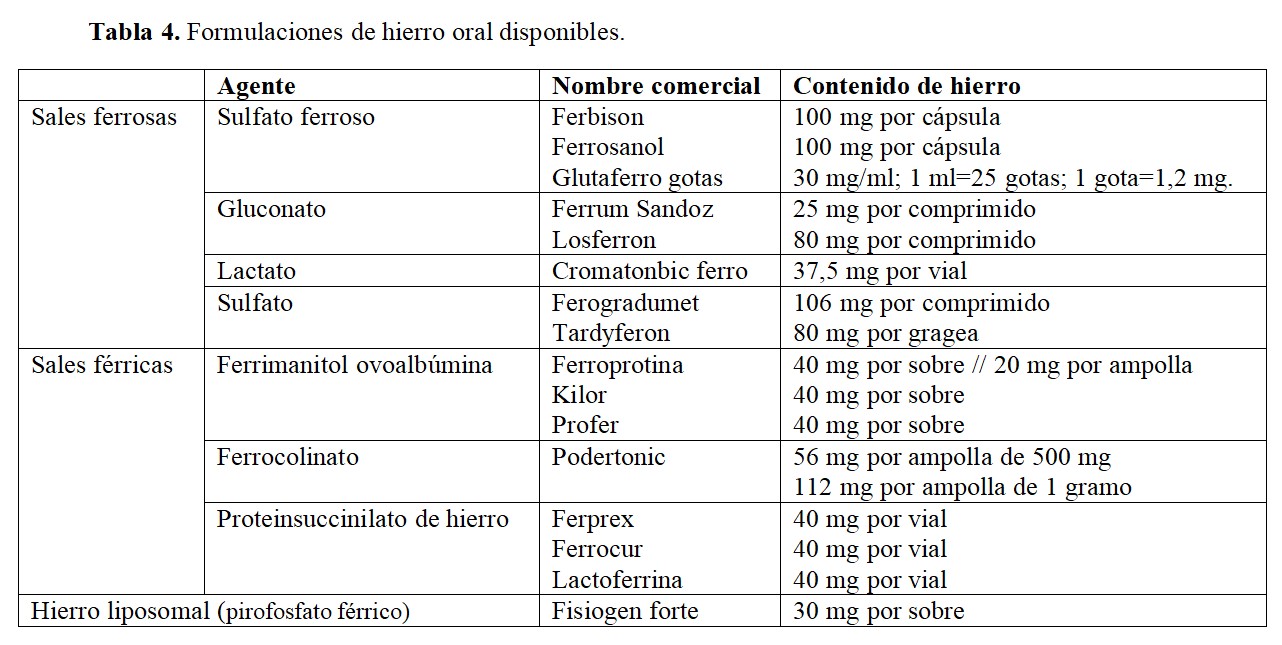
En la (Tabla 4) se resumen los principales agentes orales disponibles en el mercado. Cabe destacar que las preparaciones ferrosas presentan una absorción mayor que las férricas y dentro de ellas, las óptimas son las liberadas en el duodeno (por su alta eficacia y buena tolerancia).
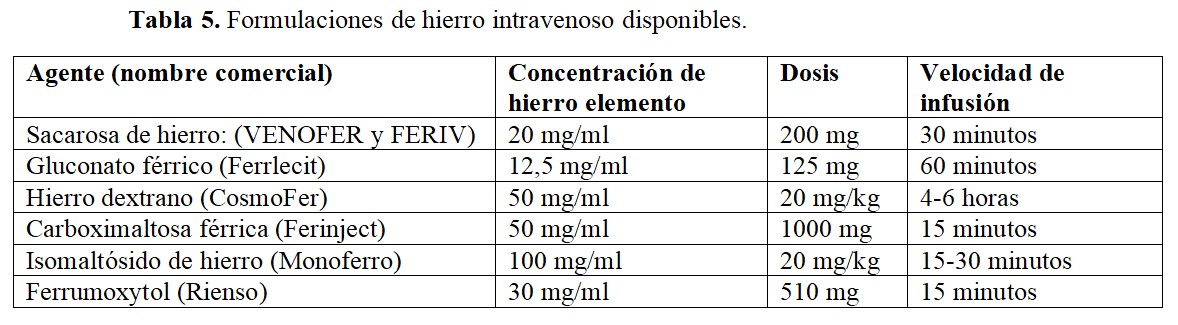
En la (Tabla 5) se resumen los agentes intravenosos disponibles. Dentro de los mismos, las formulaciones más modernas (carboximaltosa férrica, isomaltósido de hierro o ferrumoxytol) son de mayor tamaño y presentan menor hierro catalíticamente activo. Sin embargo, no existen comparaciones directas entre los diferentes agentes que permitan obtener conclusiones robustas. En términos de eficacia, el estudio FIND-CKD comparó la administración de carboximaltosa férrica a dosis altas y bajas frente a hierro oral, mostrando que dicho agente presentaba mayor efectividad para alcanzar cifras de hemoglobina superiores a 10 g/dl con menos necesidad de utilizar otras alternativas en el tratamiento de la anemia [11].
Dos estudios fundamentales: PIVOTAL y IROMAN
Los estudios PIVOTAL y IROMAN son dos importantes ensayos clínicos que han demostrado los beneficios pronósticos de replecionar los depósitos de hierro.
En primer lugar, el estudio PIVOTAL incluyó a 2141 pacientes en hemodiálisis y los aleatorizó a recibir un régimen proactivo de reposición férrica (con objetivo de alcanzar ferritina de 700 ng/ml o IST 40%) o un régimen reactivo (con objetivo de alcanzar ferritina de 200 ng/ml o IST 20%). El resultado principal del estudio fue que aquellos pacientes que recibieron dosis más elevadas de hierro presentaron un beneficio cardiovascular en términos de eventos, sin que esto supusiera un aumento de efectos adversos [12].
Por lo tanto, la administración de hierro se asocia a una disminución de las dosis de AEE, una menor incidencia de episodios de insuficiencia cardíaca e de infarto agudo de miocardio y, en el caso de pacientes en diálisis, una reducción de las necesidades transfusionales [13].
Por su parte, el estudio IRONMAN fue capaz de demostrar que la repleción de la ferropenia (definida como ferritina <100 ng/mL o IST <20%) en pacientes con insuficiencia cardíaca con fracción de eyección del ventrículo izquierdo reducida (<45%) se asoció a una menor incidencia de hospitalización por insuficiencia cardíaca y muerte cardiovascular [14]. Asumiendo que más del 30% de los pacientes con enfermedad renal presentan insuficiencia cardíaca, estos resultados son de enorme relevancia.
Efectos adversos
Los efectos adversos relacionados con la prescripción de hierro tienen su base en la sobrecarga férrica o en reacciones infusionales. La acumulación tisular de hierro ha servido de base fisiopatológica para explicar un aumento en la incidencia de infecciones y una estimulación excesiva del estrés oxidativo con potencial impacto cardiovascular. Hasta la fecha, esta última asociación no ha podido ser demostrada por lo que la seguridad de alcanzar concentraciones de ferritina hasta al menos 700 ng/ml parece garantizada. Además, como hemos comentado previamente, las nuevas formulaciones inducirían menos estrés oxidativo, al menos desde un punto de vista teórico. En cuanto a las reacciones anafilácticas, su incidencia ha decrecido considerablemente, sobre todo con las nuevas formulaciones [13].
MANEJO DE LOS AGENTES ESTIMULANTES DE LA ERITROPOYESIS
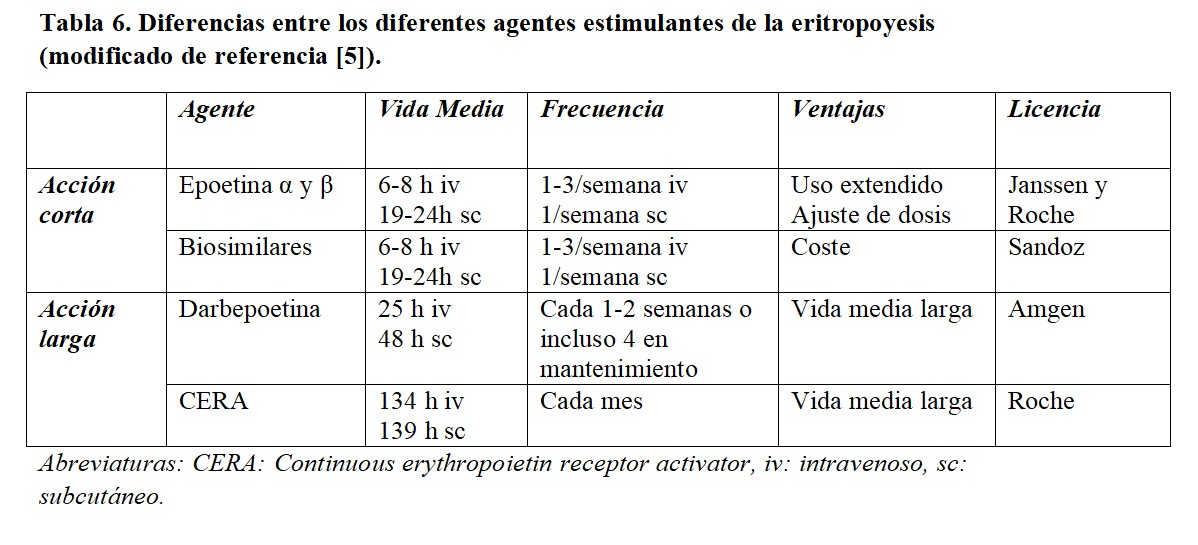
El objetivo del tratamiento con AEE nunca debe ser la normalización de los niveles de hemoglobina [15]. La indicación de los AEE es el tratamiento de la anemia de origen renal, lo que exige haber descartado previamente otras causas como las enumeradas en la (Tabla 1). En el momento actual, existen diferentes formulaciones, incluyendo el desarrollo de moléculas biosimilares (Tabla 6).
Indicaciones de tratamiento
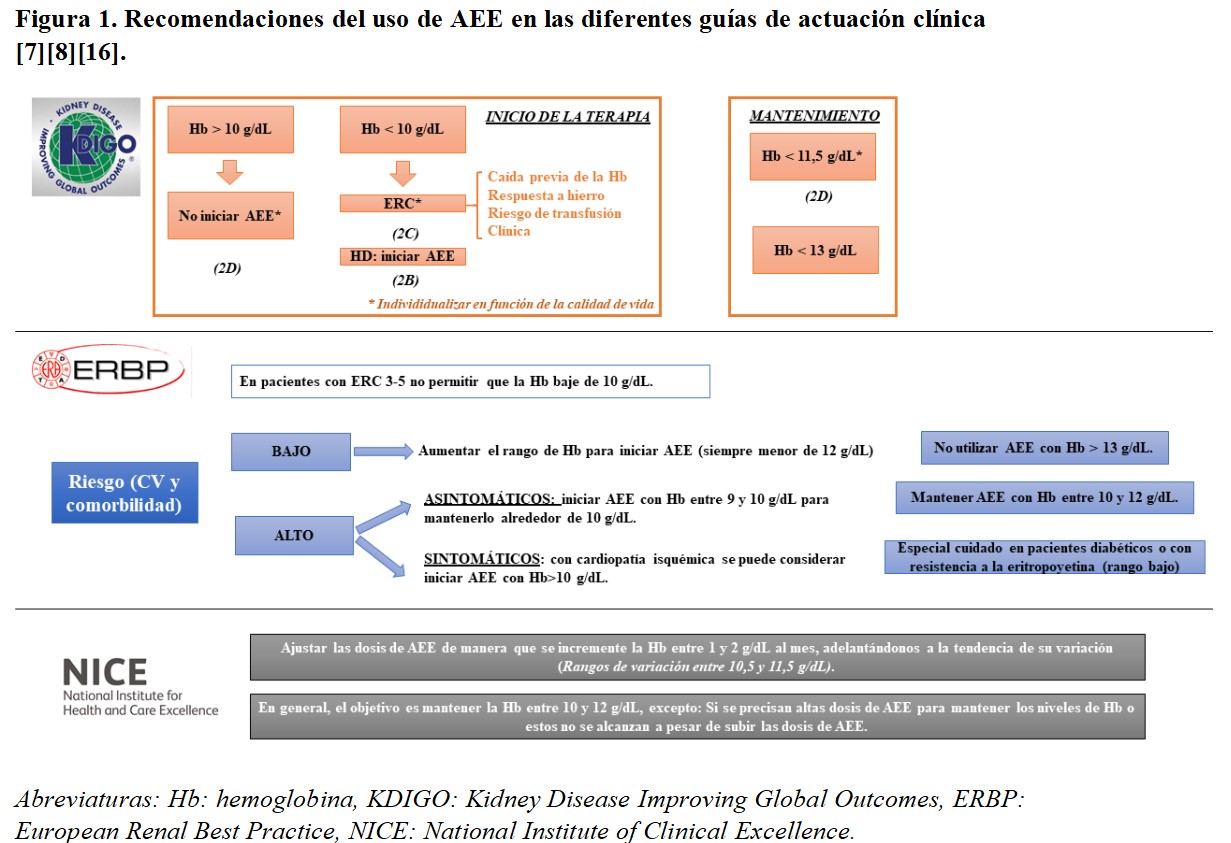
Las guías clínicas disponibles en el momento actual presentan algunas características comunes en la prescripción de los AEE. En términos generales, todo tratamiento debe ser individualizado atendiendo a la situación clínica y al riesgo cardiovascular. Se recomienda que la prescripción de AEE se realice en pacientes con hemoglobina inferior a 10 g/dl, valorando la tendencia en el momento de la corrección y evitando sobrepasar cifras de 13 g/dl, momento en el que se debería suspender. Aunque como se muestra en la (Figura 1) cada guía sugiere unos objetivos concretos, podemos establecer un objetivo de hemoglobina común entre 10 y 11,5 o 12 g/dl.
En concreto, las guías Kidney Disease Improving Global Outcomes (KDIGO) recomiendan el inicio de AEE con hemoglobina inferior a 10 g/dl. Con cifras por debajo de 10 g/dl, se sugiere iniciar AEE en los pacientes en diálisis y en el ERC individualizar teniendo en cuenta la caída previa, la respuesta al hierro, el riesgo transfusional y la clínica del paciente. En cuanto al mantenimiento sugieren no modificar el tratamiento mientras la hemoglobina no caiga por debajo de 11,5 g/dl y suspender si asciende por encima de 13 g/dl [7].
Las guías European Renal Best Practice (ERBP) estratifican el riesgo cardiovascular y las comorbilidades del paciente para establecer una recomendación. En general, sugieren no dejar que la hemoglobina baje de 10 g/dl salvo en los de alto riesgo asintomáticos. Se marca un objetivo de variabilidad entre 10 y 12 g/dl, titulando a la baja en los pacientes diabéticos y aquellos resistentes [16].
Finalmente, las guías National Institute of Clinical Excellence (NICE) recomiendan un rango de variación de 10,5 a 11,5 g/dl de hemoglobina, con objetivo de mantener entre 10 y 12 g/dl y evitando aumentos considerables de dosis en pacientes hiporrespondedores [8].
Efectos adversos
Los efectos adversos de los AEE son escasos, siempre y cuando se hayan prescrito de manera adecuada. En concreto, los más habituales incluyen el aumento de la presión arterial, las trombosis (acceso vascular), la disminución de la eficacia en hemodiálisis por aumento de hematocrito, las convulsiones y la aplasia pura de células rojas. En la actualidad, la aplasia pura de células rojas es una complicación excepcional, que se produce por la aparición de anticuerpos tipo IgG específicos frente a los AEE. El resultado es una anemia severa hiporregenerativa, con niveles muy bajos de reticulocitos y una ausencia casi completa de precursores de glóbulos rojos en la médula ósea. A finales de la década de los 90´, se produjo un aumento brusco de su incidencia, que fue relacionado con algunos de los cambios efectuados en el proceso de fabricación de una epoetina-α, y que fue especialmente llamativo cuando se administraba por vía subcutánea [17].
Resistencia a los AEE
En general, la respuesta a los distintos AEE es muy variable de unos pacientes a otros, pero cuando la hemoglobina no aumenta con arreglo a lo esperado tras el tratamiento con un AEE, debe sospecharse un proceso intercurrente o alguna deficiencia nutricional que esté alterando la respuesta eritropoyética. Las causas más frecuentes de respuesta insuficiente a los AEE quedan recogidas en la (Tabla 7).
En la actualidad, no existe una definición precisa de hiporrespuesta a los AEE. Sin embargo, con el fin de establecer un criterio objetivo de dosis/respuesta, se ha venido empleando el cociente entre la dosis de epoetina en UI/Kg/semana (o el equivalente para otros AEE) y la concentración de hemoglobina en g/dl, conocido como índice de resistencia eritropoyético. Esta relación permite identificar aquellos pacientes con pobre respuesta cuando, de forma orientativa, el índice es superior a 25-30 UI semanales de epoetina/Kg de peso/g/dl o dosis equivalentes de otros AEE. Las guías KDIGO lo definen como la ausencia de incremento inicial de hemoglobina tras un mes de tratamiento y las guías NICE como >300 IU/kg/semana (subcutáneo), >450 IU/kg/semana (intravenoso) o >1,5 mg/kg/semana (subcutáneo) [6] [7] [8].
La hiporrespuesta a los AEE se asocia a mayor mortalidad y tasa de eventos cardiovasculares [15] [18] [19], probablemente como consecuencia de la comorbilidad subyacente. En ocasiones, la causa de la hiporrespuesta puede ser totalmente asintomática y es preciso investigar posibles factores de comorbilidad asociada que la puedan estar condicionando. De hecho, en el subanálisis del estudio TREAT, entre los pacientes asignados al grupo de hemoglobina alta, aquellos con hiporrespuesta a los AEE eran los que tenían mayor número de eventos [15]. No obstante, la deficiencia de hierro continúa siendo la causa más frecuente de respuesta insuficiente, seguida de los estados de inflamación de origen múltiple.
INHIBIDORES DE PROLIL-HIDROXILASAS DEL FACTOR INDUCIBLE POR HIPOXIA
La novedad en el campo de la anemia renal es la ampliación del arsenal terapéutico con un nuevo grupo farmacológico, los inhibidores de prolil-hidroxilasas (PH) del HIF (PHI-HIF). El tratamiento basado en ferroterapia y AEE, no aborda la alteración de la vía de detección de oxígeno o la inflamación observada en pacientes con ERC y anemia [1].
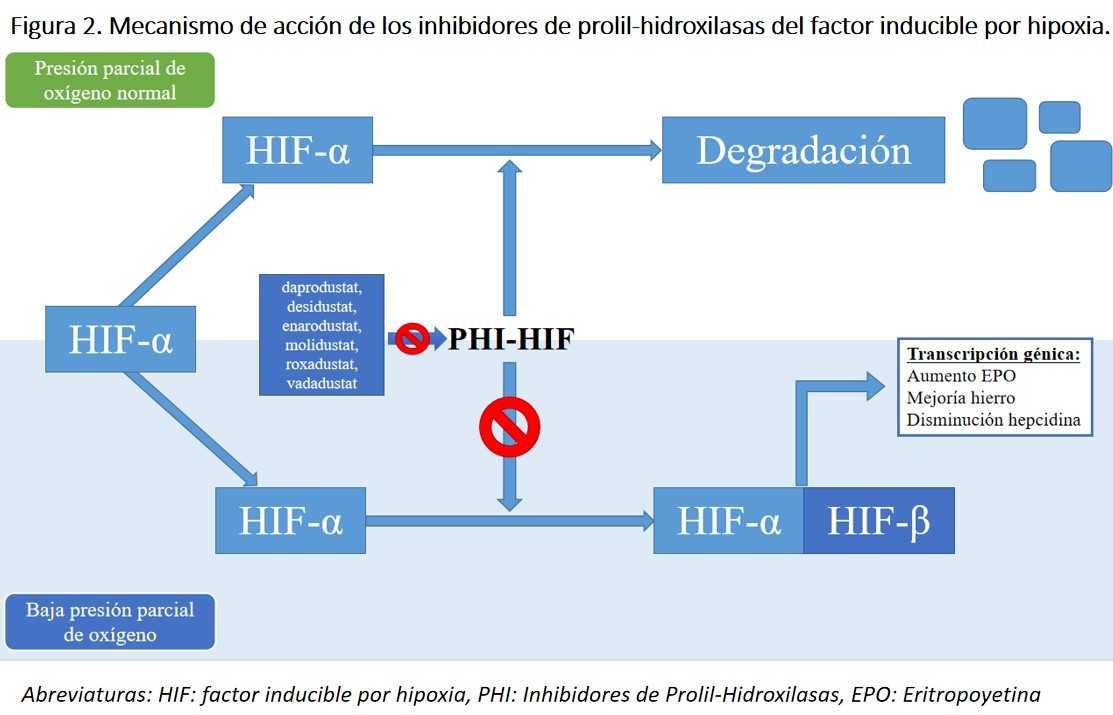
El mecanismo de acción de estos fármacos consiste, precisamente en la inhibición de las enzimas PH, que son las encargadas de degradar el HIF limitando sus funciones, entre las que se encuentra la estimulación de la eritropoyesis y la mejora en la absorción y movilización del hierro (Figura 2). El estímulo más importante para la activación del HIF es la hipoxia, situación que se simula (al inhibir las PH) con este nuevo grupo farmacológico. Mediante la inhibición reversible de PH-HIF se restaura la vía de detección de oxígeno para proporcionar una respuesta eritropoyética coordinada, que incluye el aumento de la síntesis de eritropoyetina endógena, la regulación de las proteínas transportadoras de hierro y la reducción de la hepcidina [20], . Además de la eritropoyesis, la inhibición de las PH puede afectar a la transcripción de genes relacionados con la inflamación, estrés oxidativo o angiogénesis.
Agentes disponibles
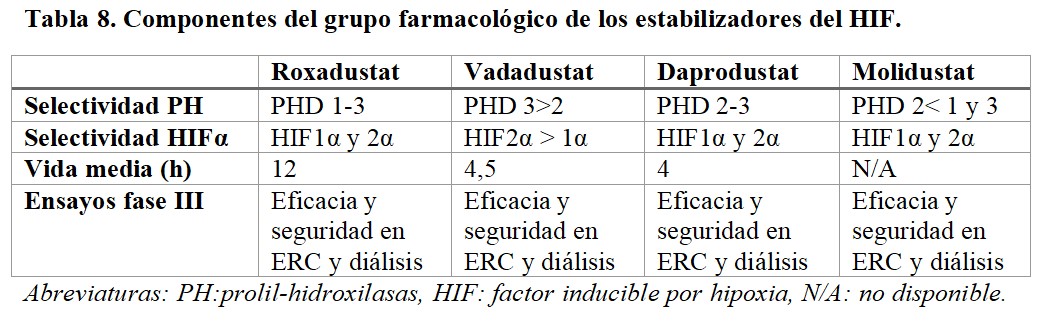
Entre todos los componentes del grupo farmacológico, sólo cuatro de ellos presentan resultados en fase III: roxadustat, vadadustat, daprodustat y molidustat (Tabla 8). En el momento actual, sólo roxadustat tiene la aprobación para su comercialización en España (Tabla 9).
Aunque de todos los componentes se han desarrollado los correspondientes ensayos pivotales, las conclusiones a las que se llega se pueden resumir en los siguientes:
-En los pacientes con ERC sin necesidad de diálisis, los PHI-HIF han mostrado ser superiores a placebo en el aumento de las cifras de hemoglobina. En estudios comparativos con AEE, el estudio de más relevancia es el DOLOMITES, que aleatorizó a 616 pacientes a recibir roxadustat o darbepoetina, evidenciando la no inferioridad del primero (89% vs 78%) en la consecución del objetivo principal [21].
En los pacientes con ERC sin necesidad de diálisis, los PHI-HIF han mostrado ser superiores a placebo en el aumento de las cifras de hemoglobina. En estudios comparativos con AEE, el estudio de más relevancia es el DOLOMITES, que aleatorizó a 616 pacientes a recibir roxadustat o darbepoetina, evidenciando la no inferioridad del primero (89% vs 78%) en la consecución del objetivo principal, que fue la respuesta de Hb durante las primeras 24 semanas de tratamiento, con una diferencia de proporciones del 11,5%. Además, roxadustat fue superior a darbepoetina en la necesidad de hierro IV [21].
-En los pacientes con ERC en diálisis, los PHI-HIF han mostrado ser no inferiores al uso de AEE.
-Los PHI-HIF presentan de manera constante algunos beneficios adicionales pero muy relevantes para los pacientes con ERC como, por ejemplo [22]:
- Mejoría del manejo del hierro a través de la disminución significativa de la hepcidina y la ferritina y del aumento significativo del hierro sérico
- Mejoría de las cifras de LDL-colesterol a través de la degradación de la hidroxi-metil-glutaril-CoA (en pacientes con y sin estatinas).
- Estimulación de la síntesis hepática de eritropoyetina
- Mejoría del estrés oxidativo y de la inflamación (vía factor nuclear κB)
Factores a tener en cuenta con el uso de los PHI-HIF
En términos de seguridad, el estudio pivotal de Vadadustat (frente a darbepoetina) en pacientes no en diálisis demostró un aumento de los eventos cardiovasculares en la rama de intervención con Vadadustat [23]. Sin embargo, recientes metaanálisis, así como en el resto de los ensayos con otros HIF-PHI, dicho riesgo no ha sido confirmado por lo que se puede considerar que la seguridad cardiovascular está garantizada [22][24].
Desde el punto de vista mecanicista, la estimulación de la transcripción génica, había sembrado algunas dudas en cuanto al posible desarrollo de tumores o al aumento de la progresión de la enfermedad renal. Dado que la inhibición de las PHI-HIF con estos agentes es selectiva, datos agregados han podido confirmar que no se aumenta la incidencia de ninguno de estos dos eventos [22]. En términos de proliferación, algunos autores han remarcado una cierta preocupación del uso de PHI-HIF en los pacientes con retinopatía diabética [25].
Finalmente, la prescripción de PHI-HIF debe realizarse con precaución en pacientes que tomen algunos fármacos sustratos de BCRP o OATP1B1 como estatinas (de las que pueden aumentar sus concentraciones siendo necesario reducir las dosis de éstas cuando se administren simultáneamente), o con otros que se metabolicen por CYP2C8 o UGT1A9 (gemfibrozilo, rifampicina) [26].