Alteraciones Lipídicas en la ERC
1. INTRODUCCIÓN
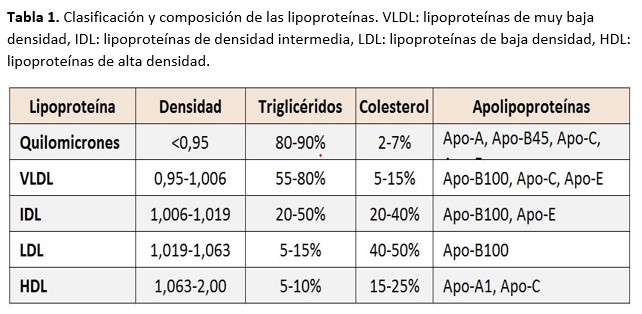
La primera causa de muerte en los pacientes con enfermedad renal crónica (ERC) son los eventos cardiovasculares. En el paciente con insuficiencia renal se produce una conjunción de factores de riesgo cardiovascular clásicos y no clásicos que sinérgicamente empeoran su pronóstico. Dentro de los factores tradicionales probablemente el más estudiado es la dislipemia cuyos componentes se resumen en la (Tabla 1).
En este capítulo vamos a resumir las evidencias disponibles de la dislipemia del paciente con insuficiencia renal y su relación con los eventos cardiovasculares, así como las dianas terapéuticas actuales y en desarrollo.
2. CARACTERÍSTICAS DE LA DISLIPEMIA DEL PACIENTES CON ENFERMEDAD RENAL
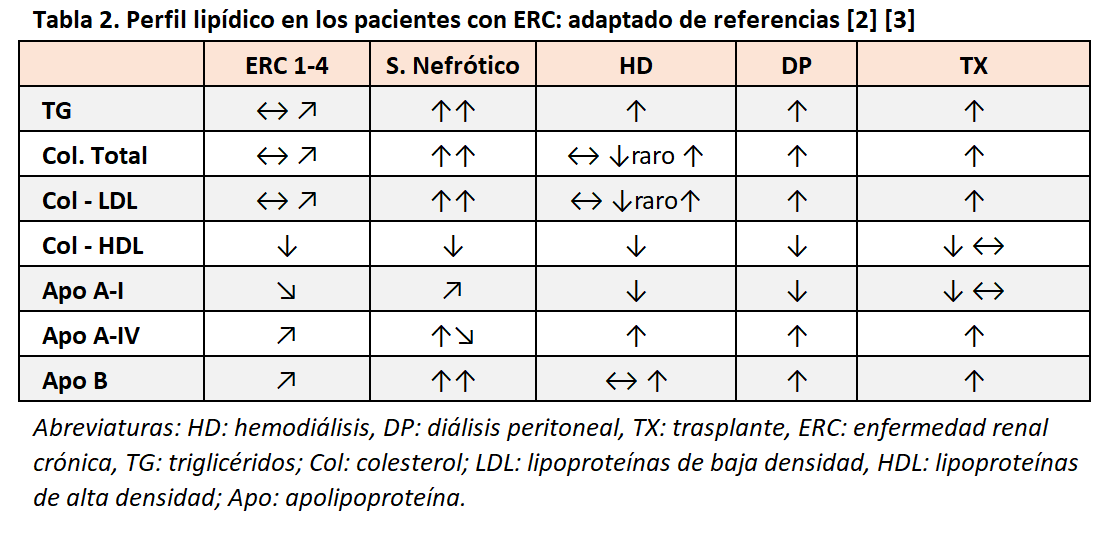
Los pacientes con ERC presentan un perfil lipídico característico que incrementa su capacidad aterogénica a medida que empeora el filtrado glomerular [1]. En la (Tabla 2) se resume el perfil lipídico en pacientes con ERC.
Las lipoproteínas de alta densidad (HDL) juegan un papel fundamental en la vía reversa del colesterol por la que el colesterol vuelve desde los tejidos periféricos al hígado. En los pacientes con ERC, el transporte desde los tejidos (incluyendo macrófagos y células endoteliales) está disminuido por inhibición en ciertos mediadores (ABCA1 y ABCR1). Además, la proteína de transferencia de ésteres de colesterol (CEPT) cuya función es transferir ésteres de colesterol de HDL a LDL tiene su actividad aumentada. Estas dos situaciones conducen a unas cifras más bajas de HDL, pero sobre todo inmaduras y con baja funcionalidad [2] [3].
Las lipoproteínas de densidad muy baja (VLDL) e intermedia (IDL) se secretan por el hígado cargadas de triglicéridos. Su hidrólisis mediante la enzima lipoproteín lipasa (LPL) libera triglicéridos a los tejidos periféricos, convirtiendo las moléculas en lipoproteínas de baja densidad (LDL). En la insuficiencia renal se produce una deficiencia en la acción de la LPL lo que condiciona valores séricos de VLDL e IDL elevados, e hipertrigliceridemia [2] [4].
Sin duda, la molécula más estudiada en sus efectos aterogénicos es la LDL. Curiosamente, y a pesar del elevado riesgo cardiovascular de los pacientes con ERC, las cifras de LDL son similares a las de la población sin enfermedad renal. Sin embargo, la composición de LDL sí es diferente. Por un lado, las moléculas de LDL están oxidadas debido al ambiente pro-oxidante y pro-inflamatorio de la enfermedad renal (sobre todo en los pacientes con ERC en estadios más avanzados). Por otro lado, las partículas de LDL en la ERC son más pequeñas lo que aumenta su capacidad difusiva en la pared arterial y por tanto su poder aterogénico [5] [6].
La asociación de las alteraciones del perfil lipídico con eventos cardiovasculares es más evidente con cifras elevadas de VLDL y LDL o valores bajos de HDL, pero, a diferencia de la población general, no con los triglicéridos [7] [8] [9].
Nefrotoxidad lipoidea
La dislipemia del síndrome nefrótico presenta, por su parte, características diferenciales. La hipótesis clásica de que la hipoalbuminemia secundaria a la proteinuria produce una disminución de la presión oncótica del plasma y como consecuencia un aumento de la síntesis hepática de lipoproteínas, y aumento de las cifras de colesterol total, VLDL, IDL, LDL, lipoproteína A, actualmente ha quedado en entredicho y son otros mecanismos los que explican las alteraciones Por un lado, como consecuencia de un defecto en su aclaramiento hepático, pero también por aumento de la actividad de K9, la mayoría de las lipoproteínas se encuentran elevadas. PCSK9 tiene como objeto degradar el receptor de LDL (R-LDL) y su elevación disminuye la capacidad de reciclaje de las moléculas de LDL en el hígado. Por otro lado, la disminución de LPL enlentece el aclaramiento de las lipoproteínas más aterogénicas [10]. En consecuencia, los pacientes con síndrome nefrótico presentan una dislipemia caracterizada por cifras elevadas de VLDL, IDL, LDL y triglicéridos lo que condiciona un mayor riesgo de eventos ateroescleróticos mayores [11]. Además, otro aspecto interesante de la dislipemia es el de la nefrotoxicidad lipoidea, que produce su efecto sobre la progresión de la enfermedad renal. En situación de dislipemia, los diferentes componentes del perfil lipídico pueden convertirse en patogénicos. Las partículas de LDL, sobre todo si están oxidadas, son atrapadas por las células mesangiales induciendo su proliferación y promoviendo esclerosis glomerular [12]. Por otro lado, los ácidos grasos libres pueden lesionar directamente el podocito, pero, además, si se filtran, pueden inducir lesiones túbulo intersticiales [13]. Estas acciones tóxicas renales pueden inducir lesiones renales de novo o agravar las ya existentes, promoviendo la progresión de la ERC [6] [14].
La lipoproteína(a): el componente genético más relevante
Hasta hace poco tiempo, la lipoproteína(a) (Lp(a)) no había recibido gran atención clínica en la evaluación de la dislipemia. Una de las razones que lo justifican es que apenas disponíamos de agentes con capacidad para disminuir sus niveles, y, por tanto, atenuar el riesgo cardiovascular que induce [15]. La Lp(a) se sintetiza en el hígado y aumenta con el deterioro del filtrado glomerular, lo que se explica por su posible aclaramiento renal. De hecho, los pacientes en hemodiálisis presentan cifras elevadas de Lp(a) por defecto en su eliminación, mientras que el síndrome nefrótico promueve su síntesis manteniendo tasas de aclaramiento cercanas a los de la población general [16] [17]. Su relación con los eventos cardiovasculares ha sido probada en poblaciones muy seleccionadas por lo que aun precisamos de más evidencia en pacientes con enfermedad renal, para poder extrapolar los datos de la población general [3]. Mientras que las estatinas tienen un efecto neutro sobre la Lp(a), la LDL-aféresis puede reducir sus niveles hasta un 75% y los inhibidores de PCSK9 (iPCSK9) un 30% [18]. Actualmente está en marcha un ensayo clínico fase III que trata de demostrar el papel sobre los eventos cardiovasculares de un fármaco oligonucleósido antisentido capaz de interferir en la síntesis de Lp(a) como comentaremos más adelante en este mismo capítulo [19].
3. ESTATINAS EN EL TRATAMIENTO DE LA DISLIPEMIA
Evidencia del tratamiento con estatinas en la ERC
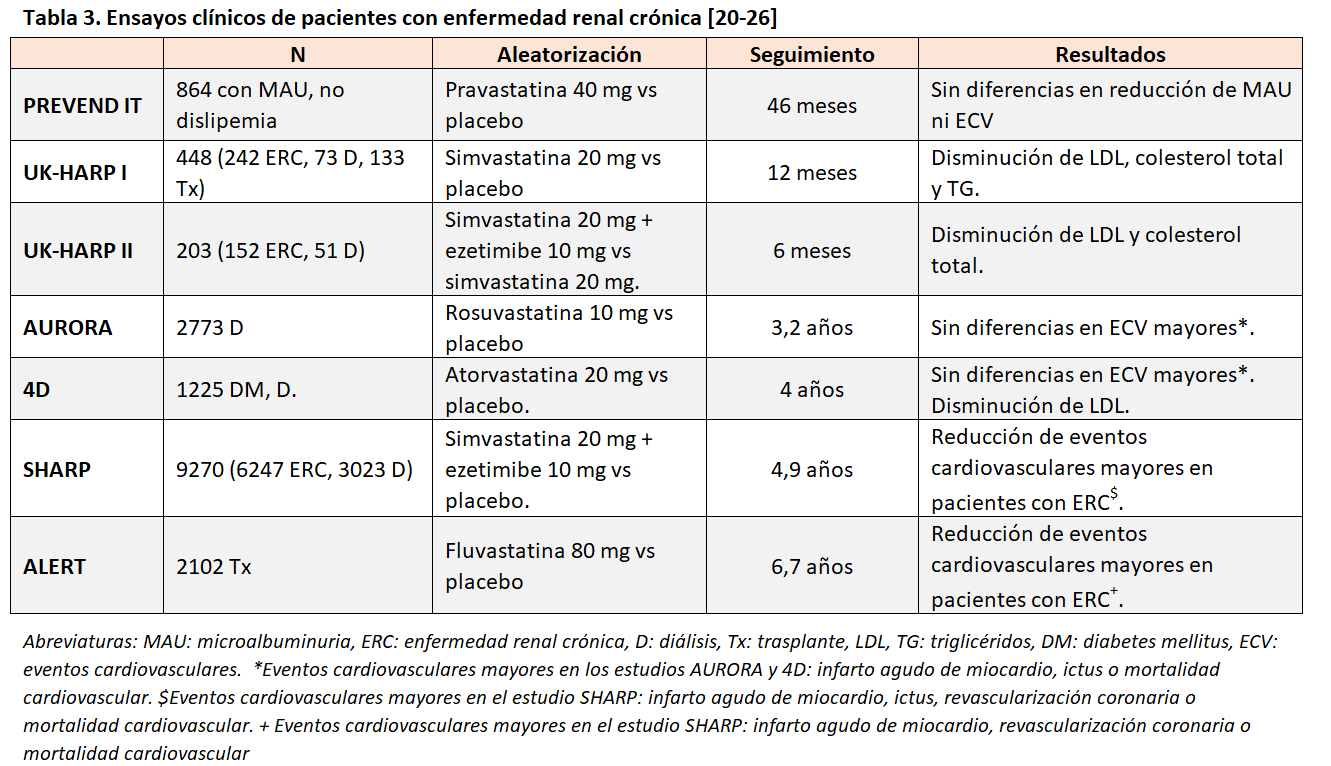
Las estatinas son el grupo farmacológico por excelencia en el tratamiento de la dislipemia. Los ensayos clínicos de pacientes con ERC en los que se analiza el efecto de las estatinas en la reducción de los eventos cardiovasculares han aportado una evidencia suficiente en el caso de pacientes sin terapia renal sustitutiva (TRS) (Tabla 3). Sin embargo, en pacientes en diálisis ninguno de ellos ha sido capaz de demostrar que el tratamiento hipolipemiante con estatinas reduzca la tasa de eventos [20] [21] [22] [23] [24] [25] [26].
En una revisión sistemática que incluyó a 484289 pacientes con ERC, se analizó el papel de las estatinas sobre eventos cardiovasculares. Los resultados mostraron que las estatinas reducían un 23% el RR de evento cardiovascular mayor, un 18% los eventos coronarios, y un 9% mortalidad cardiovascular y de cualquier causa. Sin embargo, no se objetivo efecto sobre el ictus ni la enfermedad renal. El análisis por subgrupos en función del grado de ERC mostró que el beneficio de las estatinas disminuía a medida que la ERC avanzaba [27].
Recomendaciones de las guías
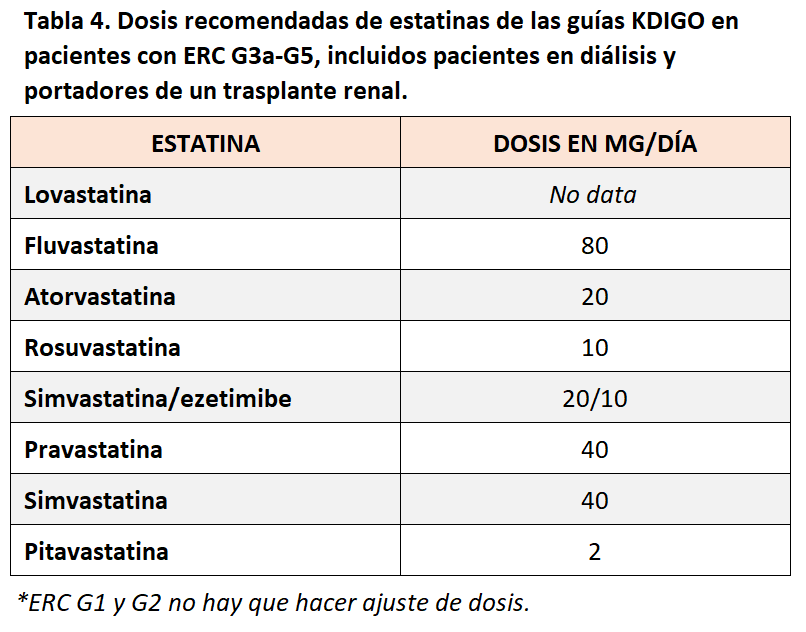
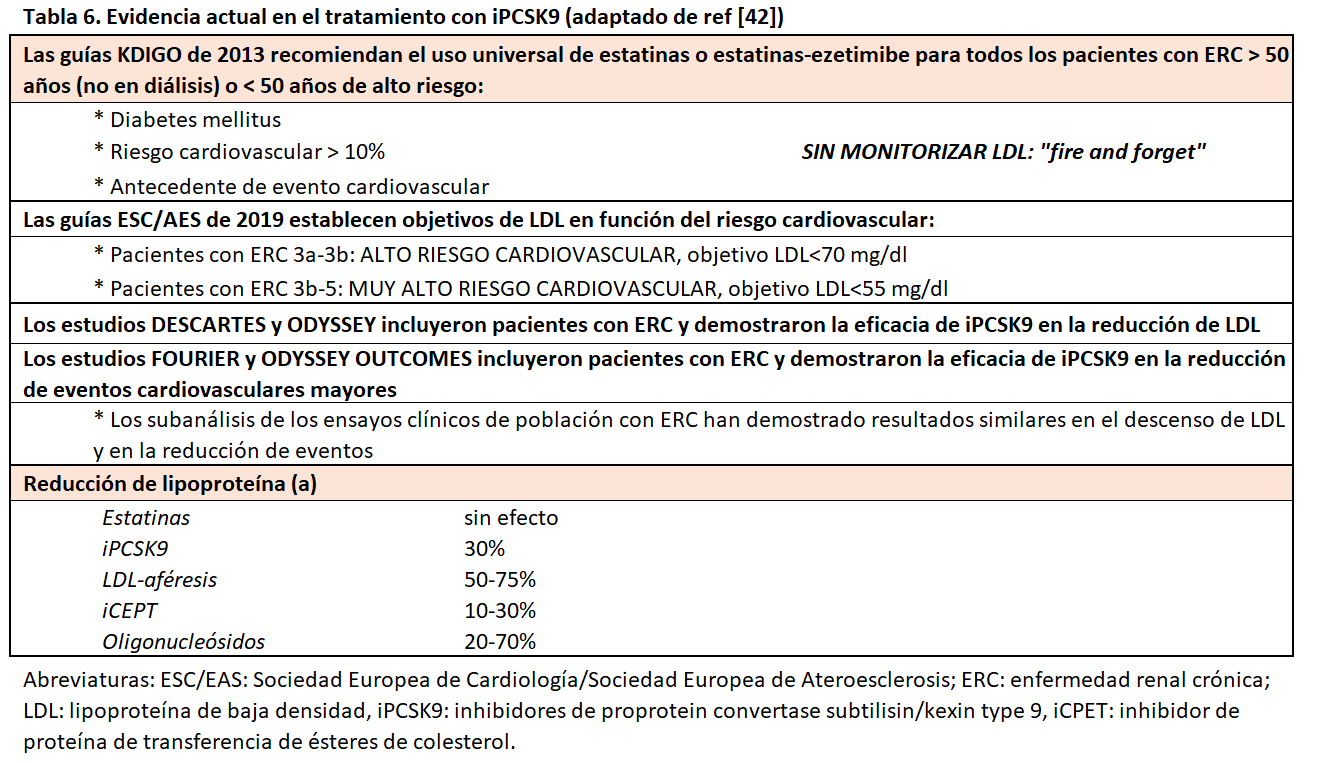
Con esa información disponible, las guías KDIGO publicadas en 2013 establecieron una estrategia denominada “fire and forget” (“dispara y olvida”). En ella, se recomendaba que los pacientes mayores de 50 años con ERC (grados 3a a 5, sin diálisis) recibieran una estatina (con o sin ezetimibe) independientemente de los niveles de LDL y sin necesidad de monitorizar la eficacia. Para los menores de 50 años recomendaba el uso de estatinas sólo si se cumplía uno de los siguientes requisitos: presentar una enfermedad coronaria, tener diabetes mellitus, haber presentado un ictus o tener un riesgo cardiovascular estimado superior al 10%. Asimismo, se sugería el tratamiento hipolipemiante a los portadores de un trasplante renal y se desaconsejaba en los pacientes en programa de diálisis (salvo que ya recibieran una estatina previamente) [28]. Adicionalmente, las guías establecen las dosis recomendadas de estatinas en los pacientes con ERC justificadas por los datos de los ensayos clínicos y por su potencial toxicidad (Tabla 4).
En cuanto a la hipertrigliceridemia, se sugiere efectuar cambios en el estilo de vida sin abordaje farmacológico. El uso de fibratos presenta dudas en cuanto a la seguridad en pacientes con ERC avanzada y los datos publicados con ácidos grasos aún son contradictorios en cuanto al impacto en el pronóstico por lo que deben ser considerados como un segundo o incluso tercer escalón en el tratamiento de la dislipemia [29] [30].
Con una estrategia completamente diferente, las guías de las Sociedades Europeas de Cardiología y Ateroesclerosis proponen el “treat to target” (“tratar para alcanzar un objetivo”) [31]. En ellas, los pacientes con ERC son considerados como de alto o muy alto riesgo cardiovascular en función del filtrado glomerular estimado (FGe) que presenten (entre 30 y 59 ml/min/1,73m2 y menor de 30 ml/min/1,73m2, respectivamente). Además, los objetivos de LDL se sitúan para todos los pacientes con alto riesgo en 70 mg/dl y en 55 mg/dl para los de muy alto riesgo. Con estas recomendaciones, la posibilidad de alcanzar dichos objetivos es muy ambicioso utilizando las estatinas en monoterapia o en combinación con ezetimibe por lo que los nuevos agentes iPCSK9 suponen una alternativa válida como veremos a continuación.
4. iPCSK9 EN EL TRATAMIENTO DE LA DISLIPEMIA
Mecanismo de acción de los iPCSK9
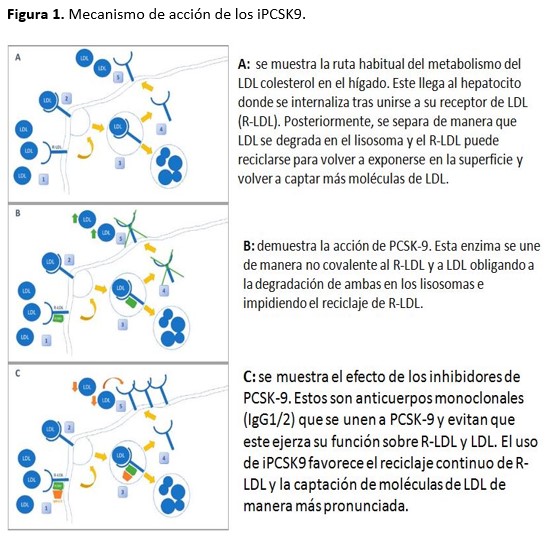
La revolución en el tratamiento de la dislipemia aterogénica en los pacientes con alto riesgo cardiovascular ha llegado de la mano de los anticuerpos frente a PCSK9 (Figura 1).
Los iPCSK9 interfieren en el mecanismo de reciclaje de LDL a nivel hepático de manera que son capaces de mantener una exposición continua de R-LDL para que capten continuamente LDL. En situación de normalidad, LDL llega al hepatocito, se internaliza a través de su receptor específico R-LDL y posteriormente, se separan la molécula de LDL y su receptor, permitiendo la degradación de LDL y el reciclaje de R-LDL. Este proceso está regulado por la enzima PCSK9 cuya función es unirse al complejo LDL – R-LDL y evitando su separación intracelular, de manera que se degradan ambas en los lisosomas y no se puede reciclar el receptor. Los anticuerpos iPCSK9 bloquean este feedback de manera permanente, permitiendo el reciclaje y exposición continuo y amplificado de R-LDL en la membrana del hepatocito con la consiguiente captación continua de LDL [32].
Control de la dislipemia
En el momento actual, se han comercializado dos principios activos de iPCSK9: evolocumab y alirocumab. El desarrollo de ambos fármacos ha seguido vías paralelas en cuanto a la consecución de hitos clínicos. En primer lugar, ambos fármacos demostraron en los estudios DESCARTES y ODYSSEY su capacidad para disminuir en más de un 50% los niveles basales de LDL [33] [34]. El control del perfil lipídico no sólo afecta a LDL, sino que también son capaces de alcanzar una mejoría de los valores de colesterol no-HDL, apolipoproteína B, triglicéridos y Lp(a) e incluso un modesto incremento de HDL-colesterol (5-10%) [35].
Reducción de eventos cardiovasculares mayores
Evolocumab y alirocumab no habrían irrumpido en la práctica clínica habitual si no hubieran sido capaces de demostrar su efecto sobre los eventos cardiovasculares. Los ensayos clínicos FOURIER y ODYSSEY-OUTCOMES aleatorizaron a pacientes con alto riesgo cardiovascular y que no alcanzaban el objetivo de LDL con tratamiento hipolipemiante optimizado, a recibir evolocumab o alirocumab, o placebo. En ambos casos, como se resume en la (Tabla 5), se demostró que ambos fármacos reducían la tasa de eventos cardiovasculares mayores alrededor de un 15% al final del seguimiento [36] [37]. Los efectos adversos de los iPCSK9 reportados en los ensayos clínicos, incluidos los del estudio OSLER con un seguimiento de 5 años son similares a los de los grupos placebo a excepción de las reacciones en el punto de punción [38].
Asimismo, estos agentes han sido capaces de demostrar su efecto beneficioso sobre la ateromatosis coronaria induciendo reducción de la placa [39].
Subanálisis en los pacientes con enfermedad renal
Todos los estudios publicados hasta la fecha han excluido a pacientes con insuficiencia renal avanzada. Salvo el estudio FOURIER que marcó como FGe límite 20 ml/min/1,73m2, el resto de los ensayos sólo incluyeron pacientes si presentaban FGe por encima de 30 ml/min/1,73m2. En cualquier caso, los subanálisis publicados tanto de los estudios cuyo objetivo era demostrar la eficacia de los iPCSK9 en la mejoría del perfil lipídico como los de reducción de eventos cardiovasculares mayores, han mostrado efectos similares en pacientes con y sin insuficiencia renal [40] [41]. En cuanto a los efectos adversos, en el subanálisis del estudio FOURIER se evaluaron los cambios en la función renal sin evidenciarse diferencias entre el grupo placebo y el grupo evolocumab, y, simplemente se reportó un leve aumento de rabdomiólisis como efecto adverso en el grupo tratamiento [8].
En la (Tabla 6), se resumen la evidencia actual del uso de iPCSK9 en pacientes con enfermedad renal [42].
Indicaciones actuales de los iPCSK9
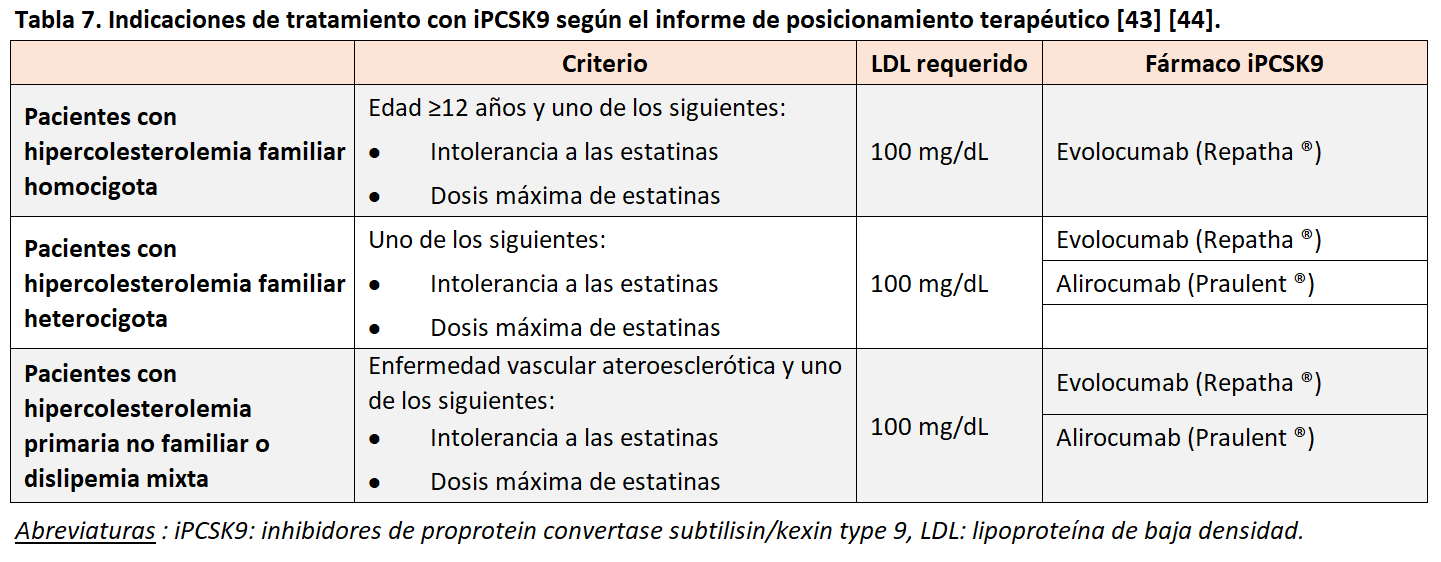
Con la evidencia disponible actualmente, las indicaciones de uso de iPCSK9 han quedado reducidas a las expuestas en la (Tabla 7) [43] [44].
5. NUEVAS DIANAS EN EL TRATAMIENTO DE LA DISLIPEMIA
Aféresis terapéutica
La aféresis se ha considerado una técnica de último escalón en el tratamiento de la dislipemia refractaria. Los pacientes en los que más se ha utilizado está técnica es en los que presentan hipercolesterolemia familiar, con buenos resultados en cuanto a la reducción de LDL colesterol [45]. Sin embargo, uno de los problemas de la LDL-aféresis radica en el rápido rebote de las cifras de LDL a pesar del pronunciado descenso inicial que puede rondar el 70-80% [46]. El recientemente publicado estudio EVOLAFER01 analiza en un estudio abierto y prospectivo el perfil lipídico de los pacientes tras someterlos a tres fases que incluyen LDL-aféresis, iPCSK9 (evolocumab) y ambas. Los resultados concluyen que evolocumab es más efectivo que la LDL-aféresis en la reducción de LDL-colesterol (y de Lp(a)) pero que la combinación de ambas puede ser una alternativa para pacientes refractarios [47].
Inhibidores de la proteína de transferencia de ésteres de colesterol (iCEPT)
Los iCEPT tienen como objetivo inhibir el paso de ésteres de colesterol y triglicéridos de HDL a LDL y VLDL con el consiguiente aumento de los primeros y descenso de lipoproteínas ricas en ApoB y por tanto aterogénicas [48]. El ensayo clínico REVEAL aleatorizó a pacientes con antecedentes de evento cardiovascular en tratamiento con estatinas a recibir anacetrapib (un potente iCEPT) o placebo. Tras cuatro años de seguimiento, anacetrapib demostró disminuir LDL-colesterol, aumentar HDL-colesterol, pero, sobre todo, redujo el riesgo de eventos cardiovasculares (HR 0.91; 95% IC, 0.85-0.97; P=0.004). Como único efecto adverso, se produjo con más frecuencia un aumento de creatín quinasa en el grupo anacetrapib [49]. Hasta la fecha anacetrapib es el único iCEPT que ha demostrado su eficacia a diferencia de otros agentes del grupo como torcetrapib, evacetrapib, dalcetrapib [50]. De hecho, la extensión del estudio REVEAL ha mostrado un modesto beneficio cardiovascular (concretamente en eventos coronarios) mayor en los pacientes con más tiempo de seguimiento [51]. A pesar del éxito relativo de los resultados, parece que los iCEPT han sido, por el momento, abandonados como tratamiento de la dislipemia.
Olionucleósidos antisentido
El mecanismo de acción de estos fármacos se efectúa a través de la unión al ARN mensajero de una apolipoproteína impidiendo su síntesis hepática. Actualmente, los agentes comercializados de este grupo terapéutico son mipomersen, volanersen y AKCEA-Apo [52]. Mipormersen es el que mayor interés suscitó ya que su inhibición en la producción de Apo-B100 implicaba una importante reducción de LDL-colesterol y Lp(a). En un reciente metaanálisis incluyendo 13 ensayos clínicos con mipomersen, la mejoría del perfil lipídico se acompañó de efectos adversos relevantes como la incidencia de esteatosis hepática, síndrome febril, reacciones a la infusión o elevación de transaminasas, motivo por el que se ha abandonado su comercialización en EEUU y Europa [53].
Volanesorsen es un oligonucleósido antisentido con capacidad para inhibir la producción de ApoCIII, que se administra de forma subcutánea y que ha demostrado una reducción de triglicéridos y de Lp(a) en los ensayos clínicos publicados teniendo como efecto adverso más destacable la trombopenia y reacciones locales tras la infusión [54] [55].
En cualquier caso, volanesorsen tiene actualmente indicación en el síndrome de quilomicronemia familiar [56]
Como se comentaba previamente, pelacarsen (AKCEA-Apo(a) o TQJ230) es una prometedora diana terapéutica que basa su mecanismo de acción en la inhibición de la síntesis de apolipoproteína(a). Hasta la fecha, pelacarsen se ha demostrado efectiva en la reducción de las cifras de Lp(a) de hasta un 80%, aunque está pendiente de demostrar su efecto sobre los eventos cardiovasculares mayores [57] [58]. Los ARN pequeños de interferencia (del inglés, small interfering RNA [siRNA]) han abierto nuevas oportunidades para la reducción de Lp(a). SLN360 o Olpasiran sólo disponen hasta la fecha de ensayos clínicos en fase 1 en los que se ha demostrado su capacidad para reducir Lp(a) hasta un 98% [59].
Ácido bempedoico
El ácido bempedoico es una molécula que se absorbe en el intestino, actuando a nivel hepático sobre la 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA) reductasa. El estudio CLEAR Harmony Trial incluyó a más de 2200 pacientes con hipercolesterolemia familiar y/o enfermedad cardiovascular ateroesclerótica, con LDL>70 mg/dl a pesar de recibir tratamiento con estatinas a dosis plenas toleradas [60].Tras 52 semanas de seguimiento, pero también en la extensión posterior del estudio, se demostró una modesta mejoría en las cifras de LDL con un aceptable perfil de seguridad [61]. Además, al presentar un mecanismo de acción diferenciado de las estatinas (en este caso a través de la ATP-citrato sintasa), entre sus efectos adversos no hay un aumento en la incidencia de mialgias, pero sí la hiperuricemia. Por todo ello, el ácido bempedoico ha sido aprobado como tratamiento de la dislipemia en pacientes que no alcancen el objetivo y en combinación con estatinas y/o ezetimibe. Está en marcha el estudio CLEAR outcomes en el que se discernirá el efecto de ácido bempedoico en la reducción de eventos cardiovasculares [62].
6. LA INFLAMACIÓN Y OTROS AGENTES
Existe una clara relación entre la inflamación y la dislipemia en la patogénesis de la aterosclerosis. El aumento de LDL produce disfunción y activación endotelial, que se asocia con elevación de citoquinas proinflamatorias, sobreexpresión de moléculas de adhesión y proteína C reactiva. Todo ello favorece la infiltración por células inflamatorias de la pared arterial. Recientemente, se han desarrollado fármacos para disminuir esta inflamación y como consecuencia el riesgo cardiovascular [63]. También están en desarrollo nuevos anticuerpos monoclonales que interfieren en el metabolismo de los lípidos.
• Canakinumab: es un anticuerpo monoclonal dirigido contra IL1ß y por tanto contra el inflamasoma. La interrelación entre inflamación y arterioesclerosis es cada vez más evidente y esto ha condicionado la investigación de agentes antiinflamatorios como protectores de eventos cardiovasculares [64]. El estudio CANTOS aleatorizó a más de 10 000 pacientes con antecedente de un infarto agudo de miocardio y con datos de inflamación basal (proteína C-reactiva por encima de 2 mg/L) a recibir canakinumab o placebo. Tras 48 meses de seguimiento, la terapia antiinflamatoria demostró reducir la tasa de eventos cardiovasculares independientemente de las cifras del perfil lipídico [65].
• Inclisirán: la disminución en la producción hepática de PCSK9 a través de la unión al ARN mensajero en el momento de su síntesis permite la reducción de LDL en porcentaje similar a los iPCSK9, pero con la ventaja de una administración trimestral o semestral [66]. Hasta la fecha, inclisirán ha demostrado importantes reducciones de LDL en pacientes que recibían estatinas a dosis plenas toleradas y con alto riesgo cardiovascular [67] [68].
A la espera de los resultados del ORION-4, en el que se evalúa el efecto de inclisirán en la reducción de eventos cardiovasculares, las agencias reguladoras (FDA y la EMA) ya han aprobado su uso como agente hipolipemiante (clinicaltrials.gov NCT03705234). Además, un análisis preliminar de los estudios ORION-9, -10 y -11 recientemente publicado, ya ha sugerido un efecto beneficioso sobre eventos cardiovasculares [69].
• Evinacumab: es un anticuerpo monoclonal dirigido contra angiopoietin-like protein 3 (ANGPTL3) cuya función es inhibir la lipoproteín lipasa y, por tanto, interferir en el metabolismo de los triglicéridos [70]. Los estudios en fase I han demostrado su efecto en la reducción de triglicéridos principalmente, aunque este efecto se acompaña de una modesta disminución de LDL [71]. Los estudios fase II llevados a cabo en población con hipercolesterolemia familiar, han evidenciado similares resultados, pero con reducciones de hasta el 50% en los niveles de LDL, con un perfil de seguridad más que aceptable [72]. Una segunda generación de fármacos con diana en ANGPTL3 cuya inhibición se realizaba a través de oligonucleótidos antisentido (Vupanorsen) ha sido suspendido por efectos adversos (33883446). En cualquier caso, los inhibidores ANGPTL3 parecen una buena estrategia en la reducción del riesgo residual, siempre que sean capaces de demostrar su seguridad.
7. HIPERTRIGLICERIDEMIA
La hipertrigliceridemia constituye una situación de importante controversia. Como referíamos previamente, las cifras elevadas de triglicéridos se asocian a mayores tasas de eventos cardiovasculares. Sin embargo, su reducción con las terapias habituales (fibratos) no han demostrado un claro efecto protector [73]. Las terapias enfocadas a disminuir los triglicéridos y, consecuentemente el riesgo cardiovascular, han presentado resultados dispares y se han focalizado principalmente en diabéticos.
-Fenofibrato: fármaco con excreción renal cuya asociación con estatinas puede aumentar las reacciones adversas. Ha demostrado su efectividad en la reducción de eventos cardiovasculares en pacientes diabéticos con HDL bajo e hipertrigliceridemia [74] pero no en otras poblaciones (ni en prevención primaria ni secundaria) [75]. Está en marcha el estudio STAFENO en el que se evalúa la efectividad cardiovascular, en términos de reducción de placa coronaria, de la combinación de estatinas y fenofibratos [77].
-Pemafibrato: fármaco modulador selectivo PPARα (SPPARM-α) con excreción hepática y una interacción con estatinas más atenuada con efectividad en la reducción de triglicéridos y elevación de HDL. A pesar del efecto beneficioso sobre el perfil lipídico, el recientemente publicado estudio PROMINENT ha demostrado la no superioridad de pemafibrato frente a placebo en la reducción de eventos cardiovasculares con un aumento en las reacciones adversas (renales y tromboembólicas), lo que supone un claro revés para esta molécula [78].
-Icosapento de etilo (EPA): fármaco basado en ácidos grasos de cadena larga. EPA ha demostrado su efectividad en el estudio REDUCE-IT al ser capaz de reducir la incidencia de eventos cardiovasculares en pacientes de alto riesgo (diabéticos o con antecedente de evento), en tratamiento con estatinas y con LDL entre 41-100 mg/dl y triglicéridos entre 135 y 499 mg/dl [79]. El subanálisis REDUCE-IT RENAL demostró la efectividad de EPA con independencia del FGe (que incluyó a pacientes hasta 15 ml/min/1,73 m2), abriendo una nueva vía de tratamiento en los pacientes con enfermedad renal crónica [80]. Todos estos resultados positivos han permitido su aprobación por parte de la EMA y la de FDA.