Alteraciones del Metabolismo Mineral: Calcio, Fósforo, PTH, Vitamina D, FGF-23, Klotho
INTRODUCCIÓN
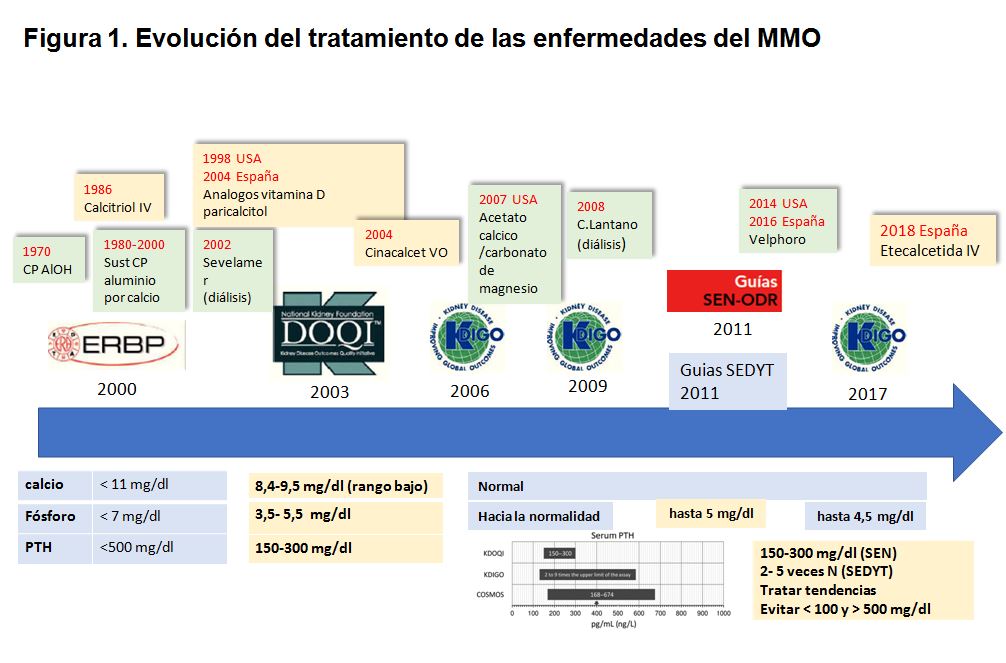
Las alteraciones del metabolismo mineral y óseo (MMO), en constante renovación y de gran complejidad, ha sido y es uno de los grandes retos de la nefrología. Prueba de ello han sido las diferentes estrategias terapéuticas, guías clínicas y objetivos que se han ido planteando a lo largo de los años (Figura 1).
Hay dos aspectos importantes que hay que conocer, pues tienen una gran importancia en su diagnóstico y tratamiento:
1) Probablemente, uno de los cambios mas importantes en este terreno es el reconocimiento, relativamente reciente, de que las alteraciones del metabolismo óseo-mi¬neral relacionadas con la enfermedad renal crónica (ERC) van más allá del hueso, y se consideran un trastorno sistémico, que incluyen el sistema cardiovascular, las cuales tienen un gran impacto sobre la morbimortali¬dad de los pacientes con ERC [1] [2].
2) Y otro aspecto importante es conocer que estos trastornos se inician en los primeros estadios de la ERC, mucho antes de que se produzca una reducción grave del filtrado glomerular o de que se establezca la necesidad de terapia renal sustitutiva.
Esta es la razón de que en 2009 las guías KDIGO (Kidney Disease: Improving Global Outcomes) proponga una nueva definición: Alteraciones del Metabolismo Óseo y Mineral asociadas a la Enfermedad Renal Crónica (CKD-MBD: chronic kidney disease-mineral and bone disorder en nomenclatura anglosajona) [3]. Actualmente se considera que estas alteraciones se ma¬nifiestan de una o varias maneras:
1) Anormalidades del calcio, el fósforo, la hormona paratiroidea (PTH) y la vitamina D (VD) y “Fibroblast Growth Factor” (FGF).
2) Alteraciones en el remodelado, la mineralización, el volumen, el crecimiento o la fragili¬dad del esqueleto. El clásico término Osteodistrofia Renal (ODR) queda restringido a este epígrafe.
3) Calcificaciones cardiovasculares o de otros tejidos blandos.
FISIOPATOLOGÍA DE LAS ALTERACIONES DEL METABOLISMO MINERAL Y ÓSEO.
En los últimos años el concepto clásico del metabolismo mineral y óseo ha cambiado con la descripción del sistema biológico FGF-23/klotho. Estas nuevas moléculas nos ayudan a entender aspectos que hasta ahora no quedaban del todo explicados por los factores clásicos [4] [5] [6] [7] [8] y permiten compren¬der la estrecha relación entre los trastornos del metabo¬lismo mineral y la morbimortalidad cardiovascular en el contexto de la ERC. Aún siguen apareciendo nuevos descubrimientos en investigación básica que arrojan luz acerca de la fisiopatología de estas enfermedades y que se desarrolla en otro capítulo.
Sistema biológico FGF-23/Klotho
Los factores de crecimiento fibroblásticos son una subfamilia de péptidos que ejercen efectos pleiotrópicos sobre una amplia gama de proceso biológicos. Uno de estos péptidos es el FGF-23 o fosfatonina [5] [9] [10], y su receptor es el fibroblast growth factor receptor 1 (FGFR1) [5] [11] [12] [13] [14].
Klotho, es una proteína transmembrana, que es necesaria para que la unión entre FGF-23 y su receptor se active.
La coexpresión del complejo Klotho-FGF receptor define la especificidad tisular de los efectos de FGF-23 [15]. Estudios en vivo han demostrado que solo la molécula completa de FGF-23 posee actividad biológica, siendo el fragmento C-terminal un elemento que puede competir con la molécula intacta por la unión al complejo FGF-klotho [16].
El FGF-23 es producido por los osteocitos y los osteoblastos, y repre¬senta las conexiones directas entre el hueso, el riñón y las glándulas paratiroides en las alteraciones del metabolismo óseo-mineral en la ERC. Se considera la principal hormona fosfatúrica (reduce la reabsorción tubular de fosforo y aumento de su eliminación renal) y contrarreguladora de la vitamina D (reduce los valores de calcitriol al disminuir su producción y aumentar su catabolismo) [17]. Como hemos dicho antes, para que FGF-23 actúe necesita el cofactor Klotho. Aunque klotho se expresa en diversos tejidos, el órgano donde se ha identificado la expresión mas importante es el riñón [18]. La ERC es, por tanto, un estado de deficiencia de klotho [19].
¿Qué sucede en la ERC?
En estadios muy tempranos de la ERC (1 y 2) las concentraciones plasmáticas y urinarias de Klotho descienden. Para compensar esta resistencia a su efecto se produce un aumento de FGF-23 que, a su vez, disminuye la vitamina D activa, también ayudada por la perdida de masa renal funcionante (en el riñón se produce la activación de la vitamina D, pasa de 25OH D3 a 1,25OH2D3 o calcitriol).
La deficiencia de vitamina D activa (calcitriol) causa hipocalcemia por descenso de la absorción intestinal de calcio (Ca), formación de complejos Ca-P y resistencia esquelética a la PTH, lo que contribuye a aumentar la PTH, y también a la perdida de nefronas funcionantes, con lo cual reduce también la expresión de klotho.
Así, en estadios precoces de la ERC se produce:
- una reducción del calcitriol
- una elevación de la PTH
- se mantienen unas concentraciones normales de calcio y fósforo (por el efecto fosfatúrico de FGF-23 y la PTH que están contribuyendo a eliminar el fósforo)
Con el deterioro de la función renal la capacidad de excreción renal de fosforo disminuirá hasta un momento en el que aparezca hiperfosforemia. La retención de fósforo produce mas hipocalcemia.
El descenso de vitamina D y la retención de P aumentan directamente la síntesis y secreción de PTH, e inducen hiperplasia paratiroidea. Las dianas sobre las que actúa el Ca y la vitamina D son el receptor-sensor de Ca [20] [21] y el receptor citosólico de la vitamina D, respectivamente. El P induce proliferación de células paratiroides y disminuyen la expresión de los receptores de Ca y vitamina D.
En etapas más avanzadas, cuando los mecanismos de compensación se ven sobrepasados, se produce todo el espectro de anormalidades englobadas en los trastornos del metabolismo óseo-mineral asociados a la ERC [22] y estímulos que potenciaran el descenso de klotho, el aumento de FGF-23, la reducción de calcitriol y el estimulo de la PTH produciendo el espectro de alteraciones óseas y cardiovasculares [23] [24] [25] .
La deficiencia de calcitriol, además de participar en la re¬ducción de la expresión de klotho, resulta en una estimu¬lación sobre las glándulas paratiroides, con un estímulo adicional derivado de la reducción en la expresión de klo¬tho y del receptor de FGFG23 en las células paratiroideas.
La consecuencia final de estas alteraciones es el aumento de la secreción y síntesis de PTH, así como una hiperplasia difusa paratiroidea. Cuando el estímulo de la hiperplasia es prolongado aparecen células paratiroideas monoclonales dando lugar a una hiperplasia nodular. En estas zonas nodulares se ha demostrado una disminución marcada de los receptores de calcio y vitamina D. Cuando se alcanza esta situación, la producción de PTH se hace autónoma apareciendo con frecuencia hipercalcemia e hiperfosforemia (hiperparatiroidismo terciario) [4].
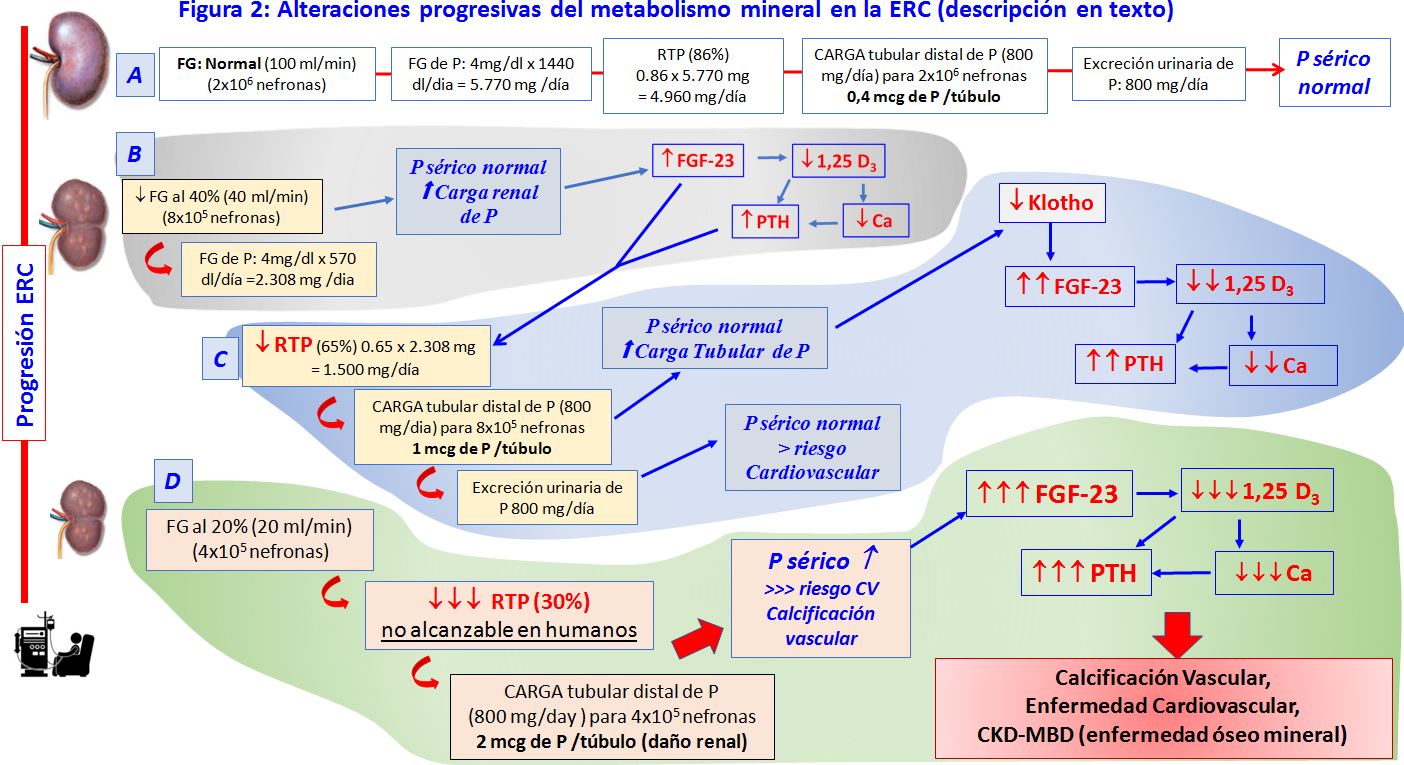
Como corolario de la secuencia de eventos que conducen al daño óseo-vascular en el enfermo renal, la (Figura 2) (diseñada y cedida por el Profesor Mariano Rodríguez, Hospital Universitario Reina Sofía. Córdoba) muestra los cambios que acontecen en el riñón para mantener la concentración de P sérico en situación de ERC y las alteraciones metabólicas que lo determinan (FGF-23, Klotho, PTH, vitamina D).
A: En condiciones normales de todo el P filtrado (5.770 mg al día), se reabsorbe aproximadamente el 86% y se excreta una cantidad de P que coincide con el fosforo absorbido en el intestino. De esta forma se mantiene el balance de P. En estas circunstancias, teóricamente, por cada uno de los túbulos distales circula aproximadamente 0,4 mcg de P al día.
B: Cuando la función renal desciende a una 40 % (ERC-3) los niveles séricos de P suelen ser normales, debido a que la reducción del P filtrado, se compensa con una disminución de la reabsorción tubular que ocurre gracias a la acción de FGF-23 y PTH.
C: Este mecanismo compensador se deteriora progresivamente, porque el aumento de la carga tubular de P produce deterioro renal y reduce la expresión tubular de Klotho, co-receptor del FGFR y necesario para actúe el FGF23. Por lo tanto, se produce una resistencia a la acción del FGF-23 y se necesitan más FGF-23 para que se mantenga la fosfaturia. Además, el exceso de FGF-23, disminuye más aún el calcitriol y, consecuentemente el hiperparatiroidismo progresa. Este incremento de FGF-23 y PTH, junto a la disminución de calcitriol, se relaciona con desarrollo de enfermedad cardiovascular, mayor riesgo de calcificación vascular y alteración del metabolismo mineral.
D: Cuando la ERC avanza y hay una reducción marcada del número de nefronas funcionantes, la capacidad de disminuir la reabsorción de P ya no es suficiente para mantener la fosfaturia y por lo tanto aumenta el P sérico y sus complicaciones asociadas, como la calcificación vascular. En este estado, la carga tubular de P se acerca a 2 mcg de P por túbulo, produciendo daño progresivo renal, y se asocian a empeoramiento marcado de las alteraciones del metabolismo mineral, deterioro óseo, enfermedad cardiovascular (CKD-MBD) y aumento de la mortalidad.
Clasificación histológica clásica
Para una descripción detallada de las alteraciones del remodelado óseo (Véase Atlas de Osteodistrofia Renal) [26].
Clásicamente, la ODR se ha clasificado en 2 tipos: Alto Remodelado (AR) y Bajo Remodelado (BR) [27] [28] [29] [30] [31] [32] [33]. Se trata de lesiones cualitativas del remodelado, pudiendo cursar con cambios cuantitativos de la más ósea: normal, aumentada (osteosclerosis) o disminuida (osteopenia u osteoporosis).
Alto Remodelado
El patrón histológico de las formas de AR es la Osteítis Fibrosa. A las formas incipientes se las ha denominado formas Leves. Su única causa en la ERC es el hiperparatiroidismo secundario.
Se caracteriza por aumento de actividad celular osteoclástica y osteoblástica. Incremento de áreas resortivas (Lagunas de Howship), aparición de fibrosis peritrabecular y acelerado depósito de osteoide, frecuentemente no laminar. El grosor del osteoide no está aumentado dado que la tasa de mineralización no suele afectarse.
Como resultado del aumento del remodelado, aumenta la captación de tetraciclinas, con incremento en la distancia entre bandas.
Bajo Remodelado
Las formas de BR se han dividido en dos tipos: Osteomalacia y Hueso adinámico u enfermedad ósea adinámica, en función del defecto de mineralización [34] [35].
Osteomalacia (déficit de mineralización): se caracteriza por baja actividad celular peritrabecular, gran acumulación de osteoide en grosor y extensión, con ausencia de osteoblastos adyacentes. Escasa captación de tetraciclinas, con bandas que emergen muy juntas; o ausencia de captación. Las formas más graves fueron causadas por intoxicación alumínica. Hoy en día su aparición es rara, asociándose a déficit de vitamina D y bajos niveles de calcio y/o fósforo.
Enfermedad ósea adinámica (mineralización normal): baja actividad celular peritrabecular similar a la osteomalacia, pero sin acumulación de osteoide ya que no hay un manifiesto defecto de mineralización. Escasa o nula captación de tetraciclinas. Este patrón histológico se describió más tardíamente, especialmente en pacientes añosos y diabéticos, y con mayor frecuencia en aquellos que reciben diálisis peritoneal. Cursa con niveles bajos de PTH.
Formas Mixtas
Suelen ser lesiones avanzadas donde coexisten signos de AR y BR.
Osteosclerosis u osteoporosis/osteopenia
Se definen como cambios cuantitativos de la masa ósea, en función de que exista ganancia o pérdida respectivamente. No se consideran lesiones específicas de ODR, sino que pueden acompañar en grado variable a las lesiones de AR y de BR.
Clasificación TMV: Turnover, Mineralización, Volumen
Esta nueva clasificación publicada por las Guías KDIGO [3] [28] tiene como principal objetivo alcanzar una armonía de criterios diagnósticos. De esta forma, el informe de las biopsias óseas deben evaluar tres parámetros histológicos: 1. Remodelado o “turnover”, 2. Mineralización y 3. Volumen óseo.
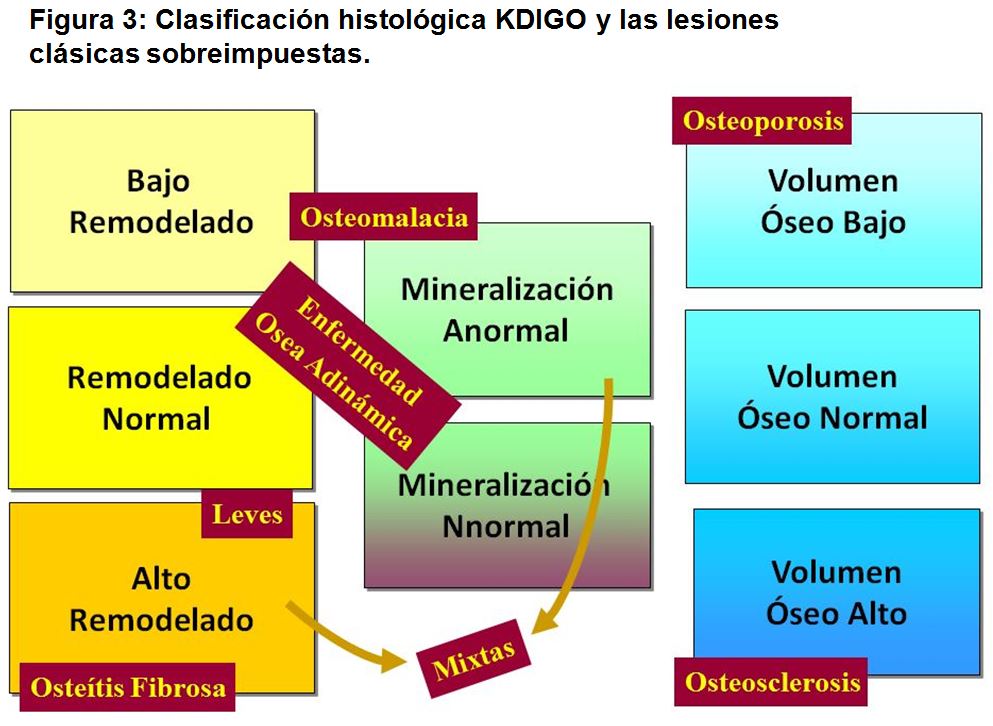
Las lesiones clásicas de ODR descritas previamente se redefinen utilizando estos 3 criterios. En la (Figura 3) mostramos la nueva propuesta de clasificación KDIGO y las lesiones clásicas sobreimpuestas.
1.- Turnover o remodelado óseo
Representa la tasa de recambio óseo en el proceso acoplado de resorción-formación, tal como hemos descrito previamente. Como hemos señalado, la ODR puede presentar todo el abanico de posibilidades, desde el AR al BR. Las lesiones de AR se corresponden con la Osteítis Fibrosa, y lo que podemos llamar su “antesala”, las formas Leves. Las lesiones de BR están representadas por la Osteomalacia o el Hueso Adinámico, en función de la tasa de mineralización.
2.- Mineralización
Este parámetro identifica la tasa de mineralización de la matriz osteoide, pudiendo ser normal, retrasada o ausente. La tasa de mineralización establece la diferencia entre las formas de BR. Mientras que la mineralización está retrasada o ausente en la Osteomalacia, es normal en el Hueso Adinámico. Las formas Mixtas también cursan con retraso en la mineralización
3.- Volumen óseo
Este parámetro cuantifica los cambios de masa ósea, y representa el balance entre formación y resorción. No implica que existan cambios estructurales del esqueleto. Los valores elevados se definen como Osteosclerosis y los valores bajos como Osteopenia u Osteoporosis. Realmente este no es un parámetro propio de la ODR, aunque contribuye a la fragilidad ósea y al riesgo de fractura. Los cambios de masa o volumen óseo pueden acompañar tanto a las formas de AR como de BR. Masa o volumen óseo bajo es característico del hueso adinámico.
En las variaciones de volumen óseo es importante establecer diferencias entre hueso cortical y trabecular, ya que los cambios metabólicos pueden afectar de distinta forma a ambos compartimientos. Es una característica del hiperparatiroidismo urémico, donde se produce un decremento del hueso cortical, mientras [36] [37] que suele mantenerse o aumentar el hueso trabecular. El balance final es variable.
Parámetros histomorfométricos: valor diagnóstico y parámetros de referencia
Esta nueva clasificación sin duda ayudará a unificar criterios diagnósticos [3] [28] [37] [38]. Sin embargo, las guías KDIGO no proporcionan valores histomorfométricos de referencia, seguramente por la dificultad de determinar parámetros dinámicos en la población normal. Previamente autores como Sherrard DJ et al [32] y Malluche H et al [30] [39] [40] habían propuesto criterios diagnósticos basados en la histomorfometría, y las guías KDOQI señalan unos parámetros histomorfométricos de referencia [36] [37].
El análisis histomorfométrico [28] [33] [36] [37] [38] [41] se basa en la medición de parámetros estáticos o estructurales y parámetros dinámicos o cinéticos. A partir de los parámetros medidos se obtienen parámetros calculados, empleándose la combinación de ambos para establecer el diagnóstico. Suelen expresarse en porcentaje o en su fracción decimal. La expresión dimensional añada complejidad al uso de las unidades, ya que debe haber coherencia en el empleo de la terminología bidimensional o tridimensional. Las unidades deben expresarse en áreas, perímetro y distancia en formato bidimensional; o su equivalente, volumen, superficie (o interfase) y grosor en formato tridimensional.
Interpretación de los cambios en biopsias óseas sucesivas
Una aportación importante de las nuevas guías KDIGO ha sido clarificar el significado de mejoramiento o empeoramiento en el tiempo, tras la realización de biopsias sucesivas. Mejoramiento significa que una progresión de los parámetros histomorfométricos de cualquier categoría a “normal” o formas “Leves”; y empeoramiento, lógicamente, lo contrario. De esta forma, el cambio en un parámetro puede resultar beneficioso o adverso en función de la lesión basal. Por ejemplo, en términos de turnover o remodelado, un incremento del BFR significa mejoría para el BR; mientras que significa empeoramiento para el AR. Igual análisis vale para el volumen óseo, incremento es mejoría en casos de osteoporosis, pero no para los casos de osteosclerosis. Cambios al otro extremo, de AR a BR o viceversa, tampoco significan mejoramiento [37].
Formas de presentación
Las formas de AR [4] [6] [7] tienen lugar como consecuencia de la pérdida progresiva de la función renal. La única causa conocida en la ERC es el hiperparatiroidismo. En general, las formas de AR son más frecuentes en jóvenes, en la raza negra y en pacientes con mayor tiempo en diálisis. Aunque varía entre series, su prevalencia está en torno al 50%.
Las formas leves cursan asintomáticas. Las formas más avanzadas de osteítis fibrosa suelen mostrar alguna de las siguientes manifestaciones: Dolores óseos, prurito, deformidades esqueléticas (tórax en tonel, genu valgo), desinserciones y rupturas tendinosas, calcifilaxis, fracturas patológicas.
Las formas de BR se describieron más tardíamente que las de AR, y no aparecen directamente como consecuencia de la progresión de la ERC [34] [35].
Inicialmente se describieron de forma esporádica asociadas a la intoxicación alumínica, siendo su expresión histológica la osteomalacia. Con el paso del tiempo, las formas de BR han pasado a ser la forma histológica más frecuente (aproximadamente 50%), presentándose en su gran mayoría como hueso adinámico. Esto es debido a que otros factores que favorecen el BR se han añadido al propio estado urémico: mayor edad, diabetes y el uso inadecuado de calcitriol y captores intestinales de P que contienen calcio en el tratamiento del AR. Se presenta como un hipoparatiroidismo relativo (valores orientativos de PTH:
En general suelen ser asintomáticas. Dado que cursan con masa ósea baja, se considera que estos huesos tienen una mayor fragilidad y en consecuencia, un mayor riesgo de fracturas.
Es notable que ambas formas de ODR, AR y BR puedan facilitar el depósito extraesqueléticos de Ca y P. En las formas de AR, el hiperparatiroidismo, favorece el balance negativo de calcio y fósforo en el hueso, especialmente hueso cortical. En las formas de BR, Ca y P no se incorporan al hueso, que no cumple sus funciones metabólicas para mantener la homeostasis mineral. Este exceso de Ca y P disponible, muy probablemente va a parar a tejidos blandos, facilitando del desarrollo de las calcificaciones cardiovasculares.
Conviene puntualizar que otros procesos relacionados con la edad como el incremento de fragilidad ósea o la enfermedad arteriosclerótica, no pueden considerarse asociados directamente a la ERC, pero coexisten con ella. Más aún, influyen sobre el diagnóstico, tratamiento y pronóstico de los efectos de la ERC sobre sus órganos diana.
Calcificaciones cardiovasculares
El patrón de calcificación en la ERC terminal se caracteriza por el depósito mineral en la túnica media, en tanto que en la población general las calcificaciones que predominan son las placas de ateroma (Véase Alteraciones cardiovasculares en diálisis) [42] [43] [44] [45] [46] [47].
El incremento del P y del Ca predispone a la aparición de calcificaciones extraesqueléticas viscerales y metastásicas que son predictoras independientes de mortalidad cardiovascular. La prevalencia de ambas entidades está aumentando, favorecida por el uso abusivo de suplementos de calcio y vitamina D. La edad es un factor de riesgo de calcificaciones arteriales de grandes vasos, valvulares cardíacas y de calcifilaxis. Este hecho está seguramente relacionado con la dificultad de los sujetos añosos para manejar un balance de Ca positivo secundario a la alta prevalencia de hueso adinámico a esta edad.
Calcificaciones de partes blandas
Las calcificaciones de partes blandas pueden ser metastásicas (afectan tejidos sanos) o distróficas (afectan tejidos previamente dañados) [48] [49]. Las localizaciones más frecuentes son: Periarticulares (denominada Calcinosis Tumoral, por su apariencia pseudotumoral); vasculares (en la media de arterias de mediano calibre, y en la íntima de las placas de ateroma de los grandes vasos), y en válvulas cardíacas; viscerales (a nivel pulmonar, cardíaco, o renal); y otras localizaciones como oculares, cutáneas y subcutáneas, condrocalcinosis.
Calcifilaxis
También conocida como arteriolopatía urémica calcificada, es un síndrome raro que generalmente causa necrosis de la piel y generalmente afecta a pacientes con enfermedad renal crónica (ERC) avanzada, en diálisis o receptores de trasplante renal; sin embargo, se han descrito casos de calcifilaxis en sujetos con función renal normal o con ERC no avanzada [50] [51].
Clínicamente se caracteriza por áreas de necrosis isquémica muy dolorosas. En algunos pacientes, el dolor precede al desarrollo de las lesiones cutáneas.
La Necrosis isquémica se caracteriza por la calcificación de la media arterial e isquemia tisular secundaria. Cursa con lívido reticularis y nódulos subcutáneos en placas violáceas, dolorosas, que representan necrosis del tejido graso. Se localiza en la dermis, grasa subcutánea, y más raramente en el músculo [52] [53].
Las áreas más afectadas son los muslos, el abdomen, las mamas y los glúteos, en general en las áreas con mayor cantidad de tejido adiposo. También pueden aparecer en zonas periféricas, como lesiones isquémicas en los dedos o en el pene, por lo que algunos autores distinguen una forma central y otra periférica, con comportamientos diferenciados [54]. Suelen progresar para tomar la apariencia de escaras que se infectan con frecuencia. Cuando se localiza en los dedos de manos o pies puede simular una gangrena por enfermedad aterosclerótica periférica.
En general, destaca la importante elevación de la proteína C reactiva en casi todos los pacientes.
Su patogenia es multifactorial y es la consecuencia de muchos factores que causan calcificaciones ectópicas en pacientes con enfermedad renal crónica, como trastornos del metabolismo del fosfato y de calcio, hiperparatiroidismo, diabetes, obesidad, sexo femenino, inflamación sistémica y el uso de antagonistas de la vitamina K, entre otros.
El tratamiento se basa principalmente en el manejo de las heridas, eliminando todos los posibles factores precipitantes de la calcificación ectópica y administrando agentes capaces de inhibir el proceso de calcificación [55].
El diagnóstico suele hacerse por la exploración clínica, pero cuando las lesiones ofrecen dudas hay que recurrir a la histología. Las técnicas radiológicas y la gammagrafía pueden facilitar el diagnóstico [56] [57]. En la biopsia aparece calcificación de las arteriolas dérmicas, hiperplasia de la íntima, fibrosis en la subíntima y oclusión trombótica, provocando isquemia y una profunda paniculitis septal. No debe haber cambios sugestivos de vasculitis. La calcificación afecta sobre todo a la capa media de las pequeñas arterias y arteriolas, aunque también se ha reportado afectación de la íntima y del intersticio del tejido adiposo subcutáneo [52].
Es una enfermedad con mal pronostico que conlleva una gran morbilidad y una elevada mortalidad [58]. Los factores asociados a peor pronóstico serían un inicio del tratamiento tardío, cuando las lesiones ya están muy avanzadas y la afectación proximal muestra isquemia y necrosis. La infección es la principal causa de muerte [59].
Calcinosis tumoral
Es una complicación infrecuente que consiste en calcificaciones masivas metastásicas de partes blandas, habitualmente periarticulares, afectando grandes articulaciones. La masa tumoral está formada por el depósito masivo de cristales de hidroxiapatita [60].
La etiología no está perfectamente establecida, se ha asociado a hiperfosforemia severa y prolongada, con producto CaxP elevado (> 70), en ocasiones como consecuencia del uso abusivo de derivados de la vitamina D.
Suelen cursar asintomáticas, aunque se ha descrito la compresión de nervios periféricos (mediano, cubital, ciático), limitación del movimiento articular e incluso síndrome febril asociado. El diagnóstico es básicamente clínico, por la presencia de masas tumorales duras, periarticulares y no dolorosas. Debe efectuarse el diagnóstico diferencial con tumores óseos, especialmente el osteosarcoma. Una intensificación en el tratamiento y en el control del P pueden conseguir su curación completa.
Rupturas tendinosas espontáneas o patológicas
Ocurren con cierta frecuencia en la población añosa en diálisis. Tienen 2 factores etiológicos principales: la amiloidosis por ß2M y el hiperparatiroidismo secundario severo. Los tendones más afectados son el de Aquiles y el del cuádriceps. El cuadro clínico habitual es la ruptura espontánea, con impotencia funcional, dolor intenso y presencia de un hematoma en la zona de ruptura. El tratamiento deberá ser siempre quirúrgico, dadas las pocas posibilidades de cicatrización espontánea [61]. El diagnóstico temprano y la reparación quirúrgica son importantes para lograr un buen resultado funcional.
ESTRATEGIAS DIAGNÓSTICAS, PERIODICIDAD y VALORES RECOMENDADOS
Parámetros Bioquímicos
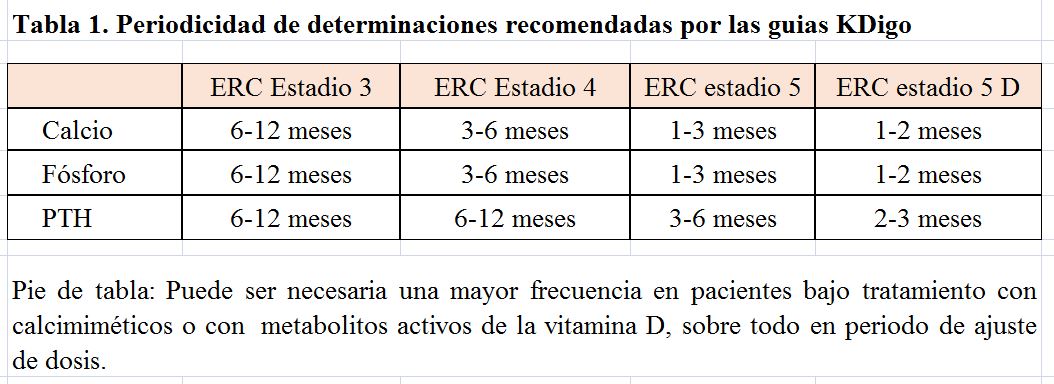
La determinación periódica de valores séricos de calcio y fosfato, junto a la PTH, es decisiva para el manejo terapéutico del paciente. Las periodicidades de las determinaciones se muestran en la (Tabla 1).
En nuestra opinión, la periodicidad mínima que recomendamos es la determinación programada de calcio y fósforo mensual, y de PTH bimestral. Esta frecuencia se justifica en base a que las decisiones en el tratamiento del complejo CKD-MBD han de basarse en las tendencias de los valores e interpretados en su conjunto, por lo que una mayor frecuencia en la determinación nos ofrecerá una visión más realista del paciente. Por otra parte, medidas frecuentes de valores como el fósforo, que dependen de la adherencia de los pacientes, ayudaran al cumplimiento terapéutico.
En pacientes bajo tratamiento, especialmente en etapa de titulación de dosis, es necesaria una mayor frecuencia de medición para analizar eficacia y efectos secundarios.
Las determinaciones deben hacerse en periodo corto de hemodiálisis, a mitad de semana.
Calcemia
La tendencia actual es intentar el rango de normalidad o de referencia del laboratorio. La precisión de la calcemia aumenta corrigiendo para la albúmina sérica: añadir 0,8 mg/dl por cada 1 mg que desciende la albumina por debajo de 4 mg/dl.
Es recomendable ajustar el calcio para los niveles de albúmina (o proteínas plasmáticas), especialmente en el caso de hipoalbuminemia o hipoproteinemia. Es importante tener en cuenta que la concentración extracelular de calcio no siempre se correlaciona con el balance de calcio (que puede ser positivo o negativo con calcio plasmático normal), al igual que ocurre con el fosforo.
La fórmula matemática del producto calcio-fósforo (Ca x P) no aporta información independiente a los valores separados de calcio y fosforo evaluados en su conjunto [62] [63].
La medición de calcio posthemodiálisis es cuestionado, y la mayoría de los expertos opina que no es necesaria su medición. En caso de determinarlo en pacientes concretos, se estudiaría el perfil habitual en cada paciente con su calcio pre y post y su ultrafiltración habitual con medicación estable, en mitad de semana dos o tres veces para precisar el perfil de ganancia de calcio individual de dicho paciente, y preferiblemente utilizando calcio iónico. La individualización del calcio de dializado de acuerdo con los niveles de calcio en suero de prediálisis puede prevenir o disminuir las excursiones no deseadas tanto de calcio en suero como de PTH [64].
Fosforemia
Las guías KDIGO (Kidney Disease Initiative Global Outcomes) sugieren mantener unas concentraciones de P normales. En los pacientes en diálisis, existe suficiente evidencia epidemiológica que demuestra la asociación de hiperfosfatemia con mortalidad [65] [66]. La mayor supervivencia en los pacientes en diálisis se observó con valores de PO43− normales, de 4,4 mg/dl (mejor intervalo: 3,6-5,2 mg/dl) [67] [68], en todos los estadios < 3mg/dL.
La fracción de excreción de fósforo (FEP) o reabsorción tubular máxima de fósforo (TmP) (FEP Normal=10-20%) pueden ser marcadores precoces de sobrecarga de fósforo y ser de interés en estadios precoces, aunque aún no se ha demostrado su utilidad clínica, por lo que no se considera obligada su medición. Los pacientes con ERC avanzada tratados con diuréticos parecen presentar concentraciones más elevadas de fosfato sérico [69].
PTH
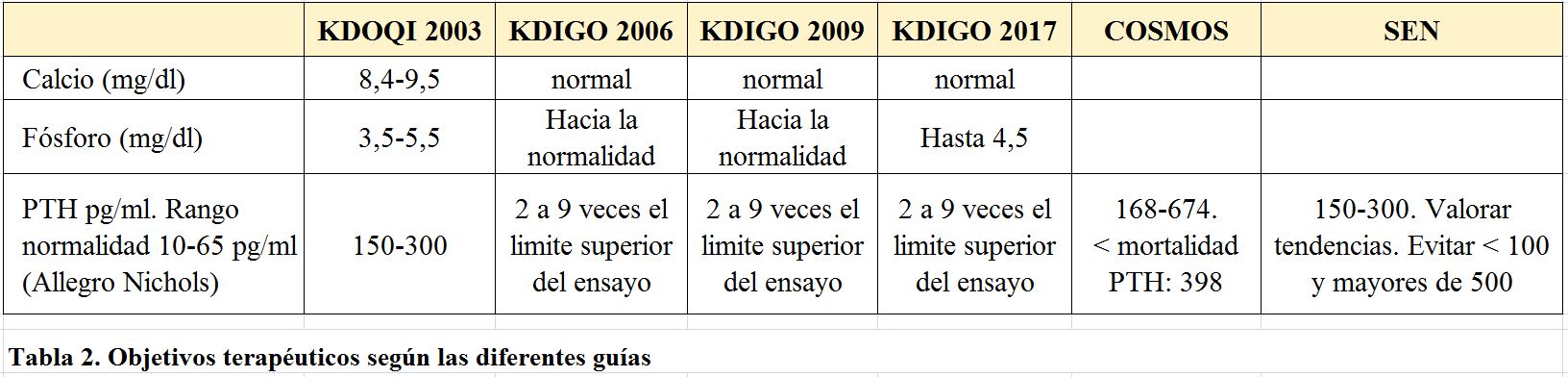
El rango de normalidad el kit clásico Allegro (Nichols) medido con doble anticuerpo es de 10-65 pg/mL. Las guías KDIGO [37] recomiendan para pacientes en diálisis un rango de 2-9 veces por encima del establecido como normal. Las guías SEN de 2011 recomendaban mantener 150-300 pg/mL como valores óptimos, valorar tendencias y evitar valores menores de 100 y mayores de 500 pg/mL.
En pacientes en diálisis, niveles de PTHi > 350-500 pg/mL (o equivalente) suelen ser específicos de enfermedad ósea de alto remodelado (osteítis fibrosa o forma mixta); y excluyen prácticamente la enfermedad de bajo remodelado. De hecho, el mejor punto de discriminación para enfermedad ósea de alto remodelado fue un nivel de PTHi > 323 pg/mL (aproximadamente 5X el límite alto de la normalidad). Niveles de PTHi < 100-120 pg/mL (o equivalente) se asocian a enfermedad ósea de bajo remodelado (forma adinámica o la más rara osteomalacia) con un valor predictivo cercano al 90%. El mejor punto de discriminación para enfermedad ósea de bajo remodelado fue < 104 pg/mL (algo menos de 2X el límite alto de la normalidad).
En la (Tabla 2) se muestran las variaciones en los objetivos terapéuticos según las diferentes guías y estudios observacionales que relacionan determinados valores con mortalidad.
Aunque puedan existir variaciones y controversias en los objetivos de los parámetros bioquímicos según las diferentes guías [3] [37] [70] [71] [72] [73] [74], lo que si parece razonable es:
a) No hay que tratar parámetros bioquímicos aislados, sino tendencias de los mismos y valorar como se comporta cada valor en determinaciones sucesivas antes de tomar decisiones terapéuticas. Parece evidente la necesidad de iniciar el tratamiento cuando los valores de laboratorio de PTH muestran una “tendencia” creciente a lo largo del tiempo, incluso dentro de los rangos recomendados y, por supuesto, antes de llegar a 9 veces lo normal.
b) Se deben evitar los valores extremos de PTH. Valores inferiores a 2X y superiores a 9X sobre el límite alto de la normalidad puesto que son considerados “extremos de riesgo”
c) El tratamiento antiparatiroideo no es una urgencia médica, y debemos proponer alcanzar resultados a medio plazo no de forma inmediata, por eso, no debemos reaccionar agresivamente con modificación de diferentes parámetros que pueden ser más perjudiciales en sí mismos para el paciente, y nunca a costa de no mantener un adecuado control de la calcemia y de la fosfatemia.
d) Sistematizar el momento de la toma de la muestra: antes de la sesión de diálisis de mitad de semana.
e) Conocer el método de medición usado y cualquier cambio en la metodología, muestra de origen (suero o plasma), así como la manipulación adecuada de las muestras para facilitar una adecuada interpretación de los resultados bioquímicos (especialmente PTH, calcidiol, albúmina) [75] [76].
Fosfatasa alcalina total y ósea
Es útil, junto a la PTH, como predictora del recambio óseo en pacientes sin enfermedad hepática. La fosfatasa alcalina ósea aunque tenga ventajas, no se justifica actualmente el coste adicional. Se considera un marcador de riesgo de mortalidad de carácter lineal (no en forma de U, J o J invertida como la PTH) [77]. Las KDIGO aconsejan su determinación cada 12 meses o más frecuentemente si la PTH es elevada.
Los niveles de PTH (en relación a los de calcio y fosfato) combinado con la fosfatasa alcalina se consideran el mejor marcador disponible de la enfermedad ósea subyacente. La PTH refleja directamente la actividad paratiroidea puntual y la fosfatasa alcalina la actividad ósea [78]. En la actualidad, puede ser de especial interés su medición en pacientes en los que nos planteamos iniciar un tratamiento para la osteoporosis. Aquellos pacientes con niveles de PTH y fosfatasa alcalina relativamente bajos pueden hacer sospechar la existencia de una enfermedad ósea adinámica, y en estos casos, los agentes antirresortivos estarían contraindicados. Es probable que en un futuro próximo con el tratamiento del riesgo de fractura debamos empezar a pedir fosfatasa alcalina ósea.
Calcidiol
La determinación de niveles de Calcidiol (25OHD3) es recomendable ya que informa sobre las reservas de vitamina D nativa. El objetivo es prevenir y tratar la frecuente insuficiencia o deficiencia de esta prohormona. Deben monitorizarse los niveles de vitamina D cada 6 meses en los pacientes suplementados para evitar toxicidad y ajustar las dosis.
Los niveles séricos adecuados se apoyan en las recomendaciones generales [79]. El déficit o insuficiencia de vitamina D es muy frecuente en la población general y, más aún, en los pacientes en diálisis debido a múltiples causas [80] [81]. En general, se acepta como “insuficiencia” de vitamina D valores séricos de calcidiol entre 15 y 30 ng/mL y como “deficiencia” valores séricos inferiores a 15 ng/mL y se deben evitar valores superiores a 60 ng/ml. Se recomiendan la suplementación de todos los pacientes con ERC para obtener unos valores al menos >20 ng/mL (idealmente >30 ng/mL), especialmente debido a su asociación epidemiológica con una disminución de la mortalidad [73] [74] [82] [83]. No parece razonable mantener a los pacientes con cifras extremadamente bajas de vitamina D sin tomar una actitud de suplementación del déficit.
La determinación de calcitriol (1,25OH2D3) solo procede en el ámbito de la investigación, no estando indicada en la práctica clínica habitual.
Otros marcadores del remodelado óseo no mejoran la información proporcionada por la PTH.
Aluminio
Aunque el contenido de aluminio en el líquido de diálisis está bajo un mejor control, con la utilización de dobles sistemas de ósmosis y la obtención de agua ultrapura en la mayoría de las unidades, y ya no se usan captores de fosfato que contienen aluminio, la acumulación de aluminio puede ser debida a un accidente [84]. El aluminio se añade al agua como floculante de la materia orgánica en cantidades que varían según la época del año, por lo que sus niveles pueden llegar a ser muy elevados. En estas situaciones la única forma de conseguir niveles óptimos en el liquido de diálisis es trabajar en serie con 2 ósmosis inversas. Aunque algunos grupos no recomiendan su determinación rutinaria, en las nuevas guías de centros se recomienda, como medida de seguridad y vigilancia, la determinación de aluminio en agua cada 6 meses y aluminio sérico anualmente [85]. Se debe determinar también de manera extraordinaria en aquellas situaciones en que se sospeche toxicidad alumínica en la unidad (anemia microcítica, demencia u osteomalacia) (Pérez-García R et al. Comisión de Expertos de la SEN para la creación de la Segunda Edición de la Guía de Gestión de Calidad del Líquido de Diálisis. Guideline for dialysate quality of Spanish Society of Nephrology (second edition, 2015). Nefrología. 2016 May-Jun;36(3):e1-e52)
En todos los estadios < 20 µg/L, óptimo < 5 µg/L. El aluminio sérico debería medirse dos veces al año en todos los pacientes. Valores basales de aluminio sérico 20 µg/L son de difícil interpretación. Los valores repetidos > 60 µg/L indican una sobrecarga alumínica (esto no siempre implica enfermedad ósea por aluminio).
En pacientes con depleción de hierro, el riesgo de incorporación tisular de aluminio es mayor.
Pruebas de Imagen
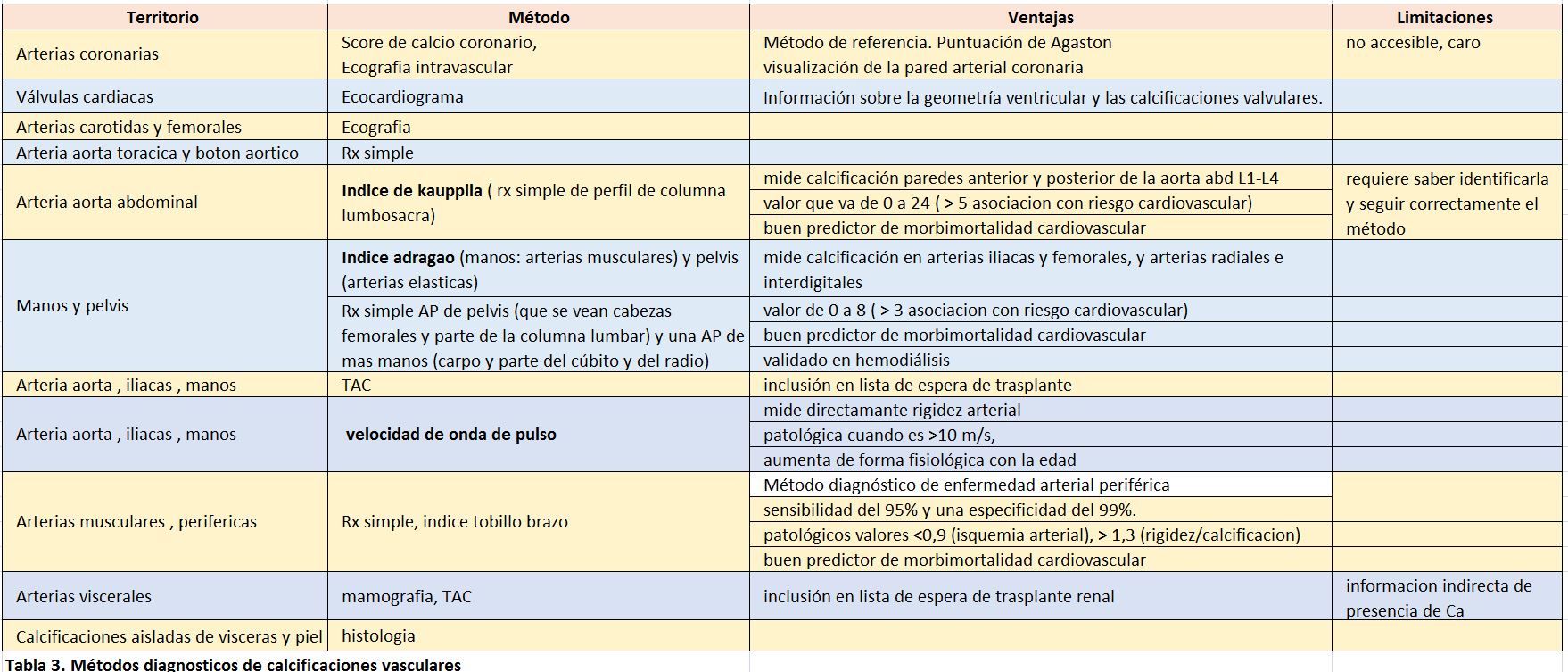
Las técnicas de imagen para el estudio del hueso o del árbol cardiovascular, son importantes para evaluar calcificaciones vasculares. La evaluación de las calcificaciones vasculares y de la geometría y función cardíaca no tiene protocolos establecidos. Los métodos para detectar calcificaciones en diferentes territorios se muestra en la (Tabla 3).
Una propuesta sencilla y posibilista para el seguimiento de las calcificaciones arteriales es utilizar el índice de Kauppila li et al [86] y/ o el de Adragao T [87] [88] con una radiografía simple de columna lateral, manos y pelvis. El ecocardiograma da información sobre la geometría ventricular y las calcificaciones valvulares. La periodicidad de estos estudios es una decisión clínica e individual. Otros estudios de morfología y función cardiovascular quedan restringidos al ámbito experimental o de indicación clínica individualizada.
El empleo de la Densitometria Ósea (DEXA), está indicada para el estudio de las alteraciones cuantitativas de la masa ósea y riesgo de fractura
(Véase Osteoporosis Diagnóstico)
(Véase Alteraciones Metabolismo Óseo Mineral trás el Trasplante Renal).
Biopsia Ósea
La indicación de biopsia ósea no tiene periodicidad. Sus indicaciones, a pesar del ser el patrón oro en el diagnóstico de la enfermedad ósea del enfermo renal, quedan restringidas a casos individuales, en el contexto de casos clínicos donde su valor diagnóstico sea relevante para la toma de decisiones terapéuticas o pronósticas (Tabla 4) [1] [3] [89].
Ocasionalmente, ante estudios diagnósticos no invasivos indeterminados, la biopsia ósea ha podido desenmascarar alguna enfermedad ósea de origen metabólico coexistente (enfermedades del modelado óseo congénitas, osteomalacia de otra causa, hiperoxaluria primaria, entre otras). Actualmente estas indicaciones son excepcionales, dados los avances en los estudios genéticos no invasivos.
PREVENCIÓN Y TRATAMIENTO DE LAS ALTERACIONES DEL METABOLISMO MINERAL
El tratamiento de las enfermedades relacionadas con el MMO ha sufrido modificaciones en los últimos años con la aparición de nuevas herramientas terapéuticas: nuevos captores de fosforo, activadores del receptor de vitamina D (VD) (ARVD) y el desarrollo innovador de moduladores del receptor sensible al calcio (CaSR), calcimiméticos. Además, el reconocimiento del factor de crecimiento de fibroblastos 23 (FGF-23)/eje klotho y el aumento de la conciencia de la importancia de la calcificación cardiovascular y la necesidad de prevenirla han cambiado algunos de los esquemas terapéuticos que existían previamente.
El primer objetivo es mantener o llevar los valores de Ca y P a rango normal y a continuación normalizar los valores de PTH. Para ello se recomienda seguir los siguientes pasos:
1. Dieta
2. Si el paciente está en diálisis, optimizar la dosis de diálisis.
3. Establecer la concentración idónea de Ca en el líquido de diálisis.
4. Garantizar niveles de Calcidiol (25(HO)D3).
5. Control Calcio-Fósforo con captores del fósforo.
6. Manejo de la PTH con ARVD y/o calcimiméticos en función de Ca, P y respuesta de la PTH.
7. Otras consideraciones: paratiroidectomía, tratamiento de la calcifilaxis, calcinosis tumoral, fragilidad ósea (osteoporosis), fracturas.
1. DIETA
(Véase manejo nutricional del paciente renal)
En este apartado hacemos especial hincapié en la prevención de la excesiva carga de P, sin afectar el estado nutricional del paciente [90] [91] [92] [93] [94]. Un estudio reciente ha demostrado que el estado nutricional fue la variable más fuertemente asociada con la mortalidad [95]. En este sentido, a la hora de hacer recomendaciones dietéticas destinadas a disminuir la ingesta de P, es importante conocer no solo el contenido en fósforo de los alimentos, sino otros aspectos como la diferente absorción intestinal de P según la fuente alimenticia o el ratio P/proteína [91] (Figura 4).
Existen dos fuentes de fósforo con diferente implicación en la fosfatemia: el fósforo orgánico y el inorgánico. El fósforo orgánico se encuentra naturalmente en los alimentos ricos en proteínas tanto de origen animal como vegetal, y su absorción es mayor si los alimentos son de origen animal (carnes, aves, pescados, huevos y lácteos) ( 60%) que si la fuente de fosforo es proteína vegetal (semillas, frutos secos y legumbres) (30%) pues su P (almacenado en forma de fitatos) se absorbe menos en el intestino (debido a la falta de la enzima fitasa en el intestino humano que es necesaria para liberar P) [92]. El fósforo inorgánico es el componente principal de varios aditivos que se utilizan en el procesamiento alimentario. Son fuentes comunes de fósforo inorgánico las bebidas, comidas congeladas, cereales para el desayuno, quesos procesados y para untar, productos instantáneos, comidas precocinadas, salchichas, galletas, bollería, bebidas a base de cola, etc. Entre el 90-100 % del fósforo inorgánico se absorbe a nivel intestinal, a diferencia del 40-60 % del fósforo orgánico presente en los alimentos naturalmente [91] [92] [93] [94].
En general, se debe recomendar:
1) Consumir productos naturales frente a procesados.
2) Consumir alimentos ricos en proteínas, pero pobres en P (cociente
3) Consumir preferiblemente proteínas de origen vegetal ricas en fitatos, que se ha demostrado que reduce la calcificación vascular.
4) Y sobre todo, evitar en lo posible el P inorgánico (casi 100% absorbible) de los aditivos alimentarios
Una vez en diálisis se debe liberar más la dieta de proteínas para prevenir desnutrición dado el carácter catabólico de la técnica. Con las recomendaciones nutricionales para el enfermo en diálisis, se suelen requerir captores del P para el control de la hiperfosforemia, que se deben adecuar a la cantidad de P ingerida [91].
2. OPTIMIZAR LA DOSIS DE DIALISIS
Obviamente, la optimización de la diálisis en pacientes dializados es condición sine qua non para controlar la hiperfosfatemia. Aun conociendo que la eliminación de fósforo con la hemodiálisis es limitada, debido a la localización intracelular del mismo, la superficie de la membrana del dializador, el tiempo y la frecuencia de la diálisis influyen en su eliminación.
Las opciones que aumentan mas la depuración de P son aumentar el tiempo por sesión, aumentar la frecuencia e introducir técnicas de alto trasporte convectivo. La más eficaz es aumentar la frecuencia [96] [97] [98], y especialmente la diálisis nocturna [99] [100].
3. ESTABLECER LA CONCENTRACIÓN IDÓNEA DE CAlCIO EN EL LÍQUIDO DE DIÁLISIS
No existe un consenso sobre cuál debe ser el contenido de calcio en el líquido de diálisis (Ca]d) (tanto hemodiálisis como diálisis peritoneal) [101, 102, 103]. Las guías KDIGO sugieren el uso de [Ca]d entre 1,25 y 1,50 mmol/L (2,5-3 mEq/L) y reservar el uso de niveles más elevados, 1,75 mmol/L (3,5 mEq/l) sólo para la hipocalcemia sintomática grave o el síndrome de hueso hambriento posparatiroidectomía, ya que frenan la secreción de PTH y producen un balance francamente positivo de calcio.
Cada vez aparece más el concepto de individualización en el contenido de [Ca]d. Los valores bajos de [Ca]d (1,25 mmol/L; 2,5 mEq/L) se han asociado con un balance negativo de calcio y tendencia al incremento de la PTH. Los valores altos de calcio en el dializado (1,5 mmol; 3 mEq/L) se han asociado a balances positivos de calcio y tendencia a frenar la PTH, especialmente en aquellos pacientes con niveles más bajos de calcio sérico prediálisis [64]. La individualización del calcio del dializado de acuerdo con los niveles séricos de calcio prediálisis puede prevenir o disminuir las excursiones no deseadas tanto del calcio sérico como de la PTH.
Algunas recomendaciones:
1) Tratar de incrementar el calcio sérico o disminuir la PTH a expensas de incrementar el contenido de calcio en el dializado pueden incrementar la mortalidad [103] y aumentar la calcificacion coronaria [102].
2) Se desconoce aún cuál es el balance de calcio según el líquido de diálisis en pacientes con hipocalcemia secundaria al uso de calcimiméticos, por lo que no parece aconsejable el aumento persistente del calcio en el líquido de diálisis como respuesta a la hipocalcemia inducida por calciméticos.
3) En pacientes con inestabilidad hemodinámica, el contenido bajo en calcio (1,25 mmol/L) dializado puede favorecer una peor tolerancia a la ultrafiltración, que se potencia si el contenido de magnesio no es adecuado. En estos casos hay que valorar riesgo / beneficio en la decisión de un contenido en calcio u otro.
La tendencia actual es que, ante el riesgo de calcificaciones extraesqueléticas, la concentración de [Ca]d se ha ido reduciendo [101]. Con calcemias en rango normal es razonable empezar con [Ca]d de (1,25 mmol/L/2,5 mEq/L/5 mg/dL). Con tendencias descendentes de calcio sérico, especialmente si se emplean calcimimeticos, se hace recomendable emplear [Ca]d de (1,5 mmol/L/3 mEq/l/6 mg/dl) para evitar balances excesivamente positivos de calcio.
4. GARANTIZAR NIVELES DE CALCIDIOL (25(HO)D3)
Más del 80% de pacientes con ERC tiene un déficit de vitamina D [81], y este déficit se ha asociado a un aumento de mortalidad, fundamentalmente por causas cardiovasculares e infecciosas [104].
Existen varias razones por las cuales parece recomendable medir niveles de calcidiol (2 C) y tratar el déficit de esta hormona [3]:
• En estadios precoces, el déficit de 25(OH)D3 puede ser la única causa de HPT2º. Los niveles adecuados de 25(OH)D3 son especialmente importantes, ya que serán el sustrato para la producción de 1-25(OH)2D3, además de que su déficit agrava el HPT2º. Un estudio reciente ha demostrado que el tratamiento con altas dosis diarias de colecalciferol (8.000 UI/día) en pacientes con ERC Etapas 3-4 detiene la progresión de SHPT y no causa hipercalcemia u otros efectos secundarios [105].
• Además, el receptor de la vitamina D se encuentra en otros tejidos además del riñón, hueso e intestino y su suplementación tendría beneficios sobre la hidroxilación extrarrenal y sus efectos pleiotrópicos auto- o paracrinos, más allá del control del hiperparatiroidismo. La vitamina D tiene efectos pleiotrópicos sobre los sistemas inmunológico, cardiovascular y neurológico y sobre la actividad antineoplásica. Los órganos extrarrenales poseen la capacidad enzimática para convertir 25(OH)D3 en 1,25(OH)2D3 [105].
• Es necesario suplementar con vitamina D en apoyo a los tratamientos de la osteoporosis en la ERC , ya que aumenta la eficacia de dichos fármacos y evita efectos secundarios indeseados como la hipocalcemia (principalmente inducida por denosumab) [106].
La mayoría de los estudios se han realizado en pacien¬tes con una función renal normal, y se siguen como base recomendaciones realizadas para ellos, desconociéndose en gran medida la fisiopatología de esta alteración en el paciente renal. El tratamiento debe individualizarse. Los factores que influyen son el sol (más déficit en invierno) , la obesidad ( vitamina D se deposita en la grasa, y tiene más déficit en suero), el grado de función renal (a peor función renal, más déficit); ingesta de P y niveles de FGF-23 (favorecen la destrucción de la vitamina D aumentando la 24 alfa hidroxilasa) [107] .
La mayoría de las recomendaciones sugieren que se debe realizar una repleción para conseguir unas cifras por encima de 20 ng/mL [108]; de esta forma, los valores óptimos deben situarse entre 20 y 30-40 ng/mL [109], ya que por encima de 40 ng/mL (100 nmol/L) se han asociado a mayor mortalidad en algunos estudios [110].
En España disponemos de las siguientes opciones terapéuticas [3]:
• Vitamina D3 (colecalciferol): 2.000UI/mL solución (precursor de vitamina D no activo, forma nutricional)
• 25(OH)D3 (calcidiol) (Hidroferol®): Las presentaciones del calcidiol en España son varias: gotas, ampollas de 16.000 U (hidroferol ® 0,266: 266 mcg) y otras de 180.000 U.
El objetivo es conseguir la dosis mínima capaz de mantener las funciones de la vitamina D sin efectos secundarios. Al ser una vitamina liposoluble tiene el riesgo de acumularse y el paciente se puede intoxicar [83].
La suplementación elegida dependerá del paciente. Probablemente la mejor alternativa sea la suplementacion diaria en gotas en la forma nutricional (colecalciferol) por ser mas fisiológica y el organismo puede modificar su activación a 25OHD3 según necesidades.
En algunos pacientes para asegurar el cumplimiento terapéutico, una buena alternativa es Calcidiol ampollas bebibles de 16.000 unidades (266 mcg), administradas en las salas de diálisis cada mes y ajustando la dosis en función de la respuesta. Es la forma más sencilla de prescribirlo, si bien hay posiciones desfavorables al empleo de suplementos intermitentes de calcidiol.
5. CONTROL CALCIO-FÓSFORO CON CAPTORES DEL FÓSFORO (P)
Conforme avanza la ERC la dieta deja de ser suficiente para controlar los valores de P y es necesario prescribir captores del P , especialmente en diálisis [111].
Todos los captores de fósforo, en dosis adecuadas son capaces de reducir el P sérico y, por consiguiente, su potencia es comparable [112] [113]. Hasta el momento, no hay ningún trabajo que demuestre de forma convincente, cuál debe de ser el captor de primera elección. El uso de cualquier captor de fósforo (excepto los basados en aluminio) se ha asociado a una mejoría de la supervivencia en múltiples estudios en pacientes en diálisis [114], aunque no se puede descartar que este efecto sea debido a un mejor estado nutricional. Se considera, por tanto, dada la presencia de numerosas alternativas disponibles y la incapacidad de determinar una dosis segura, que el uso prolongado de captores con aluminio debería evitarse, a pesar de que es el captor más barato y más eficaz.
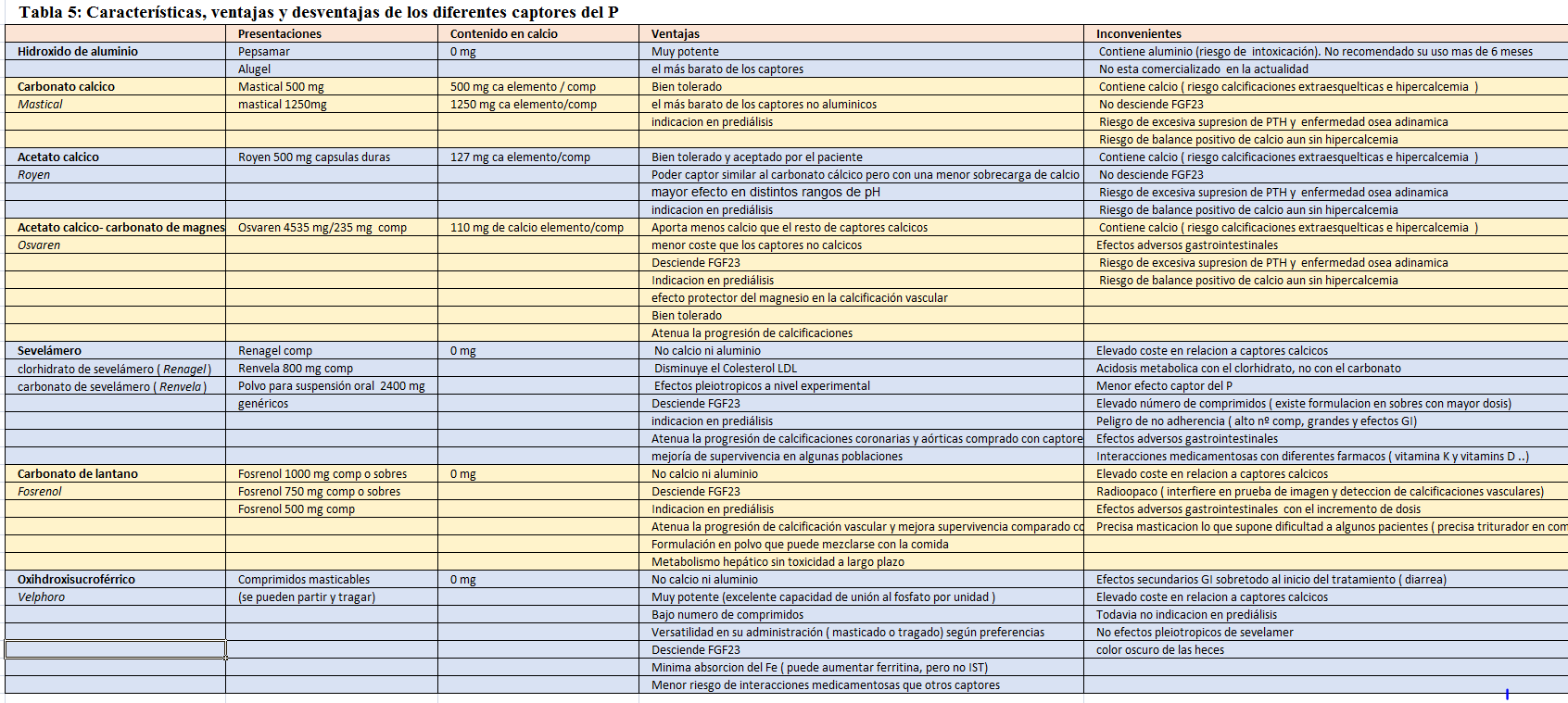
En la (Tabla 5) se muestran las características, ventajas y desventajas de los diferentes captores del P: captores alumínicos [115], cálcicos [116] [117] [118] [119] [120], sevelámero [121] [122] [123] [124] [125] [126] [127], lantano [128] [129] [130] [131] [132], con magnesio [133] [134] [135] [136] [137] [138] y con base férrica [139] [140] [141] [142] [143].
Dentro de los aspectos a tener en cuenta a la hora de prescribir un captor de fósforo hay que considerar:
• Contenido de calcio del captor de fósforo: Los resultados de los últimos estudios clínicos aleatorizados y metaanálisis [144] [145] [146] [147] han favorecido a la tendencia creciente de limitar cada vez mas el uso de captores del P cálcicos y, sobretodo, la cantidad de calcio aportado con ellos. Las nuevas guías KDIGO de 2017 [148] [149] [150] sugieren su restricción en todos los estadios de ERC en los adultos (actualmente evidencia 2B).
• Individuos normales y pacientes con ERC en estadios 3b-4 tenían un balance de calcio ligeramente negativo o neutro con una dieta de 800 mg al día de calcio, mientras que con una dieta de 2 g al día los individuos normales se encontraban en un balance ligeramente positivo y los pacientes con ERC tenían un balance muy positivo, lo que sugiere que en adultos con ERC, la ingesta total de calcio elemental no debe superar los 800-1200 mg/día para prevenir la deficiencia de calcio y la carga de calcio.
• Por tanto, en caso de utilizar captores del P hay que limitar las cantidades de calcio elemento aportado a una cifra, probablemente inferior, a 800 mg , dado que va a haber ingesta de calcio elemento en la dieta.
• Coste: Aunque existen controversias [148] en este aspecto parece razonable, que como en cualquier tratamiento, haya que hacer un ejercicio de reflexión de coste-efectividad sobre las prescripciones de captores del fosforo para proteger el Sistema Nacional de Salud (128).
• Preferencias de los pacientes (tabletas vs. polvo, sabor): Las preferencias del paciente deberían ser incluidas en el proceso de elección del captor ya que puede contribuir a una mejora de la adherencia terapéutica y, por ende, un mejor control los objetivos de fosforo [151] [152] [153]. .
Otros captores de P
Se han desarrollado otros captores de fósforo como el colestilán (MCI-196) que fue lanzado en Alemania y Austria en el año 2013, pero ya no está disponible en la Unión Europea por razones comerciales [154]. En cuanto al chitosán, a pesar de las grandes expectativas iniciales creadas, estudios aleatorizados recientes han sido incapaces de duplicar los buenos resultados iniciales [155] [156]. Otros captores de P están en fase de desarrollo [154].
Algunas consideraciones en el tratamiento con captores de fosforo:
• Los captores deben administrarse con los alimentos. Es importante no prescribir los captores del fósforo solamente en desayuno, comida y cena; sino atender a las ingestas intermedias que, muchas veces, son las que más fosforo aportan, al tratarse de alimentos procesados, ricos en P inorgánico (Figura 5).
• El hecho de que tengan que tomarse junto con los alimentos o inmediatamente después, los convierte en uno de los fármacos con menor adherencia dado que es de los que más interfieren en la vida y las costumbres de los pacientes,, y ello a su vez desempeña un papel central en el control del resto de los elementos que condicionan la CKD-MBD [157].
• Un elevado porcentaje de pacientes abandona el tratamiento, independientemente de la relevancia clínica que pueda tener, para evitar las reacciones adversas o la intolerancia [158].
• Cuando un paciente tenga el P mal controlado no entrar en la espiral de subida de dosis dando por hecho una falta de respuesta al tratamiento sino explorar la falta de adherencia. una falta de cumplimiento. Esta actitud no solo no mejora los resultados, sino que contribuye a la falta de adherencia y empeora la calidad de vida del paciente.
6. MANEJO DEL HIPERPARATIROIDISMO SECUNDARIO
Si una vez realizadas todas las medidas anteriormente descritas, haciendo especial énfasis en el control del fósforo, los niveles de PTH siguen aumentando de modo progresivo y persistente, es el momento de iniciar nuevos tratamientos, que actúan a nivel de dos receptores y van encaminados a disminuir la PTH :
• El receptor de la vitamina D: Activadores del receptor de Vitamina D (ARVD)
• El receptor del calcio: Calcimiméticos
Activadores del receptor de Vitamina D (ARVD)
Como su nombre indica actúan a nivel del receptor de la vitamina D. El receptor de vitamina D, una subfamilia de receptores nucleares que actúan como factores de transcripción en las células diana, se ha encontrado en prácticamente todos los tipos de células, lo que puede explicar sus múltiples acciones en diferentes tejidos.
En España se dispone de tres presentaciones y todas son eficaces y están indicados para tratar el hiperparatiroidismo del enfermo renal. Estas son: 1α(OH)D3 (Etalpha® presentación oral e intravenosa); 1,25(OH)2D3 o calcitriol (presentación oral: Rocaltrol®; e intravenosa: Calcijex®); y 19nor o paricalcitol (presentación oral e intravenosa: Zemplar®). Equivalencia de dosis: 1 mcg calcitriol = 3-4 mcg paricalcitol [159].
Todos son eficaces y están indicados para tratar el hiperparatiroidismo del enfermo renal.
Disponemos de los siguientes ARVD:
CLASICOS
1) Calcitriol: disminuye la síntesis y la secreción de PTH pretranscripcional, independientemente de su acción hipercalcemiante, y actua a través de su receptor específico. Como novedad, en la actualidad se conoce que , ademas de regular la homeostasis del calcio y el fosfato, también tiene acciones novedosas en la proliferación y diferenciación celular, regulación del sistema inmune innato y adaptativo, efectos preventivos sobre enfermedades cardiovasculares y neurodegenerativas, e incluso efectos antienvejecimiento [159].
2) Alfacalcidol: derivado sintético de la vitamina D, correspondiente a la molecula, 1 -alfa-hidroxicolecalciferol. Es una forma con poca actividad que requiere una biotransformación previa en una forma activa, el calcitriol o 1,25OH2D3. La acción del alfacalcidol aparece a las pocas horas de la administración. Sin embargo, la duración de sus acciones es la menor de todas, no superando por lo general las 48 horas, aunque en ocasiones puede llegar a 3-5 días. Se requieren dosis mas altas de calcitriol para obtener el mismo efecto [160].
SELECTIVOS
3) Paricalcitol es la 19-nor-vitamina D2: Se considera un activador selectivo del RVD (AsRVD). Su eficacia terapéutica se debe a la selectividad tisular de su mecanismo de acción [161]. Los AsRVD permiten inhibir la síntesis y secreción de la PTH de un modo más eficiente por su mayor afinidad a nivel de células paratiroideas y con menos hipercalcemia e hiperfosforemia por su menor impacto sobre la absorción intestinal del calcio y fósforo y su menor actividad que el calcitriol a nivel óseo [162]. La selectividad de paricalcitol se explica a nivel bioquímico por el extremo C-terminal del receptor de la vitamina D, que es la región que se une específicamente al ligando.
Paricalcitol presenta tambien ventajas en cuanto a sus efectos pleiotrópicos o multisistémicos [163]: Protección renal: reducción de la proteinuria y fibrosis renal [164] [165]; agente inmunomodulador y antiinflamatorio sobre el remodelado cardiomiocitario [166]; y menos calcificaciones vasculares comparado con dosis equipotentes de calcitriol en estudios experimentales [167]. El efecto diferencial del calcitriol y el paricalcitol sobre la calcificación vascular parece estar mediado por una regulación distinta de las vías de señalización BMP y Wnt / β-catenina [168].
A pesar de estos posibles efectos pleiotropicos asociados a los ARVD en la actualidad no se puede recomendar su uso para otras indicaciones que no sean el tratamiento del hiperparatiroidismo; ni tampoco recomendar de manera preferente el uso de Paricalcitol [169] [170].
El peligro de estos tratamientos es que incrementan la absorción intestinal de calcio y fósforo, y pueden facilitar el desarrollo de calcificaciones vasculares e incrementar la mortalidad si no se utilizan adecuadamente [65].
Si se administran dosis bajas de metabolitos activos no suelen provocar hipercalcemia ni hiperfosfatemia y algunos estudios experimentales han mostrado que podrían incluso disminuir la progresión de la ERC y numerosos estudios epidemiológicos han mostrado beneficios de supervivencia asociado tanto el uso de calcitriol como de α-calcidol de pacientes con ERC no en diálisis. [171] [172] [173].
Existen resultados controvertidos respecto al uso de analogos de la vitamina D y supervivencia en hemodiálisis [174].
En estadios prediálisis se recomienda iniciar calcitriol 0,25-0,5 mcg o alfacalcidiol 0,5-1 mcg o paricalcitol 1-2 mcg, cada 48 horas o a diario, individualizando según niveles de PTH y ajustando dosis en función de la respuesta y efectos secundarios (hipercalcemia o hiperfosforemia). En hemodiálisis el rango de dosis es mayor, siempre en función de los niveles de PTH.
El empleo de dosis bajas para favorecer los efectos pleiotrópicos (por ejemplo calcitriol 0,25-0,5 mcg, o paricalcitol 1-3 mcg por semana) en pacientes con PTH normal o baja, además del riesgo de inducir un hueso adinámico, es un aspecto controvertido por lo que su indicación tampoco está establecida.
Calcimiméticos
Los calcimiméticos actúan a nivel del receptor del calcio. Hay dos calcimiméticos comercializados actualmente en España: cinacalcet (vía oral) y etecalcetida (ha de ser administrado por vía endovenosa al final de la sesión de diálisis, si se administra durante la diálisis pierde eficacia al perderse por el dializador).
1) Cinacalcet: un activador alostérico del sensor del Ca que aumenta la sensibilidad de la glándula PTH a la acción del Ca extracelular [175] [176] y disminuye así la secreción de PTH.
2) Etecalcetide: es un pequeño péptido sintético que activa el RSCa incluso en ausencia de calcio. Sin embargo, la señalización es mayor en presencia de calcio por lo que su acción alostérica parece ser también la principal [177] [178] [179].
Los calcimiméticos reducen significativamente los valores séricos de PTH y, se ha visto asociada una disminución del calcemia y a un mejor control del fósforo [180]. Otras ventajas descritas con el uso de calcimiméticos son disminución del número de paratiroidectomías, fracturas y hospitalizaciones de causa vascular [181]. Aunque después de 64 meses no hubo diferencias en el objetivo primario de muerte o aparición de eventos cardiovasculares, hubo mejoría nominalmente significativa de la supervivencia, en el subgrupo de pacientes en diálisis ≥ 65 años [182] [183]. También se ha descrito reducción del tamaño y vascularización de las glándulas paratiroides [184].
Diferencias y similitudes entre Cinacalcet y Etecalcetida
1) Ambos fármacos pueden presentar intolerancia digestiva e hipocalcemia como efectos secundarios, que en algunos casos ha obligado a supender el fármaco. Aunque en los ensayos clínicos el etelcalcetida endovenoso no mostró diferencias significativas respecto a cinacalcet en la aparición de eventos adversos gastrointestinales, sin embargo la experiencia clínica parece demostrar que pacientes intolerantes a cinacalcet pueden tolerar etelcalcetida [185]. La hipocalcemia parece ser mas severa con etecalcetida que con cinacalcet [178] [186].
2) Por su utilización intravenosa en las unidades de hemodiálisis, etecalcetida mejora y asegura la adherencia [185].
3) Por otra parte, etelcalcetida ha resultado ser más efectiva para reducir la PTH en comparación con el cinacalcet, con un perfil de seguridad aceptable y comparable [187]. Etecalcetida reduce PTH incluso en grados avanzados de hiperparatidoismo y disminuye la necesidad de paratiroidectomias [188].
4) Tras la administración de una dosis de cinacalcet en pacientes en hemodiálisis con hiperparatiroidismo secundario controlado por cinacalcet, se observa una reducción transitoria (1-6 horas) en PTH y P después de cada dosis diaria, con un retorno al inicio a las 24 horas [189]. Sin embargo la administración de etecalcetida postdiálisis mantiene los niveles de PTH estables a lo largo de toda la semana.
Después de la interrupción de cinacalcet, la PTH aumentó significativamente a las 48 horas. Esto ha hecho que en pacientes con PTH excesivamente controlada o suprimida cinacalcet se puede administrar cada 48 horas [189].
Dosificación
• Cinacalcet. Se administra via oral. Las dosis que varian desde 30 mg hasta 180 mg. Pacientes con PTH excesivamente controlada se pueden administrar 30 mg cada 248 horas (equivalente a 15 mg/diarios).
• Etecalcetida. Se adminstra intravenoso. Inyección en bolo 3 veces por semana post hemodiálisis- en la línea venosa del circuito de diálisis al final de la sesión durante el procedimiento de lavado con suero fisiológico. Dosis que varian desde 2,5 mg postHD hasta 15 mg.
Pacientes con PTH excesivamente controlada se pueden administrar menos dosis de etecalcetida o administrar 1 vez a la semana.
• Semivida eficaz de 3 a 5 días.
• Etelcalcetida se elimina principalmente mediante la hemodiálisis.
• 60% se recuperó en el líquido de diálisis
Si el paciente estaba siendo tratado con cinacalcet y pasa a etecalcetida a ficha tecnica recomienda suspender una semana , auque en la experiencia en vida real no parace que sea necesario ese periodo de lavado , maxime cuando tras la suspensión de cinacalcet la PTH aumenta un 50% a las 48 horas [185] [189].
Diferencias y Asociación de Calcimiméticos y metabolitos activos de la vitamina D
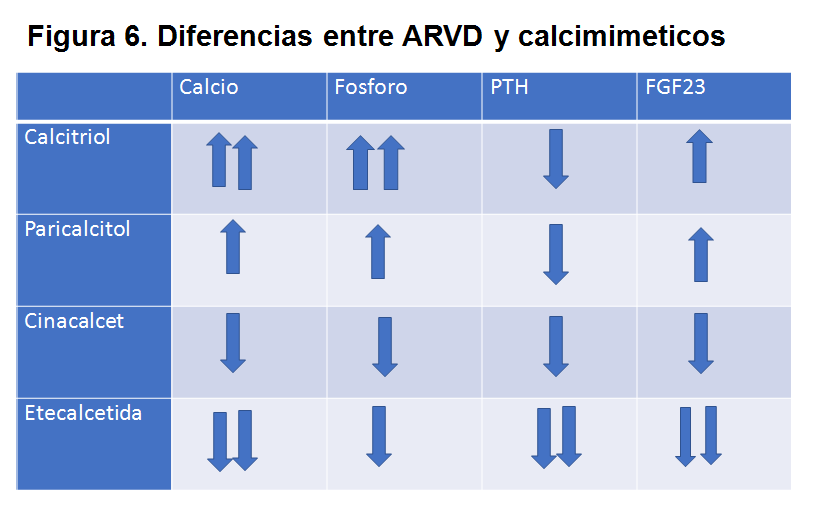
La principales diferencias entre ARVD y Calcimiméticos se ilustran en la (Figura 6).
Control PTH y Efectos secundarios
Cuando se usa vitamina D, los problemas clínicos más importantes son la hipercalcemia, la hiperfosfatemia y la calcificación vascular. Pacientes tratados durante 52 semanas con cinacalcet o con vitamina D en monoterapia tuvieron reducciones similares en la PTH. La hipocalcemia fue más común en el brazo de cinacalcet, mientras que la hipercalcemia y la hiperfosfatemia ocurrieron con mayor frecuencia en el brazo análogo de vitamina D [190]. No se debe tratar la hipocalcemia inducida por calcimiméticos con aportes de calcio, bien con calcio en forma de captores o bien en forma de calcio en el líquido de diálisis.
Efecto sobre FGF-23
Durante el tratamiento de HPTS, el uso de cinacalcet se asoció con una disminución en las concentraciones de FGF-23, mientras que los análogos de vitamina D se asociaron con un aumento. Los efectos divergentes de estos tratamientos en FGF-23 parecen ser independientes de la modificación de la PTH. Es posible que los efectos de los análogos de cinacalcet y vitamina D sobre FGF-23 puedan estar mediados indirectamente por otros efectos sobre el metabolismo óseo y mineral [191].
¿Qué usar?
No hay datos suficientes que nos hagan optar por uno u otro tratamiento pues un metaanálisis reciente concluye que los efectos de los diferentes fármacos sobre los niveles séricos de PTH, fósforo y calcio se correlacionan de manera débil e imprecisa con la muerte por todas las causas y cardiovascular en el contexto de la ERC [192]. Hay estudios experimentales que muestran que etelcalcetida y paricalcitol atenuaron de forma similar la progresión del HPT. Sin embargo, etelcalcetida evitó diferencialmente la calcificación vascular, al menos en parte, debido a la reducción de los niveles séricos de FGF-23, calcio y fósforo [193].
Asociación de Calcimiméticos y metabolitos activos de la Vitamina D
La asociación de calcimiméticos y metabolitos activos de la vitamina D es una alternativa terapéutica con potenciales ventajas:
• Los calcimimeticos aumentan la expresión de los receptores de la vitamina D y la vitamina D aumenta la expresión de los receptores de calcio, con lo que existe una acción sinérgica entre ambos fármacos en el control del hiperparatiroidismo secundario. Esto puede contribuir a disminuir dosis de ambos fármacos, con la consiguiente disminución de dosis y de efectos secundarios bioquímicos o clínicos.
• En el estudio Advance, se comparó el efecto de la administración de Cinacalcet más dosis bajas de ARVD (selectivos o no selectivos) frente a la administración de dosis flexibles de vitamina D sobre la calcificación vascular y de las válvulas cardiacas. No se alcanzaron diferencias estadísticamente significativas en el objetivo primario (cambio porcentual en la puntuación de la calcificación de las arterias coronarias), pero sí en los scores de volumen de la calcificación de las arterias coronarias y de progresión de la calcificación de la válvula aórtica. El grupo con menor calcificación fue el que combinó cinacalcet con análogos de la vitamina D a dosis bajas ( máximo 6 mcg/semana) [194].
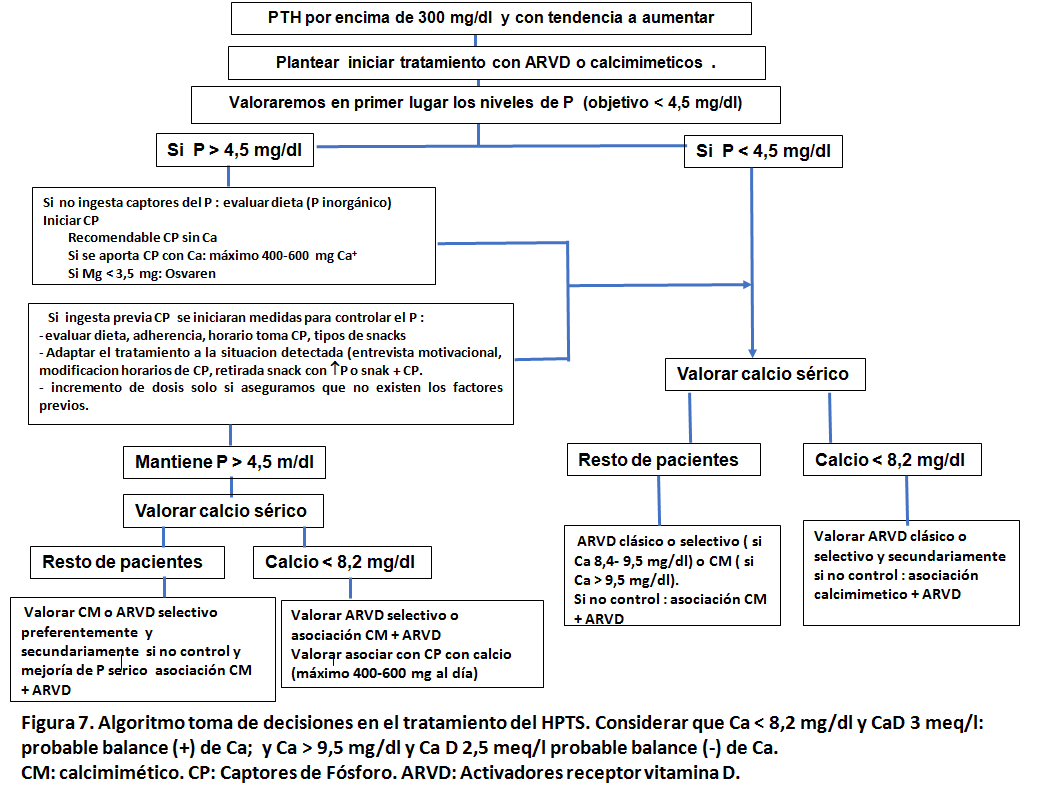
Puede ayudarnos este algoritmo (opinión del autor adaptada a las guías actualmente disponibles) (Figura 7). Se parte del supuesto de pacientes no tratados previamente.
La pauta de Ca en el líquido de diálisis se adecua a los niveles séricos de Ca. Con la excepción de niveles de Ca por debajo de 8,2 mg/dl, es recomendable utilizar [Ca]d de 3 mEq/l. El primer escalón es tratar las alteraciones del P y posteriormente, en función de los niveles de calcio elegir entre las diferentes opciones terapéuticas para tratar el incremento de PTH: ARVD clásicos (calcitriol, alfa calcidiol), ARVD selectivos (paricalcitol) y calcimimeticos (cinacalcet oral o etecalcetida). Obviamente, existen muchas situaciones en que no es posible seguir esta secuencia terapéutica. Ante la persistencia de hiperparatiroidismo, el uso combinado de calcimiméticos y ARVD es una opción atractiva, que debe adaptarse a los niveles de Ca y P.
PARATIROIDECTOMÍA
La paratiroidectomía se debe considerar si todas las medidas anteriormente mencionadas son ineficaces para controlar la PTH. En la actualidad, con la introducción de las nuevas alternativas de tratamiento médico las indicaciones de paratiroidectomía son muy escasas [186].
Estas serían [195] :
a) Cuando el nivel de la hormona paratiroidea persiste > 800 pg/mL durante > 6 meses, a pesar de las intervenciones médicas exhaustivas (asociación de cinacalcet/etecalcetida, captores del fósforo y derivados de la vitamina D), es probable que exista proliferación monoclonal con hiperplasia nodular junto con una disminución de la expresión de la vitamina D y los receptores de detección de calcio (no se debe considerar resistencia a calcimimeticos si se usan cinacalcet oral, pues no se puede asegurar el cumplimiento terapéutico).
b) Hipercalcemia o hiperfosfatemia severa refractaria.
c) Hiperparatiroidismo primario (hipercalcemia no iatrógena con PTH no suprimida) en pacientes con ERC (especialmente jóvenes con criterios quirúrgicos). En estos casos existe la posibilidad de cirugía mínimamente invasiva si el sestamibi o la ecografía paratiroidea son positivas.
d) Paciente con calcifilaxis y PTHi superior a 500 pg/mL, que no responden rápidamente al tratamiento con calcimiméticos.
e) Complicaciones asociadas al HPT2º como ruptura tendinosa, dolor óseo severo o anemia refractaria.
Localización por imagen de las glándulas paratiroides.
Es recomendable disponer de técnicas de imagen previas a la paratiroidectomía para valorar tamaño glandular, situación y sobre todo presencia de glándulas ectópicas. La asociación de Gammagrafía-MIBI y/o SPECT-TAC y/o Ecografía cervical muestran una gran sensibilidad y especificidad (BC). El uso de PET-scan con diferentes trazadores (11C-metionina, 18F-fluorocolina) se considera una modalidad de imagen de segunda línea adecuada para permitir paratiroidectomía mínimamente invasiva.
Procedimiento de extirpación
Existe controversia sobre cuál es la técnica de extirpación más adecuada, paratiroidectomía total, subtotal o total con autotrasplante y faltan ensayos clínicos aleatorizados para valorar riesgo/beneficio de la paratiroidectomía.
1) Si hay un adenoma simple o doble que causa hiperparatiroidismo terciario después del trasplante de riñón, se prefiere la paratiroidectomía subtotal (dirigida a quitar el adenoma) para lo cual la incidencia de hiperparatiroidismo secundario recurrente es baja [196].
2) En pacientes con razones convincentes para evitar la cirugía de cuello reoperatoria (es decir, afecciones de la tiroides que potencialmente requieren procedimientos quirúrgicos adicionales, antecedentes de cirugía repetida del cuello, lesión recurrente conocida del nervio laríngeo, comorbilidades médicas significativas o intolerancia a anestesia general) se prefiere la paratiroidectomía total con autotrasplante [197]. Cuando se realiza una paratiroidectomía total con autotrasplante, se coloca un fragmento de tejido paratiroideo en el músculo esternocleidomastoideo o del antebrazo o en el tejido adiposo abdominal subcutáneo. Se desaconseja dejar como tejido residual (en caso de paratiroidectomía subtotal o para uso como autotrasplante) una glándula hipercaptante en la gammagrafía.
3) Para los pacientes con una esperanza de vida más larga o aquellos con poca o ninguna probabilidad de someterse a un trasplante de riñón, una paratiroidectomía total sola (sin autotrasplante) es superior en términos de prevención del hiperparatiroidismo secundario refractario recurrente [198]. El efecto a largo plazo de los niveles excesivamente bajos de PTH sigue sin estar claro, aunque existe la preocupación de un cambio de enfermedad de recambio óseo alto a bajo con posibles resultados vasculares adversos después de la paratiroidectomía.
La paratiroidectomía total con autotrasplante conlleva un mayor riesgo de hipocalcemia permanente, mientras que el riesgo de recurrencia de hiperparatiroidismo es mayor con la paratiroidectomía subtotal [198].
La paratiroidectomía no está exenta de complicaciones, con un aumento de mortalidad precoz y aumento de las tasas de hospitalización durante el primer año, aunque con buenos resultados a largo plazo en estudios observacionales [195].
Manejo Postoperatorio
En casos de hiperparatiroidismo severo la hipocalcemia en el postoperatorio inmediato puede ser profunda y grave. Se denomina "síndrome del hueso hambriento" secundario al rápido depósito de minerales en el hueso y aparece en más del 25% de los pacientes.
Suele aparecer entre 1 y 3 semanas después de la cirugía. Los niveles de PTH antes de la cirugía no predicen la aparición de síndrome del hueso hambriento hueso , mientras tener menos de 45 años, tener un calcio postoperatorio < 8,4 mg/dL o niveles de fosfatasa alcalina > 120 U/L son mas predictivos. Su tratamiento requiere dosis elevadas de calcio oral y endovenoso, calcitriol y calcio en el baño elevado (una de sus pocas indicaciones) [195].
La vigilancia de estos pacientes debe ser rigurosa, con medición de la calcemia cada 6 horas. Para prevenir este síndrome, algunos proponen suprimir la glándula en los días previos a la PTX con altas dosis de Calcitriol (5 mg postdiálisis).
Tratamiento de la calcifilaxis
El tratamiento de la calcifilaxis consiste en:
Cuidado de las heridas mediante un programa intensivo por un equipo multidisciplinar, vigilancia intensiva de la aparición de sobreinfección y tratar de forma enérgica con antibióticos.
Control del dolor: opiáceos adecuados a la función renal, como el fentanilo, y tratamientos coadyuvantes que sean efectivos para el dolor neuropático (como la pregabalina o la gabapentina).
Control de las alteraciones del metabolismo calcio-fósforo (hiperfosfatemia con captores del fósforo no cálcicos, cinacalcet o etecalcetida, paratiroidectomía si no se puede controlar la PTH).
Adecuación de la dosis de diálisis y usar baño bajo en calcio (2,5 mmol/L). No está tan claro si está justificado pasar a una diálisis intensiva. Podría estar justificado incrementar la frecuencia o la duración de la diálisis, o pasar a hemodiafiltración en línea, en los pacientes con hiperfosfatemia resistente
Suspensión de la medicación que la favorece: captores con calcio, vitamina D activa y sus análogos, anticoagulantes antagonistas de la vitamina K y, quizá, el hierro intravenoso. Se puede cambiar a otro tipo de anticoagulante: heparina teniendo en cuenta que las inyecciones subcutáneas pueden favorecer la aparición de nuevas lesiones, y hay que tenerlo en cuenta si se indica heparina de bajo peso molecular [199], o apixaban a dosis de 2,5 mg cada 12 horas
Tratamiento de las calcificaciones vasculares
Se están aplicando tratamientos fuera de ficha técnica:
Tiosulfato sódico. Las dosis son empíricas. difieren si el paciente está en hemodiálisis, diálisis peritoneal o sin ERC avanzada. No se sabe la duración óptima del tratamiento. En la mayoría de las series de casos publicados se ha continuado el tratamiento hasta 2 meses más tras la resolución de las lesiones o la mejoría clara del dolor. Si no hay mejoría podrían asociarse otras medidas, como bisfosfonatos o cámara hiperbárica [59]. La dosificación se refleja en la (Tabla 6).
Efectos secundarios : náuseas, vómitos, diarrea y calambres abdominales si se administra muy rápido (en menos de 60 minutos). También pueden aparecer acidosis metabólica, hipotensión, hipocalcemia, prolongación del QT y sobrecarga de volumen (por el sodio). Si el paciente no lo tolera intravenoso se puede usar intralesional.
Bisfosfonatos: preferentemente ibandronato (6 mg por vía intravenosa (1ª dosis), seguido por una segunda dosis de 3 mg a los 15 días y posteriormente ibandronato oral, 150 mg/mes durante 6 meses) [200]. Otra alternativa sería el pamidronato, 90 mg por vía intravenosa (1ª dosis), seguido por 30 mg por vía intravenosa semanales o 35 mg de alendronato oral (tres o cuatro dosis en total).
Suplementos de vitamina K [201]: Existe un ensayo clínico en marcha Evaluation of Vitamin K Supplementation for Calcific Uremic Arteriolopathy (VitK-CUA) (https://clinicaltrials.gov/ct2/show/ NCT02278692) para confirmar su indicación.
Oxigenoterapia y cámara hiperbárica: terapia de segunda línea. Algunos estudios retrospectivos sugieren que aplicar este tratamiento podría favorecer la mejoría en más de la mitad de los casos, y prolongar la supervivencia más de 3 años [202] [203].
SNF472: formulación intravenosa de hexafosfato de mioinositol, que inhibe la formación y el crecimiento de cristales de hidroxiapatita, la vía común final en la patogénesis de la calcificación vascular. Un reciente ensayo clínicos en pacientes con calcifilaxis muestra que pacientes que recibieron SNF472 intravenoso 3 veces por semana durante 12 semanas fue bien tolerado y se observaron mejoras desde el inicio hasta la semana 12 en la curación de heridas, el dolor y la calidad de vida. Actualmente se está planeando realizar un ensayo aleatorizado, doble ciego, controlado con placebo para evaluar SNF472 en pacientes con calcifilaxis. En un ensayo clínico reciente SNF472 en comparación con el placebo, atenuó significativamente la progresión de as calcificaciones arteriales y la calcificación de la válvula aórtica en pacientes con ERC que reciben hemodiálisis además de la atención estándar [204] [205].
La combinación de varios tratamientos parece que es lo que mejores resultados aporta.
OSTEOPOROSIS (OP)
Véase Osteoporosis Tratamiento
Numerosos pacientes con ERC presentan una disminución de densidad mineral ósea [206], un elevado riesgo de fracturas por fragilidad ósea y un incremento de su morbimortalidad. Con el envejecimiento de la población estos hechos no son dependientes solo de la «osteodistrofia renal» sino también de la OP asociada.
Los pacientes con ERC tienen alto riesgo de fracturas [206]. Debido a la coexistencia en pacientes renales de diversas patologías que pueden condicionar fracturas (enfermedad ósea adinámica, osteomalacia, osteoporosis, hiperparatiroidismo secundario severo) se hace especialmente relevante su estudio en estos pacientes para indicar un tratamiento adecuado, puesto que en algunas de estas patologías no están indicados los fármacos antiresortivos.
La biopsia ósea seria el patrón oro en el diagnóstico pero las guías actualmente disponibles (guías KDIGO 2017) anteponen la medición de la densidad mineral ósea (guía 3.2.1) a la práctica de biopsia ósea (guía 3.2.2) y afirman que la incapacidad de biopsiar no debería impedir el uso de terapias antirresortivas, al menos en algunos pacientes [3] [150].
Tratamiento
Medidas no farmacológicas
Hábitos dietéticos saludables, incrementar la actividad física y el ejercicio (yoga, taichí, baile…), disminuir el alcohol y la abstinencia tabáquica. Prevenir caídas, fundamentalmente en pacientes de edad avanzada, deterioro cognitivo y funcional, caídas previas, hipotensión ortostática o consumo de psicotropos (incluyendo antihistamínicos y opiáceos. Corregir déficits visuales y auditivos, así como adecuar el entorno físico.
Medidas Farmacológicas
a) Aporte de calcio y vitamina D
Las dosis recomendadas para la población general estarían en torno a los 1.000-1.200 mg/día, en función del paciente y de la edad, pero en pacientes con ERC debe adecuarse el aporte de calcio al estadio de función renal dado su dificultad de eliminar el calcio.
Las dosis recomendadas de vitamina D para la población general están en torno a las 600-800 UI/día y de unas 1.000UI/día para pacientes con OP. La suplementación con vitamina D nativa en pacientes con déficit de vitamina D, incluso en diálisis, mejoraría la mineralización ósea, aunque con un efecto limitado en la reducción de la PTH. Además, la vitamina D nativa en posología diaria y en pacientes con déficit de vitamina D podría contribuir modestamente a aumentar la fuerza muscular y a disminuir el riesgo de caídas [206].
b) Fármacos antirresortivos para el tratamiento de la osteoporosis
Bisfosfonatos
Los bisfosfonatos son fármacos de primera elección en el tratamiento actual de todos los tipos de OP. Frenan la resorción ósea al inhibir la actividad de los osteoclastos y, por distintos mecanismos, inducen apoptosis de todas las células óseas [207] [208].
Las indicaciones de tratamiento con bisfosfonatos en pacientes con ERC serian similares a la población general siempre que no tuvieran alteraciones significativas del metabolismo mineral y con poco riesgo de enfermedad ósea adinámica. Los pacientes con riesgo de enfermedad ósea adinámica son fundamentalmente aquellos en diálisis peritoneal, diabéticos, mayores o malnutridos en los que destaca especialmente la presencia de hipoparatiroidismo relativo (niveles de PTH bajos o relativamente bajos a los esperados para su grado de ERC) [209].
La combinación de PTH intacta y fosfatasa alcalina (especialmente su fracción ósea) proporciona el mayor poder predictivo para el diagnóstico diferencial entre enfermedad ósea de alto o bajo remodelado en otros casos (p.ej., PTH < 200 pg/mL y fosfatasa alcalina ósea < 20ng/mL). En estos pacientes no estaría indicado el uso de agentes antirresortivos y se debería valorar la posibilidad de una biopsia ósea antes de indicarlos (o para indicar un tratamiento anabólico), al igual que ante una sospecha de osteomalacia (pacientes con niveles bajos de calcio, calcidiol y/o fósforo, frecuentemente con fosfatasa alcalina desproporcionadamente elevada, con dolor óseo importante o múltiples fracturas) [210] o posibles intoxicaciones por aluminio u otros metales, cada vez más frecuentes en nuestro medio, ante la globalización y la presencia de pacientes procedentes de otro países más deprimidos donde la calidad del agua de diálisis no cumple nuestros estándares. Efectos adversos: la osteonecrosis de mandíbula (ONM) y las fracturas atípicas de fémur (subtrocantéreas-diafisarias).
Diversos análisis han demostrado que la DMO sí predice el riesgo de fractura en pacientes con ERC aunque no discrimina el tipo de patología ósea que tenga el paciente [211] [212].
Denosumab
Denosumab (DMab) es un anticuerpo monoclonal que actúa bloqueando el ligando del receptor activador del factor nuclear kappa-B (RANKL) e inhibe la osteoclastogénesis [213]. DMab es útil para la prevención de fracturas vertebrales, no vertebrales y de cadera en la población general. No depende de la función renal para su metabolismo o excreción y no parece alterar la función renal, por lo que no se necesita ajustar dosis en pacientes con ERC. Puede inducir hipocalcemia, especialmente en pacientes con ERC y pacientes en hemodiálisis con alto recambio óseo subyacente y puede producir también un aumento (reversible) de PTH intacta que puede llegar a valores superiores a 1.000 pg/mL. Tras la interrupción del tratamiento se produce una pérdida ósea que puede ser rápida, por lo que se debería valorar una terapia secuencial con otro fármaco para sostener el beneficio obtenido en la DMO.
Fármacos anabólicos para el tratamiento de la osteoporosis
Teriparatida
Actúa incrementando la formación ósea, por la exposición de forma intermitente a la PTH, particularmente en el hueso trabecular. Elevado coste (la alternativa más cara). No se puede administrar por periodos superiores a 24meses.
Romosozumab
Anticuerpo monoclonal humanizado contra la esclerostina, inhibidor de la vía Wnt responsable de la formación de hueso
El papel de este fármaco en pacientes con ERC es insuficiente para aconsejar su uso.
Otros tratamientos
Estrógenos y raloxifeno
El hipoestrogenismo es una causa bien conocida de OP, y tanto la terapia estrogénica adecuada como el uso de los moduladores selectivos de los receptores de estrógenos han mostrado mejorar la OP posmenopáusica. La menopausia precoz (o hipogonadismo prematuro) es más frecuente en mujeres con ERC, por lo que estas pacientes representan una población especial de alto riesgo.
Raloxifeno no tiene el riesgo carcinogénico de la terapia estrogénica clásica (incluso descrito como protector de cáncer de mama) y es una alternativa en la OP posmenopáusica. Ha demostrado mejorar la DMO y disminuir el riesgo de fracturas vertebrales pero no las de cadera [206].