Recidiva de Nefropatía IgA y Glomerulonefritis Membranosa de Novo en un Paciente Trasplantado
INTRODUCCIÓN
La tasa de recurrencia de Nefropatía IgA (NIgA) en el injerto renal es del 9-60% dependiendo de los criterios de biopsia, la realización o no de biopsia de protocolo y la variable discordancia entre estudios realizados. [1] [2]. Igual que la Nefropatía Membranosa de novo (GNM) es la glomerulopatía de novo más frecuente en el trasplante renal. En cambio, no es común la coexistencia de ambas nefropatías. Se han descrito pocos casos en la literatura. [15] [16] [17].
A continuación, describimos el caso de un receptor de trasplante renal con enfermedad renal crónica secundaria a NIgA, en el que se evidencia coexistencia de dos glomerulopatías en el injerto renal, recidiva de NIgA y GNM.
CASO CLÍNICO
Hombre de 67 años, en estudio por insuficiencia renal y proteinuria máxima 5 gr/24h sin hematuria desde el 2006 por lo que se le realizó biopsia renal el abril de 2007 que fue compatible con Nefropatía IgA, con 45% de glomérulos esclerosados, fibrosis intersticial y atrofia tubular en el 40% de la corteza renal.
Se completó el resto del estudio con hallazgo de hipogammaglobulinemia en proteinograma. Las serologías fueron negativas excepto para Citomegalovirus (CMV), Epstein Barr (EB) y Toxoplasma.
Se realizó tratamiento conservador con inhibidores de la enzima convertidora de la angiotensina (IECA), sulfonamidas y estatinas. A pesar del tratamiento, el paciente presentó deterioro progresivo de la función renal y requirió inicio de hemodiálisis en 2009 e inclusión a lista de espera de trasplante renal.
El noviembre de 2011 se realizó su primer trasplante renal (TR) de donante cadáver tipo muerte encefálica, isogrupo sanguíneo A+, MM 2-0-1, de bajo riesgo inmunológico sin anticuerpos específicos del donante (DSA). Recibió inducción con basiliximab y tratamiento con tacrolimus, micofenolato y prednisona que se retiró posteriormente por protocolo de ensayo clínico de ese momento. Evoluciona con creatinina en torno a 1’1-1’3 mg/dl y proteinuria en torno a 8-20 mg/dl.
A los 5 años del TR, desarrolla proteinuria de hasta 1’4 gr/24h y creatinina de 1’32 mg/dl con sedimento urinario inactivo, así como hipertensión arterial. Se lleva a cabo control ecográfico que evidencia injerto con correcta diferenciación corticomedular, sin signos de estenosis de arteria renal. Se inicia tratamiento con ramipril.
Se realiza biopsia del injerto renal que evidencia hipercelularidad mesangial y endocapilar focal con lesiones de glomeruloesclerosis focal y segmentaria, asociada a depósitos dominantes de IgA en la inmunofluorescencia directa, confirmándose recidiva de NIgA y descartándose rechazo agudo. Se inicia tratamiento con prednisona 7’5 mg/24h descendiendo posteriormente a 5 mg/24h.
Se mantuvo con función renal con creatinina en torno a 1’16 mg/dl, y proteinuria estable entre 10-30 mg/dl durante 7 años hasta que inicia con mal control de cifras de TA y reaparición de proteinuria con cociente proteína/creatinina de 1998 mg/g y cociente albuminuria/creatinina de 1510 mg/g con un sedimento urinario sin hematuria ni leucocituria. Presenta determinación de HLA con Panel Reactive Activity (PRA) del 75% sin DSA. Clínicamente el paciente no presentaba alteraciones destacables.
Dado la evolución clínica con proteinuria en paciente con antecedente histológico de recidiva de NIgA, se decide nueva biopsia con objetivo de diagnosticar evolución de IgA u otra patología asociada.
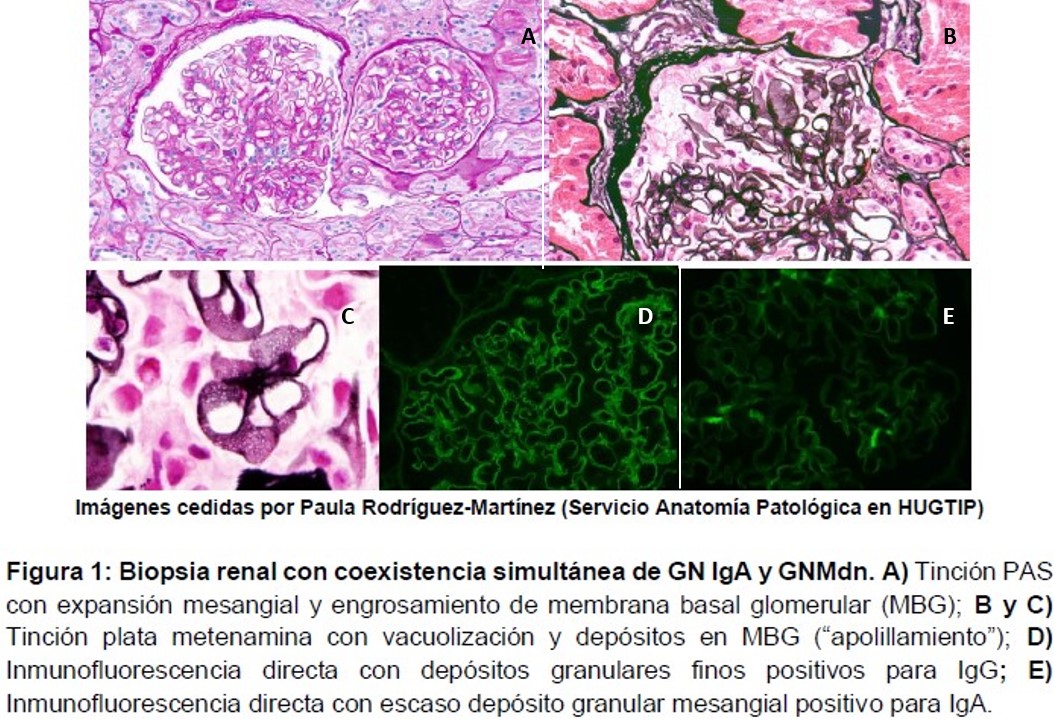
Llamativamente, la biopsia muestra hallazgos compatibles con GNM estadio I-II con inmunotinción para IgG4 y PLA2r negativo, NIgA ya conocida y ausencia de rechazo agudo. (Figura 1)
Ante este hallazgo, se estudia secundarismo mediante TAC que evidencia una lesión subcapsular de morfología alargada altamente sugestiva de proceso inflamatorio/infeccioso en lóbulo superior derecho pulmonar. Se realiza biopsia del nódulo pulmonar que confirma adenocarcinoma acinar infiltrante de pulmón con posterior estudio de extensión negativo. Finalmente, se realiza lobectomía del lóbulo superior derecho. Respecto a la inmunosupresión se suspende micofenolato, manteniéndose niveles de tacrolimus en torno 5-6 ng/dl y prednisona de 5 mg.
Se solicita Anti-PLA2r y Ac anti trombospondina tipo 1 (THSD7A) por presencia de neoplasia que resultan negativos.
Actualmente, el paciente se mantiene con injerto funcionante con creatinina en torno a 1’5- 1’7 mg/dl y filtrado glomerular (FG) en torno a 30-40 ml/min/1’73 m2 con ausencia de proteinuria y sedimento urinario normal.
COMENTARIOS
Es característica de la Nefropatía por IgA la variabilidad de presentación clínica e histológica, pudiendo manifestarse desde microhematuria aislada hasta deterioro agudo de la función renal. Es considerada la enfermedad glomerular primaria más prevalente siendo una de las principales causas de enfermedad renal crónica terminal [1]. En dichos casos el trasplante renal es el tratamiento óptimo.
El injerto renal puede presentar una tasa de recurrencia de entre 9-60%. Esta gran discordancia entre estudios se podría explicar por el momento postrasplante en que se realiza la biopsia y los criterios de realización de biopsia (protocolo o por indicación) [1] [2]. Cuando recurre, un 40-67% de las pérdidas del injerto son debidas a la recidiva [3]. Se considera que la recidiva de la NIgA es la tercera causa de fracaso del injerto renal tras la disfunción crónica y la muerte con injerto funcionante.
La forma de presentación de la NIgA recurrente es variable pudiendo presentarse como proteinuria y/o hematuria o, habitualmente de forma más tardía, como deterioro de la función renal. Varios estudios refieren que los receptores con NIgA como enfermedad de base, con independencia de recidiva o no, tienen más riesgo de fracaso del injerto durante los primeros 5-10 años postrasplante, comparado con pacientes con poliquistosis o con otras enfermedades primarias, aumentando el riesgo de pérdida posteriormente [3] [4].
Se han descrito varios factores de riesgo para la recurrencia de la enfermedad, aunque actualmente aún se encuentran en discusión. Dichos factores de riesgo son receptor y donante joven, poco tiempo en diálisis, receptor masculino, donante emparentado, retrasplante, hemodiálisis, no terapia de inducción, los inhibidores de mTOR y la progresión rápida del diagnóstico de NIgA a enfermedad renal terminal [1]. En nuestro caso clínico, pasan 3 años desde el diagnóstico de la Nefropatía IgA hasta el inicio de hemodiálisis y 2 años hasta que se realiza el trasplante renal.
La Nefropatía Membranosa (GNM) es una enfermedad causada por anticuerpos dirigidos contra diversos antígenos podocitarios, produciendo daño y depósito de inmunocomplejos en la cara externa de la membrana basal glomerular. Se clasifica en GNM primaria y secundaria. Se han descrito antígenos responsables asociados a GNM primaria como el receptor de la fosfolipasa A2 del tipo M (PLA2R), thrombospondin type-1 domain-containing 7A (THSD7A), exostosin 1/exostosin 2 (EXT1/EXT2), neural EGF-like-1 protein (NELL-1) entre otros [5] [6].
En cuanto a la GNM secundaria, los antígenos actúan en las mismas localizaciones, pero están asociados a enfermedades sistémicas como lupus eritematoso sistémico, síndrome de Sjögren o, Enfermedad por Ig4, infecciones como sífilis, virus hepatitis B o C, virus de la inmunodeficiencia humana o fármacos como fluconazol y AINES, neoplasias de colon, linfoma o adenocarcinoma de pulmón como es el caso que comentamos [7].
Dichos antígenos no son exclusivos de GNM primaria, por lo que el paradigma de la GNM ha cambiado según la propuesta de clasificación de la Clínica Mayo, basada en antígenos y enfermedades asociadas [8]. Tanto THSD7A como NELL-1 [6] [7] se han asociado a tumores en algunos casos. La asociación entre GNM y cáncer es controvertida, a diferencia de PLA2R que se ha sugerido como un supresor de tumores [9], las GNM asociadas a THSD7A tienen un riesgo significativamente mayor de malignidad. En algunos estudios [10] [11], el 20-50% de los pacientes con GNM asociados a THSD7A fueron diagnosticados de alguna neoplasia posteriormente. Por tanto, la detección de THSD7A obligaría a profundizar en la búsqueda de tumores [6] [12] [13] aún sin datos de sensibilidad por falta de estudios. Si bien en nuestro caso, pese a ser GN secundaria a cáncer de pulmón, el resultado fue negativo para THSD7A.
En el TR, como en riñones propios, la GNM, puede corresponder a recurrencia de la enfermedad primaria o a una nefropatía de novo. La GNM es una causa frecuente de glomerulopatía de novo en el trasplante renal, apareciendo en un 1’5-2% de los casos. [14]
Frecuentemente ocurre a partir del primer año postrasplante y es infrecuente la presencia de anticuerpos anti-PLA2R y THSD7A tanto en suero como en biopsia renal, que lo diferencian de la GNM recurrente. Además, se han reportado asociaciones con otras patologías como la infección por VHC y VHB, uropatía obstructiva, síndrome de Alport, NIgA recurrente y rechazo mediado por anticuerpos, por lo que nos obligaría a descartarlo. [14].
La coexistencia simultánea de NIgA y GNM es rara y muy infrecuente. Se han reportado 23 casos, de los cuales 17 se dieron en riñón nativo y 6 en injerto renal. [15] [16] [17] [18].
Este caso es de particular interés por dos razones: en primer lugar, por el hallazgo inusual de la coexistencia de NIgA y GNM en un injerto renal y en segundo lugar, por la pertinaz insistencia en la obtención de un diagnóstico histopatológico.
La decisión de no atribuir la progresión de la proteinuria únicamente a la evolución de la NIgA, e indicar la realización de una nueva biopsia renal, resultó determinante para establecer el diagnóstico histológico de GNM. Además, nos permitió la identificación precoz de una neoplasia subyacente y un manejo temprano, mejorando de forma significativa el pronóstico.