Malakoplakia en trasplante renal
Introducción
El Rhodococcus equi es un cocobacilo gram positivo intracelular que constituye una causa poco frecuente de infecciones pulmonares en pacientes inmunosuprimidos. La infección por dicho patógeno constituye un reto tanto diagnóstico como terapéutico, llegando a precisar pautas combinadas de antibióticos de larga duración con actividad intracelular, que no se encuentran definidas en la literatura y, en muchas ocasiones, la resección quirúrgica de la lesión en el caso de resistencia al tratamiento médico.
Caso clínico
Varón de 58 años, natural de Bulgaria, con antecedente de enfermedad renal crónica secundaria a nefropatía tubulointersticial crónica, por la que inició hemodiálisis en el año 1991 y recibió su primer trasplante renal en el 2000. En 2012, reinició hemodiálisis tras pérdida de función del injerto atribuida a rechazo humoral crónico. Recibió su segundo trasplante renal en 2016 y la inmunosupresión de inducción se planteó con triple terapia estándar (esteroides, tacrolimus y micofenolato mofetilo) y timoglobulina al ser un paciente hiperinmunizado. Ese mismo año, el paciente presentó un episodio de rechazo agudo humoral que precisó tratamiento con plasmaféresis e inmunoglobulina intravenosa, quedando con una creatinina basal entre 2,6 y 2,9 mg/dl. Como otro antecedente de interés, es portador de una prótesis valvular aórtica mecánica por estenosis aórtica desde 2020.
El paciente consultó en enero de 2021 por febrícula y dolor con impotencia funcional del hombro derecho de 10 días de evolución, asociado a malestar y astenia. Se planteó inicialmente la posibilidad de monoartritis de hombro derecho de origen microcristalino versus origen infeccioso, pero no se pudo analizar el líquido sinovial por negativa del paciente a la artrocentesis y el cuadro mejoró con antibioterapia de amplio espectro.
Ingresó de nuevo en febrero de 2021 por fiebre elevada de 10 días de evolución, siendo el resto de la anamnesis y la exploración física anodinos. El paciente residía en Madrid y no había tenido contactos con animales domésticos. En la analítica destacó, además de la elevación de los reactantes de fase aguda, una hemoglobina de 7,8 g/dl, desproporcionada respecto al grado de insuficiencia renal del paciente. Con respecto a la misma, se trataba de una anemia normocítica con ferritina de 1200 mg/dl, aunque con hierro y transferrina normales. En el frotis, se observaron dacriocitos y eliptocitos aislados sin otras atipias y el resto del estudio fue anodino (electroforesis e inmunofijación normales, coombs directo negativo y haptoglobina no disminuida). Destacó sólo un CD25 soluble elevado (7418 UI/ml), si bien la anemia no cumplía el resto de criterios clínicos y bioquímicos de síndrome hemofagocítico.
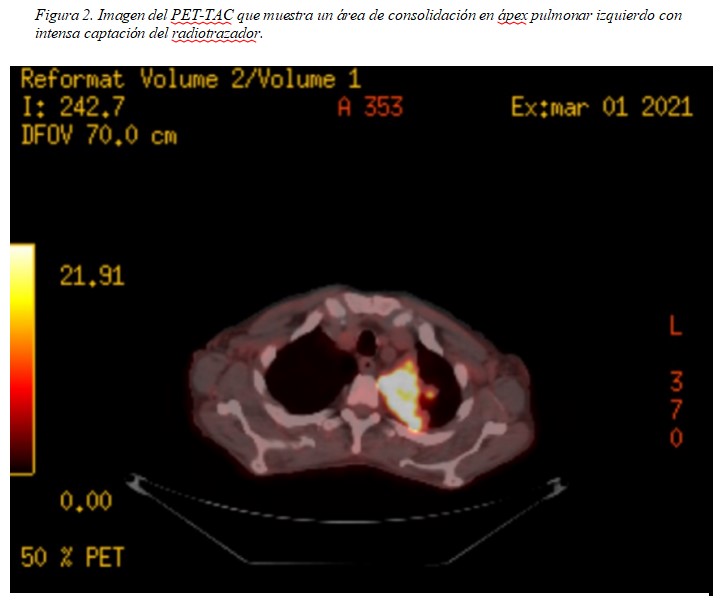
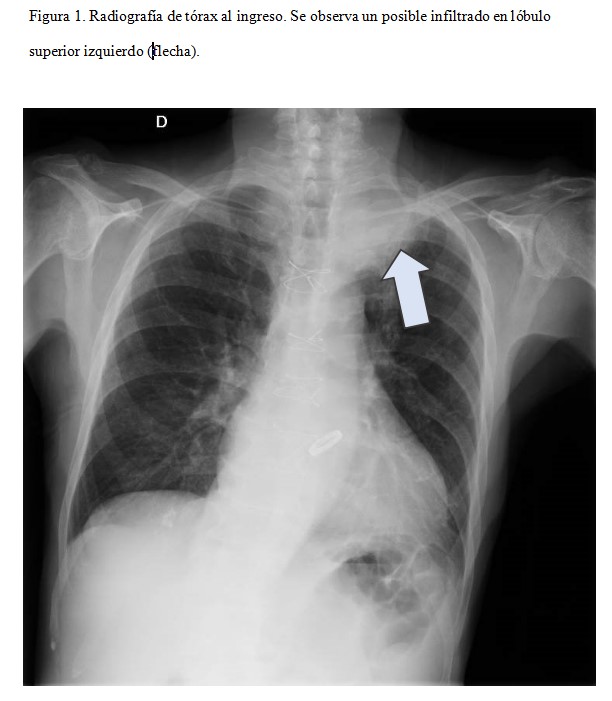
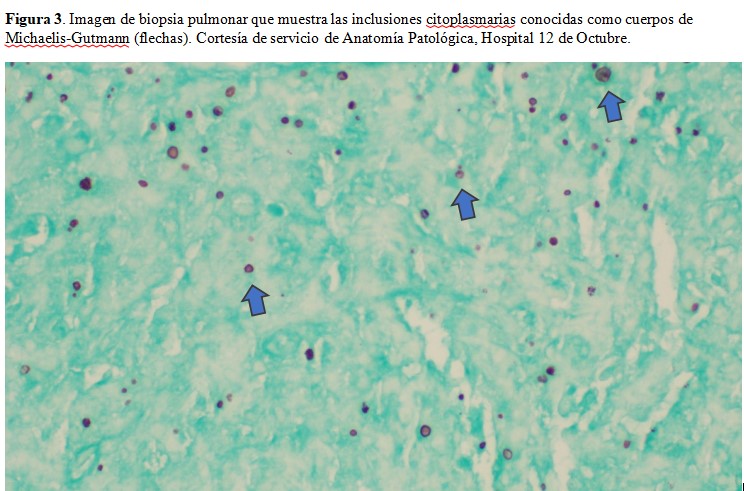
Respecto al resto de pruebas complementarias iniciales, en la radiografía de tórax se observó un dudoso infiltrado en el lóbulo superior izquierdo (Figura 1) y el ecocardiograma no mostró hallazgos. Como parte del estudio microbiológico de la fiebre, se aisló en uno de los dos hemocultivos, un Rhodococcus equi multisensible (inicialmente interpretado como posible contaminante) y se inició cobertura antibiótica con ceftazidima-avibactam. Ante la persistencia de la fiebre y la anemia, se solicitó un PET-TAC en el que se describía un área de consolidación de 7,6x5,8x7 cm en ápex del pulmón izquierdo, con extensión a la región parahiliar ipsilateral y que contacta con la pleura medial, con intensa captación del radiotrazador (Figura 2) orientando a etiología infecciosa o inflamatoria como primera posibilidad, aunque sin poderse descartar neoplasia subyacente. Con estos hallazgos, se realizó una biopsia transbronquial de la lesión que mostró una imagen de neumonía organizativa, sin poder descartarse una neoplasia subyacente. Por ello, se llevó a cabo una biopsia guiada por TAC en la que se obtienen cilindros constituidos por una celularidad histiocitaria de aspecto denso con inclusiones congruentes con cuerpos de Michaelis-Guttman (Figura 3), siendo dicha imagen compatible con infección por Rhodococcus equi. Con estos hallazgos, se inició cobertura antibiótica con linezolid y meropenem con aceptable respuesta clínica. Dada la mejoría tras el inicio de la antibioterapia, el paciente fue dado de alta con el diagnóstico de infección pulmonar por Rhodococcus equi y anemia en el contexto de lo previo. Se decidió mantener cobertura antibiótica con linezolid y azitromicina durante al menos seis meses.
Durante el seguimiento posterior en consultas de trasplante renal, la evolución inicial de la lesión fue positiva, con mejoría progresiva hasta un tamaño 5,5x2 cm. A partir de los tres meses desde el primer ingreso, se produjo un empeoramiento tanto de las citopenias como de la masa pulmonar. Se sustituyó el linezolid por tedizolid para descartar mielotoxicidad por fármacos.
El paciente reingresó seis meses después del primer ingreso por empeoramiento de la lesión pulmonar y episodios aislados de hemoptisis. Se inició cobertura con meropenem y levofloxacino, asumiendo resistencia del microorganismo a la pauta antibiótica previa, se disminuyó la dosis de micofenolato mofetilo a 180 mg cada 12 horas y se realizó una nueva biopsia guiada por TAC en la que se aisló de nuevo Rhodococcus equi sensible a azitromicina, linezolid y carbapenémicos. Con toda esta información, y teniendo en cuenta la elevada carga de inmunosupresión del paciente y la ausencia de respuesta al tratamiento médico, se planteó la resección quirúrgica de la lesión pulmonar, mediante lobectomía superior izquierda (Figura 4).
La evolución clínica posterior fue satisfactoria. Como complicaciones más relevantes, el paciente presentó un hematoma retroperitoneal espontáneo en el contexto de la anticoagulación, una reactivación de CMV y una infección por Clostridioides difficile, resuelta con vancomicina oral. Al alta, el paciente mantuvo cobertura antibiótica con azitromicina y tedizolid durante seis meses desde la cirugía, finalizando en marzo de 2022, con la infección ya resuelta.
Comentarios
La malakoplakia es un cuadro inflamatorio que se produce por la destrucción incompleta de los microorganismos por el sistema mononuclear fagocítico, probablemente en el contexto de alteraciones en el funcionamiento de los lisosomas. En este contexto, se pueden evidenciar los cuerpos de Michaelis-Gutman, patognómonicos de esta entidad, como consecuencia del depósito de calcio y hierro sobre los residuos bacterianos [1]. Una causa muy frecuente de esta entidad es la infección por Rhodococcus equi.
El Rhodococcus equi es un cocobacilo gram positivo intracelular aerobio obligado, relacionado con la familia Nocardia y Corynebacteriaciae que suele causar infecciones en los animales domésticos [2]. En el ser humano, la enfermedad afecta casi exclusivamente a pacientes inmunosuprimidos, principalmente VIH positivo y, en menor medida, a pacientes trasplantados con una alta carga de inmunosupresión [1]. La infección se transmite por inhalación, ingesta o contacto directo a través de lesiones [2]. En el caso de nuestro paciente, no refirió contacto reciente con animales domésticos y desconocemos el origen de la infección.
La afectación clínica más frecuentemente descrita en el paciente portador de trasplante renal es la pulmonar, en forma de neumonía necrotizante, en hasta en un 80% de los casos [3]. De esta forma, en la mayoría de los pacientes, el cuadro cursa con febrícula, tos, dolor torácico y disnea [1][4]. En un porcentaje pequeño de casos, la infección puede cursar con abscesos extrapulmonares por diseminación hematógena del patógeno a cerebro, hueso o tejido subcutáneo, lo que puede favorecer las recidivas [2][3][5] o con artritis séptica, como hipotetizamos que ocurrió al inicio de nuestro caso. La mediana de tiempo desde el trasplante hasta la aparición del cuadro es variable, aunque oscila en torno a los 48 meses según las series publicadas [3].
El diagnóstico de esta entidad constituye en muchos casos un reto, por un lado, dada su baja incidencia en el paciente portador de trasplante renal y por el otro, por la baja sensibilidad de los hemocultivos, al objetivarse bacteriemia en sólo el 25% de los pacientes [3]. Además, al tratarse de una bacteria de crecimiento lento, pueden tardar hasta 7 días en aislarse [4] y su baja incidencia hace que pueda interpretarse como un contaminante. Por ello, es útil detectar malakoplakia en el tejido pulmonar mediante biopsia [5]
La información de que disponemos con respecto al tratamiento procede de casos clínicos publicados en la literatura y no existen guías al respecto [2]. Generalmente, se han empleado regímenes prolongados (en torno a los 6 meses) de combinaciones de dos antibióticos con actividad frente al microorganismo (principalmente, fluoroquinolonas, macrólidos, carbapenémicos o rifampicina [1][3][4], presentando al menos uno de los dos antibióticos actividad intracelular [2]. En el caso de pacientes trasplantados, se puede plantear minimizar la carga de inmunosupresión, mediante retirada o reducción de la dosis del antimetabolito, aunque se debe individualizar según las características del paciente [2][4].
Una causa frecuente de resistencia a antibióticos, como fue nuestro caso, es la aparición de malakoplakia. En esos casos, o en aquellos en los que se produzcan complicaciones locales tales como abscesos o cavidades, puede ser necesaria la resección de la lesión mediante lobectomía o resección parcial para conseguir la resolución de la infección. Dicha intervención, según las diferentes series se ha llegado a describir en hasta el 50% de los pacientes, con buenos resultados en el postoperatorio [1][3]. El caso presentado es paradigmático de este tipo de abordaje al tratarse de una infección en la que el tratamiento antibiótico prolongado no fue eficaz, pese a la sensibilidad del microorganismo a la cobertura empleada.
Bibliografía
[1] Nickel IC, Boys JA, Dill EA, Weder MM, Krupnick AS, Walters DM. Pulmonary malakoplakia secondary to Rhodococcus equi infection mimicking a lung neoplasm in a lung transplant recipient. Am J Transplant. 2019;19(2):597-600. doi:10.1111/ajt.15045.
[2] Speck D, Koneth I, Diethelm M, Binet I. A pulmonary mass caused by Rhodococcus equi infection in a renal transplant recipient. Nat Clin Pract Nephrol. 2008;4(7):398-403. doi:10.1038/ncpneph0833
[3] Muñoz P, Burillo A, Palomo J, Rodríguez-Créixems M, Bouza E. Rhodococcus equi infection in transplant recipients: case report and review of the literature. Transplantation. 1998;65(3):449-453. doi:10.1097/00007890-199802150-00031
[4] Alfano G, Ventura P, Fontana F, et al. Rhodococcus equi Pneumonia in Kidney Transplant Recipient Affected by Acute Intermittent Porphyria: A Case Report. Transplant Proc. 2019;51(1):229-234. doi:10.1016/j.transproceed.2018.02.213.
[5] Perez MG, Vassilev T, Kemmerly SA. Rhodococcus equi infection in transplant recipients: a case of mistaken identity and review of the literature. Transpl Infect Dis. 2002;4(1):52-56. doi:10.1034/j.1399-3062.2002.01001.x