Infección fúngica por Scedosporium apiospermum tras el trasplante renal
Introducción
Las infecciones en el trasplante renal (TR) son una causa relevante de morbimortalidad en esta población, siendo el principal factor de riesgo la carga de inmunosupresión [1]. Durante el primer mes postrasplante, las infecciones están relacionadas con gérmenes nosocomiales y las técnicas derivadas del acto quirúrgico, sin embargo, desde el primer al sexto mes postrasplante, éstas son producidas principalmente por la activación de microorganismos oportunistas latentes [2].
La infección por Candida spp representa la micosis más frecuente durante el primer mes posTR, seguida en los meses posteriores por otros hongos como Aspergillus, Cryptococco, Histoplasma entre otros [2] [3]. A pesar de que el Aspergillus sigue siendo la causa más frecuente de enfermedad fúngica invasiva en esta población, el Scedosporium apiospermum representa el 25% de las infecciones por hongos filamentosos diferentes al que no sean Aspergillus.
A continuación, presentamos el caso de una paciente con TR en la que en el segundo mes post-TR, presenta enfermedad diseminada por Scedosporium apiospermum, siendo el foco primario el injerto renal.
Caso Clínico
Paciente mujer de 56 años, exfumadora, con antecedentes de artritis reumatoide desde el 2014 tratada con corticoides, hipotiroidismo y enfermedad renal crónica de etiología no filiada conocida desde el 2013. Comenzó terapia renal sustitutiva (TRS) en noviembre de 2018 y recibió un TR de donante cadáver en febrero de 2020. La inmunosupresión de inducción fue con basiliximab, tacrolimus, micofenolato de mofetilo y esteroides. Evolucionó con función retrasada del injerto, por lo que se realizó biopsia renal al séptimo día del TR, evidenciándose un rechazo agudo celular de tipo IIA de la clasificación de BANFF-19 que se trató con 3 choques de metilprednisolona de 500 mg i.v. y timoglobulina hasta alcanzar una dosis total acumulada de 9 mg/kg. Fue dada de alta a las dos semanas con creatinina sérica de 1.6 mg/dl. Se prescribió tratamiento inmunosupresor de mantenimiento con tacrolimus (niveles 6.6 ng/ml), micofenolato de mofetilo (2000 mg/día) y prednisona oral (25 mg). Así mismo, iniciamos profilaxis con trimetoprim/sulfametoxazol y valganciclovir.
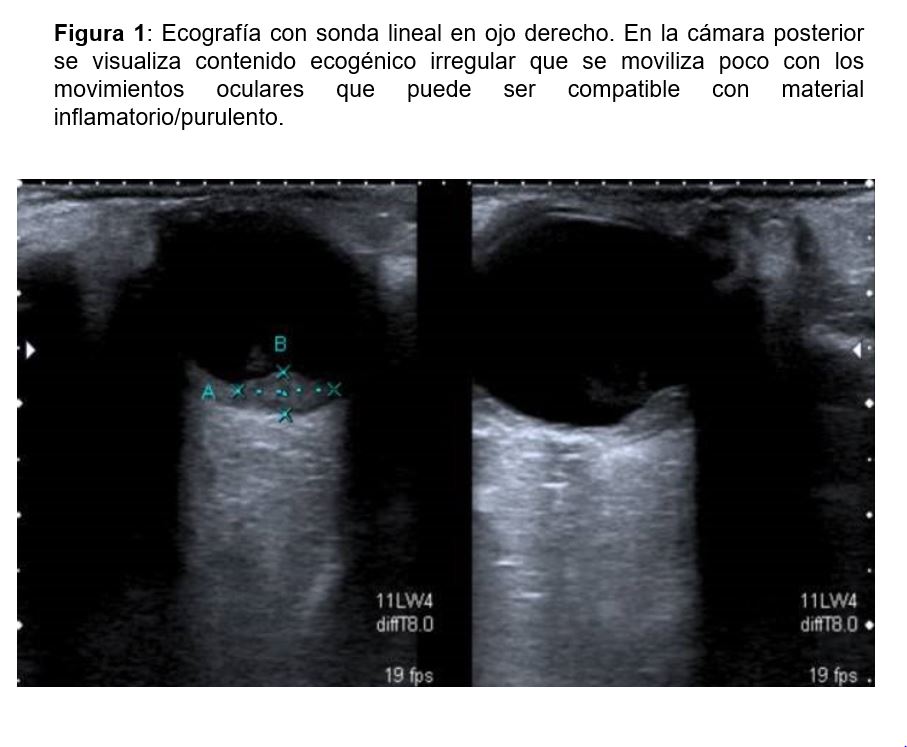
En el seguimiento posterior, presentó inicialmente buena evolución clínica con función renal óptima. En el día 49 después del TR, consultó en urgencias por dolor súbito en el ojo derecho con pérdida de la agudeza visual, astenia, febrícula y mialgias. Se diagnosticó en ese momento de uveítis asociada a la artritis reumatoide. Por este motivo se aumentó la dosis de corticoides (prednisona 60 mg) . Se hizo seguimiento ambulatorio, y ante la ausencia de mejoría se derivó para nueva evaluación oftalmológica con ecografía, diagnosticándose de endoftalmitis secundaria a proceso sistémico (Figura 1).
Ingresó a cargo de Nefrología, consciente y estable hemodinámicamente, pero en pocas horas presentó un empeoramiento clínico y analítico, con anemia, deterioro de la función renal y elevación importante de reactantes de fase aguda que sugería proceso infeccioso. La PCR para SARSCoV2 fue negativa. Se inició tratamiento empírico con piperacilina/tazobactam, linezolid, fluconazol y ganciclovir. Se mantuvo trimetoprim/sulfametoxazol a dosis profilácticas y se redujo la dosis de tacrolimus (niveles 8.7 ng/ml), micofenolato de mofetilo (1500 mg /dia), manteniendo la misma dosis de prednisona.
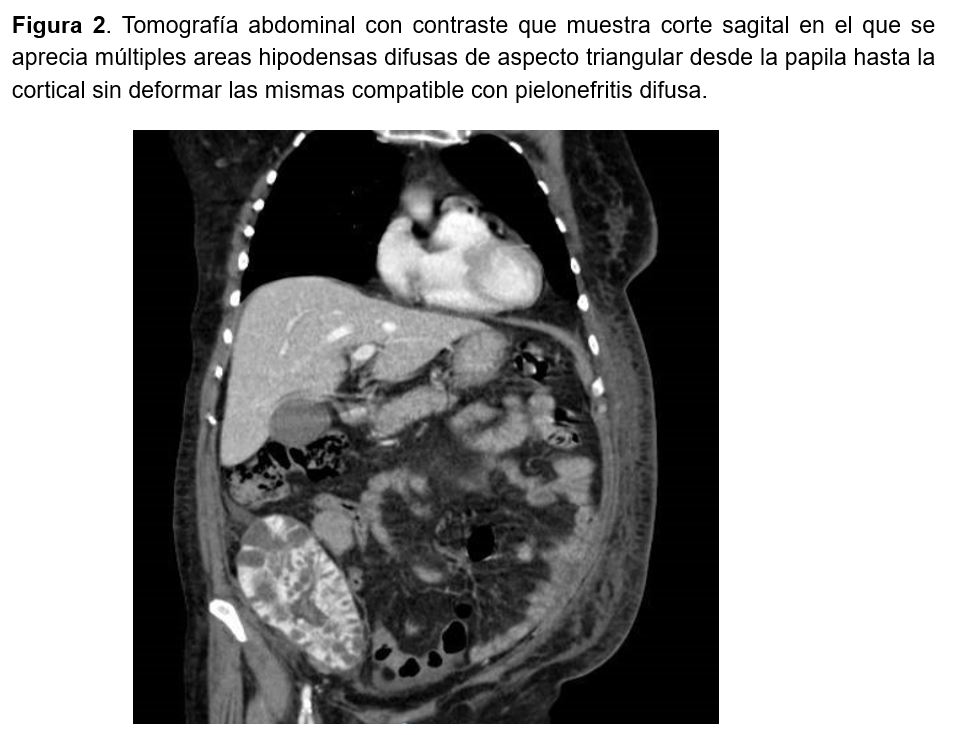
La tomografía de abdomen con contraste mostró múltiples lesiones parenquimatosas de probable origen embolígeno séptico y un injerto renal con múltiples áreas hipodensas difusas de morfología triangular compatibles con pielonefritis (Figura 2). El ecocardiograma transtorácico no mostró datos de endocarditis.
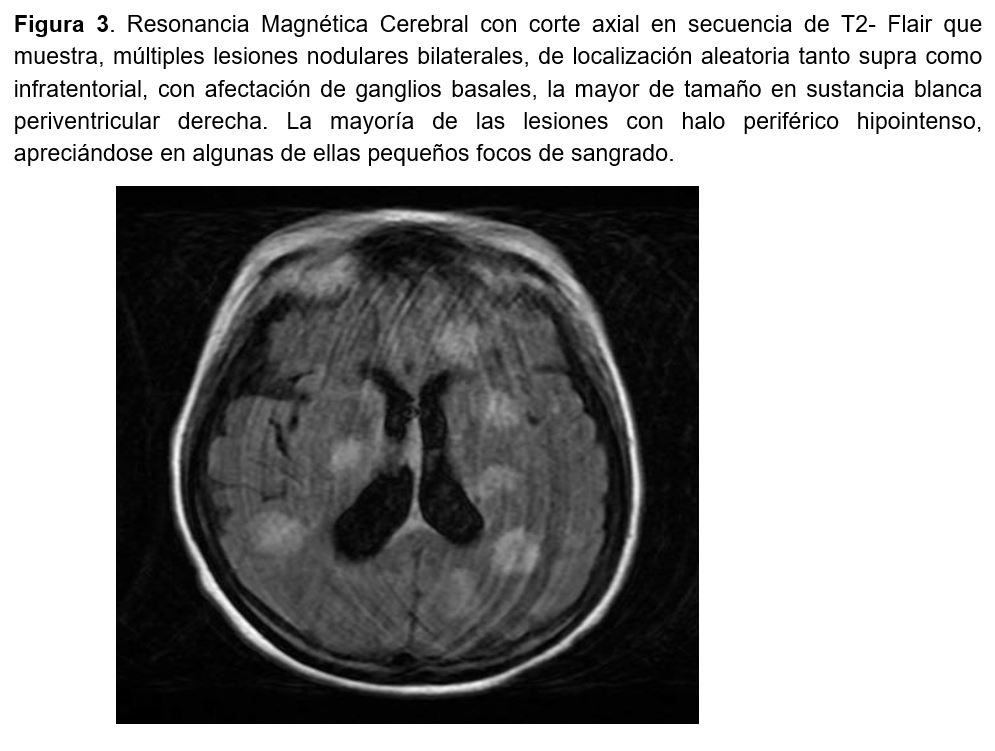
Ante estos hallazgos, se amplió cobertura antimicrobiana con meropenem y anfotericina B liposomal; se prescribió una pauta descendente de corticoides y se suspendió el micofenolato de mofetilo, bajándose dosis tacrolimus tras recibir niveles de 9.4 ng/ml. A pesar de estos cambios presentó rápido deterioro del estado general con disminución de nivel de conciencia y clínica de encefalopatía, requiriendo punción lumbar que fue negativa. Una resonancia magnética cerebral, mostró áreas de abscesos e infartos en ambos parénquimas cerebrales (Figura 3), apuntando como primera probabilidad diagnóstica un proceso infeccioso de origen fúngico.
A los 5 días de su ingreso en planta, precisó traslado a Unidad de Cuidados Intensivos permaneciendo intubada, con necesidad de drogas vasoactivas a bajas dosis y de hemodiafiltración veno-venosa continua. Tres días después, se realizó trasplantectomía ante la sospecha de que el injerto renal fuera el foco infeccioso primario. A pesar de ello, la paciente falleció por fallo multiorgánico y cuadro séptico embolígeno con mala respuesta al tratamiento.
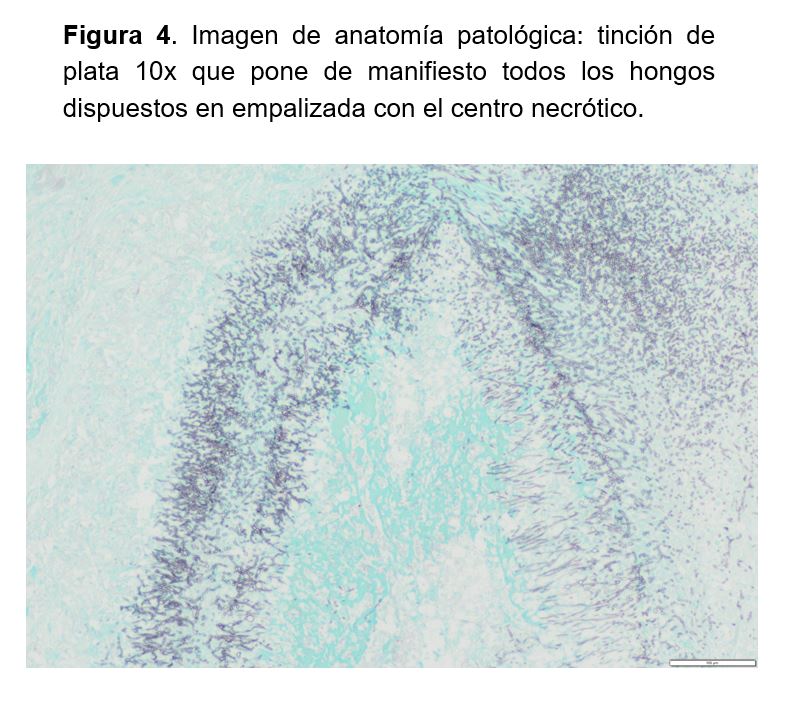
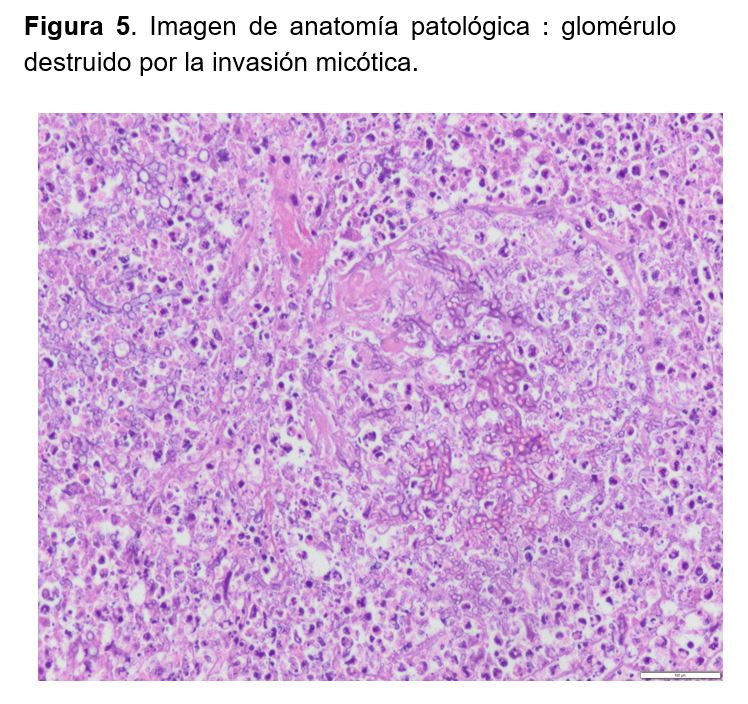
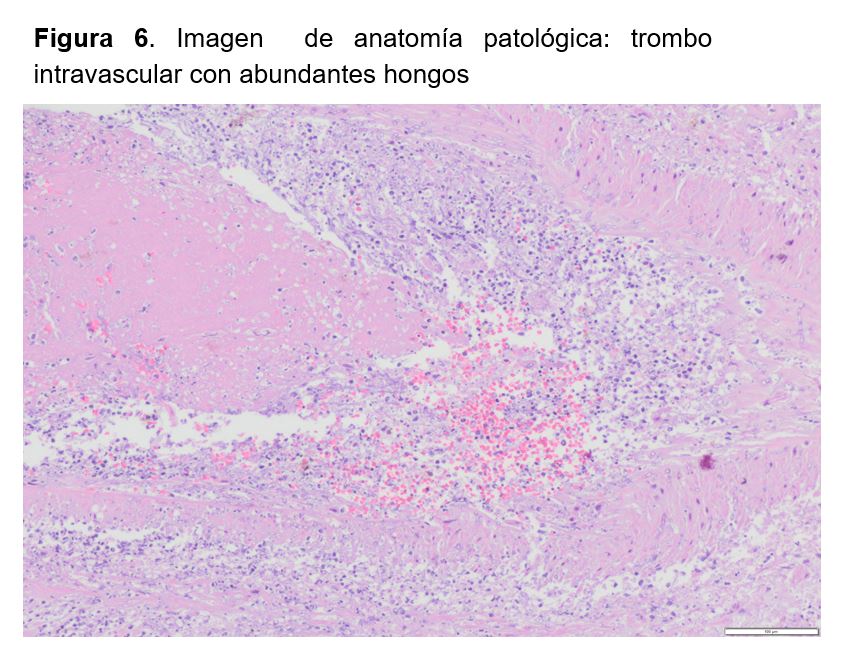
Todos los estudios complementarios para aislamientos de patógenos fueron negativos y sólo en el cultivo de los múltiples abscesos del injerto renal se logró asilar Scedosporium apiospermum. En la descripción histopatológica de la pieza quirúrgica se describía un injerto renal con múltiples áreas abscesificadas con contenido micótico filamentoso y trombos intravasculares e infartos isquémicos parenquimatosos compatible con aspergilosis angioinvasiva del injerto renal (Figura 4) (Figura 5) (Figura 6).
Discusión
Si bien la infección por Scedosporium apiospermum puede presentarse en personas inmunocompetentes, es más frecuente en la población inmunosuprimida y dentro de ella en pacientes trasplantados y en aquellos que reciben terapia con corticoesteroides. En el caso de nuestra paciente, se cumplían ambas circunstancias [4]. El hongo tiene una distribución a nivel mundial y se encuentra en el suelo, macetas, alcantarillas, aguas estancadas, estiércol, aves domésticas y ganado. La paciente convivía con perros y había estado en contacto con caballos, aunque no queda del todo claro que esto hubiese sido la fuente de infección. Sus colonias crecen rápidamente y forman hifas tabicadas ramificadas de forma cilíndrica, logrando la transmisión a humanos por medio de la inhalación de esporas o a través de punción cutánea por inoculación directa [5].
Los trasplantes de órganos sólidos más afectados por este microorganismo son en orden de frecuencia: el pulmonar, cardiaco, hepático y el renal, este último con una incidencia del 0.05%. Coincide el caso presentado con los hallazgos descritos en la literatura, ya que el tiempo medio de la infección desde el trasplante suele ser de 4 meses, y la forma de presentación más frecuente y mortal es la forma diseminada (46%), seguida de la pulmonar (43%), dérmica (31%) y del sistema nervioso central (29%) en forma de abscesos cerebrales, que incluso con la terapia con azoles y el drenaje de los mismos la mortalidad es mayor del 50%. También se han reportado casos de sinusitis, osteomielitis y endoftalmitis [4].
Para el diagnóstico etiológico, el cultivo específico puede tardar varios días en aislar el patógeno. En el diagnóstico diferencial histopatológico esta infección es casi indistinguible de otros hongos filamentosos, por lo que si la sospecha es alta se puede realizar PCR específica. El diagnóstico diferencial más frecuente suele ser con Aspergilllus, tal y como se planteó inicialmente con nuestra paciente, sin embargo, hay que destacar que mientras el Aspergillus es sensible a anfotericina B, el Scedosporium apiospermum es resistente a la misma, lo cual junto con la baja sospecha etiológica y la dificultad para su aislamiento, hace que la mortalidad por este hongo sea muy elevada. Actualmente el tratamiento es con voriconazol. Sin embargo, incluso con tratamiento dirigido, la mortalidad sigue siendo mayor al 50% [6] [7] .
En general, tras el TR se debe mantener un balance entre terapia inmunosupresora y riesgo de infecciones oportunistas que pongan en peligro la supervivencia de injerto y del paciente, especialmente en los enfermos con antecedentes personales como los de nuestra paciente. Por ello, debe individualizarse en cada caso el tratamiento inmunosupresor, y no es posible generalizar un esquema a seguir de manera global en esta población específica.
En el caso que aquí describimos, al riesgo de la inmunosupresión de inducción y mantenimiento del TR, se añadió la presencia de un rechazo celular de tipo IIA, por el que fue necesario usar altas dosis de corticoesteroides y timoglobulina. Esto condicionó un grado de inmunosupresión aún mayor que posiblemente favoreció la infección por este hongo y la evolución tórpida, llevando al fallecimiento de la paciente.
La forma de presentación diseminada, la rápida progresión del cuadro clínico, la escasa respuesta a terapia antimicrobiana de amplio espectro y la dificultad para el aislamiento en los cultivos del agente infeccioso implicado, nos deben hacer sospechar el diagnóstico de infección fúngica. Posteriormente, la resistencia a la anfotericina B descarta a priori la infección por Aspergillus. En este caso acabamos confirmando una pielonefritis del injerto renal por Scedosporium apiospermum como probable foco primario, que originó una infección diseminada.
Aunque se trata de un diagnóstico raro y poco frecuente, presenta una mortalidad muy elevada, por lo que ante casos de presentación similar en pacientes trasplantados, en especial en aquellos con gran carga de inmunosupresión, se debe considerar esta patología en el diagnóstico diferencial para tomar actitud rápida y proactiva de forma dirigida con el fin de lograr la supervivencia del paciente.
Conclusión
Las infecciones fúngicas representan una causa considerable de morbimortalidad en los pacientes con TR. El Scedosporium apiospermum es un hongo filamentoso que causa enfermedad invasiva de manera preferente en pacientes con TR recientes que han recibido alta carga inmunosupresora, lo que hace necesario la sospecha de este patógeno en este grupo de población para evitar el alto riesgo de mortalidad y en lo posible la supervivencia del injerto.
Bibliografía
1. Montejo, M., Muñiz, M. L., Zárraga, S., Aguirrebengoa, K., Amenabar, J. J., López-Soria, L., & Gonzalez, R. (2002). Case reports. Infection due to Scedosporium apiospermum in renal transplant recipients: A report of two cases and literature review of central nervous system and cutaneous infections by Pseudallescheria boydii/Sc. apiospermum. Mycoses, 45(9-10), 418-427. https://doi.org/10.1046/j.1439-0507.2002.00790.x
2. Lerma EV, Sparks MA, Topf JM. Posttrasplant Infections. In: Thomas B, Weir MR, editors. Nephrology Secrets, Philadelphia: PA: Elsevier; 2019, p. 418-423.
3. Feehally J, Floege J, Tonelli M, Johnson RJ. Medical Managment of the Kidney Transplant Recipient: Infectiones and Malignancies. In: Pham PT, Schaenman J, Pham PT, editors. Comprehensive Clinical Nephrology, New York: Elsevier inc; 2019, 1198-1212.
4. Sharma, A., & Singh, D. (2015). Scedosporium apiospermum causing brain abscess in a renal allograft recipient. Saudi Journal of Kidney Diseases and Transplantation: An Official Publication of the Saudi Center for Organ Transplantation, Saudi Arabia, 26(6), 1253-1256. https://doi.org/10.4103/1319-2442.168664
5. Epidemiology, clinical manifestations, and diagnosis of Scedosporium and Lomentospora infections - UpToDate. (n.d.). Retrieved March 23, 2021, from https://ws003.sspa.juntadeandalucia.es:2060/contents/epidemiology-clinical-manifestations-and-diagnosis-of-scedosporium-and-lomentospora-infections?search=Scedosporium apiospermum&topicRef=2429&source=see_link
6. Centellas Pérez, F. J., Martínez Antolinos, C., Piqueras Sánchez, S., Lorenzo González, I., Llamas Fuentes, F., & Gómez Roldán, C. (2019). Scedosporium apiospermum infection in a kidney transplant recipient. Revista Iberoamericana de Micologia, 36(1), 48-50. https://doi.org/10.1016/j.riam.2018.10.005
7. Torres-Sánchez, M. J., Hernández-García, E., Gómez-Sánchez, J., Palomares-Bayo, M., Peña-Ortega, M., Galindo-Sacristán, P., De Gracia-Guindo, C., & Osuna-Ortega, A. (2018). Severe Scedosporium apiospermum Infection in a Recent Renal Transplant Recipient: Case Report. Transplantation Proceedings, 50(2), 683-684. https://doi.org/10.1016/j.transproceed.2017.09.051