Complicación infecciosa post trasplante renal
Introducción:
Las complicaciones infecciosas postrasplante renal (NAD: ver Infecciones en el trasplante renal) son la segunda causa de muerte en los pacientes trasplantados, tras la enfermedad cardiovascular y seguido de cerca por las neoplasias. A pesar del desarrollo de antimicrobianos cada vez más potentes, la adaptación y resistencia de los microorganismos a dichos fármacos y la situación constante de inmunosupresión siguen suponiendo un factor de riesgo para el desarrollo de complicaciones infecciosas graves.
El periodo postrasplante inmediato, entre 1-6 meses, supone el momento de mayor inmunosupresión y, por tanto, de riesgo para el desarrollo de infecciones por microorganismos oportunistas. Comentamos el caso de un paciente con una complicación infecciosa al inicio de dicho periodo.
Exposición del caso:
Varón de 58 años que ingresa en nefrología derivado desde las consultas de trasplante renal por un cuadro de disnea de mínimos esfuerzos, asociando ortopnea y ganancia ponderal de 4 kg en la última semana. El paciente niega disminución del ritmo de diuresis o alteraciones en la orina. Refiere además tos con expectoración sin fiebre, desde hace 3 días. No asocia otra sintomatología.
En sus antecedentes destacan ERC secundaria a nefroangioesclerosis e hipoplasia de riñón derecho diagnosticado hace 7 años, requiriendo inicio de diálisis peritoneal a los 6 años del diagnóstico. Por falta de adaptación a la técnica, se cambia a hemodiálisis a través de un catéter yugular en ese mismo año. Un mes antes del ingreso actual, recibe un trasplante renal de donante cadáver. Se pauta inmunosupresión de inducción con basiliximab y de mantenimiento con tacrolimus, micofenolato de mofetilo y corticoesteroides. Desde el trasplante, permanece con tratamiento profiláctico con sulfametoxazol/trimetoprim y enjuagues orales con nistatina. Presenta buena evolución con descenso de productos nitrogenados al primer día postrasplante, siendo la creatinina al alta de 1,7 mg/dL.
Como otros antecedentes destacan una cardiopatía isquémica crónica con enfermedad coronaria no significativa y fracción de eyección preservada desde hace 4 años, dislipemia y síndrome de apnea-hipopnea del sueño con CPAP nocturna.
En el momento del ingreso, el paciente está hemodinámicamente estable, con TA de 120/80 mmHg, taquicardia sinusal a 120 lpm, saturación de oxígeno basal del 91% y afebril. Se evidencia ingurgitación yugular a 30º, hipoventilación en base pulmonar izquierda con crepitantes en la base derecha y edemas con fóvea hasta rodillas. La exploración abdominal es anodina.
En los análisis, presenta una función renal sin cambios respecto a su basal, con creatinina sérica de 1,7 mg/dL, sin alteraciones iónicas, gasométricas o hepáticas. En el hemograma, destacan una anemia con hemoglobina de 9,7 g/dL, trombopenia leve de 145000 plaquetas/mm3 y leucopenia de 3800 leucocitos/mm3. El estudio de anemia no muestra déficits corregibles y en el frotis sanguíneo, plaquetas y linfocitos están activados sin otras alteraciones destacables. Los niveles de tacrolimus son de 9,8 ng/mL.
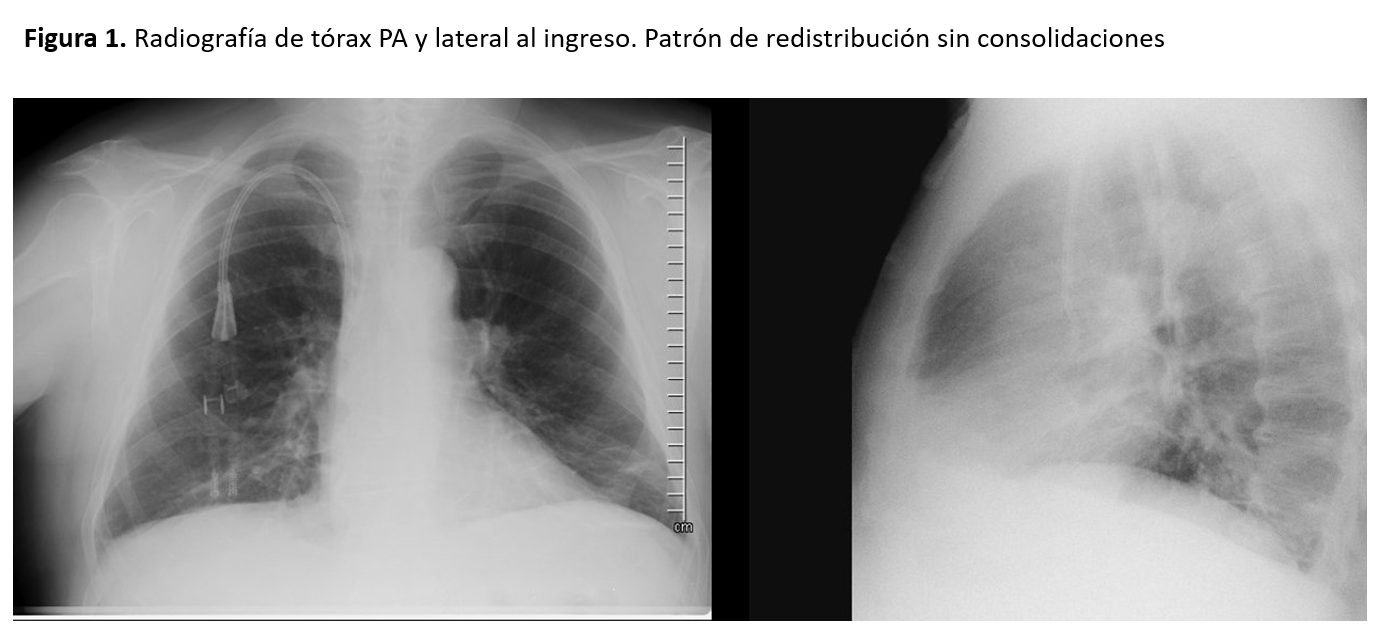
La radiografía de tórax (Figura 1) al ingreso presenta un patrón de redistribución vascular sin consolidaciones de nueva aparición.
Ante la sospecha de episodio de insuficiencia cardiaca descompensada por una infección respiratoria no consolidativa, se inicia tratamiento intravenoso con diuréticos mientras se solicitan cultivos microbiológicos de sangre, orina y esputo, y se inicia antibioterapia empírica con levofloxacino.
A pesar de la antibioterapia y balance negativo adecuado, presenta mala evolución respiratoria. Se descarta la posibilidad de tromboembolismo pulmonar agudo a través de angioTC, donde se evidencian imágenes en vidrio deslustrado en lóbulo inferior izquierdo, compatible con un proceso inflamatorio/infeccioso.
Los hemocultivos y antigenurias para Legionella y neumococo fueron negativos. Ante la sospecha de neumonía por microorganismos atípicos, se solicitan serologías en sangre de Pneumocystis jiroveci, Aspergillus, VIH y virus hepatotropos con resultado negativo, además de carga viral en suero de virus BK, citomegalovirus (CMV), parvovirus y exudado nasofaríngeo para virus influenza. A la espera de resultados se solicita fibrobroncoscopia para toma directa de muestras en broncoaspirado y lavado broncoalveolar y se amplia cobertura antibiótica con piperacilina-tazobactam.
Del estudio microbiológico realizado se obtuvo carga viral positiva para CMV, tanto en plasma (2.070.000 copias/ml), como en el lavado broncoalveolar de (370.000 copias/ml) por lo que se suspende tratamiento con micofenolato y se inicia tratamiento intravenoso con ganciclovir.
Tras el inicio de tratamiento, presenta un descenso progresivo de la carga viral en suero hasta su negativización con mejoría clínica a nivel respiratorio. Sin embargo, la función renal empeora hasta alcanzar creatinina de 4,8 mg/dL, con necesidad de reinicio de sesiones de hemodiálisis. En la biopsia renal del injerto se objetiva posible rechazo agudo, iniciándose bolos de 6-metilprednisolona. Lamentablemente el paciente presenta un cuadro de trombosis venosa del injerto a los 3 días que requiere trasplantectomía urgente.
Comentarios:
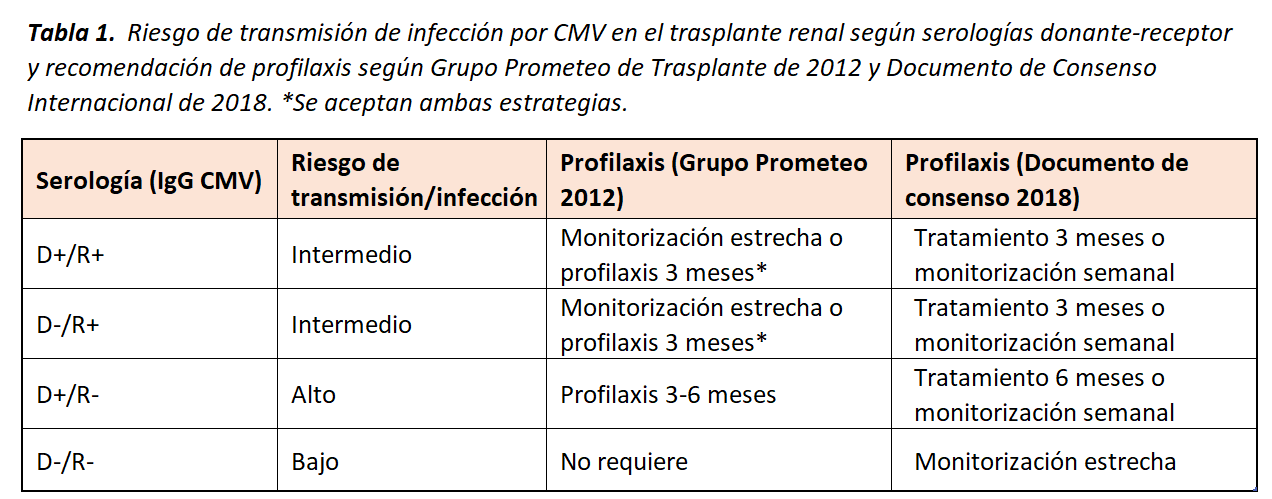
La infección por CMV es una de las enfermedades infecciosas oportunistas más frecuentes durante el primer año postrasplante renal. El mayor riesgo se da: 1) en los pacientes con serología previa para CMV negativa, como es el presente caso, siendo de curso más agresivo la primoinfección respecto a la reactivación viral, y 2) si la inmunosupresión de inducción recibida incluye anticuerpos antilinfocitarios. Para prevenir esta complicación se han establecido una serie de criterios en el uso de profilaxis en el postrasplante renal inmediato en función de las serologías de CMV previas al trasplante (Tabla 1) y también se recomienda profilaxis con valganciclovir por 1-3 meses si reciben anticuerpos antilinfocitarios.
En el caso clínico actual, el paciente presentaba un riesgo bajo de transmisión de CMV, dado que tanto el donante como receptor tenían serologías negativas pretrasplante y no había recibido un tratamiento de inducción agresivo, por lo que no requería profilaxis de mantenimiento. A pesar de ello, el paciente presentó una enfermedad por CMV al mes postrasplante que cursó en forma de neumonía.
Ante un paciente trasplantado con neumonía o infección respiratoria no consolidante durante el postransplante temprano (1-6 meses), el diagnóstico diferencial y la cobertura antimicrobiana empírica debe incluir la posibilidad de microorganismos atípicos, dado el alto riesgo de infecciones oportunistas. En nuestro caso, recibía desde el trasplante profilaxis universal con cotrimoxazol/trimetoprim que suponía cobertura para infección por Pneumocistis Jirovecii. La cobertura antibiótica iniciada al ingreso con levofloxacino suponía incluir tratamiento contra patógenos atípicos como micobacterias, para bacterias gram positivas y Pseudomona Aeruginosa (considerando la exposición reciente a ambiente hospitalario durante el ingreso del trasplante renal). No obstante, presentó un empeoramiento clínico progresivo que hacía sospechar una cobertura insuficiente y obligó a pruebas diagnósticas más precisas para dirigir el tratamiento antimicrobiano. En esta situación, está indicada la realización de broncoscopia diagnóstica con obtención de muestras respiratorias (lavado broncoalveolar y broncoaspirado) para cultivos directos y determinación por técnicas de PCR en secreciones de posibles microorganismos etiopatogénicos. Tras la realización de la prueba se obtuvo replicación viral, tanto en sangre periférica como en líquido respiratorio, de CMV, justificando el cuadro clínico y logrando el diagnóstico de neumonía por CMV.
Ante una determinación positiva de CMV en sangre periférica se distinguen dos entidades distintas: infección por CMV o enfermedad por CMV. Se considera infección por CMV a la detección de replicación viral en el organismo, sin sintomatología asociada. En contraposición, se considera enfermedad por CMV a la infección por CMV asociada a síntomas clínicos compatibles. Los síntomas son variables en función del órgano afectado. Lo más habitual es una clínica inespecífica de malestar general con fiebre, acompañada de leucopenia en análisis de control. En caso de enfermedad invasiva, el órgano más frecuentemente afectado es el intestino, donde puede cursar con síntomas digestivos inespecíficos, hepatitis leve con aumento de transaminasas, o de forma más agresiva en forma de esofagitis invasiva o colitis hemorrágica. Es menos habitual en el trasplante renal la afectación respiratoria en forma de neumonía, como en nuestro caso, que es más frecuente en pacientes con trasplante de médula ósea.
En ocasiones, el diagnóstico es difícil de alcanzar si la replicación viral está limitada al órgano afectado, ya que es posible que la carga viral de CMV en sangre periférica sea negativa con cuantificación en la muestra del tejido afecto (respiratoria o intestinal) altamente positiva. Por ello se recomienda en caso de alta sospecha, obtener muestras del órgano afectado y realizar cuantificación directa en tejido para alcanzar el diagnóstico.
Una vez alcanzado el diagnóstico, el tratamiento de la enfermedad por CMV consiste en descenso del tratamiento inmunosupresor, habitualmente suspensión de micofenolato de mofetilo, e inicio de ganciclovir intravenoso. Se reserva el tratamiento con valganciclovir oral para los casos de infección por CMV leve o asintomática. La mayor parte de pacientes responden correctamente al tratamiento dirigido. Sin embargo, entre un 5-12% pueden desarrollar resistencias, obligando a la búsqueda de tratamientos alternativos.
Independientemente de la respuesta al tratamiento, se han descrito una serie de efectos indirectos a la infección por CMV, que incluyen el aumento de riesgo de sobreinfección por otros patógenos oportunistas y el de rechazo agudo y crónico del injerto renal. Aunque la evidencia que relaciona el rechazo y la infección por CMV es baja, es lógico considerar que las modificaciones que genera el CMV sobre el sistema inmunológico, así como el descenso de inmunosupresión asociado a su tratamiento, puedan influir en el desarrollo de rechazo del injerto como resultó en nuestro paciente.