Enteritis por Virus de Epstein-Barr en trasplante renal
Introducción:
El virus de Epstein-Barr (VEB) es un virus ubicuo con una seroprevalencia superior al 90% en adultos. Tras la infección, permanece en los linfocitos B de por vida sin evidencia de replicación o actividad; sin embargo, en situaciones con alteración de la inmunidad celular, como en el trasplante renal, la posibilidad de replicación aumenta y con ello el riesgo de síndromes clínicamente relacionados como los trastornos linfoproliferativos. Otras presentaciones son muy raras y generalmente ocurren en pacientes con una carga inmunosupresora elevada [1][2]
Presentamos el caso de un varón de 32 años, receptor hiperinmunizado de un tercer trasplante renal, con antecedente de microangiopatía trombótica secundaria al tratamiento inmunosupresor y tratamiento activo con belatacept que desarrolla una enteritis por virus de Epstein-Barr.
Exposición del caso
Paciente varón de 32 años con antecedentes médicos de:
• Enfermedad renal crónica (ERC) desde los 18 meses de edad, secundaria a síndrome hemolítico urémico (SHU) recurrente por infección por E. coli. Inicio de hemodiálisis en el año 2000 (a los 7 años).
• Primer trasplante renal de donante cadáver en 2001. Episodio de rechazo agudo de predominio intersticial en 2002. Reinicio de hemodiálisis en 2004 por disfunción crónica del injerto.
• Segundo trasplante renal de donante cadáver en 2005. Presentó varios episodios de rechazo celular agudo (IB según clasificación de Banff) y reanudó hemodiálisis en 2016 debido a una disfunción crónica del injerto.
• Tercer trasplante renal de donante vivo en 2016. Inmunosupresión en base a tacrolimus + micofenolato + esteroides. Presentó un episodio de rechazo vascular agudo (IIA) en 2016 y una biopsia en 2019 compatible con fibrosis intersticial y atrofia tubular (IFTA) leve. Desarrollo de condilomas anales secundarios a infección por virus del papiloma humano (VPH), lo que motivó el cambio de ácido micofenólico a inhibidores de mTOR (everolimus).
En enero de 2023 sufrió un episodio de microangiopatía trombótica grave con afectación hematológica y renal relacionada con el tratamiento inmunosupresor (everolimus y tacrolimus). La biopsia renal confirmó el diagnóstico y mostró además toxicidad leve por inhibidores de calcineurina (ICN) con aumento del grado de IFTA. Como consecuencia, se suspendieron tacrolimus y everolimus temporalmente, iniciándose tratamiento con belatacept (IgG VEB positiva), inmunoglobulinas y dosis más altas de esteroides, consiguiendo una mejoría progresiva de la función renal hasta alcanzar una creatinina de 1,6-1,8 mg/dl y normalización de los parámetros hematológicos y de hemólisis intravascular.
El estudio genético reveló, meses más tarde, un haplotipo de riesgo en heterocigosis para SHU atípico en el gen CD46 sin presentar variantes genéticas patogénicas en los genes causantes de SHU atípico, por lo que dadas las lesiones histológicas asociadas de toxicidad por ICN se decidió la suspensión definitiva de tacrolimus y se reintrodujo el tratamiento con inhibidores mTOR, manteniendo las administraciones mensuales de belatacept, al tratarse de un paciente hiperinmunizado. Tras el inicio de everolimus no se evidenció recurrencia de microangiopatía trombótica.
En julio de 2023, ingresó en Nefrología por un cuadro de diarrea severa con aproximadamente 10 deposiciones diarias líquidas y dolor abdominal, acompañado de fiebre intermitente de bajo grado. Los análisis no mostraron hemólisis, alteraciones del perfil hepático ni deterioro de la función renal (creatinina basal 1,8 mg/dl, TFG 48 ml/min), con elevación leve de marcadores inflamatorios (PCR 37,4 mg/L) y niveles de everolimus dentro del rango objetivo.
El examen físico reveló febrícula (37,6ºC) con el resto de las constantes en rango. A la exploración abdominal se objetivaba dolor leve en flanco izquierdo, sin edema en extremidades inferiores ni signos de sobrecarga de volumen.
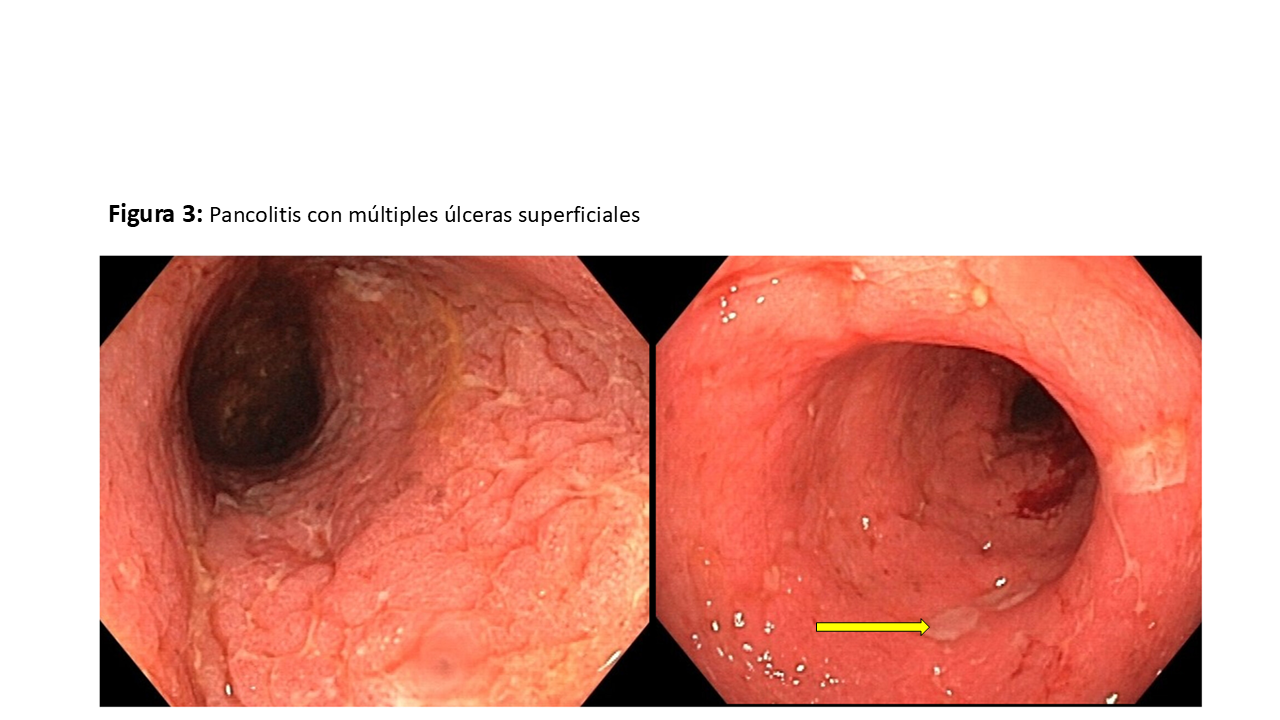
El estudio microbiológico en heces (bacterias, virus, parásitos) resultó negativo. La ecografía abdominal evidenció un asa intestinal parética y engrosada en el flanco izquierdo. Se solicitó una colonoscopia, que reveló pancolitis con múltiples úlceras superficiales (<5mm) sugestivas de colitis infecciosa. Las biopsias de las úlceras y un panel viral en sangre mostraron finalmente replicación del VEB en suero (13,100 UI/ml) siendo negativos para el resto de virus solicitados.
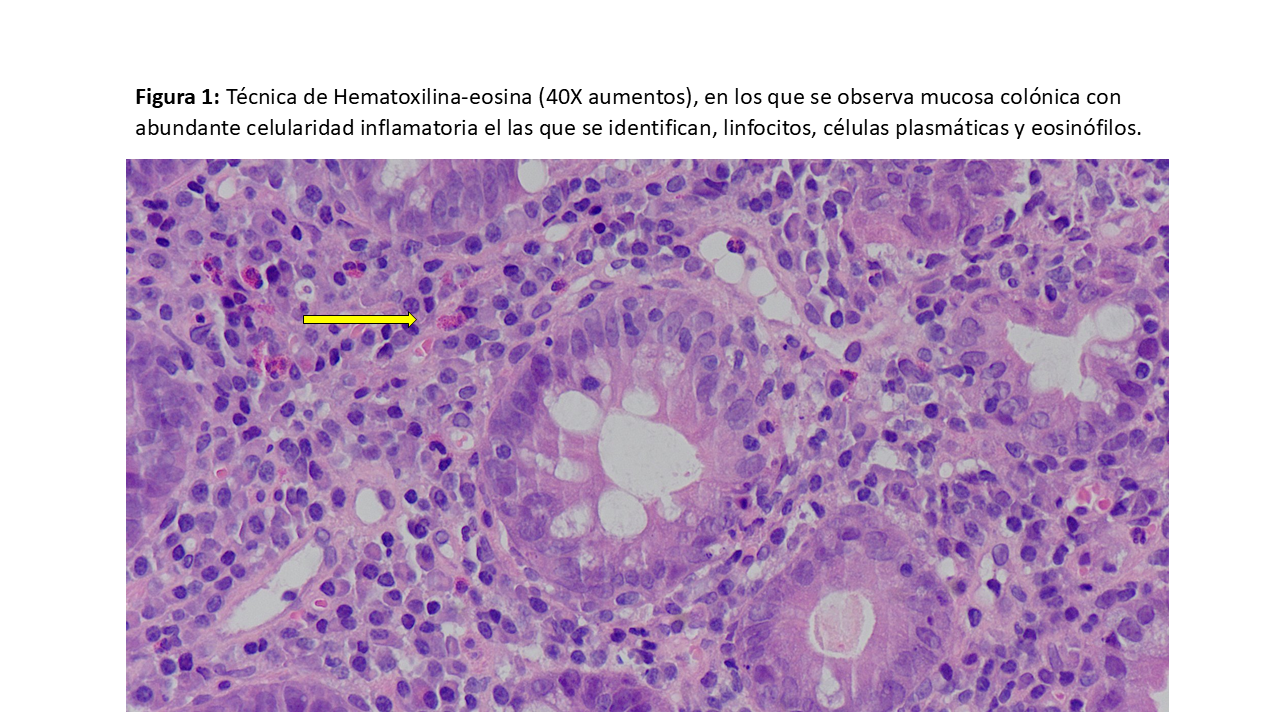
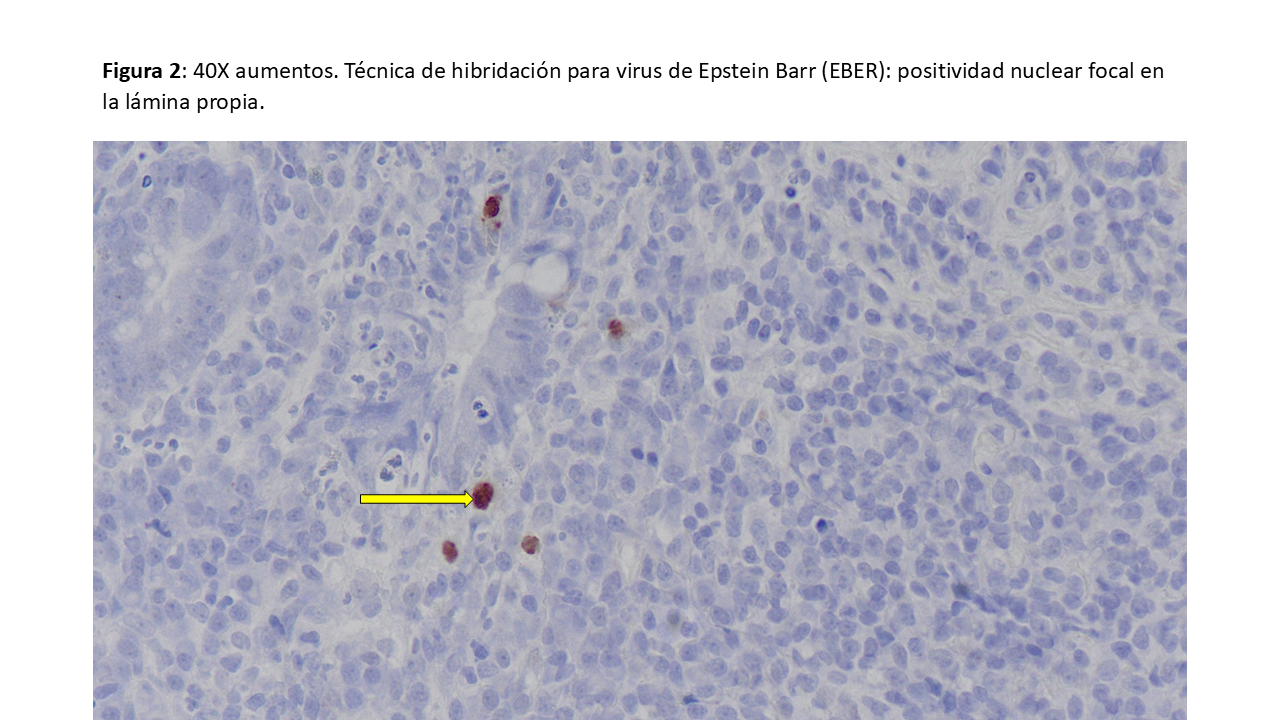
En la biopsia intestinal se observan una mucosa colónica con abundante celularidad inflamatoria (Figura 1), replicación activa del VEB (Figura 2) y pancolitis con úlceras superficiales (Figura 3).
Se inició tratamiento con aciclovir intravenoso (250 mg cada 8 horas), logrando mejoría clínica con reducción de las deposiciones a 3/día en el momento del alta. Se realizó conversión a terapia oral por 21 días, con negativización de la carga viral en suero a la semana del inicio de tratamiento.
Respecto a la inmunosupresión, debido a la replicación positiva del VEB y el riesgo de complicaciones oncohematológicas, se suspendió belatacept. Se optó por optimizar el tratamiento inmunosupresor con aumento de esteroides (prednisona 20 mg/día), everolimus (objetivo 5-7 ng/ml) y administración quincenal de inmunoglobulinas.
En el seguimiento, se realizaron una tomografía computarizada y un PET-TC para descartar trastornos linfoproliferativos, con resultados negativos. Un mes y medio después del inicio de los síntomas y 15 días tras suspender aciclovir, el VEB replicó nuevamente (<3500 copias), por lo que se inició tratamiento con valganciclovir (450 mg/día) por 3 meses, sin nuevos episodios de replicación posteriores.
Actualmente (19 meses después), el paciente mantiene carga viral negativa sin tratamiento dirigido y con resolución completa del cuadro clínico. La inmunosupresión se basa en inhibidores de mTOR como agente principal (niveles 6-8) y dosis bajas de ciclosporina (niveles 50-100) debido a su alto riesgo inmunológico, sin evidencia de enfermedad linfoproliferativa postrasplante, microangiopatía trombótica ni episodios de rechazo agudo hasta el momento.
Comentarios
El virus de Epstein-Barr, también conocido como herpesvirus humano tipo 4, es un virus de ADN de doble cadena rodeado por una nucleocápside icosaédrica y una membrana compuesta por las glucoproteínas gp350/220. Su vía de entrada al organismo es la saliva, infectando inicialmente las células epiteliales orofaríngeas para luego invadir los linfocitos B, donde se internaliza a través de los lisosomas y puede fusionarse con el ADN celular directamente o mediante la creación de un episoma [2].
Tras la infección primaria, el virus permanece en estado de latencia en los linfocitos B circulantes. La inmunidad celular desempeña un papel fundamental en la regulación de la activación viral. En este sentido, las situaciones de inmunosupresión—especialmente aquellas que afectan la inmunidad celular, como el trasplante renal—favorecen la reactivación del VEB. Estudios previos han demostrado una mayor incidencia de pérdida del injerto, infecciones oportunistas concomitantes y síndrome hemofagocítico en pacientes trasplantados con alta carga viral de VEB [1].
La complicación más temida del VEB en pacientes inmunosuprimidos es el desarrollo de trastornos linfoproliferativos (Véase Nefrología al día: Infecciones en el Trasplante Renal). Entre los principales factores de riesgo se incluyen las edades extremas, la serología negativa para VEB, el número de incompatibilidades HLA y el grado de inmunosupresión (especialmente el uso de anticuerpos antilinfocitarios, como timoglobulina, o inhibidores de la coestimulación, como belatacept) [2].
No existe un consenso definitivo sobre el manejo clínico. Se considera que, al igual que en otras infecciones en pacientes trasplantados, la reducción de la inmunosupresión es un pilar fundamental en el tratamiento. Inicialmente, se recomienda el cambio de inhibidores de calcineurina por inhibidores de mTOR, aunque los resultados en estos casos son controvertidos. Se han utilizado ganciclovir y aciclovir como tratamientos antivirales, con una eficacia limitada2 (Vease Nefrología al día: Infecciones en el Trasplante Renal).
Por otro lado, debido a la gran cantidad de tejido linfoide asociado a mucosas (MALT) presente en el sistema gastrointestinal, éste constituye un sitio frecuente de infección por el VEB. Sin embargo, las manifestaciones clínicas asociadas son muy poco frecuentes y, en su mayoría, se describen en el contexto de infecciones crónicas activas con replicación viral.
El diagnóstico de enteritis por Epstein-Barr requiere la presencia de síntomas gastrointestinales no explicados por otras causas, hallazgos histológicos compatibles y evidencia de replicación viral activa mediante PCR1. La presentación clínica suele incluir diarrea crónica, hematoquecia y episodios de fiebre intermitente de bajo grado.
Histológicamente, se observa la presencia de úlceras múltiples de diferentes formas y profundidades, que pueden estar acompañadas de eritema o edema, afectando cualquier segmento del colon o intestino delgado [1][3].
Desde el punto de vista microbiológico, la mejor estrategia diagnóstica es la detección del ADN del VEB mediante PCR en tejido, aunque en casos de enfermedad inflamatoria intestinal también puede detectarse, pero con una carga viral muy baja [4].
Debido a la baja prevalencia de esta patología, existen pocos reportes sobre su tratamiento. Estrategias inmunomoduladoras como el uso de IFN-γ o IL-2, así como agentes anti-CD20 como rituximab, han mostrado resultados poco alentadores. Algunos casos han respondido favorablemente a antivirales como aciclovir o ganciclovir, mientras que otros han sido refractarios al tratamiento [1].
En el caso de nuestro paciente, el cuadro clínico se presentó como un episodio subagudo de diarrea con unas 10 deposiciones líquidas diarias. Ante la persistencia de los síntomas sin aislamiento microbiológico inicial, se realizó una colonoscopia, evidenciando múltiples lesiones ulceradas. Estudios adicionales confirmaron replicación activa del VEB tanto en suero como en biopsia intestinal. Se instauró tratamiento con aciclovir durante 21 días, con mejoría clínica significativa y negativización de la carga viral.
Respecto a la inmunosupresión, este caso ejemplifica la complejidad de su manejo en pacientes altamente sensibilizados con procesos infecciosos intercurrentes. En esta ocasión, el paciente además presentaba antecedentes de microangiopatía trombótica desencadenada por la combinación de inhibidores de calcineurina + inhibidores de mTOR, por lo que estaba en tratamiento con belatacept, pero la replicación del VEB obligó a su suspensión por el alto riesgo asociado de desarrollar enfermedades linfoproliferativas.
Finalmente, y considerando el balance entre la aparición de rechazo vs el riesgo infeccioso se decidió cambiar a ciclosporina a dosis bajas como coadyuvante al imTOR (sirolimus), consiguiendo estabilidad de la función renal, ausencia de episodios de rechazo agudo o recurrencia de microangiopatía trombótica y no reactivación viral hasta el momento actual.
Referencias
1. Shen Y, Wang YF. Chronic active Epstein-Barr virus enteritis: A literature review. J Dig Dis. 2022 May;23(5-6):248-252. doi: 10.1111/1751-2980.13097. Epub 2022 Jun 16. PMID: 35561147.
2. Le J, Durand CM, Agha I, Brennan DC. Epstein-Barr virus and renal transplantation. Transplant Rev (Orlando). 2017 Jan;31(1):55-60. doi: 10.1016/j.trre.2016.12.001. Epub 2016 Dec 29. PMID: 28089555.
3. Liu RB, Wang MY, Zhang LZ, et al. The clinicopathologic features of chronic active Epstein–Barr virus infective enteritis. Mod Pathol. 2019;32(3):387-395.
4. Wakefield AJ, Fox JD, Sawyerr AM, et al. Detection of herpesvirus DNA in the large intestine of patients with ulcerative colitis and Crohn's disease using the nested polymerase chain reaction. J Med Virol. 1992;38(3):183-190.