Recidiva de enfermedad antimembrana basal glomerular en paciente trasplantado renal de larga evolución
INTRODUCCIÓN
La enfermedad anti-membrana basal glomerular (anti-MBG) es una vasculitis de vasos pequeños en la que los anticuerpos circulantes se dirigen contra un antígeno intrínseco de la MBG y la membrana basal alveolar, lo que da lugar a una glomerulonefritis rápidamente progresiva y/o hemorragia alveolar. Se sugieren factores de riesgo para su aparición como el hábito tabáquico y factores ambientales. La recidiva de este cuadro tras el trasplante renal (TR) es aún más rara y parece que median los mismos factores de riesgo que para la enfermedad primaria.
Presentamos el caso de un paciente varón de 40 años TR de larga evolución que presenta una recidiva muy tardía de enfermedad anti-MBG con afectación renal y pulmonar.
EXPOSICIÓN DEL CASO
Varón de 40 años, hipertenso y fumador, diagnosticado en abril del año 2004 de glomerulonefritis rápidamente progresiva con anticuerpos (Ac) anti-MBG positivos sin hemorragia pulmonar, tratado con plasmaféresis, corticoides y ciclofosfamida sin recuperación de la función renal por lo que inicia hemodiálisis en mayo 2004. Recibe un TR de donante fallecido en 2007 presentando un episodio de rechazo agudo mediado por células T tratado con esteroides. Función renal del injerto estable desde entonces (Creatinina plasmática 1,2 mg/dl), no proteinuria ni hematuria, no anemia y Ac anti-MBG negativos anuales. En tratamiento inmunosupresor con tacrolimus, micofenolato y prednisona, con niveles plasmáticos de tacrolimus estables durante el seguimiento.
Acude a urgencias de su hospital de referencia el 26 de agosto 2024 por cuadro de astenia, síncope y hemoptisis.
Analíticamente destaca fracaso renal agudo con creatinina plasmática 5,5mg/dL, hiperpotasemia en rango tóxico y acidosis metabólica severa, hemoglobina 3,3 g/dL, haptoglobina y bilirrubina total normales, Coombs directo negativo, frotis sin esquistocitos, sedimento urinario con proteínas 300/ul, hematíes 300/ul, leucocitos 25/ul y albuminuria en orina de 24h de 23.8 g. Radiografía de tórax con infiltrados algodonosos compatibles con hemorragia pulmonar. No datos de gammapatía monoclonal. C3, C4 e inmunoglobulinas normales. Ac Anti-MBG: 31.8 U/ml (rango normal 0,0 - 20,0 U/ml), ANCA: negativo. Resto autoinmunidad negativa, incluyendo factor reumatoide, crioglobulinas y Ac anti-PLA2R.
Evolución tórpida en las primeras 24 horas requiriendo ingreso en UCI, necesidad de inicio de terapia de reemplazo renal continua (TRRC) e intubación orotraqueal. Se inicia tratamiento el 28 de agosto con bolos de esteroides + plasmaféresis (7 sesiones) + ciclofosfamida IV y se retira antimetabolito permaneciendo en biterapia con tacrolimus + prednisona. Negativización de los Ac anti- MBG tras la quinta sesión de plasmaféresis.
Mala evolución desde el punto de vista respiratorio tras 2 semanas de ingreso en UCI desarrollando una neumonía asociada a ventilación mecánica y precisando traslado a nuestro centro con necesidad de membrana de oxigenación extracorpórea (ECMO). El 30 de septiembre, 34 días tras el inicio del cuadro, presenta nuevo episodio de hemoptisis con Ac anti-MBG negativos, por lo que se decide administrar bolos de metilprednisolona y nueva dosis de ciclofosfamida, no pudiéndose administrar la dosis previa por infección activa grave. En ese momento, se consideró no realizar plasmaféresis por las comorbilidades del paciente y la negatividad de los Ac Anti-MBG, descartándose otras causas de hemorragia alveolar mediante fibrobroncoscopia, lavado broncoalveolar y otros parámetros analíticos.
En los siguientes 10 días, presenta una mejoría desde el punto de vista respiratorio recibiendo una nueva dosis de ciclofosfamida (14 octubre), aunque persistiendo la necesidad de TRRC. Sin embargo, vuelve a presentar nuevo episodio de anemización y hemorragia alveolar con Ac Anti-MBG negativos. Se inician de nuevo bolos de metilprednisolona y, dada la gravedad y aunque los Ac eran negativos, se indican también 5 sesiones de plasmaféresis. Cuando se estabilizaron los parámetros hematimétricos decidimos la realización de biopsia del injerto renal el 23 octubre y administramos Rituximab 1 g el 28 de octubre y Ciclofosfamida IV el 31 de octubre.
Descripción de la biopsia del injerto renal: (23 octubre 2024)
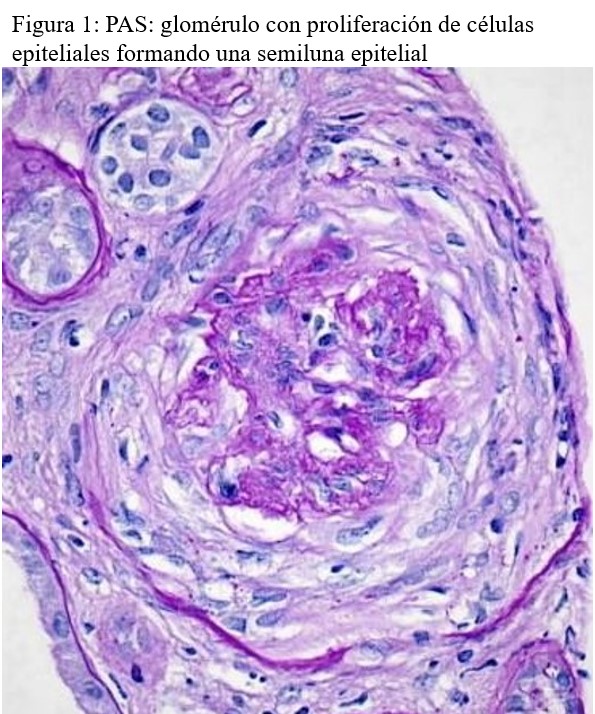
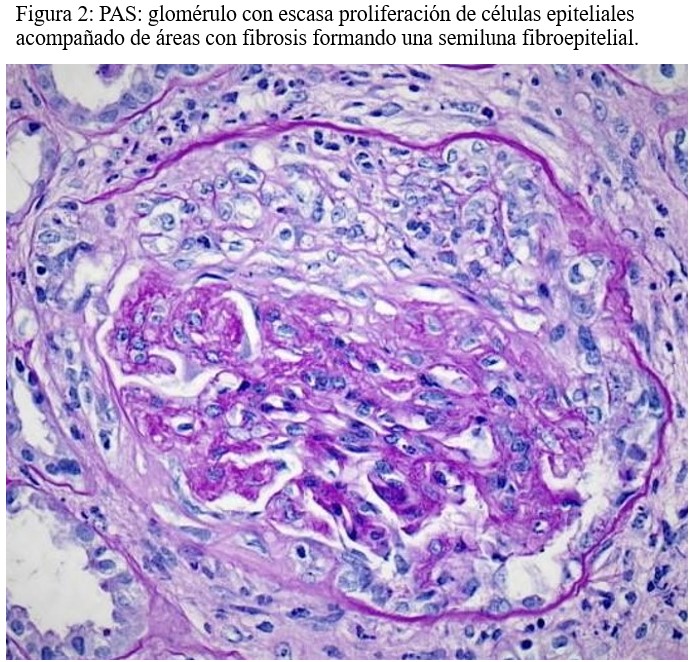
Microscopía óptica: 6 glomérulos de los cuales 2 muestran esclerosis global. Los glomérulos restantes muestran una semiluna fibrosa, una epitelial y dos mixtas. No se identifica necrosis fibrinoide. En el intersticio hay un leve infiltrado inflamatorio mixto, constituido por linfocitos, células plasmáticas y algunos neutrófilos. Hay un leve infiltrado inflamatorio crónico (i0) asociado a fibrosis y atrofia tubular, que afecta al 10% del área cortical. Se observa capilaritis en más del 10% de los capilares peritubulares, con un máximo de 4 linfocitos intraluminales (ptc 1). Las arterias muestran signos de arteriosclerosis leves. (Figura 1) y (Figura 2).
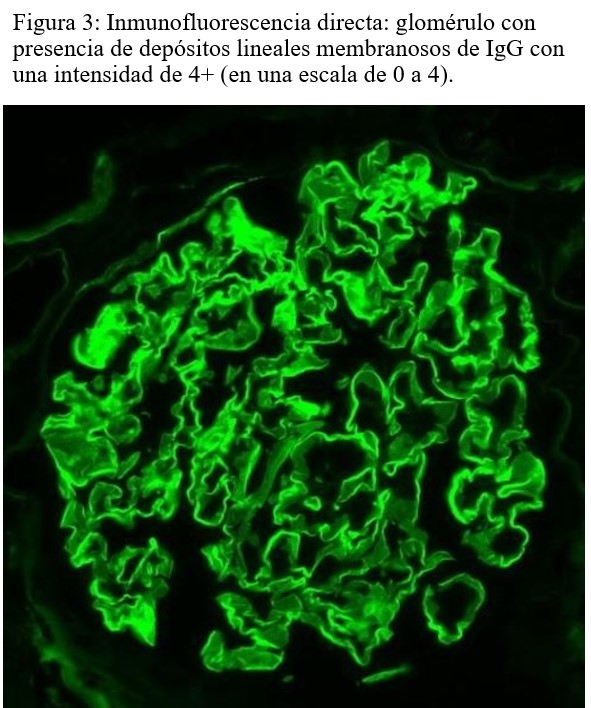
Inmunofluorescencia: Se observan depósitos lineales y membranosos de IgG de intensidad fuerte (4+) y de cadenas kappa y lambda de intensidad moderada (3+). Se observan depósitos débiles y lineales de C4d en los glomérulos y ausencia de depósitos en los capilares peritubulares. No hay depósitos de IgA, IgM, C3 ni C1q. (Figura 3).
En los días siguientes presentó mejoría desde el punto de vista respiratorio, con retirada progresiva del soporte ventilatorio junto con estabilidad de cifras de hemoglobina, aunque con necesidad de hemodiálisis intermitente. Persistía hematuria y albuminuria de 38 g en orina de 24 horas. Sin embargo, presentó un nuevo episodio de neumonía junto a bacteriemia por S. epidermidis, S. Marcescens y levaduras con evolución tórpida y refractaria al tratamiento antimicrobiano y antifúngico, con fallecimiento del paciente el 12 noviembre 2024.
COMENTARIOS
La enfermedad anti-membrana basal glomerular es una entidad rara que se caracteriza por afectación renal y/o pulmonar por el depósito de Ac circulantes dirigidos contra el colágeno tipo IV. Desde el punto de vista histológico se caracteriza por una proliferación extracapilar con formación de semilunas y una inmunofluorescencia con depósito lineal de IgG mayoritariamente en capilares glomerulares junto a la presencia de Ac anti-MBG en sangre.
Las guías recomiendan que para llevar a cabo el TR, este debe hacerse tras 6-12 meses de inactividad de la enfermedad con los Ac anti-MBG negativos. En cuanto a la recidiva de esta entidad tras el TR, se da en un 2-4% a lo largo de la evolución del TR con una patogenia similar a la enfermedad en riñón nativo [1][2][3]. La experiencia publicada se limita a series de casos [1][2][3][4].
El tratamiento es el mismo que para la enfermedad de riñón nativo y debemos tener en cuenta que hay que plantear la suspensión del antimetabolito mientras se esté bajo tratamiento de inducción con ciclofosfamida, para posteriormente retomarlo en el tratamiento de mantenimiento.
La supervivencia del injerto renal tras el episodio es muy baja, y prácticamente todos los pacientes pierden la funcionalidad del TR [4].
En el caso que presentamos destaca lo tardío de la recidiva de la enfermedad en un paciente TR, más de 20 años tras el cuadro inicial, siendo probablemente hasta la fecha el caso descrito en la literatura de recidiva más tardía [3]. Por tanto, es necesario resaltar que en estos pacientes hay que mantener la monitorización durante todo el seguimiento del TR puesto que la recidiva puede ocurrir en cualquier momento, incluso décadas después. Además, es de especial importancia que el paciente suspenda el hábito tabáquico y no permanezca en contacto con ciertos factores ambientales como los hidrocarburos, ya que podrían ser factores de riesgo tanto para la enfermedad primaria como para la recidiva. Debemos destacar que, en nuestro caso, el paciente presentaba ambos.
BIBLIOGRAFÍA
1. Singh T, Kharadjian TB, Astor BC, Panzer SE. Long-term outcomes in kidney transplant recipients with end-stage kidney disease due to anti-glomerular basement membrane disease. Clin Transplant. 2021;35(2):e14179.
2. Coche S, Sprangers B, Van Laecke S. Recurrence and Outcome of Anti-Glomerular Basement Membrane Glomerulonephritis After Kidney Transplantation. Kidney Int Rep. 2021;6(7):1888.
3. Khandelwal M, McCormick BB, Lajoie G. Recurrence of anti-GBM disease 8 years after renal transplantation. Nephrol Dial Transplant. 2004;19(2):491.
4. Sauter M, Schmid H, Anders HJ, Heller F. Loss of a renal graft due to recurrence of anti- GBM disease despite rituximab therapy. Clin Transplant. 2009 Jan;23(1):132-6.